A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיה סימולטנית של הדינמיקה של מיקרוטובולים מקושרים ובודדים במבחנה על ידי מיקרוסקופיה TIRF
In This Article
Summary
כאן, בדיקת שחזור במבחנה מבוססת מיקרוסקופיה TIRF מוצגת כדי לכמת ולהשוות בו זמנית את הדינמיקה של שתי אוכלוסיות microtubule. שיטה מתוארת כדי להציג בו זמנית את הפעילות הקולקטיבית של חלבונים מרובים הקשורים microtubule הקשורים על חבילות microtubule מקושרים ו microtubules יחיד.
Abstract
Microtubules הם פולימרים של הטרודימרים αβ-tubulin המארגנים למבנים נפרדים בתאים. ארכיטקטורות ורשתות מבוססות Microtubule מכילות לעתים קרובות תת-קבוצות של מערכי מיקרוטובולים השונים במאפייניהם הדינמיים. לדוגמה, בתאים מתחלקים, חבילות יציבות של מיקרוטובולות מקושרות מתקיימות בסמיכות למיקרוטובולות דינמיות שאינן מקושרות. מחקרי שחזור במבחנה מבוססי מיקרוסקופיה TIRF מאפשרים הדמיה סימולטנית של הדינמיקה של מערכי מיקרוטובולה שונים אלה. בבדיקה זו, תא הדמיה מורכב עם microtubules משותק פני השטח, אשר נמצאים גם חוטים בודדים או מאורגן לתוך חבילות מוצלבות. המבוא של טובולין, נוקלאוטידים, ויסותים חלבון מאפשר הדמיה ישירה של חלבונים הקשורים ושל תכונות דינמיות של microtubules יחיד מוצלב. יתר על כן, שינויים המתרחשים כמו microtubules יחיד דינמי לארגן לתוך חבילות ניתן לפקח בזמן אמת. השיטה המתוארת כאן מאפשרת הערכה שיטתית של הפעילות והלוקליזציה של חלבונים בודדים, כמו גם השפעות סינרגטיות של רגולטורים של חלבונים על שתי תתי-קבוצות מיקרוטובולה שונות בתנאים ניסיוניים זהים, ובכך מספקת תובנות מכאניסטיות שאינן נגישות בשיטות אחרות.
Introduction
מיקרוטובולים הם ביופולימרים היוצרים פיגומים מבניים החיוניים לתהליכים תאיים מרובים, החל מתחבורה תאית ומיצוב אברונים ועד לחלוקת תאים והתארכות. כדי לבצע פונקציות מגוונות אלה, microtubules בודדים מאורגנים לתוך מערכים בגודל מיקרון, כגון צירים מיטוטיים, אקסונמים ciliary, חבילות עצביות, מערכים אינטרפאזי, ומערכים קליפת המוח הצמחית. מוטיב אדריכלי הנמצא בכל מקום במבנים אלה הוא צרור של מיקרוטובולים המקושרים לאורכם1. מאפיין מסקרן של מספר מבנים מבוססי מיקרוטובולה הוא הדו-קיום של מיקרוטובולים ארוזים ומיקרוטובולות בודדות שאינן מקושרות בקרבה מרחבית קרובה. תת-אוכלוסיות מיקרוטובולות אלה יכולות להציג דינמיקת פילמור שונה בתכלית זו מזו, לפי הצורך לתפקודן התקין 2,3,4,5.5. לדוגמה, בתוך הציר המיטוטי, חבילות מקושרות יציבות ומיקרוטובולות בודדות דינמיות נמצאות בתוך אזור בקנה מידה מיקרוני במרכז התא6. לימוד האופן שבו המאפיינים הדינמיים של אוכלוסיות מיקרוטובולות מתקיימות יחד מצוין הוא, אם כן, מרכזי להבנת ההרכבה והתפקוד של מבנים מבוססי מיקרוטובולה.
מיקרוטובולים הם פולימרים דינמיים העוברים בין שלבי פילמור ודה-פילמור, ועוברים בין שני השלבים באירועים המכונים קטסטרופה והצלה7. הדינמיקה של מיקרוטובולים תאיים מוסדרת על ידי חלבונים נלווים Microtubule רבים (MAPs) המווסתים את שיעורי פילמור microtubule ו depolymerization ואת התדרים של קטסטרופה ואירועי הצלה. זה מאתגר לחקור את הפעילות של MAPs על מערכים פרוקסימליים מרחביים בתאים, בשל המגבלות של רזולוציה מרחבית במיקרוסקופיה קלה, במיוחד באזורים של צפיפות microtubule גבוהה. יתר על כן, נוכחותם של מספר MAPs באותו אזור תאי מעכבת פרשנויות של מחקרים ביולוגיים של התא. בדיקות שיחזור במבחנה, המבוצעות בשילוב עם מיקרוסקופיה פלואורסצנטית השתקפות פנימית כוללת (TIRF), עוקפות את האתגרים של בחינת מנגנונים שבאמצעותם תת-קבוצות ספציפיות של MAPs מווסתות את הדינמיקה של מערכי מיקרוטובולה תאיים פרוקסימליים. כאן, הדינמיקה של microtubules מורכב במבחנה נבדקים בנוכחות אחד או יותר MAPs רקומביננטי בתנאים מבוקרים8,9,10. עם זאת, בדיקות שיקום קונבנציונליות מבוצעות בדרך כלל על מיקרוטובולות בודדות או על סוג אחד של מערך, ומונעות הדמיה של אוכלוסיות דו-קיום.
כאן, אנו מציגים בדיקות שיחזור במבחנה המאפשרות הדמיה סימולטנית של שתי אוכלוסיות microtubule תחת אותם תנאי פתרון11. אנו מתארים שיטה כדי להציג בו זמנית את הפעילות הקולקטיבית של MPs מרובים על microtubules יחיד ועל חבילות microtubule מוצלב על ידי ציר מיטואטי הקשורים חלבון PRC1. החלבון PRC1 נקשר באופן מועדף בחפיפה בין מיקרוטובולות אנטי-מקביליות, ומקשר אותן 9. בקצרה, פרוטוקול זה מורכב מהשלבים הבאים: (1) הכנת פתרונות מלאי ורגנטים, (ii) ניקוי וטיפול על פני השטח של כיסויים המשמשים ליצירת תא ההדמיה לניסויים במיקרוסקופיה, (iii) הכנת "זרעים" מיקרוטובוליים יציבים שמהם מתבצעת פילמור במהלך הניסוי, (4) מפרט של הגדרות מיקרוסקופ TIRF להדמיית דינמיקת מיקרוטובולה, (v) הטמעת זרעי מיקרוטובולה ויצירת חבילות מיקרוטובולה מקושרות בתא ההדמיה, ו-(vi) הדמיה של דינמיקת מיקרוטובול בתא ההדמיה באמצעות מיקרוסקופיה TIRF, בתוספת טובולין מסיס, MAPs ונוקלאוטידים. בדיקות אלה מאפשרות הערכה איכותית ובדיקה כמותית של לוקליזציה MAP והשפעתן על הדינמיקה של שתי אוכלוסיות מיקרוטובולות. בנוסף, הם מאפשרים את ההערכה של השפעות סינרגטיות של MAPs מרובים על אוכלוסיות microtubule אלה, על פני מגוון רחב של תנאים ניסיוניים.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכינו ריאגנטים
- הכן מאגרים ורגנטים כמפורט בטבלה 1 ובטבלה 2. במהלך הניסוי, לשמור את כל הפתרונות על קרח, אלא אם כן צוין אחרת.
| תמיסה | רכיבים | משך אחסון מומלץ | הערות | ||
| 5X BRB80 | 400 מ"מ K-PIPES, 5 מ"מ MgCl2, 5 מ"מ EGTA, pH 6.8 עם KOH, מסנן לחיטוי | עד שנתיים | יש לאחסן בטמפרטורה של 4 °C (65 °F) | ||
| 1X BRB80 | 80 מ"מ K-PIPES, 1 מ"מ MgCl2, 1 מ"מ EGTA, pH 6.8 | עד שנתיים | יש לאחסן בטמפרטורה של 4 °C (65 °F) | ||
| BRB80-DTT | 1X BRB80, 1 מ"מ DTT | עד יומיים | |||
| מאגר בדיקה | 80 מ"מ K-PIPES, 3 מ"מ MgCl2, 1 mM EGTA, pH 6.8, 5% סוכרוז (OR 1X BRB80, 5% סוכרוז, 2 מ"מ MgCl2) | עד שנה אחת | יש לאחסן בטמפרטורה של 4 °C (65 °F) | ||
| מאגר ראשי (MB) | מאגר בדיקה, 5mM TCEP | שבוע אחד | היכונו ביום הניסוי; נפרדים לשתי שפופרות: MB-חם בטמפרטורת החדר ו MB-קר על קרח; כוללים 1 מ"מ DTT אם אתה משתמש בצבעי פלואורסצנט | ||
| מאגר ראשי עם מתיל-צלולוז (MBMC) | 1X BRB80, 0.8% מתיל צלולוז, 5 מ"מ TCEP, 5 מ"מ MgCl2 | שבוע אחד | היכונו ביום הניסוי; כוללים 1 מ"מ DTT אם אתה משתמש בצבעי פלואורסצנט | ||
| מאגר דילול חלבונים (DB) | MB, 1 מ"ג/ מ"ל סרום בקר אלבומין (BSA), 1 מיקרומטר ATP | יום אחד, על הקרח | היכונו ביום הניסוי; כוללים 1 מ"מ DTT אם אתה משתמש בצבעי פלואורסצנט | ||
| תערובת ניקוי חמצן (OSM) | MB, 389 מיקרוגרם/ מ"ל קטלאז, 4.44 מ"ג / מ"ל גלוקוז אוקסידאז, 15.9 מ"מ M 2-mercaptoethanol (BME) | יום אחד, על הקרח | היכונו ביום הניסוי | ||
| גמר ניקוי חמצן (OSF) | MB, 350 מיקרוגרם/מ"ל קטלאז, 4 מ"ג/מ"ל גלוקוז אוקסידאז, 14.3 מ"מ BME, 15 מ"ג/מ"ל גלוקוז | לשימוש תוך 30 דקות | הכנה מיד לפני השימוש על ידי הוספת 1 μL של גלוקוז ל 9 μL של OSM | ||
טבלה 1: רשימת המאגרים המשמשים בפרוטוקול זה וברכיבים שלהם. עיין בעמודה "משך אחסון מומלץ" לקבלת הדרכה לגבי כמה זמן מראש ניתן להכין כל מאגר.
| מגיב | ריכוז אחסון | ממס אחסון | טמפרטורת אחסון | ריכוז עבודה | ריכוז סופי | משך אחסון מומלץ | הערות | |||||||||
| נויטרווידין (NA) | 5 מ"ג/מ"ל | 1X BRB80 | -80°C | 0.2 מ"ג/מ"ל | 0.2 מ"ג/מ"ל | עד שנה אחת | משמש לשתק microtubules באמצעות הצמדת ביוטין-neutravidin-ביוטין; חנות ב aliquots קטן | |||||||||
| קאפה-קזאין (KC) | 5 מ"ג/מ"ל | 1X BRB80 | -80°C | 0.5 מ"ג/מ"ל | 0.5 מ"ג/מ"ל | עד שנתיים | משמש לחסימת משטח תא ההדמיה; לאחסן ב aliquots קטן; ביום הניסוי, הניחו נפח קטן בצד בטמפרטורת החדר | |||||||||
| סרום בקר אלבומין (BSA) | 50 מ"ג/מ"ל | 1X BRB80 | -20°C | 1 מ"ג /מ"ל (ב- DB) | N/A | עד שנתיים | חנות ב aliquots קטן | |||||||||
| קטלאזה | 3.5 מ"ג/מ"ל | 1X BRB80 | -80°C | 350 מיקרוגרם/מ"ל (ב-OSF) | 35 מיקרוגרם/מ"ל | עד שנתיים | רכיב של תערובת ניקוי חמצן; חנות ב aliquots קטן | |||||||||
| גלוקוז אוקסידאז | 40 מ"ג/מ"ל | 1X BRB80 | -80°C | 4 מ"ג/מ"ל (ב-OSF) | 0.4 מ"ג/מ"ל | עד שנתיים | רכיב של תערובת ניקוי חמצן; חנות ב aliquots קטן | |||||||||
| טובולין | ליופילציה | N/A | 4°C | 10 מ"ג/מ"ל | 2.12 מ"ג/מ"ל (בתערובת טובולין) | עד שנה אחת | ברגע טובולין הוא פתרון, לשמור אותו קר כדי למנוע פילמור. | |||||||||
| אדנוזין טריפוספט (ATP) | 100 מ"ר | מים אולטרה-פור | -20°C | 10 מ"מ | 1 מ"מ | 6 חודשים | הכינו פתרון במים מעוקרים במסננים, התאימו את רמת החומציות ל-7.0 אירו (pH) והקפאו באותיות קטנות. | |||||||||
| גואנוסין טריפוספט (GTP) | 100 מ"ר | מים אולטרה-פור | -20°C | 10 מ"מ | 1.29 מ"מ (בתערובת טובולין) | 6 חודשים | הכינו פתרון במים מעוקרים במסננים, התאימו את רמת החומציות ל-7.0 אירו (pH) והקפאו באותיות קטנות. | |||||||||
| גואנוסין-5'-[(α,β)-מתילנו] טריפוספט (GMPCPP) | 10 מ"מ | מים אולטרה-פור | -20°C | 10 מיקרומטר | 0.5 מיקרומטר | 6 חודשים | ||||||||||
| Dithiothreitol (DTT) | 1 מטר | מים סטריליים | -20°C | 1 מ"מ | N/A | עד שנתיים | ||||||||||
| טריס (2 קרבוקסיתיל) פוספין (TCEP) | 0.5 מטר | מים מעוקרים במסנן | טמפרטורת החדר | 5 מ"מ | N/A | עד שנתיים | ||||||||||
| מתילצלולוז | 1% | מים סטריליים | טמפרטורת החדר | 0.8% (ב-MBMC) | 0.21% (בתערובת טובולין) | עד שנה אחת | להמיס מתיל צלולוז על ידי הוספתו לאט למים כמעט רותחים. אפשר להתקרר תוך ערבוב מתמיד. | |||||||||
| בטא-מרקפטואתנול (BME) | 143 מ"מ | מים סטריליים | טמפרטורת החדר | 14.3 מ"ק (ב-OSF) | 1.43 מ"ק | עד 5 שנים | 143 mM הוא דילול 1:100 של מניות BME | |||||||||
| גלוקוז | 150 מ"ג/מ"ל | 1X BRB80 | -80°C | 15 מ"ג/מ"ל (ב-OSF) | 1.5 מ"ג/מ"ל | עד שנתיים | הוסף ל- OSM מיד לפני השימוש | |||||||||
| (±)-6-הידרוקסי-2,5,7,8-טטרמתיל כרומאן-2-חומצה קרבוקסילית (Trolox) | 10 מטר | 1X BRB80 | -80°C | 10 מ"מ | 1 מ"מ | עד שנה אחת | אינו מתמוסס לחלוטין. מוסיפים מעט NaOH, מערבבים כ-4 שעות ומסננים לפני השימוש | |||||||||
| mPEG-Succinimidyl Valerate, MW 5,000 | אבקה | N/A | -20°C | 333 מ"ג/מ"ל (ב 0.1 M נתרן ביקרבונט) | 324 מ"ג/מ"ל (ב 0.1 M נתרן ביקרבונט) | 6 חודשים | הכן ~ 34 מ"ג aliquots, סימון כל צינור עם משקל מדויק של אבקה. מעבירים גז חנקן מעל הצינורות המוצקים, האטומים עם parafilm, ומאחסנים בטמפרטורה של -20 מעלות צלזיוס במיכל עם ייבוש. | |||||||||
| ביוטין-PEG-SVA, MW 5,000 | אבקה | N/A | -20°C | 111 מ"ג/מ"ל (ב 0.1 M נתרן ביקרבונט) | 3.24 מ"ג /מ"ל (ב 0.1 M נתרן ביקרבונט) | 6 חודשים | הכן ~ 3 מ"ג aliquots, סימון כל צינור עם משקל מדויק של אבקה. מעבירים גז חנקן מעל הצינורות המוצקים, האטומים עם parafilm, ומאחסנים בטמפרטורה של -20 מעלות צלזיוס במיכל עם ייבוש. | |||||||||
טבלה 2: רשימת הריאגנטים המשמשים בפרוטוקול זה. כלולים תנאי האחסון והריכוזים המומלצים, ריכוזי עבודה של פתרונות מלאי המשמשים במהלך הניסוי, וריכוז סופי בתא ההדמיה. הערות נוספות ניתנות בעמודה השמאלית-קיצונית.
2. הכינו שקופיות ביוטין-PEG
הערה: הכינו תאי הדמיה קרוב ככל האפשר לתחילת הניסוי, ולא יותר משבועיים מראש.
- כתמי כיסוי נקיים
- מקם מספר שווה של 24 x 60 מ"מ ו-18 x 18 מ"מ #1.5 כיסויים (איור 1F) בצנצנות מכתימות שקופיות ובמתלים לשטיפת שקופיות, בהתאמה (איור 1A,B). מניחים את מתלים לשטיפת שקופיות המכילים כיסויים בגודל 18 x 18 מ"מ בכוס בגודל 100 מ"ל.
- יש לשטוף את כל כיסויי הכיסוי 5-6 פעמים במים אולטרה-פוריים (התנגדות של 18.2 MΩ-ס"מ) ולהסיר נוזל עודף לאחר כל שטיפה עם קצה פיפטה המחובר לצינור ואקום (איור 1C).
- מלאו כוסות וצנצנות מכתימות שקופיות המכילות את כיסויי הכיסוי במים אולטרה-פורר, אטמו עם parafilm, ו sonicate במשך 10 דקות.
- מלאו שתי כוסות 150 מ"ל עם אתנול 200 חסין. בעזרת פינצטה, טובלים כל כיסוי לכוס אחת מלאה באתנול, ולאחר מכן השנייה.
- באמצעות פינצטה, העבירו כיסויים למתלה לייבוש החלקות (איור 1D), ייבשו אותם תחת זרם גז חנקן ודגרו ב-37 מעלות צלזיוס עד לייבוש מלא (כ-15 דקות).
- מניחים את כיסויי הכיסוי היבשים בשכבה אחת בתוך מנקה הפלזמה. צור חותם ואקום ולאחר מכן הגדר את רמת תדר הרדיו (RF) של מנקה הפלזמה ל- ~ 8 MHz.
- לאחר הפלזמה נוצרת, להשאיר כיסויים מנקה פלזמה במשך 5 דקות. כבה את מנקה הפלזמה ושחרר את הוואקום לאט.
- לאחר שחרור חותם ואקום, להפוך את כיסויים מעל ולחזור על ניקוי פלזמה במשך 5 דקות עבור הצד השני של כיסויים.
- חלופה לניקוי פלזמה: במקום שלבים 2.1.2-2.1.3, sonicate מכסה אתlips בתמיסה חמה של 2% דטרגנט (במים אולטרה-פור) במשך 10 דקות. לאחר מכן, לשטוף ביסודיות כיסויים עם מים ultrapure sonicate במים אולטרה-פור 2-3 פעמים (10 דקות כל אחד). לאחר מכן, לשטוף אתנול ויבש כמו בשלבים 2.1.4-2.1.5. דלג על שלבים 2.1.6-2.1.8.
- טיפול ביוטין-PEG
- מיד לפני השימוש, להמיס 400 μL של 3-Aminopropyltriethoxysilane ב 40 מ"ל של אצטון. באמצעות פינצטה, העבירו כיסויים לניקוי פלזמה לתוך מתלה שטיפת השקופיות וצנצנות מכתימות שקופיות. כיסויי שקיעה בתמיסת 3-Aminopropyltriethoxysilane ודגרו במשך 5 דקות12,13.
- לשטוף את כל כיסויים 5-6 פעמים עם מים אולטרה-איפור.
- מעבירים כיסויים למתלה ייבוש החלקות, מייבשים אותם תחת זרם גז חנקן ודגרים בטמפרטורה של 37 מעלות צלזיוס עד לייבוש מלא (כ-20 דקות).
- הניחו את כיסויי הכיסוי היבשים על מגבוני משימה עדינים ותייגו כל כיסוי בפינה אחת, למשל, 'p' על כל כיסוי בגודל 18 x 18 מ"מ ו-'b' על כל כיסוי בגודל 24 x 60 מ"מ (ראו איור 2).
- ביום הניסוי, להכין פתרון טרי 0.1 M נתרן ביקרבונט על ידי המסת 0.84 מ"ג של NaHCO3 ב 10 מ"ל של מים אולטרה-פור.
- הביאו את ה-aliquots של mPEG-Succinimidyl Valerate (PEG-SVA) וביוטין-PEG-SVA לטמפרטורת החדר, מיד לפני השימוש. ראה הערות על פוליאתילן גליקול (PEG) הכנה aliquot בטבלה 2.
הערה: עבוד במהירות כי מחצית החיים הידרוליזה של Succinimidyl Valerate (SVA) moiety הוא ~ 30 דקות. - הוסף 102 μL של 0.1 M NaHCO3 ל 34 מ"ג של PEG-SVA, לסובב ב microcentrifuge ספסל ב 2,656 x גרם עבור 20 s, ולאחר מכן לערבב על ידי צנרת למעלה ולמטה. להמיס 3 מ"ג של ביוטין-PEG-SVA ב 27 μL של 0.1 M NaHCO3 על ידי צנרת למעלה ולמטה. התאם את נפחי הדילול בהתאם למשקל המדויק של PEG שצוין בצינורות (ראה טבלה 2).
- הכן 100:1 w / w PEG: תערובת ביוטין-PEG על ידי שילוב של 75 μL של פתרון PEG-SVA ו 2.25 μL של פתרון ביוטין-PEG-SVA עבור 20 כיסויים, 100 μL ו 3 μL עבור 30 כיסויים, או 125 μL ו 3.75 μL עבור 40 כיסויים.
- בנו תא לחות על ידי הנחת מגבות נייר רטובות מתחת למתלה הקצה בתחתית קופסת קצה ריקה של 10 μL (איור 1E). פעולה זו תמנע אידוי של פתרונות PEG.
- Pipette 6 μL של 100:1 PEG-SVA:תערובת ביוטין-PEG למרכז אחד 24 x 60 מ"מ כיסוי בצד המסומן. מניחים עוד כיסוי של 24 x 60 מ"מ על גבי כיסוי הראשון כך שהזוג יוצר צורת X, כאשר הצדדים מסומנים 'b' זה מול זה. מניחים את הזוג על מתלה קצה ריק בתא הידרציה וחוזרים על 24 x 60 מ"מ המכסים הנותרים.
- פיפטה 6 μL של PEG-SVA למרכז אחד 18 x 18 מ"מ כיסוי מכסה בצד המסומן. מניחים עוד כיסוי של 18 x 18 מ"מ על גבי כיסוי הראשון, כאשר הצדדים מסומנים 'p' זה מול זה. מניחים את הזוג על מתלה קצה ריק בתא הידרציה וחוזרים על 18 x 18 מ"מ הנותרים כיסויים.
- סגור את תא הידרציה ודגר במשך 3 שעות או לילה.
- מפרידים את זוגות כיסויי הכיסוי ושוטפים במים אולטרה-רפואיים.
- כיסוי יבש עם זרם חנקן ומניחים אותם באינקובטור של 37 מעלות צלזיוס לייבוש מלא.
- כדי לבנות את תא ההדמיה, מקל שלוש רצועות של סרט דו-צדדי על כיסוי 24 x 60 מ"מ בצד שכותרתו 'b'. לצד השני של רצועות סרט הדבקה, חבר כיסוי בגודל 18 x 18 מ"מ כשצדו מסומן כ-p' הפונה לכיסוי הגדול יותר. זה יוצר שני תאי זרימה לניסויים במיקרוסקופיה, כשמשטחים מטופלים פונים זה לזה (איור 2 ואיור 1G).

איור 1: ציוד לטיפול בכיסוי והכנת תאי הדמיה. (A) צנצנות מכתימות שקופיות עבור 24 x 60 מ"מ מכסים, (B) מתלים לשטיפת שקופיות עבור 18 x 18 מ"מ מכסים, (C) הגדרת ואקום, (D) מתלה לייבוש שקופיות, (E) תא לחות, (F) כיסויים, (G) תא הדמיה, מחזיק שקופיות (H). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
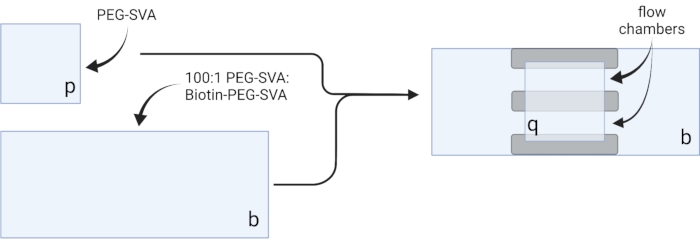
איור 2: סכמטית להכנת תאי הדמיה באמצעות סרט דו-צדדי (אפור) וכיסויים שטופלו ב-PEG/Biotin-PEG. נוצר באמצעות BioRender.com. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. מיקרוטובולים פולימריים
- הכנת זרעי GMPCPP
הערה: להכין זרעי GMPCPP בחדר קר, שמירה על כל ריאגנטים, טיפים, צינורות ב 4 °C (60 °F. זרעי GMPCPP ניתן להכין מראש ולאחסן ב -80 °C (80 °F) עד 1 שנה. מניחים רוטור אולטרה-מרכזי בזווית קבועה, המכיל צינורות צנטריפוגה 1 מ"ל, בצנטריפוגה אולטרה-מרכזית ומגדירים את הטמפרטורה ל-4 °C (60 °F).- טובולין ליופילי (טבלה 2) ל-10 מ"ג/מ"ל ב-1X BRB80, מיד לפני השימוש.
- ערבבו רכיבים של זרעי GMPCPP כמתואר בטבלה 3.
הערה: שמור את כל רכיבי טובולין על קרח ככל האפשר כדי למזער את פילמור של טובולין מסיס. - הבהירו לערבב ברוטור אולטרה-מרכזי בזווית קבועה בטמפרטורה של 352,700 x g למשך 5 דקות ב-4 °C (4 °F).
- להפריד את supernatant לתוך 5 μL aliquots, להצמיד להקפיא אותם בחנקן נוזלי, ולאחסן אותם ב -80 °C (80 °F).
- פילמור זרעים ביום הניסוי
- חם 1-2 מ"ל של BRB80-DTT (טבלה 1) עד 37 °C (37 °F).
- מניחים 5 μL aliquot של זרעי GMPCPP (-80 °C )) משלב 3.1.4 על קרח ומיד להתמוסס ב 20 μL של חם BRB80-DTT. יש לסובב ב-2,000 x גרם ל-5 שניות בטמפרטורת החדר ולהקיש כדי לערבב.
הערה: נפח הדילול הראשוני עשוי להשתנות בין 13 μL ו 21 μL והוא נקבע אמפירית עבור כל אצווה של זרעים. אם זרעים אינם מצליחים פולימריזציה, לפתור בעיות על ידי השלמת מאגר דילול ראשוני (שלב 3.2.2) עם 0.5 μM GMPCPP. - יש להגן מפני אור ולדגור בטמפרטורה של 37 מעלות צלזיוס למשך 30-45 דקות.
הערה: אורך המיקרוטובולים תלוי במשך הדגירה. עבור microtubules קצר, זמן הדגירה יכול להיות קצר כמו 15 דקות. עבור microtubules ארוך, זמן הדגירה יכול להיות ארוך ככל 2 שעות. microtubules biotinylated נוטים לדרוש זמני דגירה ארוכים יותר מאשר microtubules שאינם biotinylated. - מניחים רוטור אולטרה-מרכזי בזווית קבועה, המכיל 500 צינורות צנטריפוגות μL, בצנטריפוגה אולטרה-מרכזית וחם מראש עד 30 °C (30 °F).
- לאחר הדגירה, מוסיפים 50 μL של BRB80-DTT חם (שלב 3.2.1) לזרעי GMPCPP פולימריים ולהעביר את התערובת לצינור צנטריפוגה 500 μL. לשטוף את הצינור הריק שהכיל את זרעי GMPCPP עם עוד 50 μL של BRB80-DTT חם, פיפטה למעלה ולמטה, ולהוסיף את המאגר הזה לצינור צנטריפוגה 500 μL המכיל את התערובת.
- לפני ספינינג, לסמן את שפת צינור צנטריפוגה כדי לציין איפה הכדור יהיה (הכדור יהיה קטן מדי כדי לראות). ספין במשך 10 דקות ב 244,900 x g ב 30 °C12 °F.
- בזהירות פיפטה החוצה את supernatant ולהשליך. Resuspend את הכדור ב 100 μL של חם BRB80-DTT. הקש כדי לערבב.
- לסובב במשך 10 דקות ב 244,900 x g ב 30 °C (50 °F), יישור הסימון עם הרוטור לכדור באותו מקום.
- הסר את supernatant ו resuspend את הכדור ב 16 μL של BRB80-DTT חם. מעבירים את תמיסת המיקרוטובולה לצינור מיקרוצנטריפוגה נקי של 0.6 מ"ל. יש להגן מפני אור ולשמור בטמפרטורת החדר או מעליה.
הערה: לאחר פילמור, יש לשמור על המיקרוטובולות בטמפרטורת החדר או מעליה. אם הם יתקררו, הם יהפכו למפורסמים. דגירה בטמפרטורה של 28 מעלות צלזיוס לתוספת יציבות.
- בדיקת מיקרוטובולים באמצעות מיקרוסקופיה TIRF
- Pipette תערובת של 4.5 μL של BRB80-DTT ו 1 μL של פתרון microtubule (שלב 3.2.9) על שקופית מיקרוסקופ. מכסים עם כיסוי של 18 x 18 מ"מ וחותמים את הקצוות עם לק שקוף או תערובת של 1:1:1:1 של פטרולאטום, לנולין ופרפין (איטום valap), שהוא מוצק בטמפרטורת החדר ונוזל בטמפרטורת החדר ונוזל בטמפרטורת 95 מעלות צלזיוס.
- מקם את מטרת TIRF מתחת לכיסוי (ראה שלב 4 להגדרות מיקרוסקופ מומלצות) ודמיין את המיקרוטובולות הפולימריות החדשות באורך הגל המתאימות לאבולין המסומן בפלואורסצנטיות בתערובת הבהירה (טבלה 3), כדי לקבוע באיזו דילול של מיקרוטובולות להשתמש בניסויים הקרובים.
| מגיב | תערובת בהירה (μL) | סדר התוספת | תערובת בהירה + ביוטין (μL) | סדר התוספת |
| טובולין פלואורסצנטי, 10 מ"ג/מ"ל | 2 | 6 | 2 | 7 |
| ביוטין-טובולין, 10 מ"ג/מ"ל | 0 | N/A | 2 | 6 |
| טובולין ללא תווית, 10 מ"ג/מ"ל | 20 | 5 | 18 | 5 |
| GMPCPP, 10 מ"ר | 30 | 4 | 30 | 4 |
| DTT, 0.2 M | 0.7 | 3 | 0.7 | 3 |
| 5X BRB80 | 26.4 | 2 | 26.4 | 2 |
| מים סטריליים | 52.9 | 1 | 52.9 | 1 |
| נפח כולל (μL) | 132 | 132 |
טבלה 3: תערובת זרעים GMPCPP. רכיבים של זרעי microtubule GMPCPP, כולל נפח וסדר של תוספת. הכן 5 μL aliquots ולאחסן עד 1 שנה ב -80 °C (80 °F).
4. הגדרות מיקרוסקופ
- טמפרטורה: הגדר את טמפרטורת המיקרוסקופ ל-28 °C (50 °F) כדי להציג מיקרוטובולות דינמיות.
- מסננים: השתמש בשילוב הטוב ביותר של קוביות מסנן ומסנני פליטה, בהתאם לערוצי הפלואורסצנט שיש לדמיין. כדי להמחיש 488 ננומטר, 560 ננומטר ואורכי גל של 647 ננומטר באותו ניסוי, השתמש בערכת רצועת לייזר מרובעת של 405/488/488/560/647 ננומטר, בשילוב עם מסנני פליטה לאורכי הגל המיועדים.
- יישור לייזרים: ודא שקרני הלייזר המשמשות בניסוי מיושרות. קבעו את עוצמת הלייזר לניסוי בצורה אמפירית, כך שניתן יהיה לצלם את כל החלבונים הפלואורסצנטיים עם יחס האות לרעש הגבוה ביותר האפשרי, אך אינם עוברים צילום משמעותי במהלך הניסוי.
- מטרה: השתמש בנייר עדשה לניקוי מטרה של 100x עם 70% אתנול. לפני ההדמיה, להוסיף טיפה של שמן טבילה מיקרוסקופ למטרה.
- הגדרת רצף הדמיה
- לניסוי עם 647 ננומטר מיקרוטובולות ביו-טינוריות עם תווית פלואורופור, 560 ננומטר פלואורופור עם תווית לא ביו-ביוטינילט וצינורולין מסיס, וחלבון מעניין בעל תווית GFP, תמונה למשך 20 דקות. דמיינו את הערוצים של 560 ננומטר ו-488 ננומטר כל 10 שניות, ואת הערוץ 647 ננומטר כל 30 שניות.
- כדי ללכוד תמונת ייחוס של חבילות לפני הוספת טובולין מסיסים ו- MAPs, הגדר רצף עם תמונה אחת כל אחת באורכי גל של 560 ננומטר ו- 647 ננומטר.
5. צור חבילות מיקרוטובולה משותקות על פני השטח
הערה: עבור השלבים הבאים, הזרם את כל הפתרונות לתא זרימה על-ידי הזרמה לצד פתוח אחד, תוך הצבת נייר סינון בצד השני. הגן על תא ההדמיה מפני אור כדי להפחית את ההלבנה הפוטואורסצנטית של חלבונים המסומנים בפלואורסצנטיות. הקליטו את תא ההדמיה המוכן למחזיק שקופיות (איור 1G, H). בצע את השלבים בטבלה 4, התואמים ל- steps פרוטוקול 5.2-6.4.
- הכינו תערובת טובולין מסיסה לפי שולחן 5 ושמרו אותה על הקרח.
הערה: טובולין מסיס חייב תמיד להיות ממוקם על קרח כדי למנוע פילמור. הכן תערובת טובולין מסיס טרי כ כל 2 שעות, או כאשר microtubules כבר לא פילמור. - כדי לשתק microtubules באמצעות הצמדת ביוטין-neutravidin-ביוטין, זרימה ראשונה בתמיסת Neutravidin (NA) עד שהתא מתמלא (~ 7.5 μL) ודגר במשך 5 דקות.
- לשטוף עם 10 μL של MB-קר.
- זרימה ב 7.5 μL של חלבון חוסם κ-קזאין (KC) ודגר במשך 2 דקות.
- לשטוף עם 10 μL של MB-חם כדי להכין את החדר להכנסה של microtubules.
- לדלל את המלאי של microtubules biotinylated (על פי תצפיות בשלב 3.3.2) ב 1X BRB80-DTT ולהוסיף 1 μL של דילול זה ל 9 μL של MB-חם. מזרימים את התערובת לתא ודגורים במשך 10 דקות. השתמש בריכוז גבוה יותר של microtubules עבור חבילות נוספות.
- לשטוף את microtubules לא משותק עם 10 μL של MB-חם.
- זרימה 7.5 μL של KC חם לתוך התא ודגר במשך 2 דקות.
- במהלך הדגירה, להכין פתרון 2 ננומטר של חלבון crosslinker PRC1 ב KC חם. זרימה 10 μL של פתרון זה לתוך תא הזרימה ודגור במשך 5 דקות.
הערה: PRC1 רקומביננטי מתבטא ומטוהר מתאי חיידקים כפי שתואר בעבר13. - כדי ליצור חבילות, הזרימה 10 מיקרו-מיקרוגל של מיקרוטובולים שאינם ביו-ביוטינילים לתוך התא ותדגור במשך 10 דקות. PRC1 תצליב את המיקרוטובולים הביו-ביוטינילים הלא-ביו-טיניליים והמנותקים15,16 (איור 3).
הערה: ראה שלב 6.1 להכנת תערובת הבדיקה במהלך זמן הדגירה. - לשטוף את התא פעמיים עם 10 μL של MB-חם. המיקרוטובולות המצורפות יציבות במשך כ -20 דקות מנקודה זו.
| צעד | מגיב | עוצמת קול (μL) | זמן דגירה (דקות) |
| 1 | נויטרווידין | 7.5 | 5 |
| 2 | MB-קר | 10 | - |
| 3 | κ-casein | 7.5 | 2 |
| 4 | MB-חם | 10 | - |
| 5 | מיקרוטובולה ביו-טינילט (מדולל בחום MB) | 10 | 10 |
| 6 | MB-חם | 10 | - |
| 7 | חם κ-קזאין | 7.5 | 2 |
| 8 | 2 nM PRC1 מדולל ב κ-casein | 10 | 5 |
| 9 | מיקרוטובולה ללא ביו-ביוטינילציה | 10 | 10 |
| 10 | MB-חם x 2 | 10 | - |
| 11 | תערובת אסאיט | 10 | - |
| הזרעים המצורפים יציבים במשך כ -20 דקות בשלב זה | |||
טבלה 4: צעדי בדיקה. רשימת ריאגנטים שנוספו לתא ההדמיה, עם אינדיקציה של זמן שטיפה (-) או דגירה.
| מגיב | עוצמת קול (μL) |
| טובולין ממוחזר, 10 מ"ג/מ"ל | 10 |
| MB-קר | 10.3 |
| MBMC | 13.7 |
| BRB80-DTT | 3.4 |
| GTP, 10 מ"ר | 6.7 |
| ATP, 10 מ"ר (אם משתמשים בקינסינים) | 6.7 |
| טובולין עם תווית פלואורסצנטית, 10 מ"ג/מ"ל | 1 (Resuspend lyophilized מתויג טובולין קר BRB80-DTT) |
טבלה 5: רכיבי תערובת טובולין מסיסים. מערבבים בתחילת הניסוי ושומרים על קרח.
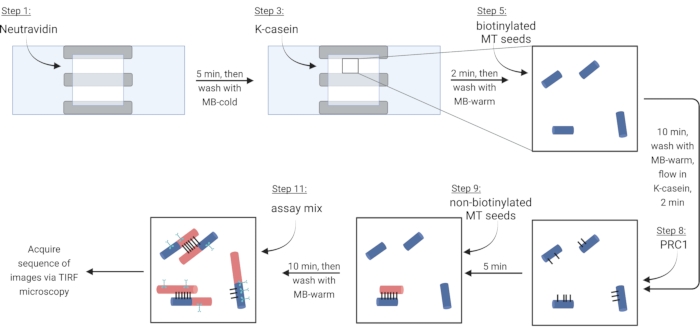
איור 3: סכמטי של תוספת של רכיבי בדיקה כדי ליצור ולדמות חבילות המסומנות בפלואורסצנטיות ומיקרוטובולות בודדות. זרעים ביוטינילטים מוצגים בזרעים כחולים, לא ביו-ביוטינילציה וטובולין מסיס באדום, PRC1 בשחור, וחלבון מעניין בכחלון. מספרי שלבים באיור תואמים לאלה בטבלה 4. החלונית המתאימה לשלב 9 מציגה חבילה שנוצרה מראש (משמאל למטה); שלב 11 מציג חבילה חדשה שנוצרה (משמאל למעלה). נוצר באמצעות BioRender.com. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
6. דינמיקת מיקרוטובול תמונה
- במהלך זמן הדגירה של 10 דקות בשלב 5.10, להכין 10 μL של תערובת בדיקה המכיל חלבונים של עניין, טובולין מסיסים, נוקלאוטידים, אוכלי נבלות חמצן14, ונוגדי חמצון על פי טבלה 6. שמור את התערובת על קרח.
- טען את תא ההדמיה המוכן, מודבק למחזיק השקופית, במטרה 100x TIRF. השתמש בערוצים של 560 ננומטר ו- 647 ננומטר כדי למצוא שדה ראייה המכיל מספר וצפיפות אופטימליים של מיקרוטובולות וחבילות בודדות.
הערה: אם הן microtubules biotinylated ולא ביו-ביוטינילated מסומנים עם אותו פלואורופור, ניתוחי סריקת קו של עוצמות פלואורסצנטיות יכולים להבחין בין microtubules יחיד וחבילות. - לאחר זיהוי שדה תצוגה, צולם תמונת הפניה.
- בזהירות לזרום בתערובת הבדיקה מבלי להפריע לתא ההדמיה.
- לאטום את הקצוות הפתוחים של התא עם איטום valap.
- התחל את רצף ההדמיה כמתואר בשלב 4.5.1.
| מגיב | עוצמת קול (μL) |
| תערובת טובולין מסיס | 4 |
| OSF | 1 |
| Trolox (אם משתמשים במיקרוטובולות המסומנות בפלואורופור מצלם בקלות) | 1 |
| ATP, 10 מ"ר (אם משתמשים בקינסינים) | 1 |
| PRC1 (או crosslinker של בחירה) | 1 |
| חלבונים מעניינים | X |
| MB-קר | 2-X |
טבלה 6: רכיבי תערובת של Assay. לערבב, לזרום לתוך תא הדמיה, ודינמיקה microtubule תמונה, בתוך 30 דקות.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הניסוי שתואר לעיל בוצע באמצעות 647 ננומטר מיקרוטובולות ביו-טינוליות עם תווית פלואורופור, 560 ננומטר פלואורופור שכותרתו מיקרוטובולות שאינן ביו-ביוטיניל, ותערובת טובולין מסיסה של 560 ננומטר פלואורופור. Microtubules היו מוצלבים על ידי חלבון crosslinker PRC1 (GFP שכותרתו). לאחר שנוצרו חבילות משותקות פני השטח ו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
הניסוי המתואר כאן מרחיב באופן משמעותי את ההיקף והמורכבות של בדיקות שיקום מיקרוטובולות קונבנציונליות, המבוצעות באופן מסורתי על מיקרוטובולות בודדות או על סוג אחד של מערך. הבדיקה הנוכחית מספקת שיטה לכמת ולהשוות בו זמנית את פעילות MAP הרגולטורית על שתי אוכלוסיות, כלומר מיקרוטובולות בודדות וח...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים שאין אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מענק מטעם NIH (מס ' 1DP2GM126894-01), ועל ידי כספים מקרנות הצדקה של פיו וקרן משפחת סמית ל- R.S. המחברים מודים לד"ר שו ג'יאנג על תרומתו לפיתוח ואופטימיזציה של הפרוטוקולים.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma Aldrich | 238813 | |
| 1,4-piperazinediethanesulfonic acid (PIPES) | Sigma Aldrich | P6757 | |
| 18x18 mm #1.5 coverslips | Electron Microscopy Sciences | 63787 | |
| 2-Mercaptoethanol (BME) | Sigma Aldrich | M-6250 | |
| 24x60 mm #1.5 coverslips | Electron Microscopy Sciences | 63793 | |
| 405/488/560/647 nm Laser Quad Band | Chroma | TRF89901-NK | |
| Acetone | Sigma Aldrich | 320110 | |
| Adenosine 5'-triphosphate disodium salt hydrate (ATP) | Sigma Aldrich | A7699-5G | |
| Avidin, NeutrAvidin® Biotin-binding Protein (Molecular Probes®) | Thermo Fischer Scientific | A2666 | |
| Bath sonicator: Branson 2800 Cleaner | Branson | CPX2800H | |
| Beckman Coulter Polycarbonate Thickwall Tubes, 11 x 34 mm | Beckman-Coulter | 343778 | |
| Beckman Coulter Polycarbonate Thickwall Tubes, 8 x 34 mm | Beckman-Coulter | 343776 | |
| Biotin-PEG-SVA, MW 5,000 | Laysan Bio | #Biotin-PEG-SVA-5000 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 2905 | |
| Catalase | Sigma Aldrich | C40 | |
| Corning LSE Mini Microcentrifuge, AC100-240V | Corning | 6670 | |
| Delicate Task Wipes | Kimtech | 34120 | |
| Dithiothreitol (DTT) | GoldBio | DTT10 | |
| Emission filter | Chroma | ET610/75m | |
| Ethanol (200-proof) | Decon Labs | 2705 | |
| Ethylene glycol tetraacetic acid (EGTA) | Sigma Aldrich | 3777 | |
| Glucose Oxidase | Sigma Aldrich | G2133 | |
| GMPCPP | Jena Bioscience | NU-405 | |
| Guanosine 5'-triphosphate sodium salt hydrate (GTP) | Sigma Aldrich | G8877 | |
| Hellmanex III detergent | Sigma Aldrich | Z805939 | |
| Immersion oil, Type A | Fisher Scientific | 77010 | |
| Kappa-casein | Sigma Aldrich | C0406 | |
| Lanolin | Fisher Scientific | S25376 | |
| Lens Cleaning Tissue | ThorLabs | MC-5 | |
| Magnesium Chloride (MgCl2) | Sigma Aldrich | M9272 | |
| Methylcellulose | Sigma Aldrich | M0512 | |
| Microfuge 16 Benchtop Centrifuge | Beckman-Coulter | A46474 | |
| Microscope Slides, Diamond White Glass, 25 x 75mm, 90° Ground Edges, WHITE Frosted | Globe Scientific | 1380-50W | |
| mPEG-Succinimidyl Valerate, MW 5,000 | Laysan Bio | #NH2-PEG-VA-5K | |
| Optima™ Max-XP Tabletop Ultracentrifuge | Beckman-Coulter | 393315 | |
| Paraffin | Fisher Scientific | P31-500 | |
| PELCO Reverse (self-closing), Fine Tweezers | Ted Pella | 5377-NM | |
| Petrolatum, White | Fisher Scientific | 18-605-050 | |
| Plasma Cleaner, 115V | Harrick Plasma | PDC-001 | |
| Potassium Hydroxide (KOH) | Sigma Aldrich | 221473 | |
| Sodium bicarbonate | Sigma Aldrich | S6014 | |
| Sucrose | Sigma Aldrich | S7903 | |
| Thermal-Lok 1-Position Dry Heat Bath | USA Scientific | 2510-1101 | |
| Thermal-Lok Block for 1.5 and 2.0 mL Tubes | USA Scientific | 2520-0000 | |
| Thermo Scientific™ Pierce™ Bond-Breaker™ TCEP Solution, Neutral pH; 500mM | Thermo Fischer Scientific | PI-77720 | |
| TIRF 100X NA 1.49 Oil Objective | Nikon | CFI Apochromat TIRF 100XC Oil | |
| TIRF microscope | Nikon | Eclipse Ti | |
| TLA 120.1 rotor | Beckman-Coulter | 362224 | |
| TLA 120.2 rotor | Beckman-Coulter | 357656 | |
| Tubulin protein (>99% pure): porcine brain | Cytoskeleton | T240 | |
| Tubulin Protein (Biotin): Porcine Brain | Cytoskeleton | T333P | |
| Tubulin protein (fluorescent HiLyte 647): porcine brain | Cytoskeleton | TL670M | |
| Tubulin protein (X-rhodamine): bovine brain | Cytoskeleton | TL620M | |
| VECTABOND® Reagent, Tissue Section Adhesion | Vector Biolabs | SP-1800-7 | |
| VWR® Personal-Sized Incubator, 120V, 50/60Hz, 0.6A | VWR | 97025-630 |
References
- Subramanian, R., Kapoor, T. M. Building complexity: insights into self-organized assembly of microtubule-based architectures. Developmental Cell. 23 (5), 874-885 (2012).
- Baas, P. W., Rao, A. N., Matamoros, A. J., Leo, L. Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73 (9), 442-460 (2016).
- Bitan, A., Rosenbaum, I., Abdu, U. Stable and dynamic microtubules coordinately determine and maintain Drosophila bristle shape. Development. 139 (11), 1987-1996 (2012).
- Foe, V. E., von Dassow, G. Stable and dynamic microtubules coordinately shape the myosin activation zone during cytokinetic furrow formation. The Journal of Cell Biology. 183 (3), 457-470 (2008).
- Pous, C., et al. Functional specialization of stable and dynamic microtubules in protein traffic in WIF-B cells. The Journal of Cell Biology. 142 (1), 153-165 (1998).
- Uehara, R., Goshima, G. Functional central spindle assembly requires de novo microtubule generation in the interchromosomal region during anaphase. The Journal of Cell Biology. 191 (2), 259-267 (2010).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bieling, P., et al. Reconstitution of a microtubule plus-end tracking system in vitro. Nature. 450 (7172), 1100-1105 (2007).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Shimamoto, Y., Forth, S., Kapoor, T. M. Measuring pushing and braking forces generated by ensembles of Kinesin-5 crosslinking two microtubules. Developmental Cell. 34 (6), 669-681 (2015).
- Mani, N., Jiang, S., Neary, A. E., Wijeratne, S. S., Subramanian, R. Differential regulation of single microtubules and bundles by a three-protein module. Nature Chemical Biology. 17 (9), 964-974 (2021).
- Hyman, A. A., Salser, S., Drechsel, D., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue, GMPCPP. Molecular Biology of the Cell. 3 (10), 1155-1167 (1992).
- Subramanian, R., et al. Insights into antiparallel microtubule crosslinking by PRC1, a conserved nonmotor microtubule binding protein. Cell. 142 (3), 433-443 (2010).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Wijeratne, S., Subramanian, R. Geometry of antiparallel microtubule bundles regulates relative sliding and stalling by PRC1 and Kif4A. eLife. 7, 32595(2018).
- Mani, N., Wijeratne, S. S., Subramanian, R. Micron-scale geometrical features of microtubules as regulators of microtubule organization. eLife. 10, 63880(2021).
- Freal, A., et al. Feedback-driven assembly of the axon initial segment. Neuron. 104 (2), 305-321 (2019).
- Ledbetter, M., Porter, K. A "microtubule" in plant cell fine structure. The Journal of Cell Biology. 19 (1), 239-250 (1963).
- Wijeratne, S. S., Marchan, M. F., Tresback, J. S., Subramanian, R. Atomic force microscopy reveals distinct protofilament-scale structural dynamics in depolymerizing microtubule arrays. Proceedings of the National Academy of Sciences of the United States of America. , 119(2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved