Method Article
تقييم استجابة جذع الدماغ السمعي في فراخ الدجاج
In This Article
Summary
لقد استخدمنا تقنيات الاستجابة السمعية القياسية لجذع الدماغ (ABR) وطبقناها على الدجاج المفرخ ، وهو نموذج طائر مبكر للوظيفة السمعية. يحدد البروتوكول إعداد الحيوانات وتقنيات الحصول على ABR بالتفصيل ، مع خطوات يمكن أن تترجم إلى نماذج أخرى للطيور أو القوارض.
Abstract
استجابة جذع الدماغ السمعي (ABR) هي اختبار لا يقدر بثمن في علم السمع السريري ، والحيوانات غير البشرية ، والبحوث البشرية. على الرغم من الاستخدام الواسع النطاق ل ABRs في قياس التزامن العصبي السمعي وتقدير حساسية السمع في أنظمة نماذج الفقاريات الأخرى ، لم يتم الإبلاغ عن طرق لتسجيل ABRs في الدجاج منذ ما يقرب من أربعة عقود. يوفر الدجاج نموذجا قويا للبحوث الحيوانية لأن نظامه السمعي يقترب من النضج الوظيفي خلال مراحل الفراخ الجنينية المتأخرة والمبكرة. لقد أظهرنا الطرق المستخدمة للحصول على تسجيلات ABR ذات قناة واحدة أو قناتين باستخدام صفائف قطب الإبرة تحت الجلد في فراخ الدجاج. بغض النظر عن تكوين تسجيل القطب الكهربائي (أي المونتاج) ، تضمنت تسجيلات ABR 3-4 أشكال موجية ذروة إيجابية خلال أول 6 مللي ثانية من حافز النقر فوق العتبة. وتراوحت سعات الشكل الموجي من الذروة إلى القاع بين 2-11 ميكروفولت عند مستويات عالية الكثافة، مع ظهور قمم موجبة تظهر وظائف كثافة الكمون المتوقعة (أي الزيادة في الكمون كدالة لانخفاض الكثافة). كان وضع سماعة الأذن الموحد أمرا بالغ الأهمية للتسجيلات المثلى حيث يمكن للجلد المترهل أن يسد قناة الأذن ، ويمكن لحركة الحيوان أن تزيح محول التحفيز. كانت سعات الذروة أصغر ، وكانت فترات التأخير أطول مع انخفاض درجة حرارة جسم الحيوان ، مما يدعم الحاجة إلى الحفاظ على درجة حرارة الجسم الفسيولوجية. بالنسبة للفراخ الصغيرة (<3 ساعات بعد يوم الفقس 1) ، تم رفع العتبات بمقدار ~ 5 ديسيبل ، وزادت زمن انتقال الذروة ~ 1-2 مللي ثانية ، وانخفضت سعات الذروة إلى الحوض الصغير ~ 1 ميكروفولت مقارنة بالفقس الأكبر سنا. هذا يشير إلى وجود مشكلة محتملة متعلقة بالموصلية (أي سائل في تجويف الأذن الوسطى) ويجب مراعاته بالنسبة للصغار الصغار. بشكل عام ، تسمح طرق ABR الموضحة هنا بتسجيل دقيق وقابل للتكرار للوظيفة السمعية داخل الجسم الحي في فراخ الدجاج التي يمكن تطبيقها على مراحل مختلفة من التطور. يمكن مقارنة هذه النتائج بسهولة بالنماذج البشرية والثدييات لفقدان السمع أو الشيخوخة أو غيرها من التلاعب المرتبط بالسمع.
Introduction
تعود دراسة الاستجابات العصبية المستحثة للمحفزات الصوتية إلى أكثر من نصف قرن1. استجابة جذع الدماغ السمعي (ABR) هي إمكانات مستحثة تم استخدامها كمقياس للوظيفة السمعية في كل من الحيوانات غير البشرية والبشر لعقود. يقدم ABR البشري من خمس إلى سبع قمم موجية الشكل تسمى تقليديا بالأرقام الرومانية (I-VII)2. يتم تحليل هذه القمم بناء على زمن الوصول (وقت حدوثها بالمللي ثانية) والسعة (حجم الذروة إلى الحوض الصغير بالميكروفولت) للاستجابات العصبية. يلعب ABR دورا أساسيا في تقييم وظيفة وسلامة العصب السمعي بالإضافة إلى حساسية جذع الدماغ وعتبة السمع. يؤدي العجز في الجهاز السمعي إلى غياب أو انخفاض أو إطالة أو عدم وجود زمن وصول أو سعة ABR. ومن اللافت للنظر أن هذه المعلمات متطابقة تقريبا في البشر والحيوانات الأخرى ، مما يجعلها اختبارا موضوعيا ثابتا للوظيفة السمعية عبر نماذج الفقاريات3.
أحد هذه الأنظمة النموذجية هو الدجاج ، وهو مفيد بشكل خاص لمجموعة متنوعة من الأسباب. يمكن تصنيف الطيور على أنها altricial أو precocial4. تفقس الطيور الثلاثية مع الحواس التي لا تزال تتطور. على سبيل المثال ، لا تظهر بوم الحظيرة ABR ثابتا حتى أربعة أيام بعد الفتحة5. الحيوانات المبكرة مثل الدجاج تفقس مع الحواس شبه الناضجة. تحدث بداية السمع في التطور الجنيني ، بحيث قبل أيام من الفقس (اليوم الجنيني 21) ، يكون الجهاز السمعي قريبا من النضج الوظيفي 6,7,8. الطيور الثلاثية ومعظم نماذج الثدييات عرضة للعوامل الخارجية التي تؤثر على التطور وتتطلب تربية الحيوانات حتى ينضج السمع. يمكن إجراء ABRs الدجاج في نفس يوم الفتحة ، مع التخلي عن الحاجة إلى التغذية أو بيئة مخصبة.
كان الدجاج الجنيني نموذجا مدروسا جيدا لعلم وظائف الأعضاء والتنمية ، خاصة في جذع الدماغ السمعي. وتشمل الهياكل المحددة نواة قوقعة الدجاج، مقسمة إلى نواة ماغنوسيلولاريس (NM) ونواة زاويريس (NA)، وارتباط الطيور للزيتون العلوي الإنسي المعروف باسم النواة الصفيحية (NL)6,7. يعد ABR مثاليا للتركيز على الوظيفة السمعية المركزية قبل مستوى الدماغ الأمامي والقشرة. توفر الترجمة بين قياسات ABR داخل الجسم الحي والدراسات العصبية في المختبر للتنمية8 وعلم وظائف الأعضاء9 و tonotopy 10 وعلم الوراثة11,12 فرصا بحثية مثالية تدعم دراسات الوظيفة السمعية الشاملة.
على الرغم من أن ABR قد تمت دراسته على نطاق واسع في نماذج الثدييات ، إلا أنه كان هناك تركيز أقل على الطيور. تشمل دراسات ABR السابقة للطيور توصيفات الببغاء 13 ونقار الخشب14 والنورس 15 وطيور الغوص 16 وعصفور الحمار الوحشي 17 والطيور الجارحة النهارية 18 والكناري 19 وثلاثة أنواع من البومة5،20،21،22 والدجاج23. بالنظر إلى ما يقرب من أربعة عقود منذ آخر توصيف شامل للدجاج ABR ، فقد تغيرت العديد من المعدات والتقنيات المستخدمة سابقا. يمكن أن تساعد الرؤى المستقاة من الدراسات التي أجريت على نماذج الطيور الأخرى في تطوير منهجية ABR الحديثة للدجاج بينما تعمل أيضا كمقارنة مع ABR الدجاج. ستحدد هذه الورقة الإعداد التجريبي والتصميم للسماح بتسجيل ABR في الدجاج المفرخ الذي يمكن تطبيقه أيضا على المراحل الجنينية من التطور وغيرها من نماذج القوارض الصغيرة والطيور. بالإضافة إلى ذلك ، بالنظر إلى التطور المبكر للدجاج ، يمكن إجراء التلاعب التنموي دون أي تربية واسعة النطاق. يمكن تقييم التلاعب بالجنين النامي بعد ساعات قليلة فقط من فقس الحيوان بقدرات سمعية شبه ناضجة.
Protocol
تمت الموافقة على التجارب الموصوفة هنا من قبل لجان رعاية واستخدام الحيوانات المؤسسية بجامعة نورث وسترن (IACUC) وأجريت وفقا لدليل المعاهد الوطنية للصحة لرعاية واستخدام المختبر.
1. تربية الدجاج
- الحصول على بيض الدجاج leghorn الأبيض المخصب.
ملاحظة: هناك العديد من سلالات الدجاج المستخدمة في البحث العلمي ، ولكن النتائج الموضحة هنا هي من دجاج leghorn الأبيض (Gallus gallus domesticus). في حين أن تباين ABR بين السلالات غير معروف ، فقد تم العثور على بعض الاختلافات عند مقارنة الدجاج البالغ الذي يضع البيض بالدجاج اللاحم المنتج للحوم24,25. - احتضن البيض عند 38 درجة مئوية ، والرطوبة عند 50 ٪ ، لمدة 21 يوما قبل تاريخ الاختبار المطلوب.
ملاحظة: إذا لم يتم احتضان البيض على الفور عند 38 درجة مئوية ، فيمكن تخزينه عند 14 درجة مئوية ، والرطوبة عند 40٪. ومع ذلك ، كلما تم الاحتفاظ بالبيض لفترة أطول عند 14 درجة مئوية ، قل احتمال تطوره إلى فقس قابل للحياة. بعد 7 أيام ، يمكن أن تنخفض صلاحية البيض بنسبة تصل إلى 50٪ اعتمادا على المدة التي يتم فيها الاحتفاظ بالبيض عند 14 درجة مئوية. سوف تنخفض صلاحية البيض أيضا في أشهر الشتاء. - اقلب البيض بشكل دوري 2-3 مرات في اليوم. معظم الحاضنات لديها آلية لتنفيذ ذلك تلقائيا.
- إذا كنت تستخدم حاضنة الستايروفوم أو حاضنة تحتوي على أكثر من 6 بيضات ، فانقل البيض إلى حاضنة صغيرة تبلغ درجة حرارتها 38 درجة مئوية في اليوم السابق للفقس ، اليوم الجنيني 20 (E20). يجب أن يفقس البيض لمدة 21 يوما (E21) بعد وضعه في الحاضنة.
ملاحظة: في عملية الفقس ، سيبدأ الحيوان في "التصويب" من البيضة ، مما يؤدي إلى ثقب صغير يدور في النهاية حول البيضة بأكملها. إذا كانت الظروف جافة جدا ، يمكن أن تجف البيضة ، ولن يتمكن الحيوان من الفقس. يجب الحفاظ على الرطوبة حوالي 50٪ ، استنادا إلى الدراسات السابقة حول جدوى فقس البيض26،27،28،29. - تحديد عمر الحيوان. إذا لم يتم مشاهدة الفتحة شخصيا ، فإن المؤشر الوحيد على العمر هو 2-3 ساعات التي يستغرقها السائل الأمنيوسي حتى يجف.
ملاحظة: يجب تنظيف حاضنة الفقس جيدا يوميا باستخدام كحول الأيزوبروبيل بنسبة 70٪ بناء على عدد الفقس الذي تتم معالجته. غالبا ما تترك فراخ الدجاج البراز والريش والسائل الأمنيوسي في الحاضنة ، مما قد يلوث الظروف وجودة الهواء.
2. إعداد المخدرات
- وزن الحيوان عن طريق وضعه في قارب وزن كبير. مع وضع لطيف بما فيه الكفاية ، يجب ألا يتحرك الحيوان.
ملاحظة: يمكن أن تتراوح الكتلة من 30-45 جم. غالبا ما تكون الحيوانات الأصغر سنا أثقل بسبب احتياطيات صفار البيض ولا تفرز النفايات بعد. الحيوانات الأكبر سنا التي تقترب من 24 ساعة من العمر و P2 عادة ما تزن أقل. - تحضير كوكتيل مخدر من الكيتامين (100 ملغم / مل) و Xylazine (20 ملغ / مل) بحيث تكون الجرعة 50 ملغ / كغ كيتامين و 16.68 ملغ / كغ Xylazine على أساس وزن الحيوان.
ملاحظة: يمكن صنع كوكتيل الدواء هذا مع 1 مل من الكيتامين (100 ملغ / مل) ، و 1.5 مل من زيلازين (20 ملغ / مل) ، و2.5مل من H 2 O. ستتراوح حقن الكوكتيل المخدر من 0.05-0.1 مل بناء على نطاق 30-45 جم في وزن الحيوان.
3. حقن المخدرات وإعداد الحيوانات
- امسك الحيوان بيد واحدة ، مع التأكد من إمساك الساقين.
- يشعر لعظم الصدر من الحيوان ، عارضة. على جانبي العارضة ستكون عضلة الثدي.
- استخدمي إبرة وحقنة 29 جم لاختراق الجلد بمقدار 5 مم وحقن كوكتيل الكيتامين / Xylazine في عضلة الثدي. حقن ما بين 0.05-0.1 مل على أساس وزن الحيوان.
- ضع الحيوان مرة أخرى في الحاضنة بعد الحقن. الحفاظ على درجة حرارة جسم الحيوان لبضع دقائق عندما يصبح المخدر ساري المفعول.
- استخدم الملقط لقرص إصبع الحيوان وتحقق مما إذا كانت الرقبة تعرج. إذا لم يكن هناك رد فعل وعنق أعرج ، فإن الحيوان فاقد الوعي.
- تحديد جنس الدجاج باستخدام ريش جناحه. إذا كان الريش بنفس الطول ، فإن الحيوان ذكر. إذا كان الريش يختلف في الطول ، فإن الحيوان هو أنثى30.
ملاحظة: طريقة أخرى لممارسة الجنس مع الحيوان هي التنفيس. يمكن رؤية الأعضاء التناسلية الذكرية في عباءة31. هذه الطريقة صعبة للغاية ويمكن أن تضر الحيوان إذا لم يتم القيام بها بشكل صحيح. يوصى باستخدام طريقة ريش الجناح. - ضع كريم مزيل الشعر باستخدام قضيب بطرف قطني على منطقة الرأس والرقبة ، خاصة بالقرب من فتحة الأذن للطائر.
- استخدم 70٪ من مناديل كحول الأيزوبروبيل لمسح الريش وأي كريم مزيل للشعر متبقي والجلد على الرأس والرقبة.
- استخدم مسحة كحول الأيزوبروبيل بنسبة 70٪ لتعقيم الأقطاب الكهربائية تحت الجلد ومسبار المستقيم.
- ضع الحيوان في عزل سليم وغرفة محمية كهربائيا. تأكد من أن البيئة لديها الحد الأدنى من الضوضاء الكهربائية والصوتية للحصول على أفضل التسجيلات.
ملاحظة: تم إجراء التجارب هنا في حاوية مخصصة معزولة الصوت بقياس 24 × 24 × 25 بوصة. أي غرفة أو غرفة تقضي على الضوضاء الصوتية ، وكذلك الضوضاء الكهربائية من التيار الكهربائي المتناوب (60 هرتز في الولايات المتحدة) ، كافية. - استخدم وسادة تدفئة أو نظام تحكم في درجة الحرارة للحفاظ على درجة حرارة جسم الحيوان.
- أدخل مسبار المستقيم المشحم لضمان الحفاظ على درجة حرارة الحيوان بين 37-41 درجة مئوية (98.6-105 درجة فهرنهايت) 32,33.
ملاحظة: إذا كان حجم المسبار غير صحيح ، فيمكن للحيوان الاستلقاء فوق مسبار درجة الحرارة. - ثبت رأس الحيوان في مكانه أو ضع المنقار على كائن لتجنب الحركة غير المرغوب فيها. يمكن القيام بذلك باستخدام طين النمذجة إذا لم يتم إعاقة التنفس.
- قم بإعطاء حقنة تكميلية من كوكتيل مخدر يبلغ نصف الجرعة الأصلية إذا بدأ الحيوان في استعادة وعيه أثناء الاختبار.
ملاحظة: أي حركة الجسم أو النطق هو علامة على أنه يجب إعطاء جرعة ملحق. تشير حركات المنقار الصغيرة إلى التنفس وهي مقبولة.
4. وضع القطب الكهربائي
- استخدم ثلاثة أقطاب كهربائية لإبرة الفولاذ المقاوم للصدأ وكلوريد الفضة مع التسميات التالية: القطب المرجعي ، القطب النشط ، والقطب الأرضي المشترك.
ملاحظة: يشار إلى القطب المرجعي أيضا باسم المقلوب أو "-". يشار إلى القطب النشط أيضا باسم غير مقلوب أو "+". - ضع كل قطب كهربائي تحت الجلد 2-3 مم في الرأس ، ولكن ليس عميقا بما يكفي لاختراق الجمجمة. استخدم أقطاب كهربائية يبلغ طولها 7 مم وقطرها 0.4 مم.
- كز القطب الكهربائي من الجلد ، مما يعرض الطرف. هذا يساعد على تقليل التلامس مع الجلد وضمان عمق إدخال ثابت عبر الحيوانات34.
ملاحظة: يجب أن يحتوي سلك القطب الكهربائي على ركود كاف بحيث لا يوجد توتر بعد وضع القطب الكهربائي يسحبه للخارج أو يسحب الجلد المشدود. - للتسجيل أحادي القناة ، ضع القطب النشط فوق الجمجمة عند خط الوسط ، بقدر ما يكون ذيليا مثل قناة الأذن.
- ضع القطب المرجعي خلف الأذن حيث سيتم تسليم الحافز ، وضع القطب الأرضي خلف قناة الأذن المقابلة في الرقبة.
ملاحظة: في حالة إجراء عملية جراحية في الجمجمة أو قناة الأذن للحيوان ، ضع القطب المرجعي في الرقبة عند خط الوسط للحيوان. يعتبر كل من هذا والخطوة 4.4.1 مونتاج تسجيل القطب الأفقي.
- ضع القطب المرجعي خلف الأذن حيث سيتم تسليم الحافز ، وضع القطب الأرضي خلف قناة الأذن المقابلة في الرقبة.
- للتسجيل ثنائي القناة، استخدم قطبين كهربائيين سالبين وقطب كهربائي موجب مدمج يتطلب كابل محول. ضع القطب الأرضي تحت الجلد في الرقبة وقطب مرجعي واحد خلف كل قناة أذن.
- تحقق من مقاومة القطب الكهربائي. تأكد من أن مقاومة القطب الكهربائي الإجمالية لا تتجاوز 5.0 kΩ. الحفاظ على مقاومة القطب البيني أقل من 3.0 kΩ.
5. تسجيل ABR
- اعتمادا على أجهزة وبرامج الاقتناء، تأكد من إجراء معايرة لمستويات الصوت الصحيحة عبر ترددات التحفيز المستخدمة.
ملاحظة: تختلف تقنيات المعايرة بناء على المعدات (انظر المناقشة). بالنسبة لبعض البرامج، يمكن تحرير توهين الصوت داخل البرنامج. تضمنت إجراءات المعايرة التي تم إجراؤها هنا استخدام ميكروفون مكثف B&K 4138 مقاس 1/8 بوصة لتسجيل محفزات التردد داخل نظام قارنة مغلقة يقترب من قناة أذن الفرخ (~ 5 مم). يتم توفير طاولة معايرة تفريخ الدجاج كطاولة تكميلية. - حرك جهاز محول الصوت نحو الأذن النشطة للحيوان. ضع محول الصوت على عمق ضحل يبلغ 2 مم في قناة الأذن.
ملاحظة: اعتمادا على محول الصوت، يمكن تركيب منظار بلاستيكي وإدخاله في قناة الأذن. وضع المنظار أمر بالغ الأهمية. إذا تم حظر الصوت بواسطة جدار القناة أو تم إغلاق قناة الأذن ، فستكون ABRs غائبة أو تشبه إزاحة ~ 40 ديسيبل في العتبة. - تحقق من الحيوان أثناء الاختبار إذا كانت النتائج تبدو غير طبيعية أو غائبة. إذا كانت كذلك ، فقم بإعادة وضع محول الصوت في قناة الأذن.
ملاحظة: نظرا لأن الجلد فضفاض وحركة الحيوانات ممكنة ، فقد يتغير موضع المنظار أثناء التسجيل. ومع ذلك ، مع الحقن المخدر الصحيح والحيوان فاقد الوعي تماما ، يمكن أن يستمر التسجيل دون انقطاع لمدة 30-45 دقيقة.
6. الحصول على البيانات
- استخدام معدات / برامج كافية لتوليد محفزات صوتية وتسجيل / الحصول على تسجيلات ABR.
ملاحظة: هناك العديد من الأنظمة المتاحة تجاريا أو المخصصة للحصول على ABR. بالنسبة لهذه التجارب ، تم استخدام منصة SmartEP USB المتاحة تجاريا لأنظمة السمع الذكية (IHS). القدرة على التعامل مع معلمات التسجيل أمر بالغ الأهمية. وتشمل هذه ، على سبيل المثال لا الحصر شدة التحفيز ، وطول التحفيز ، وتردد التحفيز ، ومعدل عرض التحفيز ، ومرشح المرور العالي والمنخفض ، ورفض القطع الأثرية ، وعدد عمليات المسح ، ومعدل أخذ العينات ، وشكل المغلف ، واستقطاب التحفيز. - اضبط الحدود العليا والدنيا لرفض القطع الأثرية (AR) على ±25 ميكروفولت ، بحيث تستبعد حركة الحيوان أو الضوضاء أثناء الاجتياح هذا الاجتياح من التحليل. عبر السكان الذين تم اختبارهم ، تم رفض أقل من 1٪ من إجمالي عمليات المسح بسبب القطع الأثرية.
- اجمع ما لا يقل عن 1024 عملية مسح للحصول على استجابة متوسطة للغاية. يمكن القيام بذلك في تسجيلين من 512 عملية مسح لكل منهما. وهذا يضمن أيضا أن تكون الاستجابة محفزة وقابلة للتكرار.
- اضبط الكسب على 100000 ، ومرشح التمرير المنخفض على 100 هرتز ، ومرشح التمرير العالي على 3000 هرتز.
ملاحظة: كانت إعدادات مرشح التمرير المنخفض والعالي مثالية للتسجيلات باستخدام نظام IHS. لذلك ، هذه المعلمات هي توصيات. قامت تسجيلات ABR في أنواع الطيور الأخرى باستخدام برنامج BIOSIG بتصفية الإشارة بين 30 و 3000 هرتز 5،13،14،16،22. - اضبط معدل عرض التحفيز بين 10 و 20 محفزا في الثانية. ستحول معدلات العرض التقديمي العالية زمن انتقال ذروة ABR ، خاصة بالنسبة للقمم اللاحقة13. وستؤدي معدلات العرض المنخفضة إلى زيادة الوقت اللازم للحصول على ABR.
- اضبط المدة الزمنية لتحفيز النقر على 100 ميكروثانية.
- في حالة استخدام حافز انفجار نغمة ، قم بتحرير تكرار ومدة التحفيز بناء على التأثير المطلوب. تم استخدام نطاق 100-4000 هرتز لمحفزات انفجار النغمة ، على الرغم من أن نطاق السمع السلوكي في الدجاج البالغ يتراوح بين 2-9000 هرتز35.
ملاحظة: في نظام IHS، لا يمكن تعديل وقت الارتفاع والهبوط لحافز انفجار النغمة إلا إذا كان شكل المغلف الطيفي شبه منحرف. ومع ذلك ، فإن مغلفات جيب التمام المربعة و Blackman توفر وقت صعود وهبوط محدد مسبقا يستخدم عادة في تجارب ABR على الحيوانات. يمكن لنظام IHS عرض الغلاف الطيفي لانفجار النغمة لضمان أوقات الارتفاع والانخفاض المناسبة. لا يمكن تحرير وقت الارتفاع والانخفاض لتحفيز النقرة في IHS.
- في حالة استخدام حافز انفجار نغمة ، قم بتحرير تكرار ومدة التحفيز بناء على التأثير المطلوب. تم استخدام نطاق 100-4000 هرتز لمحفزات انفجار النغمة ، على الرغم من أن نطاق السمع السلوكي في الدجاج البالغ يتراوح بين 2-9000 هرتز35.
- اضبط معدل أخذ العينات على أعلى قيمة مسموح بها (عادة 40 كيلو هرتز) للحصول على أفضل بيانات الدقة.
ملاحظة: تستخدم بعض الأنظمة، بما في ذلك IHS، عددا محدودا من نقاط أخذ العينات وستغير طول نافذة التسجيل. قد يسمح معدل أخذ العينات 40 كيلو هرتز (فترة 25 ميكروثانية) فقط بنافذة تسجيل 12 مللي ثانية ، لذلك لالتقاط انفجار نغمة ABR ، تم استخدام معدل أخذ عينات 20 كيلو هرتز (فترة 50 ميكروثانية) للسماح بنافذة تسجيل 24 مللي ثانية. في حالة المقارنة المباشرة بين ABRs المتلاحقة للنقر والنغمة ، حافظ على معدل أخذ العينات ثابتا للحفاظ على نفس الدقة. - اضبط استقطاب التحفيز على التناوب. يتم ذلك للقضاء على تصور الميكروفون القوقعي من تسجيلات ABR. لتصور الميكروفونية القوقعية الصناعية، استخدم الفصيل النادر أو التكثيف لقطبية التحفيز.
ملاحظة: يمكن تغيير العديد من الإعدادات عند تحديد المحفزات. قد لا تكون إعدادات الكسب والفلتر المتوفرة مثالية لإعدادات المعدات الأخرى. لم يتم تعيين إعدادات المصنع الافتراضية على معظم آلات ABR للتسجيل في الدجاج المفرخ. - في حالة تسجيل 512 عملية مسح، اجمع بين اختبارين منفصلين لإنشاء متوسط اكتساح 1024.
- للحصول على حافز اندفاع بنقرة أو نغمة ، احصل على ABR بكثافة فوق العتبة.
- استمر في التسجيل بكثافة أقل وأقل حتى لا يمكن تحديد الاستجابة المستحثة.
- تعريف عتبة ABR بأنها أدنى كثافة تحفيز تثير استجابة مثيرة يمكن اكتشافها. خفض شدة التحفيز بخطوات 5 dBSPL للعثور على أدنى كثافة تحفيز تثير ذروة يمكن اكتشافها.
7. القتل الرحيم ونهاية التجربة
- بمجرد الحصول على ABRs ، قم بإعداد جرعة زائدة (0.1 مل) من محلول القتل الرحيم (بنتوباربيتال الصوديوم 390 ملغ / مل فينيتوين الصوديوم 50 ملغ / مل).
- بعد استخدام قرصة إصبع القدم للتأكد من عدم وجود رد فعل ، حقن محلول القتل الرحيم في عضلة الثدي بإبرة 29-G على عمق 5 مم. تقنية الحقن هي نفسها الحقن المخدر.
ملاحظة: ستنتهي صلاحية الحيوان بعد بضع دقائق. لا تتلاعب بالحيوان أو تقطع رأسه حتى لا يتم اكتشاف أي حركة. تقنية القتل الرحيم البديلة هي إجراء حقن في الوريد في الوريد العضدي تحت الجناح. - بمجرد أن لا يكون الحيوان انعكاسيا ويتوقف التنفس وضربات القلب ، يقطع رأسه بسرعة باستخدام مقص حاد أو مقصات.
- نظف وسادة التدفئة ومسبار المستقيم وأقطاب كلوريد الفضة باستخدام مناديل كحول الأيزوبروبيل بنسبة 70٪.
- تأكد من حفظ جميع الآثار المكتسبة. لمزيد من التحليل ، قم بتصدير الملفات .txt الملفات التي يمكن عرضها في المفكرة أو استيرادها إلى جدول بيانات.
النتائج
تسجيلات ABR التمثيلية لفراخ الفقس
تأتي النتائج التمثيلية والسكانية التالية من تسجيلات ABR التي تم إجراؤها في 43 حيوانا. استجابة لتحفيز النقر فوق العتبة (75 dBSPL) ، لوحظت ثلاث قمم إيجابية باستمرار عبر جميع الفراخ. حدثت هذه القمم في غضون 6 مللي ثانية بعد بداية التحفيز. نادرا ما لوحظت ذروة رابعة عند ~ 6 مللي ثانية. في حين أن تحديد قمم ABR في الطيور يختلف بين الحيوانات (انظر المناقشة) ، تم تصنيف القمم وتحديدها على أنها الموجات الرقمية الرومانية I-IV. يظهر الشكل الموجي ABR التمثيلي مع قمم مصنفة في الشكل 1A (التتبع العلوي). ويبين الشكل 1 باء دالة الكمون والشدة للموجتين الأولى والثالثة المسماة في التتبع التمثيلي. زاد زمن انتقال ذروة الموجة الأولى بمقدار ~ 0.3 مللي ثانية لكل انخفاض بمقدار 20 ديسيبل في شدة التحفيز. في المتوسط، حدثت الموجات من الأول إلى الثالث عند 1.50 مللي ثانية (±0.02 مللي ثانية)، و3.00 مللي ثانية (±0.06 مللي ثانية)، و4.13 مللي ثانية (±0.09 مللي ثانية) عند 75 ديسيبل، على التوالي (الشكل 1C). يتم تقديم الموجة الأولى والموجة الثالثة دائما كقمة فريدة. في بعض الأحيان بالنسبة للموجة الثانية ، شوهدت قمم صغيرة متعددة بين 2.5-3.2 مللي ثانية. وكان لكل قمة حوض مطابق لها، وبلغ متوسط سعة الموجة الأولى من الذروة إلى القاع - وهي الأكبر بين جميع القمم - 7 ميكروفولت واقتربت من سعة قصوى تبلغ 11 ميكروفولت عند 75 ديسيبل SPL.
بالإضافة إلى أكبر سعة ، قدمت الموجة الأولى من الفرخ ABR أقل تباين في زمن انتقال الذروة بين الحيوانات. لذلك ، تم استخدام هذه الذروة لتقدير حساسية عتبة السمع. تم تعريف عتبات ABR على أنها أدنى كثافة تحفيز أثارت ذروة شكل موجي قابلة للتحديد والتكرار. تم تحديد ذلك ذاتيا من قبل المجرب والتحقق منه من قبل مجرب ثان لاتفاق العتبة. تم تعريف القمم بشكل أفضل وأسهل في تحديدها عند استخدام محفزات النقر ، ولكن رشقات النغمة ولدت أيضا قمم محددة وقابلة للتحديد تختلف اعتمادا على تردد التحفيز ومعلماته (الشكل 1D ، n = 4 كتاكيت). كانت عتبة ABR المستحضرة للنقر أقل من عتبة انفجار النغمة التي تم استثارتها ، باستثناء 1000 هرتز. غالبا ما كانت ABRs التي تم استثارتها بالنقر والتي لم تظهر قمم يمكن تحديدها >30 dBSPL نتيجة لإزاحة المنظار من قناة الأذن بسبب حركة الحيوانات.
انخفاض درجة حرارة الجسم يزيد من زمن تأخير ABR
من المعروف أن سرعة النشاط العصبي - كما تقاس بذروة حدوث سعة الشكل الموجي (أي الكمون) - تنخفض عند انخفاض درجات حرارة الجسم36,37. وقد لوحظت هذه الظاهرة في تفريخ الدجاج ABRs باستخدام حافز نقرة 75 dBSPL. ويبين الشكل 2 ألف أثرا تمثيليا. مع انخفاض درجة حرارة الجسم من 39 درجة مئوية ، حدث زمن انتقال قمم ABR في وقت لاحق من الوقت ، على الرغم من نفس مستوى شدة التحفيز. يوضح الشكل 2B زمن انتقال الموجتين الأولى والثالثة كدالة لانخفاض درجات حرارة الجسم للأثر التمثيلي. كان هناك ارتباط قوي (R2 = 0.89) بين انخفاض درجات حرارة الجسم وحدوث الكمون الذروة للموجة الأولى (الشكل 2C ، n = 5 كتاكيت). توضح هذه النتائج الحاجة إلى الحفاظ على درجة حرارة الجسم شبه الطبيعية أثناء تسجيلات ABR. إذا لم يتم الحفاظ على درجة حرارة الجسم شبه الطبيعية ، فإن وظائف شدة الكمون وقياسات السعة ل ABR متغيرة للغاية وغالبا ما تكون غير دقيقة.
اختلافات الكمون والسعة في الفقس المبكر
أظهرت الأبحاث أن النشاط العصبي المرتبط ببداية السمع للكتكوت يقترب من النضج في أواخر سنالجنين 8. ومع ذلك ، بالنسبة لمجموعة فرعية من الفقس المبكر جدا (<3 ساعات بعد الفقس) ، لاحظنا تحولا في الكمون الذروة للأشكال الموجية ABR (n = 4) استجابة لتحفيز نقرة SPL 75 ديسيبل أو لم يكن من الممكن تحديد الإمكانات المستحثة (n = 2 كتاكيت). في 2 صغار الفقس ، لا يمكن استنباط أي نغمة انفجار ABR ، وتم رفع عتبات النقر بمقدار 50 dBSPL. قد يكون هذا بسبب مشكلة موصلة حيث لا يزال هناك سائل في قناة الأذن / تجويف الأذن الوسطى للحيوان ، أو مكون عصبي متخلف. وقد أبلغت دراسات الثدييات عن تحولات عتبة تبلغ 50 ديسيبل في الأطفال حديثي الولادة38,39. كانت الحيوانات التمثيلية المستخدمة هنا عمرها >3 ساعة ، والتي تزامنت أيضا مع طول الوقت الذي يستغرقه الريش حتى يجف. ويبين الشكل 3 ألف ال ABRs المسجلة من صغار السن (P1، <3 ساعات من العمر) ومن صغار السن (P2). للتحليل ، قدمت 3 أفراخ صغيرة فقط مع جميع قمم ABR الثلاثة. وطال أمد الكمون الموجي الذروة إلى حد كبير، وانخفضت سعات الشكل الموجي انخفاضا طفيفا بالمقارنة مع الفقس الأكبر سنا (الشكل 3B-C، على التوالي).
وضع القطب الكهربائي المرجعي وتسجيلات ABR ثنائية القناة
في الشكل 4 ، تم تعديل موضع القطب المرجعي بين موقعين مختلفين ولكنه لا يزال يؤدي إلى تسجيلات ABR قابلة للمقارنة. أظهرت المقارنة بين 75 تتبع نقرة dBSPL في نفس الحيوان مع موقعي القطب المرجعي اختلافات ضئيلة في سعات الشكل الموجي من الذروة إلى القاع وزمن انتقال الشكل الموجي للذروة (الشكل 4A). كان وضع الخشاء منهجيا مثل تجارب ABR الثدييات التي تضع القطب المرجعي على الخشاء أو الصنوبر. سيكون استخدام موضع الرقبة للقطب المرجعي مفيدا إذا تم إجراء التلاعب أو الجراحة على أي من الأذنين. ومن المثير للاهتمام ، أن سعة ذروة الموجة الثانية لوضع الخشاء (التتبع الأحمر) حدثت بعد 1 مللي ثانية من ذروة الموجة الثانية لوضع الرقبة (أثر أسود). من المحتمل أن يعكس هذا الفارق الزمني موقع (مواقع) التوليد العصبي ABR بالنسبة لوضع القطب الكهربائي.
باستخدام إعداد ثنائي القناة ، تم استخدام قطب تسجيل نشط واحد (أعلى موضع الرأس) وقطب كهربائي مرجعي (مواضع الخشاء) للحصول على ABRs لكل من الأذنين اليسرى واليمنى (الشكل 4B). كانت الاستجابات بين الأذنين متشابهة ، مع تغييرات طفيفة في سعات الذروة على الأرجح بسبب وضع سماعة الأذن. دعم الكمون لكل من الأذن اليسرى واليمنى المكافئة الوظيفة الصحية المتساوية لكل من الأذنين ونصفي الكرة المخية في الدجاج المفرخ. ويمكن استخدام مونتاج التسجيل ثنائي القناة في عمليات التسجيل بكلتا الأذنين أيضا، ولكن ستكون هناك اعتبارات إضافية ضرورية لتلك التسجيلات.

الشكل 1: التسجيلات التمثيلية لكتاكيت الفقس إلى المحفزات التي تستحضر النقر والنغمة . (أ) تسجيلات ABR التمثيلية من كتكوت الفقس (P2) كدالة لمستويات شدة التحفيز المختلفة. يمكن تحديد ثلاث إلى أربع قمم إيجابية في ميكروفولت (μV) في غضون 6 مللي ثانية بعد بداية التحفيز (الوقت = 0 مللي ثانية). تم تحديد الموجات باستخدام الأرقام الرومانية. تنخفض السعات من الذروة إلى القاع عند انخفاض مستويات كثافة التحفيز. (ب) دوال شدة الكمون للموجتين الأولى والثالثة للأثر التمثيلي الموضح في (أ). تم تحليل هذه القمم فقط ، حيث لم يتم ملاحظة الموجة الثانية عادة بكثافة <45 dBSPL. (ج) زمن انتقال الأشكال الموجية لذروة ABR المستحثة بالنقر (n = 43 كتكوت). تشير أشرطة الخطأ إلى الخطأ المعياري للمتوسط (SEM). (د) متوسط ABRs المستحضر للنغمة (آثار سوداء) لأربعة فراخ تفريخ على ثلاثة ترددات مختلفة. الآثار الحمراء = الخطأ القياسي لمتوسط المحفزات (SEM) = 75 dBSPL. في هذا الشكل والأرقام اللاحقة ، تشير أشرطة الخطأ إلى SEM ، وكانت الأذن اليمنى هي الأذن المحفزة. (باستثناء الشكل 4 ب حيث تم تحفيز كلتا الأذنين). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تأثير درجة حرارة الجسم على تسجيلات ABR . (أ) تسجيلات ABR التمثيلية من كتكوت الفقس (P2) كدالة لدرجة حرارة الجسم. وبالنسبة لدرجات حرارة الجسم المنخفضة، زادت زمن انتقال الشكل الموجي الذروة بينما ظلت السعة من الذروة إلى القاع دون تغيير نسبيا. (ب) دالة الكمون ودرجة الحرارة للموجتين الأولى والثالثة للآثار التمثيلية المبينة في (أ). (ج) بيانات السكان التي تبين العلاقة بين الكمون وتغيرات درجة الحرارة ل 5 كتاكيت (p < 0.01 ، R2 = 0.89). ولوحظ اتجاه مماثل بالنسبة للموجتين الثانية والثالثة (البيانات غير معروضة). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
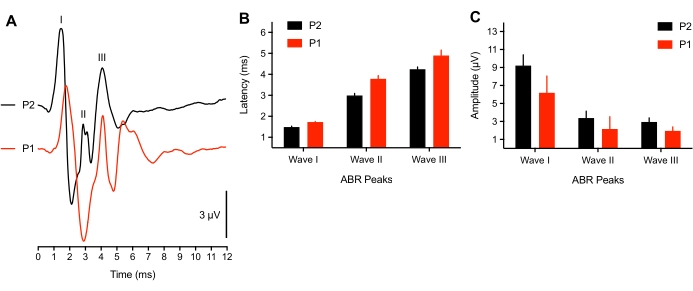
الشكل 3: الاختلافات المرتبطة بالعمر في تسجيلات ABR. (أ) تسجيلات ABR التمثيلية (المتداخلة) لكتكوت الفقس التمثيلي في P2 (الأثر الأسود) و P1 (<3 ساعة بعد الفقس ، أثر أحمر). (ب) زمن انتقال الشكل الموجي الذروة للموجات الأولى والثانية والثالثة كدالة للعمر. كانت زمن انتقال الموجات I-III مختلفة اختلافا كبيرا بين الأعمار (P < 0.05 ، n = 6 كتاكيت). (ج) سعات الشكل الموجي من الذروة إلى القاع للموجات الأولى والثانية والثالثة كدالة للعمر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
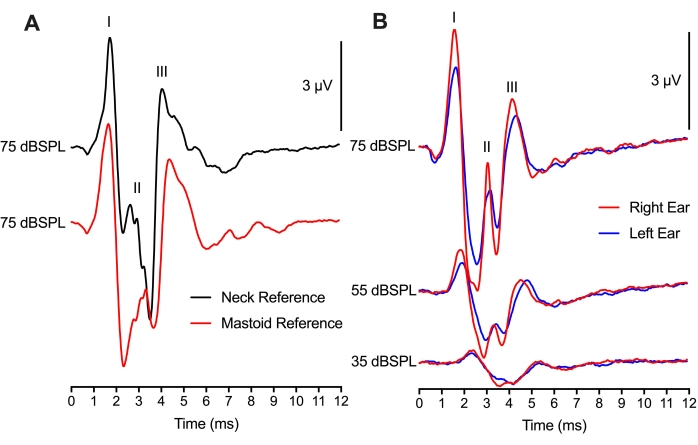
الشكل 4: وضع القطب الكهربائي وتسجيلات ABR ثنائية القناة: (أ) تسجيلات ABR التمثيلية (متداخلة) من نفس الفرخ الفقس (P2) مع وضع القطب المرجعي في الرقبة (أثر أسود) أو الخشاء (أثر أحمر). تم وضع القطب النشط في خط الوسط من الجمجمة لكل من مونتاج تسجيل القطب الكهربائي. زمن انتقال الموجتين الأولى والثالثة، وسعة الموجتين الأولى والثالثة متطابقان تقريبا في كلتا الحالتين. زمن انتقال الموجة الثانية سابق ، والسعة أكبر للقطب الموجود في أنسجة الرقبة. (ب) تسجيل بقناتين مع تحفيز الأذنين اليمنى واليسرى بالتتابع. تسجيلات ABR التمثيلية (متداخلة) من نفس فرخ الفقس (P2) مع الأقطاب الكهربائية المرجعية الموضوعة في خشاء الأذن اليسرى (الآثار الزرقاء) والأذن اليمنى (الآثار الحمراء) عند ثلاثة مستويات شدة مختلفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي: جدول معايرة تفريخ الدجاج. يرجى النقر هنا لتنزيل هذا الجدول.
Discussion
تمت دراسة جذع الدماغ السمعي للطيور بشكل جيد ، والعديد من الهياكل تشبه المسار السمعي للثدييات. يوفر العصب السمعي مدخلات مثيرة على النواتين المركزيتين من الدرجة الأولى، وهما النواة القوقعية ماغنوسيلولاريس (NM) والزاوي (NA). يرسل NM إسقاطا مثيرا ثنائيا إلى هدفه السمعي ، النواة الصفيحية (NL)7. مشاريع NL إلى نواة الدماغ المتوسط الجانبي ، pars dorsalis (MLd) 40,41. NL أيضا مشاريع إلى نواة أوليفاري متفوقة (SON) ، والتي توفر تثبيط التغذية المرتدة إلى NM و NA و NL42. يتم الحفاظ على هذه الدائرة الدقيقة السمعية السفلية لجذع الدماغ بشكل رائع للوظيفة التي تخدمها ، وتوطين الصوت ، والسمع بكلتا الأذنين33. تحتوي مناطق جذع الدماغ السمعية العليا للطائر أيضا على نوى مماثلة لل lemniscus الجانبي للثدييات و colliculus السفلي في الدماغ الأوسط. بالنظر إلى أوجه التشابه هذه ، فإن تكوين ABR للطيور حتى الدماغ المتوسط السمعي قابل للمقارنة عبر جميع الفقاريات.
في حين أن العديد من أنواع الطيور تظهر ثلاث قمم إيجابية في غضون 6 مللي ثانية بعد بداية التحفيز ، فإن العلاقة بين قمم ABR والهياكل السمعية المركزية لها بعض التباين. يمكن افتراض أن الموجة الأولى هي الاستجابة العصبية الأولى من الحليمة القاعدية الطرفية والعصب السمعي وتظهر القليل من التباين بين الأفراد (الشكل 1C). تحديد الموجة اللاحقة أقل تأكيدا وقد يختلف بين الأنواع. قرر Kuokkanen et al.17 مؤخرا أن الموجة الثالثة من ABR لبومة الحظيرة يتم إنشاؤها بواسطة NL. وبالتالي ، من المعقول القول بأن الموجة الثانية تنشأ من NM و NA من نواة القوقعةالصناعية 20. ومع ذلك ، تم تعريف موجة البومة الثالثة على أنها الذروة الإيجابية التي تم إنشاؤها بعد 3 مللي ثانية بعد بدء التحفيز. هذا يتوافق مع الموجة الثانية كما هو محدد في الدجاج الفقس ABR. في بومة الحظيرة ABR ، تم الجمع بين الموجتين الأولى والثانية.
في حين أن الدجاج المفرخ عادة ما يقدم مع ثلاث قمم في حدود 6 مللي ثانية ، فقد لوحظت أحيانا ذروة رابعة (على سبيل المثال ، انظر الشكل 1 أ). ستكون هناك حاجة إلى بيانات سكانية ، وحجم عينة أكبر ، ونماذج تجريبية إضافية لدعم موجة رابعة ، وفي بعض الحالات ، ABR دجاج من خمس موجات. كانت النتيجة الأكثر اتساقا هي تمثيلات الذروة الثلاثة الموضحة هنا.
نظرا لأن ABR يعرف بأنه مقياس للتزامن العصبي ، فإن النوى الرئيسية في المسار السمعي يمكن أن تمثل كل ذروة إيجابية في ABR. قد تحدد الإشارة التي تمر من العصب السمعي إلى NM / NA ثم إلى NL الموجات الأولى والثانية والثالثة في الدجاج الفقس ABR ، على التوالي. بالإضافة إلى ذلك ، يمكن أن تمثل الذروة الرابعة التي تحدث لاحقا من ABR الدجاج جذع الدماغ العلوي أو البنية السمعية للدماغ المتوسط. يجب أن يأخذ توصيف ABRs الطيور في الاعتبار أيضا الفرق بين الطيور المبكرة والطيور الألتريسيال. يختلف نضج الاستجابات السمعية بين الأنواع ويتأثر أيضا بسمات حرجة أخرى مثل سلوك المفترس و / أو التعلم الصوتي4. وبغض النظر عن ذلك، فإن الأساليب والتقنيات الموصوفة تطبق بسهولة على مجموعة متنوعة من أنواع الطيور والفقاريات.
يوضح الشكل 2 أهمية الحفاظ على درجة حرارة جسم الحيوان. مع انخفاض درجة حرارة الجسم الداخلية ، زاد زمن انتقال استجابات ABR لنفس مستوى شدة التحفيز. هذا أكثر وضوحا عندما تنخفض درجة حرارة الجسم إلى أقل من 32 درجة مئوية36,37. زيادة الكمون حوالي 1 مللي ثانية في ABR أقل مما تم الإبلاغ عنه سابقا في الدجاج23. ومع ذلك ، استخدم كاتاياما23 فقسا عمره 12 يوما تم تبريده وتسخينه لاحقا على مدار 4 ساعات. تم تسجيل البيانات الواردة في الشكل 2 أثناء عملية التبريد على مدى فترة 20 دقيقة. للحصول على أفضل جودة وأكثر التسجيلات اتساقا ، يجب الحفاظ على درجة حرارة جسم الحيوان ، ويجب إجراء جميع التسجيلات في نفس درجة الحرارة الفسيولوجية بين الحيوانات.
تأثير العمر على ABR طفيف ولكن من المهم مراعاته. وفي حين أن زمن انتقال الموجتين الأولى والثانية من ABR فقط كان مختلفا اختلافا كبيرا، فإن هذا يرجع جزئيا إلى أنه لم يستخدم سوى ثلاثة صغار صغار في الشكل 3؛ أما الثلاثة الآخرون فلم يقدموا ثلاث قمم ABR يمكن التعرف عليها. وقد تكون التحولات في سعة ABR وعتبتها واضحة أيضا إذا استخدمت أحجام عينات كبيرة أو قارنت بين ABRs الخاصة بالتردد. يمكن أن يحدث هذا التأثير المرتبط بالعمر بسبب السوائل الموجودة في الأذن الوسطى للدجاج. تؤدي هذه التغييرات الموصلة إلى زيادة ملحوظة في عتبات ABR لكل من النماذج البشرية والثدييات الأخرى38,39.
باستخدام اثنين من مونتاج التسجيل المختلفين ، لوحظت استجابات مماثلة (الشكل 4A). في حين أن المونتاج الأكثر شيوعا يضع القطب المرجعي خلف الأذن المستقبلة للتحفيز ، فإن وجود القطب المرجعي في أنسجة الرقبة يمكن أن يكون مفيدا إذا كان هناك تدخل جراحي مصاحب ل ABR. ومع ذلك ، إذا تم استخدام تسجيلات ABR ثنائية القناة ، فيجب وضع الأقطاب الكهربائية المرجعية بشكل منفصل ومتماثل ، وهو أمر صعب إذا تم وضع القطب المرجعي في الرقبة. يوصى باستخدام موضع الخشاء للقطب المرجعي لتوحيد أكبر عدد ممكن من جوانب التسجيل. يعد تسجيل ABR ثنائي القناة أداة فعالة تتطلب القليل من التحضير الإضافي وتؤدي إلى استجابات مماثلة بين الأذنين. من المحتمل أن تكون الاختلافات الطفيفة في السعة بسبب وضع سماعة الأذن. يسمح التسجيل ثنائي القناة بإجراء مقارنة سهلة بين الأذن أو نصف الكرة المخية الذي تم التلاعب به تجريبيا مقابل عنصر التحكم. سيكون هذا الإعداد مطلوبا أيضا لاختبار ABRs بكلتا الأذنين. يمكن أن تشير التجارب المستقبلية باستخدام ABR الدجاج إلى الأدبيات السابقة حول تسجيل التكوينات والمونتاج34.
هذه المنهجية تأتي مع العديد من القيود. كما ذكرنا في الخطوة 5.1 ، يمكن أن يؤدي وضع المنظار الضعيف إلى تحول 40 dBSPL استجابة لذلك. هذا يمكن أن يسبب تفسيرا غير صحيح لحيوان تم التلاعب به أو تعديله. يوصى بالاحتياطات التالية: الحصول على عينة كبيرة من بيانات التحكم قبل الحصول على ABRs للنماذج التي تم التلاعب بها أو المتحورة. لا تقلل من شدة التحفيز بأكثر من 20 dBSPL بين التسجيلات. إذا تغيرت السعة أو الكمون أكثر من المتوقع ، فتحقق من وضع الحيوان والمضارب. كرر هذا الحافز ABR لمراقبة التغييرات. إذا تحرك المنظار ، فاستعيد الاختبارات السابقة. هناك قيد آخر هو معايرة ABRs. بدون معايرة مناسبة لتسجيل مستوى ضغط الصوت ، فإن الكثافة المقدمة للحيوان غير معروفة. عند قياس إخراج الصوت ، استخدم نفس المنظار كما هو الحال في التسجيل التجريبي وميكروفون صغير داخل تجويف يقارب طول قناة أذن الحيوان (~ 5 مم). قم بقياس نفس ترددات النغمة المستخدمة في التجارب، حيث أن المعايرة خاصة بالتردد. قد يأتي الدليل الخاص بكل من أنظمة الأجهزة والبرامج مع إرشادات للمعايرة. هناك أيضا مرشحات إضافية مثل مرشحات الطور الخطي والحد الأدنى للطور ، والتي يمكن أن تحسن من النقر والنغمة المتلاحقة ABRs43. لم يتم استخدام هذه المرشحات في هذه الدراسة. كما لم يتم فحص اعتبارات إضافية، مثل زمن الارتفاع والهبوط لغلاف طيفي لانفجار نغمة يتغير كدالة للتردد أو تغيير وقت الارتفاع والانخفاض لمحفزات النقر. هذه تحقيقات مستقبلية جيدة بمجرد الحصول على ABRs موثوقة ومتسقة.
مقارنة الدجاج الفقس مع نماذج الطيور الأخرى واعدة. كما تعرض الببغاء والبوم الشرقي الصراخ ثلاث قمم ميكروفولت إيجابية خلال أول 6 مللي ثانية من ABR13,22. في أنواع مختلفة من نقار الخشب ، ينظر إلى ثلاث قمم أيضا ، ولكن الكمون الخاص بها في وقت لاحق في الوقت المناسب. بالإضافة إلى ذلك ، يتراوح نطاق أفضل حساسية للتردد في نقار الخشب بين 1500 و 4000 هرتز ، وهو أعلى إلى حد ما من أفضل عتبة للدجاج عند 1000 هرتز. في الدجاج البالغ ، تكون أفضل حساسية عند 2000 هرتز35 ، لذلك قد يكون هناك تحسين في سماع الترددات العالية مع تطور فراخ الدجاج إلى بالغين. سيختلف هذا التطور بين أنواع الطيور ، مع الأخذ بعين الاعتبار التطور الألتريسي أو المبكر للحيوان4.
يمكن أن تساعد الطرق التجريبية الموضحة هنا في تحديد العوامل التي تؤدي إلى أضرار أو تغييرات في الاستجابات والعتبات السمعية ، بالإضافة إلى الدراسات في مراحل مختلفة من التطور الجنيني. التلاعب الجيني والشيخوخة والتعرض للضوضاء كلها تلاعبات معروفة في الحيوانات ونماذج الطيور الأخرى24،25،44،45. يجب توسيع هذه الطرق لتشمل نموذج الدجاج الآن بعد أن سمحت تقنيات مثل الكهربية داخل البويضة بالتعبير عن البروتينات التي يتم التحكم فيها بشكل فوكلي وزمني في جانب واحد من جذع الدماغ السمعي 12,46. وهذا يسمح بالمقارنة المباشرة بين ABRs من الأذن التي تم التلاعب بها وراثيا إلى أذن التحكم المعاكسة باستخدام نموذج تسجيل ثنائي القناة.
بشكل عام ، يعد ABR لتفريخ الدجاج طريقة بحث مفيدة ، متطابقة تقريبا مع مقاييس وظيفة السمع في النماذج البشرية والثدييات الأخرى. وهي أيضا منهجية غير غازية في الجسم الحي . بصرف النظر عن الحقن المخدر ووضع القطب الكهربائي تحت الجلد لبضعة ملليمترات ، لا يلزم أي تلاعب مادي آخر. يمكن نظريا اختبار الفقس عدة مرات على مدار أيام أو أسابيع من أيام أو أسابيع إذا تم الاحتفاظ به في بيئة مناسبة. لا يحدد هذا البروتوكول الخطوات اللازمة ومعلمات التسجيل لدجاج الفقس ABR فحسب ، بل يقترح أيضا خصائص ABR الطيور التي يمكن أن تفيد في إجراء المزيد من الاختبارات في وظيفة جذع الدماغ السمعي.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يتم دعم هذا العمل من قبل NIH / NIDCD R01 DC017167
Materials
| Name | Company | Catalog Number | Comments |
| 1/8 inch B&K Microphone | Brüel & Kjær | 4138 | Type 4138-A-015 also works |
| Auditory Evoked Potential Universal Smart Box | Intelligent Hearing Systems | M011110 | |
| Custom Sound Isolation Chamber | GK Soundbooth Inc | N/A | Custom built |
| DC Power Supply | CSI/Speco | PSV-5 | |
| ER3 Insert Earphone | Intelligent Hearing Systems | M015302 | Used as sound transducer |
| Euthasol | Virbac | 710101 | Controlled Substance; euthanasia solution |
| Insulin Syringe (29 G) | Comfort Point | 26028 | |
| Ketamine | Covetrus | 11695-0703-1 | Controlled Substance |
| Power Supply | Powervar | 93051-55R | |
| Rectal Probe | YSI | 401 (10-09010) | Any 400 series probe will work with the YSI temperatuer monitor |
| Subdermal needles | Rhythmlink | RLSND107-1.5 | |
| Temperature Monitor | YSI | 73ATA 7651 | Works with any 400 series rectal probe |
| Xylazine | Anased | 59399-110-20 | Used with ketamine and water for anesthetic |
References
- Wever, E. G., Bray, C. W. Action currents in the auditory nerve in response to acoustical stimulation. Proceedings of the National Academy of Sciences of the United States of America. 16 (5), 344-350 (1930).
- Jewett, D. L., Williston, J. S. Auditory-evoked far fields averaged from the scalp of humans. Brain. 94 (4), 681-696 (1971).
- Corwin, J. T., Bullock, T. H., Schweitzer, J. The auditory brain stem response in five vertebrate classes. Electroencephalography and Clinical Neurophysiology. 54 (6), 629-641 (1982).
- Carey, C. Avian Growth and Development. Evolution within the Altricial Precocial Spectrum. , Oxford University Press. Oxford. (1998).
- Kraemer, A., Baxter, C., Hendrix, A., Carr, C. E. Development of auditory sensitivity in the barn owl. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 203 (10), 843-853 (2017).
- Rebillard, G., Rubel, E. W. Electrophysiological study of the maturation of auditory responses from the inner ear of the chick. Brain Research. 229 (1), 15-23 (1981).
- Parks, T. N., Rubel, E. W. Organization and development of brain stem auditory nuclei of the chicken: organization of projections from n. magnocellularis to n. laminaris. Journal of Comparative Neurology. 164 (4), 435-448 (1975).
- Hong, H., Rollman, L., Feinstein, B., Sanchez, J. T. Developmental profile of ion channel specializations in the avian nucleus magnocellularis. Frontiers in Cellular Neuroscience. 10, 80(2016).
- Leao, R. M. The ion channels and synapses responsible for the physiological diversity of mammalian lower brainstem auditory neurons. Hearing Research. 376, 33-46 (2019).
- Oline, S. N., Ashida, G., Burger, R. M. Tonotopic optimization for temporal processing in the cochlear nucleus. Journal of Neuroscience. 36 (32), 8500-8515 (2016).
- Kopp-Scheinpflug, C. Your genes decide what you are listening to. Channels. 11 (5), 355-356 (2017).
- Sid, H., Schusser, B. Applications of gene editing in chickens: A new era is on the horizon. Frontiers in Genetics. 9, 456(2018).
- Brittan-Powell, E. F., Dooling, R. J., Gleich, O. Auditory brainstem responses in adult budgerigars (Melopsittacus undulatus). The Journal of the Acoustical Society of America. 112 (3), Pt 1 999-1008 (2002).
- Lohr, B., Brittan-Powell, E. F., Dooling, R. J. Auditory brainstem responses and auditory thresholds in woodpeckers. The Journal of the Acoustical Society of America. 133 (1), 337-342 (2013).
- Counter, S. A. Brain-stem evoked potentials and noise effects in seagulls. Comparative Biochemistry and Physiology. A, Comparative Physiology. 81 (4), 837-845 (1985).
- Crowell, S. E., et al. A comparison of auditory brainstem responses across diving bird species. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 201 (8), 803-815 (2015).
- Noirot, I. C., Brittan-Powell, E. F., Dooling, R. J. Masked auditory thresholds in three species of birds, as measured by the auditory brainstem response (L). Journal of the Acoustical Society of America. 129 (6), 3445-3448 (2011).
- McGee, J., et al. Auditory performance in bald eagles and red-tailed hawks: a comparative study of hearing in diurnal raptors. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 205 (6), 793-811 (2019).
- Brittan-Powell, E. F., Dooling, R. J., Ryals, B., Gleich, O. Electrophysiological and morphological development of the inner ear in Belgian Waterslager canaries. Hearing Research. 269 (1-2), 56-69 (2010).
- Kuokkanen, P. T., Kraemer, A., Kempter, R., Koppl, C., Carr, C. E. Auditory brainstem response wave iii is correlated with extracellular field potentials from nucleus laminaris of the barn owl. Acta Acustica United with Acustica. The Journal of the European Acoustics Association (EEIG). 104 (5), 874-877 (2018).
- Beatini, J. R., Proudfoot, G. A., Gall, M. D. Frequency sensitivity in Northern saw-whet owls (Aegolius acadicus). Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 204 (2), 145-154 (2018).
- Brittan-Powell, E. F., Lohr, B., Hahn, D. C., Dooling, R. J. Auditory brainstem responses in the Eastern Screech Owl: an estimate of auditory thresholds. The Journal of the Acoustical Society of America. 118 (1), 314-321 (2005).
- Katayama, A. Postnatal development of auditory function in the chicken revealed by auditory brainstem responses (ABRs). Electroencephalography and Clinical Neurophysiology. 62 (5), 388-398 (1985).
- Durham, D., Park, D. L., Girod, D. A. Breed differences in cochlear integrity in adult, commercially raised chickens. Hearing Research. 166 (1-2), 82-95 (2002).
- Kaiser, C. L., Girod, D. A., Durham, D. Breed-dependent susceptibility to acute sound exposure in young chickens. Hearing Research. 203 (1-2), 101-111 (2005).
- Hamdy, A. M., Vander Hel, W., Henken, A. M., Galal, A. G., Abd-Elmoty, A. K. Effects of air humidity during incubation and age after hatch on heat tolerance of neonatal male and female chicks. Poultry Science. 70 (7), 1499-1506 (1991).
- Bruzual, J. J., Peak, S. D., Brake, J., Peebles, E. D. Effects of relative humidity during the last five days of incubation and brooding temperature on performance of broiler chicks from young broiler breeders. Poultry Science. 79 (10), 1385-1391 (2000).
- vander Pol, C. W., van Roovert-Reijrink, I. A. M., Maatjens, C. M., vanden Brand, H., Molenaar, R. Effect of relative humidity during incubation at a set eggshell temperature and brooding temperature posthatch on embryonic mortality and chick quality. Poultry Science. 92 (8), 2145-2155 (2013).
- Buhr, R. J. Incubation relative humidity effects on allantoic fluid volume and hatchability. Poultry Science. 74 (5), 874-884 (1995).
- Galli, R., et al. Sexing of chicken eggs by fluorescence and Raman spectroscopy through the shell membrane. PLoS One. 13 (2), 0192554(2018).
- Otsuka, M., Miyashita, O., Shibata, M., Sato, F., Naito, M. A novel method for sexing day-old chicks using endoscope system. Poultry Science. 95 (11), 2685-2689 (2016).
- Kaiser, A. The ontogeny of homeothermic regulation in post-hatching chicks: its influence on the development of hearing. Comparative Biochemistry and Physiology. A, Comparative Physiology. 103 (1), 105-111 (1992).
- Kuba, H., Yamada, R., Ohmori, H. Evaluation of the limiting acuity of coincidence detection in nucleus laminaris of the chicken. The Journal of Physiology. 552, Pt 2 611-620 (2003).
- Shaheen, L. A., Valero, M. D., Liberman, M. C. Towards a diagnosis of cochlear neuropathy with envelope following responses. Journal of the Association for Research in Otolaryngology. 16 (6), 727-745 (2015).
- Hill, E. M., Koay, G., Heffner, R. S., Heffner, H. E. Audiogram of the chicken (Gallus gallus domesticus) from 2 Hz to 9 kHz. Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 200 (10), 863-870 (2014).
- Rossi, G. T., Britt, R. H. Effects of hypothermia on the cat brainstem auditory evoked response. Electroencephalography and Clinical Neurophysiology. 57 (2), 143-155 (1984).
- Doyle, W. J., Fria, T. J. The effects of hypothermia on the latencies of the auditory brainstem response (ABR) in the rhesus monkey. Electroencephalography and Clinical Neurophysiology. 60 (3), 258-266 (1985).
- Guan, X., Gan, R. Z. Effect of middle ear fluid on sound transmission and auditory brainstem response in guinea pigs. Hearing Research. 277 (1-2), 96-106 (2011).
- Ravicz, M. E., Rosowski, J. J., Merchant, S. N. Mechanisms of hearing loss resulting from middle-ear fluid. Hearing Research. 195 (1-2), 103-130 (2004).
- Wang, Y., Zorio, D. A. R., Karten, H. J. Heterogeneous organization and connectivity of the chicken auditory thalamus (Gallus gallus). Journal of Comparative Neurology. 525 (14), 3044-3071 (2017).
- Wang, Y., Karten, H. J. Three subdivisions of the auditory midbrain in chicks (Gallus gallus) identified by their afferent and commissural projections. Journal of Comparative Neurology. 518 (8), 1199-1219 (2010).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. Journal of Neuroscience. 30 (36), 12075-12083 (2010).
- Beutelmann, R., Laumen, G., Tollin, D., Klump, G. M. Amplitude and phase equalization of stimuli for click evoked auditory brainstem responses. The Journal of the Acoustical Society of America. 137 (1), 71-77 (2015).
- Liberman, M. C. Noise-induced and age-related hearing loss: new perspectives and potential therapies. F1000Research. 6, 927(2017).
- Efrati, A., Gutfreund, Y. Early life exposure to noise alters the representation of auditory localization cues in the auditory space map of the barn owl. Journal of Neurophysiology. 105 (5), 2522-2535 (2011).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments: JoVE. (124), e55628(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved