Method Article
치킨 부화의 청각 뇌간 반응 평가
요약
우리는 표준 청각 뇌간 반응 (ABR) 기술을 사용하여 청각 기능을위한 조숙 한 조류 모델 인 부화 닭에 적용했습니다. 이 프로토콜은 동물 준비 및 ABR 획득 기술을 자세히 설명하고 다른 조류 또는 설치류 모델로 번역 할 수있는 단계를 설명합니다.
초록
청각 뇌간 반응 (ABR)은 임상 청각학, 비 인간 동물 및 인간 연구에서 귀중한 분석입니다. 청각 신경 동기화를 측정하고 다른 척추 동물 모델 시스템에서 청력 감도를 추정하는 데 ABR이 널리 사용되었지만 닭고기에 ABR을 기록하는 방법은 거의 사십 년 동안보고되지 않았습니다. 닭은 청각 시스템이 후기 배아 및 초기 부화 단계에서 기능적 성숙에 가깝기 때문에 강력한 동물 연구 모델을 제공합니다. 우리는 닭 부화에서 피하 바늘 전극 어레이를 사용하여 하나 또는 두 개의 채널 ABR 기록을 이끌어내는 데 사용되는 방법을 시연했습니다. 전극 기록 구성(즉, 몽타주)에 관계없이, ABR 기록은 초임계 클릭 자극의 처음 6ms 이내에 3-4개의 포지티브-진행 피크 파형을 포함하였다. 피크 대 트로프 파형 진폭은 고강도 레벨에서 2-11μV 범위였으며, 포지티브 피크는 예상되는 레이턴시-강도 함수(즉, 감소된 강도의 함수로서 레이턴시 증가)를 나타낸다. 표준화된 이어폰 위치는 느슨한 피부가 외이도를 가리고 동물의 움직임이 자극 변환기를 제거 할 수 있기 때문에 최적의 녹음에 중요했습니다. 피크 진폭은 더 작았고, 동물의 체온이 낮아짐에 따라 대기 시간이 길어져 생리적 체온 유지의 필요성을 뒷받침했다. 어린 해칭 (해칭 후 1 일 <3 시간)의 경우 임계 값이 ~ 5dB만큼 상승하고 피크 대기 시간이 ~ 1-2ms, 피크 대 트로프 진폭이 이전 부화에 비해 ~ 1 μV 감소했습니다. 이것은 잠재적 인 전도 관련 문제 (즉, 중이 공동의 유체)를 암시하며 어린 부화에 대해 고려되어야합니다. 전반적으로, 여기에 설명 된 ABR 방법은 다양한 발달 단계에 적용 할 수있는 닭 부화에서 생체 내 청각 기능을 정확하고 재현 가능한 기록으로 허용합니다. 이러한 발견은 난청, 노화 또는 기타 청각 관련 조작의 인간 및 포유류 모델과 쉽게 비교됩니다.
서문
소리 자극에 대한 유발 된 신경 반응에 대한 연구는 반세기 이상거슬러 올라갑니다 1. 청각 뇌간 반응 (ABR)은 수십 년 동안 인간이 아닌 동물과 인간 모두에서 청각 기능의 척도로 활용 된 유발 된 잠재력입니다. 인간 ABR은 통상적으로 로마 숫자(I-VII)2로 라벨링된 다섯 개 내지 일곱 개의 파형 피크를 제시한다. 이러한 피크는 신경 반응의 대기 시간(밀리초 단위의 발생 시간)과 진폭(마이크로볼트의 피크 대 트로프 크기)을 기반으로 분석됩니다. ABR은 청각 신경의 기능과 무결성뿐만 아니라 뇌간 및 청력 임계 감도를 평가하는 데 도움이됩니다. 청각 시스템의 결핍은 부재, 감소, 연장 또는 비정상적인 ABR 대기 시간 및 진폭을 초래합니다. 놀랍게도, 이러한 매개 변수는 인간과 다른 동물에서 거의 동일하므로 척추 동물 모델3에서 청각 기능에 대한 일관된 객관적인 테스트가됩니다.
그러한 모델 시스템 중 하나는 닭고기이며, 다양한 이유로 특히 유용합니다. 새는 altricial 또는 precocial4로 분류 될 수 있습니다. Altricial 새들은 여전히 발전하고있는 감각으로 부화합니다. 예를 들어, 헛간 올빼미는 해치5 이후 나흘 동안 일관된 ABR을 표시하지 않습니다. 닭과 같은 조숙 한 동물은 거의 성숙한 감각으로 부화합니다. 청력의 발병은 부화 전 (배아 21 일째)에 배아 발달에서 발생하며, 청각 시스템은 기능적 성숙6,7,8에 가깝습니다. Altricial 조류와 대부분의 포유류 모델은 발달에 영향을 미치고 청력이 성숙 할 때까지 축산이 필요한 외인성 요인에 취약합니다. 닭고기 ABR은 해치와 같은 날에 수행 할 수 있으므로 먹이가 필요하거나 풍요로운 환경을 피할 수 있습니다.
배아 닭은 생리학 및 발달, 특히 청각 뇌간에서 잘 연구 된 모델이었습니다. 특정 구조는 닭 달팽이관 핵을 포함하며, 핵 magnocellularis (NM)와 핵 각형 (NA)으로 나뉘며, 조류는 핵 laminaris (NL)6,7로 알려진 내측 우수한 올리브의 상관 관계가 있습니다. ABR은 전뇌와 피질의 수준 이전에 중앙 청각 기능에 초점을 맞추는 데 이상적입니다. 생체 내 ABR 측정과 발달8, 생리학9, 토노토피10 및 유전학 11,12에 대한 시험관내 신경 연구 사이의 번역은 전반적인 청각 기능에 대한 연구를 지원하는 이상적인 연구 기회를 제공합니다.
ABR은 포유류 모델에서 광범위하게 연구되었지만 조류에 대한 초점은 적었습니다. 이전의 조류 ABR 연구에는 budgerigar 13, 딱따구리 14, 갈매기 15, 다이빙 조류 16, 얼룩말 핀치 17, 일주일 랩 터18, 카나리아 19, 올빼미 5,20,21,22 및 닭 23의 세 종의 특성화가 포함됩니다. 닭고기 ABR의 마지막 철저한 특성화 이후 거의 사십 년을 감안할 때, 이전에 사용 된 많은 장비와 기술이 변경되었습니다. 다른 조류 모델에 대한 연구의 통찰력은 닭고기 ABR과의 비교로도 사용되는 동시에 현대 닭고기 ABR 방법론을 개발하는 데 도움이 될 수 있습니다. 이 논문은 발달의 배아 단계 및 기타 작은 설치류 및 조류 모델에도 적용될 수있는 부화 닭의 ABR 기록을 허용하기위한 실험 설정 및 설계를 간략하게 설명합니다. 또한, 닭의 조숙 한 발달을 감안할 때, 발달 조작은 광범위한 축산업없이 수행 될 수 있습니다. 발달중인 배아에 대한 조작은 동물이 거의 성숙한 청력 능력으로 부화 한 후 불과 몇 시간 만에 평가할 수 있습니다.
프로토콜
여기에 설명 된 실험은 노스 웨스턴 대학의 기관 동물 관리 및 사용위원회 (IACUC)의 승인을 받았으며 실험실 동물의 관리 및 사용을위한 국립 보건원 가이드에 따라 수행되었습니다.
1. 닭 축산
- 수정 된 흰 다리 뿔 닭 알을 얻으십시오.
참고 : 과학 연구에 사용 된 여러 닭 품종이 있지만 여기에 표시된 결과는 흰색 다리 뿔 닭 (Gallus gallus domesticus)에서 나온 것입니다. 품종 간의 ABR 변동성은 알려지지 않았지만, 성인 알을 낳는 닭과 육류 생산 육계 닭24,25을 비교할 때 몇 가지 차이점이 발견되었습니다. - 원하는 시험일 21 일 전에 38 °C, 습도 50 %에서 계란을 배양하십시오.
참고 : 계란을 38 ° C에서 즉시 배양하지 않으면 14 ° C, 습도 40 %에서 보관할 수 있습니다. 그러나 알이 14 °C에서 더 오래 유지될수록 생존 가능한 부화로 발전 할 가능성이 적습니다. 7 일 후, 계란 생존력은 계란이 14 °C에서 얼마나 오래 유지되는지에 따라 50 %만큼 낮아질 수 있습니다. 계란 생존력도 겨울철에 떨어질 것입니다. - 주기적으로 하루에 2-3 번 알을 돌립니다. 대부분의 인큐베이터에는 이것을 자동으로 수행하는 메커니즘이 있습니다.
- 스티로폼 인큐베이터 또는 6 개 이상의 알을 보유하고있는 인큐베이터를 사용하는 경우, 부화 전날, 배아 20 일 (E20)에 작은 38 °C 인큐베이터로 알을 옮깁니다. 계란은 인큐베이터에 놓인 후 21 일 (E21)을 부화해야합니다.
참고 : 부화 과정에서 동물은 알에서 "배관"을 시작하여 결국 계란 전체를 돌아 다니는 작은 구멍을 만듭니다. 조건이 너무 건조하면 알이 말라서 동물이 부화 할 수 없습니다. 습도는 달걀 부화 생존 가능성26,27,28,29에 대한 이전 연구를 기반으로 약 50 %를 유지해야합니다. - 동물의 나이를 결정하십시오. 해치가 직접 목격되지 않으면 나이의 유일한 표시는 양수가 건조하는 데 걸리는 2-3 시간입니다.
참고 : 부화 인큐베이터는 얼마나 많은 부화가 처리되는지에 따라 70 % 이소프로필 알코올로 매일 철저히 청소해야합니다. 닭 부화는 종종 배설물, 깃털 및 양수를 인큐베이터에 남겨 두어 조건과 공기의 질을 오염시킬 수 있습니다.
2. 약물 준비
- 동물을 큰 계량 보트에 넣어 동물의 무게를 측정하십시오. 충분히 부드러운 배치로 동물은 움직이지 않아야합니다.
참고: 질량의 범위는 30-45g입니다. 어린 동물들은 노른자 매장량 때문에 종종 더 무겁고 아직 폐기물을 배설하지 않습니다. 나이가 24 시간에 접근하는 오래된 동물과 P2의 체중은 대개 적습니다. - 케타민 (100 mg / mL)과 자일라진 (20 mg / mL)의 마취 칵테일을 준비하여 복용량이 케타민 50 mg / kg 및 동물 체중 기준으로 16.68 mg / kg 자일라진이 되도록하십시오.
참고: 이 약물 칵테일은 케타민 1mL(100mg/mL), 자일라진 1.5mL(20mg/mL), H2O. 마취성 칵테일 주사 2.5mL로 만들 수 있으며, 동물 체중30~45g 범위를 기준으로 0.05~0.1mL입니다.
3. 약물 주사 및 동물 준비
- 한 손에 동물을 잡고 다리를 아래로 잡으십시오.
- 동물의 가슴뼈, 용골을 느껴보십시오. 용골의 양쪽에는 유방 근육이 있습니다.
- 29-G 바늘과 주사기를 사용하여 5mm를 피부에 침투시키고 케타민 / 자일라진 칵테일을 유방 근육에 주입하십시오. 동물 체중을 기준으로 0.05-0.1 mL 사이에 주사하십시오.
- 주사 후 동물을 인큐베이터에 다시 넣으십시오. 마취제가 효력을 발휘할 때 동물의 체온을 몇 분 동안 유지하십시오.
- 포셉을 사용하여 동물의 발가락을 꼬집고 목이 절뚝 거리는지 확인하십시오. 반사 작용이없고 목이 절뚝 거리면 동물은 의식이 없습니다.
- 날개 깃털을 사용하여 닭의 성별을 결정하십시오. 깃털이 모두 같은 길이라면 동물은 남성입니다. 깃털의 길이가 다양하면 동물은 여성30입니다.
참고 : 동물을 섹스하는 또 다른 방법은 환기입니다. 남성 생식기는 cloaca31에서 볼 수 있습니다. 이 방법은 매우 어려우며 올바르게 수행하지 않으면 동물에게 해를 끼칠 수 있습니다. 날개 깃털 방법을 사용하는 것이 좋습니다. - 머리와 목 부위, 특히 새의 귀 개구 근처에면화 팁 도포기가있는 탈모 크림을 바르십시오.
- 70 % 이소프로필 알코올 물티슈를 사용하여 깃털, 남아있는 탈모 크림 및 머리와 목의 피부를 닦아냅니다.
- 70% 이소프로필 알코올 와이프를 사용하여 피하 전극 및 직장 프로브를 멸균합니다.
- 동물을 소리 격리 및 전기적으로 차폐 된 챔버에 두십시오. 최상의 녹음을 위해 환경에 최소한의 전기 및 음향 소음이 있는지 확인하십시오.
참고 : 여기에있는 실험은 24 x 24 x 25 인치 크기의 맞춤형 사운드 격리 인클로저에서 수행되었습니다. 음향 소음뿐만 아니라 교류 전류 (미국의 경우 60Hz)로 인한 전기 소음을 제거하는 모든 챔버 또는 방으로 충분합니다. - 동물의 체온을 유지하기 위해 가열 패드 또는 온도 제어 시스템을 사용하십시오.
- 윤활된 직장 프로브를 삽입하여 동물의 온도가 37-41°C(98.6-105°F)32,33 사이에서 유지되도록 합니다.
참고 : 프로브의 크기가 잘못된 경우 동물은 온도 프로브 위에 놓을 수 있습니다. - 동물의 머리를 제자리에 고정하거나 부리를 물체에 대고 원치 않는 움직임을 피하십시오. 이것은 호흡이 방해받지 않는 경우 점토를 모델링하여 수행 할 수 있습니다.
- 동물이 시험 중에 의식을 회복하기 시작하면 원래 복용량의 절반 인 마취 칵테일의 보충 주사를 투여하십시오.
참고 : 모든 신체 움직임이나 발성은 보충제 복용량을 투여해야한다는 신호입니다. 작은 부리 움직임은 호흡을 나타내며 허용됩니다.
4. 전극 배치
- 세 개의 스테인레스 스틸, 염화은 바늘 전극을 다음과 같은 명칭으로 사용하십시오 : 참조 전극, 활성 전극 및 공통 접지 전극.
주: 기준 전극은 반전 또는 "-"라고도 합니다. 활성 전극은 또한 비반전 또는 "+"로 지칭된다. - 각 전극을 진피 하 2-3 mm를 머리에 넣지 만 두개골을 관통 할만큼 깊지는 않습니다. 길이 7mm, 직경 0.4mm의 전극을 사용하십시오.
- 전극을 피부 밖으로 찌르고 팁을 노출시킵니다. 이것은 피부와의 접촉을 최소화하고 동물(34)에 걸쳐 일관된 삽입 깊이를 보장하는 데 도움이 된다.
참고 : 전극 와이어는 전극을 배치 한 후 전극을 당기거나 피부를 당길 수있는 장력이 없도록 충분한 여유가 있어야합니다. - 단일 채널 녹화의 경우, 활성 전극을 외이도만큼 멀리 떨어진 중앙선의 두개골 위에 놓습니다.
- 자극이 전달될 귀 뒤에 기준 전극을 놓고 목의 대측성 외이도 뒤에 접지 전극을 놓습니다.
참고: 동물의 두개골이나 외이도에서 수술을 하는 경우, 동물의 중앙선에 목에 참조 전극을 놓으십시오. 이 단계와 4.4.1 단계 모두 수평 전극 기록 몽타주로 간주됩니다.
- 자극이 전달될 귀 뒤에 기준 전극을 놓고 목의 대측성 외이도 뒤에 접지 전극을 놓습니다.
- 두 채널 녹화의 경우 두 개의 음극과 어댑터 케이블이 필요한 결합된 양극을 사용하십시오. 접지 전극을 목에 피하 놓고 각 외이도 뒤에 하나의 기준 전극을 놓습니다.
- 전극 임피던스를 확인합니다. 전체 전극 임피던스가 5.0kΩ을 초과하지 않는지 확인하십시오. 전극간 임피던스를 3.0kΩ 미만으로 유지하십시오.
5. ABR 기록
- 수집 하드웨어 및 소프트웨어에 따라 사용된 자극 주파수에서 올바른 사운드 레벨에 대한 보정을 수행해야 합니다.
참고: 교정 기술은 장비에 따라 다릅니다(토론 참조). 일부 프로그램의 경우 소프트웨어 내에서 사운드 감쇠를 편집 할 수 있습니다. 여기에서 수행된 교정 절차에는 1/8인치 B&K 4138 콘덴서 마이크를 사용하여 병아리 외이도(~5mm)에 근접한 폐쇄형 커플러 시스템 내에서 주파수 자극을 기록하는 작업이 포함되었습니다. 닭 부화 교정 테이블은 보충 테이블로 제공됩니다. - 사운드 트랜스듀서 장치를 동물의 활성 귀 쪽으로 옮깁니다. 사운드 트랜스듀서를 외이도의 얕은 깊이 2mm에 놓습니다.
참고: 사운드 트랜스듀서에 따라 플라스틱 검경을 부착하여 외이도에 삽입할 수 있습니다. 사경 배치가 중요합니다. 소리가 운하 벽에 의해 막히거나 외이도가 막히면 ABR이 없거나 임계 값에서 ~ 40dB 시프트와 유사합니다. - 검사 중에 결과가 비정상적이거나 결석한 경우 동물을 확인하십시오. 이 경우 외이도에서 사운드 변환기를 재배치하십시오.
참고 : 피부가 느슨하고 동물의 움직임이 가능하기 때문에 녹음 중에 검경 배치가 바뀔 수 있습니다. 그러나 올바른 마취 주사와 동물이 완전히 의식을 잃으면 30-45 분 동안 기록이 중단되지 않을 수 있습니다.
6. 데이터 수집
- 충분한 장비 / 소프트웨어를 사용하여 사운드 자극을 생성하고 ABR 녹음을 녹음 / 획득하십시오.
참고: ABR 인수를 위한 상업적으로 이용 가능한 또는 맞춤형 시스템이 많이 있습니다. 이러한 실험을 위해 상용화된 지능형 보청기 시스템(IHS) SmartEP USB 플랫폼이 사용되었습니다. 기록 매개 변수를 조작하는 기능은 매우 중요합니다. 이들은 자극 강도, 자극 길이, 자극 주파수, 자극 프리젠테이션 속도, 하이 패스 및 저역 통과 필터, 아티팩트 제거, 스윕 수, 샘플링 속도, 엔벨로프 형상 및 자극 분극을 포함하나 이에 제한되지는 않는다. - 아티팩트 제거율(AR) 상한과 하한을 ±25μV로 설정하여 스윕 중 동물의 움직임이나 소음이 분석에서 해당 스윕을 제외하도록 합니다. 테스트 된 인구 전체에서 총 스윕의 1 % 미만이 유물로 인해 거부되었습니다.
- 최소 1024개의 스윕을 수집하여 평균 응답을 얻습니다. 이것은 각각 512 스윕의 두 개의 녹음에서 수행 할 수 있습니다. 이것은 또한 반응이 자극을 불러 일으키고 반복 할 수 있도록합니다.
- 게인을 100,000으로, 저역 통과 필터를 100Hz로, 고역 통과 필터를 3000Hz로 설정합니다.
참고: 저역 및 고역 통과 필터 설정은 IHS 시스템을 사용하는 레코딩에 최적이었습니다. 따라서 이러한 매개 변수는 권장 사항입니다. BIOSIG 소프트웨어를 사용하여 다른 조류 종에서의 ABR 기록은 30 ~ 3000 Hz 5,13,14,16,22 사이의 신호를 필터링했습니다. - 초당 10~20회 자극 사이의 자극 발표 속도를 설정합니다. 높은 프리젠테이션 속도는 ABR 피크 레이턴시를 이동시키며, 특히 이후 피크(13)의 경우 더욱그러하다. 프리젠 테이션 속도가 낮 으면 ABR을 획득하는 데 필요한 시간이 늘어납니다.
- 클릭 자극의 지속 시간을 100μs로 설정합니다.
- 톤 버스트 자극을 사용하는 경우, 원하는 효과에 따라 자극의 빈도와 지속 시간을 편집하십시오. 톤 버스트 자극에는 100-4000Hz의 범위가 사용되었지만 성인 닭의 행동 청력 범위는 2-9000Hz35입니다.
참고: IHS 시스템에서 톤 버스트 자극의 상승 및 하강 시간은 스펙트럼 엔벨로프 형태가 사다리꼴인 경우에만 수정할 수 있습니다. 그러나 코사인 제곱 및 Blackman 봉투는 동물 ABR 실험에 일반적으로 사용되는 사전 설정된 상승 및 하강 시간을 제공합니다. IHS 시스템은 톤 버스트의 스펙트럼 엔벨로프를 표시하여 적절한 상승 및 하강 시간을 보장할 수 있습니다. 클릭 자극의 상승 및 하강 시간은 IHS에서 편집할 수 없습니다.
- 톤 버스트 자극을 사용하는 경우, 원하는 효과에 따라 자극의 빈도와 지속 시간을 편집하십시오. 톤 버스트 자극에는 100-4000Hz의 범위가 사용되었지만 성인 닭의 행동 청력 범위는 2-9000Hz35입니다.
- 최상의 분해능 데이터를 위해 샘플링 속도를 허용되는 가장 높은 값(일반적으로 40kHz)으로 설정합니다.
주: IHS를 포함한 일부 시스템은 제한된 수의 샘플링 포인트를 사용하며 기록 창의 길이를 변경합니다. 40kHz(25μs 주기) 샘플링 레이트는 12ms 레코딩 윈도우에 대해서만 허용할 수 있으므로, 톤 버스트 ABR을 캡처하기 위해, 20kHz 샘플링 레이트(50μs 주기)가 24ms 레코딩 윈도우를 허용하기 위해 사용되었다. 클릭과 톤 버스트 ABR을 직접 비교하는 경우 샘플링 속도를 일정하게 유지하여 동일한 해상도를 유지하십시오. - 자극 분극을 교대로 설정하십시오. 이것은 ABR 녹음에서 달팽이관 마이크로포닉의 시각화를 제거하기 위해 수행됩니다. 달팽이관 마이크로포닉을 시각화하려면 극성 자극을 위해 희귀 또는 응축을 사용하십시오.
참고: 자극을 선택할 때 많은 설정을 변경할 수 있습니다. 제공된 게인 및 필터 설정은 다른 장비 설정에 적합하지 않을 수 있습니다. 대부분의 ABR 기계의 공장 기본값은 부화 닭고기에 기록하도록 설정되어 있지 않습니다. - 512개의 스윕을 기록하는 경우 두 개의 개별 테스트를 결합하여 1024 스윕 평균을 생성합니다.
- 클릭 또는 톤 버스트 자극의 경우, 초임계 강도에서 ABR을 획득하십시오.
- 유발된 응답을 더 이상 식별할 수 없을 때까지 더 낮은 강도와 낮은 강도로 계속 기록하십시오.
- ABR 역치를 검출 가능한 유발 반응을 유도하는 가장 낮은 자극 강도로 정의합니다. 자극 강도를 5dBSPL의 단계별로 낮추어 검출 가능한 피크를 이끌어내는 가장 낮은 자극 강도를 찾으십시오.
7. 안락사와 실험 종료
- ABR이 획득되면 과다 복용 (0.1 mL)의 안락사 용액 (펜토바르비탈 나트륨 390 mg / mL 페니토인 나트륨 50 mg / mL)을 준비하십시오.
- 발가락 꼬집음을 사용하여 반사가 없음을 확인한 후 안락사 용액을 유방 근육에 5mm 깊이의 29-G 바늘로 주사하십시오. 주사 기술은 마취 주사와 동일하다.
참고 : 동물은 몇 분 후에 만료됩니다. 움직임이 감지되지 않을 때까지 동물을 조작하거나 무력화시키지 마십시오. 대안적인 안락사 기술은 날개 아래의 상완 정맥에 정맥 주사를 수행하는 것입니다. - 동물이 반사적이지 않고 호흡과 심장 박동이 멈추 자마자 날카로운 가위 또는 가위로 빠르게 목을 졸라매십시오.
- 가열 패드, 직장 프로브 및 염화은 전극을 70 % 이소프로필 알코올 와이프로 청소하십시오.
- 획득한 모든 추적이 저장되었는지 확인합니다. 추가 분석을 위해 파일을 메모장에서 보거나 스프레드시트로 가져올 수 있는 .txt 파일로 내보냅니다.
결과
부화 병아리를위한 대표적인 ABR 녹음
다음의 대표 및 인구 결과는 43 마리의 동물로 만들어진 ABR 기록에서 나온 것입니다. 초임계 클릭 자극 (75 dBSPL)에 대한 응답으로, 모든 부화에서 세 개의 양성 - 진행 피크가 일관되게 관찰되었습니다. 이 피크는 자극 발병 후 6ms 이내에 발생했습니다. 드물게, 네 번째 피크도 ~6ms에서 관찰되었다. 조류에서 ABR 피크의 확인은 동물마다 다양하지만 (토론 참조), 피크는 로마 숫자 Waves I-IV로 분류되고 확인되었습니다. 라벨링된 피크를 갖는 대표적인 ABR 파형이 도 1A (상단 트레이스)에 도시되어 있다. 도 1B는 대표적인 트레이스에 표지된 Waves I 및 III에 대한 레이턴시-강도 함수를 도시한다. 웨이브 I 피크 레이턴시는 자극 강도의 20dB 감소마다 ~0.3ms씩 증가하였다. 평균적으로 Wave I-III는 75dBSPL에서 각각 1.50ms(±0.02ms), 3.00ms(±0.06ms) 및 4.13ms(±0.09ms)에서 발생했습니다(그림 1C). 웨이브 I과 웨이브 III는 항상 단수 피크로 제시됩니다. 때때로 Wave II의 경우 2.5-3.2ms 사이에 여러 개의 작은 봉우리가 보였습니다. 각 피크는 상응하는 트로프를 가졌고, 모든 피크 중 가장 큰 Wave I의 피크 대 트로프 진폭은 평균 7μV이고 75dB SPL에서 11μV의 최대 진폭에 접근했다.
가장 큰 진폭 이외에, 병아리 ABR의 웨이브 I은 동물들 사이에서 피크 레이턴시에서 가장 적은 가변성을 나타냈다. 따라서, 이 피크는 청력 역치 감도를 추정하는데 사용되었다. ABR 임계값은 식별 가능하고 반복 가능한 파형 피크를 유도하는 가장 낮은 자극 강도로 정의되었습니다. 이것은 실험자에 의해 주관적으로 결정되었고, 역치 합의에 대해 두 번째 실험자에 의해 교차 확인되었다. 피크는 클릭 자극을 사용할 때 더 잘 정의되고 식별하기 쉬웠지만, 톤 버스트는 자극 주파수와 그 파라미터에 따라 변하는 정의되고 식별 가능한 피크를 생성했습니다 (그림 1D, n = 4 병아리). 클릭이 유발된 ABR 임계값은 1000Hz를 제외한 톤 버스트 유발 임계값보다 낮았습니다. 임계값은 클릭 자극에 대해 10-30dBSPL 사이에서 다양했습니다. 식별 가능한 피크 >30 dBSPL을 보여주지 않은 클릭으로 유발 된 ABR은 종종 동물의 움직임으로 인해 외이도에서 사경이 빠져 나간 결과였습니다.
체온 감소는 ABR 대기 시간을 증가시킵니다.
신경 활동의 속도-파형 진폭(즉, 레이턴시)의 피크 발생에 의해 측정되는 바와 같이-은 더 낮은 체온(36,37)에서 감소하는 것으로 알려져 있다. 이러한 현상은 75 dBSPL 클릭 자극을 사용하는 닭고기 ABRs를 부화시키면서 관찰되었다. 대표적인 트레이스가 도 2A에 도시되어 있다. 체온이 39°C에서 감소함에 따라, ABR 피크의 잠복기는 동일한 자극 강도 수준에도 불구하고 시간 후반에 발생하였다. 도 2B는 대표적인 트레이스에 대한 더 낮은 체온의 함수로서 Waves I 및 III의 레이턴시를 보여준다. 낮은 체온과 Wave I 피크 레이턴시의 발생 사이에 강한 상관관계(R2=0.89)가 있었다(도 2C, n=5마리의 병아리). 이러한 결과는 ABR 기록 중에 거의 정상적인 체온을 유지할 필요성을 보여줍니다. 거의 정상에 가까운 체온이 유지되지 않으면 ABR의 대기 시간 강도 함수 및 진폭 측정은 매우 가변적이며 종종 부정확합니다.
초기 부화의 대기 시간 및 진폭 차이
연구에 따르면 병아리의 청력 시작과 관련된 신경 활동은 늦은 배아연령 8에서 거의 성숙 단계에 있습니다. 그러나, 매우 초기 부화의 서브세트(<3시간 후 해치)의 경우, 우리는 75dB SPL 클릭 자극 또는 유발된 전위에 대한 응답으로 ABR 파형(n=4)의 피크 레이턴시 시프트를 관찰하였다(n=2 병아리). 2개의 어린 해칭에서는 톤 버스트 ABR을 도출할 수 없었고, 클릭 임계값은 50dBSPL만큼 높아졌습니다. 이것은 동물의 외이도 / 중이관에 여전히 유체가있는 전도성 문제 또는 저개발 신경 구성 요소 때문일 수 있습니다. 포유류 연구는 신생아38,39에서 50dB의 역치 이동을보고했습니다. 여기에 사용 된 대표적인 동물은 >3 시간 된 동물이었으며, 깃털이 건조되는 데 걸리는 시간과 일치했습니다. 그림 3A는 젊음(P1, <3시간 늙음)과 오래된 부화(P2)에서 기록된 ABR을 보여준다. 분석을 위해, 3 개의 어린 부화만이 세 개의 ABR 피크를 모두 제시했습니다. 피크 파형 레이턴시는 상당히 길었고, 파형 진폭은 이전 해칭과 비교했을 때 약간 감소하였다(각각 도 3B-C).
참조 전극 배치 및 두 채널 ABR 레코딩
그림 4에서, 기준 전극 배치는 2개의 상이한 위치들 사이에서 수정되었지만, 여전히 비교가능한 ABR 기록들을 가져왔다. 동일한 동물에서 75dBSPL 클릭 트레이스와 두 개의 기준 전극 배치를 비교한 결과, 피크 투 트로프 파형 진폭과 피크 파형 레이턴시에서 최소한의 차이가 나타났다(그림 4A). 유양돌기 배치는 방법론적으로 유양돌기 또는 피나 상에 기준 전극을 배치하는 포유동물 ABR 실험과 유사하였다. 기준 전극에 목 배치를 사용하는 것은 양쪽 귀에서 조작이나 수술을 수행하는 경우 유익합니다. 흥미롭게도, 유양돌기 배치에 대한 Wave II 피크 진폭(적색 트레이스)은 목 배치에 대한 Wave II 피크 후 1 ms 후에 발생하였다(검정 트레이스). 이 시간차는 전극 배치에 대한 ABR 신경 생성 부위(들)를 반영할 가능성이 높다.
두 채널 설정을 사용하여 하나의 활성 기록 전극(헤드 배치의 상단)과 두 개의 기준 전극(마스토이드 배치)을 사용하여 왼쪽 귀와 오른쪽 귀 모두에 대한 ABR을 획득했습니다(그림 4B). 두 귀 사이의 반응은 비슷했으며 이어폰 위치 지정으로 인해 피크 진폭이 약간 변경되었을 가능성이 큽니다. 왼쪽 귀와 오른쪽 귀의 대기 시간은 부화 닭에서 귀와 뇌 줄기 반구의 똑같이 건강한 기능을 지원했습니다. 두 채널 레코딩 몽타주는 바이노럴 ABR에도 사용할 수 있지만 이러한 레코딩에 필요한 추가 고려 사항이 있습니다.

그림 1: 부화 병아리를 클릭 및 톤으로 불러일으킨 자극에 대한 대표적인 기록. (A) 부화 병아리(P2)의 대표적인 ABR 기록은 다양한 자극 강도 수준의 함수입니다. 마이크로볼트(μV)에서 서너 개의 포지티브 피크는 자극 개시 후 6ms(시간 = 0ms) 이내에 확인될 수 있다. 파도는 로마 숫자를 사용하여 식별되었습니다. 피크 투 트로프 진폭은 낮은 자극 강도 수준에서 감소합니다. (B) (A)에 나타낸 대표적인 트레이스에 대한 웨이브 I 및 III의 레이턴시-강도 함수. Wave II가 전형적으로 강도 <45 dBSPL에서 관찰되지 않았기 때문에 이들 피크들만이 분석되었다. (C) 클릭을 유발한 ABR 피크 파형의 레이턴시(n=43병아리). 오차 막대는 평균(SEM)의 표준 오차를 나타낸다. (D) 세 가지 주파수에서 네 마리의 부화 병아리에 대한 평균 톤 유발 ABR (검은 색 흔적). 적색 트레이스 = 평균(SEM) 자극의 표준 오차 = 75 dBSPL. 이 수치와 그 이후의 수치에서 오류 막대는 SEM을 나타내고 오른쪽 귀는 자극 귀였습니다. (양쪽 귀가 자극된 도 4B의 예외). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: ABR 기록에 대한 체온의 영향. (A) 체온의 함수로서 부화 병아리(P2)로부터의 대표적인 ABR 기록. 낮은 체온의 경우, 피크 파형 레이턴시는 증가한 반면, 피크 투 트로프 진폭은 상대적으로 변하지 않았다. (B) (A)에 나타낸 대표적인 트레이스에 대한 웨이브 I 및 III의 레이턴시-온도 함수. (c) 5마리의 병아리에 대한 잠복기와 온도 변화 사이의 관계를 보여주는 집단 데이터(p<0.01,R2=0.89). Waves II 및 III에 대해서도 유사한 경향이 관찰되었다(데이터는 나타내지 않음). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
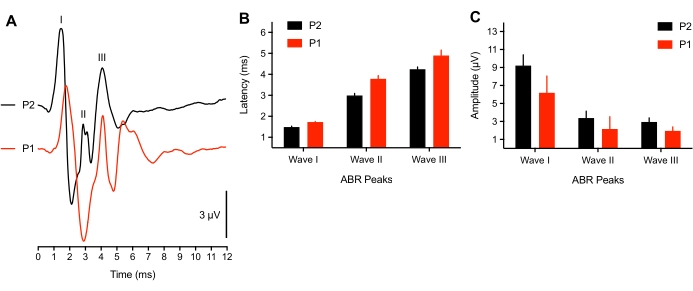
그림 3: ABR 기록에 대한 연령 관련 차이. (A) P2(검정 추적) 및 P1(<3시간 부화 후 빨간색 추적)에서 대표적인 부화 병아리의 대표적인 ABR 기록(겹쳐짐). (B) 나이의 함수로서 웨이브 I, II 및 III에 대한 피크 파형 레이턴시. Waves I-III에 대한 레이턴시는 연령에 따라 유의하게 달랐다(P < 0.05, n=6마리의 병아리). (C) 나이의 함수로서 Waves I, II 및 III의 피크 투 트로프 파형 진폭. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
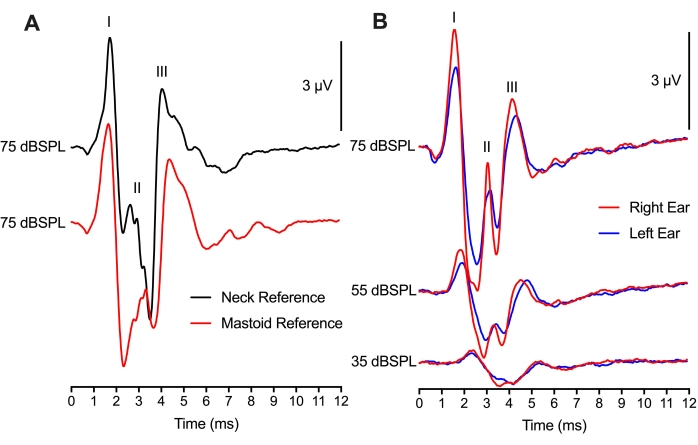
그림 4: 전극 배치 및 2채널 ABR 기록: (A) 목에 배치된 기준 전극(검은색 트레이스) 또는 유양돌기(적색 트레이스)와 동일한 부화 병아리(P2)로부터의 대표적인 ABR 기록(중첩됨). 활성 전극은 두 전극 기록 몽타주 모두에 대해 두개골의 중간선에 배치되었다. Waves I과 III의 레이턴시와 Waves I과 III의 진폭은 두 조건 모두에서 거의 동일합니다. Wave II의 레이턴시는 더 빠르며, 목 조직에 배치된 전극의 진폭은 더 큽니다. (B) 좌우 귀를 순차적으로 자극하면서 두 채널 녹화. 동일한 부화 병아리 (P2)로부터의 대표적인 ABR 기록 (중첩 된)은 세 가지 다른 강도 수준에서 왼쪽 귀 (파란색 흔적) 및 오른쪽 귀 (적색 트레이스)의 유양돌기에 배치 된 기준 전극과 함께. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표: 치킨 부화 교정 테이블. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
토론
조류의 청각 뇌간은 잘 연구되어 있으며, 많은 구조는 포유류의 청각 경로와 유사합니다. 청각 신경은 두 개의 일차 중추 핵, 달팽이관 핵 magnocellularis (NM)와 angularis (NA)에 흥분성 입력을 제공합니다. NM은 청각 대상인 핵 층류(NL)7에 양측으로 흥분 투영을 보낸다. NL은 핵에 mesencephalicus lateralis, pars dorsalis (MLd) 40,41에 투사한다. NL은 또한 NM, NA 및 NL42에 대한 피드백 억제를 제공하는 우수한 올리바리 핵(SON)에 투사한다. 이러한 낮은 청각 뇌간극 마이크로회로는 그것이 서브서브하는 기능, 사운드 국소화 및 바이노럴 청력(33)을 위해 정교하게 보존된다. 새의 상부 청각 뇌간 영역은 또한 포유류의 측면 렘니쿠스와 유사한 핵을 가지고 있으며 중뇌의 열등한 콜리큘러스를 가지고 있습니다. 이러한 유사성을 감안할 때, 청각 중뇌까지의 조류 ABR의 구성은 모든 척추 동물에 걸쳐 비교할 수 있습니다.
여러 조류 종은 자극 발병 후 6ms 이내에 세 개의 긍정적 인 피크를 보이지만 ABR 피크와 중앙 청각 구조의 상관 관계는 약간의 변동성이 있습니다. 파동 I은 말초 기저 유두와 청각 신경으로부터의 첫 번째 신경 반응이라고 합리적으로 가정할 수 있으며, 개인들 사이에서 거의 변동성을 나타내지 않는다(도 1C). 후속 웨이브 식별은 덜 확실하며 종마다 다를 수 있습니다. Kuokkanen et al.17은 최근에 헛간 올빼미의 ABR의 Wave III가 NL에 의해 생성된다고 결정했습니다. 따라서, Wave II가 달팽이관 핵(20)의 NM 및 NA로부터 유래한다고 주장하는 것이 합리적이다. 그러나, 올빼미 Wave III는 자극 개시 후 3 ms 후에 생성된 양성 피크로 정의되었다. 이것은 부화 닭고기 ABR에 정의 된 웨이브 II에 해당합니다. 헛간 올빼미 ABR에서는 파도 I과 II가 결합되었습니다.
부화 닭은 보통 6ms 이내에 세 개의 피크를 나타내지만, 때때로 네 번째 피크가 관찰되었다(예를 들어, 도 1A 참조). 인구 데이터, 더 큰 표본 크기 및 추가 실험 패러다임은 네 번째 파동을 지원하기 위해 필요할 것이며, 경우에 따라 다섯 가지 웨이브 치킨 ABR을 지원해야합니다. 가장 일관된 발견은 여기에 표시된 세 가지 피크 표현이었습니다.
ABR은 신경 동시성의 척도로 정의되기 때문에, 청각 경로의 주요 핵은 ABR에서 각각의 양성 - 진행 피크를 나타낼 수 있습니다. 청각 신경에서 NM / NA로 전달 된 다음 NL로 전달되는 신호는 부화 닭 ABR에서 Waves I, II 및 III을 각각 정의 할 수 있습니다. 또한, 닭 ABR의 나중에 발생하는 네 번째 피크는 상부 뇌간 또는 중뇌 청각 구조를 나타낼 수 있습니다. 조류 ABR의 특성화는 또한 조숙 조류와 altricial 조류의 차이를 고려해야합니다. 청각 반응의 성숙은 종마다 다를 수 있으며 포식자 행동 및 / 또는 음성 학습과 같은 다른 중요한 특성의 영향을받습니다4. 그럼에도 불구하고, 기술된 방법 및 기술은 다양한 조류 및 척추동물 종에 용이하게 적용된다.
동물의 체온 유지의 중요성은 그림 2에 예시되어 있다. 내부 체온이 감소함에 따라 ABR 반응의 대기 시간이 동일한 자극 강도 수준에 대해 증가했습니다. 이것은 체온이 32 °C36,37 이하로 떨어질 때 더 두드러집니다. ABR에서의 대략 1ms의 레이턴시 증가는 닭고기(23)에서 이전에 보고된 것보다 적다. 그러나 Katayama23은 냉각되고 4 시간 동안 따뜻해진 12 일 된 부화를 사용했습니다. 도 2의 데이터는 20분에 걸쳐 냉각 과정 동안 기록되었다. 최상의 품질과 가장 일관된 기록을 얻으려면 동물의 체온을 유지해야하며 모든 기록은 동물간에 동일한 생리적 온도에서 수행되어야합니다.
나이가 ABR에 미치는 영향은 약간이지만 고려해야 할 중요한 사항입니다. ABR의 Waves I과 II의 대기 시간만 크게 달랐지만, 이는 그림 3에서 3개의 어린 부화만 사용되었기 때문입니다. 나머지 세 개는 세 개의 식별 가능한 ABR 피크를 가지고 있지 않았다. ABR 진폭 및 임계값 이동은 큰 표본 크기를 사용하거나 주파수별 ABR을 비교하는 경우에도 분명할 수 있습니다. 이 연령 관련 효과는 닭의 중이의 액체에 의해 발생할 수 있습니다. 이러한 전도성 변화는 인간 및 다른 포유동물 모델38,39 둘 다에 대한 ABR 역치의 현저한 증가로 이어진다.
두 개의 서로 다른 기록 몽타주를 사용하여 유사한 반응이 관찰되었다(그림 4A). 가장 일반적인 몽타주가 자극을받는 귀 뒤에 기준 전극을 배치하는 반면, 목 조직에 기준 전극을 갖는 것은 ABR을 수반하는 외과 적 개입이있는 경우 유용 할 수 있습니다. 그러나, 두 채널 ABR 기록이 사용되는 경우, 기준 전극은 개별적으로 대칭적으로 배치되어야 하며, 이는 기준 전극을 목에 배치하는 경우 어렵다. 기준 전극의 유양돌기 위치는 가능한 한 많은 기록 측면을 표준화하는 것이 좋습니다. 두 채널 ABR 녹음은 추가 준비가 거의 필요하지 않은 효과적인 도구이며 귀간에 비슷한 반응을 일으 킵니다. 경미한 진폭 차이는 이어폰의 위치 때문일 가능성이 큽니다. 두 채널 레코딩을 통해 실험적으로 조작된 귀 또는 뇌 반구와 대조군을 쉽게 비교할 수 있습니다. 이 설정은 바이노럴 ABR을 테스트하는 데도 필요합니다. 치킨 ABR을 이용한 미래의 실험은 기록 구성 및 몽타주(34)에 관한 이전 문헌을 참조할 수 있다.
이 방법론에는 몇 가지 제한 사항이 있습니다. 단계 5.1에서 언급한 바와 같이, 불량한 투기 배치는 응답에서 40dBSPL 시프트로 이어질 수 있다. 이로 인해 조작되거나 수정 된 동물에 대한 잘못된 해석이 발생할 수 있습니다. 다음 예방 조치가 권장됩니다: 조작된 모델 또는 돌연변이 모델의 ABR을 획득하기 전에 대량의 제어 데이터 샘플을 획득하십시오. 기록 사이에 자극 강도를 20dBSPL 이상 감소시키지 마십시오. 진폭 또는 대기 시간이 예상보다 많이 이동하면 동물과 검경 위치를 확인하십시오. 변화를 관찰하기 위해 ABR 자극을 반복하십시오. 검경이 이동했다면 이전 테스트를 다시 획득하십시오. 또 다른 한계는 ABR의 교정입니다. 음압 레벨을 기록하기위한 적절한 교정이 없으면 동물에게 제시되는 강도는 알 수 없습니다. 사운드 출력을 측정할 때는 실험 녹음과 동일한 검경을 사용하고 동물의 외이도 길이(~5mm)에 근접한 캐비티 내부의 작은 마이크를 사용하십시오. 보정은 주파수에 따라 다르므로 실험에 사용된 것과 동일한 톤 주파수를 측정합니다. 하드웨어 및 소프트웨어 시스템 모두에 대한 설명서에는 교정에 대한 지침이 함께 제공될 수 있습니다. 또한 선형 위상 및 최소 위상 필터와 같은 추가적인 필터가 있으며, 이는 클릭 및 톤 버스트 ABR(43)을 향상시킬 수 있다. 이들 필터는 본 연구에서 사용되지 않았다. 톤 버스트 스펙트럼 엔벨로프의 상승 및 하강 시간이 주파수의 함수로서 변경되거나 클릭 자극의 상승 및 하강 시간을 변경하는 것과 같은 추가적인 고려사항도 조사되지 않았다. 이는 신뢰할 수 있고 일관된 ABR을 획득 할 수있게되면 좋은 미래의 조사입니다.
부화 닭을 다른 조류 모델과 비교하는 것은 유망합니다. Budgerigars와 동부 screech-owls는 또한 ABR13,22의 처음 6ms 이내에 세 개의 양의 마이크로 볼트 피크를 표시합니다. 딱따구리의 다른 종에서는 세 개의 봉우리도 보이지만 대기 시간은 나중에 나타납니다. 또한 딱따구리에서 가장 좋은 주파수 감도의 범위는 1500Hz에서 4000Hz 사이이며, 이는 1000Hz에서 닭의 최고 임계 값보다 다소 높습니다. 성인 닭에서 가장 좋은 감도는 2000Hz35이므로 닭 부화기가 성인으로 발전함에 따라 고주파의 청력이 향상 될 수 있습니다. 그 발달은 동물의 알트리컬 또는 조숙 한 발달을 고려하여 조류 종마다 다를 것입니다4.
여기에 설명 된 실험 방법은 청각 반응 및 임계 값의 손상 또는 변화뿐만 아니라 배아 발달의 여러 단계에서의 연구를 초래하는 요인을 결정하는 데 도움이 될 수 있습니다. 유전자 조작, 노화 및 소음 노출은 동물 및 기타 조류 모델 24,25,44,45에서 모두 알려진 조작입니다. 이러한 방법은 인-오보 전기천공과 같은 기술이 청각 뇌간(12,46)의 한쪽 면에서 대위적, 시간적으로 조절되는 단백질의 발현을 허용하도록 이제 닭 모델로 확장되어야 한다. 이를 통해 두 채널 기록 패러다임을 사용하여 유전적으로 조작된 귀에서 대측 제어 귀까지 ABR을 직접 비교할 수 있습니다.
전반적으로, 부화 닭의 ABR은 인간 및 기타 포유류 모델의 청력 기능 측정과 거의 동일한 유용한 연구 방법입니다. 또한 비침습적, 생체내 방법론이다. 몇 밀리미터의 마취 주입 및 피하 전극 배치 외에도 다른 물리적 조작이 필요하지 않습니다. 해칭은 이론적으로 적절한 환경에 보관하면 며칠 또는 몇 주 동안 발달 시간 동안 여러 번 테스트 할 수 있습니다. 이 프로토콜은 부화 닭 ABR에 필요한 단계와 기록 매개 변수를 배치 할뿐만 아니라 청각 뇌간 기능에 대한 추가 테스트를 알릴 수있는 조류 ABR의 특성을 제안합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 NIH/NIDCD R01 DC017167에서 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 1/8 inch B&K Microphone | Brüel & Kjær | 4138 | Type 4138-A-015 also works |
| Auditory Evoked Potential Universal Smart Box | Intelligent Hearing Systems | M011110 | |
| Custom Sound Isolation Chamber | GK Soundbooth Inc | N/A | Custom built |
| DC Power Supply | CSI/Speco | PSV-5 | |
| ER3 Insert Earphone | Intelligent Hearing Systems | M015302 | Used as sound transducer |
| Euthasol | Virbac | 710101 | Controlled Substance; euthanasia solution |
| Insulin Syringe (29 G) | Comfort Point | 26028 | |
| Ketamine | Covetrus | 11695-0703-1 | Controlled Substance |
| Power Supply | Powervar | 93051-55R | |
| Rectal Probe | YSI | 401 (10-09010) | Any 400 series probe will work with the YSI temperatuer monitor |
| Subdermal needles | Rhythmlink | RLSND107-1.5 | |
| Temperature Monitor | YSI | 73ATA 7651 | Works with any 400 series rectal probe |
| Xylazine | Anased | 59399-110-20 | Used with ketamine and water for anesthetic |
참고문헌
- Wever, E. G., Bray, C. W. Action currents in the auditory nerve in response to acoustical stimulation. Proceedings of the National Academy of Sciences of the United States of America. 16 (5), 344-350 (1930).
- Jewett, D. L., Williston, J. S. Auditory-evoked far fields averaged from the scalp of humans. Brain. 94 (4), 681-696 (1971).
- Corwin, J. T., Bullock, T. H., Schweitzer, J. The auditory brain stem response in five vertebrate classes. Electroencephalography and Clinical Neurophysiology. 54 (6), 629-641 (1982).
- Carey, C. . Avian Growth and Development. Evolution within the Altricial Precocial Spectrum. , (1998).
- Kraemer, A., Baxter, C., Hendrix, A., Carr, C. E. Development of auditory sensitivity in the barn owl. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 203 (10), 843-853 (2017).
- Rebillard, G., Rubel, E. W. Electrophysiological study of the maturation of auditory responses from the inner ear of the chick. Brain Research. 229 (1), 15-23 (1981).
- Parks, T. N., Rubel, E. W. Organization and development of brain stem auditory nuclei of the chicken: organization of projections from n. magnocellularis to n. laminaris. Journal of Comparative Neurology. 164 (4), 435-448 (1975).
- Hong, H., Rollman, L., Feinstein, B., Sanchez, J. T. Developmental profile of ion channel specializations in the avian nucleus magnocellularis. Frontiers in Cellular Neuroscience. 10, 80 (2016).
- Leao, R. M. The ion channels and synapses responsible for the physiological diversity of mammalian lower brainstem auditory neurons. Hearing Research. 376, 33-46 (2019).
- Oline, S. N., Ashida, G., Burger, R. M. Tonotopic optimization for temporal processing in the cochlear nucleus. Journal of Neuroscience. 36 (32), 8500-8515 (2016).
- Kopp-Scheinpflug, C. Your genes decide what you are listening to. Channels. 11 (5), 355-356 (2017).
- Sid, H., Schusser, B. Applications of gene editing in chickens: A new era is on the horizon. Frontiers in Genetics. 9, 456 (2018).
- Brittan-Powell, E. F., Dooling, R. J., Gleich, O. Auditory brainstem responses in adult budgerigars (Melopsittacus undulatus). The Journal of the Acoustical Society of America. 112 (3), 999-1008 (2002).
- Lohr, B., Brittan-Powell, E. F., Dooling, R. J. Auditory brainstem responses and auditory thresholds in woodpeckers. The Journal of the Acoustical Society of America. 133 (1), 337-342 (2013).
- Counter, S. A. Brain-stem evoked potentials and noise effects in seagulls. Comparative Biochemistry and Physiology. A, Comparative Physiology. 81 (4), 837-845 (1985).
- Crowell, S. E., et al. A comparison of auditory brainstem responses across diving bird species. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 201 (8), 803-815 (2015).
- Noirot, I. C., Brittan-Powell, E. F., Dooling, R. J. Masked auditory thresholds in three species of birds, as measured by the auditory brainstem response (L). Journal of the Acoustical Society of America. 129 (6), 3445-3448 (2011).
- McGee, J., et al. Auditory performance in bald eagles and red-tailed hawks: a comparative study of hearing in diurnal raptors. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 205 (6), 793-811 (2019).
- Brittan-Powell, E. F., Dooling, R. J., Ryals, B., Gleich, O. Electrophysiological and morphological development of the inner ear in Belgian Waterslager canaries. Hearing Research. 269 (1-2), 56-69 (2010).
- Kuokkanen, P. T., Kraemer, A., Kempter, R., Koppl, C., Carr, C. E. Auditory brainstem response wave iii is correlated with extracellular field potentials from nucleus laminaris of the barn owl. Acta Acustica United with Acustica. The Journal of the European Acoustics Association (EEIG). 104 (5), 874-877 (2018).
- Beatini, J. R., Proudfoot, G. A., Gall, M. D. Frequency sensitivity in Northern saw-whet owls (Aegolius acadicus). Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 204 (2), 145-154 (2018).
- Brittan-Powell, E. F., Lohr, B., Hahn, D. C., Dooling, R. J. Auditory brainstem responses in the Eastern Screech Owl: an estimate of auditory thresholds. The Journal of the Acoustical Society of America. 118 (1), 314-321 (2005).
- Katayama, A. Postnatal development of auditory function in the chicken revealed by auditory brainstem responses (ABRs). Electroencephalography and Clinical Neurophysiology. 62 (5), 388-398 (1985).
- Durham, D., Park, D. L., Girod, D. A. Breed differences in cochlear integrity in adult, commercially raised chickens. Hearing Research. 166 (1-2), 82-95 (2002).
- Kaiser, C. L., Girod, D. A., Durham, D. Breed-dependent susceptibility to acute sound exposure in young chickens. Hearing Research. 203 (1-2), 101-111 (2005).
- Hamdy, A. M., Vander Hel, W., Henken, A. M., Galal, A. G., Abd-Elmoty, A. K. Effects of air humidity during incubation and age after hatch on heat tolerance of neonatal male and female chicks. Poultry Science. 70 (7), 1499-1506 (1991).
- Bruzual, J. J., Peak, S. D., Brake, J., Peebles, E. D. Effects of relative humidity during the last five days of incubation and brooding temperature on performance of broiler chicks from young broiler breeders. Poultry Science. 79 (10), 1385-1391 (2000).
- vander Pol, C. W., van Roovert-Reijrink, I. A. M., Maatjens, C. M., vanden Brand, H., Molenaar, R. Effect of relative humidity during incubation at a set eggshell temperature and brooding temperature posthatch on embryonic mortality and chick quality. Poultry Science. 92 (8), 2145-2155 (2013).
- Buhr, R. J. Incubation relative humidity effects on allantoic fluid volume and hatchability. Poultry Science. 74 (5), 874-884 (1995).
- Galli, R., et al. Sexing of chicken eggs by fluorescence and Raman spectroscopy through the shell membrane. PLoS One. 13 (2), 0192554 (2018).
- Otsuka, M., Miyashita, O., Shibata, M., Sato, F., Naito, M. A novel method for sexing day-old chicks using endoscope system. Poultry Science. 95 (11), 2685-2689 (2016).
- Kaiser, A. The ontogeny of homeothermic regulation in post-hatching chicks: its influence on the development of hearing. Comparative Biochemistry and Physiology. A, Comparative Physiology. 103 (1), 105-111 (1992).
- Kuba, H., Yamada, R., Ohmori, H. Evaluation of the limiting acuity of coincidence detection in nucleus laminaris of the chicken. The Journal of Physiology. 552, 611-620 (2003).
- Shaheen, L. A., Valero, M. D., Liberman, M. C. Towards a diagnosis of cochlear neuropathy with envelope following responses. Journal of the Association for Research in Otolaryngology. 16 (6), 727-745 (2015).
- Hill, E. M., Koay, G., Heffner, R. S., Heffner, H. E. Audiogram of the chicken (Gallus gallus domesticus) from 2 Hz to 9 kHz. Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 200 (10), 863-870 (2014).
- Rossi, G. T., Britt, R. H. Effects of hypothermia on the cat brainstem auditory evoked response. Electroencephalography and Clinical Neurophysiology. 57 (2), 143-155 (1984).
- Doyle, W. J., Fria, T. J. The effects of hypothermia on the latencies of the auditory brainstem response (ABR) in the rhesus monkey. Electroencephalography and Clinical Neurophysiology. 60 (3), 258-266 (1985).
- Guan, X., Gan, R. Z. Effect of middle ear fluid on sound transmission and auditory brainstem response in guinea pigs. Hearing Research. 277 (1-2), 96-106 (2011).
- Ravicz, M. E., Rosowski, J. J., Merchant, S. N. Mechanisms of hearing loss resulting from middle-ear fluid. Hearing Research. 195 (1-2), 103-130 (2004).
- Wang, Y., Zorio, D. A. R., Karten, H. J. Heterogeneous organization and connectivity of the chicken auditory thalamus (Gallus gallus). Journal of Comparative Neurology. 525 (14), 3044-3071 (2017).
- Wang, Y., Karten, H. J. Three subdivisions of the auditory midbrain in chicks (Gallus gallus) identified by their afferent and commissural projections. Journal of Comparative Neurology. 518 (8), 1199-1219 (2010).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. Journal of Neuroscience. 30 (36), 12075-12083 (2010).
- Beutelmann, R., Laumen, G., Tollin, D., Klump, G. M. Amplitude and phase equalization of stimuli for click evoked auditory brainstem responses. The Journal of the Acoustical Society of America. 137 (1), 71-77 (2015).
- Liberman, M. C. Noise-induced and age-related hearing loss: new perspectives and potential therapies. F1000Research. 6, 927 (2017).
- Efrati, A., Gutfreund, Y. Early life exposure to noise alters the representation of auditory localization cues in the auditory space map of the barn owl. Journal of Neurophysiology. 105 (5), 2522-2535 (2011).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments: JoVE. (124), e55628 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유