Method Article
鸡幼崽听觉脑干反应的评价
摘要
我们使用标准的听觉脑干反应(ABR)技术,并将其应用于孵化鸡,这是一种用于听觉功能的早熟鸟类模型。该协议详细概述了动物准备和ABR获取技术,以及可以转化为其他鸟类或啮齿动物模型的步骤。
摘要
听觉脑干反应(ABR)是临床听力学,非人类动物和人类研究中的宝贵测定。尽管ABR在测量听觉神经同步性和估计其他脊椎动物模型系统中的听力敏感性方面被广泛使用,但在近四十年中还没有报道在鸡中记录ABR的方法。鸡提供了一个强大的动物研究模型,因为它们的听觉系统在晚期胚胎和早期孵化阶段接近功能成熟。我们已经演示了用于在鸡幼鸡中使用皮下针电极阵列引发单通道或双通道ABR记录的方法。无论电极记录配置如何(即蒙太奇),ABR记录在超阈值点击激励的前6ms内包括3-4个正向峰值波形。在高强度水平下,峰至谷波形幅度范围为2-11 μV,正峰值表现出预期的延迟强度函数(即,延迟增加与强度降低的函数关系)。标准化的耳机位置对于最佳录音至关重要,因为松弛的皮肤会阻塞耳道,而动物运动可以移开刺激传感器。随着动物体温的降低,峰值振幅更小,潜伏期更长,支持维持生理体温的需要。对于幼雏(孵化后<3 h),阈值升高约5 dB,峰值潜伏期增加~1-2 ms,峰至谷幅度降低~1 μV。这表明存在潜在的导电相关问题(即中耳腔积液),应考虑用于幼雏。总体而言,这里概述的ABR方法允许准确和可重复地记录鸡幼崽的 体内 听觉功能,可以应用于不同的发育阶段。这些发现很容易与人类和哺乳动物的听力损失,衰老或其他听觉相关操作模型进行比较。
引言
对声音刺激的诱发神经反应的研究可以追溯到半个多世纪1。听觉脑干反应(ABR)是一种诱发电位,几十年来一直被用作非人类动物和人类听觉功能的衡量标准。人类 ABR 呈现五到七个波形峰,通常用罗马数字 (I-VII)2 标记。这些峰值根据其延迟(以毫秒为单位的发生时间)和振幅(以微伏为单位的峰谷大小)来分析神经反应。ABR有助于评估听觉神经的功能和完整性以及脑干和听力阈值敏感性。听觉系统中的缺陷导致ABR潜伏期和振幅的缺失,减少,延长或异常。值得注意的是,这些参数在人类和其他动物中几乎相同,使其成为脊椎动物模型3中听觉功能的一致客观测试。
一个这样的模型系统是鸡,由于各种原因,它特别有用。鸟类可分为无节性或早熟性 4.雌雄异鸟在感官发育的同时孵化;例如,谷仓猫头鹰直到孵化后四天才显示出一致的ABR5。早熟的动物,如鸡孵化,具有近乎成熟的感官。听力的发作发生在胚胎发育中,使得在孵化前几天(胚胎第21天),听觉系统接近功能成熟6,7,8。无菌鸟类和大多数哺乳动物模型容易受到影响发育的外在因素的影响,并且需要畜牧业,直到听力成熟。鸡的ABR可以在孵化的同一天进行,因为不需要喂养或丰富的环境。
胚胎鸡一直是生理学和发育的经过充分研究的模型,特别是在听觉脑干中。具体结构包括鸡耳蜗核,分为木兰细胞核(NM)和核无柄细胞核(NA),以及内侧上橄榄核的鸟类相关性,称为核层(NL)6,7。ABR是专注于前脑和皮层水平之前的中枢听觉功能的理想选择。体内ABR测量与发育8,生理学9,tonotopy 10和遗传学11,12的体外神经元研究之间的转换提供了理想的研究机会,支持整体听觉功能的研究。
尽管ABR已经在哺乳动物模型中得到了广泛的研究,但对鸟类的关注却较少。以前的鸟类ABR研究包括鹦鹉13,啄木鸟14,海鸥15,潜水鸟16,斑马雀17,昼夜猛禽18,金丝雀19,猫头鹰3种5,20,21,22和鸡23的表征。鉴于自上次对鸡ABR进行彻底表征以来的近四十年时间里,以前使用的许多设备和技术都发生了变化。来自其他鸟类模型研究的见解可以帮助开发现代鸡ABR方法,同时也可以与鸡ABR进行比较。本文将概述实验设置和设计,以便在孵化鸡中进行ABR记录,这也可以应用于胚胎发育阶段以及其他小型啮齿动物和鸟类模型。此外,鉴于鸡的早熟发育,可以在没有任何广泛畜牧业的情况下进行发育操作。对发育中的胚胎的操作可以在具有接近成熟听力能力的动物孵化后几个小时内进行评估。
研究方案
这里描述的实验是由西北大学的机构动物护理和使用委员会(IACUC)批准的,并根据美国国立卫生研究院实验动物护理和使用指南进行。
1. 养鸡业
- 获取受精的白色腿角鸡蛋。
注意:有几种鸡品种用于科学研究,但这里显示的结果来自白色腿角鸡(Gallus gallus domesticus)。虽然品种之间的ABR变异性尚不清楚,但在比较成年产蛋鸡和产肉肉鸡24,25时发现了一些差异。 - 在所需测试日期之前,将鸡蛋在38°C,湿度为50%的温度下孵育21天。
注意:如果鸡蛋没有立即在38°C下孵化,它们可以储存在14°C,湿度为40%。然而,卵在14°C下保存的时间越长,它们发育成有活力的幼崽的可能性就越小。7天后,卵子活力可降至50%,具体取决于卵子在14°C下保存的时间。 卵子的生存能力在冬季也会下降。 - 每天定期翻转鸡蛋2-3次。大多数孵化器都有一种自动执行此操作的机制。
- 如果使用聚苯乙烯泡沫塑料孵化器或容纳6个以上种蛋的孵化器,请在孵化前一天,胚胎第20天(E20)将种蛋转移到38°C的小孵化器中。种蛋应在孵化器中设置后21天(E21)孵化。
注意:在孵化过程中,动物将开始从卵中"捻出",形成一个小孔,最终绕过整个卵。如果条件太干燥,卵会变干,动物将无法孵化。湿度应保持在50%左右,基于先前对卵孵化可行性26,27,28,29的研究。 - 确定动物的年龄。如果没有亲自目睹孵化,年龄的唯一迹象是羊水干燥所需的2-3小时。
注意:孵化器应根据处理的数量,每天用70%异丙醇彻底清洁孵化器。鸡幼崽通常会在培养箱中留下粪便,羽毛和羊水,这会污染条件和空气质量。
2. 药物制剂
- 通过将动物放在大型称重船上来称重动物。如果放置得足够轻柔,动物就不应该移动。
注意:质量范围为30-45克。由于卵黄储备和尚未排泄废物,年幼的动物通常更重。接近24小时龄和P2的老年动物通常体重较轻。 - 准备氯胺酮(100毫克/毫升)和赛拉嗪(20毫克/毫升)的麻醉剂鸡尾酒,根据动物体重,剂量为50毫克/千克氯胺酮和16.68毫克/千克赛拉嗪。
注意:这种药物鸡尾酒可以用1毫升氯胺酮(100毫克/毫升),1.5毫升赛拉嗪(20毫克/毫升)和2.5毫升H2O制成。
3. 药物注射和动物制备
- 用一只手握住动物,确保将腿放下。
- 感受动物的胸骨,龙骨。龙骨的两侧将是乳房肌肉。
- 使用29-G针头和注射器将5毫米穿透皮肤,并将氯胺酮/赛拉嗪鸡尾酒注射到乳房肌肉中。根据动物体重注射0.05-0.1毫升。
- 注射后将动物放回培养箱中。在麻醉剂生效时将动物体温保持几分钟。
- 用镊子捏住动物的脚趾,检查脖子是否跛行。如果没有反射和脖子跛行,动物就会失去知觉。
- 用鸡的翅膀羽毛确定鸡的性别。如果羽毛的长度都相同,则动物是雄性的。如果羽毛的长度不同,则该动物是雌性30。
注意:对动物进行的另一种方法是发泄。男性生殖器可以在泄殖腔31中看到。这种方法非常困难,如果操作不正确,可能会伤害动物。建议使用翅膀羽毛法。 - 用棉签涂抹在头部和颈部区域,特别是在鸟的耳朵开口附近,涂抹脱毛霜。
- 使用70%异丙醇湿巾擦拭羽毛,任何剩余的脱毛霜以及头颈部的皮肤。
- 使用70%异丙醇擦拭剂对皮下电极和直肠探针进行灭菌。
- 将动物置于隔音和电气屏蔽室中。确保环境具有最小的电气和声学噪声,以获得最佳录音效果。
注意:此处的实验是在尺寸为 24 x 24 x 25 英寸的定制隔音外壳中进行的。任何消除声学噪声以及交流电(美国为60 Hz)的电气噪声的腔室或房间就足够了。 - 使用加热垫或温度控制系统来保持动物体温。
- 插入润滑的直肠探头,以确保动物的温度保持在37-41°C(98.6-105°F)32,33之间。
注意:如果探头尺寸不正确,动物可以躺在温度探头的顶部。 - 将动物的头部固定到位或将喙靠在物体上,以避免不必要的运动。如果呼吸没有阻塞,这可以通过建模粘土来完成。
- 如果动物在测试期间开始恢复意识,则给予麻醉剂鸡尾酒的补充注射,该剂量为原始剂量的一半。
注意:任何身体运动或发声都是必须施用补充剂量的迹象。微小的喙部运动表明呼吸,是可以接受的。
4. 电极放置
- 使用三种不锈钢氯化银针电极,具有以下名称:参比电极、活性电极和公共接地电极。
注:参比电极也称为反相或"-"。有源电极也称为同相或"+"。 - 将每个电极皮下放入头部2-3毫米,但不足以穿透颅骨。使用长度为 7 mm、直径为 0.4 mm 的电极。
- 将电极从皮肤中戳出,露出尖端。这有助于最大限度地减少与皮肤的接触,并确保动物之间的插入深度一致34.
注意:电极丝应具有足够的松弛度,以便在放置电极后,没有张力将其拉出或拉紧皮肤。 - 对于单通道记录,将活性电极放在颅骨上方的中线,远至尾部至耳道。
- 将参比电极放在将传递刺激的耳朵后面,并将接地电极放在颈部对侧耳道的后面。
注意:如果在动物的颅骨或耳道上进行手术,请将参比电极放在动物中线的颈部。这和步骤4.4.1都被认为是水平电极记录蒙太奇。
- 将参比电极放在将传递刺激的耳朵后面,并将接地电极放在颈部对侧耳道的后面。
- 对于双通道录制,请使用两个负极和一个需要适配器电缆的组合正极。将接地电极皮下放在颈部,每个耳道后面放置一个参比电极。
- 检查电极阻抗。确保整体电极阻抗不超过5.0 kΩ。将电极间阻抗保持在3.0 kΩ以下。
5. ABR记录
- 根据采集硬件和软件的不同,请确保在所使用的激励频率范围内执行正确的声级校准。
注意:校准技术因设备而异(参见讨论)。对于某些程序,可以在软件中编辑声音衰减。这里执行的校准程序涉及使用1/8英寸B&K 4138电容式麦克风在接近小鸡耳道(~5 mm)的封闭耦合器系统中记录频率刺激。鸡孵化校准表作为 补充表提供。 - 将声音换能器装置向动物的活动耳朵移动。将声音换能器放置在耳道中2 mm的浅深度。
注意:根据声音传感器的不同,可以安装塑料窥器并将其插入耳道。窥器放置至关重要。如果声音被耳道壁阻挡或耳道被捏合,则ABR将不存在或类似于阈值中约40 dB的偏移。 - 在测试期间检查动物,如果结果看起来异常或不存在。如果是,请将声音换能器重新定位在耳道中。
注意:由于皮肤松弛且动物可以移动,因此在记录过程中窥器位置可能会发生变化。然而,通过正确的麻醉注射和动物完全失去知觉,记录可以不间断地进行30-45分钟。
6. 数据采集
- 利用足够的设备/软件来生成声音刺激并记录/获取ABR录音。
注意:有许多商用或定制系统可用于 ABR 采购。对于这些实验,使用了市售的智能听力系统(IHS)SmartEP USB平台。操作记录参数的能力至关重要;这些包括但不限于刺激强度、刺激长度、刺激频率、刺激呈现率、高通和低通滤波器、伪像抑制、扫描次数、采样率、包络形状和刺激极化。 - 将伪像抑制(AR)上限和下限设置为±25 μV,以便扫描过程中的动物运动或噪声将从分析中排除该扫描。在测试的总体中,只有不到1%的总扫描因伪影而被拒绝。
- 收集至少 1024 次扫描以获得较大的平均响应。这可以在两个记录中完成,每个记录有512次扫描。这也确保了响应是刺激诱发的和可重复的。
- 将增益设置为100,000,将低通滤波器设置为100 Hz,将高通滤波器设置为3000 Hz。
注:低通和高通滤波器设置对于使用 IHS 系统的录制是最佳的。因此,这些参数是建议。使用BIOSIG软件在其他鸟类物种中记录的ABR过滤了30至3000 Hz 5,13,14,16,22之间的信号。 - 将刺激呈现速率设置为每秒 10 到 20 个刺激之间。高演示速率将改变 ABR 峰值延迟,特别是对于较晚的峰值13。低演示率将增加获得ABR所需的时间。
- 将点击刺激的持续时间设置为 100 μs。
- 如果使用音调突发刺激,请根据所需效果编辑刺激的频率和持续时间。100-4000 Hz的范围用于音调突发刺激,尽管成年鸡的行为听力范围范围为2-9000 Hz35。
注意:在 IHS 系统中,仅当光谱包络形状为梯形时,才能修改音调突发刺激的上升和下降时间。然而,余弦平方和布莱克曼包络提供了动物ABR实验中常用的预设上升和下降时间。IHS系统可以显示音调突发的光谱包络,以确保适当的上升和下降时间。点击刺激的上升和下降时间不能在IHS中编辑。
- 如果使用音调突发刺激,请根据所需效果编辑刺激的频率和持续时间。100-4000 Hz的范围用于音调突发刺激,尽管成年鸡的行为听力范围范围为2-9000 Hz35。
- 将采样率设置为允许的最高值(通常为 40 kHz),以获得最佳分辨率数据。
注意:某些系统(包括 IHS)使用有限数量的采样点,并且会改变记录窗口的长度。40 kHz(25 μs周期)采样速率可能只允许12 ms的记录窗口,因此为了捕获音调突发ABR,使用20 kHz采样速率(50 μs周期)来允许24 ms的记录窗口。如果直接比较咔嗒声和音调突发 ABR,请保持采样率恒定以保持相同的分辨率。 - 将刺激极化设置为交替。这样做是为了消除 ABR 记录中耳蜗微音的可视化。要可视化耳蜗微音,请使用稀疏或凝聚来获得刺激极性。
注意:选择刺激时可以更改许多设置。提供的增益和滤波器设置可能不是其他设备设置的最佳选择。大多数 ABR 机器的出厂默认设置未设置为在孵化鸡中进行记录。 - 如果记录 512 次扫描,则将两个单独的测试组合在一起以创建 1024 扫描平均值。
- 对于咔嗒声或音调突发刺激,请以超阈值强度获取 ABR。
- 继续以越来越低的强度进行记录,直到无法再识别诱发的反应。
- 将 ABR 阈值定义为引发可检测的诱发电响应的最低刺激强度。按 5 dBSPL 的步长降低刺激强度,以找到引发可检测峰的最低刺激强度。
7. 安乐死和实验结束
- 获得ABR后,准备过量(0.1mL)安乐死溶液(戊巴比妥钠390mg / mL苯妥英钠50mg / mL)。
- 使用脚趾捏确认没有反射后,用29-G针头在5毫米深处注射乳房肌肉中的安乐死溶液。注射技术与麻醉注射相同。
注意:动物将在几分钟后过期。在未检测到任何运动之前,请勿操纵或斩首动物。另一种安乐死技术是在翼下的肱静脉进行静脉注射。 - 一旦动物没有反射性,呼吸和心跳停止,迅速用锋利的剪刀或剪刀斩首。
- 用70%异丙醇湿巾清洁加热垫,直肠探针和氯化银电极。
- 确保已保存所有获取的跟踪。为了进一步分析,请将文件导出为.txt文件,可以在记事本中查看或导入电子表格。
结果
孵化雏鸡的代表性ABR录音
以下代表性和种群结果来自43只动物的ABR记录。为了响应超阈值点击刺激(75 dBSPL),在所有幼鸟中始终观察到三个正向峰值。这些峰值发生在刺激开始后6 ms内。在极少数情况下,在约6 ms处也观察到第四个峰值。虽然鸟类中ABR峰的识别因动物而异(见讨论),但峰值被标记并识别为罗马数字波I-IV。具有标记峰的代表性ABR波形如图 1A 所示(顶部迹线)。 图1B 显示了代表性迹线中标记的波I和III的延迟-强度函数。每降低 20 dB,波 I 峰值延迟增加约 0.3 ms。平均而言,波 I-III 分别发生在 1.50 ms (±0.02 ms)、3.00 ms (±0.06 ms) 和 4.13 ms (±0.09 ms) 的 75 dBSPL 时(图 1C)。Wave I和Wave III总是表现为一个奇异的峰值。对于Wave II,偶尔会在2.5-3.2 ms之间看到多个小峰。每个峰值都有相应的波谷,波I的峰谷幅度 - 所有峰值中最大的 - 平均为7 μV,在75 dB SPL时接近11 μV的最大幅度。
除了最大的振幅外,雏鸡ABR的Wave I在动物的峰值潜伏期变化最小。因此,该峰值用于估计听力阈值灵敏度。ABR阈值被定义为引发可识别和可重复波形峰值的最低刺激强度。这是由实验者主观确定的,并由第二个实验者交叉检查阈值协议。使用点击刺激时,峰值定义得更好,更容易识别,但音调爆发也会产生定义和可识别的峰值,这些峰值根据刺激频率及其参数而变化(图1D,n = 4个小鸡)。点击诱发的ABR阈值低于音调突发诱发阈值,但1000 Hz除外。点击刺激的阈值在10-30 dBSPL之间变化。点击诱发的ABR没有显示可识别的峰值>30 dBSPL通常是由于动物运动而窥器从耳道中移位的结果。
体温下降会增加 ABR 潜伏期
神经活动的速度 - 通过波形幅度的峰值发生(即潜伏期)测量 - 已知在较低的体温36,37下降低。在使用75 dBSPL点击刺激的孵化鸡ABR中观察到这种现象。代表性迹线如图 2A所示。随着体温从39°C下降,尽管刺激强度水平相同,但ABR峰值的潜伏期在较晚的时间内发生。 图2B 显示了第一波和第三波的潜伏期作为代表性迹线的较低体温的函数。较低的体温与Wave I峰值潜伏期的发生之间存在很强的相关性(R2 = 0.89)(图2C,n = 5只雏鸡)。这些结果表明,在ABR记录期间需要保持接近正常的体温。如果不保持接近正常的体温,ABR的潜伏强度函数和振幅测量值变化很大,并且通常不准确。
早期幼雏的延迟和振幅差异
研究表明,与雏鸡听力发作相关的神经活动在胚胎晚期8岁时接近成熟。然而,对于非常早期的幼雏子集(孵化后<3小时),我们观察到ABR波形的峰值延迟偏移(n = 4)响应于75 dB SPL点击刺激或诱发电位无法识别(n = 2只雏鸡)。在2只幼雏中,没有音调爆发ABR可以被引发,点击阈值提高了50 dBSPL。这可能是由于传导问题,即动物的耳道/中耳腔中仍有液体,或神经成分发育不全。哺乳动物研究报告,新生儿阈值变化为50分贝38,39。这里使用的代表性动物>3小时大,这也与羽毛干燥所需的时间相吻合。图3A显示了从幼鸟(P1,<3小时大)和年长的幼雏(P2)记录的ABR。为了分析,只有3只幼雏呈现了所有3个ABR峰。峰值波形延迟显著延长,与较老的幼雏相比,波形幅度略有降低(分别为图3B-C)。
参比电极放置和双通道 ABR 记录
在 图4中,参比电极的位置在2个不同位置之间进行了修改,但仍然产生了可比的ABR记录。同一动物的75 dBSPL点击迹线与两个参比电极放置之间的比较显示,峰通波形幅度和峰值波形延迟的差异很小(图4A)。乳突放置的方法学类似于哺乳动物的ABR实验,将参比电极放在乳突或耳廓上。如果在任一耳朵上进行操作或手术,则对参比电极使用颈部放置将是有益的。有趣的是,乳突放置(红色迹线)的Wave II峰值幅度发生在颈部放置(黑色迹线)的Wave II峰值之后1 ms。这个时间差可能反映了相对于电极放置的ABR神经产生的位点。
使用双通道设置,使用一个有源记录电极(头顶放置)和两个参比电极(乳突放置)来获得左耳和右耳的ABR(图4B)。两只耳朵之间的反应相似,峰值振幅的微小变化可能是由于耳机的位置。左耳和右耳的潜伏期相等,支持了孵化鸡的耳朵和脑干半球同样健康的功能。双声道录音蒙太奇也可以用于双耳ABR,但这些录音还需要额外的考虑因素。

图1:孵化雏鸡的代表性记录到点击和音调诱发的刺激。 (A)来自孵化雏鸡(P2)的代表性ABR记录作为不同刺激强度水平的函数。在刺激开始后6 ms内(时间= 0 ms),可以在微伏(μV)中识别出3到4个正峰值。波浪是用罗马数字识别的。峰谷幅度在较低的刺激强度水平下减小。(B)波I和III的延迟强度函数,用于(A)中所示的代表性迹线。仅分析了这些峰值,因为在强度为<45 dBSPL时通常未观察到Wave II。(C) 咔嗒声诱发的 ABR 峰值波形的延迟(n = 43 只雏鸡)。误差线表示均值 (SEM) 的标准误差。(D) 四只幼雏在三种不同频率下的平均音调诱发ABRs(黑色痕迹)。红色迹线 = 均值 (SEM) 激励的标准误差 = 75 dBSPL。在此图和随后的图中,误差线表示SEM,右耳是刺激耳。( 图4B 例外,其中两只耳朵都受到刺激)。 请点击此处查看此图的大图。

图2:体温对ABR记录的影响。 (A)来自孵化雏鸡(P2)的代表性ABR记录作为体温的函数。对于较低的体温,峰值波形延迟增加,而峰谷幅度相对保持不变。(B)波I和III的延迟 - 温度函数,用于(A)中所示的代表性迹线。(C)显示5只雏鸡潜伏期与温度变化之间关系的人口数据(p <0.01,R2 = 0.89)。在第二波和第三波中观察到类似的趋势(数据未显示)。 请点击此处查看此图的大图。
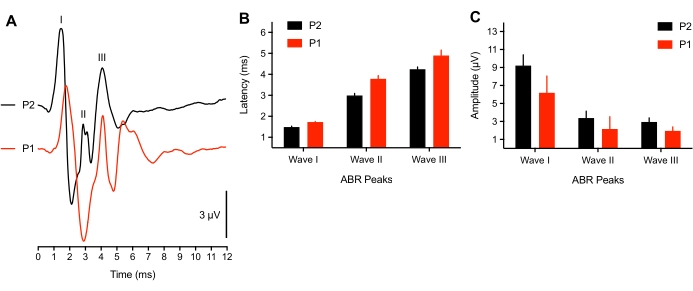
图3:ABR记录中与年龄相关的差异。 (A)代表性孵化雏鸡在P2(黑色痕迹)和P1(孵化后<3小时,红色痕迹)的代表性ABR记录(重叠)。(B) 波 I、II 和 III 波的峰值波形延迟与年龄的函数关系。Wave I-III的潜伏期在年龄之间显着不同(P <0.05,n = 6只雏鸡)。(C) 波 I、II 和 III 波的峰谷波形振幅作为年龄的函数。 请点击此处查看此图的大图。
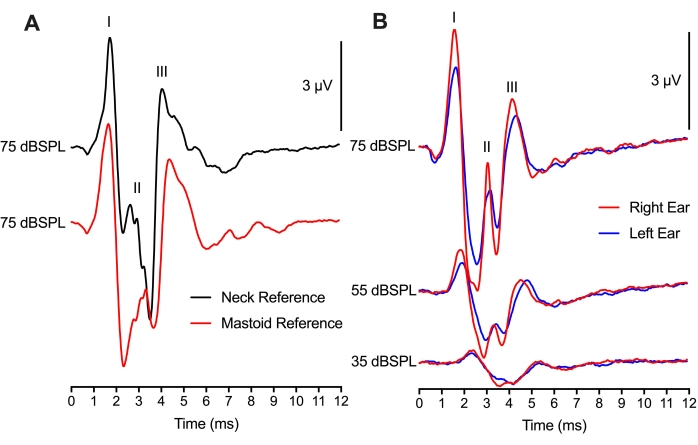
图4:电极放置和双通道ABR记录: (A)来自同一雏鸡(P2)的代表性ABR记录(重叠),参比电极放置在颈部(黑色迹线)或乳突(红色迹线)。将活性电极放置在颅骨的中线,用于两个电极记录蒙太奇。波浪I和III的延迟以及波浪I和III的振幅在这两种情况下几乎相同。Wave II的潜伏期较早,放置在颈部组织中的电极的振幅较大。(B)双声道录音,同时依次刺激左右耳。来自同一只孵化雏鸡(P2)的代表性ABR记录(重叠),参比电极以三种不同的强度水平放置在左耳(蓝色痕迹)和右耳(红色痕迹)的乳突中。 请点击此处查看此图的大图。
补充表: 鸡孵化校准表。 请按此下载此表格。
讨论
鸟类的听觉脑干得到了很好的研究,许多结构类似于哺乳动物的听觉通路。听觉神经为两个一阶中央细胞核(乳腺细胞核 (NM) 和角质细胞 (NA))提供兴奋性输入。NM将兴奋性投射双侧发送到其听觉靶标,即层核(NL)7。NL投射到侧侧中脑核,背鳍核(MLd)40,41。NL还投射到上橄榄核(SON),其为NM,NA和NL42提供反馈抑制。这种下听觉脑干微电路因其功能,声音定位和双耳听力33而得到精心保存。鸟类的上听觉脑干区域也具有类似于哺乳动物外侧脑和中脑下丘脑的细胞核。鉴于这些相似性,鸟类ABR到听觉中脑的组成在所有脊椎动物中都是相当的。
虽然多种鸟类在刺激开始后6 ms内显示出三个正峰,但ABR峰与中央听觉结构的相关性确实具有一定的可变性。可以合理地假设波I是来自外周基底和听觉神经的第一个神经反应,并且在个体之间几乎没有变异性(图1C)。随后的波浪识别不太确定,并且可能因物种而异。Kuokkanen等人17 最近确定谷仓猫头鹰的ABR的第三波是由NL产生的;因此,有理由认为Wave II起源于耳蜗核20的NM和NA。然而,猫头鹰Wave III被定义为刺激开始后3 ms产生的正峰值。这对应于孵化鸡ABR中定义的Wave II。在谷仓猫头鹰ABR中,波浪I和II被组合在一起。
虽然雏鸡通常在6 ms内出现三个峰,但偶尔观察到第四个峰(例如,见 图1A)。需要总体数据,更大的样本量和额外的实验范式来支持第四波,在某些情况下,还需要五波鸡ABR。最一致的发现是此处显示的三个峰值表示。
由于ABR被定义为神经同步性的量度,因此听觉通路中的主要细胞核可以代表ABR中的每个正向峰。从听觉神经传递到NM / NA然后到NL的信号可能分别定义孵化鸡ABR中的I,II和III波。此外,后来发生的鸡的第四峰ABR可能代表上脑干或中脑听觉结构。鸟类ABRs的特征还应考虑早熟鸟类和无菌鸟类之间的差异。听觉反应的成熟会因物种而异,并且还受到捕食者行为和/或声音学习等其他关键特征的影响4.无论如何,所描述的方法和技术很容易应用于各种鸟类和脊椎动物物种。
维持动物体温的重要性如图 2所示。随着内部体温的降低,在相同的刺激强度水平下,ABR反应的潜伏期增加。当体温降至32°C以下36,37时,这更为明显。ABR中大约1毫秒的延迟增加小于之前在鸡23中报告的。然而,片山23 号使用了一只12天大的幼雏,该幼雏冷却并在4小时内变暖。 图2 中的数据是在20分钟的冷却过程中记录的。为了获得最佳质量和最一致的记录,必须保持动物的体温,并且所有记录都应在动物之间的相同生理温度下进行。
年龄对ABR的影响很小,但重要的是要考虑。虽然只有ABR的Waves I和Wave II的延迟显着不同,但这部分是因为 图3中仅使用了三个幼雏;其他三个没有出现三个可识别的ABR峰。如果使用大样本量或比较频率特异性ABR,ABR幅度和阈值偏移也可能很明显。这种与年龄有关的影响可能是由鸡中耳中的液体引起的。这种导电变化导致人类和其他哺乳动物模型的ABR阈值显着增加38,39。
使用两种不同的记录蒙太奇,观察到类似的响应(图4A)。虽然最常见的蒙太奇将参比电极放在刺激接收耳的后面,但如果伴随ABR进行手术干预,则将参比电极放在颈部组织中是有用的。但是,如果使用双通道ABR记录,参比电极应单独对称放置,如果将参比电极放在颈部,则很难。建议使用参比电极的乳突位置,以标准化尽可能多的记录方面。双通道ABR录音是一种有效的工具,几乎不需要额外的准备,并且在耳朵之间产生类似的反应。微小的振幅差异可能是由于耳机的位置造成的。双通道记录允许将实验操纵的耳朵或大脑半球与对照进行比较。测试双耳ABR也需要此设置。未来使用鸡ABR的实验可以参考以前关于记录配置和蒙太奇的文献34。
这种方法确实存在一些限制。如步骤5.1所述,不良的窥器放置可能导致响应中40 dBSPL的偏移。这可能会导致对纵或改良的动物的错误解释。建议采取以下预防措施:在获取操纵或突变模型的ABR之前,先获取大量对照数据样本。不要在两次录制之间将刺激强度降低超过 20 dBSPL。如果振幅或潜伏期变化超过预期,请检查动物和窥器位置。重复ABR刺激以观察变化。如果窥器已移动,请重新获取以前的测试。另一个限制是ABR的校准。如果没有适当的校准来记录声压级,呈现给动物的强度是未知的。测量声音输出时,使用与实验录音相同的窥器,并在腔内使用接近动物耳道长度(〜5 mm)的小麦克风。测量实验中使用的相同音调频率,因为校准是特定于频率的。硬件和软件系统的手册可能附带校准说明。还有额外的滤波器,如线性相位和最小相位滤波器,可以改善咔嗒声和音调突发ABR43。本研究未使用这些过滤器。其他考虑因素,例如音调突发频谱包络的上升和下降时间作为频率的函数而变化或改变点击刺激的上升和下降时间也没有被检查。一旦可以获得可靠和一致的ABR,这些都是良好的未来调查。
将孵化鸡与其他鸟类模型进行比较是有希望的。Budgerigars和东部尖叫猫头鹰在ABR13,22的前6 ms内也显示出三个正微伏峰值。在不同种类的啄木鸟中,也可以看到三个峰值,但它们的延迟时间较晚。此外,啄木鸟的最佳频率灵敏度范围在1500至4000 Hz之间,略高于鸡在1000 Hz时的最佳阈值。在成年鸡中,最好的灵敏度是2000 Hz35,因此随着鸡幼崽发育成成体,高频的听力可能会得到改善。考虑到动物的萎缩或早熟发育,这种发育在鸟类物种之间会有所不同4.
这里概述的实验方法可以帮助确定哪些因素导致听觉反应和阈值的损害或变化,以及胚胎发育不同阶段的研究。遗传操纵,衰老和噪音暴露都是已知的动物和其他鸟类模型中的操纵24,25,44,45。这些方法应该扩展到鸡模型,因为像 内卵 电穿孔这样的技术允许在听觉脑干的一侧进行局灶性和时间控制的蛋白质的表达12,46。这允许使用双通道记录范式将ABR从遗传操纵的耳朵到对侧控制耳朵的直接比较。
总体而言,孵化鸡的ABR是一种有用的研究方法,几乎与人类和其他哺乳动物模型中的听力功能测量相同。它也是一种非侵入性的 体内 方法。除了麻醉剂注射和几毫米的皮下电极放置外,不需要其他物理操作。理论上,如果将其保持在适当的环境中,则可以在几天或几周的发育时间内对幼雏进行多次测试。该协议不仅列出了孵化鸡ABR的必要步骤和记录参数,而且还提出了禽类ABR的特征,可以为进一步测试听觉脑干功能提供信息。
披露声明
作者没有什么可透露的。
致谢
这项工作由NIH / NIDCD R01 DC017167支持
材料
| Name | Company | Catalog Number | Comments |
| 1/8 inch B&K Microphone | Brüel & Kjær | 4138 | Type 4138-A-015 also works |
| Auditory Evoked Potential Universal Smart Box | Intelligent Hearing Systems | M011110 | |
| Custom Sound Isolation Chamber | GK Soundbooth Inc | N/A | Custom built |
| DC Power Supply | CSI/Speco | PSV-5 | |
| ER3 Insert Earphone | Intelligent Hearing Systems | M015302 | Used as sound transducer |
| Euthasol | Virbac | 710101 | Controlled Substance; euthanasia solution |
| Insulin Syringe (29 G) | Comfort Point | 26028 | |
| Ketamine | Covetrus | 11695-0703-1 | Controlled Substance |
| Power Supply | Powervar | 93051-55R | |
| Rectal Probe | YSI | 401 (10-09010) | Any 400 series probe will work with the YSI temperatuer monitor |
| Subdermal needles | Rhythmlink | RLSND107-1.5 | |
| Temperature Monitor | YSI | 73ATA 7651 | Works with any 400 series rectal probe |
| Xylazine | Anased | 59399-110-20 | Used with ketamine and water for anesthetic |
参考文献
- Wever, E. G., Bray, C. W. Action currents in the auditory nerve in response to acoustical stimulation. Proceedings of the National Academy of Sciences of the United States of America. 16 (5), 344-350 (1930).
- Jewett, D. L., Williston, J. S. Auditory-evoked far fields averaged from the scalp of humans. Brain. 94 (4), 681-696 (1971).
- Corwin, J. T., Bullock, T. H., Schweitzer, J. The auditory brain stem response in five vertebrate classes. Electroencephalography and Clinical Neurophysiology. 54 (6), 629-641 (1982).
- Carey, C. Avian Growth and Development. Evolution within the Altricial Precocial Spectrum. , Oxford University Press. Oxford. (1998).
- Kraemer, A., Baxter, C., Hendrix, A., Carr, C. E. Development of auditory sensitivity in the barn owl. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 203 (10), 843-853 (2017).
- Rebillard, G., Rubel, E. W. Electrophysiological study of the maturation of auditory responses from the inner ear of the chick. Brain Research. 229 (1), 15-23 (1981).
- Parks, T. N., Rubel, E. W. Organization and development of brain stem auditory nuclei of the chicken: organization of projections from n. magnocellularis to n. laminaris. Journal of Comparative Neurology. 164 (4), 435-448 (1975).
- Hong, H., Rollman, L., Feinstein, B., Sanchez, J. T. Developmental profile of ion channel specializations in the avian nucleus magnocellularis. Frontiers in Cellular Neuroscience. 10, 80(2016).
- Leao, R. M. The ion channels and synapses responsible for the physiological diversity of mammalian lower brainstem auditory neurons. Hearing Research. 376, 33-46 (2019).
- Oline, S. N., Ashida, G., Burger, R. M. Tonotopic optimization for temporal processing in the cochlear nucleus. Journal of Neuroscience. 36 (32), 8500-8515 (2016).
- Kopp-Scheinpflug, C. Your genes decide what you are listening to. Channels. 11 (5), 355-356 (2017).
- Sid, H., Schusser, B. Applications of gene editing in chickens: A new era is on the horizon. Frontiers in Genetics. 9, 456(2018).
- Brittan-Powell, E. F., Dooling, R. J., Gleich, O. Auditory brainstem responses in adult budgerigars (Melopsittacus undulatus). The Journal of the Acoustical Society of America. 112 (3), Pt 1 999-1008 (2002).
- Lohr, B., Brittan-Powell, E. F., Dooling, R. J. Auditory brainstem responses and auditory thresholds in woodpeckers. The Journal of the Acoustical Society of America. 133 (1), 337-342 (2013).
- Counter, S. A. Brain-stem evoked potentials and noise effects in seagulls. Comparative Biochemistry and Physiology. A, Comparative Physiology. 81 (4), 837-845 (1985).
- Crowell, S. E., et al. A comparison of auditory brainstem responses across diving bird species. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 201 (8), 803-815 (2015).
- Noirot, I. C., Brittan-Powell, E. F., Dooling, R. J. Masked auditory thresholds in three species of birds, as measured by the auditory brainstem response (L). Journal of the Acoustical Society of America. 129 (6), 3445-3448 (2011).
- McGee, J., et al. Auditory performance in bald eagles and red-tailed hawks: a comparative study of hearing in diurnal raptors. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 205 (6), 793-811 (2019).
- Brittan-Powell, E. F., Dooling, R. J., Ryals, B., Gleich, O. Electrophysiological and morphological development of the inner ear in Belgian Waterslager canaries. Hearing Research. 269 (1-2), 56-69 (2010).
- Kuokkanen, P. T., Kraemer, A., Kempter, R., Koppl, C., Carr, C. E. Auditory brainstem response wave iii is correlated with extracellular field potentials from nucleus laminaris of the barn owl. Acta Acustica United with Acustica. The Journal of the European Acoustics Association (EEIG). 104 (5), 874-877 (2018).
- Beatini, J. R., Proudfoot, G. A., Gall, M. D. Frequency sensitivity in Northern saw-whet owls (Aegolius acadicus). Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 204 (2), 145-154 (2018).
- Brittan-Powell, E. F., Lohr, B., Hahn, D. C., Dooling, R. J. Auditory brainstem responses in the Eastern Screech Owl: an estimate of auditory thresholds. The Journal of the Acoustical Society of America. 118 (1), 314-321 (2005).
- Katayama, A. Postnatal development of auditory function in the chicken revealed by auditory brainstem responses (ABRs). Electroencephalography and Clinical Neurophysiology. 62 (5), 388-398 (1985).
- Durham, D., Park, D. L., Girod, D. A. Breed differences in cochlear integrity in adult, commercially raised chickens. Hearing Research. 166 (1-2), 82-95 (2002).
- Kaiser, C. L., Girod, D. A., Durham, D. Breed-dependent susceptibility to acute sound exposure in young chickens. Hearing Research. 203 (1-2), 101-111 (2005).
- Hamdy, A. M., Vander Hel, W., Henken, A. M., Galal, A. G., Abd-Elmoty, A. K. Effects of air humidity during incubation and age after hatch on heat tolerance of neonatal male and female chicks. Poultry Science. 70 (7), 1499-1506 (1991).
- Bruzual, J. J., Peak, S. D., Brake, J., Peebles, E. D. Effects of relative humidity during the last five days of incubation and brooding temperature on performance of broiler chicks from young broiler breeders. Poultry Science. 79 (10), 1385-1391 (2000).
- vander Pol, C. W., van Roovert-Reijrink, I. A. M., Maatjens, C. M., vanden Brand, H., Molenaar, R. Effect of relative humidity during incubation at a set eggshell temperature and brooding temperature posthatch on embryonic mortality and chick quality. Poultry Science. 92 (8), 2145-2155 (2013).
- Buhr, R. J. Incubation relative humidity effects on allantoic fluid volume and hatchability. Poultry Science. 74 (5), 874-884 (1995).
- Galli, R., et al. Sexing of chicken eggs by fluorescence and Raman spectroscopy through the shell membrane. PLoS One. 13 (2), 0192554(2018).
- Otsuka, M., Miyashita, O., Shibata, M., Sato, F., Naito, M. A novel method for sexing day-old chicks using endoscope system. Poultry Science. 95 (11), 2685-2689 (2016).
- Kaiser, A. The ontogeny of homeothermic regulation in post-hatching chicks: its influence on the development of hearing. Comparative Biochemistry and Physiology. A, Comparative Physiology. 103 (1), 105-111 (1992).
- Kuba, H., Yamada, R., Ohmori, H. Evaluation of the limiting acuity of coincidence detection in nucleus laminaris of the chicken. The Journal of Physiology. 552, Pt 2 611-620 (2003).
- Shaheen, L. A., Valero, M. D., Liberman, M. C. Towards a diagnosis of cochlear neuropathy with envelope following responses. Journal of the Association for Research in Otolaryngology. 16 (6), 727-745 (2015).
- Hill, E. M., Koay, G., Heffner, R. S., Heffner, H. E. Audiogram of the chicken (Gallus gallus domesticus) from 2 Hz to 9 kHz. Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 200 (10), 863-870 (2014).
- Rossi, G. T., Britt, R. H. Effects of hypothermia on the cat brainstem auditory evoked response. Electroencephalography and Clinical Neurophysiology. 57 (2), 143-155 (1984).
- Doyle, W. J., Fria, T. J. The effects of hypothermia on the latencies of the auditory brainstem response (ABR) in the rhesus monkey. Electroencephalography and Clinical Neurophysiology. 60 (3), 258-266 (1985).
- Guan, X., Gan, R. Z. Effect of middle ear fluid on sound transmission and auditory brainstem response in guinea pigs. Hearing Research. 277 (1-2), 96-106 (2011).
- Ravicz, M. E., Rosowski, J. J., Merchant, S. N. Mechanisms of hearing loss resulting from middle-ear fluid. Hearing Research. 195 (1-2), 103-130 (2004).
- Wang, Y., Zorio, D. A. R., Karten, H. J. Heterogeneous organization and connectivity of the chicken auditory thalamus (Gallus gallus). Journal of Comparative Neurology. 525 (14), 3044-3071 (2017).
- Wang, Y., Karten, H. J. Three subdivisions of the auditory midbrain in chicks (Gallus gallus) identified by their afferent and commissural projections. Journal of Comparative Neurology. 518 (8), 1199-1219 (2010).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. Journal of Neuroscience. 30 (36), 12075-12083 (2010).
- Beutelmann, R., Laumen, G., Tollin, D., Klump, G. M. Amplitude and phase equalization of stimuli for click evoked auditory brainstem responses. The Journal of the Acoustical Society of America. 137 (1), 71-77 (2015).
- Liberman, M. C. Noise-induced and age-related hearing loss: new perspectives and potential therapies. F1000Research. 6, 927(2017).
- Efrati, A., Gutfreund, Y. Early life exposure to noise alters the representation of auditory localization cues in the auditory space map of the barn owl. Journal of Neurophysiology. 105 (5), 2522-2535 (2011).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments: JoVE. (124), e55628(2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。