Method Article
Tavuk Yavrularında İşitsel Beyin Sapı Yanıtının Değerlendirilmesi
Bu Makalede
Özet
Standart işitsel beyin sapı yanıtı (ABR) tekniklerini kullandık ve bunları işitsel işlev için erken bir kuş modeli olan yavru tavuklara uyguladık. Protokol, hayvan hazırlama ve ABR edinme tekniklerini, diğer kuş veya kemirgen modellerine çevrilebilecek adımlarla ayrıntılı olarak özetlemektedir.
Özet
İşitsel beyin sapı yanıtı (ABR), klinik odyolojide, insan dışı hayvanlarda ve insan araştırmalarında paha biçilmez bir testtir. İşitsel nöral senkronizasyonu ölçmede ve diğer omurgalı model sistemlerinde işitme duyarlılığını tahmin etmede ABR'lerin yaygın olarak kullanılmasına rağmen, tavuktaki ABR'leri kaydetme yöntemleri yaklaşık kırk yıldır bildirilmemiştir. Tavuklar sağlam bir hayvan araştırma modeli sağlar, çünkü işitsel sistemleri geç embriyonik ve erken kuluçka aşamalarında fonksiyonel olgunlaşmaya yakındır. Tavuk yavrularında subdermal iğne elektrot dizileri kullanarak bir veya iki kanallı ABR kayıtlarını ortaya çıkarmak için kullanılan yöntemleri gösterdik. Elektrot kayıt konfigürasyonundan (yani montajdan) bağımsız olarak, ABR kayıtları, bir eşik üstü tıklama uyaranının ilk 6 ms'sinde 3-4 pozitif giden tepe dalga formu içeriyordu. Tepeden oluğa dalga formu genlikleri, yüksek yoğunluklu seviyelerde 2-11 μV arasında değişmekte olup, beklenen gecikme yoğunluğu fonksiyonlarını sergileyen pozitif pikler (yani, azalan yoğunluğun bir fonksiyonu olarak gecikme süresinde artış). Standartlaştırılmış kulaklık pozisyonu, gevşek cilt kulak kanalını tıkayabileceğinden ve hayvan hareketi uyaran dönüştürücüsünü yerinden çıkarabileceğinden, optimum kayıtlar için kritik öneme sahipti. Tepe genlikleri daha küçüktü ve hayvan vücut ısısı düştükçe gecikmeler daha uzundu ve fizyolojik vücut ısısını koruma ihtiyacını destekledi. Genç yavrular için (<3 saat kuluçka sonrası gün 1), eşikler ~5 dB yükseltildi, pik gecikme süreleri ~ 1-2 ms arttı ve zirveden oluğa genlikler yaşlı yavrulara kıyasla ~ 1 μV azaldı. Bu, potansiyel bir iletken ilgili sorunu (yani, orta kulak boşluğundaki sıvı) düşündürmektedir ve genç yavrular için dikkate alınmalıdır. Genel olarak, burada özetlenen ABR yöntemleri, tavuk yavrularında gelişimin farklı aşamalarına uygulanabilecek in-vivo işitsel fonksiyonun doğru ve tekrarlanabilir bir şekilde kaydedilmesine izin verir. Bu bulgular, işitme kaybı, yaşlanma veya diğer işitsel ile ilgili manipülasyonların insan ve memeli modelleriyle kolayca karşılaştırılabilir.
Giriş
Ses uyaranlarına karşı uyarılmış nöral tepkilerin incelenmesi yarım yüzyıldan daha eskiye dayanmaktadır1. İşitsel beyin sapı yanıtı (ABR), hem insan olmayan hayvanlarda hem de insanlarda on yıllardır işitsel fonksiyonun bir ölçüsü olarak kullanılan uyarılmış bir potansiyeldir. İnsan ABR'si, geleneksel olarak Roma rakamları (I-VII) ile etiketlenmiş beş ila yedi dalga formu zirvesi sunar2. Bu zirveler, nöral yanıtların gecikme sürelerine (milisaniye cinsinden oluşum süresi) ve genliklerine (mikrovoltlarda tepeden oluğa boyut) göre analiz edilir. ABR, işitme sinirinin fonksiyonunu ve bütünlüğünü, beyin sapı ve işitme eşiği duyarlılığını değerlendirmede etkilidir. İşitsel sistemdeki eksiklikler yok, azalmış, uzamış veya anormal ABR gecikmeleri ve genlikleri ile sonuçlanır. Dikkat çekici bir şekilde, bu parametreler insanlarda ve diğer hayvanlarda neredeyse aynıdır, bu da onu omurgalı modelleri arasında işitsel fonksiyonun tutarlı bir objektif testi haline getirir3.
Böyle bir model sistemi tavuktur ve çeşitli nedenlerden dolayı özellikle yararlıdır. Kuşlar altrisiyel veya precocial4 olarak sınıflandırılabilir. Altrisiyel kuşlar hala gelişmekte olan duyularla yumurtadan çıkarlar; Örneğin, peçeli baykuşlar, kapak5'ten dört gün sonrasına kadar tutarlı bir ABR göstermez. Tavuk gibi erken hayvanlar, neredeyse olgun duyulara sahip yumurtadan çıkar. İşitmenin başlangıcı embriyonik gelişimde meydana gelir, öyle ki yumurtadan çıkmadan günler önce (embriyonik gün 21), işitsel sistem fonksiyonel olgunlaşmaya yakındır 6,7,8. Altrisiyel kuşlar ve çoğu memeli modeli, gelişimi etkileyen ve işitme olgunlaşana kadar hayvancılık gerektiren dışsal faktörlere karşı hassastır. Tavuk ABR'leri, kapakla aynı gün, beslenme veya zenginleştirilmiş bir ortam ihtiyacından vazgeçerek gerçekleştirilebilir.
Embriyonik tavuk, özellikle işitsel beyin sapında, fizyoloji ve gelişim için iyi çalışılmış bir model olmuştur. Spesifik yapılar, çekirdek magnocellularis (NM) ve nucleus angularis (NA) olarak bölünmüş tavuk koklear çekirdeğini ve nucleus laminaris (NL) olarak bilinen medial superior zeytinin kuş korelasyonunu içerir6,7. ABR, ön beyin ve korteks seviyesinden önce merkezi işitsel fonksiyona odaklanmak için idealdir. İn-vivo ABR ölçümleri ile gelişim8, fizyoloji9, tonotopi 10 ve genetik11,12'nin in-vitro nöronal çalışmaları arasındaki çeviri, genel işitsel fonksiyon çalışmalarını destekleyen ideal araştırma fırsatları sunmaktadır.
ABR, memeli modellerinde kapsamlı bir şekilde çalışılmasına rağmen, kuşlar için daha az odak noktası olmuştur. Önceki kuş ABR çalışmaları, muhabbet kuşu 13, ağaçkakan14, martı15, dalış kuşları 16, zebra ispinozu 17, günlük raptors 18, kanarya 19, üç baykuş türü5,20,21,22 ve tavuk 23'ün karakterizasyonlarını içerir. Tavuk ABR'sinin son kapsamlı karakterizasyonundan bu yana geçen yaklaşık kırk yıl göz önüne alındığında, daha önce kullanılan ekipman ve tekniklerin çoğu değişmiştir. Diğer kuş modellerindeki çalışmalardan elde edilen bilgiler, modern tavuk ABR metodolojisinin geliştirilmesine yardımcı olurken, aynı zamanda tavuk ABR ile bir karşılaştırma görevi de görebilir. Bu makale, embriyonik gelişim aşamalarına ve diğer küçük kemirgen ve kuş modellerine de uygulanabilecek yavru tavuklarda ABR kaydına izin vermek için deneysel kurulum ve tasarımı özetleyecektir. Ek olarak, tavuğun erken gelişimi göz önüne alındığında, gelişimsel manipülasyonlar kapsamlı bir hayvancılık olmadan gerçekleştirilebilir. Gelişmekte olan bir embriyoya yapılan manipülasyonlar, hayvanın neredeyse olgun işitme yetenekleriyle yumurtadan çıkmasından sadece birkaç saat sonra değerlendirilebilir.
Protokol
Burada açıklanan deneyler, Northwestern Üniversitesi'nin Kurumsal Hayvan Bakımı ve Kullanım Komiteleri (IACUC) tarafından onaylanmış ve Ulusal Sağlık Enstitüleri Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak yürütülmüştür.
1. Tavuk yetiştiriciliği
- Döllenmiş beyaz bacak boynuzlu tavuk yumurtası elde edin.
NOT: Bilimsel araştırmalarda kullanılan birkaç tavuk ırkı vardır, ancak burada gösterilen sonuçlar beyaz bacak boynuzlu tavuktan (Gallus gallus domesticus) alınmıştır. Irklar arasındaki ABR değişkenliği bilinmemekle birlikte, yetişkin yumurtlayan tavukları et üreten piliç tavuklarıyla karşılaştırırken bazı farklılıklar bulunmuştur24,25. - İstenilen test tarihinden 21 gün önce yumurtaları 38 °C'de, nemi %50'de inkübe edin.
NOT: Yumurtalar hemen 38 °C'de inkübe edilmezse, 14 °C'de, nem% 40'ta saklanabilirler. Bununla birlikte, yumurtalar 14 ° C'de ne kadar uzun süre tutulursa, canlı yavrulara dönüşme olasılıkları o kadar düşük olur. 7 gün sonra, yumurta canlılığı, yumurtaların 14 ° C'de ne kadar süre tutulduğuna bağlı olarak% 50'ye kadar düşebilir. Yumurta canlılığı kış aylarında da düşecektir. - Yumurtaları periyodik olarak günde 2-3 kez çevirin. Çoğu inkübatörün bunu otomatik olarak gerçekleştirmek için bir mekanizması vardır.
- Bir strafor inkübatörü veya 6'dan fazla yumurta tutan bir inkübatör kullanıyorsanız, yumurtadan çıkmadan bir gün önce, embriyonik gün 20'de (E20) küçük bir 38 ° C inkübatöre aktarın. Yumurtalar inkübatöre yerleştirildikten 21 gün sonra (E21) yumurtadan çıkmalıdır.
NOT: Kuluçka işleminde, hayvan yumurtadan "boru çekmeye" başlayacak ve sonunda tüm yumurtanın etrafından dolaşan küçük bir delik açacaktır. Koşullar çok kuruysa, yumurta kuruyabilir ve hayvan yumurtadan çıkamaz. Yumurtadan çıkma canlılığı26,27,28,29 ile ilgili önceki çalışmalara dayanarak nem% 50 civarında tutulmalıdır. - Hayvanın yaşını belirleyin. Kapak şahsen görülmüyorsa, yaşın tek göstergesi amniyotik sıvının kuruması için gereken 2-3 saattir.
NOT: Kuluçka inkübatörü, kaç yavrunun işlendiğine bağlı olarak günlük olarak% 70 izopropil alkol ile iyice temizlenmelidir. Tavuk yavruları genellikle inkübatörde dışkı, tüyler ve amniyotik sıvı bırakır, bu da koşulları ve hava kalitesini kirletebilir.
2. İlaç hazırlama
- Hayvanı büyük bir tartım teknesine yerleştirerek tartın. Yeterince yumuşak bir yerleştirme ile, hayvan hareket etmemelidir.
NOT: Kütle 30-45 g arasında değişebilir. Genç hayvanlar, yumurta sarısı rezervleri nedeniyle ve henüz atık atmadıkları için genellikle daha ağırdır. 24 saatlik yaşa ve P2'ye yaklaşan yaşlı hayvanlar genellikle daha az ağırlığa sahiptir. - Ketamin (100 mg / mL) ve Ksilazin (20 mg / mL) anestezik bir kokteyli hazırlayın, böylece dozaj hayvan ağırlığına göre 50 mg / kg Ketamin ve 16.68 mg / kg Ksilazin olacaktır.
NOT: Bu ilaç kokteyli 1 mL Ketamin (100 mg / mL), 1.5 mL Ksilazin (20 mg / mL) ve2.5mL H 2 O ile yapılabilir. anestezik kokteyl enjeksiyonları, hayvan ağırlığındaki 30-45 g aralığına bağlı olarak 0.05-0.1 mL arasında değişecektir.
3. İlaç enjeksiyonu ve hayvan hazırlığı
- Hayvanı bir elinizde tutun, bacakları aşağıda tuttuğunuzdan emin olun.
- Hayvanın göğüs kemiğini, omurgasını hissedin. Omurganın her iki tarafında meme kası olacaktır.
- Cilde 5 mm nüfuz etmek için 29-G iğne ve şırınga kullanın ve Ketamin / Ksilazin kokteylini meme kasına enjekte edin. Hayvan ağırlığına göre 0,05-0,1 mL arasında enjekte edin.
- Enjeksiyondan sonra hayvanı tekrar inkübatöre yerleştirin. Anestezik etkili olduğu için hayvanın vücut ısısını birkaç dakika koruyun.
- Hayvanın ayak parmağını sıkıştırmak için forseps kullanın ve boynun gevşek olup olmadığını kontrol edin. Refleks ve topallayan bir boyun yoksa, hayvan bilinçsizdir.
- Kanat tüylerini kullanarak tavuğun cinsiyetini belirleyin. Tüylerin hepsi aynı uzunluktaysa, hayvan erkektir. Tüylerin uzunluğu değişirse, hayvan dişi30'dur.
NOT: Hayvanı cinsiyetlendirmenin bir başka yöntemi havalandırmadır. Erkek cinsel organı kloak31'de görülebilir. Bu yöntem çok zordur ve doğru yapılmazsa hayvana zarar verebilir. Kanat tüyü yönteminin kullanılması tavsiye edilir. - Pamuk uçlu bir aplikatör ile tüy dökücü kremi baş ve boyun bölgesine, özellikle de kuş için kulak açıklığının yakınında uygulayın.
- Tüyleri, kalan tüy dökücü kremleri ve baş ve boyundaki cildi silmek için% 70 izopropil alkollü mendil kullanın.
- Subdermal elektrotları ve rektal probu sterilize etmek için% 70 izopropil alkol mendili kullanın.
- Hayvanı ses yalıtımına ve elektrik korumalı bir odaya yerleştirin. En iyi kayıtlar için ortamın minimum elektriksel ve akustik gürültüye sahip olduğundan emin olun.
NOT: Buradaki deneyler, 24 x 24 x 25 inç boyutlarında özel bir ses yalıtımlı muhafazada yapılmıştır. Akustik gürültüyü ve alternatif elektrik akımından kaynaklanan elektrik gürültüsünü (Amerika Birleşik Devletleri'nde 60 Hz) ortadan kaldıran herhangi bir oda veya oda yeterlidir. - Hayvan vücut ısısını korumak için bir ısıtma yastığı veya sıcaklık kontrol sistemi kullanın.
- Hayvanın sıcaklığının 37-41 °C (98,6-105 °F)32,33 arasında tutulmasını sağlamak için yağlanmış rektal probu takın.
NOT: Prob yanlış bir boyuttaysa, hayvan sıcaklık probunun üzerine yerleştirilebilir. - İstenmeyen hareketleri önlemek için hayvanın kafasını yerine sabitleyin veya gagayı bir nesneye yaslayın. Bu, solunum engellenmemişse kilin modellenmesiyle yapılabilir.
- Hayvan test sırasında bilincini yeniden kazanmaya başlarsa, orijinal dozajın yarısı olan ek bir anestezik kokteyl enjeksiyonu uygulayın.
NOT: Herhangi bir vücut hareketi veya seslendirme, ek bir dozajın uygulanması gerektiğinin bir işaretidir. Küçük gaga hareketleri nefes almayı gösterir ve kabul edilebilir.
4. Elektrot yerleştirme
- Aşağıdaki isimlere sahip üç paslanmaz çelik, gümüş klorür iğne elektrodu kullanın: referans elektrodu, aktif elektrot ve ortak topraklama elektrodu.
NOT: Referans elektrodu ters çevirme veya "-" olarak da adlandırılır. Aktif elektrot ayrıca ters çevrilmeyen veya "+" olarak da adlandırılır. - Her elektrodu dermal altı olarak kafaya yerleştirin, ancak kafatasına nüfuz edecek kadar derin değil. 7 mm uzunluğunda ve 0,4 mm çapında elektrotlar kullanın.
- Elektrodu deriden dışarı doğru dürtün, ucu açığa çıkarın. Bu, ciltle teması en aza indirmeye ve hayvanlar arasında tutarlı yerleştirme derinliği sağlamaya yardımcı olur34.
NOT: Elektrot teli, elektrodu yerleştirdikten sonra, onu dışarı çekecek veya cildi gerginleştirecek herhangi bir gerginlik olmayacak şekilde yeterli gevşekliğe sahip olmalıdır. - Tek kanallı kayıt için, aktif elektrodu orta hatta kafatasının üstüne, kulak kanalına kadar kaudal olarak yerleştirin.
- Referans elektrodunu, uyaranın verileceği kulağın arkasına yerleştirin ve toprak elektrodunu boyundaki kontralateral kulak kanalının arkasına yerleştirin.
NOT: Hayvanın kafatasında veya kulak kanalında ameliyat yapıyorsanız, referans elektrodu hayvanın orta hattındaki boynuna yerleştirin. Hem bu hem de adım 4.4.1, yatay elektrot kayıt montajları olarak kabul edilir.
- Referans elektrodunu, uyaranın verileceği kulağın arkasına yerleştirin ve toprak elektrodunu boyundaki kontralateral kulak kanalının arkasına yerleştirin.
- İki kanallı kayıt için, iki negatif elektrot ve adaptör kablosu gerektiren birleşik bir pozitif elektrot kullanın. Zemin elektrodunu subdermal olarak boyuna ve her kulak kanalının arkasına bir referans elektrodu yerleştirin.
- Elektrot empedansını kontrol edin. Genel elektrot empedansının 5,0 kΩ'yi geçmediğinden emin olun. Elektrotlar arası empedansı 3,0 kΩ'un altında tutun.
5. ABR kaydı
- Edinme donanımına ve yazılımına bağlı olarak, kullanılan uyaran frekansları arasında doğru ses seviyeleri için kalibrasyon yaptığınızdan emin olun.
NOT: Kalibrasyon teknikleri ekipmana göre değişiklik gösterir (tartışmaya bakın). Bazı programlar için, ses zayıflaması yazılım içinde düzenlenebilir. Burada gerçekleştirilen kalibrasyon prosedürleri, civciv kulak kanalına (~ 5 mm) yaklaşan kapalı bir ataşman değiştirici sistemi içindeki frekans uyaranlarını kaydetmek için 1/8 inç B & K 4138 kondansatörlü mikrofon kullanılmasını içeriyordu. Ek Tablo olarak tavuk kuluçka kalibrasyon tablosu sağlanmaktadır. - Ses dönüştürücü aparatını hayvanın aktif kulağına doğru hareket ettirin. Ses dönüştürücüsünü kulak kanalında 2 mm'lik sığ bir derinliğe yerleştirin.
NOT: Ses dönüştürücüsüne bağlı olarak, plastik bir spekulum takılabilir ve kulak kanalına yerleştirilebilir. Spülüm yerleşimi kritiktir. Ses kanal duvarı tarafından engellenirse veya kulak kanalı kıstırılırsa, ABR'ler yoktur veya eşikte ~ 40 dB'lik bir kaymaya benzeyecektir. - Test sırasında sonuçların anormal veya eksik görünüp görünmediğini kontrol edin. Öyleyse, ses dönüştürücüyü kulak kanalında yeniden konumlandırın.
NOT: Cilt gevşek olduğundan ve hayvan hareketi mümkün olduğundan, spekulum yerleşimi kayıt sırasında değişebilir. Ancak doğru anestezik enjeksiyon ve hayvanın tamamen bilinçsiz olması ile kayıt 30-45 dakika kesintisiz devam edebilir.
6. Veri toplama
- Ses uyaranları üretmek ve ABR kayıtlarını kaydetmek / elde etmek için yeterli ekipman / yazılım kullanın.
NOT: ABR edinimi için piyasada bulunan veya özel birçok sistem vardır. Bu deneyler için, piyasada bulunan Akıllı İşitme Sistemleri (IHS) SmartEP USB platformu kullanıldı. Kayıt parametrelerini manipüle etme yeteneği kritiktir; bunlar uyaran yoğunluğu, uyaran uzunluğu, uyaran frekansı, uyaran sunum hızı, yüksek geçiş ve düşük geçiş filtresi, artefakt reddi, süpürme sayısı, örnekleme hızı, zarf şekli ve uyaran polarizasyonunu içerir, ancak bunlarla sınırlı değildir. - Yapı reddetme (AR) üst ve alt sınırlarını ±25 μV olarak ayarlayın, böylece süpürme sırasında hayvan hareketi veya gürültüsü bu süpürmeyi analizden hariç tutacaktır. Test edilen popülasyon genelinde, toplam taramaların% 1'inden azı eserler nedeniyle reddedildi.
- Büyük bir ortalama yanıt elde etmek için en az 1024 tarama toplayın. Bu, her biri 512 taramadan oluşan iki kayıtta yapılabilir. Bu aynı zamanda yanıtın uyaran tarafından uyarılmış ve tekrarlanabilir olmasını sağlar.
- Kazancı 100.000'e, düşük geçişli filtreyi 100 Hz'e ve yüksek geçiş filtresini 3000 Hz'ye ayarlayın.
NOT: Düşük ve yüksek geçirgen filtre ayarları, IHS sistemini kullanan kayıtlar için en uygunuydu. Bu nedenle, bu parametreler önerilerdir. BIOSIG yazılımını kullanan diğer kuş türlerindeki ABR kayıtları, sinyali 30 ila 3000 Hz 5,13,14,16,22 arasında filtreledi. - Uyaran sunum hızını saniyede 10 ila 20 uyaran arasında ayarlayın. Yüksek sunum hızları, özellikle daha sonraki zirveler için ABR tepe gecikmesini değiştirir13. Düşük sunum oranları, ABR'yi elde etmek için gereken süreyi artıracaktır.
- Tıklama uyarıcısının süresini 100 μs olarak ayarlayın.
- Bir ton patlaması uyaranı kullanıyorsanız, uyaranın sıklığını ve süresini istenen etkiye göre düzenleyin. Ton patlaması uyaranları için 100-4000 Hz aralığı kullanılmıştır, ancak yetişkin tavuklarda davranışsal işitme aralığı 2-9000 Hz35 arasında değişmektedir.
NOT: IHS sisteminde, bir ton patlaması uyaranının yükselme ve düşme süresi ancak spektral zarf şekli bir yamuk ise değiştirilebilir. Bununla birlikte, kosinüs kareli ve Blackman zarfları, hayvan ABR deneylerinde yaygın olarak kullanılan önceden ayarlanmış bir yükselme ve düşme süresi sağlar. IHS sistemi, uygun yükselme ve düşme sürelerini sağlamak için bir ton patlamasının spektral zarfını görüntüleyebilir. Bir tıklama uyarıcısının yükselme ve düşme zamanı IHS'de düzenlenemez.
- Bir ton patlaması uyaranı kullanıyorsanız, uyaranın sıklığını ve süresini istenen etkiye göre düzenleyin. Ton patlaması uyaranları için 100-4000 Hz aralığı kullanılmıştır, ancak yetişkin tavuklarda davranışsal işitme aralığı 2-9000 Hz35 arasında değişmektedir.
- En iyi çözünürlükteki veriler için örnekleme hızını izin verilen en yüksek değere (genellikle 40 kHz) ayarlayın.
NOT: IHS dahil olmak üzere bazı sistemler sınırlı sayıda örnekleme noktası kullanır ve kayıt penceresinin uzunluğunu değiştirir. 40 kHz (25 μs dönem) örnekleme hızı yalnızca 12 ms'lik bir kayıt penceresine izin verebilir, bu nedenle bir ton patlaması ABR'sini yakalamak için 24 ms'lik bir kayıt penceresine izin vermek için 20 kHz'lik bir örnekleme hızı (50 μs periyodu) kullanılmıştır. Tıklama ve ton patlaması ABR'lerini doğrudan karşılaştırıyorsanız, aynı çözünürlüğü korumak için örnekleme hızını sabit tutun. - Uyaran polarizasyonunu dönüşümlü olarak ayarlayın. Bu, koklear mikrofonik kameranın ABR kayıtlarından görselleştirilmesini ortadan kaldırmak için yapılır. Koklear mikrofonik mikrofoniği görselleştirmek için, uyaran polaritesi için nadir veya yoğuşma kullanın.
NOT: Uyaranlar seçilirken birçok ayar değiştirilebilir. Sağlanan kazanç ve filtre ayarları diğer ekipman kurulumları için ideal olmayabilir. Çoğu ABR makinesindeki fabrika varsayılanları, yavru tavukta kayıt için ayarlanmamıştır. - 512 süpürme kaydediyorsanız, 1024 süpürme ortalaması oluşturmak için iki ayrı testi birleştirin.
- Bir tıklama veya ton patlaması uyaranı için, eşik üstü yoğunlukta bir ABR edinin.
- Uyandırılan yanıt artık tanımlanamayana kadar daha düşük ve daha düşük yoğunluklarda kayda devam edin.
- ABR eşiğini, tespit edilebilir bir uyarılmış yanıt ortaya çıkaran en düşük uyaran yoğunluğu olarak tanımlayın. Tespit edilebilir bir zirve ortaya çıkaran en düşük uyaran yoğunluğunu bulmak için uyaran yoğunluğunu 5 dBSPL'lik adımlarla azaltın.
7. Ötenazi ve deney sonu
- ABR'ler edinildikten sonra, aşırı dozda (0.1 mL) ötenazi çözeltisi hazırlayın (Pentobarbital Sodyum 390 mg / mL Fenitoin Sodyum 50 mg / mL).
- Refleks olmadığını doğrulamak için bir ayak parmağı tutamağı kullandıktan sonra, ötenazi solüsyonunu meme kasına 5 mm derinlikte 29-G'lik bir iğne ile enjekte edin. Enjeksiyon tekniği anestezik enjeksiyon ile aynıdır.
NOT: Hayvanın süresi birkaç dakika sonra dolacaktır. Hiçbir hareket tespit edilmeyene kadar hayvanı manipüle etmeyin veya kafasını kesmeyin. Alternatif bir ötenazi tekniği, kanat altındaki brakiyal vende intravenöz enjeksiyon yapmaktır. - Hayvan refleksif olmadığında ve nefes alma ve kalp atışı durduğunda, keskin makas veya makasla hızla kafasını kesin.
- Isıtma yastığını, rektal probu ve gümüş klorür elektrotlarını %70 izopropil alkollü mendillerle temizleyin.
- Edinilen tüm izlerin kaydedildiğinden emin olun. Daha fazla analiz için, dosyaları not defterinde görüntülenebilen veya bir e-tabloya aktarılabilen .txt dosyaları olarak dışa aktarın.
Sonuçlar
Yavru civcivler için temsili ABR kayıtları
Aşağıdaki temsili ve popülasyon sonuçları, 43 hayvanda yapılan ABR kayıtlarından gelmektedir. Bir eşik üstü tıklama uyaranına (75 dBSPL) yanıt olarak, tüm yavrularda sürekli olarak üç pozitif giden tepe noktası gözlenmiştir. Bu zirveler, uyaran başlangıcından 6 ms sonra meydana geldi. Nadiren, ~ 6 ms'de dördüncü bir tepe noktası da gözlendi. Kuşlarda ABR zirvelerinin tanımlanması hayvanlar arasında değişirken (tartışmaya bakınız), zirveler Roma rakamsal Dalgaları I-IV olarak etiketlenmiş ve tanımlanmıştır. Etiketli zirvelere sahip temsili bir ABR dalga formu Şekil 1A'da gösterilmiştir (üst iz). Şekil 1B , temsili izlemede etiketlenmiş Dalga I ve III için gecikme-yoğunluk fonksiyonunu göstermektedir. Dalga I tepe gecikmesi, uyaran yoğunluğundaki her 20 dB'lik azalma için ~ 0,3 ms arttı. Ortalama olarak, I-III Dalgaları 75 dBSPL'de sırasıyla 1.50 ms (±0.02 ms), 3.00 ms (±0.06 ms) ve 4.13 ms (±0.09 ms) olarak meydana geldi (Şekil 1C). Dalga I ve Dalga III her zaman tekil bir zirve olarak sunuldu. Dalga II için zaman zaman 2.5-3.2 ms arasında çoklu küçük pikler görülmüştür. Her zirvenin karşılık gelen bir oluğu vardı ve tüm zirvelerin en büyüğü olan Dalga I'in tepeden oluğa genliği ortalama 7 μV idi ve 75 dB SPL'de maksimum 11 μV genliğe yaklaştı.
En büyük genliğe ek olarak, civciv ABR'nin I. Dalgası, hayvanlar arasında pik gecikmesinde en az değişkenlik gösterdi. Bu nedenle, bu tepe noktası işitme eşiği hassasiyetini tahmin etmek için kullanılmıştır. ABR eşikleri, tanımlanabilir ve tekrarlanabilir bir dalga formu zirvesi ortaya çıkaran en düşük uyaran yoğunluğu olarak tanımlandı. Bu, deneyci tarafından öznel olarak belirlendi ve eşik anlaşması için ikinci bir deneyci tarafından çapraz kontrol edildi. Tıklama uyaranları kullanılırken zirveler daha iyi tanımlanmış ve tanımlanması daha kolaydı, ancak ton patlamaları ayrıca uyaran frekansına ve parametrelerine bağlı olarak değişen tanımlanmış ve tanımlanabilir zirveler üretti (Şekil 1D, n = 4 civciv). Tıklama ile uyarılan ABR eşiği, 1000 Hz hariç, ton patlaması uyandırılan eşikten daha düşüktü. Tanımlanabilir pikler >30 dBSPL göstermeyen tıklama ile uyarılmış ABR'ler genellikle spekulumun hayvan hareketi nedeniyle kulak kanalından çıkmasının bir sonucuydu.
Azalan vücut ısısı ABR gecikme sürelerini artırır
Nöral aktivitenin hızının - bir dalga formu genliğinin (yani gecikmenin) tepe noktası oluşumu ile ölçüldüğü gibi - daha düşük vücut sıcaklıklarında36,37 azaldığı bilinmektedir. Bu fenomen, kuluçkalık tavuk ABR'lerinde 75 dBSPL tıklama uyarıcısı kullanılarak gözlenmiştir. Temsili bir iz Şekil 2A'da gösterilmiştir. Vücut ısısı 39 ° C'den düştüğünde, ABR zirvelerinin gecikmesi, aynı uyaran yoğunluğu seviyesine rağmen, daha sonra meydana geldi. Şekil 2B, temsili iz için daha düşük vücut sıcaklıklarının bir fonksiyonu olarak Dalga I ve III'ün gecikmesini göstermektedir. Düşük vücut sıcaklıkları ile Dalga I tepe gecikmesinin oluşumu arasında güçlü bir korelasyon (R2 = 0.89) vardı (Şekil 2C, n = 5 civciv). Bu sonuçlar, ABR kayıtları sırasında normale yakın bir vücut ısısının korunması ihtiyacını göstermektedir. Normale yakın vücut ısısı korunmazsa, ABR'nin gecikme yoğunluğu fonksiyonları ve genlik ölçümleri oldukça değişkendir ve genellikle yanlıştır.
Erken yavrularda gecikme ve genlik farklılıkları
Araştırmalar, civciv için işitme başlangıcı ile ilgili nöral aktivitenin, geç embriyonik yaşlarda8 yaşlarında olgunlaşmaya yakın olduğunu göstermiştir. Bununla birlikte, çok erken yavruların bir alt kümesi için (<3 saat yumurtadan çıktıktan sonra), 75 dB'lik bir SPL tıklama uyaranına yanıt olarak ABR dalga formlarının (n = 4) tepe gecikmeli bir kaymasını gözlemledik veya uyarılmış potansiyeller tanımlanamadı (n = 2 civciv). 2 genç yavruda, hiçbir ton patlaması ABR elde edilemedi ve tıklama eşikleri 50 dBSPL yükseltildi. Bunun nedeni, hayvanın kulak kanalında / orta kulak boşluğunda hala sıvı bulunan iletken bir sorundan veya az gelişmiş bir nöral bileşenden kaynaklanıyor olabilir. Memeli çalışmaları, yenidoğanlarda38,39 dB'lik eşik kaymaları bildirmiştir. Burada kullanılan temsili hayvanlar >3 saat yaşındaydı ve bu da tüylerin kuruması için gereken sürenin uzunluğuna denk geliyordu. Şekil 3A, genç (P1, <3 saat yaş) ve yaşlı yavrulardan (P2) kaydedilen ABR'leri göstermektedir. Analiz için, sadece 3 genç yavru, üç ABR zirvesinin hepsiyle birlikte sunuldu. Pik dalga formu gecikmeleri önemli ölçüde uzamış ve dalga formu genlikleri yaşlı yavrulara kıyasla biraz azalmıştır (sırasıyla Şekil 3B-C).
Referans elektrot yerleştirme ve iki kanallı ABR kayıtları
Şekil 4'te, referans elektrot yerleşimi 2 farklı konum arasında değiştirildi, ancak yine de karşılaştırılabilir ABR kayıtlarıyla sonuçlandı. Aynı hayvandaki 75 dBSPL tıklama izi ile iki referans elektrot yerleşimi arasındaki karşılaştırma, tepeden oluğa dalga formu genliklerinde ve tepe dalga formu gecikmelerinde minimum farklılıklar göstermiştir (Şekil 4A). Mastoid yerleşimi metodolojik olarak, referans elektrodu mastoid veya pinna üzerine yerleştiren memeli ABR deneyleri gibiydi. Referans elektrodu için bir boyun yerleşimi kullanmak, her iki kulakta manipülasyon veya ameliyat yapılmışsa faydalı olacaktır. İlginç bir şekilde, mastoid yerleşimi için Wave II tepe genliği (kırmızı iz), boyun yerleşimi için Wave II zirvesinden 1 ms sonra meydana geldi (siyah iz). Bu zaman farkı muhtemelen elektrot yerleşimine göre ABR nöral üretiminin bölgelerini yansıtır.
İki kanallı bir kurulum kullanılarak, hem sol hem de sağ kulaklar için ABR'ler elde etmek için bir aktif kayıt elektrodu (kafa yerleşiminin üst kısmı) ve iki referans elektrodu (mastoid yerleşimler) kullanılmıştır (Şekil 4B). İki kulak arasındaki tepkiler benzerdi, muhtemelen kulaklık konumlandırmasından dolayı tepe genliklerinde küçük değişiklikler oldu. Hem sol hem de sağ kulağın eşdeğer olmasının gecikmesi, yavru tavukta hem kulakların hem de beyin sapı yarımkürelerinin eşit derecede sağlıklı işlevini destekledi. İki kanallı kayıt montajı, binoral ABR'ler için de kullanılabilir, ancak bu kayıtlar için gerekli olan ek hususlar olacaktır.

Şekil 1: Yavru civcivlerin tıklama ve ton uyandırılmış uyaranlara temsili kayıtları . (A) Farklı uyaran yoğunluk seviyelerinin bir fonksiyonu olarak bir yavru civcivden (P2) temsili ABR kayıtları. Mikrovoltlarda (μV) üç ila dört pozitif pik, uyaran başlangıcından sonraki 6 ms içinde tanımlanabilir (zaman = 0 ms). Dalgalar Roma rakamları kullanılarak tanımlandı. Tepeden oluğa genlikler daha düşük uyaran yoğunluğu seviyelerinde azalır. (B) (A)'da gösterilen temsili iz için Dalga I ve III'ün gecikme-yoğunluk fonksiyonları. Sadece bu zirveler analiz edildi, çünkü Dalga II tipik olarak <45 dBSPL yoğunluklarında gözlenmedi. (C) Tıklama ile uyarılan ABR tepe dalga formlarının gecikmesi (n = 43 civciv). Hata çubukları, ortalamanın (SEM) standart hatasını gösterir. (D) Üç farklı frekansta dört yavru civciv için ortalama ton uyarılmış ABR'ler (siyah izler). Kırmızı izler = ortalama standart hata (SEM) Uyaranlar = 75 dBSPL. Bu ve sonraki şekillerde, hata çubukları SEM'i gösterir ve sağ kulak uyarıcı kulaktı. (Her iki kulağın da uyarıldığı Şekil 4B için istisna). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Vücut sıcaklığının ABR kayıtları üzerindeki etkisi. (A) Vücut ısısının bir fonksiyonu olarak yavru bir civcivden (P2) temsili ABR kayıtları. Düşük vücut sıcaklıkları için, tepe dalga formu gecikmeleri artarken, tepeden oluğa genlikler nispeten değişmeden kaldı. (B) (A)'da gösterilen temsili izler için Dalga I ve III'ün gecikme-sıcaklık fonksiyonu. (C) 5 civciv için gecikme süresi ve sıcaklık değişimleri arasındaki ilişkiyi gösteren popülasyon verileri (p < 0.01, R2 = 0.89). Benzer bir eğilim Waves II ve III için de gözlenmiştir (veriler gösterilmemiştir). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
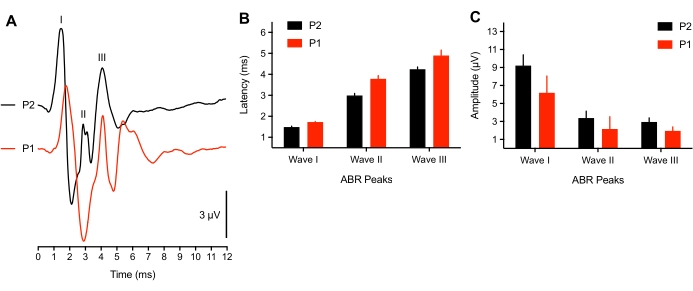
Şekil 3: ABR kayıtlarında yaşa bağlı farklılıklar. (A) P2 (siyah iz) ve P1'de (<3 saat yumurtadan çıktıktan sonra, kırmızı iz) temsili bir yavru civcivin temsili ABR kayıtları (üst üste binmiş). (B) Yaşın bir fonksiyonu olarak I, II ve III Dalgaları için tepe dalga formu gecikmeleri. Dalga I-III için gecikmeler yaşlar arasında anlamlı derecede farklıydı (P < 0.05, n = 6 civciv). (C) Yaşın bir fonksiyonu olarak I, II ve III dalgalarının tepeden oluğa dalga formu genlikleri. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
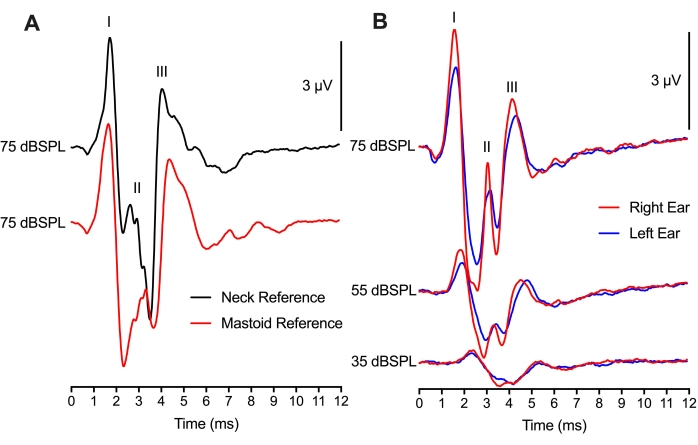
Şekil 4: Elektrot yerleşimi ve iki kanallı ABR kayıtları: (A) Boyuna (siyah iz) veya mastoide (kırmızı iz) yerleştirilen referans elektrot ile aynı yavru civcivden (P2) temsili ABR kayıtları (üst üste binmiş). Aktif elektrot, her iki elektrot kayıt montajı için kafatasının orta hattına yerleştirildi. Dalga I ve III'ün gecikmesi ve Dalga I ve III'ün genliği her iki durumda da neredeyse aynıdır. Dalga II'nin gecikmesi daha erkendir ve boyun dokusuna yerleştirilen elektrot için genlik daha büyüktür. (B) Sağ ve sol kulakları sırayla uyarırken iki kanallı kayıt. Aynı yavru civcivden (P2) temsili ABR kayıtları (üst üste binmiş), sol kulağın mastoidine (mavi izler) ve sağ kulağa (kırmızı izler) yerleştirilen referans elektrotları ile üç farklı yoğunluk seviyesinde. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Tablo: Tavuk kuluçka kalibrasyon tablosu. Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Kuşların işitsel beyin sapı iyi çalışılmıştır ve birçok yapı memeli işitsel yoluna benzer. İşitme siniri, iki birinci dereceden merkezi çekirdeğe, koklear çekirdek magnoselülaris (NM) ve açısal (NA) üzerine uyarıcı girdiler sağlar. NM, işitsel hedefi olan nucleus laminaris'e (NL)7 iki taraflı olarak uyarıcı bir projeksiyon gönderir. NL nükleus mesencephalicus lateralis, pars dorsalis (MLd)40,41'e yansıtır. NL ayrıca NM, NA ve NL42'ye geri besleme inhibisyonu sağlayan üstün olivary çekirdeğine (SON) de yansıtılır. Bu alt işitsel beyin sapı mikrodevresi, hizmet ettiği işlev, ses lokalizasyonu ve binaural işitme33 için zarif bir şekilde korunmuştur. Kuşun üst işitsel beyin sapı bölgeleri ayrıca memeli lateral lemniscusuna ve orta beyindeki inferior kollikulusa benzer çekirdeklere sahiptir. Bu benzerlikler göz önüne alındığında, kuş ABR'sinin işitsel orta beyine kadar olan bileşimi tüm omurgalılar arasında karşılaştırılabilir.
Birden fazla kuş türü, uyaran başlangıcını takiben 6 ms içinde üç pozitif tepe noktası gösterirken, ABR zirvelerinin merkezi işitsel yapılarla korelasyonu bazı değişkenliklere sahiptir. Dalga I'in periferik baziler papilla ve işitme sinirinden gelen ilk nöral yanıt olduğu ve bireyler arasında çok az değişkenlik gösterdiği makul olarak varsayılabilir (Şekil 1C). Sonraki Dalga tanımlaması daha az kesindir ve türler arasında farklılık gösterebilir. Kuokkanen ve ark.17 yakın zamanda peçeli baykuşun ABR'sinin Dalga III'ünün NL tarafından üretildiğini belirledi; Bu nedenle, Dalga II'nin koklear çekirdek20'nin NM ve NA'sından kaynaklandığını iddia etmek mantıklıdır. Bununla birlikte, baykuş Dalgası III, uyaran başlangıcından 3 ms sonra üretilen pozitif tepe noktası olarak tanımlandı. Bu, yavru tavuk ABR'sinde tanımlandığı gibi Wave II'ye karşılık gelir. Peçeli baykuş ABR'de dalgalar I ve II birleştirildi.
Yavru tavuk genellikle 6 ms içinde üç tepe noktası ile sunulurken, zaman zaman dördüncü bir tepe noktası gözlenmiştir (örneğin, bkz. Şekil 1A). Dördüncü bir dalgayı ve bazı durumlarda beş dalgalı bir tavuk ABR'sini desteklemek için popülasyon verilerine, daha büyük örneklem büyüklüğüne ve ek deneysel paradigmalara ihtiyaç duyulacaktır. En tutarlı bulgu, burada gösterilen üç tepe temsiliydi.
ABR, nöral senkronizasyonun bir ölçüsü olarak tanımlandığından, işitsel yolaktaki ana çekirdekler, ABR'deki her pozitif giden zirveyi temsil edebilir. İşitme sinirinden NM/NA'ya ve daha sonra NL'ye geçen sinyal, kuluçkalık tavuk ABR'sinde sırasıyla I, II ve III Dalgalarını tanımlayabilir. Ek olarak, tavuk ABR'sinin daha sonra meydana gelen dördüncü zirvesi, üst beyin sapı veya orta beyin işitsel yapısını temsil edebilir. Kuş ABR'lerinin karakterizasyonu, precocial ve altricial kuşlar arasındaki farkı da göz önünde bulundurmalıdır. İşitsel tepkilerin olgunlaşması türler arasında değişecektir ve ayrıca avcı davranışı ve / veya vokal öğrenme gibi diğer kritik özelliklerden de etkilenir4. Ne olursa olsun, tarif edilen yöntem ve teknikler çeşitli kuş ve omurgalı türlerine kolayca uygulanır.
Hayvan vücut ısısının korunmasının önemi Şekil 2'de gösterilmiştir. İç vücut ısısı düştükçe, ABR yanıtlarının gecikmesi aynı uyaran yoğunluğu seviyesi için artmıştır. Bu, vücut ısısı 32 ° C 36,37'nin altına düştüğünde daha belirgindir. ABR'deki kabaca 1 ms gecikme süresi artışı, tavuk23'te daha önce bildirilenden daha azdır. Bununla birlikte, Katayama23, soğutulan ve daha sonra 4 saatlik bir süre boyunca ısıtılan 12 günlük bir yavru kullandı. Şekil 2'deki veriler, soğutma işlemi sırasında 20 dakikalık bir süre boyunca kaydedilmiştir. En kaliteli ve en tutarlı kayıtları elde etmek için, hayvanın vücut ısısı korunmalı ve tüm kayıtlar hayvanlar arasında aynı fizyolojik sıcaklıkta yapılmalıdır.
Yaşın ABR üzerindeki etkisi hafiftir, ancak dikkate alınması önemlidir. ABR'nin sadece Dalga I ve II'sinin gecikmesi önemli ölçüde farklı olsa da, bunun nedeni kısmen Şekil 3'te sadece üç genç yavrunun kullanılmasıdır; diğer üçü tanımlanabilir üç ABR zirvesi ile mevcut değildi. ABR genliği ve eşik kaymaları, büyük örneklem boyutları kullanıldığında veya frekansa özgü ABR'lerin karşılaştırılmasında da belirgin olabilir. Yaşa bağlı bu etki, tavuğun orta kulağındaki sıvıdan kaynaklanabilir. Bu tür iletken değişiklikler, hem insan hem de diğer memeli modelleri için ABR eşiklerinde belirgin bir artışa yol açmaktadır38,39.
İki farklı kayıt montajı kullanılarak benzer tepkiler gözlenmiştir (Şekil 4A). En yaygın montaj, referans elektrodu uyaran alan kulağın arkasına yerleştirirken, referans elektrodunun boyun dokusunda olması, ABR'ye eşlik eden cerrahi müdahale varsa yararlı olabilir. Bununla birlikte, iki kanallı ABR kayıtları kullanılıyorsa, referans elektrotları ayrı ayrı ve simetrik olarak yerleştirilmelidir, bu da referans elektrodunu boyuna yerleştirirse zordur. Referans elektrodunun mastoid konumunun, kaydın mümkün olduğunca çok yönünü standartlaştırması önerilir. İki kanallı ABR kaydı, çok az ekstra hazırlık gerektiren etkili bir araçtır ve kulaklar arasında benzer tepkilerle sonuçlanır. Küçük genlik farklılıkları muhtemelen kulaklığın konumlandırılmasından kaynaklanıyordu. İki kanallı kayıt, deneysel olarak manipüle edilmiş bir kulak veya beyin yarımküresi ile bir kontrol arasında kolay karşılaştırma yapılmasını sağlar. Bu kurulum aynı zamanda binoral ABR'leri test etmek için de gerekli olacaktır. Tavuk ABR'sini kullanan gelecekteki deneyler, kayıt konfigürasyonları ve montajları34 ile ilgili önceki literatüre atıfta bulunabilir.
Bu metodoloji birkaç sınırlama ile birlikte gelir. Adım 5.1'de belirtildiği gibi, zayıf spekulum yerleşimi yanıt olarak 40 dBSPL kaymasına neden olabilir. Bu, manipüle edilmiş veya değiştirilmiş bir hayvanın yanlış yorumlanmasına neden olabilir. Aşağıdaki önlemler önerilir: manipüle edilmiş veya mutant modellerin ABR'lerini almadan önce büyük bir kontrol verisi örneği edinin. Kayıtlar arasında uyaran yoğunluğunu 20 dBSPL'den fazla azaltmayın. Genlik veya gecikme beklenenden daha fazla değişirse, hayvan ve spekulum pozisyonunu kontrol edin. Değişiklikleri gözlemlemek için ABR uyaranını tekrarlayın. Spekulum hareket etmişse, önceki testleri yeniden edinin. Diğer bir sınırlama ABR'lerin kalibrasyonudur. Ses basıncı seviyesini kaydetmek için uygun kalibrasyon olmadan, hayvana sunulan yoğunluk bilinmemektedir. Ses çıkışını ölçerken, deneysel kayıtta olduğu gibi aynı spekulumu ve hayvanın kulak kanalı uzunluğuna (~ 5 mm) yaklaşan bir boşluğun içinde küçük bir mikrofon kullanın. Kalibrasyonlar frekansa özgü olduğu için deneylerde kullanılan aynı ton frekanslarını ölçün. Hem donanım hem de yazılım sistemleri için kılavuz, kalibrasyon için talimatlarla birlikte gelebilir. Ayrıca, tıklama ve ton patlaması ABR'lerini43'ü iyileştirebilen doğrusal faz ve minimum faz filtreleri gibi ek filtreler de vardır. Bu filtreler bu çalışmada kullanılmamıştır. Bir ton patlaması spektral zarfının yükselme ve düşme süresinin, frekansın bir fonksiyonu olarak değişmesi veya tıklama uyaranlarının yükselme ve düşme zamanının değişmesi gibi ek hususlar da incelenmemiştir. Bunlar, güvenilir ve tutarlı ABR'ler elde edilebildiğinde gelecekteki iyi araştırmalardır.
Yavru tavuğun diğer kuş modelleriyle karşılaştırılması umut vericidir. Muhabbet kuşları ve doğu çığlık baykuşları da ABR 13,22'nin ilk 6 ms'sinde üç pozitif mikrovolt zirvesi gösterir. Farklı ağaçkakan türlerinde, üç tepe noktası da görülür, ancak gecikmeleri daha sonra zamandır. Ek olarak, ağaçkakanlardaki en iyi frekans duyarlılığı aralığı 1500 ila 4000 Hz arasındadır, bu da tavuğun 1000 Hz'deki en iyi eşiğinden biraz daha yüksektir. Yetişkin tavukta, en iyi hassasiyet 2000 Hz35'tir, bu nedenle tavuk yavruları yetişkinlere dönüştükçe yüksek frekansların duyulması daha iyi olabilir. Bu gelişme, hayvanın altrisiyal veya erken gelişimini dikkate alarak kuş türleri arasında farklılık gösterecektir4.
Burada özetlenen deneysel yöntemler, hangi faktörlerin işitsel yanıtlarda ve eşiklerde ve ayrıca embriyonik gelişimin farklı aşamalarındaki çalışmalarda zararlara veya değişikliklere yol açtığını belirlemeye yardımcı olabilir. Genetik manipülasyon, yaşlanma ve gürültüye maruz kalma, hayvanlarda ve diğer kuş modellerinde bilinen manipülasyonlardır24,25,44,45. Bu yöntemler, in-ovo elektroporasyonu gibi tekniklerin, işitsel beyin sapının bir tarafında fokal ve geçici olarak kontrol edilen proteinlerin ekspresyonuna izin verdiği için tavuk modeline genişletilmelidir12,46. Bu, ABR'lerin genetik olarak manipüle edilmiş kulaktan kontralateral kontrol kulağına iki kanallı bir kayıt paradigması kullanılarak doğrudan karşılaştırılmasına izin verir.
Genel olarak, yavru tavukların ABR'si, insan ve diğer memeli modellerinde işitme fonksiyonu ölçümleriyle neredeyse aynı olan yararlı bir araştırma yöntemidir. Aynı zamanda invaziv olmayan, in-vivo bir metodolojidir. Anestezik enjeksiyon ve birkaç milimetrelik subdermal elektrot yerleştirilmesi dışında, başka hiçbir fiziksel manipülasyona gerek yoktur. Bir yavru, uygun bir ortamda tutulursa, teorik olarak günler veya haftalar süren gelişimsel bir zaman dilimi boyunca birçok kez test edilebilir. Bu protokol sadece yavru tavuk ABR'si için gerekli adımları ve kayıt parametrelerini ortaya koymakla kalmaz, aynı zamanda işitsel beyin sapı fonksiyonuna daha fazla test yapılmasını sağlayabilecek bir kuş ABR'sinin özelliklerini de önerir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma NIH/NIDCD R01 DC017167 tarafından desteklenmektedir
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1/8 inch B&K Microphone | Brüel & Kjær | 4138 | Type 4138-A-015 also works |
| Auditory Evoked Potential Universal Smart Box | Intelligent Hearing Systems | M011110 | |
| Custom Sound Isolation Chamber | GK Soundbooth Inc | N/A | Custom built |
| DC Power Supply | CSI/Speco | PSV-5 | |
| ER3 Insert Earphone | Intelligent Hearing Systems | M015302 | Used as sound transducer |
| Euthasol | Virbac | 710101 | Controlled Substance; euthanasia solution |
| Insulin Syringe (29 G) | Comfort Point | 26028 | |
| Ketamine | Covetrus | 11695-0703-1 | Controlled Substance |
| Power Supply | Powervar | 93051-55R | |
| Rectal Probe | YSI | 401 (10-09010) | Any 400 series probe will work with the YSI temperatuer monitor |
| Subdermal needles | Rhythmlink | RLSND107-1.5 | |
| Temperature Monitor | YSI | 73ATA 7651 | Works with any 400 series rectal probe |
| Xylazine | Anased | 59399-110-20 | Used with ketamine and water for anesthetic |
Referanslar
- Wever, E. G., Bray, C. W. Action currents in the auditory nerve in response to acoustical stimulation. Proceedings of the National Academy of Sciences of the United States of America. 16 (5), 344-350 (1930).
- Jewett, D. L., Williston, J. S. Auditory-evoked far fields averaged from the scalp of humans. Brain. 94 (4), 681-696 (1971).
- Corwin, J. T., Bullock, T. H., Schweitzer, J. The auditory brain stem response in five vertebrate classes. Electroencephalography and Clinical Neurophysiology. 54 (6), 629-641 (1982).
- Carey, C. Avian Growth and Development. Evolution within the Altricial Precocial Spectrum. , Oxford University Press. Oxford. (1998).
- Kraemer, A., Baxter, C., Hendrix, A., Carr, C. E. Development of auditory sensitivity in the barn owl. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 203 (10), 843-853 (2017).
- Rebillard, G., Rubel, E. W. Electrophysiological study of the maturation of auditory responses from the inner ear of the chick. Brain Research. 229 (1), 15-23 (1981).
- Parks, T. N., Rubel, E. W. Organization and development of brain stem auditory nuclei of the chicken: organization of projections from n. magnocellularis to n. laminaris. Journal of Comparative Neurology. 164 (4), 435-448 (1975).
- Hong, H., Rollman, L., Feinstein, B., Sanchez, J. T. Developmental profile of ion channel specializations in the avian nucleus magnocellularis. Frontiers in Cellular Neuroscience. 10, 80(2016).
- Leao, R. M. The ion channels and synapses responsible for the physiological diversity of mammalian lower brainstem auditory neurons. Hearing Research. 376, 33-46 (2019).
- Oline, S. N., Ashida, G., Burger, R. M. Tonotopic optimization for temporal processing in the cochlear nucleus. Journal of Neuroscience. 36 (32), 8500-8515 (2016).
- Kopp-Scheinpflug, C. Your genes decide what you are listening to. Channels. 11 (5), 355-356 (2017).
- Sid, H., Schusser, B. Applications of gene editing in chickens: A new era is on the horizon. Frontiers in Genetics. 9, 456(2018).
- Brittan-Powell, E. F., Dooling, R. J., Gleich, O. Auditory brainstem responses in adult budgerigars (Melopsittacus undulatus). The Journal of the Acoustical Society of America. 112 (3), Pt 1 999-1008 (2002).
- Lohr, B., Brittan-Powell, E. F., Dooling, R. J. Auditory brainstem responses and auditory thresholds in woodpeckers. The Journal of the Acoustical Society of America. 133 (1), 337-342 (2013).
- Counter, S. A. Brain-stem evoked potentials and noise effects in seagulls. Comparative Biochemistry and Physiology. A, Comparative Physiology. 81 (4), 837-845 (1985).
- Crowell, S. E., et al. A comparison of auditory brainstem responses across diving bird species. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 201 (8), 803-815 (2015).
- Noirot, I. C., Brittan-Powell, E. F., Dooling, R. J. Masked auditory thresholds in three species of birds, as measured by the auditory brainstem response (L). Journal of the Acoustical Society of America. 129 (6), 3445-3448 (2011).
- McGee, J., et al. Auditory performance in bald eagles and red-tailed hawks: a comparative study of hearing in diurnal raptors. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 205 (6), 793-811 (2019).
- Brittan-Powell, E. F., Dooling, R. J., Ryals, B., Gleich, O. Electrophysiological and morphological development of the inner ear in Belgian Waterslager canaries. Hearing Research. 269 (1-2), 56-69 (2010).
- Kuokkanen, P. T., Kraemer, A., Kempter, R., Koppl, C., Carr, C. E. Auditory brainstem response wave iii is correlated with extracellular field potentials from nucleus laminaris of the barn owl. Acta Acustica United with Acustica. The Journal of the European Acoustics Association (EEIG). 104 (5), 874-877 (2018).
- Beatini, J. R., Proudfoot, G. A., Gall, M. D. Frequency sensitivity in Northern saw-whet owls (Aegolius acadicus). Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 204 (2), 145-154 (2018).
- Brittan-Powell, E. F., Lohr, B., Hahn, D. C., Dooling, R. J. Auditory brainstem responses in the Eastern Screech Owl: an estimate of auditory thresholds. The Journal of the Acoustical Society of America. 118 (1), 314-321 (2005).
- Katayama, A. Postnatal development of auditory function in the chicken revealed by auditory brainstem responses (ABRs). Electroencephalography and Clinical Neurophysiology. 62 (5), 388-398 (1985).
- Durham, D., Park, D. L., Girod, D. A. Breed differences in cochlear integrity in adult, commercially raised chickens. Hearing Research. 166 (1-2), 82-95 (2002).
- Kaiser, C. L., Girod, D. A., Durham, D. Breed-dependent susceptibility to acute sound exposure in young chickens. Hearing Research. 203 (1-2), 101-111 (2005).
- Hamdy, A. M., Vander Hel, W., Henken, A. M., Galal, A. G., Abd-Elmoty, A. K. Effects of air humidity during incubation and age after hatch on heat tolerance of neonatal male and female chicks. Poultry Science. 70 (7), 1499-1506 (1991).
- Bruzual, J. J., Peak, S. D., Brake, J., Peebles, E. D. Effects of relative humidity during the last five days of incubation and brooding temperature on performance of broiler chicks from young broiler breeders. Poultry Science. 79 (10), 1385-1391 (2000).
- vander Pol, C. W., van Roovert-Reijrink, I. A. M., Maatjens, C. M., vanden Brand, H., Molenaar, R. Effect of relative humidity during incubation at a set eggshell temperature and brooding temperature posthatch on embryonic mortality and chick quality. Poultry Science. 92 (8), 2145-2155 (2013).
- Buhr, R. J. Incubation relative humidity effects on allantoic fluid volume and hatchability. Poultry Science. 74 (5), 874-884 (1995).
- Galli, R., et al. Sexing of chicken eggs by fluorescence and Raman spectroscopy through the shell membrane. PLoS One. 13 (2), 0192554(2018).
- Otsuka, M., Miyashita, O., Shibata, M., Sato, F., Naito, M. A novel method for sexing day-old chicks using endoscope system. Poultry Science. 95 (11), 2685-2689 (2016).
- Kaiser, A. The ontogeny of homeothermic regulation in post-hatching chicks: its influence on the development of hearing. Comparative Biochemistry and Physiology. A, Comparative Physiology. 103 (1), 105-111 (1992).
- Kuba, H., Yamada, R., Ohmori, H. Evaluation of the limiting acuity of coincidence detection in nucleus laminaris of the chicken. The Journal of Physiology. 552, Pt 2 611-620 (2003).
- Shaheen, L. A., Valero, M. D., Liberman, M. C. Towards a diagnosis of cochlear neuropathy with envelope following responses. Journal of the Association for Research in Otolaryngology. 16 (6), 727-745 (2015).
- Hill, E. M., Koay, G., Heffner, R. S., Heffner, H. E. Audiogram of the chicken (Gallus gallus domesticus) from 2 Hz to 9 kHz. Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 200 (10), 863-870 (2014).
- Rossi, G. T., Britt, R. H. Effects of hypothermia on the cat brainstem auditory evoked response. Electroencephalography and Clinical Neurophysiology. 57 (2), 143-155 (1984).
- Doyle, W. J., Fria, T. J. The effects of hypothermia on the latencies of the auditory brainstem response (ABR) in the rhesus monkey. Electroencephalography and Clinical Neurophysiology. 60 (3), 258-266 (1985).
- Guan, X., Gan, R. Z. Effect of middle ear fluid on sound transmission and auditory brainstem response in guinea pigs. Hearing Research. 277 (1-2), 96-106 (2011).
- Ravicz, M. E., Rosowski, J. J., Merchant, S. N. Mechanisms of hearing loss resulting from middle-ear fluid. Hearing Research. 195 (1-2), 103-130 (2004).
- Wang, Y., Zorio, D. A. R., Karten, H. J. Heterogeneous organization and connectivity of the chicken auditory thalamus (Gallus gallus). Journal of Comparative Neurology. 525 (14), 3044-3071 (2017).
- Wang, Y., Karten, H. J. Three subdivisions of the auditory midbrain in chicks (Gallus gallus) identified by their afferent and commissural projections. Journal of Comparative Neurology. 518 (8), 1199-1219 (2010).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. Journal of Neuroscience. 30 (36), 12075-12083 (2010).
- Beutelmann, R., Laumen, G., Tollin, D., Klump, G. M. Amplitude and phase equalization of stimuli for click evoked auditory brainstem responses. The Journal of the Acoustical Society of America. 137 (1), 71-77 (2015).
- Liberman, M. C. Noise-induced and age-related hearing loss: new perspectives and potential therapies. F1000Research. 6, 927(2017).
- Efrati, A., Gutfreund, Y. Early life exposure to noise alters the representation of auditory localization cues in the auditory space map of the barn owl. Journal of Neurophysiology. 105 (5), 2522-2535 (2011).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments: JoVE. (124), e55628(2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır