Method Article
Avaliação da Resposta Auditiva do Brainstem em Filhotes de Frango
Neste Artigo
Resumo
Usamos técnicas padrão de resposta ao tronco cerebral (ABR) e aplicamos-as a galinhas filhotes, um modelo aviário precoce para função auditiva. O protocolo descreve detalhadamente as técnicas de preparação animal e aquisição da ABR, com etapas que podem se traduzir em outros modelos aviários ou roedores.
Resumo
A resposta auditiva do tronco cerebral (ABR) é um ensaio inestimável em audiologia clínica, animais não humanos e pesquisa humana. Apesar do uso generalizado de ABRs na medição da sincronia neural auditiva e na estimativa da sensibilidade auditiva em outros sistemas de modelos vertebrados, os métodos para o registro de ABRs no frango não foram relatados há quase quatro décadas. As galinhas fornecem um modelo robusto de pesquisa animal porque seu sistema auditivo está perto da maturação funcional durante estágios embrionários tardios e precoces de incubação. Demonstramos métodos usados para obter gravações de ABR de um ou dois canais usando matrizes de eletrodos de agulha subdérmica em filhotes de frango. Independentemente da configuração de gravação de eletrodo (ou seja, montagem), as gravações de ABR incluíram formas de onda de pico positivas de 3-4 nos primeiros 6 ms de um estímulo de clique suprathreshold. As amplitudes de forma de onda de pico para cocho variaram de 2-11 μV em níveis de alta intensidade, com picos positivos exibindo funções esperadas de intensidade de latência (ou seja, aumento da latência em função da diminuição da intensidade). A posição padronizada do fone de ouvido foi fundamental para gravações ideais, pois a pele solta pode ocluir o canal auditivo, e o movimento animal pode desalojar o transdutor de estímulo. As amplitudes de pico foram menores, e as latências foram mais longas à medida que a temperatura do corpo animal diminuiu, apoiando a necessidade de manter a temperatura fisiológica do corpo. Para filhotes jovens (<3 h pós-hatch dia 1), os limiares foram elevados em ~5 dB, as latências máximas aumentaram ~1-2 ms, e o pico para amplitudes de cocho foram diminuídos ~1 μV em comparação com os filhotes mais antigos. Isso sugere um problema potencial de condução (ou seja, fluido na cavidade do ouvido médio) e deve ser considerado para filhotes jovens. No geral, os métodos ABR aqui descritos permitem o registro preciso e reprodutível da função auditiva in vivo em filhotes de frango que poderiam ser aplicados a diferentes estágios de desenvolvimento. Tais achados são facilmente comparados com modelos humanos e mamíferos de perda auditiva, envelhecimento ou outras manipulações relacionadas ao auditivo.
Introdução
O estudo das respostas neurais evocadas a estímulos sonoros data de mais de meio século1. A resposta auditiva do tronco cerebral (ABR) é um potencial evocado que tem sido utilizado como uma medida de função auditiva tanto em animais não humanos quanto em humanos há décadas. A ABR humana apresenta cinco a sete picos de forma de onda convencionalmente rotulados por algarismos romanos (I-VII)2. Esses picos são analisados com base em sua latência (tempo de ocorrência em milissegundos) e amplitude (tamanho de pico para cocho em microvolts) das respostas neurais. A ABR é fundamental na avaliação da função e integridade do nervo auditivo, bem como da sensibilidade do tronco cerebral e do limiar auditivo. Os déficits no sistema auditivo resultam em latências e amplitudes ABR ausentes, reduzidas, prolongadas ou anormais. Notavelmente, esses parâmetros são quase idênticos em humanos e outros animais, tornando-se um teste objetivo consistente de função auditiva entre os modelosvertebrados 3.
Um desses modelos é o frango, e é especialmente útil por uma variedade de razões. As aves podem ser classificadas como altricial ou pré-ciais4. As aves altricial eclodem com sentidos ainda em desenvolvimento; por exemplo, corujas-do-celeiro não mostram uma ABR consistente até quatro dias após o hatch5. Animais precoces como a escotilha de frango com sentidos quase maduros. O início da audição ocorre no desenvolvimento embrionário, de tal forma que dias antes do hatch (dia 21), o sistema auditivo está próximo da maturação funcional 6,7,8. As aves altricial e a maioria dos modelos de mamíferos são suscetíveis a fatores extrínsecos que influenciam o desenvolvimento e requerem criação animal até que a audição esteja madura. Os ABRs de frango podem ser realizados no mesmo dia que a escotilha, esquecendo a necessidade de alimentação ou um ambiente enriquecido.
O frango embrionário tem sido um modelo bem estudado para fisiologia e desenvolvimento, especialmente no tronco cerebral auditivo. Estruturas específicas incluem o núcleo coclear de frango, dividido em núcleo magnocelularis (NM) e núcleo angularis (NA), e o correlato aviário da azeitona superior medial conhecida como núcleo laminaris (NL)6,7. A ABR é ideal para focar na função auditiva central antes do nível do cérebro e do córtex. A tradução entre medições in vivo ABR e estudos neuronais in vitro de desenvolvimento8, fisiologia9, tonotopia10 e genética11,12 fornece oportunidades ideais de pesquisa que apoiam estudos da função auditiva global.
Embora a ABR tenha sido extensivamente estudada em modelos mamíferos, tem havido menos foco para os aviários. Estudos anteriores da ABR aviária incluem caracterizações do budgerigar13, pica-pau14, gaivota15, aves de mergulho16, zebra finch17, raptores diurnos18, canário19, três espécies de coruja 5,20,21,22 e frango23. Dadas as quase quatro décadas desde a última caracterização completa do frango ABR, muitos dos equipamentos e técnicas anteriormente utilizados mudaram. Insights de estudos em outros modelos aviários podem ajudar a desenvolver a metodologia moderna de ABR de frango, ao mesmo tempo em que servem como comparação com o frango ABR. Este artigo delineará a configuração e o design experimentais para permitir a gravação de ABR em galinhas filhotes que também poderiam ser aplicadas a estágios embrionários de desenvolvimento e outros pequenos modelos de roedores e aviários. Além disso, dado o desenvolvimento precoce do frango, as manipulações de desenvolvimento podem ser realizadas sem qualquer pecuária extensiva. As manipulações para um embrião em desenvolvimento podem ser avaliadas apenas algumas horas após o animal chocar com capacidade auditiva quase madura.
Protocolo
Os experimentos descritos aqui foram aprovados pelos Comitês Institucionais de Atenção e Uso de Animais (IACUC) da Northwestern University e realizados de acordo com o Guia Nacional de Institutos de Saúde para o Cuidado e Uso de Animais de Laboratório.
1. Criação de frango
- Adquira ovos de galinha leghorn brancos fertilizados.
NOTA: Existem várias raças de frango usadas em pesquisas científicas, mas os resultados aqui mostrados são de frango leghorn branco (Gallus gallus domesticus). Embora a variabilidade da ABR entre as raças seja desconhecida, algumas diferenças têm sido encontradas ao comparar galinhas adultas que colocam ovos com galinhas de frangos de corteprodutoras de carne 24,25. - Incubar ovos a 38 °C, umidade a 50%, por 21 dias antes da data desejada de teste.
NOTA: Se os ovos não forem incubados imediatamente a 38 °C, eles podem ser armazenados a 14 °C, umidade a 40%. No entanto, quanto mais tempo os ovos são mantidos a 14 °C, menor a probabilidade de se desenvolverem em filhotes viáveis. Após 7 dias, a viabilidade do ovo pode cair até 50% dependendo do tempo que os ovos são mantidos a 14 °C. A viabilidade dos ovos também cairá nos meses de inverno. - Gire periodicamente os ovos 2-3 vezes por dia. A maioria das incubadoras tem um mecanismo para realizar isso automaticamente.
- Se usar uma incubadora de isopor ou uma incubadora com mais de 6 ovos, transfira ovos para uma pequena incubadora de 38 °C um dia antes da eclosão, dia 20 embrionário (E20). Os ovos devem eclodir 21 dias (E21) após serem colocados na incubadora.
NOTA: No processo de eclosão, o animal começará a "pipping" do ovo, fazendo um pequeno buraco que eventualmente gira em torno de todo o ovo. Se as condições estiverem muito secas, o ovo pode secar, e o animal não poderá eclodir. A umidade deve ser mantida em torno de 50%, com base em estudos anteriores sobre viabilidade de eclosão de ovos 26,27,28,29. - Determine a idade do animal. Se a escotilha não for testemunhada pessoalmente, a única indicação de idade é a de 2-3 h que leva para o fluido amniótico secar.
NOTA: A incubadora de filhotes deve ser completamente limpa diariamente com 70% de álcool isopropílico com base em quantos filhotes são processados. Filhotes de frango muitas vezes deixam excrementos, penas e fluido amniótico na incubadora, que pode contaminar condições e qualidade do ar.
2. Preparação de drogas
- Pesar o animal colocando-o em um grande barco de pesagem. Com uma colocação suave o suficiente, o animal não deve se mover.
NOTA: A massa pode variar de 30 a 45 g. Animais mais jovens são muitas vezes mais pesados por causa das reservas de gema e ainda não excretam resíduos. Animais mais velhos se aproximando de 24h de idade e P2 geralmente pesam menos. - Prepare um coquetel anestésico de Cetamina (100 mg/mL) e Xylazine (20 mg/mL) de modo que a dosagem seja de 50 mg/kg de cetamina e 16,68 mg/kg de Xylazine à base de peso animal.
NOTA: Este coquetel de drogas pode ser feito com 1 mL de Cetamina (100 mg/mL), 1,5 mL de Xilazina (20 mg/mL) e 2,5 mL de H2O. As injeções de coquetel anestésico variam de 0,05-0,1 mL com base na faixa de 30-45 g em peso animal.
3. Injeção de drogas e preparação animal
- Segure o animal em uma mão, certificando-se de segurar as pernas para baixo.
- Sinta pelo osso do peito do animal, a quilha. Em ambos os lados da quilha haverá músculo mamário.
- Use uma agulha e seringa de 29 G para penetrar 5 mm na pele e injetar o coquetel de cetamina/xilazina no músculo do peito. Injete entre 0,05-0,1 mL com base no peso animal.
- Coloque o animal de volta na incubadora após a injeção. Mantenha a temperatura do corpo animal por alguns minutos à medida que o anestésico faz efeito.
- Use fórceps para beliscar o dedo do dedo do animal e verificar se o pescoço está mole. Se não houver reflexo e pescoço mole, o animal está inconsciente.
- Determine o sexo do frango usando suas penas de asa. Se as penas têm o mesmo comprimento, o animal é macho. Se as penas variam de comprimento, o animal é fêmea30.
NOTA: Outro método de sexing do animal é desabafar. A genitália masculina pode ser vista na cloaca31. Este método é muito difícil e pode prejudicar o animal se não for feito corretamente. Recomenda-se o uso do método de pena de asa. - Aplique creme depilatório com um aplicador de ponta de algodão na região da cabeça e pescoço, especialmente perto da abertura da orelha para o pássaro.
- Use 70% de álcool isopropílico para limpar penas, qualquer creme depilatório restante e a pele na cabeça e pescoço.
- Use um lenço de álcool isopropílico de 70% para esterilizar os eletrodos subdérmicos e a sonda retal.
- Coloque o animal em um isolamento sonoro e câmara eletricamente blindada. Certifique-se de que o ambiente tenha ruído elétrico e acústico mínimo para as melhores gravações.
NOTA: Os experimentos aqui foram feitos em um gabinete isolado de som personalizado medindo 24 x 24 x 25 polegadas. Qualquer câmara ou sala que elimine o ruído acústico, bem como o ruído elétrico da corrente elétrica alternada (60 Hz nos Estados Unidos), é suficiente. - Use uma almofada de aquecimento ou sistema de controle de temperatura para manter a temperatura do corpo animal.
- Insira a sonda retal lubrificada para garantir que a temperatura do animal seja mantida entre 37-41 °C (98.6-105 °F)32,33.
NOTA: Se a sonda tiver um tamanho incorreto, o animal pode colocar em cima da sonda de temperatura. - Fixar a cabeça do animal no lugar ou descansar o bico contra um objeto para evitar movimentos indesejados. Isso pode ser feito com argila de modelagem se a respiração não estiver obstruída.
- Administre uma injeção suplementar de coquetel anestésico que é metade da dosagem original se o animal começar a recuperar a consciência durante os testes.
NOTA: Qualquer movimento ou vocalização do corpo é um sinal de que uma dosagem de suplemento deve ser administrada. Movimentos minúsculos de bico indicam respiração e são aceitáveis.
4. Colocação de eletrodos
- Use três eletrodos de aço inoxidável, a agulha de cloreto de prata com as seguintes designações: o eletrodo de referência, o eletrodo ativo e o eletrodo comum.
NOTA: O eletrodo de referência também é referido como invertido ou "-". O eletrodo ativo também é referido como não invertido ou "+". - Coloque cada eletrodo sub-dermally 2-3 mm na cabeça, mas não profundo o suficiente para penetrar o crânio. Use eletrodos de 7 mm de comprimento e 0,4 mm de diâmetro.
- Tire o eletrodo da pele, expondo a ponta. Isso ajuda a minimizar o contato com a pele e garantir uma profundidade de inserção consistente entre os animais34.
NOTA: O fio de eletrodo deve ter folga suficiente de tal forma que, após a colocação do eletrodo, não há tensão que o puxe para fora ou puxe a pele esticada. - Para gravação de canal único, coloque o eletrodo ativo acima do crânio na linha média, tão caudal quanto o canal auditivo.
- Coloque o eletrodo de referência atrás da orelha onde o estímulo será entregue, e coloque o eletrodo moído atrás do canal auditivo contralateral no pescoço.
NOTA: Se realizar cirurgia no crânio ou canal auditivo do animal, coloque o eletrodo de referência no pescoço na linha média do animal. Este e o passo 4.4.1 são considerados montagens de gravação de eletrodos horizontais.
- Coloque o eletrodo de referência atrás da orelha onde o estímulo será entregue, e coloque o eletrodo moído atrás do canal auditivo contralateral no pescoço.
- Para gravação de dois canais, use dois eletrodos negativos e um eletrodo positivo combinado que requer um cabo adaptador. Coloque o eletrodo moído subdermicamente no pescoço e um eletrodo de referência atrás de cada canal auditivo.
- Verifique a impedância do eletrodo. Certifique-se de que a impedância total do eletrodo não exceda 5,0 kΩ. Mantenha a impedância interelerode abaixo de 3,0 kΩ.
5. Gravação de ABR
- Dependendo da aquisição de hardware e software, certifique-se de executar a calibração para níveis de som corretos em todas as frequências de estímulo utilizadas.
NOTA: As técnicas de calibração variam de acordo com os equipamentos (ver discussão). Para alguns programas, a atenuação de som pode ser editada dentro do software. Os procedimentos de calibração realizados aqui envolveram o uso de um microfone condensador B&K 4138 de 1/8 polegadas para gravar estímulos de frequência dentro de um sistema de acoelheiro fechado que se aproximava do canal auditivo do filhote (~5 mm). Uma mesa de calibração de filhotes de frango é fornecida como uma Mesa Suplementar. - Mova o aparelho transdutor de som em direção ao ouvido ativo do animal. Coloque o transdutor de som a uma profundidade rasa de 2 mm no canal auditivo.
NOTA: Dependendo do transdutor de som, um espéculo plástico pode ser anexado e inserido no canal auditivo. A colocação do espéculo é crítica. Se o som for bloqueado pela parede do canal ou o canal auditivo estiver fechado, os ABRs estarão ausentes ou se assemelharão a uma mudança de ~40 dB no limiar. - Verifique o animal durante o teste se os resultados parecem anormais ou ausentes. Se forem, reposicione o transdutor de som no canal auditivo.
NOTA: Como a pele está solta e o movimento animal é possível, a colocação do espéculo pode mudar durante a gravação. No entanto, com injeção anestésico correta e o animal totalmente inconsciente, a gravação pode ir ininterrupta por 30-45 min.
6. Aquisição de dados
- Utilize equipamentos/softwares suficientes para gerar estímulos sonoros e gravar/adquirir gravações ABR.
NOTA: Existem muitos sistemas comercialmente disponíveis ou personalizados para aquisição da ABR. Para esses experimentos, utilizou-se a plataforma SmartEP USB (Intelligent Hearing Systems, sistemas auditivos inteligentes) disponíveis comercialmente( IHS). A capacidade de manipular parâmetros de gravação é fundamental; estes incluem, mas não se limitam à intensidade de estímulo, comprimento de estímulo, frequência de estímulo, taxa de apresentação de estímulo, filtro de passe alto e baixo, rejeição de artefatos, número de varreduras, taxa de amostragem, forma de envelope e polarização de estímulo. - Defina os limites superiores e inferiores de rejeição do artefato (AR) para ±25 μV, de tal forma que o movimento ou ruído animal durante uma varredura excluirá essa varredura da análise. Em toda a população testada, menos de 1% do total de varreduras foram rejeitadas devido a artefatos.
- Colete pelo menos 1024 varreduras para obter uma grande resposta média. Isso pode ser feito em duas gravações de 512 varreduras cada. Isso também garante que a resposta seja evocada por estímulos e repetível.
- Defina o ganho para 100.000, o filtro low pass para 100 Hz, e o filtro de passe alto para 3000 Hz.
NOTA: As configurações do filtro de passagem baixa e alta foram ótimas para gravações usando o sistema IHS. Portanto, esses parâmetros são recomendações. Gravações de ABR em outras espécies aviárias usando o software BIOSIG filtraram o sinal entre 30 e 3000 Hz 5,13,14,16,22. - Defina a taxa de apresentação de estímulo entre 10 e 20 estímulos por segundo. Altas taxas de apresentação mudarão a latência máxima da ABR, especialmente para os picosposteriores 13. Baixas taxas de apresentação aumentarão o tempo necessário para adquirir a ABR.
- Defina a duração do tempo do estímulo do clique para 100 μs.
- Se usar um estímulo de explosão de tom, edite a frequência e duração do estímulo com base no efeito desejado. Uma faixa de 100-4000 Hz foi usada para estímulos de explosão de tom, embora a gama de audição comportamental em galinhas adultas varie de 2-9000 Hz35.
NOTA: No sistema IHS, o tempo de ascensão e queda de um estímulo de explosão de tom só pode ser modificado se a forma do envelope espectral for um trapezoide. No entanto, os envelopes cosseno e Blackman fornecem um tempo de subida e queda predefinido que é comumente usado em experimentos de ABR animal. O sistema IHS pode exibir o envelope espectral de uma explosão de tom para garantir tempos apropriados de elevação e queda. O tempo de ascensão e queda de um estímulo de clique não pode ser editado no IHS.
- Se usar um estímulo de explosão de tom, edite a frequência e duração do estímulo com base no efeito desejado. Uma faixa de 100-4000 Hz foi usada para estímulos de explosão de tom, embora a gama de audição comportamental em galinhas adultas varie de 2-9000 Hz35.
- Defina a taxa de amostragem para o maior valor permitido (geralmente 40 kHz) para os melhores dados de resolução.
NOTA: Alguns sistemas, incluindo o IHS, utilizam um número limitado de pontos de amostragem e alterarão o comprimento da janela de gravação. Uma taxa de amostragem de 40 kHz (período de 25 μs) só pode permitir uma janela de gravação de 12 ms, de modo a capturar uma explosão de tom ABR, uma taxa de amostragem de 20 kHz (período de 50 μs) foi usada para permitir uma janela de gravação de 24 ms. Se comparar diretamente o clique e o tom estourar ABRs, mantenha a taxa de amostragem constante para manter a mesma resolução. - Coloque a polarização de estímulos em alternância. Isso é feito para eliminar a visualização do microfônico coclear das gravações de ABR. Para visualizar o microfônico coclear, use a rara ação ou condensação para polarização de estímulo.
NOTA: Muitas configurações podem ser alteradas ao selecionar estímulos. As configurações de ganho e filtro fornecidas podem não ser ideais para outras configurações do equipamento. Os padrões de fábrica na maioria das máquinas ABR não estão definidos para gravação em frango incubador. - Se gravar 512 varreduras, combine dois testes separados para criar uma média de varredura de 1024.
- Para um estímulo de explosão de clique ou tom, adquira uma ABR em uma intensidade de suprathreshold.
- Continue gravando em intensidades cada vez menores até que a resposta evocada não possa mais ser identificada.
- Defina o limiar de ABR como a menor intensidade de estímulo que provoca uma resposta detectável evocada. Reduza a intensidade de estímulo por passos de 5 dBSPL para encontrar a menor intensidade de estímulo que provoca um pico detectável.
7. Eutanásia e fim de experimento
- Uma vez adquiridos os ABRs, prepare uma overdose (0,1 mL) de solução de eutanásia (Sódio Pentobarbital 390 mg/mL Phenytoin Sódio 50 mg/mL).
- Depois de usar uma pitada de dedo do dedo do dedo para confirmar que não há reflexo, injete a solução de eutanásia no músculo da mama com uma agulha de 29 G a uma profundidade de 5 mm. A técnica de injeção é a mesma da injeção anestésico.
NOTA: O animal expirará após alguns minutos. Não manipule ou decapite o animal até que nenhum movimento seja detectado. Uma técnica alternativa de eutanásia é realizar uma injeção intravenosa na veia braquial sob a asa. - Assim que o animal não estiver reflexivo e respirar e os batimentos cardíacos cessarem, decapitem rapidamente com tesouras afiadas ou tesouras.
- Limpe a almofada de aquecimento, a sonda retal e os eletrodos de cloreto de prata com 70% de álcool isopropílico.
- Certifique-se de que todos os vestígios adquiridos foram salvos. Para análise posterior, exporte arquivos como .txt arquivos que podem ser visualizados no bloco de notas ou importados em uma planilha.
Resultados
Representante ABR grava para filhotes de filhotes
Os seguintes resultados representativos e populacionais vêm de registros da ABR feitos em 43 animais. Em resposta a um estímulo de clique suprathreshold (75 dBSPL), três picos positivos foram consistentemente observados em todos os filhotes. Esses picos ocorreram dentro de 6 ms após o início do estímulo. Raramente, um quarto pico também foi observado em ~6 ms. Enquanto a identificação dos picos de ABR em aves variava entre os animais (ver discussão), os picos eram rotulados e identificados como ondas numélicas romanas I-IV. Uma forma de onda ABR representativa com picos rotulados é mostrada na Figura 1A (traço superior). A Figura 1B mostra a função de intensidade de latência para ondas I e III rotuladas no traço representativo. A latência de pico de onda I aumentou ~0,3 ms para cada redução de 20 dB na intensidade de estímulo. Em média, as ondas I-III ocorreram a 1,50 ms (±0,02 ms), 3,00 ms (±0,06 ms) e 4,13 ms (±0,09 ms) a 75 dBSPL, respectivamente (Figura 1C). Onda I e Onda III sempre apresentados como um pico singular. Ocasionalmente para a Onda II, vários pequenos picos foram vistos entre 2,5-3,2 ms. Cada pico tinha um cocho correspondente, e a amplitude de pico para cocho da Onda I - a maior de todos os picos - media 7 μV e se aproximou de uma amplitude máxima de 11 μV a 75 dB SPL.
Além da maior amplitude, a Onda I do filhote ABR apresentou a menor variabilidade no pico de latência entre os animais. Portanto, esse pico foi utilizado para estimar a sensibilidade ao limiar auditivo. Os limiares de ABR foram definidos como a menor intensidade de estímulo que provocou um pico de forma de onda identificável e repetitivo. Isso foi subjetivamente determinado pelo experimentador e cruzado por um segundo experimentador para acordo limiar. Os picos foram melhor definidos e mais fáceis de identificar ao usar estímulos de clique, mas as rajadas de tom também geraram picos definidos e identificáveis que variavam dependendo da frequência de estímulo e seus parâmetros (Figura 1D, n = 4 filhotes). O limiar de ABR evocado por cliques era inferior ao limiar evocado de explosão de tom, com exceção de 1000 Hz. Os limiares variavam entre 10-30 dBSPL para estímulos de cliques. AbRs evocados por cliques que não apresentavam picos identificáveis >30 dBSPL eram frequentemente o resultado do espéculo se desalojado do canal auditivo devido ao movimento animal.
Diminuição da temperatura corporal aumenta latências ABR
A velocidade da atividade neural - medida pelo pico de ocorrência de uma amplitude de forma de onda (ou seja, latência) - é conhecida por diminuir a temperaturas corporais mais baixas 36,37. Este fenômeno foi observado em ABRs de frango incubador utilizando um estímulo de clique de 75 dBSPL. Um traço representativo é mostrado na Figura 2A. Como a temperatura corporal diminuiu a partir de 39 °C, a latência dos picos de ABR ocorreu mais tarde no tempo, apesar do mesmo nível de intensidade de estímulo. A Figura 2B mostra a latência das ondas I e III em função das temperaturas mais baixas do corpo para o traço representativo. Houve forte correlação (R2 = 0,89) entre temperaturas corporais mais baixas e a ocorrência de latência máxima de Onda I (Figura 2C, n = 5 filhotes). Esses resultados demonstram a necessidade de manter uma temperatura corporal quase normal durante as gravações de ABR. Se a temperatura corporal quase normal não for mantida, as funções de intensidade de latência e as medidas de amplitude da ABR são altamente variáveis e muitas vezes imprecisas.
Diferenças de latência e amplitude nos primeiros filhotes
Pesquisas mostraram que a atividade neural relacionada ao início da audição para o filhote está perto de amadurecer aos8 anos de idade. No entanto, para um subconjunto de filhotes muito precoces (<3 h pós-escotilha), observamos uma mudança de pico de latência de formas de onda ABR (n = 4) em resposta a um estímulo de clique spl de 75 dB ou potenciais evocados não eram identificáveis (n = 2 filhotes). Em 2 filhotes jovens, nenhuma explosão de tom ABR poderia ser provocada, e os limiares de clique foram elevados por 50 dBSPL. Isso pode ser devido a um problema condutivo onde ainda há fluido no canal auditivo/cavidade do ouvido médio do animal, ou um componente neural subdesenvolvido. Estudos de mamíferos relataram mudanças limiares de 50 dB em recém-nascidos38,39. Os animais representativos usados aqui tinham >3h de idade, o que também coincidiu com o tempo que leva para as penas secarem. A Figura 3A mostra ABRs registrados de filhotes (P1, <3 h de idade) e filhotes mais antigos (P2). Para análise, apenas 3 filhotes jovens apresentaram os três picos de ABR. As latências de forma de onda foram significativamente prolongadas, e as amplitudes de forma de onda foram ligeiramente reduzidas quando comparadas aos filhotes mais antigos (Figura 3B-C, respectivamente).
Colocação de eletrodos de referência e gravações ABR de dois canais
Na Figura 4, a colocação do eletrodo de referência foi modificada entre 2 locais diferentes, mas ainda resultou em gravações ABR comparáveis. Uma comparação entre traços de cliques de 75 dBSPL no mesmo animal com as duas colocações de eletrodos de referência mostrou diferenças mínimas nas amplitudes de forma de onda de pico para cocho e latências de forma de onda de pico (Figura 4A). A colocação mastoide foi metodologicamente como experimentos de ABR de mamíferos que colocam o eletrodo de referência no mastoide ou pinna. O uso de uma colocação no pescoço para o eletrodo de referência seria benéfico se a manipulação ou cirurgia fosse realizada em ambos os ouvidos. Curiosamente, a amplitude de pico da Onda II para a colocação mastoide (traço vermelho) ocorreu 1 ms após o pico da Onda II para a colocação do pescoço (traço preto). Essa diferença de tempo provavelmente reflete o site(s) de geração neural ABR em relação à colocação do eletrodo.
Utilizando uma configuração de dois canais, um eletrodo de gravação ativo (topo de colocação da cabeça) e dois eletrodos de referência (colocações mastoides) foram usados para obter ABRs tanto para as orelhas esquerda quanto para a direita (Figura 4B). As respostas entre as duas orelhas foram semelhantes, com pequenas alterações nas amplitudes de pico provavelmente devido ao posicionamento do fone de ouvido. A latência do ouvido esquerdo e direito sendo equivalente apoiou a função igualmente saudável dos hemisférios das orelhas e do tronco cerebral no frango filhote. A montagem de gravação de dois canais poderia ser usada para ABRs binaural também, mas haveria considerações adicionais necessárias para essas gravações.

Figura 1: Gravações representativas de filhotes de filhotes para clicar e evocar tons. (A) Gravações representativas da ABR de um filhote de filhote de filhote (P2) em função de diferentes níveis de intensidade de estímulo. Três a quatro picos positivos em microvolts (μV) podem ser identificados dentro do início pós-estímulo de 6 ms (tempo = 0 ms). Ondas foram identificadas usando numerais romanos. As amplitudes de pico para cocho diminuem em níveis de intensidade de estímulo mais baixos. (B) Funções de intensidade de latência das ondas I e III para o traço representativo mostrado em (A). Apenas esses picos foram analisados, pois a Onda II normalmente não era observada em intensidades <45 dBSPL. (C) Latência das formas de onda de pico ABR evocadas por cliques (n = 43 filhotes). As barras de erro denotam o erro padrão da média (SEM). (D) ABRs evocados de tom médio (traços pretos) para quatro filhotes de filhotes em três frequências diferentes. Traços vermelhos = erro padrão dos estímulos médios (SEM) = 75 dBSPL. Nesta e nas figuras subsequentes, as barras de erro denotam SEM, e o ouvido direito foi o ouvido de estímulo. (exceção para a Figura 4B onde ambas as orelhas foram estimuladas). Clique aqui para ver uma versão maior desta figura.

Figura 2: Efeito da temperatura corporal nas gravações de ABR. (A) Gravações representativas de ABR de um filhote de filhote (P2) em função da temperatura corporal. Para temperaturas mais baixas do corpo, as latências de forma de onda máxima aumentaram enquanto as amplitudes de pico para cocho permaneceram relativamente inalteradas. (B) Função de latência-temperatura das ondas I e III para os traços representativos mostrados em (A). (C) Dados populacionais que mostram a relação entre latência e temperatura mudam para 5 filhotes (p < 0,01, R2 = 0,89). Observou-se tendência semelhante para as Ondas II e III (dados não apresentados). Clique aqui para ver uma versão maior desta figura.
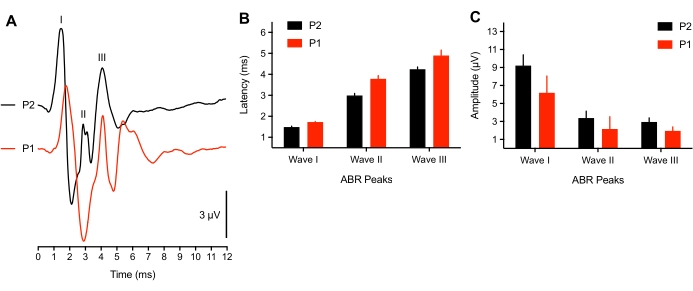
Figura 3: Diferenças relacionadas à idade nas gravações de ABR. (A) Gravações representativas de ABR (sobrepostas) de um filhote de filhote representativo em P2 (traço preto) e P1 (<3 h pós-escotilha, traço vermelho). (B) Latências de forma de onda de pico para ondas I, II e III em função da idade. As latências para ondas I-III foram significativamente diferentes entre as idades (P < 0,05, n = 6 filhotes). (C) Amplitudes de forma de onda de pico a cocho das ondas I, II e III em função da idade. Clique aqui para ver uma versão maior desta figura.
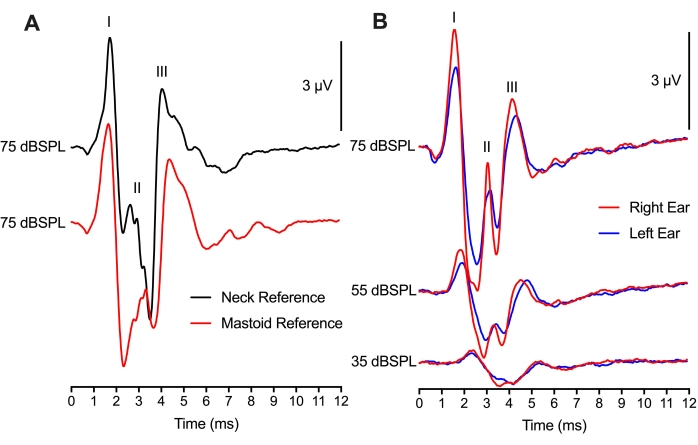
Figura 4: Colocação de eletrodo e gravações de ABR de dois canais: (A) Gravações representativas de ABR (sobrepostas) do mesmo filhote de filhote (P2) com o eletrodo de referência colocado no pescoço (traço preto) ou mastoide (traço vermelho). O eletrodo ativo foi colocado na linha média do crânio para ambas as montagens de gravação de eletrodos. A latência das ondas I e III, e a amplitude das ondas I e III são quase idênticas em ambas as condições. A latência da Onda II é mais cedo, e a amplitude é maior para o eletrodo colocado no tecido do pescoço. (B) Gravação de dois canais enquanto estimula sequencialmente as orelhas direita e esquerda. Gravações representativas de ABR (sobrepostas) do mesmo filhote de filhote de filhote (P2) com os eletrodos de referência colocados no mastoide da orelha esquerda (traços azuis) e ouvido direito (traços vermelhos) em três níveis de intensidade diferentes. Clique aqui para ver uma versão maior desta figura.
Tabela Suplementar: Mesa de calibração do filhote de frango. Clique aqui para baixar esta Tabela.
Discussão
O tronco cerebral auditivo das aves é bem estudado, e muitas estruturas são análogas à via auditiva dos mamíferos. O nervo auditivo fornece insumos excitatórios nos dois núcleos centrais de primeira ordem, o núcleo coclear magnocelularis (NM) e angularis (NA). NM envia uma projeção excitatória bilateralmente para seu alvo auditivo, núcleo laminaris (NL)7. NL projeta para o núcleo mesencephalicus lateralis, pars dorsalis (MLd)40,41. A NL também projeta para o núcleo olivary superior (SON), que fornece inibição de feedback para NM, NA e NL42. Este microcircuito cerebral auditivo inferior é requintadamente conservado para a função que ele subserve, localização sonora e audição binaural33. As regiões superiores auditivas da ave também têm núcleos análogos ao lemniscus lateral mamífero e colículo inferior no cérebro médio. Dadas essas semelhanças, a composição da ABR aviária até o cérebro médio auditivo é comparável entre todos os vertebrados.
Enquanto várias espécies aviárias apresentam três picos positivos dentro de 6 ms após o início do estímulo, a correlação dos picos de ABR com as estruturas auditivas centrais tem alguma variabilidade. Onda Eu posso ser razoavelmente assumido como a primeira resposta neural da papila basílica periférica e nervo auditivo e apresenta pouca variabilidade entre os indivíduos (Figura 1C). A identificação subsequente da onda é menos certa e pode diferir entre espécies. Kuokkanen et al.17 determinaram recentemente que a Onda III da ABR da coruja-do-celeiro é gerada pela NL; assim, é razoável argumentar que a Onda II se origina da NM e na NA do núcleo coclear20. No entanto, a onda iii coruja foi definida como o pico positivo gerado 3 ms após o início do estímulo. Isso corresponde à Onda II como definido no frango de incubação ABR. Na coruja-do-celeiro ABR, as ondas I e II foram combinadas.
Enquanto o frango filhote geralmente apresentava três picos dentro de 6 ms, um quarto pico era ocasionalmente observado (por exemplo, ver Figura 1A). Dados populacionais, tamanho amostral maior e paradigmas experimentais adicionais seriam necessários para apoiar uma quarta onda e, em alguns casos, um frango de cinco ondas ABR. O achado mais consistente foram as três representações de pico mostradas aqui.
Uma vez que a ABR é definida como uma medida de sincronia neural, os principais núcleos na via auditiva poderiam representar cada pico positivo na ABR. O sinal que passa do nervo auditivo para NM/NA e, em seguida, para NL pode definir ondas I, II e III no frango de incubação ABR, respectivamente. Além disso, o quarto pico posterior do frango ABR poderia representar uma estrutura auditiva superior ou midbrain. A caracterização das ABRs aviárias também deve considerar a diferença entre aves pré-comerciais e altriciais. O amadurecimento das respostas auditivas variará entre as espécies e também é afetado por outros traços críticos, como comportamento predador e/ou aprendizagem vocal4. Independentemente disso, os métodos e técnicas descritos são facilmente aplicados a uma variedade de espécies aviárias e vertebradas.
A importância da manutenção da temperatura corporal animal é ilustrada na Figura 2. À medida que a temperatura interna do corpo diminuiu, a latência das respostas da ABR aumentou para o mesmo nível de intensidade de estímulo. Isso é mais pronunciado quando a temperatura corporal cai abaixo de 32 °C36,37. O aumento de latência de aproximadamente 1 ms na ABR é menor do que o relatado anteriormente no frango23. No entanto, Katayama23 usou um filhote de 12 dias de idade que foi resfriado e posteriormente aquecido durante um período de 4 horas. Os dados da Figura 2 foram registrados durante o processo de resfriamento durante um período de 20 minutos. Para adquirir a melhor qualidade e as gravações mais consistentes, a temperatura corporal do animal deve ser mantida, e todas as gravações devem ser feitas na mesma temperatura fisiológica entre os animais.
O efeito da idade na ABR é leve, mas importante a considerar. Embora apenas a latência das Ondas I e II da ABR tenha sido significativamente diferente, isso ocorre em parte porque apenas três filhotes jovens foram usados na Figura 3; os outros três não apresentaram três picos ABR identificáveis. A amplitude e as mudanças de limiar da ABR também podem ser evidentes se usar grandes tamanhos de amostra ou comparar ABRs específicos da frequência. Este efeito relacionado à idade pode ser causado por fluido no ouvido médio do frango. Tais mudanças condutivas levam a um aumento acentuado dos limiares de ABR para os modelos humanos e outros mamíferos38,39.
Utilizando duas montagens de gravação diferentes, foram observadas respostas semelhantes (Figura 4A). Enquanto a montagem mais comum coloca o eletrodo de referência atrás do ouvido receptor de estímulo, ter o eletrodo de referência no tecido do pescoço pode ser útil se houver intervenção cirúrgica que acompanha a ABR. No entanto, se forem utilizadas gravações ABR de dois canais, os eletrodos de referência devem ser colocados separadamente e simetricamente, o que é difícil se colocar o eletrodo de referência no pescoço. Recomenda-se que a posição mastoide para o eletrodo de referência padronize o maior número possível de aspectos de gravação. A gravação de ABR de dois canais é uma ferramenta eficaz que requer pouca preparação extra e resulta em respostas semelhantes entre os ouvidos. Pequenas diferenças de amplitude foram prováveis devido ao posicionamento do fone de ouvido. A gravação de dois canais permite uma comparação fácil entre um hemisfério cerebral ou de ouvido experimentalmente manipulado versus um controle. Essa configuração também seria necessária para testar ABRs binaurais. Experimentos futuros usando o frango ABR podem se referir à literatura anterior sobre configurações de gravação e montagens34.
Essa metodologia vem com várias limitações. Como mencionado na etapa 5.1, a má colocação do espéculo pode levar a uma mudança de 40 dBSPL em resposta. Isso pode causar uma interpretação incorreta de um animal manipulado ou modificado. Recomenda-se as seguintes precauções: adquirir uma grande amostra de dados de controle antes de adquirir os ABRs de modelos manipulados ou mutantes. Não diminua a intensidade de estímulo em mais de 20 dBSPL entre gravações. Se a amplitude ou latência mudar mais do que o esperado, verifique a posição animal e espéculo. Repita esse estímulo ABR para observar as alterações. Se o espéculo se moveu, readquive testes anteriores. Outra limitação é a calibração das ABRs. Sem a calibração adequada para registrar o nível de pressão sonora, a intensidade apresentada ao animal é desconhecida. Ao medir a saída de som, use o mesmo espéculo que na gravação experimental e um pequeno microfone dentro de uma cavidade que se aproxima do comprimento do canal auditivo do animal (~5 mm). Meça as mesmas frequências de tom utilizadas em experimentos, pois as calibrações são específicas de frequência. O manual para sistemas de hardware e software pode vir com instruções para calibração. Há também filtros adicionais, como fase linear e filtros de fase mínima, que podem melhorar o clique e o tom estourar ABRs43. Estes filtros não foram utilizados no presente estudo. Considerações adicionais, como o tempo de ascensão e queda de um toque de estouro de envelope espectral mudando em função da frequência ou alterando o tempo de ascensão e queda dos estímulos do clique também não foram examinadas. Estas são boas investigações futuras, uma vez que ABRs confiáveis e consistentes podem ser adquiridas.
A comparação do frango filhote com outros modelos aviários é promissora. Budgerigars e corujas orientais também apresentam três picos positivos de microvolt dentro dos primeiros 6 ms da ABR13,22. Em diferentes espécies de pica-paus, três picos também são vistos, mas sua latência é mais tarde no tempo. Além disso, a faixa de melhor sensibilidade de frequência em pica-paus está entre 1500 e 4000 Hz, o que é um pouco maior do que o melhor limiar do frango em 1000 Hz. No frango adulto, a melhor sensibilidade está em 2000 Hz35, então pode haver melhor audição de altas frequências à medida que os filhotes de frango se desenvolvem em adultos. Esse desenvolvimento será diferente entre as espécies de aves, levando em conta o desenvolvimento altricial ou precoce do animal4.
Os métodos experimentais aqui descritos podem ajudar a determinar quais fatores levam a prejuízos ou mudanças nas respostas e limiares auditivos, bem como estudos em diferentes estágios de desenvolvimento embrionário. Manipulação genética, envelhecimento e exposição ao ruído são manipulações conhecidas em animais e outros modelos aviários 24,25,44,45. Esses métodos devem ser estendidos ao modelo de frango agora que técnicas como a eletroporação in-ovo permitem a expressão de proteínas que são controladas focalmente e temporalmente em um lado do tronco cerebral auditivo12,46. Isso permite a comparação direta das ABRs do ouvido geneticamente manipulado ao ouvido de controle contralateral usando um paradigma de gravação de dois canais.
No geral, a ABR de galinhas filhotes é um método de pesquisa útil, quase idêntico às medidas de função auditiva em modelos humanos e outros mamíferos. É também uma metodologia não invasiva e invasiva . Além da injeção anestésica e colocação de eletrodos subdérmicos de alguns milímetros, nenhuma outra manipulação física é necessária. Um filhote poderia teoricamente ser testado várias vezes durante um curso de tempo de desenvolvimento de dias ou semanas se mantido em um ambiente apropriado. Este protocolo não apenas estabelece as etapas necessárias e os parâmetros de registro para o frango incubador ABR, mas propõe características de uma ABR aviária que pode informar mais testes na função de tronco cerebral auditivo.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho é suportado pelo NIH/NIDCD R01 DC017167
Materiais
| Name | Company | Catalog Number | Comments |
| 1/8 inch B&K Microphone | Brüel & Kjær | 4138 | Type 4138-A-015 also works |
| Auditory Evoked Potential Universal Smart Box | Intelligent Hearing Systems | M011110 | |
| Custom Sound Isolation Chamber | GK Soundbooth Inc | N/A | Custom built |
| DC Power Supply | CSI/Speco | PSV-5 | |
| ER3 Insert Earphone | Intelligent Hearing Systems | M015302 | Used as sound transducer |
| Euthasol | Virbac | 710101 | Controlled Substance; euthanasia solution |
| Insulin Syringe (29 G) | Comfort Point | 26028 | |
| Ketamine | Covetrus | 11695-0703-1 | Controlled Substance |
| Power Supply | Powervar | 93051-55R | |
| Rectal Probe | YSI | 401 (10-09010) | Any 400 series probe will work with the YSI temperatuer monitor |
| Subdermal needles | Rhythmlink | RLSND107-1.5 | |
| Temperature Monitor | YSI | 73ATA 7651 | Works with any 400 series rectal probe |
| Xylazine | Anased | 59399-110-20 | Used with ketamine and water for anesthetic |
Referências
- Wever, E. G., Bray, C. W. Action currents in the auditory nerve in response to acoustical stimulation. Proceedings of the National Academy of Sciences of the United States of America. 16 (5), 344-350 (1930).
- Jewett, D. L., Williston, J. S. Auditory-evoked far fields averaged from the scalp of humans. Brain. 94 (4), 681-696 (1971).
- Corwin, J. T., Bullock, T. H., Schweitzer, J. The auditory brain stem response in five vertebrate classes. Electroencephalography and Clinical Neurophysiology. 54 (6), 629-641 (1982).
- Carey, C. Avian Growth and Development. Evolution within the Altricial Precocial Spectrum. , Oxford University Press. Oxford. (1998).
- Kraemer, A., Baxter, C., Hendrix, A., Carr, C. E. Development of auditory sensitivity in the barn owl. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 203 (10), 843-853 (2017).
- Rebillard, G., Rubel, E. W. Electrophysiological study of the maturation of auditory responses from the inner ear of the chick. Brain Research. 229 (1), 15-23 (1981).
- Parks, T. N., Rubel, E. W. Organization and development of brain stem auditory nuclei of the chicken: organization of projections from n. magnocellularis to n. laminaris. Journal of Comparative Neurology. 164 (4), 435-448 (1975).
- Hong, H., Rollman, L., Feinstein, B., Sanchez, J. T. Developmental profile of ion channel specializations in the avian nucleus magnocellularis. Frontiers in Cellular Neuroscience. 10, 80(2016).
- Leao, R. M. The ion channels and synapses responsible for the physiological diversity of mammalian lower brainstem auditory neurons. Hearing Research. 376, 33-46 (2019).
- Oline, S. N., Ashida, G., Burger, R. M. Tonotopic optimization for temporal processing in the cochlear nucleus. Journal of Neuroscience. 36 (32), 8500-8515 (2016).
- Kopp-Scheinpflug, C. Your genes decide what you are listening to. Channels. 11 (5), 355-356 (2017).
- Sid, H., Schusser, B. Applications of gene editing in chickens: A new era is on the horizon. Frontiers in Genetics. 9, 456(2018).
- Brittan-Powell, E. F., Dooling, R. J., Gleich, O. Auditory brainstem responses in adult budgerigars (Melopsittacus undulatus). The Journal of the Acoustical Society of America. 112 (3), Pt 1 999-1008 (2002).
- Lohr, B., Brittan-Powell, E. F., Dooling, R. J. Auditory brainstem responses and auditory thresholds in woodpeckers. The Journal of the Acoustical Society of America. 133 (1), 337-342 (2013).
- Counter, S. A. Brain-stem evoked potentials and noise effects in seagulls. Comparative Biochemistry and Physiology. A, Comparative Physiology. 81 (4), 837-845 (1985).
- Crowell, S. E., et al. A comparison of auditory brainstem responses across diving bird species. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 201 (8), 803-815 (2015).
- Noirot, I. C., Brittan-Powell, E. F., Dooling, R. J. Masked auditory thresholds in three species of birds, as measured by the auditory brainstem response (L). Journal of the Acoustical Society of America. 129 (6), 3445-3448 (2011).
- McGee, J., et al. Auditory performance in bald eagles and red-tailed hawks: a comparative study of hearing in diurnal raptors. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 205 (6), 793-811 (2019).
- Brittan-Powell, E. F., Dooling, R. J., Ryals, B., Gleich, O. Electrophysiological and morphological development of the inner ear in Belgian Waterslager canaries. Hearing Research. 269 (1-2), 56-69 (2010).
- Kuokkanen, P. T., Kraemer, A., Kempter, R., Koppl, C., Carr, C. E. Auditory brainstem response wave iii is correlated with extracellular field potentials from nucleus laminaris of the barn owl. Acta Acustica United with Acustica. The Journal of the European Acoustics Association (EEIG). 104 (5), 874-877 (2018).
- Beatini, J. R., Proudfoot, G. A., Gall, M. D. Frequency sensitivity in Northern saw-whet owls (Aegolius acadicus). Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 204 (2), 145-154 (2018).
- Brittan-Powell, E. F., Lohr, B., Hahn, D. C., Dooling, R. J. Auditory brainstem responses in the Eastern Screech Owl: an estimate of auditory thresholds. The Journal of the Acoustical Society of America. 118 (1), 314-321 (2005).
- Katayama, A. Postnatal development of auditory function in the chicken revealed by auditory brainstem responses (ABRs). Electroencephalography and Clinical Neurophysiology. 62 (5), 388-398 (1985).
- Durham, D., Park, D. L., Girod, D. A. Breed differences in cochlear integrity in adult, commercially raised chickens. Hearing Research. 166 (1-2), 82-95 (2002).
- Kaiser, C. L., Girod, D. A., Durham, D. Breed-dependent susceptibility to acute sound exposure in young chickens. Hearing Research. 203 (1-2), 101-111 (2005).
- Hamdy, A. M., Vander Hel, W., Henken, A. M., Galal, A. G., Abd-Elmoty, A. K. Effects of air humidity during incubation and age after hatch on heat tolerance of neonatal male and female chicks. Poultry Science. 70 (7), 1499-1506 (1991).
- Bruzual, J. J., Peak, S. D., Brake, J., Peebles, E. D. Effects of relative humidity during the last five days of incubation and brooding temperature on performance of broiler chicks from young broiler breeders. Poultry Science. 79 (10), 1385-1391 (2000).
- vander Pol, C. W., van Roovert-Reijrink, I. A. M., Maatjens, C. M., vanden Brand, H., Molenaar, R. Effect of relative humidity during incubation at a set eggshell temperature and brooding temperature posthatch on embryonic mortality and chick quality. Poultry Science. 92 (8), 2145-2155 (2013).
- Buhr, R. J. Incubation relative humidity effects on allantoic fluid volume and hatchability. Poultry Science. 74 (5), 874-884 (1995).
- Galli, R., et al. Sexing of chicken eggs by fluorescence and Raman spectroscopy through the shell membrane. PLoS One. 13 (2), 0192554(2018).
- Otsuka, M., Miyashita, O., Shibata, M., Sato, F., Naito, M. A novel method for sexing day-old chicks using endoscope system. Poultry Science. 95 (11), 2685-2689 (2016).
- Kaiser, A. The ontogeny of homeothermic regulation in post-hatching chicks: its influence on the development of hearing. Comparative Biochemistry and Physiology. A, Comparative Physiology. 103 (1), 105-111 (1992).
- Kuba, H., Yamada, R., Ohmori, H. Evaluation of the limiting acuity of coincidence detection in nucleus laminaris of the chicken. The Journal of Physiology. 552, Pt 2 611-620 (2003).
- Shaheen, L. A., Valero, M. D., Liberman, M. C. Towards a diagnosis of cochlear neuropathy with envelope following responses. Journal of the Association for Research in Otolaryngology. 16 (6), 727-745 (2015).
- Hill, E. M., Koay, G., Heffner, R. S., Heffner, H. E. Audiogram of the chicken (Gallus gallus domesticus) from 2 Hz to 9 kHz. Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 200 (10), 863-870 (2014).
- Rossi, G. T., Britt, R. H. Effects of hypothermia on the cat brainstem auditory evoked response. Electroencephalography and Clinical Neurophysiology. 57 (2), 143-155 (1984).
- Doyle, W. J., Fria, T. J. The effects of hypothermia on the latencies of the auditory brainstem response (ABR) in the rhesus monkey. Electroencephalography and Clinical Neurophysiology. 60 (3), 258-266 (1985).
- Guan, X., Gan, R. Z. Effect of middle ear fluid on sound transmission and auditory brainstem response in guinea pigs. Hearing Research. 277 (1-2), 96-106 (2011).
- Ravicz, M. E., Rosowski, J. J., Merchant, S. N. Mechanisms of hearing loss resulting from middle-ear fluid. Hearing Research. 195 (1-2), 103-130 (2004).
- Wang, Y., Zorio, D. A. R., Karten, H. J. Heterogeneous organization and connectivity of the chicken auditory thalamus (Gallus gallus). Journal of Comparative Neurology. 525 (14), 3044-3071 (2017).
- Wang, Y., Karten, H. J. Three subdivisions of the auditory midbrain in chicks (Gallus gallus) identified by their afferent and commissural projections. Journal of Comparative Neurology. 518 (8), 1199-1219 (2010).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. Journal of Neuroscience. 30 (36), 12075-12083 (2010).
- Beutelmann, R., Laumen, G., Tollin, D., Klump, G. M. Amplitude and phase equalization of stimuli for click evoked auditory brainstem responses. The Journal of the Acoustical Society of America. 137 (1), 71-77 (2015).
- Liberman, M. C. Noise-induced and age-related hearing loss: new perspectives and potential therapies. F1000Research. 6, 927(2017).
- Efrati, A., Gutfreund, Y. Early life exposure to noise alters the representation of auditory localization cues in the auditory space map of the barn owl. Journal of Neurophysiology. 105 (5), 2522-2535 (2011).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments: JoVE. (124), e55628(2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados