Method Article
ニワトリ孵化子の聴覚脳幹応答の評価
要約
私たちは標準的な聴覚脳幹応答(ABR)技術を使用し、聴覚機能のための早熟な鳥類モデルである孵化鶏に適用しました。このプロトコルは、動物の準備とABRの獲得技術を詳細に概説し、他の鳥類またはげっ歯類のモデルに翻訳できる手順を示しています。
要約
聴覚脳幹応答(ABR)は、臨床聴覚学、非ヒト動物、およびヒト研究において非常に貴重なアッセイである。他の脊椎動物モデルシステムにおける聴覚神経同期の測定および聴覚感受性の推定におけるABRの広範な使用にもかかわらず、ニワトリ中のABRを記録する方法はほぼ40年間報告されていない。ニワトリは、その聴覚系が後期胚期および早期孵化期に機能的成熟に近いため、堅牢な動物研究モデルを提供する。我々は、ニワトリの孵化子の皮下針電極アレイを用いて1チャンネルまたは2チャンネルのABR記録を引き出すために使用される方法を実証した。電極記録構成(すなわち、モンタージュ)にかかわらず、ABR記録には、超閾値クリック刺激の最初の6ミリ秒以内に3〜4個の正方向のピーク波形が含まれていた。ピークからトラフへの波形振幅は、高強度レベルで2~11μVの範囲であり、正のピークは予想されるレイテンシ強度関数(すなわち、強度低下の関数としてのレイテンシの増加)を示す。皮膚が緩むと外耳道が閉塞し、動物の動きが刺激トランスデューサを外す可能性があるため、標準化されたイヤホンの位置が最適な記録に不可欠でした。ピーク振幅は小さく、動物の体温が下がるにつれてレイテンシーは長くなり、生理学的体温を維持する必要性が支持された。若い孵化子(孵化1日目から<3時間後)では、閾値は〜5dB上昇し、ピークレイテンシは〜1〜2ms増加し、ピークからトラフへの振幅は、古い孵化子と比較して〜1μV減少した。これは、潜在的な伝導関連の問題(すなわち、中耳腔内の流体)を示唆しており、若い孵化子のために考慮されるべきである。全体として、ここで概説したABR法は、ニワトリの孵化子における 生体内 聴覚機能の正確かつ再現性のある記録を可能にし、発達のさまざまな段階に適用することができる。このような知見は、難聴、老化、または他の聴覚関連の操作のヒトおよび哺乳類モデルと容易に比較される。
概要
音刺激に対する誘発された神経応答の研究は、半世紀以上前にさかのぼります1。聴覚脳幹応答(ABR)は、何十年もの間、非ヒト動物とヒトの両方で聴覚機能の尺度として利用されてきた誘発電位である。ヒトABRは、従来ローマ数字(I-VII)2でラベル付けされた5〜7個の波形ピークを有する。これらのピークは、神経応答のレイテンシ(ミリ秒単位の発生時間)と振幅(マイクロボルト単位のピークからトラフへのサイズ)に基づいて分析されます。ABRは、聴覚神経の機能および完全性、ならびに脳幹および聴力閾値感受性を評価するのに有用である。聴覚系の欠損は、ABRの待ち時間および振幅の不在、減少、長期化、または異常な結果をもたらす。驚くべきことに、これらのパラメータはヒトと他の動物でほぼ同一であり、脊椎動物モデル全体で聴覚機能の一貫した客観的試験となっている3。
そのようなモデルシステムの1つは鶏肉であり、それは様々な理由で特に有用である。鳥類は、アルトリシャルまたは早熟4として分類することができます。アルトリシャルバードは、まだ発達中の感覚で孵化します。例えば、メンフクロウはハッチ5の4日後まで一貫したABRを示さない。鶏のような早熟な動物は、ほぼ成熟した感覚で孵化します。聴力の発症は胚発生において起こり、孵化の数日前(胚発生21日目)に、聴覚系は機能的成熟6、7、8に近い。甲羅鳥類およびほとんどの哺乳類モデルは、発達に影響を与え、聴覚が成熟するまで畜産を必要とする外因性因子の影響を受けやすい。チキンABRはハッチと同じ日に行うことができ、給餌や豊かな環境の必要性を忘れることができます。
胚性ニワトリは、特に聴覚脳幹において、生理学と発達のためのよく研究されたモデルとなっている。具体的な構造には、モクレン核(NM)と角核(NA)に分けられるニワトリ蝸牛核と、ラミナリス核(NL)6,7として知られる内側の優れたオリーブの鳥類の相関があります。ABRは、前脳および皮質のレベルの前に中枢聴覚機能に焦点を当てるのに理想的である。インビボABR測定と、発達8、生理学9、トノトピー10、および遺伝学11,12のインビトロニューロン研究との間の翻訳は、全体的な聴覚機能の研究を支援する理想的な研究機会を提供する。
ABRは哺乳類モデルで広く研究されてきたが、鳥類にはあまり焦点が当てられていない。以前の鳥類ABR研究には、ブッジリガー13、キツツキ14、カモメ15、潜水鳥16、シマウマフィンチ17、日周猛禽類18、カナリア19、フクロウ5、20、21、22およびニワトリ23の3種の特徴付けが含まれる。チキンABRの最後の徹底的な特性評価から約40年が経過したことを考えると、以前に使用されていた機器や技術の多くは変化しました。他の鳥類モデルの研究からの洞察は、現代のニワトリABR方法論の開発に役立ち、ニワトリABRとの比較としても役立ちます。本稿では、孵化ニワトリのABR記録を可能にするための実験セットアップと設計を概説し、発生の初期段階やその他の小型げっ歯類および鳥類モデルにも適用できる。さらに、鶏の早熟な発達を考えると、発達操作は広範な畜産なしで行うことができます。発達中の胚への操作は、動物がほぼ成熟した聴覚能力で孵化してからわずか数時間後に評価することができます。
プロトコル
ここで説明する実験は、ノースウェスタン大学の施設動物ケアおよび使用委員会(IACUC)によって承認され、実験動物のケアと使用のための国立衛生研究所ガイドに従って実施されました。
1. 鶏の飼育
- 受精した白いレッグホーン鶏の卵を入手してください。
注:科学研究に使用されているいくつかの鶏の品種がありますが、ここに示されている結果は白いレッグホーンチキン(Gallus gallus domesticus)からのものです。品種間のABRのばらつきは不明であるが、成体の産卵鶏と肉を生産するブロイラー鶏を比較すると、いくつかの違いが見つかっている24,25。 - 卵を38°C、湿度50%で、所望の試験日の21日前に孵化させる。
注:卵を38°Cですぐに孵化させない場合は、14°C、湿度40%で保存できます。しかし、卵が14°Cに長く保たれているほど、生存可能な孵化子に発達する可能性は低くなります。7日後、卵の生存率は、卵が14°Cに保たれる期間に応じて50%まで低下する可能性があります。 卵の生存率も冬には低下します。 - 定期的に卵を1日2〜3回回します。ほとんどのインキュベーターには、これを自動的に実行するメカニズムがあります。
- 6個以上の卵を保持する発泡スチロールインキュベーターまたはインキュベーターを使用する場合は、孵化前日に卵子を小型の38°Cインキュベーターに移し、胚発生20日目(E20)。卵はインキュベーターにセットされてから21日後(E21)に孵化する必要があります。
注:孵化の過程で、動物は卵から「配管」し始め、最終的に卵全体の周りを回る小さな穴を作ります。条件が乾燥しすぎると、卵が乾燥し、動物は孵化できなくなります。湿度は、卵の孵化生存率に関する以前の研究に基づいて、約50%に保つ必要があります26,27,28,29。 - 動物の年齢を決定します。ハッチが直接目撃されない場合、年齢の唯一の指標は羊水が乾燥するのにかかる時間が2〜3時間です。
注:孵化子インキュベーターは、処理された孵化子の数に基づいて、毎日70%イソプロピルアルコールで徹底的に清掃する必要があります。鶏の孵化子はしばしば排泄物、羽毛、羊水をインキュベーターに残し、条件や空気の質を汚染する可能性があります。
2. 薬物製剤
- 動物を大きな計量ボートに入れて体重を量る。十分に穏やかな配置で、動物は動くべきではありません。
注:質量は30〜45gの範囲です。若い動物は、卵黄の埋蔵量のためにしばしば重く、まだ廃棄物を排泄していません。24歳に近づく年配の動物とP2は通常体重が少ないです。 - ケタミン(100mg / mL)とキシラジン(20mg / mL)の麻酔薬カクテルを調製し、投与量が動物の体重に基づいて50mg / kgケタミンおよび16.68mg / kgキシラジンになるようにする。
注:この薬のカクテルは、1 mLのケタミン(100 mg / mL)、1.5 mLのキシラジン(20 mg / mL)、および2.5mLのH 2 Oで作ることができます麻酔カクテル注射は、動物の体重の30〜45 gの範囲に基づいて0.05〜0.1 mLの範囲です。
3. 薬物注射と動物準備
- 片手で動物を持ち、足を下に押さえるようにしてください。
- 動物の胸骨、キールを感じてください。キールの両側には胸の筋肉があります。
- 29G針と注射器を使用して皮膚に5mm浸透させ、ケタミン/キシラジンカクテルを乳房の筋肉に注入します。動物の体重に基づいて0.05〜0.1mLを注射する。
- 注射後、動物をインキュベーターに戻します。麻酔薬が効くので、動物の体温を数分間維持します。
- 鉗子を使って動物のつま先をつまみ、首がぐったりしているかどうかを確認します。反射がなく、首がぐったりしている場合、動物は無意識です。
- 羽の羽を使って鶏の性別を決定します。羽がすべて同じ長さであれば、動物は男性です。羽の長さが異なる場合、動物は女性30です。
注:動物を性交する別の方法は通気です。男性性器はクロアカ31に見られる。この方法は非常に困難であり、正しく行われないと動物に害を及ぼす可能性があります。翼羽法を使用することをお勧めします。 - 綿の先端アプリケーターで脱毛クリームを頭と首の部分、特に鳥の耳の開口部の近くに塗布します。
- 70%イソプロピルアルコールワイプを使用して、羽毛、残りの脱毛クリーム、頭と首の皮膚を拭き取ります。
- 70%イソプロピルアルコールワイプを使用して、皮下電極と直腸プローブを滅菌します。
- 動物を遮音および電気的に遮蔽されたチャンバーに入れる。環境が電気的および音響的ノイズを最小限に抑え、最高の録音を行うようにします。
注:ここでの実験は、24 x 24 x 25インチのカスタム免音エンクロージャで行われました。音響ノイズ、および交流電流(米国では60Hz)からの電気ノイズを排除する部屋または部屋であれば十分です。 - 動物の体温を維持するために、加熱パッドまたは温度制御システムを使用してください。
- 潤滑された直腸プローブを挿入して、動物の体温が37〜41°C(98.6〜105°F)の間で維持されていることを確認してください32,33。
注:プローブのサイズが正しくない場合、動物は温度プローブの上に横たわることができます。 - 動物の頭を所定の位置に固定するか、くちばしを物体に押し付けて、不要な動きを避けます。これは、呼吸が妨げられていない場合、粘土をモデリングすることで行うことができます。
- 動物が試験中に意識を取り戻し始めた場合、元の投与量の2分の1である麻酔薬カクテルの補助注射を投与する。
注:体の動きや発声は、サプリメントの投与量を投与しなければならないという兆候です。小さなくちばしの動きは呼吸を示し、許容されます。
4. 電極の配置
- 参照電極、活性電極、および共通接地電極の 3 つのステンレス鋼、塩化銀ニードル電極を使用します。
メモ: 参照電極は、反転または「-」とも呼ばれます。活性電極は、非反転または「+」とも呼ばれる。 - 各電極を頭部に皮下に2〜3mm入れるが、頭蓋骨を貫通するほど深くはない。長さ7mm、直径0.4mmの電極を使用してください。
- 電極を皮膚から突き出し、先端を露出させます。これは、皮膚との接触を最小限に抑え、動物34全体にわたって一貫した挿入深さを保証するのに役立つ。
注:電極線は、電極を配置した後、電極を引き抜いたり、皮膚を引っ張ったりする張力がないように、十分な弛みがあるはずです。 - シングルチャンネル録音の場合は、正中線の頭蓋骨の上、外耳道の尾まで活性電極を配置します。
- 参照電極を刺激が届く耳の後ろに置き、グランド電極を首の反対側の外耳道の後ろに置きます。
注:動物の頭蓋骨または外耳道で手術を行う場合は、動物の正中線の首の参照電極を置きます。これとステップ 4.4.1 はどちらも水平電極記録モンタージュと見なされます。
- 参照電極を刺激が届く耳の後ろに置き、グランド電極を首の反対側の外耳道の後ろに置きます。
- 2 チャンネル録音の場合は、アダプター・ケーブルを必要とする 2 つの負極と結合された正極を使用します。接地電極を皮下に首に置き、各外耳道の後ろに1つの参照電極を置きます。
- 電極のインピーダンスを確認します。電極全体のインピーダンスが5.0kΩを超えないようにしてください。電極間インピーダンスを3.0kΩ以下に維持してください。
5. ABR録音
- 集録ハードウェアとソフトウェアに応じて、使用する刺激周波数にわたって正しいサウンドレベルが得られるようにキャリブレーションを実行してください。
メモ:キャリブレーションの手法は機器によって異なります(説明を参照)。一部のプログラムでは、サウンド減衰をソフトウェア内で編集できます。ここで実施された較正手順では、1/8インチのB&K 4138コンデンサーマイクロホンを使用して、ひよこの外耳道(約5mm)に近似した閉じたカプラーシステム内で周波数刺激を記録しました。鶏の孵化子校正表は 補足表として提供されています。 - 音変換装置を動物の活動的な耳に向かって動かす。音響探触子を外耳道の2mmの浅い深さに置きます。
メモ:音響探触子によっては、プラスチック製の鏡を外耳道に取り付けて挿入することができます。スペキュラムの配置は重要です。音が運河の壁によって遮られたり、外耳道が挟まれて閉じられたりすると、ABRは存在しないか、しきい値の〜40dBシフトに似ています。 - 試験中に動物に結果が異常または存在しないかどうかを確認してください。その場合は、外耳道に音響探触子の位置を変えます。
注:皮膚が緩んでおり、動物の動きが可能であるため、録音中に鏡の配置がずれることがあります。しかし、正しい麻酔薬注射と動物が完全に意識を失えば、記録は30〜45分間中断されずに行うことができます。
6. データ取得
- 十分な機器/ソフトウェアを利用して、音刺激を生成し、ABR録音を録音/取得します。
メモ:ABR取得用の市販またはカスタムシステムは数多くあります。これらの実験には、市販のインテリジェント聴覚システム(IHS)SmartEP USBプラットフォームが使用されました。記録パラメータを操作する機能は非常に重要です。これらには、刺激強度、刺激長、刺激周波数、刺激提示率、ハイパスおよびローパスフィルタ、アーチファクト除去、掃引数、サンプリング速度、エンベロープ形状、および刺激分極が含まれるがこれらに限定されない。 - アーチファクト除去(AR)の上限と下限を±25μVに設定し、スイープ中の動物の動きやノイズがそのスイープを解析から除外するようにします。テストされた母集団全体で、アーティファクトのために拒否された掃引全体の1%未満でした。
- 少なくとも1024回のスイープを収集して、総平均応答を求めます。これは、それぞれ512スイープの2つの録音で行うことができます。これにより、応答が刺激を誘発し、反復可能であることも保証されます。
- ゲインを 100,000、ローパスフィルタを 100 Hz、ハイパスフィルタを 3000 Hz に設定します。
メモ: ローパスフィルターとハイパスフィルターの設定は、IHS システムを使用した録音に最適です。したがって、これらのパラメーターは推奨事項です。BIOSIGソフトウェアを使用した他の鳥類のABR記録は、30〜3000Hz 5、13、14、16、22の間の信号をフィルタリングした。 - 刺激の提示率を 1 秒あたり 10 ~ 20 の刺激に設定します。プレゼンテーション率が高いと、ABR のピーク待機時間が、特に後のピーク13 でシフトします。プレゼンテーション率が低いと、ABR の取得に必要な時間が長くなります。
- クリック刺激の時間時間を100μsに設定します。
- トーンバースト刺激を使用する場合は、目的の効果に基づいて刺激の周波数と持続時間を編集します。トーンバースト刺激には100〜4000Hzの範囲が用いられたが、成鶏の行動聴覚の範囲は2〜9000Hz35の範囲であった。
メモ: IHS システムでは、トーンバースト刺激の立ち上がり時間と立ち下がり時間は、スペクトルエンベロープ形状が台形である場合にのみ変更できます。ただし、余弦の二乗エンベロープとブラックマンエンベロープは、動物のABR実験で一般的に使用されるプリセットの立上り時間と立ち下がり時間を提供します。IHSシステムは、トーンバーストのスペクトルエンベロープを表示して、適切な立上り時間と立ち下がり時間を確保することができます。クリック刺激の立ち上がり時間と立ち下がり時間はIHSでは編集できません。
- トーンバースト刺激を使用する場合は、目的の効果に基づいて刺激の周波数と持続時間を編集します。トーンバースト刺激には100〜4000Hzの範囲が用いられたが、成鶏の行動聴覚の範囲は2〜9000Hz35の範囲であった。
- サンプリングレートを許容最大値(通常は40kHz)に設定して、最高の解像度のデータを得ます。
注: IHS を含む一部のシステムでは、限られた数のサンプリング・ポイントが使用され、記録ウィンドウの長さが変更されます。40 kHz(25 μs周期)のサンプリングレートでは12ミリ秒の記録ウィンドウしか許さないため、トーンバーストABRをキャプチャするには、20 kHzのサンプリングレート(50 μs周期)を使用して24ミリ秒の記録ウィンドウを可能にしました。クリックとトーンバーストのABRを直接比較する場合は、サンプリングレートを一定に保ち、同じ解像度を維持します。 - 刺激分極を交互に設定します。これは、ABR録音から蝸牛マイクロフォニックの視覚化を排除するために行われます。蝸牛マイクロフォニックを視覚化するには、刺激極性の希薄化または凝縮を使用します。
メモ: 刺激を選択するときに、多くの設定を変更できます。提供されるゲインとフィルタの設定は、他の機器の設定には最適ではない場合があります。ほとんどのABRマシンの工場出荷時のデフォルトは、孵化鶏に記録するように設定されていません。 - 512 回のスイープを記録する場合は、2 つの別々のテストを組み合わせて、1024 回のスイープ平均を作成します。
- クリックまたはトーンバースト刺激の場合は、超閾値強度でABRを獲得します。
- 誘発された応答が識別できなくなるまで、より低い強度で記録を続けます。
- ABR閾値を、検出可能な誘発応答を惹起する最も低い刺激強度として定義する。刺激強度を 5 dBSPL のステップで下げて、検出可能なピークを引き出す最も低い刺激強度を見つけます。
7. 安楽死と実験終了
- ABRが取得されたら、安楽死溶液(ペントバルビタールナトリウム390mg / mLフェニトインナトリウム50mg / mL)の過剰摂取(0.1mL)を調製する。
- つま先のピンチで反射がないことを確認した後、安楽死液を29G針で乳房筋肉に5mmの深さで注入する。注射技術は麻酔薬注射と同じである。
注:動物は数分後に有効期限が切れます。動きが検出されなくなるまで動物を操作したり首を切ったりしないでください。代替の安楽死技術は、翼の下の上腕静脈に静脈内注射を行うことである。 - 動物が反射的でなく、呼吸と鼓動が止まったらすぐに、鋭いはさみやはさみで素早く首を切ってください。
- 加熱パッド、直腸プローブ、および塩化銀電極を70%イソプロピルアルコールワイプで清掃します。
- 取得したすべてのトレースが保存されていることを確認します。さらに分析するには、ファイルを.txtファイルとしてエクスポートし、メモ帳で表示したり、スプレッドシートにインポートしたりできます。
結果
孵化雛のための代表的なABR記録
以下の代表的および集団的結果は、43匹の動物で行われたABR記録から来ている。閾値を超えるクリック刺激(75dBSPL)に応答して、3つの正のピークがすべての孵化子にわたって一貫して観察された。これらのピークは、刺激開始後6ミリ秒以内に発生した。まれに、第4のピークも〜6msで観察された。鳥類のABRピークの同定は動物によって異なるが(議論を参照)、ピークはローマ数字の波I-IVとしてラベル付けされ、同定された。ラベル付きピークを持つ代表的なABR波形を 図1A (トップトレース)に示します。 図1B は、代表的なトレースでラベル付けされた波IおよびIIIのレイテンシ強度関数を示す。Wave I のピーク遅延は、刺激強度が 20 dB 減少するごとに約 0.3 ミリ秒増加しました。平均して、I-III波は75dBSPLでそれぞれ1.50ミリ秒(±0.02ミリ秒)、3.00ミリ秒(±0.06ミリ秒)、および4.13ミリ秒(±0.09ミリ秒)で発生しました(図1C)。ウェーブ I とウェーブ III は、常に特異なピークとして提示されます。時折、Wave II では、2.5 ~ 3.2 ミリ秒の間に複数の小さなピークが見られました。各ピークには対応するトラフがあり、すべてのピークの中で最も大きいWave Iのピーク間振幅は平均7μVで、75dB SPLで最大振幅11μVに近づきました。
最大の振幅に加えて、ひよこABRの波Iは、動物間のピークレイテンシの変動が最も小さいことを示した。したがって、このピークは、聴力閾値感受性を推定するために使用された。ABR閾値は、識別可能で再現可能な波形ピークを惹起する最も低い刺激強度として定義した。これは、実験者によって主観的に決定され、閾値の一致について第2の実験者によってクロスチェックされた。ピークはクリック刺激を使用するとよりよく定義され、識別が容易でしたが、トーンバーストは刺激周波数とそのパラメータに応じて変化する定義済みで識別可能なピークも生成しました(図1D、n = 4羽のひよこ)。クリック誘発 ABR しきい値は、1000 Hz を除き、トーン バースト誘発しきい値よりも低かった。クリック刺激のしきい値は 10 ~ 30 dBSPL の間で変化した。30dBSPL>の識別可能なピークを示さなかったクリック誘発ABRは、しばしば、動物の動きのために鏡面鏡が外耳道から外れた結果であった。
体温の低下はABRの待ち時間を増加させます
神経活動の速度−波形振幅のピーク発生(すなわち、潜時)によって測定されるように−は、より低い体温において減少することが知られている36、37。この現象は、75dBSPLクリック刺激を用いた孵化鶏ABRにおいて観察された。代表的なトレースを 図2Aに示す。体温が39°Cから低下すると、同じ刺激強度レベルにもかかわらず、ABRピークの潜伏時間が遅くなった。 図2B は、代表的な痕跡に対する低い体温の関数としてのWave IおよびIIIの潜伏を示す。体温の低下とWave Iピークレイテンシの発生との間には強い相関関係(R2 = 0.89)があった(図2C、n = 5羽のひよこ)。これらの結果は、ABR記録中にほぼ正常な体温を維持する必要性を実証している。ほぼ正常な体温が維持されない場合、ABRの潜伏強度関数および振幅測定は非常に可変であり、しばしば不正確である。
初期の孵化子の潜伏と振幅の違い
研究によると、ひよこの聴覚の発症に関連する神経活動は、後期胚年齢8で成熟に近づいていることが示されています。しかし、非常に初期の孵化子のサブセット(ハッチング後<3時間)では、75dB SPLクリック刺激に応答してABR波形(n = 4)のピークレイテンシシフトが観察されたか、誘発電位が識別できませんでした(n = 2ひよこ)。2匹の若い孵化子では、トーンバーストABRは引き起こすことができず、クリック閾値は50dBSPL上昇した。これは、動物の外耳道/中耳腔にまだ体液がある導電性の問題、または未発達の神経成分が原因である可能性があります。哺乳類の研究では、新生児38,39で50dBの閾値シフトが報告されています。ここで使用された代表的な動物は生後>3時間で、これも羽が乾くのにかかる時間の長さと一致しました。図3Aは、若い(P1、<3時間齢)および高齢の孵化子(P2)から記録されたABRを示す。分析のために、3つの若い孵化子だけが3つのABRピークすべてを提示した。ピーク波形レイテンシは有意に長く、波形振幅は古いハッチリングと比較してわずかに減少した(それぞれ図3B-C)。
参照電極の配置と2チャンネルABR記録
図4では、参照電極の配置は2つの異なる位置間で変更されましたが、それでも同等のABR記録が得られました。2つの参照電極配置を持つ同じ動物の75dBSPLクリックトレースを比較すると、ピークtoトラフ波形振幅とピーク波形レイテンシの差が最小限に抑えられました(図4A)。乳様の配置は、方法論的には、参照電極を乳様体または大尖頭上に配置した哺乳動物のABR実験に似ていた。参照電極に首の配置を使用することは、どちらかの耳に操作または手術が行われた場合に有益であろう。興味深いことに、乳様体配置のためのウェーブIIピーク振幅(赤色トレース)は、首配置のためのウェーブIIピーク(黒トレース)の1ms後に発生した。この時間差は、電極配置に対するABR神経生成の部位を反映している可能性が高い。
2チャンネルのセットアップを使用して、1つのアクティブ記録電極(頭頂部配置)と2つの参照電極(乳房配置)を使用して、左耳と右耳の両方のABRを取得しました(図4B)。2つの耳の間の反応は類似しており、ピーク振幅のわずかな変化はイヤホンの位置による可能性が高い。左耳と右耳の両方の潜伏が同等であることは、孵化鶏の耳と脳幹半球の両方の等しく健康な機能を支持した。2チャンネルの録音モンタージュはバイノーラルABRにも使用できますが、これらの録音には追加の考慮事項が必要です。

図1:孵化ヒヨコのクリックおよびトーン誘発刺激に対する代表的な記録。(A)異なる刺激強度レベルの関数としての孵化ヒナヨコ(P2)からの代表的なABR記録。マイクロボルト(μV)で3~4個の正のピークは、刺激開始後6ms以内に同定できます(時間=0ms)。波はローマ数字で識別された。ピークからトラフへの振幅は、刺激強度レベルが低いほど減少します。(B)(A)に示す代表的なトレースに対する波動IおよびIIIのレイテンシ強度関数。これらのピークのみが分析され、ウェーブIIは典型的には強度<45dBSPLでは観察されなかった。(C) クリック誘発ABRピーク波形のレイテンシ(n = 43ひよこ)。エラーバーは平均の標準誤差(SEM)を示す。(D)3つの異なる周波数で4羽の孵化雛の平均トーン誘発ABR(黒い痕跡)。赤色のトレース = 平均(SEM)刺激の標準誤差 = 75 dBSPL.この図以降の図において、エラーバーはSEMを示し、右耳は刺激耳であった。(両耳を刺激した図4Bの例外)。この図の拡大版を表示するには、ここをクリックしてください。

図2:ABR記録に対する体温の影響 (A)孵化ヒナヨコ(P2)の体温関数としての代表的なABR記録。体温が低い場合、ピーク波形のレイテンシは増加しましたが、ピークからトラフへの振幅は比較的変化しませんでした。(B)(A)に示す代表的なトレースに対する波IおよびIIIのレイテンシ-温度関数。(c)5羽の雛について潜時と温度変化の関係を示す集団データ(p <0.01、R2 =0.89)。同様の傾向が波IIおよびIIIについて観察された(データは示さず)。 この図の拡大版を表示するには、ここをクリックしてください。
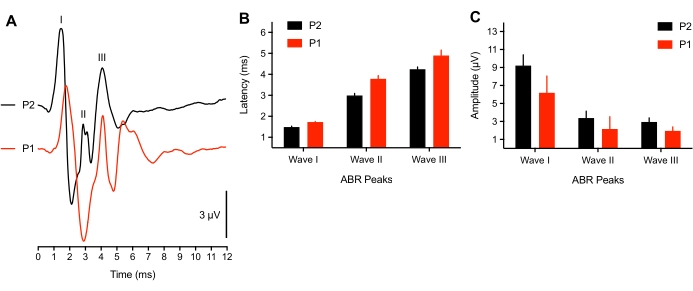
図3:ABR記録における年齢関連の違い 。(A)P2(黒い痕跡)とP1(ハッチング後<3時間、赤い痕跡)における代表的な孵化ヒヨコの代表的なABR記録(重なり合った)。(B) 波I、II、およびIIIのピーク波形レイテンシ(年齢の関数として)。波I-IIIのレイテンシは年齢によって有意に異なっていた(P < 0.05、n = 6羽のひよこ)。(C) 波I、II、およびIIIのピークからトラフへの波形振幅(年齢の関数として)。 この図の拡大版を表示するには、ここをクリックしてください。
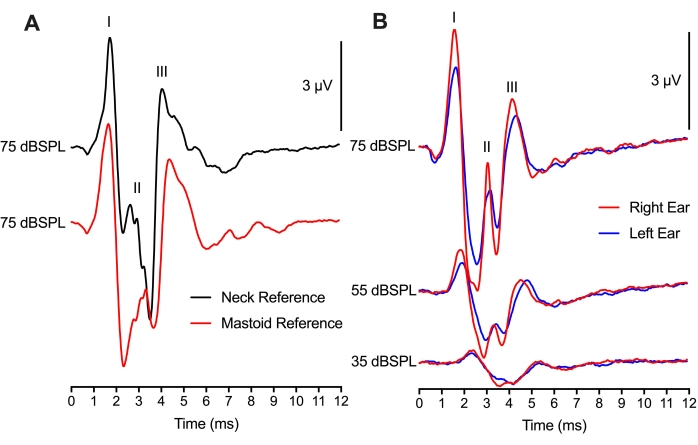
図4:電極配置および2チャンネル ABR記録:(A)参照電極を首(黒い痕跡)または乳様(赤い痕跡)に置いた同じハッチリングチック(P2)からの代表的なABR記録(重なり合った)。活性電極を、両方の電極記録モンタージュのために頭蓋骨の正中線に配置した。波IとIIIのレイテンシ、および波IとIIIの振幅は両方の条件でほぼ同じです。Wave IIのレイテンシは早く、振幅は頸部組織に配置された電極の方が大きくなります。(b)左右の耳を順次刺激しながら2チャンネル録音。3つの異なる強度レベルで左耳(青色の痕跡)および右耳(赤色の痕跡)の乳様体に配置された参照電極を有する同じ孵化雛(P2)からの代表的なABR記録(重なり合った)。 この図の拡大版を表示するには、ここをクリックしてください。
補足表: 鶏の孵化子の口径測定テーブル。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
鳥類の聴覚脳幹はよく研究されており、多くの構造は哺乳類の聴覚経路に類似している。聴覚神経は、2つの一次中心核、蝸牛核マグノセルラーリス(NM)およびアンギュラリス(NA)に興奮性入力を提供する。NMは、興奮性突起をその聴覚標的であるラミナリス核(NL)7に両側的に送る。NLは中脳核ラテラリス、パース背部(MLd)40,41に投影する。NLはまた、NM、NA、およびNL42にフィードバック阻害を提供する上オリバリー核(SON)に投影する。この下部聴覚脳幹微小回路は、それが従属する機能、音の局在化、および両耳聴覚33のために絶妙に保存されています。鳥類の上部聴覚脳幹領域はまた、哺乳類の側方レムニスカスに類似した核および中脳の下顎骨を有する。これらの類似性を考慮すると、聴覚中脳までの鳥類ABRの組成は、すべての脊椎動物で同等である。
複数の鳥類種が刺激開始後6ms以内に3つの正のピークを示すが、ABRピークと中央聴覚構造との相関関係にはある程度のばらつきがある。波動Iは末梢脳底乳頭および聴覚神経からの最初の神経応答であると合理的に推測することができ、個人間でほとんど変動性を示さない(図1C)。その後の波動の同定はそれほど確実ではなく、種によって異なる可能性があります。Kuokkanen et al.17 は最近、メンフクロウのABRの波IIIがNLによって生成されることを決定した。したがって、第II波が蝸牛核20のNMおよびNAに由来すると主張することは合理的である。ただし、フクロウ波IIIは、刺激開始から3ms後に発生した正のピークと定義した。これは、孵化鶏ABRに定義されているウェーブIIに相当する。メンフクロウABRでは、波IとIIが組み合わされました。
孵化鶏は通常6ms以内に3つのピークを示したが、4番目のピークが時折観察された(例えば、 図1A参照)。母集団データ、より大きなサンプルサイズ、および追加の実験パラダイムは、第4波、場合によっては5波のチキンABRをサポートするために必要になります。最も一貫性のある発見は、ここに示した3つのピーク表現でした。
ABRは神経同期の尺度として定義されるので、聴覚経路における主要な核は、ABRにおける各陽性のピークを表すことができる。聴覚神経からNM/NAへ、そしてNLへと流れる信号は、それぞれ孵化鶏ABRの波I、II、IIIを定義することができる。さらに、ニワトリABRの後期に生じる第4のピークは、上部脳幹または中脳の聴覚構造を表す可能性がある。鳥類ABRの特徴付けは、早熟鳥と甲虫鳥の違いも考慮する必要があります。聴覚応答の成熟は種によって異なり、捕食者の行動や発声学習などの他の重要な特性によっても影響を受けます4。いずれにせよ、記載された方法および技術は、様々な鳥類および脊椎動物種に容易に適用される。
動物の体温を維持することの重要性を図2に示します。内部体温が低下するにつれて、ABR応答の潜伏時間は同じ刺激強度レベルで増加した。これは、体温が32°C36,37を下回るとより顕著になります。ABRのおよそ1msのレイテンシ増加は、ニワトリ23において以前に報告されたよりも小さい。しかし、片山23は12日齢の孵化子を使用し、冷却し、その後4時間かけて温めました。図 2 のデータは、20 分間にわたる冷却プロセス中に記録されました。最高の品質と最も一貫した記録を得るためには、動物の体温を維持しなければならず、すべての記録は動物間で同じ生理学的温度で行われなければなりません。
ABRに対する年齢の影響はわずかですが、考慮することが重要です。ABRの波IとIIのレイテンシだけが有意に異なっていたが、これは 部分的には図3で3匹の若い孵化子しか使用されなかったことによるものである。他の3つは、3つの識別可能なABRピークを示さなかった。ABR振幅とスレッショルドシフトは、大きなサンプルサイズを使用したり、周波数固有のABRを比較したりする場合にも明らかです。この加齢に伴う影響は、鶏肉の中耳の体液によって引き起こされる可能性があります。このような導電性の変化は、ヒトおよび他の哺乳動物モデルの両方についてABR閾値の顕著な増加をもたらす38、39。
2つの異なる記録モンタージュを用いて、同様の応答が観察された(図4A)。最も一般的なモンタージュは、参照電極を耳の刺激を受ける背後に配置するが、参照電極を頸部組織に持つことは、ABRに伴う外科的介入がある場合に有用であり得る。しかし、2チャンネルのABR記録を使用する場合、参照電極は別々に対称的に配置する必要がありますが、参照電極を首に配置すると困難です。参照電極の乳様の位置は、記録のできるだけ多くの側面を標準化するために推奨されます。2チャンネルABR録音は、余分な準備をほとんど必要としない効果的なツールであり、耳の間で同様の反応をもたらします。わずかな振幅差は、イヤホンの位置によるものと考えられた。2チャンネル録音により、実験的に操作された耳または脳半球と対照とを簡単に比較できます。この設定は、バイノーラル ABR をテストするためにも必要になります。ニワトリABRを用いた将来の実験は、記録構成およびモンタージュ34に関する以前の文献を参照することができる。
この方法にはいくつかの制限があります。ステップ5.1で述べたように、スペキュラムの配置が悪いと、応答として40dBSPLシフトが発生する可能性があります。これにより、操作または改造された動物の誤った解釈が発生する可能性があります。次の予防措置をお勧めします:操作されたモデルまたは変異モデルのABRを取得する前に、制御データの大規模なサンプルを取得します。録音間で刺激強度を 20 dBSPL 以上減らさないでください。振幅またはレイテンシが予想以上にシフトした場合は、動物と鏡の位置を確認してください。そのABR刺激を繰り返して変化を観察します。スペキュラムが移動した場合は、以前のテストを再取得します。もう 1 つの制限は、ABR のキャリブレーションです。音圧レベルを記録するための適切な較正がなければ、動物に提示される強度は不明である。音出力を測定するときは、実験録音と同じ鏡と、動物の外耳道の長さ(〜5mm)に近似した空洞内に小さなマイクを使用してください。キャリブレーションは周波数固有であるため、実験で使用したのと同じトーン周波数を測定します。ハードウェアシステムとソフトウェアシステムの両方のマニュアルには、キャリブレーションの指示が付いている場合があります。また、線形位相および最小位相フィルタなどの追加のフィルタもあり、クリックおよびトーンバーストABRを改善することができる43。これらのフィルターは、本研究では使用されなかった。周波数の関数として変化するトーンバーストスペクトルエンベロープの立ち上がりおよび立ち下がり時間、またはクリック刺激の立ち上がりおよび立ち下がり時間の変化のような追加の考慮事項も検討されなかった。これらは、信頼性が高く一貫性のあるABRを取得できれば、将来の調査に適しています。
孵化した鶏と他の鳥のモデルとの比較は有望です。バジェリガーと東部のスクリーチフクロウも、ABR 13,22の最初の6ミリ秒以内に3つの正のマイクロボルトピークを示します。キツツキの異なる種では、3つのピークも見られますが、それらの待ち時間は時間の後半です。さらに、キツツキの最高の周波数感度の範囲は1500〜4000 Hzであり、これは1000 Hzでの鶏の最高の閾値よりもやや高いです。成鶏では、最高の感度は2000Hz35であるため、鶏の孵化子が成虫に発達するにつれて高周波の聴力が向上する可能性があります。その発達は、動物のアルトリシャルまたは早熟な発達を考慮に入れて、鳥の種によって異なるでしょう4。
ここで概説した実験方法は、どの要因が聴覚応答および閾値の有害性または変化につながるか、ならびに胚発生のさまざまな段階での研究を決定するのに役立つ可能性がある。遺伝子操作、老化、および騒音曝露はすべて、動物および他の鳥類モデルにおける既知の操作である24、25、44、45。これらの方法は、in-ovo electroporationのような技術が、聴覚脳幹の片側でフォカリーおよび時間的に制御されるタンパク質の発現を可能にするようになった今、ニワトリモデルに拡張されるべきである12,46。これにより、2チャンネル記録パラダイムを使用して、遺伝子操作された耳から対側制御耳へのABRの直接比較が可能になります。
全体として、孵化鶏のABRは有用な研究方法であり、ヒトおよび他の哺乳類モデルにおける聴覚機能の尺度とほぼ同じである。また、非侵襲的な 生体内 方法論でもあります。麻酔薬の注射と数ミリメートルの皮下電極の配置を除いて、他の物理的な操作は必要ありません。理論的には、孵化子は適切な環境に保たれていれば、数日または数週間の発達時間経過にわたって複数回テストすることができます。このプロトコルは、孵化鶏ABRに必要なステップと記録パラメータをレイアウトするだけでなく、聴覚脳幹機能へのさらなる検査に情報を提供できる鳥類ABRの特性を提案します。
開示事項
著者らは開示するものは何もありません。
謝辞
この作業は、NIH/NIDCD R01 DC017167 によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 1/8 inch B&K Microphone | Brüel & Kjær | 4138 | Type 4138-A-015 also works |
| Auditory Evoked Potential Universal Smart Box | Intelligent Hearing Systems | M011110 | |
| Custom Sound Isolation Chamber | GK Soundbooth Inc | N/A | Custom built |
| DC Power Supply | CSI/Speco | PSV-5 | |
| ER3 Insert Earphone | Intelligent Hearing Systems | M015302 | Used as sound transducer |
| Euthasol | Virbac | 710101 | Controlled Substance; euthanasia solution |
| Insulin Syringe (29 G) | Comfort Point | 26028 | |
| Ketamine | Covetrus | 11695-0703-1 | Controlled Substance |
| Power Supply | Powervar | 93051-55R | |
| Rectal Probe | YSI | 401 (10-09010) | Any 400 series probe will work with the YSI temperatuer monitor |
| Subdermal needles | Rhythmlink | RLSND107-1.5 | |
| Temperature Monitor | YSI | 73ATA 7651 | Works with any 400 series rectal probe |
| Xylazine | Anased | 59399-110-20 | Used with ketamine and water for anesthetic |
参考文献
- Wever, E. G., Bray, C. W. Action currents in the auditory nerve in response to acoustical stimulation. Proceedings of the National Academy of Sciences of the United States of America. 16 (5), 344-350 (1930).
- Jewett, D. L., Williston, J. S. Auditory-evoked far fields averaged from the scalp of humans. Brain. 94 (4), 681-696 (1971).
- Corwin, J. T., Bullock, T. H., Schweitzer, J. The auditory brain stem response in five vertebrate classes. Electroencephalography and Clinical Neurophysiology. 54 (6), 629-641 (1982).
- Carey, C. Avian Growth and Development. Evolution within the Altricial Precocial Spectrum. , Oxford University Press. Oxford. (1998).
- Kraemer, A., Baxter, C., Hendrix, A., Carr, C. E. Development of auditory sensitivity in the barn owl. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 203 (10), 843-853 (2017).
- Rebillard, G., Rubel, E. W. Electrophysiological study of the maturation of auditory responses from the inner ear of the chick. Brain Research. 229 (1), 15-23 (1981).
- Parks, T. N., Rubel, E. W. Organization and development of brain stem auditory nuclei of the chicken: organization of projections from n. magnocellularis to n. laminaris. Journal of Comparative Neurology. 164 (4), 435-448 (1975).
- Hong, H., Rollman, L., Feinstein, B., Sanchez, J. T. Developmental profile of ion channel specializations in the avian nucleus magnocellularis. Frontiers in Cellular Neuroscience. 10, 80(2016).
- Leao, R. M. The ion channels and synapses responsible for the physiological diversity of mammalian lower brainstem auditory neurons. Hearing Research. 376, 33-46 (2019).
- Oline, S. N., Ashida, G., Burger, R. M. Tonotopic optimization for temporal processing in the cochlear nucleus. Journal of Neuroscience. 36 (32), 8500-8515 (2016).
- Kopp-Scheinpflug, C. Your genes decide what you are listening to. Channels. 11 (5), 355-356 (2017).
- Sid, H., Schusser, B. Applications of gene editing in chickens: A new era is on the horizon. Frontiers in Genetics. 9, 456(2018).
- Brittan-Powell, E. F., Dooling, R. J., Gleich, O. Auditory brainstem responses in adult budgerigars (Melopsittacus undulatus). The Journal of the Acoustical Society of America. 112 (3), Pt 1 999-1008 (2002).
- Lohr, B., Brittan-Powell, E. F., Dooling, R. J. Auditory brainstem responses and auditory thresholds in woodpeckers. The Journal of the Acoustical Society of America. 133 (1), 337-342 (2013).
- Counter, S. A. Brain-stem evoked potentials and noise effects in seagulls. Comparative Biochemistry and Physiology. A, Comparative Physiology. 81 (4), 837-845 (1985).
- Crowell, S. E., et al. A comparison of auditory brainstem responses across diving bird species. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 201 (8), 803-815 (2015).
- Noirot, I. C., Brittan-Powell, E. F., Dooling, R. J. Masked auditory thresholds in three species of birds, as measured by the auditory brainstem response (L). Journal of the Acoustical Society of America. 129 (6), 3445-3448 (2011).
- McGee, J., et al. Auditory performance in bald eagles and red-tailed hawks: a comparative study of hearing in diurnal raptors. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 205 (6), 793-811 (2019).
- Brittan-Powell, E. F., Dooling, R. J., Ryals, B., Gleich, O. Electrophysiological and morphological development of the inner ear in Belgian Waterslager canaries. Hearing Research. 269 (1-2), 56-69 (2010).
- Kuokkanen, P. T., Kraemer, A., Kempter, R., Koppl, C., Carr, C. E. Auditory brainstem response wave iii is correlated with extracellular field potentials from nucleus laminaris of the barn owl. Acta Acustica United with Acustica. The Journal of the European Acoustics Association (EEIG). 104 (5), 874-877 (2018).
- Beatini, J. R., Proudfoot, G. A., Gall, M. D. Frequency sensitivity in Northern saw-whet owls (Aegolius acadicus). Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 204 (2), 145-154 (2018).
- Brittan-Powell, E. F., Lohr, B., Hahn, D. C., Dooling, R. J. Auditory brainstem responses in the Eastern Screech Owl: an estimate of auditory thresholds. The Journal of the Acoustical Society of America. 118 (1), 314-321 (2005).
- Katayama, A. Postnatal development of auditory function in the chicken revealed by auditory brainstem responses (ABRs). Electroencephalography and Clinical Neurophysiology. 62 (5), 388-398 (1985).
- Durham, D., Park, D. L., Girod, D. A. Breed differences in cochlear integrity in adult, commercially raised chickens. Hearing Research. 166 (1-2), 82-95 (2002).
- Kaiser, C. L., Girod, D. A., Durham, D. Breed-dependent susceptibility to acute sound exposure in young chickens. Hearing Research. 203 (1-2), 101-111 (2005).
- Hamdy, A. M., Vander Hel, W., Henken, A. M., Galal, A. G., Abd-Elmoty, A. K. Effects of air humidity during incubation and age after hatch on heat tolerance of neonatal male and female chicks. Poultry Science. 70 (7), 1499-1506 (1991).
- Bruzual, J. J., Peak, S. D., Brake, J., Peebles, E. D. Effects of relative humidity during the last five days of incubation and brooding temperature on performance of broiler chicks from young broiler breeders. Poultry Science. 79 (10), 1385-1391 (2000).
- vander Pol, C. W., van Roovert-Reijrink, I. A. M., Maatjens, C. M., vanden Brand, H., Molenaar, R. Effect of relative humidity during incubation at a set eggshell temperature and brooding temperature posthatch on embryonic mortality and chick quality. Poultry Science. 92 (8), 2145-2155 (2013).
- Buhr, R. J. Incubation relative humidity effects on allantoic fluid volume and hatchability. Poultry Science. 74 (5), 874-884 (1995).
- Galli, R., et al. Sexing of chicken eggs by fluorescence and Raman spectroscopy through the shell membrane. PLoS One. 13 (2), 0192554(2018).
- Otsuka, M., Miyashita, O., Shibata, M., Sato, F., Naito, M. A novel method for sexing day-old chicks using endoscope system. Poultry Science. 95 (11), 2685-2689 (2016).
- Kaiser, A. The ontogeny of homeothermic regulation in post-hatching chicks: its influence on the development of hearing. Comparative Biochemistry and Physiology. A, Comparative Physiology. 103 (1), 105-111 (1992).
- Kuba, H., Yamada, R., Ohmori, H. Evaluation of the limiting acuity of coincidence detection in nucleus laminaris of the chicken. The Journal of Physiology. 552, Pt 2 611-620 (2003).
- Shaheen, L. A., Valero, M. D., Liberman, M. C. Towards a diagnosis of cochlear neuropathy with envelope following responses. Journal of the Association for Research in Otolaryngology. 16 (6), 727-745 (2015).
- Hill, E. M., Koay, G., Heffner, R. S., Heffner, H. E. Audiogram of the chicken (Gallus gallus domesticus) from 2 Hz to 9 kHz. Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 200 (10), 863-870 (2014).
- Rossi, G. T., Britt, R. H. Effects of hypothermia on the cat brainstem auditory evoked response. Electroencephalography and Clinical Neurophysiology. 57 (2), 143-155 (1984).
- Doyle, W. J., Fria, T. J. The effects of hypothermia on the latencies of the auditory brainstem response (ABR) in the rhesus monkey. Electroencephalography and Clinical Neurophysiology. 60 (3), 258-266 (1985).
- Guan, X., Gan, R. Z. Effect of middle ear fluid on sound transmission and auditory brainstem response in guinea pigs. Hearing Research. 277 (1-2), 96-106 (2011).
- Ravicz, M. E., Rosowski, J. J., Merchant, S. N. Mechanisms of hearing loss resulting from middle-ear fluid. Hearing Research. 195 (1-2), 103-130 (2004).
- Wang, Y., Zorio, D. A. R., Karten, H. J. Heterogeneous organization and connectivity of the chicken auditory thalamus (Gallus gallus). Journal of Comparative Neurology. 525 (14), 3044-3071 (2017).
- Wang, Y., Karten, H. J. Three subdivisions of the auditory midbrain in chicks (Gallus gallus) identified by their afferent and commissural projections. Journal of Comparative Neurology. 518 (8), 1199-1219 (2010).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. Journal of Neuroscience. 30 (36), 12075-12083 (2010).
- Beutelmann, R., Laumen, G., Tollin, D., Klump, G. M. Amplitude and phase equalization of stimuli for click evoked auditory brainstem responses. The Journal of the Acoustical Society of America. 137 (1), 71-77 (2015).
- Liberman, M. C. Noise-induced and age-related hearing loss: new perspectives and potential therapies. F1000Research. 6, 927(2017).
- Efrati, A., Gutfreund, Y. Early life exposure to noise alters the representation of auditory localization cues in the auditory space map of the barn owl. Journal of Neurophysiology. 105 (5), 2522-2535 (2011).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments: JoVE. (124), e55628(2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved