Method Article
הערכה של תגובת גזע המוח השמיעתי באבקועים עופות
In This Article
Summary
השתמשנו בטכניקות סטנדרטיות של תגובה לגזע מוחי שמיעתי (ABR) ויישמנו אותן על תרנגולות בוקעות, מודל עופות מקדים לתפקוד שמיעתי. הפרוטוקול מתווה בפירוט את הכנת בעלי החיים ואת טכניקות רכישת ABR, עם שלבים שיכולים להיות מתורגמים למודלים אחרים של עופות או מכרסמים.
Abstract
תגובת גזע המוח השמיעתי (ABR) היא בדיקה שלא תסולא בפז באודיולוגיה קלינית, בבעלי חיים שאינם בני אדם ובמחקר בבני אדם. למרות השימוש הנרחב ב-ABRs במדידת סינכרון עצבי שמיעתי ובהערכת הרגישות לשמיעה במערכות מודלים אחרות של בעלי חוליות, שיטות לרישום ABRs בתרנגולת לא דווחו במשך כמעט ארבעה עשורים. תרנגולות מספקות מודל חזק למחקר בבעלי חיים מכיוון שמערכת השמיעה שלהן קרובה להבשלה תפקודית בשלבי הבקיעה העובריים המאוחרים ובשלבי האבקוע המוקדמים. הדגמנו שיטות המשמשות ליצירת הקלטות ABR חד-ערוציות או דו-ערוציות באמצעות מערכי אלקטרודות מחט תת-עוריות באבקועני עוף. ללא קשר לתצורת הקלטת האלקטרודות (כלומר, מונטאז'), הקלטות ABR כללו 3-4 צורות שיא חיוביות בתוך 6 אלפיות השנייה הראשונות של גירוי קליק suprathreshold. משרעת צורת הגל של שיא לשוקת נעה בין 2-11 μV ברמות של עוצמה גבוהה, כאשר פסגות חיוביות הציגו תפקודי עוצמת השהיה צפויים (כלומר, עלייה בהשהיה כפונקציה של ירידה בעוצמה). מיקום אוזניות סטנדרטי היה קריטי להקלטות אופטימליות מכיוון שעור רפוי יכול לחסום את תעלת האוזן, ותנועת בעלי חיים יכולה לנתק את מתמר הגירוי. משרעת השיא הייתה קטנה יותר, והאחריות הייתה ארוכה יותר ככל שטמפרטורת הגוף של בעלי החיים ירדה, מה שתמך בצורך בשמירה על טמפרטורת הגוף הפיזיולוגית. עבור אבקועים צעירים (<3 שעות לאחר הבקיעה ביום הראשון), הסף הועלה ב~5 dB, שיא ההפסקות עלה ~1-2 אלפיות השנייה, ואמפליטודות השיא של שוקת לשוקת ירדו ~1 μV בהשוואה לאבקועים מבוגרים יותר. זה מצביע על בעיה פוטנציאלית הקשורה להולכה (כלומר, נוזל בחלל האוזן התיכונה) ויש לקחת אותה בחשבון עבור אבקועים צעירים. באופן כללי, שיטות ה-ABR המתוארות כאן מאפשרות הקלטה מדויקת וניתנת לשחזור של תפקוד שמיעתי in-vivo באבקועני עוף שניתן ליישם בשלבי התפתחות שונים. ממצאים כאלה מושווים בקלות למודלים אנושיים ויונקים של ליקוי שמיעה, הזדקנות או מניפולציות אחרות הקשורות בשמיעה.
Introduction
המחקר של תגובות עצביות מעוררות לגירויים קוליים מתוארך למעלה מחצי מאה1. תגובת גזע המוח השמיעתי (ABR) היא פוטנציאל מעורר המשמש כמדד לתפקוד שמיעתי הן בבעלי חיים שאינם בני אדם והן בבני אדם במשך עשרות שנים. ה-ABR האנושי מציג חמש עד שבע פסגות בצורת גל המסומנות באופן קונבנציונלי על ידי ספרות רומיות (I-VII)2. פסגות אלה מנותחות על סמך ההשהיה שלהן (זמן ההתרחשות באלפיות השנייה) והמשרעת (גודל שיא לשוקת במיקרו-וולטים) של התגובות העצביות. ה-ABR מסייע בהערכת התפקוד והשלמות של עצב השמיעה, כמו גם רגישות לגזע המוח ולסף השמיעה. ליקויים במערכת השמיעה גורמים להיעדרות, מופחתת, ממושכת או חריגות של ABR ולאמפליטודות. למרבה הפלא, פרמטרים אלה כמעט זהים בבני אדם ובבעלי חיים אחרים, מה שהופך אותו למבחן אובייקטיבי עקבי של תפקוד שמיעתי על פני מודלים של בעלי חוליות3.
מערכת מודל אחת כזו היא העוף, והיא שימושית במיוחד ממגוון סיבות. ציפורים ניתן לסווג כמו altricial או precocial4. ציפורים אלטריאליות בוקעות עם חושים שעדיין מתפתחים; לדוגמה, ינשופי אסם אינם מראים ABR עקבי עד ארבעה ימים לאחר הבקיעה5. בעלי חיים מוקדמים כמו העוף בוקעים עם חושים כמעט בוגרים. הופעת השמיעה מתרחשת בהתפתחות העוברית, כך שימים לפני הבקיעה (היום העוברי 21), מערכת השמיעה קרובה להבשלה תפקודיתשל 6,7,8. ציפורים אלטריאליות ורוב המודלים של יונקים רגישים לגורמים חיצוניים המשפיעים על ההתפתחות ודורשים גידול בעלי חיים עד שהשמיעה מבשילה. ניתן לבצע ABRs עוף באותו יום כמו הבקיעה, ולוותר על הצורך בהאכלה או בסביבה מועשרת.
העוף העוברי היה מודל נחקר היטב לפיזיולוגיה והתפתחות, במיוחד בגזע המוח השמיעתי. מבנים ספציפיים כוללים את גרעין שבלול העוף, המחולק לגרעין מגנוצלריס (NM) וגרעין זוויתי (NA), ואת מתאם העופות של הזית העליון המדיאלי המכונה גרעין למינריס (NL)6,7. ה-ABR אידיאלי להתמקדות בתפקוד השמיעתי המרכזי לפני רמת המוח הקדמי וקליפת המוח הקדמי. תרגום בין מדידות ABR in-vivo לבין מחקרים עצביים במבחנה של התפתחות8, פיזיולוגיה9, טונוטופיה10 וגנטיקה11,12 מספק הזדמנויות מחקר אידיאליות התומכות במחקרים של תפקוד שמיעתי כולל.
למרות שה-ABR נחקר בהרחבה במודלים של יונקים, היה פחות מיקוד עבור עופות. מחקרי ABR קודמים של העופות כוללים אפיונים של הבודגריגר13, נקר14, שחף15, ציפורי צלילה16, זברה פינץ'17, עופות דורסיםיומיים 18, קנרית19, שלושה מינים של ינשוף 5,20,21,22 ועוף 23. בהתחשב בכמעט ארבעה עשורים שחלפו מאז האפיון היסודי האחרון של העוף ABR, רבים מהציוד והטכניקות ששימשו בעבר השתנו. תובנות ממחקרים במודלים אחרים של עופות יכולים לסייע בפיתוח מתודולוגיית ABR של עוף מודרני תוך שהם משמשים גם כהשוואה ל-ABR העוף. מאמר זה יתווה את המערך והתכנון הניסיוניים כדי לאפשר רישום ABR בתרנגולות האבקועות שניתן ליישם גם על שלבי התפתחות עובריים ועל מודלים אחרים של מכרסמים קטנים ועופות. בנוסף, בהתחשב בהתפתחות המוקדמת של העוף, ניתן לבצע מניפולציות התפתחותיות ללא כל גידול בעלי חיים נרחב. ניתן להעריך מניפולציות לעובר מתפתח שעות ספורות בלבד לאחר שבעל החיים בוקע עם יכולות שמיעה כמעט בוגרות.
Protocol
הניסויים המתוארים כאן אושרו על ידי הוועדות המוסדיות לטיפול ושימוש בבעלי חיים של אוניברסיטת נורת'ווסטרן (IACUC) ונערכו בהתאם למדריך המכונים הלאומיים לבריאות לטיפול בחיות מעבדה ולשימוש בהן.
1. גידול עוף
- לרכוש ביצי תרנגולת לבן מופרה.
הערה: ישנם מספר גזעי עוף המשמשים במחקר מדעי, אך התוצאות המוצגות כאן הן מתרנגולת רגל לבנה (Gallus gallus domesticus). בעוד שהשונות של ABR בין הגזעים אינה ידועה, נמצאו כמה הבדלים בהשוואה בין תרנגולות מטילות ביצים בוגרות לתרנגולות ברוילר המייצרות בשר24,25. - דגירה ביצים בטמפרטורה של 38 מעלות צלזיוס, לחות ב-50%, במשך 21 יום לפני תאריך הבדיקה הרצוי.
הערה: אם ביצים אינן דוגרות מיד בטמפרטורה של 38 מעלות צלזיוס, ניתן לאחסן אותן בטמפרטורה של 14 מעלות צלזיוס, לחות ב-40%. עם זאת, ככל שהביצים נשמרות זמן רב יותר ב-14 מעלות צלזיוס, כך יש פחות סיכוי שהן יתפתחו לאבקועים בני קיימא. לאחר 7 ימים, כדאיות הביצים יכולה לרדת עד 50% בהתאם למשך הזמן שבו ביצים נשמרות ב -14 מעלות צלזיוס. גם הכדאיות של הביצים תרד בחודשי החורף. - מדי פעם להפוך את הביצים 2-3 פעמים ביום. לרוב האינקובטורים יש מנגנון לבצע זאת באופן אוטומטי.
- אם אתם משתמשים באינקובטור קלקר או באינקובטור המכיל יותר מ-6 ביציות, העבירו את הביצים לחממה קטנה של 38 מעלות צלזיוס יום לפני הבקיעה, היום העוברי 20 (E20). ביצים צריכות לבקוע 21 יום (E21) לאחר שהוצבו באינקובטור.
הערה: בתהליך הבקיעה, החיה תתחיל "לטפטף" מתוך הביצה, וליצור חור קטן שבסופו של דבר מסתובב סביב הביצה כולה. אם התנאים יבשים מדי, הביצה יכולה להתייבש, והחיה לא תוכל לבקוע. הלחות צריכה להישמר סביב 50%, בהתבסס על מחקרים קודמים על כדאיות בקיעת ביצים 26,27,28,29. - קבעו את גיל החיה. אם הצוהר לא נצפה באופן אישי, האינדיקציה היחידה לגיל היא 2-3 שעות שלוקח לנוזל מי השפיר להתייבש.
הערה: יש לנקות ביסודיות את חממת האבקועים מדי יום עם 70% אלכוהול איזופרופיל בהתבסס על מספר האבקועים המעובדים. אבקועים עוף משאירים לעתים קרובות צואה, נוצות ונוזל מי שפיר באינקובטור, מה שעלול לזהם את התנאים ואת איכות האוויר.
2. הכנת סמים
- שקלו את החיה על ידי הצבתה בסירת שקילה גדולה. עם מיקום עדין מספיק, החיה לא צריכה לזוז.
הערה: המסה יכולה לנוע בין 30-45 גרם. בעלי חיים צעירים יותר הם לעתים קרובות כבדים יותר בגלל עתודות החלמון ועדיין לא מפרישים פסולת. בעלי חיים מבוגרים המתקרבים לגיל 24 שעות ו-P2 בדרך כלל שוקלים פחות. - מכינים קוקטייל הרדמה של קטמין (100 מ"ג/מ"ל) וקסילזין (20 מ"ג/מ"ל) כך שהמינון הוא 50 מ"ג/ק"ג קטמין ו-16.68 מ"ג/ק"ג קסילאזין על בסיס משקל בעלי חיים.
הערה: ניתן להכין קוקטייל תרופה זה עם 1 מ"ל של קטמין (100 מ"ג/מ"ל), 1.5 מ"ל של קסילאזין (20 מ"ג/מ"ל) ו-2.5 מ"ל של H2O. זריקות קוקטייל הרדמה ינועו בין 0.05-0.1 מ"ל בהתבסס על טווח של 30-45 גרם במשקל בעלי חיים.
3. הזרקת סמים והכנה לבעלי חיים
- החזיקו את החיה ביד אחת, והקפידו להחזיק את הרגליים למטה.
- להרגיש את עצם החזה של החיה, את הכד. משני צדי הכד יהיה שריר השד.
- השתמשו במחט ומזרק 29 גרם כדי לחדור 5 מ"מ לתוך העור ולהזריק את קוקטייל הקטמין/קסילאזין לשריר השד. להזריק בין 0.05-0.1 מ"ל על בסיס משקל בעלי חיים.
- מניחים את החיה בחזרה באינקובטור לאחר ההזרקה. יש לשמור על טמפרטורת הגוף של בעלי החיים למשך מספר דקות כאשר חומר ההרדמה נכנס לתוקף.
- השתמש במלקחיים כדי לצבוט את הבוהן של החיה ולבדוק אם הצוואר רפוי. אם אין רפלקס וצוואר רפוי, החיה מחוסרת הכרה.
- לקבוע את המין של העוף באמצעות נוצות הכנף שלה. אם הנוצות כולן באותו אורך, החיה היא זכר. אם הנוצות משתנות באורכן, החיה היא נקבה30.
הערה: שיטה נוספת למין החיה היא אוורור. את איברי המין הגבריים ניתן לראות בקלואקה31. שיטה זו קשה מאוד ועלולה לפגוע בבעל החיים אם לא נעשתה כראוי. מומלץ להשתמש בשיטת נוצות הכנף. - יש למרוח קרם דפילטורי עם אפליקטור קצה כותנה לאזור הראש והצוואר, במיוחד ליד פתח האוזן עבור הציפור.
- השתמשו במגבונים אלכוהוליים של 70% איזופרופיל כדי לנגב את הנוצות, את כל שאריות הקרם הדפילטורי ואת העור על הראש והצוואר.
- השתמש במגבון אלכוהול של 70% איזופרופיל כדי לעקר את האלקטרודות התת-עוריות ואת הבדיקה הרקטלית.
- מכניסים את החיה לבידוד קול ותא מוגן חשמלית. ודא שלסביבה יש רעש חשמלי ואקוסטי מינימלי עבור ההקלטות הטובות ביותר.
הערה: הניסויים כאן נעשו במארז מבודד קול מותאם אישית בגודל 24 x 24 x 25 אינץ '. כל תא או חדר שמבטל רעש אקוסטי, כמו גם רעש חשמלי מזרם חשמלי לסירוגין (60 הרץ בארצות הברית), מספיק. - השתמשו בכרית חימום או במערכת בקרת טמפרטורה כדי לשמור על טמפרטורת הגוף של בעלי החיים.
- הכנס את הבדיקה הרקטלית המשומנת כדי להבטיח שהטמפרטורה של החיה נשמרת בין 37-41 °C (98.6-105 °F)32,33.
הערה: אם הגשושית בגודל שגוי, החיה יכולה לשכב על גבי גשושית הטמפרטורה. - תקן את ראש החיה במקומו או הנח את המקור על חפץ כדי למנוע תנועה לא רצויה. זה יכול להיעשות עם דוגמנות חימר אם הנשימה אינה חסומה.
- תנו זריקה משלימה של קוקטייל הרדמה שהוא מחצית מהמינון המקורי אם החיה מתחילה לחזור להכרה במהלך הבדיקה.
הערה: כל תנועת גוף או ווקאליזציה היא סימן לכך שיש לתת מינון תוסף. תנועות מקור זעירות מצביעות על נשימה ומקובלות.
4. מיקום אלקטרודות
- השתמש בשלוש אלקטרודות מחט נירוסטה, כסף כלוריד עם הכינויים הבאים: אלקטרודת הייחוס, האלקטרודה הפעילה והאלקטרודה המשותפת.
הערה: אלקטרודת הייחוס מכונה גם היפוך או "-". האלקטרודה הפעילה מכונה גם לא-היפוך או "+". - מכניסים כל אלקטרודה תת-דרמלית בקוטר 2-3 מ"מ לראש, אך לא עמוק מספיק כדי לחדור לגולגולת. השתמש באלקטרודות באורך 7 מ"מ ובקוטר 0.4 מ"מ.
- מוציא את האלקטרודה מהעור וחושף את הקצה. זה עוזר למזער את המגע עם העור ולהבטיח עומק החדרה עקבי בין בעלי חיים34.
הערה: חוט האלקטרודה צריך להיות בעל רפיון מספיק כך שלאחר הנחת האלקטרודה, אין מתח שימשוך אותה החוצה או ימשוך את העור מתוח. - לצורך הקלטה חד-ערוצית, מקם את האלקטרודה הפעילה מעל הגולגולת בקו האמצע, עד כדי קאודל כמו תעלת האוזן.
- הניחו את אלקטרודת הייחוס מאחורי האוזן במקום שבו יועבר הגירוי, והניחו את אלקטרודת ההארקה מאחורי תעלת האוזן הקונטרה-צדדית בצוואר.
הערה: אם מבצעים ניתוח בגולגולת או בתעלת האוזן של החיה, הניחו את אלקטרודת הייחוס בצוואר בקו האמצע של החיה. גם זה וגם שלב 4.4.1 נחשבים למונטאז'ים של הקלטת אלקטרודות אופקיות.
- הניחו את אלקטרודת הייחוס מאחורי האוזן במקום שבו יועבר הגירוי, והניחו את אלקטרודת ההארקה מאחורי תעלת האוזן הקונטרה-צדדית בצוואר.
- להקלטה דו-ערוצית, השתמש בשתי אלקטרודות שליליות ובאלקטרודה חיובית משולבת הדורשת כבל מתאם. מקם את אלקטרודת הקרקע באופן תת-עורי בצוואר ואלקטרודת ייחוס אחת מאחורי כל תעלת אוזן.
- בדוק את עכבת האלקטרודה. ודא כי עכבת האלקטרודה הכוללת אינה עולה על 5.0 kΩ. שמור על עכבת האינטרלקטרוד מתחת ל-3.0 kΩ.
5. הקלטת ABR
- בהתאם לחומרת הרכישה ולתוכנה, הקפד לבצע כיול עבור רמות צליל נכונות בתדרי גירויים שבהם נעשה שימוש.
הערה: טכניקות הכיול ישתנו בהתאם לציוד (ראה דיון). עבור תוכניות מסוימות, ניתן לערוך הנחתת קול בתוך התוכנה. הליכי כיול שבוצעו כאן כללו שימוש במיקרופון מעבה B&K 4138 בגודל 1/8 אינץ' כדי להקליט גירויים בתדר בתוך מערכת מצמד סגורה שהתקרבה לתעלת האוזן של האפרוח (כ-5 מ"מ). טבלת כיול אבקוע עוף מסופקת כטבלה משלימה. - הזז את מנגנון מתמר הקול לעבר האוזן הפעילה של החיה. מקם את מתמר הקול בעומק רדוד של 2 מ"מ בתעלת האוזן.
הערה: בהתאם למתמר הצליל, ניתן לחבר ספקולום פלסטיק ולהכניס אותו לתעלת האוזן. מיקום הספקולום הוא קריטי. אם הצליל נחסם על ידי דופן התעלה או שתעלת האוזן תצובט סגורה, ABRs ייעדר או יהיה דומה לשינוי של ~ 40 dB בסף. - בדוק את בעל החיים במהלך הניסויים אם התוצאות נראות חריגות או נעדרות. אם כן, מקם מחדש את מתמר הקול בתעלת האוזן.
הערה: מכיוון שהעור רפוי ותנועת בעלי החיים אפשרית, מיקום הספקולום עשוי להשתנות במהלך ההקלטה. עם זאת, עם הזרקת הרדמה נכונה והחיה מחוסרת הכרה לחלוטין, ההקלטה יכולה להימשך ללא הפרעה במשך 30-45 דקות.
6. רכישת נתונים
- השתמש בציוד / תוכנה מספיקים כדי ליצור גירויי קול ולהקליט / לרכוש הקלטות ABR.
הערה: ישנן מערכות רבות הזמינות מסחרית או מותאמות אישית לרכישת ABR. עבור ניסויים אלה, נעשה שימוש בפלטפורמת SmartEP USB חכמה של מערכות שמיעה חכמות (IHS) הזמינה מסחרית. היכולת לתמרן פרמטרים של הקלטה היא קריטית; אלה כוללים, אך אינם מוגבלים לעוצמת גירוי, אורך גירוי, תדירות גירוי, קצב הצגת גירוי, מעבר גבוה ומסנן מעבר נמוך, דחיית ממצאים, מספר מטאטאים, קצב דגימה, צורת מעטפת וקיטוב גירוי. - הגדר את הגבולות העליונים והתחתונים של דחיית הממצאים (AR) ל-±25 μV, כך שתנועת בעלי חיים או רעש במהלך מטאטא לא יכללו את הטאטוא בניתוח. בכל האוכלוסייה שנבדקו, פחות מ-1% מכלל הטאטואים נדחו בשל ממצאים.
- אספו לפחות 1024 מטאטאים כדי לקבל תשובה ממוצעת גדולה. ניתן לעשות זאת בשתי הקלטות של 512 מטאטאים כל אחת. זה גם מבטיח שהתגובה תתעורר ותחזור על עצמה.
- הגדר את הרווח ל- 100,000, את מסנן המעבר הנמוך ל- 100 הרץ ואת מסנן המעבר הגבוה ל- 3000 הרץ.
הערה: הגדרות מסנן המעבר הנמוך והגבוה היו אופטימליות להקלטות באמצעות מערכת IHS. לכן, פרמטרים אלה הם המלצות. הקלטות ABR במינים אחרים של עופות באמצעות תוכנת BIOSIG סיננו את האות בין 30 ל-3000 הרץ 5,13,14,16,22. - הגדר את קצב הצגת הגירוי בין 10 ל -20 גירויים בשנייה. קצבי מצגות גבוהים ישנו את ההשהיה של שיא ABR, במיוחד עבור שיאים מאוחרים יותר13. שיעורי מצגות נמוכים יגדילו את הזמן הנדרש לרכישת ABR.
- הגדר את משך הזמן של גירוי הלחיצה ל- 100 μs.
- אם אתה משתמש בגירוי פרץ צליל, ערוך את התדירות והמשך של הגירוי בהתבסס על האפקט הרצוי. טווח של 100-4000 הרץ שימש לגירויי פרץ טון, אם כי טווח השמיעה ההתנהגותית בתרנגולות בוגרות נע בין 2-9000 הרץ35.
הערה: במערכת IHS, ניתן לשנות את זמן העלייה והירידה של גירוי פרץ צליל רק אם צורת המעטפת הספקטרלית היא טרפז. עם זאת, מעטפות הקוסינוס בריבוע ובלקמן מספקות זמן עלייה וירידה מוגדר מראש המשמש בדרך כלל בניסויי ABR בבעלי חיים. מערכת IHS יכולה להציג את המעטפת הספקטרלית של פרץ צלילים כדי להבטיח זמני עלייה וירידה מתאימים. לא ניתן לערוך את זמן העלייה והירידה של גירוי קליק ב- IHS.
- אם אתה משתמש בגירוי פרץ צליל, ערוך את התדירות והמשך של הגירוי בהתבסס על האפקט הרצוי. טווח של 100-4000 הרץ שימש לגירויי פרץ טון, אם כי טווח השמיעה ההתנהגותית בתרנגולות בוגרות נע בין 2-9000 הרץ35.
- הגדר את קצב הדגימה לערך הגבוה ביותר המותר (בדרך כלל 40 קילוהרץ) עבור נתוני הרזולוציה הטובה ביותר.
הערה: מערכות מסוימות, כולל IHS, משתמשות במספר מוגבל של נקודות דגימה וישנו את אורך חלון ההקלטה. קצב דגימה של 40 קילוהרץ (25 מיקרו-הרץ) עשוי לאפשר רק חלון הקלטה של 12 אלפיות השנייה, ולכן כדי ללכוד ABR של פרץ צלילים, נעשה שימוש בקצב דגימה של 20 קילו-הרץ (תקופה של 50 מיקרו-סיביות) כדי לאפשר חלון הקלטה של 24 אלפיות השנייה. אם משווים ישירות את ה-ABRs של קליקים וצלילים, שמרו על קצב הדגימה קבוע כדי לשמור על אותה רזולוציה. - הגדר את קיטוב הגירוי לסירוגין. זה נעשה כדי למנוע את ההדמיה של מיקרופוני שבלול מהקלטות ABR. כדי לדמיין את המיקרופוני שבלול, השתמש ב- rarefaction או עיבוי עבור קוטביות גירוי.
הערה: ניתן לשנות הגדרות רבות בעת בחירת גירויים. ייתכן שהגדרות הרווח והסינון המסופקות לא יהיו אופטימליות עבור הגדרות ציוד אחרות. ברירות המחדל של המפעל ברוב מכונות ה-ABR אינן מוגדרות להקלטה בעוף האבקוע. - אם אתם רושמים 512 טאטואים, שלבו שתי בדיקות נפרדות כדי ליצור ממוצע טאטוא של 1024.
- עבור גירוי פרץ קליק או טון, לרכוש ABR בעוצמה של superrathreshold.
- המשך להקליט בעוצמות נמוכות יותר ויותר עד שלא ניתן עוד לזהות את התגובה המעוררת.
- הגדר סף ABR כעוצמת הגירוי הנמוכה ביותר המעוררת תגובה מעוררת הניתנת לזיהוי. הנמיכו את עוצמת הגירוי בשלבים של 5 dBSPL כדי למצוא את עוצמת הגירוי הנמוכה ביותר שמעוררת שיא הניתן לזיהוי.
7. המתת חסד וסיום הניסוי
- לאחר רכישת ABRs, הכינו מנת יתר (0.1 מ"ל) של תמיסת המתת חסד (נתרן פנטוברביטל 390 מ"ג/מ"ל פניטואין נתרן 50 מ"ג/מ"ל).
- לאחר שימוש בצביטת בוהן כדי לאשר שאין רפלקס, להזריק את תמיסת המתת החסד בשריר השד עם מחט 29-G בעומק 5 מ"מ. טכניקת ההזרקה זהה להזרקת ההרדמה.
הערה: תוקף החיה יפוג לאחר מספר דקות. אין לתמרן או לערוף את החיה עד שלא תזוהה תנועה. טכניקת המתת חסד חלופית היא לבצע זריקה תוך ורידית בווריד הברכיאלי שמתחת לכנף. - ברגע שהחיה אינה רפלקסיבית והנשימה והדופק פסקו, מתפרקים במהירות עם מספריים חדים או גזירה.
- נקו את כרית החימום, הבדיקה הרקטלית ואלקטרודות כסף כלוריד עם 70% מגבוני אלכוהול איזופרופיל.
- ודא שכל העקבות שנרכשו נשמרו. לניתוח נוסף, ייצא קבצים כקבצי .txt שניתן להציגם בפנקס הרשימות או לייבא לגיליון אלקטרוני.
תוצאות
הקלטות ABR מייצגות לאפרוחים הבוקעים
התוצאות הייצוגיות והאוכלוסייה הבאות מגיעות מרישומי ABR שנעשו ב-43 בעלי חיים. בתגובה לגירוי קליק של suprathreshold (75 dBSPL), נצפו באופן עקבי שלושה שיאים חיוביים בכל האבקועים. שיאים אלה התרחשו תוך 6 אלפיות השנייה לאחר הופעת הגירוי. לעתים רחוקות נצפתה גם שיא רביעי של כ-6 אלפיות השנייה. בעוד שהזיהוי של פסגות ABR בציפורים היה מגוון בין בעלי חיים (ראו דיון), פסגות סומנו וזוהו כגלים רומיים I-IV. צורת גל ABR מייצגת עם פסגות מסומנות מוצגת באיור 1A (עקבות עליונים). איור 1B מציג את פונקציית עוצמת ההשהיה עבור גלים I ו-III המסומנים בעקבה הייצוגית. ההשהיה בגל I עלתה בכ-0.3 אלפיות השנייה עבור כל ירידה של 20 dB בעוצמת הגירוי. בממוצע, גלים I-III התרחשו ב-1.50 אלפיות השנייה (±0.02 אלפיות השנייה), 3.00 אלפיות השנייה (±0.06 אלפיות השנייה) ו-4.13 אלפיות השנייה (±0.09 אלפיות השנייה) ב-75 dBSPL, בהתאמה (איור 1C). גל I וגל III הוצגו תמיד כשיא יחיד. מדי פעם עבור גל II, מספר פסגות קטנות נצפו בין 2.5-3.2 אלפיות השנייה. לכל פסגה הייתה שוקת מקבילה, והמשרעת של גל I - הגדולה מבין כל הפסגות - הייתה בממוצע 7 μV והתקרבה למשעת מקסימלית של 11 μV ב-75 dB SPL.
בנוסף לאמפליטודה הגדולה ביותר, גל I של האפרוח ABR הציג את השונות הפחותה ביותר בהשהיית שיא בקרב בעלי חיים. לכן, שיא זה שימש להערכת הרגישות לסף השמיעה. ספי ABR הוגדרו כעוצמת הגירוי הנמוכה ביותר שעוררה שיא של צורת גל הניתנת לזיהוי וחזרה על עצמה. זה נקבע באופן סובייקטיבי על ידי הנסיין והוצלב על ידי נסיין שני להסכמת סף. פסגות היו מוגדרות טוב יותר וקל יותר לזהות אותן בעת שימוש בגירויי קליק, אך התפרצויות צלילים יצרו גם פסגות מוגדרות וניתנות לזיהוי שהשתנו בהתאם לתדירות הגירוי ולפרמטרים שלו (איור 1D, n = 4 אפרוחים). סף ה-ABR המעורר בלחיצה היה נמוך יותר מסף פרץ הטון, למעט 1000 הרץ. ABRs מעוררי קליק שלא הראו פסגות ניתנות לזיהוי >30 dBSPL היו לעתים קרובות תוצאה של ניתוק הספקולום מתעלת האוזן עקב תנועת בעלי חיים.
ירידה בטמפרטורת הגוף מעלה את חריגות ה-ABR
מהירות הפעילות העצבית - כפי שנמדדה על ידי מופע השיא של משרעת צורת גל (כלומר, השהיה) - ידועה בירידה בטמפרטורות גוף נמוכות יותר36,37. תופעה זו נצפתה בבקיעה של עוף ABRs באמצעות גירוי קליק 75 dBSPL. עקבות מייצגים מוצגים באיור 2A. כאשר טמפרטורת הגוף ירדה מ -39 מעלות צלזיוס, ההשהיה של שיאי ABR התרחשה מאוחר יותר בזמן, למרות אותה רמת עוצמת גירוי. איור 2B מראה את ההשהיה של גלים I ו-III כפונקציה של טמפרטורות גוף נמוכות יותר עבור העקבה הייצוגית. היה מתאם חזק (R2 = 0.89) בין טמפרטורות הגוף התחתונות לבין התרחשות ההשהיה של שיא גל I (איור 2C, n = 5 אפרוחים). תוצאות אלה מדגימות את הצורך בשמירה על טמפרטורת גוף כמעט נורמלית במהלך הקלטות ABR. אם טמפרטורת הגוף הכמעט נורמלית אינה נשמרת, תפקודי עוצמת ההשהיה ומדידות המשרעת של ה-ABR משתנים מאוד ולעתים קרובות אינם מדויקים.
הבדלי השהיה ואמפליטודה באבקועים המוקדמים
מחקרים הראו כי פעילות עצבית הקשורה לתחילת השמיעה של הגוזל קרובה להבשלה בגילים העובריים המאוחרים8. עם זאת, עבור תת-קבוצה של אבקועים מוקדמים מאוד (<3 שעות לאחר הבקיעה), צפינו בתזוזת חביון שיא של צורות גל ABR (n = 4) בתגובה לגירוי קליק 75 dB SPL או פוטנציאלים מעוררים לא היו ניתנים לזיהוי (n = 2 אפרוחים). ב-2 אבקועים צעירים, לא ניתן היה לעורר ABR מתפרץ טון, וסף הקליק הוגבה ב-50 dBSPL. זה יכול להיות בגלל בעיה מוליכה שבה עדיין יש נוזל בתעלת האוזן / חלל האוזן התיכונה של החיה, או מרכיב עצבי לא מפותח. מחקרים ביונקים דיווחו על שינויי סף של 50 dB בתינוקות38,39. בעלי חיים מייצגים ששימשו כאן היו בני >3 שעות, שגם הם חפפו את משך הזמן שלוקח לנוצות להתייבש. איור 3A מראה ש-ABRs תועדו מאבקועים צעירים (P1, בני <3 שעות) ומבוגרים יותר (P2). לצורך ניתוח, רק 3 אבקועים צעירים הציגו את כל שלוש פסגות ה-ABR. ההשהיות של צורת הגל היו ממושכות באופן משמעותי, ואמפליטודות צורת הגל הופחתו מעט בהשוואה לאבקועים ישנים יותר (איור 3B-C, בהתאמה).
מיקום אלקטרודות ייחוס והקלטות ABR דו-ערוציות
באיור 4, מיקום אלקטרודות הייחוס שונה בין 2 מיקומים שונים, אך עדיין הביא להקלטות ABR דומות. השוואה בין 75 עקבות קליקים של dBSPL באותה חיה לבין שני מיקומי האלקטרודות הייחוס הראתה הבדלים מזעריים באמפליטודות של צורת גל שיא לשוקת ובעיכובים של צורות גל שיא (איור 4A). מיקום המסטואידים היה דומה מבחינה מתודולוגית לניסויים ABR של יונקים שממקמים את אלקטרודת הייחוס על המסטואיד או הפינה. שימוש במיקום צוואר לאלקטרודת הייחוס יועיל אם יבוצעו מניפולציה או ניתוח בשתי האוזניים. באופן מעניין, משרעת השיא של Wave II עבור מיקום המסטואידים (עקבות אדומים) התרחשה 1 אלפיות השנייה לאחר שיא הגל II עבור מיקום הצוואר (עקבות שחורים). הפרש זמן זה משקף ככל הנראה את האתר(ים) של יצירת עצבי ABR ביחס למיקום האלקטרודה.
באמצעות מערך דו-ערוצי, אלקטרודת הקלטה פעילה אחת (החלק העליון של מיקום הראש) ושתי אלקטרודות ייחוס (מיקומי מסטואידים) שימשו להשגת ABRs הן עבור האוזניים השמאלית והן עבור האוזן הימנית (איור 4B). התגובות בין שתי האוזניים היו דומות, עם שינויים קלים באמפליטודות שיא ככל הנראה עקב מיקום האוזניות. ההשהיה של האוזן השמאלית והימנית כאחד, שהייתה שקולה, תמכה בתפקוד הבריא באותה מידה של שתי האוזניים ושל ההמיספרות של גזע המוח בעוף הבוקע. מונטאז' ההקלטה הדו-ערוצי יכול לשמש גם ל-ABRs דו-כיווניים, אך יהיו שיקולים נוספים הדרושים להקלטות אלה.

איור 1: הקלטות מייצגות של אפרוחים בוקעים לגירויים מעוררי קליקים וצלילים. ניתן לזהות שלושה עד ארבעה שיאים חיוביים במיקרו-וולטים (μV) בתוך 6 אלפיות השנייה לאחר הופעת הגירוי (זמן = 0 אלפיות השנייה). גלים זוהו באמצעות ספרות רומיות. משרעת שיא לשוקת יורדת ברמות נמוכות יותר של עוצמת גירוי. (B) פונקציות עוצמת השהיה של גלים I ו-III עבור העקבה הייצוגית המוצגת ב-(A). רק פסגות אלה נותחו, שכן גל II בדרך כלל לא נצפה בעוצמות <45 dBSPL. (C) השהיה של צורות גל שיא ABR המעוררות בלחיצה (n = 43 אפרוחים). פסי שגיאה מציינים את שגיאת התקן של הממוצע (SEM). (D) ABRs (עקבות שחורים) מעוררי טון ממוצעים לארבעה אפרוחים בוקעים בשלושה תדרים שונים. עקבות אדומים = שגיאת תקן של הגירויים הממוצעים (SEM) = 75 dBSPL. בנתונים אלה ובנתונים הבאים, פסי שגיאה מציינים SEM, ואוזן ימין הייתה אוזן הגירוי. (יוצא מן הכלל באיור 4B שבו שתי האוזניים היו מגורות). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: השפעת טמפרטורת הגוף על הקלטות ABR. (A) הקלטות ABR מייצגות של אפרוח בוקע (P2) כפונקציה של טמפרטורת הגוף. עבור טמפרטורות גוף נמוכות יותר, חריגות שיא בצורת הגל עלו בעוד משרעת השיא לשוקת נותרה יחסית ללא שינוי. (B) פונקציית טמפרטורת השהיה של גלים I ו-III עבור העקבות המייצגים המוצגים ב-(A). (C) נתוני אוכלוסייה המראים את הקשר בין חביון לשינויי טמפרטורה עבור 5 אפרוחים (עמ' < 0.01, R2 = 0.89). מגמה דומה נצפתה עבור גלים II ו- III (נתונים שלא הוצגו). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
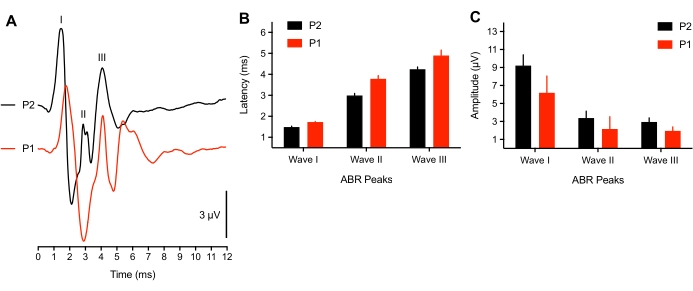
איור 3: הבדלים תלויי גיל בהקלטות ABR. (A) הקלטות ABR מייצגות (חופפות) של אפרוח אבקוע מייצג ב-P2 (עקבות שחורים) ו-P1 (<3 שעות לאחר הצוהר, עקבות אדומים). (B) איחורים בצורת גל שיא עבור גלים I, II ו-III כפונקציה של גיל. האיחורים עבור גלים I-III היו שונים באופן משמעותי בין הגילאים (P < 0.05, n = 6 אפרוחים). (C) משרעת צורת גל מפסגת השוקת של גלים I, II ו-III כפונקציה של הגיל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
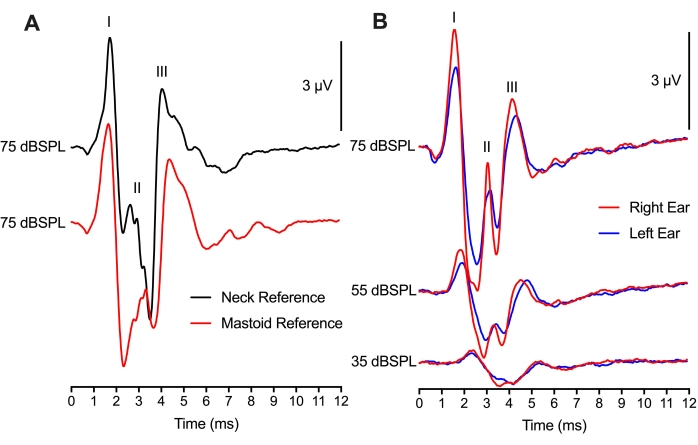
איור 4: מיקום אלקטרודות והקלטות ABR דו-ערוציות: (A) הקלטות ABR מייצגות (חופפות) מאותו אפרוח בוקע (P2) כאשר אלקטרודת הייחוס ממוקמת בצוואר (עקבות שחורים) או במסטואיד (עקבות אדומים). האלקטרודה הפעילה הוצבה בקו האמצע של הגולגולת עבור שני מונטאז'ים להקלטת אלקטרודות. ההשהיה של גלים I ו-III, והמשרעת של גלים I ו-III כמעט זהים בשני התנאים. ההשהיה של גל II מוקדמת יותר, והמשרעת גדולה יותר עבור האלקטרודה הממוקמת ברקמת הצוואר. (B) הקלטה דו-ערוצית תוך גירוי רציף של האוזניים הימנית והשמאלית. הקלטות ABR מייצגות (חופפות) מאותו אפרוח אבקוע (P2) עם אלקטרודות הייחוס הממוקמות במסטואיד של האוזן השמאלית (עקבות כחולים) ובאוזן ימין (עקבות אדומים) בשלוש רמות עוצמה שונות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
טבלה משלימה: שולחן כיול אבקוע עוף. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
גזע המוח השמיעתי של ציפורים נחקר היטב, ומבנים רבים מקבילים למסלול השמיעה של היונקים. עצב השמיעה מספק קלטים מעוררים על שני הגרעינים המרכזיים מסדר ראשון, גרעין השבלול מגנוצלריס (NM) וזוויתי (NA). NM שולחת הקרנה מעוררת באופן דו-צדדי אל המטרה השמיעתית שלה, גרעין למינריס (NL)7. NL מקרין לגרעין mesencephalicus lateralis, pars dorsalis (MLd)40,41. NL מקרין גם את גרעין האוליברי העליון (SON), המספק עיכוב משוב ל-NM, NA ו-NL42. המיקרו-מעגל של גזע המוח השמיעתי התחתון הזה נשמר בצורה נהדרת לתפקוד שהוא משרת, לוקליזציה קולית ושמיעה דו-כיוונית33. לאזורי גזע המוח השמיעתי העליון של הציפור יש גם גרעינים המקבילים ללמניסקוס הלטרלי של היונקים ולקוליקולוס נחות במוח האמצעי. בהתחשב בדמיון זה, הרכב ה- ABR של העופות עד המוח האמצעי השמיעתי דומה בכל בעלי החוליות.
בעוד שמיני עופות רבים מראים שלוש פסגות חיוביות בטווח של 6 אלפיות השנייה לאחר הופעת הגירוי, המתאם של פסגות ABR עם מבנים שמיעתיים מרכזיים אכן כולל שונות מסוימת. ניתן להניח באופן סביר שגל I הוא התגובה העצבית הראשונה של הפפילה הבזילרית ההיקפית ועצב השמיעה, והוא מפגין שונות מועטה בין פרטים (איור 1C). זיהוי הגלים הבאים פחות ודאי ועשוי להיות שונה בין המינים. Kuokkanen et al.17 קבעו לאחרונה כי גל III של ABR של ינשוף האסם נוצר על ידי NL; לפיכך, סביר לטעון כי גל II מקורו ב- NM ו- NA של גרעין השבלול20. עם זאת, גל הינשוף III הוגדר כשיא חיובי שנוצר 3 אלפיות השנייה לאחר הופעת הגירוי. זה מתאים לגל II כפי שמוגדר בתרנגולת האבקועה ABR. באסם ינשוף ABR, גלים I ו- II שולבו.
בעוד שעוף האבקוע מוצג בדרך כלל עם שלוש פסגות בטווח של 6 אלפיות השנייה, מדי פעם נצפתה פסגה רביעית (למשל, ראו איור 1A). יהיה צורך בנתוני אוכלוסייה, גודל מדגם גדול יותר ופרדיגמות ניסיוניות נוספות כדי לתמוך בגל רביעי, ובמקרים מסוימים בתרנגולת ABR בעלת חמישה גלים. הממצא העקבי ביותר היה שלושת ייצוגי השיא שהוצגו כאן.
מאחר שה-ABR מוגדר כמדד לסינכרוניזציה עצבית, הגרעינים העיקריים במסלול השמיעתי יכולים לייצג כל שיא חיובי ב-ABR. האות העובר מעצב השמיעה ל-NM/NA ולאחר מכן ל-NL עשוי להגדיר את גלים I, II ו-III ב-ABR של עוף האבקוע, בהתאמה. בנוסף, השיא הרביעי המאוחר יותר של ה-ABR של העוף יכול לייצג גזע מוח עליון או מבנה שמיעתי של המוח האמצעי. האפיון של ABRs העופות צריך גם לשקול את ההבדל בין ציפורים קדם-קוציואליות ואלטריאליות. ההבשלה של תגובות שמיעתיות תשתנה בין המינים ותושפע גם מתכונות קריטיות אחרות כמו התנהגות טורפים ו/או למידה קולית4. ללא קשר, השיטות והטכניקות המתוארות מיושמות בקלות על מגוון מיני עופות ובעלי חוליות.
החשיבות של שמירה על טמפרטורת הגוף של בעלי החיים מודגמת באיור 2. ככל שטמפרטורת הגוף הפנימית ירדה, ההשהיה של תגובות ה-ABR עלתה עבור אותה רמת עוצמת גירוי. זה בולט יותר כאשר טמפרטורת הגוף יורדת מתחת ל 32 °C36,37. העלייה בהשהיה של כ-1 אלפיות השנייה ב-ABR נמוכה מבעברב-23 העוף. עם זאת, קטאיאמה23 השתמשה באבקוע בן 12 יום שהתקרר ולאחר מכן התחמם במשך 4 שעות. הנתונים באיור 2 תועדו במהלך תהליך הקירור במשך תקופה של 20 דקות. כדי לרכוש את האיכות הטובה ביותר ואת הרישומים העקביים ביותר, יש לשמור על טמפרטורת הגוף של החיה, וכל ההקלטות צריכות להיעשות באותה טמפרטורה פיזיולוגית בקרב בעלי חיים.
השפעת הגיל על ה- ABR היא קלה אך חשובה לשקול. בעוד שרק ההשהיה של גלים I ו-II של ה-ABR הייתה שונה באופן משמעותי, הסיבה לכך היא שרק שלושה אבקועים צעירים שימשו באיור 3; שלושת האחרים לא הציגו שלוש פסגות ABR הניתנות לזיהוי. משרעת ABR ושינויי סף עשויים להיות ברורים גם אם משתמשים בגדלים גדולים של מדגם או משווים ABRs ספציפיים לתדר. השפעה זו הקשורה לגיל יכולה להיגרם על ידי נוזל באוזן התיכונה של העוף. שינויים מוליכים כאלה מובילים לעלייה ניכרת בסף ה-ABR הן עבור מודלים אנושיים והן עבור מודלים אחרים של יונקים38,39.
באמצעות שני מונטאז'ים שונים של הקלטה נצפו תגובות דומות (איור 4A). בעוד שהמונטאז' הנפוץ ביותר ממקם את אלקטרודת הייחוס מאחורי האוזן המקבלת גירוי, אלקטרודת הייחוס ברקמת הצוואר יכולה להיות שימושית אם יש התערבות כירורגית המלווה את ה- ABR. עם זאת, אם נעשה שימוש בהקלטות ABR דו-ערוציות, יש למקם את אלקטרודות הייחוס בנפרד ובאופן סימטרי, דבר שקשה אם מניחים את אלקטרודת הייחוס בצוואר. המיקום המסטואידי של אלקטרודת הייחוס מומלץ לתקנן כמה שיותר היבטים של ההקלטה. הקלטת ABR דו-ערוצית היא כלי יעיל הדורש מעט הכנה נוספת ומביאה לתגובות דומות בין האוזניים. הבדלי משרעת קלים נבעו ככל הנראה ממיקום האוזנייה. הקלטה דו-ערוצית מאפשרת השוואה קלה בין אוזן או חצי כדור מוח שעברו מניפולציה ניסיונית לעומת שליטה. הגדרה זו תידרש גם לבדיקת ABRs דו-כיווניים. ניסויים עתידיים באמצעות ABR עוף יכולים להתייחס לספרות קודמת על תצורות הקלטה ומונטאז'ים34.
מתודולוגיה זו אכן מגיעה עם מספר מגבלות. כפי שצוין בשלב 5.1, מיקום ספקולום לקוי יכול להוביל לשינוי של 40 dBSPL בתגובה. זה יכול לגרום לפרשנות שגויה של בעל חיים שעבר מניפולציה או שינוי. אמצעי הזהירות הבאים מומלצים: לרכוש מדגם גדול של נתוני בקרה לפני רכישת ה- ABRs של מודלים מניפולטיביים או מוטנטיים. אין להפחית את עוצמת הגירוי ביותר מ-20 dBSPL בין ההקלטות. אם המשרעת או ההשהיה זזות יותר מהצפוי, בדקו את מיקום החיה והספקולום. חזור על גירוי ABR כדי להתבונן בשינויים. אם הספקולום זז, בדוק מחדש בדיקות קודמות. מגבלה נוספת היא כיול של ABRs. ללא כיול מתאים להקלטת רמת לחץ הקול, העוצמה המוצגת לבעל החיים אינה ידועה. בעת מדידת פלט קול, השתמש באותו ספקולום כמו בהקלטה ניסיונית ובמיקרופון קטן בתוך חלל המעריך את אורך תעלת האוזן של החיה (כ-5 מ"מ). מדוד את אותם תדרי טון המשמשים בניסויים, מכיוון שהכיולים הם ספציפיים לתדרים. המדריך הן למערכות חומרה והן למערכות תוכנה עשוי להגיע עם הוראות לכיול. ישנם גם מסננים נוספים כגון מסנני פאזה ליניארית ומסנני פאזה מינימליים, אשר יכולים לשפר את הלחץ ואת הטון פרץ ABRs43. מסננים אלה לא שימשו במחקר הנוכחי. גם שיקולים נוספים, כמו זמן העלייה והירידה של מעטפת ספקטרלית של פרץ טון המשתנה כפונקציה של תדירות או שינוי זמן העלייה והירידה של גירויי הקליק לא נבדקו. אלה הן חקירות עתידיות טובות ברגע שניתן יהיה לרכוש ABRs אמינים ועקביים.
ההשוואה של עוף האבקוע לדגמי עופות אחרים מבטיחה. גם בודג'ריגרים וינשופים מזרחיים מציגים שלוש פסגות חיוביות של מיקרו-וולט בתוך 6 אלפיות השנייה הראשונות של ה-ABR13,22. במינים שונים של נקרים נראים גם שלוש פסגות, אך ההשהיה שלהם מאוחרת יותר בזמן. בנוסף, טווח רגישות התדרים הטובה ביותר בנקרים הוא בין 1500 ל-4000 הרץ, שהוא מעט גבוה יותר מהסף הטוב ביותר של העוף ב-1000 הרץ. אצל העוף הבוגר, הרגישות הטובה ביותר היא ב-2000 הרץ35, כך שייתכן שיהיה שיפור בשמיעה על תדרים גבוהים ככל שאבקועים של עוף יתפתחו למבוגרים. התפתחות זו תהיה שונה בין מיני הציפורים, תוך התחשבות בהתפתחות המטריאלית או המוקדמת של החיה4.
השיטות הניסוייות המתוארות כאן יכולות לסייע בקביעת הגורמים המובילים לפגיעה או לשינויים בתגובות ובספי הסף השמיעתיים, כמו גם במחקרים בשלבים שונים של התפתחות עוברית. מניפולציה גנטית, הזדקנות וחשיפה לרעש הן כולן מניפולציות ידועות בבעלי חיים ובמודלים אחרים של עופות 24,25,44,45. יש להרחיב את השיטות הללו למודל העוף כעת, כאשר טכניקות כמו אלקטרופורציה בתוך אובו מאפשרות ביטוי של חלבונים הנשלטים באופן מוקדי וזמני בצד אחד של גזע המוח השמיעתי12,46. זה מאפשר השוואה ישירה של ABRs מהאוזן שעברה מניפולציה גנטית לאוזן הבקרה הקונטרה-צדדית באמצעות פרדיגמת הקלטה דו-ערוצית.
באופן כללי, ה-ABR של תרנגולות האבקועים הוא שיטת מחקר שימושית, כמעט זהה למדידות של תפקוד השמיעה במודלים אנושיים ואחרים של יונקים. זוהי גם מתודולוגיה לא פולשנית, in-vivo . מלבד הזרקת הרדמה ומיקום אלקטרודות תת-עוריות של כמה מילימטרים, אין צורך במניפולציה פיזיקלית אחרת. תיאורטית ניתן לבחון אבקוע מספר פעמים במהלך זמן התפתחותי של ימים או שבועות אם הוא נשמר בסביבה מתאימה. פרוטוקול זה לא רק מפרט את הצעדים הדרושים ואת פרמטרי הרישום עבור עוף האבקוע ABR, אלא הוא מציע מאפיינים של ABR עוף שיכולים ליידע בדיקות נוספות לתפקוד גזע המוח השמיעתי.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכת על-ידי NIH/NIDCD R01 DC017167
Materials
| Name | Company | Catalog Number | Comments |
| 1/8 inch B&K Microphone | Brüel & Kjær | 4138 | Type 4138-A-015 also works |
| Auditory Evoked Potential Universal Smart Box | Intelligent Hearing Systems | M011110 | |
| Custom Sound Isolation Chamber | GK Soundbooth Inc | N/A | Custom built |
| DC Power Supply | CSI/Speco | PSV-5 | |
| ER3 Insert Earphone | Intelligent Hearing Systems | M015302 | Used as sound transducer |
| Euthasol | Virbac | 710101 | Controlled Substance; euthanasia solution |
| Insulin Syringe (29 G) | Comfort Point | 26028 | |
| Ketamine | Covetrus | 11695-0703-1 | Controlled Substance |
| Power Supply | Powervar | 93051-55R | |
| Rectal Probe | YSI | 401 (10-09010) | Any 400 series probe will work with the YSI temperatuer monitor |
| Subdermal needles | Rhythmlink | RLSND107-1.5 | |
| Temperature Monitor | YSI | 73ATA 7651 | Works with any 400 series rectal probe |
| Xylazine | Anased | 59399-110-20 | Used with ketamine and water for anesthetic |
References
- Wever, E. G., Bray, C. W. Action currents in the auditory nerve in response to acoustical stimulation. Proceedings of the National Academy of Sciences of the United States of America. 16 (5), 344-350 (1930).
- Jewett, D. L., Williston, J. S. Auditory-evoked far fields averaged from the scalp of humans. Brain. 94 (4), 681-696 (1971).
- Corwin, J. T., Bullock, T. H., Schweitzer, J. The auditory brain stem response in five vertebrate classes. Electroencephalography and Clinical Neurophysiology. 54 (6), 629-641 (1982).
- Carey, C. Avian Growth and Development. Evolution within the Altricial Precocial Spectrum. , Oxford University Press. Oxford. (1998).
- Kraemer, A., Baxter, C., Hendrix, A., Carr, C. E. Development of auditory sensitivity in the barn owl. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 203 (10), 843-853 (2017).
- Rebillard, G., Rubel, E. W. Electrophysiological study of the maturation of auditory responses from the inner ear of the chick. Brain Research. 229 (1), 15-23 (1981).
- Parks, T. N., Rubel, E. W. Organization and development of brain stem auditory nuclei of the chicken: organization of projections from n. magnocellularis to n. laminaris. Journal of Comparative Neurology. 164 (4), 435-448 (1975).
- Hong, H., Rollman, L., Feinstein, B., Sanchez, J. T. Developmental profile of ion channel specializations in the avian nucleus magnocellularis. Frontiers in Cellular Neuroscience. 10, 80(2016).
- Leao, R. M. The ion channels and synapses responsible for the physiological diversity of mammalian lower brainstem auditory neurons. Hearing Research. 376, 33-46 (2019).
- Oline, S. N., Ashida, G., Burger, R. M. Tonotopic optimization for temporal processing in the cochlear nucleus. Journal of Neuroscience. 36 (32), 8500-8515 (2016).
- Kopp-Scheinpflug, C. Your genes decide what you are listening to. Channels. 11 (5), 355-356 (2017).
- Sid, H., Schusser, B. Applications of gene editing in chickens: A new era is on the horizon. Frontiers in Genetics. 9, 456(2018).
- Brittan-Powell, E. F., Dooling, R. J., Gleich, O. Auditory brainstem responses in adult budgerigars (Melopsittacus undulatus). The Journal of the Acoustical Society of America. 112 (3), Pt 1 999-1008 (2002).
- Lohr, B., Brittan-Powell, E. F., Dooling, R. J. Auditory brainstem responses and auditory thresholds in woodpeckers. The Journal of the Acoustical Society of America. 133 (1), 337-342 (2013).
- Counter, S. A. Brain-stem evoked potentials and noise effects in seagulls. Comparative Biochemistry and Physiology. A, Comparative Physiology. 81 (4), 837-845 (1985).
- Crowell, S. E., et al. A comparison of auditory brainstem responses across diving bird species. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 201 (8), 803-815 (2015).
- Noirot, I. C., Brittan-Powell, E. F., Dooling, R. J. Masked auditory thresholds in three species of birds, as measured by the auditory brainstem response (L). Journal of the Acoustical Society of America. 129 (6), 3445-3448 (2011).
- McGee, J., et al. Auditory performance in bald eagles and red-tailed hawks: a comparative study of hearing in diurnal raptors. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 205 (6), 793-811 (2019).
- Brittan-Powell, E. F., Dooling, R. J., Ryals, B., Gleich, O. Electrophysiological and morphological development of the inner ear in Belgian Waterslager canaries. Hearing Research. 269 (1-2), 56-69 (2010).
- Kuokkanen, P. T., Kraemer, A., Kempter, R., Koppl, C., Carr, C. E. Auditory brainstem response wave iii is correlated with extracellular field potentials from nucleus laminaris of the barn owl. Acta Acustica United with Acustica. The Journal of the European Acoustics Association (EEIG). 104 (5), 874-877 (2018).
- Beatini, J. R., Proudfoot, G. A., Gall, M. D. Frequency sensitivity in Northern saw-whet owls (Aegolius acadicus). Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 204 (2), 145-154 (2018).
- Brittan-Powell, E. F., Lohr, B., Hahn, D. C., Dooling, R. J. Auditory brainstem responses in the Eastern Screech Owl: an estimate of auditory thresholds. The Journal of the Acoustical Society of America. 118 (1), 314-321 (2005).
- Katayama, A. Postnatal development of auditory function in the chicken revealed by auditory brainstem responses (ABRs). Electroencephalography and Clinical Neurophysiology. 62 (5), 388-398 (1985).
- Durham, D., Park, D. L., Girod, D. A. Breed differences in cochlear integrity in adult, commercially raised chickens. Hearing Research. 166 (1-2), 82-95 (2002).
- Kaiser, C. L., Girod, D. A., Durham, D. Breed-dependent susceptibility to acute sound exposure in young chickens. Hearing Research. 203 (1-2), 101-111 (2005).
- Hamdy, A. M., Vander Hel, W., Henken, A. M., Galal, A. G., Abd-Elmoty, A. K. Effects of air humidity during incubation and age after hatch on heat tolerance of neonatal male and female chicks. Poultry Science. 70 (7), 1499-1506 (1991).
- Bruzual, J. J., Peak, S. D., Brake, J., Peebles, E. D. Effects of relative humidity during the last five days of incubation and brooding temperature on performance of broiler chicks from young broiler breeders. Poultry Science. 79 (10), 1385-1391 (2000).
- vander Pol, C. W., van Roovert-Reijrink, I. A. M., Maatjens, C. M., vanden Brand, H., Molenaar, R. Effect of relative humidity during incubation at a set eggshell temperature and brooding temperature posthatch on embryonic mortality and chick quality. Poultry Science. 92 (8), 2145-2155 (2013).
- Buhr, R. J. Incubation relative humidity effects on allantoic fluid volume and hatchability. Poultry Science. 74 (5), 874-884 (1995).
- Galli, R., et al. Sexing of chicken eggs by fluorescence and Raman spectroscopy through the shell membrane. PLoS One. 13 (2), 0192554(2018).
- Otsuka, M., Miyashita, O., Shibata, M., Sato, F., Naito, M. A novel method for sexing day-old chicks using endoscope system. Poultry Science. 95 (11), 2685-2689 (2016).
- Kaiser, A. The ontogeny of homeothermic regulation in post-hatching chicks: its influence on the development of hearing. Comparative Biochemistry and Physiology. A, Comparative Physiology. 103 (1), 105-111 (1992).
- Kuba, H., Yamada, R., Ohmori, H. Evaluation of the limiting acuity of coincidence detection in nucleus laminaris of the chicken. The Journal of Physiology. 552, Pt 2 611-620 (2003).
- Shaheen, L. A., Valero, M. D., Liberman, M. C. Towards a diagnosis of cochlear neuropathy with envelope following responses. Journal of the Association for Research in Otolaryngology. 16 (6), 727-745 (2015).
- Hill, E. M., Koay, G., Heffner, R. S., Heffner, H. E. Audiogram of the chicken (Gallus gallus domesticus) from 2 Hz to 9 kHz. Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 200 (10), 863-870 (2014).
- Rossi, G. T., Britt, R. H. Effects of hypothermia on the cat brainstem auditory evoked response. Electroencephalography and Clinical Neurophysiology. 57 (2), 143-155 (1984).
- Doyle, W. J., Fria, T. J. The effects of hypothermia on the latencies of the auditory brainstem response (ABR) in the rhesus monkey. Electroencephalography and Clinical Neurophysiology. 60 (3), 258-266 (1985).
- Guan, X., Gan, R. Z. Effect of middle ear fluid on sound transmission and auditory brainstem response in guinea pigs. Hearing Research. 277 (1-2), 96-106 (2011).
- Ravicz, M. E., Rosowski, J. J., Merchant, S. N. Mechanisms of hearing loss resulting from middle-ear fluid. Hearing Research. 195 (1-2), 103-130 (2004).
- Wang, Y., Zorio, D. A. R., Karten, H. J. Heterogeneous organization and connectivity of the chicken auditory thalamus (Gallus gallus). Journal of Comparative Neurology. 525 (14), 3044-3071 (2017).
- Wang, Y., Karten, H. J. Three subdivisions of the auditory midbrain in chicks (Gallus gallus) identified by their afferent and commissural projections. Journal of Comparative Neurology. 518 (8), 1199-1219 (2010).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. Journal of Neuroscience. 30 (36), 12075-12083 (2010).
- Beutelmann, R., Laumen, G., Tollin, D., Klump, G. M. Amplitude and phase equalization of stimuli for click evoked auditory brainstem responses. The Journal of the Acoustical Society of America. 137 (1), 71-77 (2015).
- Liberman, M. C. Noise-induced and age-related hearing loss: new perspectives and potential therapies. F1000Research. 6, 927(2017).
- Efrati, A., Gutfreund, Y. Early life exposure to noise alters the representation of auditory localization cues in the auditory space map of the barn owl. Journal of Neurophysiology. 105 (5), 2522-2535 (2011).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments: JoVE. (124), e55628(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved