Method Article
Оценка слухового ответа ствола мозга у цыплят
В этой статье
Резюме
Мы использовали стандартные методы слухового ответа ствола мозга (ABR) и применили их к птенцам, преждевременной птичьей модели для слуховой функции. В протоколе подробно описываются методы подготовки животных и получения ABR с шагами, которые могут быть переведены на другие модели птиц или грызунов.
Аннотация
Слуховая реакция ствола мозга (ABR) является бесценным анализом в клинической аудиологии, нечеловеческих животных и исследованиях на людях. Несмотря на широкое использование ABR для измерения слуховой нейронной синхронности и оценки чувствительности слуха в других модельных системах позвоночных, о методах регистрации ABR у кур не сообщалось в течение почти четырех десятилетий. Цыплята обеспечивают надежную модель исследования на животных, потому что их слуховая система близка к функциональному созреванию на поздних эмбриональных и ранних стадиях птенца. Мы продемонстрировали методы, используемые для получения одно- или двухканальных записей ABR с использованием подкожных игольчатых электродных массивов у птенцов. Независимо от конфигурации записи электродов (т.е. монтажа), записи ABR включали 3-4 положительные пиковые формы сигнала в течение первых 6 мс надпорогового стимула щелчка. Амплитуды формы сигнала от пика до впадины варьировались от 2 до 11 мкВ на уровнях высокой интенсивности, причем положительные пики демонстрировали ожидаемые функции задержки-интенсивности (т.е. увеличение задержки в зависимости от снижения интенсивности). Стандартизированное положение наушников имело решающее значение для оптимальной записи, поскольку дряблая кожа может закупорить ушной канал, а движение животных может вытеснить датчик стимула. Пиковые амплитуды были меньше, а задержки были длиннее по мере снижения температуры тела животных, что поддерживало необходимость поддержания физиологической температуры тела. Для молодых птенцов (<3 ч после вылупления 1-го дня) пороговые значения были повышены на ~5 дБ, пиковые задержки увеличились ~1-2 мс, а пиковые амплитуды до корыта были уменьшены ~1 мкВ по сравнению со старшими птенцами. Это предполагает потенциальную проблему, связанную с проводимостью (т. Е. Жидкость в полости среднего уха) и должна рассматриваться для молодых детенышей. В целом, методы ABR, изложенные здесь, позволяют точно и воспроизводимо регистрировать слуховую функцию in vivo у птенцов, которая может быть применена на разных стадиях развития. Такие результаты легко сравнить с моделями потери слуха, старения или других слуховых манипуляций человека и млекопитающих.
Введение
Изучение вызванных нейронных реакций на звуковые раздражители насчитывает более полувека1. Слуховая реакция ствола мозга (ABR) представляет собой вызванный потенциал, который использовался в качестве меры слуховой функции как у нечеловеческих животных, так и у людей в течение десятилетий. Человеческий ABR представляет собой от пяти до семи пиков формы волны, условно обозначенных римскими цифрами (I-VII)2. Эти пики анализируются на основе их задержки (время возникновения в миллисекундах) и амплитуды (размер пика до впадины в микровольтах) нейронных реакций. ABR играет важную роль в оценке функции и целостности слухового нерва, а также чувствительности ствола мозга и порога слуха. Дефицит в слуховой системе приводит к отсутствующим, уменьшенным, длительным или аномальным задержкам и амплитудам ABR. Примечательно, что эти параметры почти идентичны у людей и других животных, что делает его последовательным объективным тестом слуховой функции на моделях позвоночных3.
Одной из таких модельных систем является курица, и она особенно полезна по целому ряду причин. Птицы могут быть классифицированы как альтрициальные или прекоциальные4. Альтрициальные птицы вылупляются с еще развивающимися чувствами; например, амбарные совы не показывают последовательного ABR до четырех дней после вылупления5. Скороспелые животные, такие как курица, вылупляются с почти зрелыми чувствами. Начало слуха происходит в эмбриональном развитии, так что за несколько дней до вылупления (эмбриональный день 21) слуховая система близка к функциональному созреванию 6,7,8. Альтрициальные птицы и большинство моделей млекопитающих восприимчивы к внешним факторам, которые влияют на развитие и требуют животноводства до тех пор, пока слух не станет зрелым. Курные АБР могут выполняться в тот же день, что и вылупление, отказываясь от необходимости кормления или обогащенной среды.
Эмбриональная курица была хорошо изученной моделью физиологии и развития, особенно в слуховом стволе мозга. Специфические структуры включают куриное кохлеарное ядро, разделенное на магноцеллюлярное ядро (NM) и угловатое ядро (NA), и птичий коррелят медиальной верхней оливы, известный как ядро laminaris (NL)6,7. ABR идеально подходит для сосредоточения внимания на центральной слуховой функции перед уровнем переднего мозга и коры. Трансляция между измерениями ABR in-vivo и исследованиями нейронов in vitro развития8, физиологии9, тонотопии10 и генетики11,12 обеспечивает идеальные исследовательские возможности, которые поддерживают исследования общей слуховой функции.
Хотя ABR был широко изучен в моделях млекопитающих, меньше внимания уделялось птицам. Предыдущие исследования птиц ABR включают характеристики волнистого попугая13, дятла14, чайки15, ныряющих птиц16, зебрового зяблика17, суточныххищников 18, канарейки19, трех видов совы 5,20,21,22 и курицы23. Учитывая почти четыре десятилетия с момента последней тщательной характеристики куриного ABR, многие из ранее использовавшихся оборудования и методов изменились. Выводы из исследований в других птичьих моделях могут помочь разработать современную методологию ABR курицы, а также служить сравнением с куриным ABR. В этой статье будет описана экспериментальная установка и дизайн, позволяющие регистрировать ABR у птенцов, которые также могут быть применены к эмбриональным стадиям развития и другим моделям мелких грызунов и птиц. Кроме того, учитывая преждевременное развитие курицы, манипуляции по развитию могут быть выполнены без какого-либо обширного животноводства. Манипуляции с развивающимся эмбрионом могут быть оценены всего через несколько часов после того, как животное вылупится с почти зрелыми слуховыми способностями.
протокол
Эксперименты, описанные здесь, были одобрены Институциональными комитетами по уходу и использованию животных Северо-Западного университета (IACUC) и проведены в соответствии с Руководством Национальных институтов здравоохранения по уходу и использованию лабораторных животных.
1. Птицеводство
- Приобретайте оплодотворенные белые куриные яйца.
ПРИМЕЧАНИЕ: Существует несколько пород кур, используемых в научных исследованиях, но результаты, показанные здесь, получены от белой курицы-леггорна (Gallus gallus domesticus). В то время как изменчивость ABR между породами неизвестна, некоторые различия были обнаружены при сравнении взрослых яйцекладущих кур с мясопроизводящими цыплятами-бройлерами24,25. - Инкубировать яйца при 38 °C, влажности 50%, в течение 21 дня до желаемой даты тестирования.
ПРИМЕЧАНИЕ: Если яйца не инкубируются сразу при 38 °C, их можно хранить при 14 °C, влажности при 40%. Однако, чем дольше яйца содержатся при 14 ° C, тем меньше вероятность того, что они разовьются в жизнеспособных птенцов. Через 7 дней жизнеспособность яиц может упасть до 50% в зависимости от того, как долго яйца хранятся при 14 °C. Жизнеспособность яиц также будет падать в зимние месяцы. - Периодически переворачивайте яйца 2-3 раза в день. Большинство инкубаторов имеют механизм для выполнения этого автоматически.
- При использовании инкубатора из пенополистирола или инкубатора, содержащего более 6 яиц, перенесите яйца в небольшой инкубатор с температурой 38 °C за день до вылупления, эмбриональный день 20 (E20). Яйца должны вылупляться через 21 день (E21) после установки в инкубатор.
ПРИМЕЧАНИЕ: В процессе вылупления животное начнет «выбивать» из яйца, делая небольшое отверстие, которое в конечном итоге огибает все яйцо. Если условия слишком сухие, яйцо может высохнуть, и животное не сможет вылупиться. Влажность должна поддерживаться около 50%, основываясь на предыдущих исследованиях жизнеспособности вылупления яиц 26,27,28,29. - Определите возраст животного. Если люк не засвидетельствован лично, единственным показателем возраста является 2-3 часа, необходимые для высыхания околоплодных вод.
ПРИМЕЧАНИЕ: Инкубатор для птенцов должен ежедневно тщательно очищаться 70% изопропиловым спиртом в зависимости от того, сколько птенцов обработано. Детеныши кур часто оставляют экскременты, перья и околоплодные воды в инкубаторе, что может загрязнить условия и качество воздуха.
2. Препарат препарат
- Взвесьте животное, поместив его в большую весовую лодку. При достаточно мягком размещении животное не должно двигаться.
ПРИМЕЧАНИЕ: Масса может варьироваться в пределах 30-45 г. Молодые животные часто тяжелее из-за запасов желтка и еще не выделяют отходы. Пожилые животные, приближающиеся к 24-часовому возрасту и P2, обычно весят меньше. - Приготовьте обезболивающий коктейль из кетамина (100 мг / мл) и ксилазина (20 мг / мл) таким образом, чтобы дозировка составляла 50 мг / кг кетамина и 16,68 мг / кг ксилазина в зависимости от веса животного.
ПРИМЕЧАНИЕ: Этот лекарственный коктейль может быть приготовлен из 1 мл кетамина (100 мг / мл), 1,5 мл ксилазина (20 мг / мл) и 2,5 мл H2O. Инъекции анестетического коктейля будут варьироваться от 0,05-0,1 мл в зависимости от диапазона 30-45 г веса животных.
3. Инъекции наркотиков и подготовка животных
- Держите животное в одной руке, следя за тем, чтобы ноги были опущены.
- Почувствуйте грудную кость животного, киль. По обе стороны киля будут находиться мышцы молочной железы.
- Используйте иглу 29-G и шприц для проникновения 5 мм в кожу и вводят коктейль кетамин/ксилазин в мышцу груди. Вводят в пределах 0,05-0,1 мл в зависимости от веса животного.
- Поместите животное обратно в инкубатор после инъекции. Поддерживайте температуру тела животного в течение нескольких минут, пока анестетик вступает в силу.
- Используйте щипцы, чтобы ущипнуть палец животного и проверить, не хромает ли шея. Если нет рефлекса и хромает шея, животное находится без сознания.
- Определите пол курицы, используя ее перья крыла. Если перья все одинаковой длины, то животное мужское. Если перья различаются по длине, то животное женскогопола 30.
ПРИМЕЧАНИЕ: Другим методом полового созревания животного является вентиляция. Мужские гениталии можно увидеть в клоаке31. Этот метод очень сложен и может навредить животному, если не сделать это правильно. Рекомендуется использовать метод пера крыла. - Нанесите крем для депиляции с ватным аппликатором на область головы и шеи, особенно возле отверстия уха для птицы.
- Используйте 70% изопропиловые спиртовые салфетки, чтобы вытереть перья, любой оставшийся крем для депиляции, а также кожу на голове и шее.
- Используйте 70% изопропиловую спиртовую салфетку для стерилизации подкожных электродов и ректального зонда.
- Поместите животное в звукоизоляционную и электрически защищенную камеру. Убедитесь, что окружающая среда имеет минимальный электрический и акустический шум для наилучшей записи.
ПРИМЕЧАНИЕ: Эксперименты здесь проводились в специальном звукоизолированном корпусе размером 24 x 24 x 25 дюймов. Достаточно любой камеры или помещения, исключающей акустический шум, а также электрический шум от переменного электрического тока (60 Гц в США). - Используйте грелку или систему контроля температуры для поддержания температуры тела животного.
- Вставьте смазанный ректальный зонд, чтобы температура животного поддерживалась в пределах 37-41 °C (98,6-105 °F)32,33.
ПРИМЕЧАНИЕ: Если зонд имеет неправильный размер, животное может лежать поверх датчика температуры. - Зафиксируйте голову животного на месте или упирайтесь клювом в предмет, чтобы избежать нежелательных движений. Это можно сделать с помощью лепки из глины, если дыхание не затруднено.
- Введите дополнительную инъекцию анестетического коктейля, который составляет половину первоначальной дозировки, если животное начинает приходить в сознание во время тестирования.
ПРИМЕЧАНИЕ: Любое движение тела или вокализация является признаком того, что необходимо вводить дозировку добавки. Незначительные движения клюва указывают на дыхание и являются приемлемыми.
4. Размещение электродов
- Используйте три игольчатых электрода из нержавеющей стали, хлорид серебра со следующими обозначениями: электрод сравнения, активный электрод и электрод общего заземления.
ПРИМЕЧАНИЕ: Опорный электрод также называется инвертирующим или "-". Активный электрод также называют неинвертирующим или «+». - Поместите каждый электрод подкожно на 2-3 мм в голову, но недостаточно глубоко, чтобы проникнуть в череп. Используйте электроды длиной 7 мм и диаметром 0,4 мм.
- Высуньте электрод из кожи, обнажив наконечник. Это помогает свести к минимуму контакт с кожей и обеспечить постоянную глубину введения у животных34.
ПРИМЕЧАНИЕ: Электродный провод должен иметь достаточную слабину, чтобы после размещения электрода не было натяжения, которое вытянет его или вытянет кожу подтянутой. - Для одноканальной записи поместите активный электрод над черепом на средней линии, так же далеко, как каудальный, как ушной канал.
- Поместите опорный электрод за ухом, куда будет доставлен стимул, и поместите заземляющий электрод за контралатеральным ушным каналом в шее.
ПРИМЕЧАНИЕ: Если вы выполняете операцию на черепе или слуховом проходе животного, поместите опорный электрод в шею на средней линии животного. Как этот, так и шаг 4.4.1 считаются горизонтальными монтажами записи электродов.
- Поместите опорный электрод за ухом, куда будет доставлен стимул, и поместите заземляющий электрод за контралатеральным ушным каналом в шее.
- Для двухканальной записи используйте два отрицательных электрода и комбинированный положительный электрод, для которого требуется кабель-адаптер. Поместите заземляющий электрод в шею и один опорный электрод за каждым ушным каналом.
- Проверьте сопротивление электрода. Убедитесь, что общее сопротивление электрода не превышает 5,0 кОм. Поддерживайте межэлектродное сопротивление ниже 3,0 кОм.
5. Запись ABR
- В зависимости от аппаратного и программного обеспечения для сбора данных обязательно выполните калибровку для правильных уровней звука на используемых частотах стимулов.
ПРИМЕЧАНИЕ: Методы калибровки будут варьироваться в зависимости от оборудования (см. обсуждение). Для некоторых программ затухание звука может быть отредактировано в программном обеспечении. Процедуры калибровки, выполняемые здесь, включали использование 1/8-дюймового конденсаторного микрофона B&K 4138 для записи частотных раздражителей в закрытой системе соединителей, которая приближалась к ушному каналу цыпленка (~ 5 мм). Калибровочный стол для детенышей курицы предоставляется в качестве дополнительной таблицы. - Переместите звуковой преобразователь в сторону активного уха животного. Поместите звуковой преобразователь на небольшую глубину 2 мм в ушной канал.
ПРИМЕЧАНИЕ: В зависимости от звукового преобразователя, пластиковое зеркало может быть прикреплено и вставлено в ушной канал. Расположение зеркал имеет решающее значение. Если звук блокируется стенкой канала или ушной канал защемлен, ABR будут отсутствовать или напоминать сдвиг ~ 40 дБ в пороге. - Проверьте на животном во время тестирования, если результаты выглядят ненормальными или отсутствующими. Если они есть, переместите звуковой преобразователь в ушной канал.
ПРИМЕЧАНИЕ: Поскольку кожа рыхлая и возможно движение животных, расположение зеркал может смещаться во время записи. Однако при правильной инъекции анестетика и животном полностью без сознания запись может идти непрерывно в течение 30-45 мин.
6. Сбор данных
- Используйте достаточное оборудование / программное обеспечение для генерации звуковых стимулов и записи / получения записей ABR.
ПРИМЕЧАНИЕ: Существует множество коммерчески доступных или пользовательских систем для приобретения ABR. Для этих экспериментов была использована коммерчески доступная usb-платформа SmartEP Intelligent Hearing Systems (IHS). Возможность манипулировать параметрами записи имеет решающее значение; к ним относятся, но не ограничиваются ими, интенсивность стимула, длина стимула, частота стимула, скорость представления стимула, фильтр высоких и низких частот, отторжение артефактов, количество разверток, частота выборки, форма оболочки и поляризация стимула. - Установите верхний и нижний пределы отклонения артефактов (AR) на ±25 мкВ, так что движение животного или шум во время развертки исключит эту развертку из анализа. Среди протестированной популяции менее 1% от общего числа зачисток были отклонены из-за артефактов.
- Соберите не менее 1024 разверток, чтобы получить большой усредненный ответ. Это можно сделать в двух записях по 512 разверток в каждой. Это также гарантирует, что реакция вызвана стимулом и повторяется.
- Установите коэффициент усиления на 100 000, фильтр нижних частот на 100 Гц, а фильтр высоких частот на 3000 Гц.
ПРИМЕЧАНИЕ: Настройки фильтра нижних и высоких частот были оптимальными для записи с использованием системы IHS. Поэтому эти параметры являются рекомендациями. Записи ABR у других видов птиц с использованием программного обеспечения BIOSIG фильтровали сигнал между 30 и 3000 Гц 5,13,14,16,22. - Установите скорость представления стимула между 10 и 20 стимулами в секунду. Высокая скорость представления сместит пиковую задержку ABR, особенно для более поздних пиков13. Низкие показатели презентации увеличат время, необходимое для приобретения ABR.
- Установите временную продолжительность стимула щелчка на 100 мкс.
- Если используется стимул тонального всплеска, отредактируйте частоту и продолжительность стимула в зависимости от желаемого эффекта. Диапазон 100-4000 Гц использовался для стимулов тонального всплеска, хотя диапазон поведенческого слуха у взрослых кур колеблется от 2-9000 Гц35.
ПРИМЕЧАНИЕ: В системе IHS время подъема и падения стимула тонального всплеска может быть изменено только в том случае, если форма спектральной оболочки является трапецией. Тем не менее, косинусные квадраты и конверты Блэкмана обеспечивают заданное время подъема и падения, которое обычно используется в экспериментах ABR на животных. Система IHS может отображать спектральную оболочку тонального всплеска, чтобы обеспечить соответствующее время подъема и падения. Время подъема и падения стимула клика не может быть отредактировано в IHS.
- Если используется стимул тонального всплеска, отредактируйте частоту и продолжительность стимула в зависимости от желаемого эффекта. Диапазон 100-4000 Гц использовался для стимулов тонального всплеска, хотя диапазон поведенческого слуха у взрослых кур колеблется от 2-9000 Гц35.
- Установите частоту дискретизации на максимально допустимое значение (обычно 40 кГц) для наилучшего разрешения данных.
ПРИМЕЧАНИЕ: Некоторые системы, включая IHS, используют ограниченное число точек выборки и изменяют длину окна записи. Частота дискретизации 40 кГц (период 25 мкс) может допускать только окно записи 12 мс, поэтому для захвата тонального всплеска ABR использовалась частота дискретизации 20 кГц (период 50 мкс), чтобы обеспечить окно записи 24 мс. При прямом сравнении ABR щелчка и тона, держите частоту дискретизации постоянной, чтобы сохранить то же разрешение. - Установите поляризацию стимула на чередование. Это сделано для исключения визуализации кохлеарной микрофоники из записей ABR. Чтобы визуализировать кохлеарную микрофонию, используйте разрежение или конденсацию для полярности стимула.
ПРИМЕЧАНИЕ: Многие настройки могут быть изменены при выборе стимулов. Параметры усиления и фильтра могут быть неоптимальными для других установок оборудования. Заводские значения по умолчанию на большинстве машин ABR не установлены для записи у детенышей цыплят. - При записи 512 разверток объедините два отдельных теста, чтобы создать среднее значение развертки 1024.
- Для стимуляции щелчка или тонального всплеска приобретите ABR с сверхпороговой интенсивностью.
- Продолжайте запись с все меньшей и меньшей интенсивностью до тех пор, пока вызванная реакция больше не может быть идентифицирована.
- Определите порог АБР как самую низкую интенсивность стимула, которая вызывает обнаруживаемый вызванный ответ. Уменьшите интенсивность стимула с шагом 5 dBSPL, чтобы найти самую низкую интенсивность стимула, которая вызывает обнаруживаемый пик.
7. Эвтаназия и конец эксперимента
- Как только АБР приобретены, приготовьте передозировку (0,1 мл) раствора для эвтаназии (пентобарбитал натрия 390 мг / мл фенитоина натрия 50 мг / мл).
- После использования щипки пальца ноги, чтобы подтвердить, что рефлекса нет, вводят раствор для эвтаназии в мышцу молочной железы иглой 29-G на глубине 5 мм. Техника инъекции такая же, как и инъекция анестетика.
ПРИМЕЧАНИЕ: Срок действия животного истекает через несколько минут. Не манипулируйте и не обезглавливайте животное до тех пор, пока не будет обнаружено никакого движения. Альтернативной техникой эвтаназии является выполнение внутривенной инъекции в плечевую вену под крылом. - Как только животное перестанет рефлексировать и дыхание и сердцебиение прекратятся, быстро обезглавить острыми ножницами или ножницами.
- Очистите грелку, ректальный зонд и электроды из хлорида серебра салфетками с 70% изопропиловым спиртом.
- Убедитесь, что все полученные следы сохранены. Для дальнейшего анализа экспортируйте файлы как .txt файлы, которые можно просмотреть в блокноте или импортировать в электронную таблицу.
Результаты
Репрезентативные записи ABR для птенцов
Следующие репрезентативные и популяционные результаты получены из записей ABR, сделанных у 43 животных. В ответ на надпороговой стимул щелчка (75 dBSPL) у всех птенцов последовательно наблюдались три положительных пика. Эти пики происходили в течение 6 мс после начала стимула. Нечасто четвертый пик также наблюдался при ~6 мс. В то время как идентификация пиков ABR у птиц варьировалась среди животных (см. обсуждение), пики были помечены и идентифицированы как римские числовые волны I-IV. Репрезентативная форма сигнала ABR с мечеными пиками показана на рисунке 1A (верхняя трассировка). На рисунке 1B показана функция задержки-интенсивности для волн I и III, помеченных в репрезентативной трассировке. Пиковая задержка wave I увеличивалась на ~0,3 мс на каждые 20 дБ снижения интенсивности стимула. В среднем волны I-III происходили при 1,50 мс (±0,02 мс), 3,00 мс (±0,06 мс) и 4,13 мс (±0,09 мс) при 75 dBSPL соответственно (рисунок 1C). Волна I и Волна III всегда представлены как единичная вершина. Иногда для Волны II наблюдалось несколько небольших пиков между 2,5-3,2 мс. Каждый пик имел соответствующую впадину, а амплитуда от пика до впадины волны I - самая большая из всех пиков - составляла в среднем 7 мкВ и приближалась к максимальной амплитуде 11 мкВ при 75 дБ SPL.
В дополнение к наибольшей амплитуде, волна I цыпленка ABR представлена с наименьшей изменчивостью пиковой латентности среди животных. Поэтому этот пик был использован для оценки пороговой чувствительности слуха. Пороговые значения ABR были определены как самая низкая интенсивность стимула, которая вызвала идентифицируемый и повторяемый пик формы сигнала. Это было субъективно определено экспериментатором и перепроверено вторым экспериментатором на предмет порогового согласия. Пики были лучше определены и их было легче идентифицировать при использовании стимулов щелчка, но тональные всплески также генерировали определенные и идентифицируемые пики, которые варьировались в зависимости от частоты стимула и его параметров (рисунок 1D, n = 4 цыплят). Порог ABR, вызванный щелчком, был ниже порога тонального всплеска, за исключением 1000 Гц. Пороговые значения варьировались в пределах 10-30 dBSPL для стимулов щелчка. Вызванные щелчками ABR, которые не показывали идентифицируемых пиков >30 dBSPL, часто были результатом того, что зеркало выбивалось из ушного канала из-за движения животных.
Снижение температуры тела увеличивает задержки АБР
Известно, что скорость нейронной активности, измеряемая пиковым возникновением амплитуды формы сигнала (т.е. латентности), уменьшается при более низких температурах тела36,37. Это явление наблюдалось у детенышей цыплят ABR с использованием стимула щелчка 75 dBSPL. Репрезентативная трассировка показана на рисунке 2А. Поскольку температура тела снизилась с 39 ° C, латентность пиков ABR произошла позже во времени, несмотря на тот же уровень интенсивности стимула. На рисунке 2B показана латентность волн I и III как функция более низких температур тела для репрезентативного следа. Наблюдалась сильная корреляция (R2 = 0,89) между более низкими температурами тела и возникновением пиковой задержки волны I (рисунок 2C, n = 5 цыплят). Эти результаты демонстрируют необходимость поддержания почти нормальной температуры тела во время записей ABR. Если почти нормальная температура тела не поддерживается, функции латентности-интенсивности и измерения амплитуды ABR сильно варьируются и часто неточны.
Различия в задержке и амплитуде у ранних птенцов
Исследования показали, что нейронная активность, связанная с началом слуха у цыпленка, близка к созреванию в позднем эмбриональном возрасте8 лет. Однако для подмножества очень ранних детенышей (<3 ч после вылупления) мы наблюдали пиковый сдвиг задержки форм сигналов ABR (n = 4) в ответ на стимул щелчка SPL 75 дБ или вызванные потенциалы не были идентифицированы (n = 2 птенца). У 2 молодых детенышей не было выявлено всплеска тона ABR, а пороги щелчков были повышены на 50 dBSPL. Это может быть связано с проблемой проводимости, когда в ушном канале / полости среднего уха животного все еще есть жидкость, или недоразвитым нервным компонентом. Исследования млекопитающих сообщили о пороговых сдвигах в 50 дБ у новорожденных38,39. Репрезентативным животным, используемым здесь, было >3 ч, что также совпало с продолжительностью времени, необходимого для высыхания перьев. На рисунке 3А показаны ABR, зарегистрированные у молодых (P1, <3 h) и старших детенышей (P2). Для анализа только 3 молодых детеныша представлены со всеми тремя пиками ABR. Пиковые задержки формы сигнала были значительно увеличены, а амплитуды формы сигнала были немного уменьшены по сравнению с более старыми детенышами (рисунок 3B-C, соответственно).
Размещение опорных электродов и двухканальные записи ABR
На рисунке 4 размещение опорного электрода было изменено между 2 различными местами, но все же привело к сопоставимым записям ABR. Сравнение 75 следов щелчка dBSPL у одного и того же животного с двумя опорными электродами показало минимальные различия в амплитудах формы сигнала от пика до впадины и пиковых задержках формы сигнала (рисунок 4A). Размещение сосцевидных узлов было методологически похоже на эксперименты С АБР млекопитающих, которые помещали опорный электрод на сосцевидную или ушную раковину. Использование размещения шеи для опорного электрода было бы полезно, если бы манипуляция или операция были выполнены на любом ухе. Интересно, что пиковая амплитуда волны II для размещения сосцевидной части (красный след) произошла через 1 мс после пика волны II для размещения шеи (черный след). Эта разница во времени, вероятно, отражает участок (участки) нейронной генерации ABR относительно размещения электрода.
Используя двухканальную установку, один активный записывающий электрод (верхнее расположение головы) и два опорных электрода (сосцевидные размещения) использовались для получения ABR как для левого, так и для правого ушей (рисунок 4B). Ответы между двумя ушами были похожими, с незначительными изменениями пиковых амплитуд, вероятно, из-за позиционирования наушников. Латентность как левого, так и правого уха, будучи эквивалентной, поддерживала одинаково здоровую функцию как ушей, так и полушарий ствола мозга у детенышей курицы. Двухканальный монтаж записи может быть использован и для бинауральных АВР, но для этих записей потребуются дополнительные соображения.

Рисунок 1: Репрезентативные записи птенцов в отношении стимулов, вызванных щелчком и тоном. (A) Репрезентативные записи ABR от птенца (P2) в зависимости от различных уровней интенсивности стимула. Три-четыре положительных пика в микровольтах (мкВ) могут быть идентифицированы в течение 6 мс после начала стимула (время = 0 мс). Волны были идентифицированы с использованием римских цифр. Амплитуды от пика до впадины уменьшаются при более низких уровнях интенсивности стимула. (B) Функции задержки-интенсивности волн I и III для репрезентативного следа, показанного в (A). Были проанализированы только эти пики, так как волна II обычно не наблюдалась при интенсивностях <45 dBSPL. (C) Задержка пиковых сигналов ABR, вызванных щелчком (n = 43 цыплят). Полосы ошибок обозначают стандартную погрешность среднего значения (SEM). (D) Усредненные тональные АБР (черные следы) для четырех детенышей птенцов на трех различных частотах. Красные следы = стандартная погрешность средних (SEM) стимулов = 75 dBSPL. На этом и последующих рисунках полосы ошибок обозначают SEM, а правое ухо было стимулирующим ухом. (исключение для рисунка 4B , где стимулировались оба уха). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Влияние температуры тела на записи ABR. (A) Репрезентативные записи ABR от птенца (P2) в зависимости от температуры тела. Для более низких температур тела пиковые задержки формы сигнала увеличились, в то время как амплитуды от пика до впадины остались относительно неизменными. (B) Латентно-температурная функция волн I и III для репрезентативных следов, показанных в пункте (A). (C) Популяционные данные, показывающие взаимосвязь между задержкой и изменениями температуры для 5 цыплят (p < 0,01,R2 = 0,89). Аналогичная тенденция наблюдалась для волн II и III (данные не показаны). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
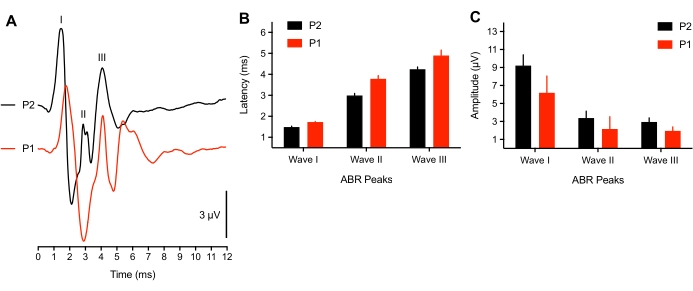
Рисунок 3: Возрастные различия на записях ABR. (A) Репрезентативные записи ABR (перекрывающиеся) репрезентативного птенца детеныша при P2 (черный след) и P1 (<3 ч после вылупления, красный след). (B) Пиковые задержки формы сигнала для волн I, II и III в зависимости от возраста. Задержки для волн I-III значительно различались между возрастами (P < 0,05, n = 6 птенцов). (C) Амплитуды волн от пика до впадины волн I, II и III в зависимости от возраста. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
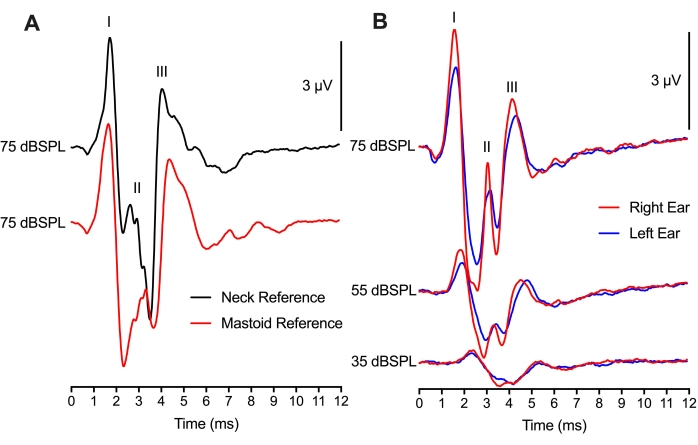
Рисунок 4: Размещение электродов и двухканальные записи ABR: (A) Репрезентативные записи ABR (перекрывающиеся) от одного и того же птенца (P2) с опорным электродом, помещенным в шею (черный след) или сосцевидный (красный след). Активный электрод был помещен на среднюю линию черепа для обоих монтажей записи электрода. Латентность волн I и III, амплитуда волн I и III почти идентичны в обоих условиях. Латентность Wave II раньше, а амплитуда больше для электрода, помещенного в ткань шеи. (B) Двухканальная запись при последовательной стимуляции правого и левого ушей. Репрезентативные записи ABR (перекрывающиеся) одного и того же птенца (P2) с опорными электродами, помещенными в сосце левого уха (синие следы) и правого уха (красные следы) на трех различных уровнях интенсивности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительная таблица: Калибровочный стол для детенышей курицы. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Слуховой ствол мозга птиц хорошо изучен, и многие структуры аналогичны слуховому пути млекопитающих. Слуховой нерв обеспечивает возбуждающие входы в два центральных ядра первого порядка, кохлеарное ядро magnocellularis (NM) и angularis (NA). NM посылает возбуждающую проекцию двусторонне к своей слуховой мишени, ядру laminaris (NL)7. NL проецируется на ядро mesencephalicus lateralis, pars dorsalis (MLd)40,41. NL также проецируется на верхнее оливковое ядро (SON), которое обеспечивает ингибирование обратной связи с NM, NA и NL42. Эта нижняя слуховая микросхема ствола мозга изысканно сохранена для функции, которую она выполняет, локализации звука и бинаурального слуха33. Верхние слуховые области ствола мозга птицы также имеют ядра, аналогичные латеральному лемнискусу млекопитающих и нижнему колликулусу в среднем мозге. Учитывая эти сходства, состав птичьего АБР вплоть до слухового среднего мозга сопоставим у всех позвоночных.
В то время как несколько видов птиц показывают три положительных пика в течение 6 мс после начала стимула, корреляция пиков ABR с центральными слуховыми структурами имеет некоторую изменчивость. Волна I может быть разумно принята как первая нейронная реакция от периферического базилярного сосочка и слухового нерва и демонстрирует небольшую вариабельность среди людей (рисунок 1C). Последующая идентификация волн менее определенна и может отличаться между видами. Kuokkanen et al.17 недавно определили, что ВОЛНА III АБР амбарной совы генерируется NL; таким образом, разумно утверждать, что волна II происходит от NM и NA кохлеарного ядра20. Тем не менее, волна совы III была определена как положительный пик, генерируемый через 3 мс после начала стимула. Это соответствует Волне II, как определено в детеныше курицы ABR. В сарае совы АБР объединились волны I и II.
В то время как птенец обычно имел три пика в течение 6 мс, иногда наблюдался четвертый пик (например, см. Рисунок 1А). Популяционные данные, больший размер выборки и дополнительные экспериментальные парадигмы потребуются для поддержки четвертой волны, а в некоторых случаях и пятиволнового куриного ABR. Наиболее последовательным выводом были три пиковых представления, показанные здесь.
Поскольку ABR определяется как мера нейронной синхронности, основные ядра в слуховом пути могут представлять каждый положительный пик в ABR. Сигнал, проходящий от слухового нерва к NM/NA, а затем к NL, может определять волны I, II и III у детенышей цыплят ABR, соответственно. Кроме того, более поздний четвертый пик куриного ABR может представлять собой верхний ствол мозга или слуховую структуру среднего мозга. При характеристике птичьих АБР следует также учитывать разницу между предкоциальными и альтрициальными птицами. Созревание слуховых реакций будет варьироваться в зависимости от вида, а также зависит от других критических черт, таких как поведение хищника и / или вокальное обучение4. Несмотря на это, описанные методы и приемы легко применяются к различным видам птиц и позвоночных.
Важность поддержания температуры тела животных проиллюстрирована на рисунке 2. По мере снижения внутренней температуры тела латентность реакций ABR увеличивалась при том же уровне интенсивности стимула. Это более выражено, когда температура тела опускается ниже 32 °C36,37. Увеличение задержки ABR примерно на 1 мс меньше, чем сообщалось ранее у курицы23. Тем не менее, Katayama23 использовала 12-дневный детеныш, который охлаждался и впоследствии нагревался в течение 4 часов. Данные на рисунке 2 были записаны в процессе охлаждения в течение 20-минутного периода. Чтобы получить наилучшее качество и наиболее последовательные записи, температура тела животного должна поддерживаться, и все записи должны быть сделаны при одинаковой физиологической температуре среди животных.
Влияние возраста на АБР незначительно, но важно учитывать. Хотя только латентность волн I и II ABR значительно отличалась, это отчасти потому, что на рисунке 3 было использовано только три молодых детеныша; остальные три не имели трех идентифицируемых пиков АБР. Амплитудные и пороговые сдвиги ABR также могут быть очевидны при использовании больших размеров выборки или сравнении частотно-специфических ABR. Этот возрастной эффект может быть вызван жидкостью в среднем ухе курицы. Такие проводящие изменения приводят к заметному увеличению пороговых значений АБР как для модели человека, так и для моделей других млекопитающих38,39.
Используя два разных монтажа записи, наблюдались аналогичные ответы (рисунок 4A). В то время как наиболее распространенный монтаж помещает опорный электрод за ухом, принимающим стимул, наличие опорного электрода в ткани шеи может быть полезным, если есть хирургическое вмешательство, сопровождающее ABR. Однако, если используются двухканальные записи ABR, опорные электроды должны быть отдельно и симметрично размещены, что затруднительно при размещении опорного электрода в горловине. Сосцевидное положение электрода эталонного образца рекомендуется стандартизировать как можно больше аспектов записи. Двухканальная запись ABR является эффективным инструментом, требующим небольшой дополнительной подготовки и приводящим к аналогичным реакциям между ушами. Незначительные различия в амплитуде, вероятно, были связаны с позиционированием наушников. Двухканальная запись позволяет легко сравнивать экспериментально управляемое ухо или полушарие мозга с контролем. Эта настройка также потребуется для тестирования бинауральных АБР. Будущие эксперименты с использованием куриного ABR могут ссылаться на предыдущую литературу по записи конфигураций и монтажей34.
Эта методология имеет несколько ограничений. Как упоминалось в шаге 5.1, плохое расположение зеркал может привести к сдвигу в ответе на 40 dBSPL. Это может привести к неправильной интерпретации манипулируемого или модифицированного животного. Рекомендуются следующие меры предосторожности: получить большую выборку контрольных данных перед получением ABR манипулируемых или мутантных моделей. Не снижайте интенсивность стимула более чем на 20 дБСПЛ между записями. Если амплитуда или задержка смещается больше, чем ожидалось, проверьте положение животного и зеркала. Повторите этот стимул ABR, чтобы наблюдать изменения. Если зеркало переместилось, повторно приобретите предыдущие тесты. Другим ограничением является калибровка ABR. Без надлежащей калибровки для записи уровня звукового давления интенсивность, представленная животному, неизвестна. При измерении звука используйте то же зеркало, что и в экспериментальной записи, и небольшой микрофон внутри полости, которая приближается к длине ушного канала животного (~ 5 мм). Измеряйте те же частоты тона, которые использовались в экспериментах, так как калибровки зависят от частоты. Руководство как для аппаратных, так и для программных систем может сопровождаться инструкциями по калибровке. Существуют также дополнительные фильтры, такие как линейные фазовые и минимальные фазовые фильтры, которые могут улучшить щелчок и тональный всплеск ABR43. Эти фильтры не использовались в настоящем исследовании. Дополнительные соображения, такие как время подъема и падения спектральной оболочки тонального всплеска, изменяющейся в зависимости от частоты или изменяющей время подъема и падения стимулов щелчка, также не рассматривались. Это хорошие будущие исследования, как только можно будет получить надежные и последовательные АБР.
Сравнение птенца с другими птичьими моделями является многообещающим. Волнистые попугайчики и восточные визгливые совы также демонстрируют три положительных пика микровольта в течение первых 6 мс от ABR13,22. У разных видов дятлов также наблюдаются три пика, но их латентность позже по времени. Кроме того, диапазон лучшей частотной чувствительности у дятлов составляет от 1500 до 4000 Гц, что несколько выше, чем лучший порог курицы при 1000 Гц. У взрослой курицы наилучшая чувствительность составляет 2000 Гц35, поэтому может быть улучшен слух высоких частот по мере того, как детеныши курицы превращаются во взрослых особей. Это развитие будет различаться среди видов птиц, принимая во внимание альтрициальное или преждевременное развитие животного4.
Экспериментальные методы, изложенные здесь, могут помочь определить, какие факторы приводят к повреждениям или изменениям слуховых реакций и порогов, а также исследования на разных стадиях эмбрионального развития. Генетические манипуляции, старение и воздействие шума — все это известные манипуляции у животных и другихмоделей птиц 24,25,44,45. Эти методы должны быть распространены на модель курицы теперь, когда такие методы, как электропорация in-ovo, позволяют экспрессировать белки, которые фокально и временно контролируются на одной стороне слухового ствола мозга12,46. Это позволяет напрямую сравнивать АБР от генетически манипулируемого уха с контралатеральным контрольным ухом с использованием двухканальной парадигмы записи.
В целом, ABR птенцов является полезным методом исследования, почти идентичным показателям слуховой функции в моделях человека и других млекопитающих. Это также неинвазивная методология in vivo . Кроме инъекции анестетика и размещения подкожного электрода на несколько миллиметров, никаких других физических манипуляций не требуется. Детеныш теоретически может быть протестирован несколько раз в течение времени развития в течение нескольких дней или недель, если его содержать в соответствующей среде. Этот протокол не только излагает необходимые шаги и параметры записи для ABR птенца, но и предлагает характеристики птичьего ABR, которые могут информировать о дальнейшем тестировании слуховой функции ствола мозга.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа поддерживается NIH/NIDCD R01 DC017167
Материалы
| Name | Company | Catalog Number | Comments |
| 1/8 inch B&K Microphone | Brüel & Kjær | 4138 | Type 4138-A-015 also works |
| Auditory Evoked Potential Universal Smart Box | Intelligent Hearing Systems | M011110 | |
| Custom Sound Isolation Chamber | GK Soundbooth Inc | N/A | Custom built |
| DC Power Supply | CSI/Speco | PSV-5 | |
| ER3 Insert Earphone | Intelligent Hearing Systems | M015302 | Used as sound transducer |
| Euthasol | Virbac | 710101 | Controlled Substance; euthanasia solution |
| Insulin Syringe (29 G) | Comfort Point | 26028 | |
| Ketamine | Covetrus | 11695-0703-1 | Controlled Substance |
| Power Supply | Powervar | 93051-55R | |
| Rectal Probe | YSI | 401 (10-09010) | Any 400 series probe will work with the YSI temperatuer monitor |
| Subdermal needles | Rhythmlink | RLSND107-1.5 | |
| Temperature Monitor | YSI | 73ATA 7651 | Works with any 400 series rectal probe |
| Xylazine | Anased | 59399-110-20 | Used with ketamine and water for anesthetic |
Ссылки
- Wever, E. G., Bray, C. W. Action currents in the auditory nerve in response to acoustical stimulation. Proceedings of the National Academy of Sciences of the United States of America. 16 (5), 344-350 (1930).
- Jewett, D. L., Williston, J. S. Auditory-evoked far fields averaged from the scalp of humans. Brain. 94 (4), 681-696 (1971).
- Corwin, J. T., Bullock, T. H., Schweitzer, J. The auditory brain stem response in five vertebrate classes. Electroencephalography and Clinical Neurophysiology. 54 (6), 629-641 (1982).
- Carey, C. Avian Growth and Development. Evolution within the Altricial Precocial Spectrum. , Oxford University Press. Oxford. (1998).
- Kraemer, A., Baxter, C., Hendrix, A., Carr, C. E. Development of auditory sensitivity in the barn owl. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 203 (10), 843-853 (2017).
- Rebillard, G., Rubel, E. W. Electrophysiological study of the maturation of auditory responses from the inner ear of the chick. Brain Research. 229 (1), 15-23 (1981).
- Parks, T. N., Rubel, E. W. Organization and development of brain stem auditory nuclei of the chicken: organization of projections from n. magnocellularis to n. laminaris. Journal of Comparative Neurology. 164 (4), 435-448 (1975).
- Hong, H., Rollman, L., Feinstein, B., Sanchez, J. T. Developmental profile of ion channel specializations in the avian nucleus magnocellularis. Frontiers in Cellular Neuroscience. 10, 80(2016).
- Leao, R. M. The ion channels and synapses responsible for the physiological diversity of mammalian lower brainstem auditory neurons. Hearing Research. 376, 33-46 (2019).
- Oline, S. N., Ashida, G., Burger, R. M. Tonotopic optimization for temporal processing in the cochlear nucleus. Journal of Neuroscience. 36 (32), 8500-8515 (2016).
- Kopp-Scheinpflug, C. Your genes decide what you are listening to. Channels. 11 (5), 355-356 (2017).
- Sid, H., Schusser, B. Applications of gene editing in chickens: A new era is on the horizon. Frontiers in Genetics. 9, 456(2018).
- Brittan-Powell, E. F., Dooling, R. J., Gleich, O. Auditory brainstem responses in adult budgerigars (Melopsittacus undulatus). The Journal of the Acoustical Society of America. 112 (3), Pt 1 999-1008 (2002).
- Lohr, B., Brittan-Powell, E. F., Dooling, R. J. Auditory brainstem responses and auditory thresholds in woodpeckers. The Journal of the Acoustical Society of America. 133 (1), 337-342 (2013).
- Counter, S. A. Brain-stem evoked potentials and noise effects in seagulls. Comparative Biochemistry and Physiology. A, Comparative Physiology. 81 (4), 837-845 (1985).
- Crowell, S. E., et al. A comparison of auditory brainstem responses across diving bird species. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 201 (8), 803-815 (2015).
- Noirot, I. C., Brittan-Powell, E. F., Dooling, R. J. Masked auditory thresholds in three species of birds, as measured by the auditory brainstem response (L). Journal of the Acoustical Society of America. 129 (6), 3445-3448 (2011).
- McGee, J., et al. Auditory performance in bald eagles and red-tailed hawks: a comparative study of hearing in diurnal raptors. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 205 (6), 793-811 (2019).
- Brittan-Powell, E. F., Dooling, R. J., Ryals, B., Gleich, O. Electrophysiological and morphological development of the inner ear in Belgian Waterslager canaries. Hearing Research. 269 (1-2), 56-69 (2010).
- Kuokkanen, P. T., Kraemer, A., Kempter, R., Koppl, C., Carr, C. E. Auditory brainstem response wave iii is correlated with extracellular field potentials from nucleus laminaris of the barn owl. Acta Acustica United with Acustica. The Journal of the European Acoustics Association (EEIG). 104 (5), 874-877 (2018).
- Beatini, J. R., Proudfoot, G. A., Gall, M. D. Frequency sensitivity in Northern saw-whet owls (Aegolius acadicus). Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 204 (2), 145-154 (2018).
- Brittan-Powell, E. F., Lohr, B., Hahn, D. C., Dooling, R. J. Auditory brainstem responses in the Eastern Screech Owl: an estimate of auditory thresholds. The Journal of the Acoustical Society of America. 118 (1), 314-321 (2005).
- Katayama, A. Postnatal development of auditory function in the chicken revealed by auditory brainstem responses (ABRs). Electroencephalography and Clinical Neurophysiology. 62 (5), 388-398 (1985).
- Durham, D., Park, D. L., Girod, D. A. Breed differences in cochlear integrity in adult, commercially raised chickens. Hearing Research. 166 (1-2), 82-95 (2002).
- Kaiser, C. L., Girod, D. A., Durham, D. Breed-dependent susceptibility to acute sound exposure in young chickens. Hearing Research. 203 (1-2), 101-111 (2005).
- Hamdy, A. M., Vander Hel, W., Henken, A. M., Galal, A. G., Abd-Elmoty, A. K. Effects of air humidity during incubation and age after hatch on heat tolerance of neonatal male and female chicks. Poultry Science. 70 (7), 1499-1506 (1991).
- Bruzual, J. J., Peak, S. D., Brake, J., Peebles, E. D. Effects of relative humidity during the last five days of incubation and brooding temperature on performance of broiler chicks from young broiler breeders. Poultry Science. 79 (10), 1385-1391 (2000).
- vander Pol, C. W., van Roovert-Reijrink, I. A. M., Maatjens, C. M., vanden Brand, H., Molenaar, R. Effect of relative humidity during incubation at a set eggshell temperature and brooding temperature posthatch on embryonic mortality and chick quality. Poultry Science. 92 (8), 2145-2155 (2013).
- Buhr, R. J. Incubation relative humidity effects on allantoic fluid volume and hatchability. Poultry Science. 74 (5), 874-884 (1995).
- Galli, R., et al. Sexing of chicken eggs by fluorescence and Raman spectroscopy through the shell membrane. PLoS One. 13 (2), 0192554(2018).
- Otsuka, M., Miyashita, O., Shibata, M., Sato, F., Naito, M. A novel method for sexing day-old chicks using endoscope system. Poultry Science. 95 (11), 2685-2689 (2016).
- Kaiser, A. The ontogeny of homeothermic regulation in post-hatching chicks: its influence on the development of hearing. Comparative Biochemistry and Physiology. A, Comparative Physiology. 103 (1), 105-111 (1992).
- Kuba, H., Yamada, R., Ohmori, H. Evaluation of the limiting acuity of coincidence detection in nucleus laminaris of the chicken. The Journal of Physiology. 552, Pt 2 611-620 (2003).
- Shaheen, L. A., Valero, M. D., Liberman, M. C. Towards a diagnosis of cochlear neuropathy with envelope following responses. Journal of the Association for Research in Otolaryngology. 16 (6), 727-745 (2015).
- Hill, E. M., Koay, G., Heffner, R. S., Heffner, H. E. Audiogram of the chicken (Gallus gallus domesticus) from 2 Hz to 9 kHz. Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 200 (10), 863-870 (2014).
- Rossi, G. T., Britt, R. H. Effects of hypothermia on the cat brainstem auditory evoked response. Electroencephalography and Clinical Neurophysiology. 57 (2), 143-155 (1984).
- Doyle, W. J., Fria, T. J. The effects of hypothermia on the latencies of the auditory brainstem response (ABR) in the rhesus monkey. Electroencephalography and Clinical Neurophysiology. 60 (3), 258-266 (1985).
- Guan, X., Gan, R. Z. Effect of middle ear fluid on sound transmission and auditory brainstem response in guinea pigs. Hearing Research. 277 (1-2), 96-106 (2011).
- Ravicz, M. E., Rosowski, J. J., Merchant, S. N. Mechanisms of hearing loss resulting from middle-ear fluid. Hearing Research. 195 (1-2), 103-130 (2004).
- Wang, Y., Zorio, D. A. R., Karten, H. J. Heterogeneous organization and connectivity of the chicken auditory thalamus (Gallus gallus). Journal of Comparative Neurology. 525 (14), 3044-3071 (2017).
- Wang, Y., Karten, H. J. Three subdivisions of the auditory midbrain in chicks (Gallus gallus) identified by their afferent and commissural projections. Journal of Comparative Neurology. 518 (8), 1199-1219 (2010).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. Journal of Neuroscience. 30 (36), 12075-12083 (2010).
- Beutelmann, R., Laumen, G., Tollin, D., Klump, G. M. Amplitude and phase equalization of stimuli for click evoked auditory brainstem responses. The Journal of the Acoustical Society of America. 137 (1), 71-77 (2015).
- Liberman, M. C. Noise-induced and age-related hearing loss: new perspectives and potential therapies. F1000Research. 6, 927(2017).
- Efrati, A., Gutfreund, Y. Early life exposure to noise alters the representation of auditory localization cues in the auditory space map of the barn owl. Journal of Neurophysiology. 105 (5), 2522-2535 (2011).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments: JoVE. (124), e55628(2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены