Method Article
Evaluación de la respuesta auditiva del tronco encefálico en crías de pollo
En este artículo
Resumen
Hemos utilizado técnicas estándar de respuesta auditiva del tronco encefálico (ABR) y las hemos aplicado a pollos lactantes, un modelo aviar precoz para la función auditiva. El protocolo describe en detalle las técnicas de preparación animal y adquisición de ABR, con pasos que podrían traducirse a otros modelos de aves o roedores.
Resumen
La respuesta auditiva del tronco encefálico (ABR) es un ensayo invaluable en audiología clínica, animales no humanos e investigación humana. A pesar del uso generalizado de ABRs en la medición de la sincronía neuronal auditiva y la estimación de la sensibilidad auditiva en otros sistemas modelo de vertebrados, los métodos para registrar ABRs en el pollo no se han reportado en casi cuatro décadas. Los pollos proporcionan un modelo robusto de investigación en animales porque su sistema auditivo está cerca de la maduración funcional durante las etapas embrionarias tardías y tempranas de la cría. Hemos demostrado métodos utilizados para obtener registros ABR de uno o dos canales utilizando matrices de electrodos de aguja subdérmica en crías de pollo. Independientemente de la configuración de grabación de electrodos (es decir, el montaje), las grabaciones ABR incluyeron 3-4 formas de onda de pico positivas dentro de los primeros 6 ms de un estímulo de clic supratenso. Las amplitudes de la forma de onda de pico a valle oscilaron entre 2 y 11 μV a niveles de alta intensidad, con picos positivos que exhibieron funciones de intensidad de latencia esperadas (es decir, aumento de la latencia en función de la disminución de la intensidad). La posición estandarizada de los auriculares fue fundamental para las grabaciones óptimas, ya que la piel suelta puede ocluir el canal auditivo y el movimiento de los animales puede desalojar el transductor de estímulo. Las amplitudes máximas fueron más pequeñas y las latencias fueron más largas a medida que la temperatura corporal de los animales disminuyó, lo que respalda la necesidad de mantener la temperatura corporal fisiológica. Para las crías jóvenes (<3 h después del día 1 de la eclosión), los umbrales se elevaron en ~ 5 dB, las latencias máximas aumentaron ~ 1-2 ms y las amplitudes de pico a valle disminuyeron ~ 1 μV en comparación con las crías más viejas. Esto sugiere un posible problema relacionado con el conductivo (es decir, líquido en la cavidad del oído medio) y debe considerarse para las crías jóvenes. En general, los métodos ABR descritos aquí permiten un registro preciso y reproducible de la función auditiva in vivo en crías de pollo que podría aplicarse a diferentes etapas de desarrollo. Tales hallazgos se comparan fácilmente con modelos humanos y mamíferos de pérdida auditiva, envejecimiento u otras manipulaciones relacionadas con la audición.
Introducción
El estudio de las respuestas neuronales evocadas a los estímulos sonoros se remonta a más de medio siglo1. La respuesta auditiva del tronco encefálico (ABR) es un potencial evocado que se ha utilizado como una medida de la función auditiva tanto en animales no humanos como en humanos durante décadas. El ABR humano presenta de cinco a siete picos de forma de onda etiquetados convencionalmente por números romanos (I-VII)2. Estos picos se analizan en función de su latencia (tiempo de ocurrencia en milisegundos) y amplitud (tamaño de pico a valle en microvoltios) de las respuestas neuronales. El ABR es fundamental para evaluar la función y la integridad del nervio auditivo, así como la sensibilidad del tronco encefálico y del umbral auditivo. Los déficits en el sistema auditivo resultan en latencias y amplitudes ABR ausentes, reducidas, prolongadas o anormales. Sorprendentemente, estos parámetros son casi idénticos en humanos y otros animales, lo que lo convierte en una prueba objetiva consistente de la función auditiva en todos los modelos de vertebrados3.
Uno de estos sistemas modelo es el pollo, y es especialmente útil por una variedad de razones. Las aves se pueden clasificar como altriciales o precociales4. Las aves altriciales eclosionan con los sentidos aún en desarrollo; por ejemplo, las lechuzas no muestran un ABR consistente hasta cuatro días después de la eclosión5. Animales precoces como el pollo eclosionan con sentidos casi maduros. El inicio de la audición se produce en el desarrollo embrionario, de tal manera que días antes de la eclosión (día embrionario 21), el sistema auditivo está cerca de la maduración funcional 6,7,8. Las aves altriciales y la mayoría de los modelos de mamíferos son susceptibles a factores extrínsecos que influyen en el desarrollo y requieren la cría de animales hasta que la audición esté madura. Los ABR de pollo se pueden realizar el mismo día de la eclosión, renunciando a la necesidad de alimentación o a un ambiente enriquecido.
El pollo embrionario ha sido un modelo bien estudiado para la fisiología y el desarrollo, especialmente en el tronco encefálico auditivo. Las estructuras específicas incluyen el núcleo coclear del pollo, dividido en núcleo magnocellularis (NM) y núcleo angularis (NA), y el correlato aviar de la aceituna superior medial conocido como núcleo laminaris (NL)6,7. El ABR es ideal para centrarse en la función auditiva central antes del nivel del cerebro anterior y la corteza. La traducción entre las mediciones de ABR in vivo y los estudios neuronales in vitro del desarrollo8, fisiología9, tonotopía10 y genética11,12 proporciona oportunidades de investigación ideales que respaldan los estudios de la función auditiva general.
Aunque el ABR ha sido ampliamente estudiado en modelos de mamíferos, ha habido menos enfoque para las aves. Los estudios previos de ABR aviar incluyen caracterizaciones del periquito13, pájaro carpintero 14, gaviota15, aves buceadoras16, pinzón cebra17, rapaces diurnas18, canario19, tres especies de búho 5,20,21,22 y pollo23. Dadas las casi cuatro décadas transcurridas desde la última caracterización exhaustiva del pollo ABR, muchos de los equipos y técnicas utilizados anteriormente han cambiado. Los conocimientos de estudios en otros modelos aviares pueden ayudar a desarrollar la metodología MODERNA de ABR de pollo al tiempo que sirven como una comparación con el ABR de pollo. Este documento describirá la configuración y el diseño experimentales para permitir el registro de ABR en pollos recién nacidos que también podría aplicarse a las etapas embrionarias de desarrollo y otros modelos de roedores pequeños y aves. Además, dado el desarrollo precoz del pollo, las manipulaciones del desarrollo se pueden realizar sin ninguna cría extensa de animales. Las manipulaciones a un embrión en desarrollo se pueden evaluar solo unas pocas horas después de que el animal eclosiona con capacidades auditivas casi maduras.
Protocolo
Los experimentos descritos aquí fueron aprobados por los Comités Institucionales de Cuidado y Uso de Animales (IACUC) de la Universidad Northwestern y se llevaron a cabo de acuerdo con la Guía de los Institutos Nacionales de Salud para el Cuidado y Uso de Animales de Laboratorio.
1. Cría de pollos
- Adquirir huevos de gallina de leghorn blanco fertilizados.
NOTA: Hay varias razas de pollos utilizadas en la investigación científica, pero los resultados que se muestran aquí son de pollo cuerno de pata blanca (Gallus gallus domesticus). Si bien se desconoce la variabilidad de ABR entre razas, se han encontrado algunas diferencias al comparar pollos adultos que ponen huevos con pollos de engorde productores de carne24,25. - Incubar los huevos a 38 °C, humedad al 50%, durante 21 días antes de la fecha de prueba deseada.
NOTA: Si los huevos no se incuban inmediatamente a 38 °C, se pueden almacenar a 14 °C, la humedad al 40%. Sin embargo, cuanto más tiempo se mantengan los huevos a 14 ° C, menos probable es que se conviertan en crías viables. Después de 7 días, la viabilidad del huevo puede caer hasta un 50% dependiendo de cuánto tiempo se mantengan los huevos a 14 ° C. La viabilidad de los huevos también disminuirá en los meses de invierno. - Gire periódicamente los huevos 2-3 veces al día. La mayoría de las incubadoras tienen un mecanismo para realizar esto automáticamente.
- Si utiliza una incubadora de espuma de poliestireno o una incubadora que contenga más de 6 huevos, transfiera los huevos a una incubadora pequeña de 38 °C el día antes de la eclosión, día embrionario 20 (E20). Los huevos deben eclosionar 21 días (E21) después de ser colocados en la incubadora.
NOTA: En el proceso de eclosión, el animal comenzará a "picar" el huevo, haciendo un pequeño agujero que eventualmente rodea todo el huevo. Si las condiciones son demasiado secas, el huevo puede secarse y el animal no podrá eclosionar. La humedad debe mantenerse en torno al 50%, en base a estudios previos sobre la viabilidad de la eclosión de huevos 26,27,28,29. - Determinar la edad del animal. Si la eclosión no se observa en persona, la única indicación de la edad son las 2-3 h que tarda el líquido amniótico en secarse.
NOTA: La incubadora de crías debe limpiarse a fondo diariamente con alcohol isopropílico al 70% en función de la cantidad de crías que se procesan. Las crías de pollo a menudo dejan excrementos, plumas y líquido amniótico en la incubadora, lo que puede contaminar las condiciones y la calidad del aire.
2. Preparación de medicamentos
- Pesa al animal colocándolo en un bote de pesaje grande. Con una colocación lo suficientemente suave, el animal no debe moverse.
NOTA: La masa puede variar de 30-45 g. Los animales más jóvenes a menudo son más pesados debido a las reservas de yema y aún no excretan desechos. Los animales mayores que se acercan a las 24 h de edad y P2 suelen pesar menos. - Prepare un cóctel anestésico de ketamina (100 mg/ml) y xilazina (20 mg/ml) de tal manera que la dosis sea de 50 mg/kg de ketamina y 16,68 mg/kg de xilazina en función del peso animal.
NOTA: Este cóctel de medicamentos se puede hacer con 1 ml de ketamina (100 mg / ml), 1.5 ml de xilazina (20 mg / ml) y 2.5 ml de H2O. Las inyecciones de cóctel anestésico oscilarán entre 0.05-0.1 ml según el rango de 30-45 g en peso animal.
3. Inyección de drogas y preparación animal
- Sostenga al animal en una mano, asegurándose de sostener las patas hacia abajo.
- Siente por el esternón del animal, la quilla. A cada lado de la quilla estará el músculo mamario.
- Use una aguja y una jeringa de 29 G para penetrar 5 mm en la piel e inyecte el cóctel de ketamina / xilazina en el músculo mamario. Inyecte entre 0.05-0.1 ml según el peso del animal.
- Coloque al animal de nuevo en la incubadora después de la inyección. Mantenga la temperatura corporal del animal durante unos minutos a medida que el anestésico hace efecto.
- Use fórceps para pellizcar el dedo del pie del animal y verifique si el cuello está cojeando. Si no hay reflejo y un cuello flácido, el animal está inconsciente.
- Determine el sexo del pollo usando sus plumas de ala. Si las plumas son todas de la misma longitud, el animal es macho. Si las plumas varían en longitud, el animal es hembra30.
NOTA: Otro método de sexado del animal es la ventilación. Los genitales masculinos se pueden ver en la cloaca31. Este método es muy difícil y puede dañar al animal si no se hace correctamente. Se recomienda utilizar el método de plumas de ala. - Aplique crema depilatoria con un aplicador de punta de algodón en el área de la cabeza y el cuello, especialmente cerca de la abertura de la oreja para el ave.
- Use toallitas de alcohol isopropílico al 70% para limpiar las plumas, cualquier crema depilatoria restante y la piel de la cabeza y el cuello.
- Use una toallita de alcohol isopropílico al 70% para esterilizar los electrodos subdérmicos y la sonda rectal.
- Coloque al animal en una cámara de aislamiento acústico y blindada eléctricamente. Asegúrese de que el entorno tenga un ruido eléctrico y acústico mínimo para obtener las mejores grabaciones.
NOTA: Los experimentos aquí se realizaron en un gabinete aislado de sonido personalizado que mide 24 x 24 x 25 pulgadas. Cualquier cámara o habitación que elimine el ruido acústico, así como el ruido eléctrico de la corriente eléctrica alterna (60 Hz en los Estados Unidos), es suficiente. - Use una almohadilla térmica o un sistema de control de temperatura para mantener la temperatura corporal del animal.
- Inserte la sonda rectal lubricada para asegurarse de que la temperatura del animal se mantenga entre 37-41 °C (98.6-105 °F)32,33.
NOTA: Si la sonda tiene un tamaño incorrecto, el animal puede colocarse encima de la sonda de temperatura. - Fije la cabeza del animal en su lugar o apoye el pico contra un objeto para evitar movimientos no deseados. Esto se puede hacer con arcilla de modelado si la respiración no está obstruida.
- Administre una inyección suplementaria de cóctel anestésico que sea la mitad de la dosis original si el animal comienza a recuperar la conciencia durante la prueba.
NOTA: Cualquier movimiento corporal o vocalización es una señal de que se debe administrar una dosis de suplemento. Los movimientos minúsculos del pico indican respiración y son aceptables.
4. Colocación del electrodo
- Utilice tres electrodos de aguja de cloruro de plata de acero inoxidable con las siguientes designaciones: el electrodo de referencia, el electrodo activo y el electrodo de tierra común.
NOTA: El electrodo de referencia también se conoce como inversión o "-". El electrodo activo también se conoce como no inversor o "+". - Coloque cada electrodo subdérmicamente 2-3 mm en la cabeza, pero no lo suficientemente profundo como para penetrar en el cráneo. Utilice electrodos de 7 mm de longitud y 0,4 mm de diámetro.
- Saque el electrodo de la piel, exponiendo la punta. Esto ayuda a minimizar el contacto con la piel y garantizar una profundidad de inserción constante en los animales34.
NOTA: El cable del electrodo debe tener suficiente holgura para que después de colocar el electrodo, no haya tensión que lo saque o tire de la piel tensa. - Para la grabación de un solo canal, coloque el electrodo activo sobre el cráneo en la línea media, hasta el canal auditivo.
- Coloque el electrodo de referencia detrás de la oreja donde se entregará el estímulo y coloque el electrodo de tierra detrás del canal auditivo contralateral en el cuello.
NOTA: Si realiza una cirugía en el cráneo o el canal auditivo del animal, coloque el electrodo de referencia en el cuello en la línea media del animal. Tanto este como el paso 4.4.1 se consideran montajes de grabación de electrodos horizontales.
- Coloque el electrodo de referencia detrás de la oreja donde se entregará el estímulo y coloque el electrodo de tierra detrás del canal auditivo contralateral en el cuello.
- Para la grabación de dos canales, utilice dos electrodos negativos y un electrodo positivo combinado que requiera un cable adaptador. Coloque el electrodo de tierra subdérmicamente en el cuello y un electrodo de referencia detrás de cada canal auditivo.
- Compruebe la impedancia del electrodo. Asegúrese de que la impedancia total del electrodo no exceda de 5.0 kΩ. Mantener la impedancia interelectrodo por debajo de 3,0 kΩ.
5. Grabación ABR
- Dependiendo del hardware y software de adquisición, asegúrese de realizar la calibración para obtener niveles de sonido correctos en todas las frecuencias de estímulo utilizadas.
NOTA: Las técnicas de calibración variarán según el equipo (ver discusión). Para algunos programas, la atenuación del sonido se puede editar dentro del software. Los procedimientos de calibración realizados aquí implicaron el uso de un micrófono de condensador B&K 4138 de 1/8 de pulgada para grabar estímulos de frecuencia dentro de un sistema de acoplamiento cerrado que se aproximaba al canal auditivo del pollito (~ 5 mm). Se proporciona una tabla de calibración de cría de pollo como una tabla suplementaria. - Mueva el aparato del transductor de sonido hacia el oído activo del animal. Coloque el transductor de sonido a una profundidad poco profunda de 2 mm en el canal auditivo.
NOTA: Dependiendo del transductor de sonido, se puede unir un espéculo de plástico e insertarlo en el canal auditivo. La colocación del espéculo es crítica. Si el sonido está bloqueado por la pared del canal o el canal auditivo se cierra, los ABR estarán ausentes o se parecerán a un cambio de ~ 40 dB en el umbral. - Verifique en el animal durante la prueba si los resultados parecen anormales o ausentes. Si lo son, reposicione el transductor de sonido en el canal auditivo.
NOTA: Dado que la piel está suelta y es posible el movimiento del animal, la colocación del espéculo puede cambiar durante la grabación. Sin embargo, con la inyección de anestésico correcta y el animal completamente inconsciente, la grabación puede ser ininterrumpida durante 30-45 minutos.
6. Adquisición de datos
- Utilizar suficiente equipo / software para generar estímulos de sonido y grabar / adquirir grabaciones ABR.
NOTA: Hay muchos sistemas disponibles comercialmente o personalizados para la adquisición de ABR. Para estos experimentos, se utilizó la plataforma SmartEP USB SmartEP de Intelligent Hearing Systems (IHS) disponible comercialmente. La capacidad de manipular los parámetros de grabación es fundamental; estos incluyen, entre otros, la intensidad del estímulo, la longitud del estímulo, la frecuencia del estímulo, la tasa de presentación del estímulo, el filtro de paso alto y bajo, el rechazo del artefacto, el número de barridos, la frecuencia de muestreo, la forma de la envoltura y la polarización del estímulo. - Establezca los límites superior e inferior de rechazo de artefactos (AR) en ±25 μV, de modo que el movimiento o el ruido de los animales durante un barrido excluyan ese barrido del análisis. En toda la población analizada, menos del 1% de los barridos totales fueron rechazados debido a artefactos.
- Recopile al menos 1024 barridos para obtener una gran respuesta promediada. Esto se puede hacer en dos grabaciones de 512 barridos cada una. Esto también asegura que la respuesta sea evocada por estímulos y repetible.
- Establezca la ganancia en 100.000, el filtro de paso bajo en 100 Hz y el filtro de paso alto en 3000 Hz.
NOTA: Los ajustes del filtro de paso bajo y alto fueron óptimos para las grabaciones que utilizan el sistema IHS. Por lo tanto, estos parámetros son recomendaciones. Las grabaciones ABR en otras especies de aves utilizando el software BIOSIG filtraron la señal entre 30 y 3000 Hz 5,13,14,16,22. - Establezca la tasa de presentación del estímulo entre 10 y 20 estímulos por segundo. Las altas tasas de presentación cambiarán la latencia máxima de ABR, especialmente para los picos posteriores13. Las bajas tasas de presentación aumentarán el tiempo requerido para adquirir el ABR.
- Establezca la duración del estímulo de clic en 100 μs.
- Si utiliza un estímulo de ráfaga de tono, edite la frecuencia y la duración del estímulo en función del efecto deseado. Se utilizó un rango de 100-4000 Hz para los estímulos de explosión de tono, aunque el rango de audición conductual en pollos adultos varía de 2-9000 Hz35.
NOTA: En el sistema IHS, el tiempo de subida y bajada de un estímulo de estallido de tono solo se puede modificar si la forma de la envoltura espectral es un trapecio. Sin embargo, el coseno cuadrado y los sobres Blackman proporcionan un tiempo preestablecido de subida y bajada que se usa comúnmente en experimentos ABR con animales. El sistema IHS puede mostrar la envolvente espectral de una ráfaga de tono para garantizar tiempos adecuados de subida y bajada. El tiempo de subida y bajada de un estímulo de clic no se puede editar en IHS.
- Si utiliza un estímulo de ráfaga de tono, edite la frecuencia y la duración del estímulo en función del efecto deseado. Se utilizó un rango de 100-4000 Hz para los estímulos de explosión de tono, aunque el rango de audición conductual en pollos adultos varía de 2-9000 Hz35.
- Establezca la frecuencia de muestreo en el valor más alto permitido (generalmente 40 kHz) para obtener los mejores datos de resolución.
NOTA: Algunos sistemas, incluido IHS, utilizan un número limitado de puntos de muestreo y alterarán la duración de la ventana de grabación. Una frecuencia de muestreo de 40 kHz (período de 25 μs) solo puede permitir una ventana de grabación de 12 ms, por lo que para capturar una ráfaga de tono ABR, se utilizó una frecuencia de muestreo de 20 kHz (período de 50 μs) para permitir una ventana de grabación de 24 ms. Si compara directamente los APR de clic y ráfaga de tono, mantenga la frecuencia de muestreo constante para mantener la misma resolución. - Establezca la polarización del estímulo en alternancia. Esto se hace para eliminar la visualización del microfónico coclear de las grabaciones ABR. Para visualizar el microfónico coclear, use rarefacción o condensación para la polaridad del estímulo.
NOTA: Se pueden cambiar muchos ajustes al seleccionar estímulos. La configuración de ganancia y filtro proporcionada puede no ser óptima para otras configuraciones de equipos. Los valores predeterminados de fábrica en la mayoría de las máquinas ABR no están configurados para el registro en pollos recién nacidos. - Si registra 512 barridos, combine dos pruebas separadas para crear un promedio de barrido de 1024.
- Para un estímulo de clic o ráfaga de tono, adquiera un ABR a una intensidad supratensible.
- Continúe grabando a intensidades cada vez más bajas hasta que la respuesta evocada ya no pueda ser identificada.
- Defina el umbral ABR como la intensidad de estímulo más baja que provoca una respuesta evocada detectable. Reduzca la intensidad del estímulo en pasos de 5 dBSPL para encontrar la intensidad de estímulo más baja que provoque un pico detectable.
7. Fin de la eutanasia y el experimento
- Una vez adquiridos los ABR, preparar una sobredosis (0,1 ml) de solución para eutanasia (Pentobarbital sódico 390 mg/ml fenitoína sódica 50 mg/ml).
- Después de usar un pellizco en el dedo del pie para confirmar que no hay reflejo, inyecte la solución de eutanasia en el músculo mamario con una aguja de 29 G a una profundidad de 5 mm. La técnica de inyección es la misma que la inyección anestésica.
NOTA: El animal caducará después de unos minutos. No manipule ni decapite al animal hasta que no se detecte ningún movimiento. Una técnica alternativa de eutanasia es realizar una inyección intravenosa en la vena braquial debajo del ala. - Tan pronto como el animal no sea reflexivo y la respiración y los latidos del corazón hayan cesado, decapite rápidamente con tijeras o tijeras afiladas.
- Limpie la almohadilla térmica, la sonda rectal y los electrodos de cloruro de plata con toallitas de alcohol isopropílico al 70%.
- Asegúrese de que se hayan guardado todos los rastros adquiridos. Para un análisis más detallado, exporte los archivos como .txt archivos que se pueden ver en el bloc de notas o importar a una hoja de cálculo.
Resultados
Registros REPRESENTATIVOS de ABR para pollitos de cría
Los siguientes resultados representativos y poblacionales provienen de registros ABR realizados en 43 animales. En respuesta a un estímulo de clic supratenso (75 dBSPL), se observaron consistentemente tres picos positivos en todas las crías. Estos picos ocurrieron dentro de los 6 ms después del inicio del estímulo. Con poca frecuencia, también se observó un cuarto pico a ~ 6 ms. Si bien la identificación de los picos abr en las aves varió entre los animales (ver discusión), los picos fueron etiquetados e identificados como ondas de número romano I-IV. En la Figura 1A (traza superior) se muestra una forma de onda ABR representativa con picos etiquetados. La Figura 1B muestra la función latencia-intensidad para las ondas I y III etiquetadas en la traza representativa. La latencia máxima de la onda I aumentó en ~ 0.3 ms por cada disminución de 20 dB en la intensidad del estímulo. En promedio, las ondas I-III ocurrieron a 1.50 ms (±0.02 ms), 3.00 ms (±0.06 ms) y 4.13 ms (±0.09 ms) a 75 dBSPL, respectivamente (Figura 1C). La Onda I y la Onda III siempre se presentaron como un pico singular. Ocasionalmente para la Onda II, se observaron múltiples picos pequeños entre 2.5-3.2 ms. Cada pico tenía un valle correspondiente, y la amplitud de pico a valle de la Onda I, la más grande de todos los picos, promedió 7 μV y se acercó a una amplitud máxima de 11 μV a 75 dB SPL.
Además de la mayor amplitud, la Onda I del polluelo ABR presentó la menor variabilidad en la latencia máxima entre los animales. Por lo tanto, este pico se utilizó para estimar la sensibilidad del umbral auditivo. Los umbrales ABR se definieron como la intensidad de estímulo más baja que provocó un pico de forma de onda identificable y repetible. Esto fue determinado subjetivamente por el experimentador y cotejado por un segundo experimentador para el acuerdo de umbral. Los picos estaban mejor definidos y eran más fáciles de identificar cuando se usaban estímulos de clic, pero las ráfagas de tono también generaban picos definidos e identificables que variaban según la frecuencia del estímulo y sus parámetros (Figura 1D, n = 4 polluelos). El umbral ABR evocado por clic era más bajo que el umbral evocado por ráfaga de tono, con la excepción de 1000 Hz. Los umbrales variaban entre 10-30 dBSPL para estímulos de clic. Los ABR evocados por clics que no mostraban picos identificables >30 dBSPL a menudo eran el resultado de que el espéculo se desalojaba del canal auditivo debido al movimiento de los animales.
La disminución de la temperatura corporal aumenta las latencias ABR
Se sabe que la velocidad de la actividad neuronal, medida por la ocurrencia máxima de una amplitud de forma de onda (es decir, latencia), disminuye a temperaturas corporales más bajas36,37. Este fenómeno se observó en los ABR de pollos recién nacidos utilizando un estímulo de clic de 75 dBSPL. En la figura 2A se muestra un seguimiento representativo. A medida que la temperatura corporal disminuyó de 39 ° C, la latencia de los picos de ABR ocurrió más tarde en el tiempo, a pesar del mismo nivel de intensidad del estímulo. La Figura 2B muestra la latencia de las Ondas I y III en función de las temperaturas corporales más bajas para la traza representativa. Hubo una fuerte correlación (R2 = 0,89) entre las temperaturas corporales más bajas y la aparición de la latencia máxima de la Onda I (Figura 2C, n = 5 polluelos). Estos resultados demuestran la necesidad de mantener una temperatura corporal casi normal durante los registros de ABR. Si no se mantiene una temperatura corporal casi normal, las funciones de intensidad de latencia y las mediciones de amplitud del ABR son muy variables y, a menudo, inexactas.
Diferencias de latencia y amplitud en las primeras crías
La investigación ha demostrado que la actividad neuronal relacionada con el inicio de la audición para el pollito está cerca de la maduración a finales de los8 años embrionarios. Sin embargo, para un subconjunto de crías muy tempranas (<3 h después de la eclosión), observamos un cambio de latencia máxima de las formas de onda ABR (n = 4) en respuesta a un estímulo de clic SPL de 75 dB o los potenciales evocados no fueron identificables (n = 2 polluelos). En 2 crías jóvenes, no se pudo provocar una ráfaga de tono ABR, y los umbrales de clic se elevaron en 50 dBSPL. Esto podría deberse a un problema conductor en el que todavía hay líquido en el canal auditivo / cavidad del oído medio del animal, o un componente neural subdesarrollado. Los estudios en mamíferos han reportado cambios de umbral de 50 dB en recién nacidos38,39. Los animales representativos utilizados aquí tenían >3 h de edad, lo que también coincidió con el tiempo que tardan las plumas en secarse. La Figura 3A muestra los APR registrados de crías jóvenes (P1, <3 h de edad) y crías mayores (P2). Para el análisis, solo 3 crías jóvenes presentaron los tres picos de ABR. Las latencias máximas de la forma de onda se prolongaron significativamente, y las amplitudes de la forma de onda se redujeron ligeramente en comparación con las crías más viejas (Figura 3B-C, respectivamente).
Colocación de electrodos de referencia y grabaciones ABR de dos canales
En la Figura 4, la colocación del electrodo de referencia se modificó entre 2 ubicaciones diferentes, pero aún así dio lugar a grabaciones ABR comparables. Una comparación entre 75 trazas de clic dBSPL en el mismo animal con las dos ubicaciones de electrodos de referencia mostró diferencias mínimas en las amplitudes de forma de onda de pico a valle y las latencias de forma de onda pico (Figura 4A). La colocación mastoidea fue metodológicamente similar a los experimentos ABR de mamíferos que colocan el electrodo de referencia en el mastoideo o pinna. El uso de una colocación del cuello para el electrodo de referencia sería beneficioso si se realizara manipulación o cirugía en cualquiera de las orejas. Curiosamente, la amplitud del pico de la Onda II para la colocación mastoidea (traza roja) ocurrió 1 ms después del pico de la Onda II para la colocación del cuello (traza negra). Esta diferencia de tiempo probablemente refleja el sitio (s) de la generación neuronal ABR en relación con la colocación del electrodo.
Utilizando una configuración de dos canales, se utilizó un electrodo de grabación activo (colocación de la parte superior de la cabeza) y dos electrodos de referencia (colocaciones mastoides) para obtener ABRs para los oídos izquierdo y derecho (Figura 4B). Las respuestas entre los dos oídos fueron similares, con cambios menores en las amplitudes máximas probablemente debido al posicionamiento de los auriculares. La latencia del oído izquierdo y derecho que es equivalente apoyó la función igualmente saludable de ambos oídos y hemisferios del tronco encefálico en el pollo recién nacido. El montaje de grabación de dos canales también podría utilizarse para los ABR binaurales, pero habría consideraciones adicionales necesarias para esas grabaciones.

Figura 1: Registros representativos de pollitos de cría a estímulos evocados por clic y tono. (A) Registros ABR representativos de un pollito de cría (P2) en función de diferentes niveles de intensidad del estímulo. Se pueden identificar de tres a cuatro picos positivos en microvoltios (μV) dentro de los 6 ms posteriores al inicio del estímulo (tiempo = 0 ms). Las ondas se identificaron utilizando números romanos. Las amplitudes de pico a valle disminuyen a niveles más bajos de intensidad de estímulo. (B) Funciones de latencia-intensidad de las Ondas I y III para la traza representativa mostrada en (A). Solo se analizaron estos picos, ya que la Onda II generalmente no se observó a intensidades <45 dBSPL. (C) Latencia de las formas de onda máximas ABR evocadas por clics (n = 43 pollitos). Las barras de error denotan el error estándar de la media (SEM). (D) ABRs (rastros negros) evocados por tonos promediados para cuatro polluelos de cría a tres frecuencias diferentes. Trazas rojas = error estándar de la media (SEM) Estímulos = 75 dBSPL. En esta y siguientes figuras, las barras de error denotan SEM, y el oído derecho fue el oído de estímulo. (excepción para la Figura 4B donde ambos oídos fueron estimulados). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Efecto de la temperatura corporal en los registros ABR. (A) Registros ABR representativos de un pollito (P2) en función de la temperatura corporal. Para las temperaturas corporales más bajas, las latencias de forma de onda máxima aumentaron, mientras que las amplitudes de pico a valle se mantuvieron relativamente sin cambios. (B) Función latencia-temperatura de las Ondas I y III para las trazas representativas mostradas en (A). (C) Datos de población que muestran la relación entre la latencia y los cambios de temperatura para 5 pollitos (p < 0,01, R2 = 0,89). Se observó una tendencia similar para las ondas II y III (datos no mostrados). Haga clic aquí para ver una versión más grande de esta figura.
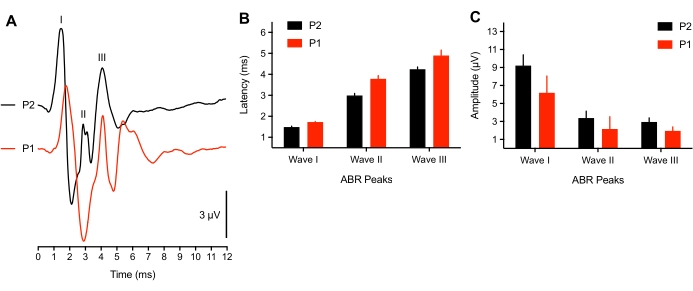
Figura 3: Diferencias relacionadas con la edad en los registros ABR. (A) Registros ABR representativos (superpuestos) de un pollito de cría representativo en P2 (traza negra) y P1 (<3 h después de la eclosión, traza roja). (B) Latencias de forma de onda máxima para las ondas I, II y III en función de la edad. Las latencias para las Ondas I-III fueron significativamente diferentes entre las edades (P < 0,05, n = 6 polluelos). (C) Amplitudes de forma de onda de pico a valle de las ondas I, II y III en función de la edad. Haga clic aquí para ver una versión más grande de esta figura.
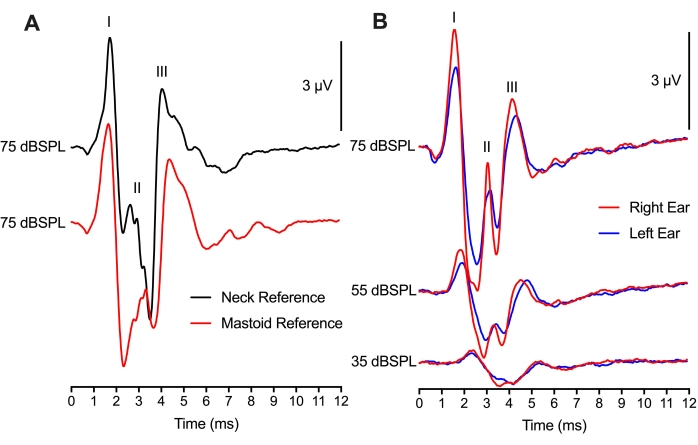
Figura 4: Colocación de electrodos y registros ABR de dos canales: (A) Registros ABR representativos (superpuestos) del mismo pollito de cría (P2) con el electrodo de referencia colocado en el cuello (traza negra) o mastoideo (traza roja). El electrodo activo se colocó en la línea media del cráneo para ambos montajes de grabación de electrodos. La latencia de las ondas I y III, y la amplitud de las ondas I y III son casi idénticas en ambas condiciones. La latencia de la onda II es más temprana y la amplitud es mayor para el electrodo colocado en el tejido del cuello. (B) Grabación de dos canales mientras se estimula secuencialmente los oídos derecho e izquierdo. Registros ABR representativos (superpuestos) del mismo pollito de cría (P2) con los electrodos de referencia colocados en la mastoidea del oído izquierdo (trazas azules) y la oreja derecha (trazas rojas) a tres niveles de intensidad diferentes. Haga clic aquí para ver una versión más grande de esta figura.
Tabla suplementaria: Mesa de calibración de crías de pollo. Haga clic aquí para descargar esta tabla.
Discusión
El tronco encefálico auditivo de las aves está bien estudiado, y muchas estructuras son análogas a la vía auditiva de los mamíferos. El nervio auditivo proporciona entradas excitatorias sobre los dos núcleos centrales de primer orden, el núcleo coclear magnocellularis (NM) y el angularis (NA). Nm envía una proyección excitatoria bilateralmente a su diana auditiva, el núcleo laminaris (NL)7. NL se proyecta al núcleo mesencephalicus lateralis, pars dorsalis (MLd)40,41. NL también se proyecta al núcleo olivar superior (SON), que proporciona inhibición de retroalimentación a NM, NA y NL42. Este microcircuito auditivo inferior del tronco encefálico se conserva exquisitamente para la función que cumple, la localización del sonido y la audición binaural33. Las regiones auditivas superiores del tronco encefálico del ave también tienen núcleos análogos al lemnisco lateral de los mamíferos y al colículo inferior en el mesencéfalo. Dadas estas similitudes, la composición del ABR aviar hasta el mesencéfalo auditivo es comparable en todos los vertebrados.
Mientras que múltiples especies de aves muestran tres picos positivos dentro de los 6 ms posteriores al inicio del estímulo, la correlación de los picos abr con las estructuras auditivas centrales tiene cierta variabilidad. Se puede suponer razonablemente que la onda I es la primera respuesta neuronal de la papila basilar periférica y el nervio auditivo y muestra poca variabilidad entre los individuos (Figura 1C). La identificación posterior de la onda es menos segura y puede diferir entre las especies. Kuokkanen et al.17 determinaron recientemente que la Onda III del ABR de la lechuza común es generada por NL; por lo tanto, es razonable argumentar que la Onda II se origina a partir de NM y NA del núcleo coclear20. Sin embargo, el búho Wave III se definió como el pico positivo generado 3 ms después del inicio del estímulo. Esto corresponde a la Onda II tal como se define en el pollo de cría ABR. En la lechuza común ABR, se combinaron las olas I y II.
Mientras que el pollo recién nacido generalmente presentaba tres picos dentro de los 6 ms, ocasionalmente se observó un cuarto pico (por ejemplo, ver Figura 1A). Se necesitarían datos de población, un mayor tamaño de muestra y paradigmas experimentales adicionales para apoyar una cuarta ola y, en algunos casos, un ABR de pollo de cinco olas. El hallazgo más consistente fueron las tres representaciones máximas que se muestran aquí.
Dado que el ABR se define como una medida de la sincronía neuronal, los núcleos principales en la vía auditiva podrían representar cada pico positivo en el ABR. La señal que pasa del nervio auditivo a NM/NA y luego a NL puede definir las ondas I, II y III en el pollo varón varón, respectivamente. Además, el cuarto pico posterior del ABR del pollo podría representar una estructura auditiva superior del tronco encefálico o del mesencéfalo. La caracterización de los ABR aviares también debe considerar la diferencia entre aves precociales y altriciales. La maduración de las respuestas auditivas variará entre especies y también se ve afectada por otros rasgos críticos como el comportamiento de los depredadores y / o el aprendizaje vocal4. En cualquier caso, los métodos y técnicas descritos se aplican fácilmente a una variedad de especies de aves y vertebrados.
La importancia de mantener la temperatura corporal animal se ilustra en la Figura 2. A medida que la temperatura interna del cuerpo disminuyó, la latencia de las respuestas ABR aumentó para el mismo nivel de intensidad del estímulo. Esto es más pronunciado cuando la temperatura corporal desciende por debajo de 32 °C36,37. El aumento de latencia de aproximadamente 1 ms en el ABR es menor que el reportado anteriormente en el pollo23. Sin embargo, Katayama23 utilizó una cría de 12 días de edad que se enfrió y posteriormente se calentó durante un período de 4 h. Los datos de la Figura 2 se registraron durante el proceso de enfriamiento durante un período de 20 minutos. Para adquirir la mejor calidad y los registros más consistentes, se debe mantener la temperatura corporal del animal, y todos los registros deben hacerse a la misma temperatura fisiológica entre los animales.
El efecto de la edad en el ABR es leve pero importante de considerar. Si bien solo la latencia de las Ondas I y II del ABR fue significativamente diferente, esto se debe en parte a que solo se usaron tres crías jóvenes en la Figura 3; los otros tres no presentaron tres picos ABR identificables. La amplitud de ABR y los cambios de umbral también pueden ser evidentes si se utilizan tamaños de muestra grandes o se comparan ABR específicos de frecuencia. Este efecto relacionado con la edad podría ser causado por el líquido en el oído medio del pollo. Tales cambios conductores conducen a un marcado aumento de los umbrales de ABR tanto para modelos humanos como para otros mamíferos38,39.
Utilizando dos montajes de grabación diferentes, se observaron respuestas similares (Figura 4A). Si bien el montaje más común coloca el electrodo de referencia detrás de la oreja receptora del estímulo, tener el electrodo de referencia en el tejido del cuello puede ser útil si hay una intervención quirúrgica que acompaña al ABR. Sin embargo, si se utilizan grabaciones ABR de dos canales, los electrodos de referencia deben colocarse por separado y simétricamente, lo que es difícil si se coloca el electrodo de referencia en el cuello. Se recomienda la posición mastoidea para el electrodo de referencia para estandarizar tantos aspectos de la grabación como sea posible. La grabación ABR de dos canales es una herramienta efectiva que requiere poca preparación adicional y da como resultado respuestas similares entre los oídos. Las diferencias de amplitud menores probablemente se debieron a la posición del auricular. La grabación de dos canales permite una fácil comparación entre un oído manipulado experimentalmente o un hemisferio cerebral versus un control. Esta configuración también sería necesaria para probar los ABR binaurales. Los experimentos futuros con el pollo ABR pueden referirse a la literatura previa sobre configuraciones y montajes de grabación34.
Esta metodología viene con varias limitaciones. Como se mencionó en el paso 5.1, la mala colocación del espéculo puede conducir a un cambio de 40 dBSPL en la respuesta. Esto podría causar una interpretación incorrecta de un animal manipulado o modificado. Se recomiendan las siguientes precauciones: adquirir una gran muestra de datos de control antes de adquirir los ABRs de modelos manipulados o mutantes. No disminuya la intensidad del estímulo en más de 20 dBSPL entre grabaciones. Si la amplitud o latencia cambia más de lo esperado, verifique la posición del animal y el espéculo. Repita ese estímulo ABR para observar los cambios. Si el espéculo se ha movido, vuelva a adquirir pruebas previas. Otra limitación es la calibración de los ABR. Sin la calibración adecuada para registrar el nivel de presión sonora, se desconoce la intensidad presentada al animal. Al medir la salida de sonido, use el mismo espéculo que en la grabación experimental y un pequeño micrófono dentro de una cavidad que se aproxime a la longitud del canal auditivo del animal (~ 5 mm). Mida las mismas frecuencias de tono utilizadas en los experimentos, ya que las calibraciones son específicas de la frecuencia. El manual para sistemas de hardware y software puede venir con instrucciones para la calibración. También hay filtros adicionales, como los filtros de fase lineal y de fase mínima, que pueden mejorar los ABR43 de ráfaga de clic y tono. Estos filtros no se utilizaron en el presente estudio. Tampoco se examinaron consideraciones adicionales, como el tiempo de subida y bajada de una envolvente espectral de estallido de tono que cambia en función de la frecuencia o el cambio del tiempo de subida y bajada de los estímulos de clic. Estas son buenas investigaciones futuras una vez que se puedan adquirir ABR confiables y consistentes.
La comparación del pollo recién nacido con otros modelos de aves es prometedora. Los periquitos y los búhos chillones orientales también muestran tres picos positivos de microvoltios dentro de los primeros 6 ms del ABR13,22. En diferentes especies de pájaros carpinteros, también se ven tres picos, pero su latencia es más tardía en el tiempo. Además, el rango de mejor sensibilidad de frecuencia en pájaros carpinteros está entre 1500 y 4000 Hz, que es algo más alto que el mejor umbral del pollo a 1000 Hz. En el pollo adulto, la mejor sensibilidad es a 2000 Hz35, por lo que puede haber una mejor audición de las frecuencias altas a medida que las crías de pollo se convierten en adultos. Ese desarrollo diferirá entre las especies de aves, teniendo en cuenta el desarrollo altricial o precoz del animal4.
Los métodos experimentales descritos aquí pueden ayudar a determinar qué factores conducen a detrimentos o cambios en las respuestas auditivas y los umbrales, así como estudios en diferentes etapas del desarrollo embrionario. La manipulación genética, el envejecimiento y la exposición al ruido son manipulaciones conocidas en animales y otros modelos aviares 24,25,44,45. Estos métodos deberían extenderse al modelo de pollo ahora que técnicas como la electroporación in-ovo permiten la expresión de proteínas que se controlan focal y temporalmente en un lado del tronco encefálico auditivo12,46. Esto permite la comparación directa de los ABR desde el oído manipulado genéticamente con el oído de control contralateral utilizando un paradigma de grabación de dos canales.
En general, el ABR de los pollos recién nacidos es un método de investigación útil, casi idéntico a las medidas de la función auditiva en modelos humanos y otros mamíferos. También es una metodología no invasiva, in vivo . Aparte de la inyección anestésica y la colocación de electrodos subdérmicos de unos pocos milímetros, no se requiere ninguna otra manipulación física. En teoría, una cría podría ser probada varias veces durante un curso de tiempo de desarrollo de días o semanas si se mantiene en un entorno apropiado. Este protocolo no solo establece los pasos necesarios y los parámetros de registro para el POLLO recién nacido ABR, sino que propone características de un ABR aviar que puede informar más pruebas sobre la función auditiva del tronco encefálico.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo es apoyado por el NIH/NIDCD R01 DC017167
Materiales
| Name | Company | Catalog Number | Comments |
| 1/8 inch B&K Microphone | Brüel & Kjær | 4138 | Type 4138-A-015 also works |
| Auditory Evoked Potential Universal Smart Box | Intelligent Hearing Systems | M011110 | |
| Custom Sound Isolation Chamber | GK Soundbooth Inc | N/A | Custom built |
| DC Power Supply | CSI/Speco | PSV-5 | |
| ER3 Insert Earphone | Intelligent Hearing Systems | M015302 | Used as sound transducer |
| Euthasol | Virbac | 710101 | Controlled Substance; euthanasia solution |
| Insulin Syringe (29 G) | Comfort Point | 26028 | |
| Ketamine | Covetrus | 11695-0703-1 | Controlled Substance |
| Power Supply | Powervar | 93051-55R | |
| Rectal Probe | YSI | 401 (10-09010) | Any 400 series probe will work with the YSI temperatuer monitor |
| Subdermal needles | Rhythmlink | RLSND107-1.5 | |
| Temperature Monitor | YSI | 73ATA 7651 | Works with any 400 series rectal probe |
| Xylazine | Anased | 59399-110-20 | Used with ketamine and water for anesthetic |
Referencias
- Wever, E. G., Bray, C. W. Action currents in the auditory nerve in response to acoustical stimulation. Proceedings of the National Academy of Sciences of the United States of America. 16 (5), 344-350 (1930).
- Jewett, D. L., Williston, J. S. Auditory-evoked far fields averaged from the scalp of humans. Brain. 94 (4), 681-696 (1971).
- Corwin, J. T., Bullock, T. H., Schweitzer, J. The auditory brain stem response in five vertebrate classes. Electroencephalography and Clinical Neurophysiology. 54 (6), 629-641 (1982).
- Carey, C. Avian Growth and Development. Evolution within the Altricial Precocial Spectrum. , Oxford University Press. Oxford. (1998).
- Kraemer, A., Baxter, C., Hendrix, A., Carr, C. E. Development of auditory sensitivity in the barn owl. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 203 (10), 843-853 (2017).
- Rebillard, G., Rubel, E. W. Electrophysiological study of the maturation of auditory responses from the inner ear of the chick. Brain Research. 229 (1), 15-23 (1981).
- Parks, T. N., Rubel, E. W. Organization and development of brain stem auditory nuclei of the chicken: organization of projections from n. magnocellularis to n. laminaris. Journal of Comparative Neurology. 164 (4), 435-448 (1975).
- Hong, H., Rollman, L., Feinstein, B., Sanchez, J. T. Developmental profile of ion channel specializations in the avian nucleus magnocellularis. Frontiers in Cellular Neuroscience. 10, 80(2016).
- Leao, R. M. The ion channels and synapses responsible for the physiological diversity of mammalian lower brainstem auditory neurons. Hearing Research. 376, 33-46 (2019).
- Oline, S. N., Ashida, G., Burger, R. M. Tonotopic optimization for temporal processing in the cochlear nucleus. Journal of Neuroscience. 36 (32), 8500-8515 (2016).
- Kopp-Scheinpflug, C. Your genes decide what you are listening to. Channels. 11 (5), 355-356 (2017).
- Sid, H., Schusser, B. Applications of gene editing in chickens: A new era is on the horizon. Frontiers in Genetics. 9, 456(2018).
- Brittan-Powell, E. F., Dooling, R. J., Gleich, O. Auditory brainstem responses in adult budgerigars (Melopsittacus undulatus). The Journal of the Acoustical Society of America. 112 (3), Pt 1 999-1008 (2002).
- Lohr, B., Brittan-Powell, E. F., Dooling, R. J. Auditory brainstem responses and auditory thresholds in woodpeckers. The Journal of the Acoustical Society of America. 133 (1), 337-342 (2013).
- Counter, S. A. Brain-stem evoked potentials and noise effects in seagulls. Comparative Biochemistry and Physiology. A, Comparative Physiology. 81 (4), 837-845 (1985).
- Crowell, S. E., et al. A comparison of auditory brainstem responses across diving bird species. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 201 (8), 803-815 (2015).
- Noirot, I. C., Brittan-Powell, E. F., Dooling, R. J. Masked auditory thresholds in three species of birds, as measured by the auditory brainstem response (L). Journal of the Acoustical Society of America. 129 (6), 3445-3448 (2011).
- McGee, J., et al. Auditory performance in bald eagles and red-tailed hawks: a comparative study of hearing in diurnal raptors. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural and Behavioral Physiology. 205 (6), 793-811 (2019).
- Brittan-Powell, E. F., Dooling, R. J., Ryals, B., Gleich, O. Electrophysiological and morphological development of the inner ear in Belgian Waterslager canaries. Hearing Research. 269 (1-2), 56-69 (2010).
- Kuokkanen, P. T., Kraemer, A., Kempter, R., Koppl, C., Carr, C. E. Auditory brainstem response wave iii is correlated with extracellular field potentials from nucleus laminaris of the barn owl. Acta Acustica United with Acustica. The Journal of the European Acoustics Association (EEIG). 104 (5), 874-877 (2018).
- Beatini, J. R., Proudfoot, G. A., Gall, M. D. Frequency sensitivity in Northern saw-whet owls (Aegolius acadicus). Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 204 (2), 145-154 (2018).
- Brittan-Powell, E. F., Lohr, B., Hahn, D. C., Dooling, R. J. Auditory brainstem responses in the Eastern Screech Owl: an estimate of auditory thresholds. The Journal of the Acoustical Society of America. 118 (1), 314-321 (2005).
- Katayama, A. Postnatal development of auditory function in the chicken revealed by auditory brainstem responses (ABRs). Electroencephalography and Clinical Neurophysiology. 62 (5), 388-398 (1985).
- Durham, D., Park, D. L., Girod, D. A. Breed differences in cochlear integrity in adult, commercially raised chickens. Hearing Research. 166 (1-2), 82-95 (2002).
- Kaiser, C. L., Girod, D. A., Durham, D. Breed-dependent susceptibility to acute sound exposure in young chickens. Hearing Research. 203 (1-2), 101-111 (2005).
- Hamdy, A. M., Vander Hel, W., Henken, A. M., Galal, A. G., Abd-Elmoty, A. K. Effects of air humidity during incubation and age after hatch on heat tolerance of neonatal male and female chicks. Poultry Science. 70 (7), 1499-1506 (1991).
- Bruzual, J. J., Peak, S. D., Brake, J., Peebles, E. D. Effects of relative humidity during the last five days of incubation and brooding temperature on performance of broiler chicks from young broiler breeders. Poultry Science. 79 (10), 1385-1391 (2000).
- vander Pol, C. W., van Roovert-Reijrink, I. A. M., Maatjens, C. M., vanden Brand, H., Molenaar, R. Effect of relative humidity during incubation at a set eggshell temperature and brooding temperature posthatch on embryonic mortality and chick quality. Poultry Science. 92 (8), 2145-2155 (2013).
- Buhr, R. J. Incubation relative humidity effects on allantoic fluid volume and hatchability. Poultry Science. 74 (5), 874-884 (1995).
- Galli, R., et al. Sexing of chicken eggs by fluorescence and Raman spectroscopy through the shell membrane. PLoS One. 13 (2), 0192554(2018).
- Otsuka, M., Miyashita, O., Shibata, M., Sato, F., Naito, M. A novel method for sexing day-old chicks using endoscope system. Poultry Science. 95 (11), 2685-2689 (2016).
- Kaiser, A. The ontogeny of homeothermic regulation in post-hatching chicks: its influence on the development of hearing. Comparative Biochemistry and Physiology. A, Comparative Physiology. 103 (1), 105-111 (1992).
- Kuba, H., Yamada, R., Ohmori, H. Evaluation of the limiting acuity of coincidence detection in nucleus laminaris of the chicken. The Journal of Physiology. 552, Pt 2 611-620 (2003).
- Shaheen, L. A., Valero, M. D., Liberman, M. C. Towards a diagnosis of cochlear neuropathy with envelope following responses. Journal of the Association for Research in Otolaryngology. 16 (6), 727-745 (2015).
- Hill, E. M., Koay, G., Heffner, R. S., Heffner, H. E. Audiogram of the chicken (Gallus gallus domesticus) from 2 Hz to 9 kHz. Journal of Comparative Physiology. A, Neuroethology Sensory Neural and Behavioral Physiology. 200 (10), 863-870 (2014).
- Rossi, G. T., Britt, R. H. Effects of hypothermia on the cat brainstem auditory evoked response. Electroencephalography and Clinical Neurophysiology. 57 (2), 143-155 (1984).
- Doyle, W. J., Fria, T. J. The effects of hypothermia on the latencies of the auditory brainstem response (ABR) in the rhesus monkey. Electroencephalography and Clinical Neurophysiology. 60 (3), 258-266 (1985).
- Guan, X., Gan, R. Z. Effect of middle ear fluid on sound transmission and auditory brainstem response in guinea pigs. Hearing Research. 277 (1-2), 96-106 (2011).
- Ravicz, M. E., Rosowski, J. J., Merchant, S. N. Mechanisms of hearing loss resulting from middle-ear fluid. Hearing Research. 195 (1-2), 103-130 (2004).
- Wang, Y., Zorio, D. A. R., Karten, H. J. Heterogeneous organization and connectivity of the chicken auditory thalamus (Gallus gallus). Journal of Comparative Neurology. 525 (14), 3044-3071 (2017).
- Wang, Y., Karten, H. J. Three subdivisions of the auditory midbrain in chicks (Gallus gallus) identified by their afferent and commissural projections. Journal of Comparative Neurology. 518 (8), 1199-1219 (2010).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. Journal of Neuroscience. 30 (36), 12075-12083 (2010).
- Beutelmann, R., Laumen, G., Tollin, D., Klump, G. M. Amplitude and phase equalization of stimuli for click evoked auditory brainstem responses. The Journal of the Acoustical Society of America. 137 (1), 71-77 (2015).
- Liberman, M. C. Noise-induced and age-related hearing loss: new perspectives and potential therapies. F1000Research. 6, 927(2017).
- Efrati, A., Gutfreund, Y. Early life exposure to noise alters the representation of auditory localization cues in the auditory space map of the barn owl. Journal of Neurophysiology. 105 (5), 2522-2535 (2011).
- Lu, T., Cohen, A. L., Sanchez, J. T. In ovo electroporation in the chicken auditory brainstem. Journal of Visualized Experiments: JoVE. (124), e55628(2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados