Method Article
إعادة تكوين قشرة الأكتين الدنيا المربوطة بالغشاء على الطبقات الثنائية الدهنية المدعومة
In This Article
Summary
يصف هذا البروتوكول تكوين طبقات ثنائية دهنية مدعومة وإضافة خيوط هيكلية خلوية وبروتينات حركية لدراسة ديناميكيات الشبكات الهيكلية الخلوية المعاد تشكيلها والمربوطة بالغشاء باستخدام الفحص المجهري الفلوري.
Abstract
يوفر سطح الخلية الحية منصة نشطة متعددة الاستخدامات للعديد من العمليات الخلوية ، والتي تنشأ من تفاعل غشاء البلازما مع قشرة الأكتين الأساسية. في العقود الماضية ، أثبتت الأنظمة الدنيا المعاد تشكيلها والقائمة على الطبقات الثنائية الدهنية المدعومة بالاشتراك مع شبكات خيوط الأكتين أنها مفيدة للغاية في كشف الآليات الأساسية وعواقب شبكات الأكتين المربوطة بالغشاء ، وكذلك في دراسة وظائف البروتينات الفردية المرتبطة بالغشاء. هنا ، نصف كيفية إعادة تكوين مثل هذه الأنظمة المركبة النشطة في المختبر والتي تتكون من طبقات ثنائية دهنية مدعومة بالسوائل مقترنة ببروتينات مرتبطة بالغشاء مرتبطة بالأكتين إلى خيوط الأكتين الديناميكية ومحركات الميوسين التي يمكن ملاحظتها بسهولة عبر الفحص المجهري الفلوري للانعكاس الداخلي الكلي. يسمح تصميم الغرفة المفتوحة للمرء بتجميع النظام بطريقة خطوة بخطوة والتحكم بشكل منهجي في العديد من المعلمات مثل تركيز بروتين الرابط ، وتركيز الأكتين ، وطول خيوط الأكتين ، ونسبة الأكتين / الميوسين ، وكذلك مستويات ATP. أخيرا ، نناقش كيفية التحكم في جودة النظام ، وكيفية اكتشاف المشكلات الشائعة واستكشاف الأخطاء وإصلاحها ، وبعض قيود هذا النظام مقارنة بسطح الخلية الحية.
Introduction
يتفاعل غشاء البلازما لخلية حيوانية حية باستمرار مع الهيكل الخلوي للأكتين المجاور ، ويشكلان معا مادة مركبة نشطة تؤدي العديد من الوظائف الخلوية 1,2. لدراسة العمليات في واجهة غشاء الأكتين الدهنية هذه ، أثبتت إعادة تكوين الشبكات الهيكلية الخلوية فوق الطبقات الثنائية الدهنية المدعومة (SLBs) أنها مفيدة للغاية. يسمح نهج النظام الأدنى هذا بالتحكم الدقيق في مكونات شبكة الهيكل الخلوي وتكوين الدهون. بالمقارنة مع الأغشية الدهنية القائمة بذاتها للحويصلات العملاقة أحادية الصفيحة ، تسمح الهندسة المستوية ل SLBs بالاستخدام الفعال لأحدث تقنيات الفحص المجهري مثل الدقة الفائقة 3,4 ، أو مضانالانعكاس الداخلي الكلي (TIRF)5،6،7 ، أو التشتت التداخلي8 لدراسة التنظيم المكاني وديناميات الشبكات الهيكلية الخلوية. يوفر TIRF أعلى تباين للمكونات ذات العلامات الفلورية ، نظرا لأن إشارة الجزيئات غير المنضمة في المحلول الذي يساهم في إشارة الخلفية تكون ضئيلة.
هنا ، نصف بروتوكولا أساسيا لتشكيل شبكات الأكتوميوسين المربوطة بطبقات ثنائية دهنية مدعومة ، والتي تستخدم على نطاق واسع في هذا المجال لدراسة فيزياء الشبكات النشطة شبه ثنائية الأبعاد9،10،11 وتأثيرها على تنظيم الغشاء3،5،12،13،14،15،16 (الشكل 1 ). لا يقتصر هذا النهج على الشبكات القائمة على الأكتين ولكن يمكن أيضا تكييفه بسهولة لاستكشاف الأنابيب الدقيقة أو الخيوط الوسيطة أو الشبكات المركبة ذات الطبيعة المختلطة ودراسة مجموعة متنوعة من التفاعلات بين بروتينات الغشاء الدهني ومكونات الهيكل الخلوي باستخدام طرق الفحص المجهري الحساسة للسطح.
للحفاظ على تركيز هذا البروتوكول ، استبعدنا وصفا تفصيليا لتنقية ووسم بروتينات الأكتين والميوسين أو تفاصيل حول كيفية ضبط وتنظيم شبكات الأكتوميوسين والتحكم فيها. يجب على المرء الرجوع إلى البروتوكولات الأخرى التي يتم نشرها جنبا إلى جنب مع هذا البروتوكولات في مجموعة طرق JoVE ، في المختبر إعادة تكوين شبكات الهيكل الخلوي للمواد الحيوية والفيزياء الحيوية وأبحاث المادة النشطة17.

الشكل 1: رسم تخطيطي للنظام المركب النشط لغشاء الأكتين في المختبر . تم إنشاؤها باستخدام Biorender. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
1. الكواشف والمعدات
- قم بإعداد مخازن مؤقتة جديدة كما هو موضح في الجدول 1. استخدم ماء نقي منزوع الأيونات بمقاومة 18.2 MΩ سم عند 25 درجة مئوية. تعقيم جميع المخازن المؤقتة عن طريق تمريرها من خلال مرشحات 0.22 ميكرومتر تحت فراغ. Degas المخازن المؤقتة المستخدمة في كروماتوغرافيا العمود.
- تنقية الأكتين العضلات والهيكل العظمي كما هو موضح سابقا18،19. أضف 20٪ من الجلسرين إلى محلول G-actin المنقى النهائي واجعل حصص 500 ميكرولتر (لوضع العلامات أو التجارب السائبة) وحجم 10 ميكرولتر (للتجارب الفردية). قم بتجميد القسمة عن طريق غمس الأنابيب في النيتروجين السائل لمدة 30 ثانية ثم تخزينها في -80 درجة مئوية لمدة تصل إلى 18 شهرا.
ملاحظة: بدلا من ذلك ، يمكن شراء مسحوق الأكتين أو الأسيتون المنقى تجاريا. - قم بتسمية العضلات الهيكلية المنقاة G-actin مع أي أصباغ ماليميد فلورية كما هو موضح سابقا5. تحديد تركيز ودرجة وضع العلامات على البروتين عن طريق القياس الطيفي باستخدام A290nm المصحح للأكتين (εactin = 26,600 M-1 cm-1) و Aλmax من الصبغة. اصنع حصصا من 10 ميكرولتر وقم بتجميد سريع عن طريق غمس الأنابيب في النيتروجين السائل لمدة 30 ثانية وتخزينها في -80 درجة مئوية لمدة تصل إلى 18 شهرا.
ملاحظة: وضع العلامات باستخدام استرات NHS المترافقة بالليسين سيخلق أكتين غير وظيفي ويجب تجنبه. - تنقية العضلات الهيكلية الميوسين الثاني باتباع البروتوكول20. قم بتشغيل SDS-PAGE باستخدام 10٪ من جل بولي أكريلاميد متبوعا بتلوين Coomassie لتحديد مستوى نقاء البروتين21. قم بتخزين العضلات الهيكلية المنقاة الميوسين-II عند -20 درجة مئوية في شكل سائل في محلول الميوسين II مع 50٪ من الجلسرين.
ملاحظة: يمكن استخدام الميوسين II المخزن لمدة تصل إلى 2 سنوات. - قم بتسمية الميوسين-II المنقى بأي أصباغ ماليميد فلورية كما هو موضح سابقا5. تجنب وضع علامات على محركات الميوسين بأصباغ استرات NHS. تحديد تركيز ودرجة وضع العلامات عن طريق القياس الطيفي باستخدام تصحيحA 280nm من الميوسين II و Aλmax من الصبغة. قم بتخزين الميوسين II المعاد تدويره (داكن أو ملصق) في درجة حرارة 4 درجات مئوية واستخدمه في غضون 6 أسابيع.
- تنقية البروتين السد
- الحصول على بروتين تغطية الفئران باتباع بروتوكولسابق 22. قم بتشغيل SDS-PAGE باستخدام 10٪ من جل بولي أكريلاميد متبوعا بتلوين Coomassie لتحديد مستوى نقاء البروتين. قم بقياس التركيز باستخدامA 280nm من بروتين السد (εCP = 99,530 M-1 cm-1).
- أضف 20٪ من الجلسرين إلى محلول البروتين واصنع 5 ميكرولتر من القسمة في أنابيب PCR سعة 200 ميكرولتر. اغمر الأنابيب في النيتروجين السائل وتخزينها في -80 °C لمدة تصل إلى 2 سنوات.
ملاحظة: يتم فحص نشاط بروتين السد عن طريق بلمرة كميات ثابتة من G-actin الفلوري في وجود كميات مختلفة من بروتين السد. ثم يتم تصوير الخيوط تحت المجهر ، ويتم تحديد توزيع طولها. كلما زاد التركيز النسبي لبروتين السد ، كانت توزيعات خيوط الأكتين أقصر. انظر كوستر وآخرون 5.
- التعبير عن بروتين رابط غشاء الأكتين الفلوري ، على سبيل المثال ، لهذا البروتوكول ، استخدم 10xHis-YFP-EzrinABD (HYE) ، وعبر عنه في Bl21DE3 * Escherichia Coli ، وقم بتنقيته كما هو موضح سابقا23. تحديد تركيز البروتين عن طريق القياس الطيفي.
- قم بتخزين البروتين في حصص صغيرة في محلول كروماتوغرافي ترشيح هلامي (أو أي مخزن مؤقت مناسب آخر) مع 20٪ جلسرين عند -80 درجة مئوية. في ظل هذه الظروف ، يكون البروتين مستقرا لأكثر من 2 سنوات.
ملاحظة: يعتمد اختيار بروتين رابط غشاء الأكتين وعلامة الفلورسنت على نوع السؤال الذي يتناوله المرء. تم تطوير مجموعة واسعة من استراتيجيات ربط الدهون في السنوات الماضية بما في ذلك البروتينات الموسومة بالهيستيدين 24 ، والبيوتين ستربتافيدين25 ، والحمض النووي أحادي الشريط26. - تحضير الحويصلات متعددة الصفائح (MLVs)
ملاحظة: يوضح الشكل 2 سير العمل من MLVs إلى طبقات الدهون الثنائية المدعومة.- ضع 5-10 قوارير زجاجية كهرمانية في دورق زجاجي سعة 200 مل. املأ الدورق بمحلول تنظيف 2٪ ، وهو ما يكفي فقط لغمر القوارير الزجاجية. قم بتسخينها في حمام مائي لمدة 30 دقيقة عند النبض الكامل و 65 درجة مئوية.
- أخرج القوارير من المحلول وشطفها جيدا بالماء المقطر. ضع القوارير في دورق زجاجي يحتوي على 2 N NaOH وصوتيك لمدة 20 دقيقة. لا يلزم التدفئة خلال هذه الخطوة.
- أخرج القوارير من محلول NaOH واشطفها جيدا بالماء المقطر. جفف القوارير داخل فرن هواء ساخن على حرارة 65 درجة مئوية لمدة 2 ساعة أو أكثر.
- قم بتخزين القوارير التي تم تنظيفها في دورق نظيف مختوم بغشاء شفاف لمدة تصل إلى 6 أسابيع.
تنبيه: قم بتنفيذ الخطوات التالية داخل غطاء دخان كيميائي. تعامل مع الكلوروفورم والمحاليل الدهنية باستخدام محاقن هاميلتون الزجاجية محكمة الغلق للغاز لتجنب التلوث بالبلاستيك. - شطف محاقن هاملتون وعدد قليل من قوارير الزجاج الكهرماني عدة مرات مع الكلوروفورم النقي. خذ مسحوق الدهون المخزن في أمبولات زجاجية من الفريزر -20 درجة مئوية وأضف كميات كافية من الكلوروفورم لإذابة مساحيق الدهون إلى تركيزات 10-25 مجم / مل.
- انقل المحلول من الأمبولة إلى قارورة زجاجية كهرمانية تم تنظيفها حديثا وقم بتسميتها بشكل مناسب. نفذ هذه الخطوة على الجليد لتقليل تبخر الكلوروفورم.
- اصنع محلول مخزون DOPC بتركيز 10-25 مجم / مل و DGS-NTA-Ni2+ بتركيز 1-10 مجم / مل.
- لعمل مزيج دهني عامل ، خذ قارورة زجاجية نظيفة واشطفها 2x بالكلوروفورم. أضف 300 ميكرولتر من الكلوروفورم النقي إلى القارورة لتكون بمثابة قاعدة لخلط المكونات بشكل أفضل. لن يؤثر ذلك على التركيزات النهائية لليبيدات؛ لأن الكلوروفورم كله سيجفف في الخطوات التالية.
- أضف كميات مقاسة من محاليل الدهون المخزنة إلى القارورة لعمل خلطات الدهون العاملة المطلوبة. تركيز الليبيدات المستهدف في محلول معالجة الجفاف الليبيدي هو 4 mM. جفف خليط الدهون تحت تيار بطيء من غاز N2 داخل الغطاء الكيميائي في درجة حرارة الغرفة. يمكن أن تستغرق هذه الخطوة ما يصل إلى 30 دقيقة لكل قارورة.
- بعد أن يجف كل المذيب ، قم بتجفيف الفيلم الدهني لمدة >2 ساعة في درجة حرارة الغرفة لإزالة أي آثار للكلوروفورم المتبقي. أعد تعليق مزيج الليبيدات المجففة في محلول معالجة الجفاف الليبيدي للحصول على تركيز نهائي للدهون يبلغ 4 mM.
- احتضان لمدة 5-10 دقائق للسماح بإعادة إماهة الدهون. دوامة محلول الدهون لمدة 30 ثانية لتشكيل MLVs.
- اصنع 0.5-1 مل من القسمة من MLVs في أنابيب الطرد المركزي الدقيقة 1.5 مل. اغمر الأنابيب في النيتروجين السائل ، وأغلقها بغشاء شفاف ، وقم بتخزينها في -20 درجة مئوية (لمدة تصل إلى 6 أسابيع).
ملاحظة: يتم اختيار تركيزات مخزون الدهون للسماح بكميات كبيرة بما فيه الكفاية تسمح بسحب العينات بشكل موثوق باستخدام محاقن هاملتون. إذا كانت الأحجام اللازمة لصنع المخزون كبيرة جدا بحيث لا يمكن إذابة مسحوق الدهون المجففة ، فقم بعمل تخفيفات متعددة للمخزون لضمان خلط الدهون المختلفة القابلة للتكرار.
- تحضير حويصلات صغيرة أحادية الصفيحة (سيارات الدفع الرباعي)
- أخرج حصة من MLVs من التخزين -20 درجة مئوية وقم بإذابته في درجة حرارة الغرفة. قم بتجميد الحويصلات عن طريق غمر أنبوب الطرد المركزي الدقيق في النيتروجين السائل لمدة 15-30 ثانية ووضعه على الفور في حمام مائي مضبوط على 45 درجة مئوية حتى يذوب المحلول تماما (1-2 دقيقة). كرر دورة التجميد والذوبان أعلاه 10x-15x حتى يبدو المحلول أقل تعكرا.
ملاحظة: اضبط درجة حرارة الحمام المائي أعلى من درجة حرارة الانتقال لمزيج الدهون الذي يتم إذابته للسماح بخلط الدهون بشكل موحد. - قم بموازنة آلة بثق صغيرة قائمة على حقنة مزودة بغشاء مرشح بولي كربونات بحجم 80 نانومتر مع عازل إماهة سيارات الدفع الرباعي. تأكد من عدم وجود تسرب أو فقاعات في النظام. في حين أن طريقة البثق تنتج سيارات الدفع الرباعي أحادية التشتت مع الحد الأدنى من الضرر الدهني ، فإن مزيج الدهون مع الشحنة السالبة يمكن أن يلتصق بغشاء البولي.
- مرر محلول الدهون المذاب برفق من خلال الطارد المتوازن مسبقا من جانب إلى آخر ثم ارجع. كرر الدورة 5x-10x حتى يصبح محلول الدهون واضحا بشكل واضح ، مما يشير إلى تكوين سيارات الدفع الرباعي بقطر ~ 100 نانومتر.
- قم بالطرد المركزي للتعليق المبثوق (أو طرف صوتنة المحلول ؛ انظر الملاحظة أدناه) عند 15000 × جم لمدة 60 دقيقة عند 4 درجات مئوية لحبيبات الحطام الدهني. اجمع أعلى 80٪ من المحلول دون إزعاج الحبيبات ودون إنشاء فقاعات. انقل المادة الطافية التي تحتوي على سيارات الدفع الرباعي إلى أنبوب طرد مركزي دقيق جديد وقم بتخزينها على الثلج لمدة تصل إلى 6 أيام.
ملاحظة: بديل للطرد المركزي هو صوتنة الطرف التي يتم إجراؤها على النحو التالي. قم بتشغيل صوتي microtip واضبط الإعدادات التالية: السعة = 30٪ من الحد الأقصى ، في الوقت المحدد = 10 ثوان ، وقت إيقاف التشغيل = 60 ثانية. قم بتنظيف طرف جهاز الصوتنة الدقيقة بالماء منزوع الأيونات متبوعا ب 2 N NaOH ، والكلوروفورم ، ومرة أخرى الماء منزوع الأيونات. تراجع طرف sonicator في كل من هذه الحلول وصوتي لمدة 1-2 دورات باستخدام الإعدادات المذكورة أعلاه. اغمس الطرف النظيف في محلول الحويصلة المذاب بالتجميد وصوتيك لمدة 3-6 دورات على الثلج حتى يصبح المحلول صافيا. - بعد الطرد المركزي ، تحقق من وجود علامات على تدهور الدهون العالي أو فشل قذف الدهون كتشكيل طبقة بيضاء رقيقة و / أو حبيبات مرئية بوضوح. في هذه الحالات ، لا تتابع وكرر خطوات إعداد سيارات الدفع الرباعي مرة أخرى.
ملاحظة: يمكن أن يختلف العمر الافتراضي لسيارات الدفع الرباعي باختلاف مخاليط الدهون. سيارات الدفع الرباعي المصنوعة من DOPC: DGS-NTA-Ni2+ مستقرة لمدة تصل إلى 6 أيام لأغراض هذه التجارب. يمكن العثور على نصائح لحل المشكلات الشائعة في الجدول 2.
- أخرج حصة من MLVs من التخزين -20 درجة مئوية وقم بإذابته في درجة حرارة الغرفة. قم بتجميد الحويصلات عن طريق غمر أنبوب الطرد المركزي الدقيق في النيتروجين السائل لمدة 15-30 ثانية ووضعه على الفور في حمام مائي مضبوط على 45 درجة مئوية حتى يذوب المحلول تماما (1-2 دقيقة). كرر دورة التجميد والذوبان أعلاه 10x-15x حتى يبدو المحلول أقل تعكرا.
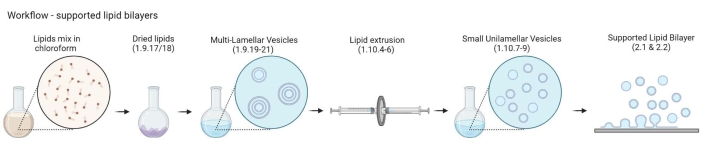
الشكل 2: رسم تخطيطي يوضح سير العمل من تحضير الحويصلات متعددة الصفائح والحويصلات الصغيرة أحادية الصفيحة إلى تكوين طبقات ثنائية دهنية مدعومة. تم إنشاؤها باستخدام Biorender. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
2. إعادة تكوين شبكات الأكتين المربوطة بالغشاء
- إعداد غرف العينة
- خذ 3-5 أغطية زجاجية مستطيلة وضعها داخل جرة كوبلن. قم بتشغيل جهاز صوتي الحمام واضبط درجة الحرارة على 65 درجة مئوية. املأ جرة كوبلين بمحلول تنظيف 2٪ لغمر الأغطية بالكامل وضعها في جهاز الصوت لمدة 30 دقيقة في وضع النبض الكامل.
- استخدم ملقط غير حاد مطلي ب PTFE لإزالة أغطية الأغطية واحدة تلو الأخرى من البرطمان. اشطفها جيدا بالماء المقطر وضعها في جرة كوبلين أخرى مملوءة ب 2 N NaOH.
- قم بتقطيع الأغطية لمدة 20 دقيقة في وضع النبض الكامل. قم بإزالة الأغطية واحدة تلو الأخرى ، واشطفها جيدا بالماء المقطر ، وضعها في وعاء كوبلين آخر مملوء بالماء المقطر.
ملاحظة: اختياريا ، صوتنة أغطية في الماء المقطر لمدة 20 دقيقة ثم شطفها مرة أخرى بالماء المقطر. - مباشرة قبل بدء التجربة ، خذ الجرة التي تحتوي على أغطية في غطاء كيميائي مزود بمصدر غاز N2 .
- قم بتحسين ضغط الهواء لتيار الغاز N2 عن طريق التجربة والخطأ بحيث يكفي فقط لإزاحة الماء من سطح الغطاء دون كسره. قم بمحاذاة تدفق غاز N2 الموازي لمستوى انزلاق الغطاء لتقليل احتمالية كسر غطاء الغطاء.
- استخدم القفازات والملقط لإزالة الأغطية واحدة تلو الأخرى من الجرة لتجفيفها تحت تيار N2 . جفف جانبي كل غطاء وضعه على شبكة بلاستيكية نظيفة بغطاء. ضع الصندوق مع أغطية الغطاء في مجفف لتجنب ملامسة جزيئات الغبار في الهواء.
ملاحظة: يمكن تخزين أغطية N2 المجففة في مجفف حيث يمكن أن تظل محبة للماء لمدة تصل إلى يومين. قد تكون هذه الاستراتيجية مفيدة عندما تكون هناك حاجة إلى العديد من الطبقات الثنائية للتجربة أو إذا استغرقت التجربة وقتا أطول من 8 ساعات. - خذ أنابيب PCR المعقمة وقطع أغطيتها ونصفيها المخروطيين السفليين بشفرة جراحية حادة. خذ الأنابيب الأسطوانية نصف المقطوعة واحدة تلو الأخرى ، ضع مادة لاصقة قابلة للشفاء بالأشعة فوق البنفسجية على الحافة الملساء لكل أنبوب مقطوع ، وضعها مقلوبة على غطاء نظيف حديثا بحيث تستقر الحافة بشكل مسطح على غطاء الغطاء.
- لا تحرك الأسطوانة بشكل جانبي بمجرد وضعها على غطاء الغطاء لضمان عدم انسكاب الغراء إلى المساحة المركزية للغرفة. يمكن أن تستوعب أغطية الأغطية المستطيلة بشكل مريح ما يصل إلى ثلاث غرف تفاعل ، ويمكن أن تستوعب الغرف المستديرة واحدة فقط في المركز (الشكل 1).
- ضع أغطية الغرفة داخل منظف الأوزون للأشعة فوق البنفسجية مع إمداد O2 وفراغ (أو استخدم مصباح الأشعة فوق البنفسجية). قم بتشغيل ضوء الأشعة فوق البنفسجية وأضيء لمدة 3-5 دقائق للسماح للمادة اللاصقة بالبلمرة. قم بإجراء إضاءة أطول (10-15 دقيقة) لتحسين مقاومة الماء لزجاج الغطاء ، وبالتالي جودة طبقة الدهون المزدوجة.
- قم بتخزين غرف العينات الجافة المضاءة بالأشعة فوق البنفسجية لمدة تصل إلى 8 ساعات داخل صناديق بلاستيكية صغيرة (مثل صناديق الغطاء المستطيلة الفارغة) ملفوفة في فيلم شفاف لتقليل ملامسة جزيئات الغبار في الهواء.
ملاحظة: يشكل التدفق المستمر ل O2 في وجود ضوء الأشعة فوق البنفسجية جذور الأوزون والأكسجين التي يمكنها إزالة الشوائب العضوية من سطح غطاء الغطاء. سيمنع الفراغ تسرب الأوزون السام الذي يتشكل أثناء العملية. - أخرج أغطية الغطاء واختبر الغرف بحثا عن التسرب عن طريق ملئها بالماء المقطر. يمكن لكل غرفة استيعاب ما يصل إلى ~ 150 ميكرولتر من العينة. تخلص من الغرف المتسربة.
ملاحظة: خيار تنظيف آخر رائع وآمن هو منظف البلازما. تعتمد إعدادات الوقت والطاقة على الطراز ، ولكن تأكد من عدم الإفراط في معالجة الشرائح الزجاجية بالبلازما لأن ذلك سيؤدي إلى تقليل حركة الدهون. يمكن أن تؤثر المعالجة السطحية على حركة الدهون27 ، كما لوحظ مع المعالجة المطولة بمحلول التنظيف (>45 دقيقة) أو هيدروكسيد الصوديوم (>30 دقيقة).
- إعداد طبقات الدهون المدعومة
- اغسل كل غرفة بمخزن مؤقت لتشكيل SLB (أو 1x PBS) لإزالة أي ملوثات سطحية ، تاركا 100 ميكرولتر من المخزن المؤقت في النهاية. حدد مستوى المخزن المؤقت عند 100 ميكرولتر بعلامة دائمة لتتبع التغييرات في الحجم بشكل متكرر.
- أضف 2 ميكرولتر من 0.1 M CaCl2 إلى الغرفة. هذا يحسن امتصاص الحويصلات على سطح الزجاج ، مما يعزز تكوين الطبقة المزدوجة في الخطوة التالية. أضف 8 ميكرولتر من محلول سيارات الدفع الرباعي (من الخطوة 1.10) إلى كل غرفة واحتضانها لمدة 15 دقيقة عند 25 درجة مئوية.
ملاحظة: يمكن تقدير حجم مزيج سيارات الدفع الرباعي المراد إضافته عن طريق حساب العدد الإجمالي للدهون (بمتوسط مساحة 0.72 نانومتر2) اللازمة لتغطية المنطقة المكشوفة المحبة للماء بالكامل في البئر بطبقتين دهنيتين. - اغسل الحويصلات غير المنضمة باستخدام عازل حركة الأكتين (1x KMEH). أولا ، قم بإزالة 50 ميكرولتر من المخزن المؤقت لتشكيل SLB ، ولم يتبق سوى 50 ميكرولتر في غرفة العينة. ثانيا ، أضف 100 ميكرولتر من 1x KMEH إلى الغرفة. امزج برفق ثم قم بإزالة 100 ميكرولتر من المخزن المؤقت دون لمس القاع.
ملاحظة: من المهم أن تكون لطيفا أثناء الغسيل. تأكد من أن طرف الماصة لا يلمس الجزء السفلي من الغرفة. حافظ على ميل الماصة لتوجيه تدفق المخزن المؤقت إلى جدار الغرفة وليس مباشرة في الطبقة المزدوجة ، لأن التدفق المباشر قد يعطل الطبقة المزدوجة. احرص على عدم إدخال أي فقاعات هواء أثناء السحب لأن الهواء قد يصل إلى طبقة الدهون المزدوجة ويسبب عيوبا فيها. - كرر الغسل 10x بإضافة 100 ميكرولتر من 1x KMEH وإزالة 100 ميكرولتر.
- أضف 10 ميكرولتر من 1 مجم / مل β-الكازين إلى الطبقة المزدوجة ، واخلطها برفق واحتضانها لمدة 5-10 دقائق. يسد β-الكازين المناطق الموجودة على الغطاء حيث لم تتشكل الطبقة المزدوجة. اغسل β الكازين 3x مع 1x KMEH كما هو موضح في الخطوة 2.2.3. وإعادة مستوى المخزن المؤقت إلى علامة 100 ميكرولتر.
- إضافة رابط غشاء الأكتين
- أثناء حضانة الكازين β (الخطوة 2.2.5) ، أخرج حصة من بروتين رابط الأكتين الغشائي من -80 درجة مئوية ، وقم بإذابته بسرعة عند 37 درجة مئوية ، ثم احتفظ به على الجليد. تمييع القسمة مع عازلة تخفيف البروتين إلى تركيز 1 ميكرومتر.
- أضف بروتين الرابط بتركيز نهائي محدد (عادة 5-20 نانومتر) واخلطه برفق. لضمان التوازن السريع للبروتين في الغرفة ، أضف أحجاما أكبر من 20 ميكرولتر عن طريق الخلط المسبق لبروتين الرابط مع 1x KMEH.
- احتضان لمدة 40 دقيقة في درجة حرارة الغرفة. اغسل 3x باستخدام 1x KMEH buffer لإزالة بروتين HSE غير المنضم (كما في الخطوة 2.2.3.). أعد مستوى المخزن المؤقت في كل غرفة إلى علامة 100 ميكرولتر. العينة جاهزة الآن للتصوير.
- تقييم جودة طبقة الدهون المزدوجة
ملاحظة: هذه خطوة اختيارية لا يلزم تنفيذها في كل مرة. نوصي بإجراء هذا التقييم في كل مرة يتم فيها تصنيع سيارات الدفع الرباعي الجديدة من مخزون MLV المجمد.- قم بتشغيل المجهر وليزر الإثارة وكاميرات الكشف. تأكد من محاذاة الليزر ، وتنظيف الهدف ، وأن البرنامج جاهز للحصول على الصور.
- ضع الزيت على هدف 100x ، وقم بتركيب العينة على مرحلة المجهر ، وركز الهدف على الطبقة المزدوجة. تأكد من أن موضع الليزر بحيث يخضع لانعكاس داخلي كلي على العينة. استخدم ليزر إثارة 488 نانومتر للتحقق من توزيع شدة التألق لطبقة 10xHis-YFP-EzrinABD ثنائية الطبقة.
ملاحظة: تظهر الطبقات الثنائية عالية الجودة توزيعا موحدا واسع النطاق لشدة التألق. تظهر الطبقات الثنائية السيئة بقع فلورية مكثفة وغير مكتملة. - لتحديد سلامة الطبقة الثنائية ، قم بإجراء فحص FRAP.
- حدد منطقة الاهتمام على الطبقة الثنائية وسجل بعض الصور لمجال الرؤية باستخدام ظروف التصوير التي توفر نسبة إشارة إلى ضوضاء تبلغ 5: 1 أو أعلى. أوقف التسجيل مؤقتا وأغلق الحجاب الحاجز الميداني لمجهر TIRF لتركيز شعاع ليزر مركز على منطقة دائرية صغيرة من الطبقة المزدوجة لتبييض الفلوروفورات محليا.
- قم بتشغيل الليزر إلى أقصى إخراج له لتبييض المنطقة الصغيرة لمدة 3-10 ثوان ثم قم بإيقاف تشغيل الليزر. أعد فتح غشاء المجال إلى نصف قطره الأصلي ، وأعد ضبط حالة التصوير مرة أخرى إلى إعدادات (ما قبل التبييض) ، واستأنف على الفور تسجيل استعادة إشارة الفلورسنت في مجال الرؤية.
- تحقق مما إذا كانت الطبقة المزدوجة سائلة. تتعافى الطبقات الثنائية الجيدة ذات الانتشار الجانبي الطبيعي بسرعة ، بينما تتعافى الطبقات الثنائية السيئة ببطء أو لا تتعافى على الإطلاق (الشكل 3). إذا لم يتعافى الطبقة المزدوجة ، فتحقق من قسم استكشاف الأخطاء وإصلاحها وأعد التشغيل. احفظ الصور كملفات TIFF 16 بت. للحصول على تقدير كمي لمعامل الانتشار ، تحقق من الخطوة 3. ادناه.
- بلمرة الأكتين الفلوري
ملاحظة: لتوفير الوقت ، ابدأ بلمرة الأكتين أثناء وقت حضانة ارتباط بروتين HSE بالطبقة الثنائية (الخطوة 2.3.) أو أثناء تقييم جودة الطبقة الثنائية (الخطوة 2.4.).- امزج G-actin غير المسمى والموسوم بالفلورسنت بنسبة مولار 10: 1 وقم بتعبئته ب G-Buffer بحيث يكون تركيز G-actin 20 ميكرومتر. التركيز الذي يتبلمر عنده الأكتين أخيرا سيكون 1/4 من هذه القيمة. أضف 1/10 من 10x ME buffer إلى المزيج للحصول على محلول 1x واحتضانه لمدة دقيقتين. تستبدل هذه الخطوة أيونات Ca 2+ المرتبطة ب G-actin بأيونات Mg2+. تأكد من أن الحجم النهائي بمضاعفات 10 ميكرولتر.
- أضف الكمية المطلوبة من بروتين السد على النحو التالي. قم بإذابة قارورة من مخزون البروتين بسرعة عند 37 درجة مئوية ثم احتفظ بها على الجليد. تمييع مع G-buffer بحيث يكون تركيز بروتين السد الآن ضعف تركيزه النهائي المطلوب في مزيج البلمرة. أضف حجما متساويا من محلول بروتين السد المخفف إلى مزيج الأكتين من الخطوة 2.5.1.
- أخيرا ، أضف حجما متساويا من المخزن المؤقت المستهدف 2x الجديد إلى مزيج التفاعل. يجب أن يكون الحجم النهائي للمحلول أربعة أضعاف حجم مزيج الأكتين في نهاية الخطوة 2.5.2. تأكد من أن التركيز النهائي ل KMEH هو 1x ، و ATP هو 1 mM ، و BSA هو 1 mg / mL ، و G-actin هو 5 μM.
احتضن في الظلام عند 25 درجة مئوية لمدة 45-60 دقيقة للسماح بحدوث البلمرة.
ملاحظة: وهذا ما يسمى استراتيجية المخزن المؤقت الهدف ، حيث يتم خلط حجم واحد من Mg 2+ G-actin (الخطوة 2.5.1.) مع حجم واحد من مزيج بروتين السد (الخطوة 2.5.2.) ومجلدين من المخزن المؤقت المستهدف2x (الخطوة 2.5.3.). هذا يجعل من السهل زيادة أو خفض كمية الأكتين وتغيير التركيز النسبي لبروتين السد (أو أي معدل أكتين آخر ؛ الشكل 4).
- إضافة خيوط الأكتين الفلورية
- قطع بضع نصائح 200 ميكرولتر بشفرة حادة أو مقص لجعلها حادة تنتهي. اسحب الحجم المطلوب من الأكتين المبلمر 5 ميكرومتر برفق (من الخطوة 2.5.3.) بطرف ماصة غير حاد (لمنع قص خيوط الأكتين) وأضفه إلى أنبوب PCR نظيف.
- أضف 1x KMEH إلى الأنبوب لجعل الحجم >20 ميكرولتر واخلطه برفق لتجنب قص F-actin. من غرفة العينة المركبة ، قم بإزالة حجم متساو من المخزن المؤقت.
- أضف محلول الأكتين المبلمر إلى الحجرة واسحب برفق لأعلى ولأسفل 3x دون لمس الطبقة المزدوجة في الأسفل. هذا يسمح لخيوط الأكتين بالتوزيع بشكل موحد على الطبقة المزدوجة. قم بتركيب العينة على مجهر TIRF (انظر الخطوة 2.4.1. والخطوة 2.4.2.).
- يمكن للمرء تسجيل عملية ربط F-actin بالطبقة المزدوجة. احتضان لمدة 20-30 دقيقة. سجل بعض الصور من مجالات رؤية مختلفة بعد وصول إضافة F-actin إلى حالة مستقرة. لاحظ التغيير في التنظيم المكاني ل 10xHis-YFP-EzrinABD قبل (متجانس) وبعد تنظيم الأكتين.
ملاحظة: يتم توزيع HYE بشكل موحد على طبقة الدهون المزدوجة في حالة عدم وجود الأكتين. عند إضافة خيوط الأكتين ، يتزامن HYE مع F-actin. يعتمد مدى التمركز المشترك على تقارب ارتباط الأكتين لبروتين الرابط. كلما كان التقارب أقوى ، زاد التمركز المشترك وأبطأ الحركة الجانبية لبروتين الرابط (الشكل 5).
- إضافة الميوسين الثاني
- بعد 30 دقيقة من حضانة الأكتين ، قم بتركيب العينة مرة أخرى على المجهر (إذا كانت غير مثبتة). تحقق من الإشارة في قنوات البروتين الرابط و F-actin. اضبط ظروف التصوير إذا لزم الأمر.
- حدد منطقة جيدة مع إشارة بروتين رابط موحدة وخيوط أكتين متناثرة بشكل موحد ولا توجد قطع أثرية لتسجيل فاصل زمني طويل. سجل 10-15 إطارا عند 0.1-0.2 هرتز قبل إضافة الميوسين وأوقف التسجيل مؤقتا. ماصة خارج الحجم المطلوب من العضلات المعاد تدويرها myosin-II من قارورة المخزون مع طرف ماصة حادة النهاية (لمنع قص خيوط الميوسين) وإضافتها إلى أنبوب PCR نظيف.
- أضف على الفور 1x KMEH إلى الأنبوب لجعل الحجم >20 ميكرولتر واخلطه برفق. يمكن للمرء أيضا إضافة ATP ، مزيج تجديد ATP ، عوامل تثبيت الصورة ، إلخ. خلال هذه الخطوة. قم بإزالة حجم متساو من المخزن المؤقت بعناية من غرفة العينة المركبة دون إزعاجه.
- أضف محلول الميوسين برفق إلى حجرة العينة. لا تقم بماصة لأعلى ولأسفل لأنها ستزعج الخيوط المرتبطة بالسطح. استأنف على الفور تسجيل الفاصل الزمني وراقب النظام أثناء تطوره من حالة ما قبل الميوسين إلى تدفقات الأكتو-ميوسين المقلص التي تغذيها ATP وتشكيل النجم إلى حالة انحشار مستنفدة ل ATP (انظر النتائج التمثيلية).
- التقط صورا خلفية لجميع القنوات باستخدام عينة عازلة فقط. احفظ جميع الصور كملفات .tiff 16 بت. انظر الجدول 2 للحصول على نصائح لحل المشاكل الشائعة.

الشكل 3: تقييم جودة الطبقات الثنائية مع فحص FRAP السريع. الطبقات الثنائية الدهنية المدعومة (SLBs) المحضرة من دهون DOPC و Ni-NTA (98: 2 مول٪) مغلفة برابط غشاء أكتين ذو علامة HYE (10xHis-YFP). بعد غسل البروتين غير المنضم ، يتم تصوير الطبقة المزدوجة الفلورية تحت مجهر TIRF. يتم تبييض منطقة صغيرة على الطبقة المزدوجة بقوة ليزر عالية ، ويتم تسجيل استعادة التألق. (أ) تتعافى الطبقة الثنائية الجيدة دائما بسرعة ، مع معامل انتشار متوقع من 1-1.5 μm2 / s لتكوين الدهون المستخدم في هذه الحالة. (ب) تتعافى الطبقات الثنائية السيئة ببطء شديد أو لا تتعافى على الإطلاق. (ج) صور تمثيلية للطبقات الثنائية السيئة: (C-i) طبقة ثنائية بها ثقوب ، (C-ii) طبقة ثنائية ذات بقع دهنية كبيرة غير متحركة ، و (C-iii) طبقة ثنائية ذات نقاط صغيرة غير متحركة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
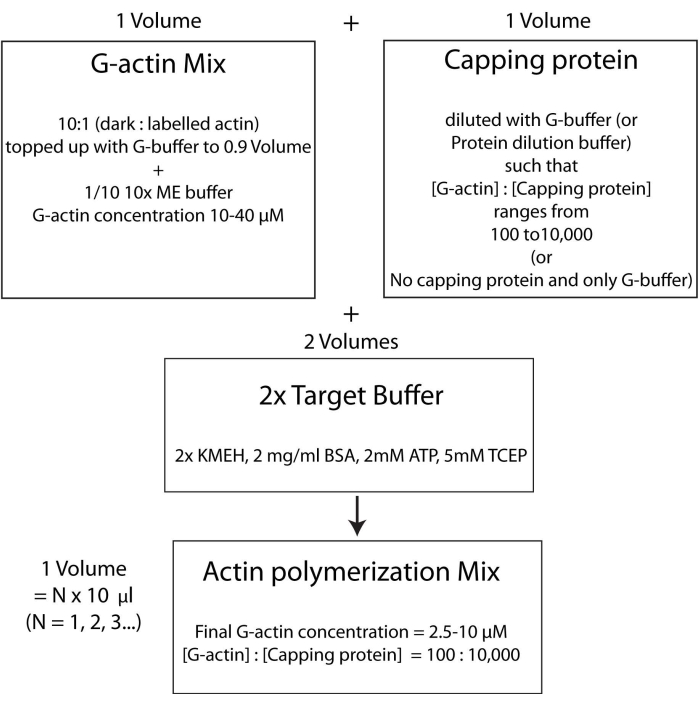
الشكل 4: رسم تخطيطي يوضح كيفية بلمرة الأكتين باستخدام طريقة المخزن المؤقت المستهدف. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5: التنظيم المكاني ل HYE عند الارتباط ب F-actin. لقطات TIRF تظهر التنظيم المكاني ل HYE قبل وبعد إضافة خيوط الأكتين (المسمى Atto-635 maleimide). تكون منظمة HYE متجانسة قبل إضافة F-actin وتصبح موضعية ومحاذاة على طول خيوط الأكتين. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
3. تحليل البيانات
- باستخدام برنامج فيجي (https://imagej.net) ، اطرح الخلفية من صور بروتين الرابط (من الخطوة 2.4.). قم بقياس متوسط قيم الشدة من البقعة المبيضة والمنطقة المرجعية.
- قم بتطبيع آثار الوقت من البقعة المبيضة والمنطقة المرجعية لشدة قيم شدة ما قبل التبييض الخاصة بكل منها. قسم كل نقطة زمنية في قيم المنطقة المبيضة التي تمت تسويتها على النقاط الزمنية المعنية في تتبع وقت المنطقة المرجعية التي تمت تسويتها. قم بتصحيح تتبع الوقت الطبيعي الناتج للخلفية ولأي تقلبات منهجية في الشدة أثناء الاستحواذ (التبييض الضوئي العالمي ، الانجراف z ، إلخ).
- استخدم طريقة يدوية خالية من التركيب28 لتقدير معامل الانتشار للبروتينات المربوطة ثنائية الطبقة. باختصار ، يمكن حساب نصف وقت ملف تعريف الاسترداد ، τ1/2 ، من خلال النظر إلى الوقت الذي يصل فيه ملف تعريف الاسترداد الطبيعي إلى نصف حالته المستقرة:
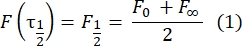
هنا ، F 0 هو متوسط الكثافة في المنطقة المبيضة في الإطار الأول بعد التبييض الضوئي ، و F∞ هي قيمة الحالة الثابتة طويلة المدى لاستعادة الطبقة المزدوجة. - تقدير نصف قطر التبييض الفعال ، re ، معلمة تصحح الانتشار أثناء التبييض الضوئي ، من مسح خطي لملف تعريف بقعة التبييضبعد 29. نصف العرض عند نصف الحد الأدنى من مسح الخط هذا الذي يمر عبر مركز بقعة التبييض ، r 1/2 ، يتعلق ب re على النحو التالي:
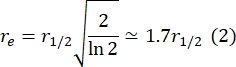
يتم استخدام τ1/2 المحسوب في الخطوة 2.8.3 ، r e المحسوب في الخطوة 2.8.4 ، ونصف قطر التبييض المحدد أصلا ، rn ، لحساب معامل الانتشار (D) باستخدام الصيغة التالية: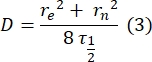
- استخدم طريقة يدوية خالية من التركيب28 لتقدير معامل الانتشار للبروتينات المربوطة ثنائية الطبقة. باختصار ، يمكن حساب نصف وقت ملف تعريف الاسترداد ، τ1/2 ، من خلال النظر إلى الوقت الذي يصل فيه ملف تعريف الاسترداد الطبيعي إلى نصف حالته المستقرة:
- تحليل صورة زهور النجمة أكتوميوسين
- باستخدام فيجي ، اطرح الخلفية من جميع الصور المسجلة في جميع القنوات. صحح الصور بحثا عن أي إضاءة غير منتظمة أو نمط تداخل باستخدام تصحيح المجال المسطح.
ملاحظة: يمكن للمرء استخدام الشرائح البلاستيكية الملونة ، وهي عينات مسطحة جيدة للقيام بمثل هذه التصحيحات. بالنسبة لبروتين الرابط وخيوط الأكتين على طبقة ثنائية مستوية ، يمكن للمرء أيضا استخدام متوسط إسقاط صور متعددة لما قبل الميوسين لإنشاء خرائط تصحيح إضاءة خاصة بالقناة.- بالنسبة لقناة HYE ، الموضحة هنا ، خذ إسقاطا متوسط الكثافة لصور HYE متعددة (مسجلة من مناطق مختلفة من طبقة الدهون المزدوجة قبل إضافة الميوسين). قم بتطبيق مرشح غاوسي مناسب (σ = 50 بكسل إلى 80 بكسل) على متوسط الإسقاط (من صور ما قبل الميوسين أو أي عينة مسطحة قياسية).
- تحويل الصورة التي تمت تصفيتها إلى صورة 32 بت. قسم كل قيم البكسل على متوسط الصورة بأكملها. سيعطي هذا خريطة تصحيح طبيعية لقناة HYE. قسم جميع الصور في قناة HYE باستخدام هذه الخريطة لتصحيح المجال المسطح. إنشاء خرائط تصحيح للقنوات الأخرى باستخدام نفس الاستراتيجية.
- صحيح للتبييض الضوئي باستخدام طريقة النسبة الأسية أو البسيطة (اعتمادا على ملف اضمحلال الشدة) في فيجي.
- لتصحيح أي اختلال زمني x-y (حركة متعدية) ، ادمج جميع القنوات المصححة بالتبييض الضوئي في Hyperstack واحد. باستخدام المكون الإضافي Hyperstack-Reg في فيجي ، قم بتطبيق تحويل الجسم الصلب أو الترجمة.
- أخيرا ، قم بتقسيم Hyperstack المحاذي إلى قنوات فردية واحفظها بشكل منفصل كمكدسات TIFF 16 بت لمزيد من التحليل.
- باستخدام فيجي ، اطرح الخلفية من جميع الصور المسجلة في جميع القنوات. صحح الصور بحثا عن أي إضاءة غير منتظمة أو نمط تداخل باستخدام تصحيح المجال المسطح.
النتائج
للتمثيل ، هنا يتم عرض ملف تعريف postbleach نموذجي من الصورة الأولى بعد التبييض الضوئي (الصورة عند t = 0 s في الشكل 3A) وملاءمتها للوظيفة التالية28 (انظر الشكل 6A):

قيمة r e (23.94 μm) المحسوبة بواسطة ملاءمة هذا المنحنى تشبه إلى حد كبير قيمة r e المحسوبة في الخطوة 2.8.4. (23.24 ميكرومتر). هنا ، K هي معلمة عمق التبييض التي يمكن تقديرها مباشرة من F0 (الموضحة في الخطوة 2.8.4.). وبالمثل ، يوضح الشكل 6B ملف تعريف الاسترداد وملاءمته للوظيفة التالية28:
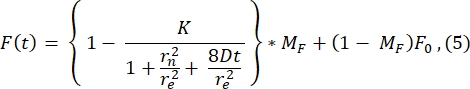
نجد أن القيمة الملائمة لمعامل الانتشار هي 1.34 ميكرومتر 2 / ثانية ، وهي قيمة تتفق تماما مع قيمة 1.39 ميكرومتر 2 / ثانية التي يتم حسابها بواسطة الصيغة في الخطوة2.8.4. هنا ، يرمز MF إلى الجزء المتحرك من طبقة الدهون المزدوجة التي تمثل جزء السكان المبيضين الذين يتعافون مرة أخرى. تعتمد حركة الجزيئات المثبتة على الدهون ، بالطبع ، على تكوين الدهون وحالتها الفيزيائية (المرحلة السائلة أو الهلامية). بالنسبة لتجاربنا باستخدام الأغشية الدهنية القائمة على DOPC ، يجب أن تكون الحركة >1 ميكرومتر2 / ثانية ، ويجب ألا يقل الكسر المتحرك عن 0.9 للإشارة إلى طبقة ثنائية دهنية جيدة. نوصي باستخدام الطريقة اليدوية الخالية من التركيب لإجراء اختبار سريع لجودة وتنقل الطبقة المزدوجة. يمكن أن تكون طريقة التركيب مفيدة أثناء أتمتة التحليل للعديد من منحنيات FRAP. علاوة على ذلك ، إذا أراد المرء إجراء تجربة FRAP أكثر تعقيدا لتوصيف الانتشار في النظام بشكل منهجي ، فإننا نوصي القارئ بهذه المراجعة من Lorén et al.30 لمزيد من التفاصيل حول نماذج التركيب والمزالق المحتملة في التصميم التجريبي.

الشكل 6: تحديد معامل الانتشار للطبقات الدهنية المزدوجة. (أ) ملف تعريف الخط للصورة الأولى بعد التبييض الضوئي (t = 0 s في الشكل 3A) وملاءمته للمعادلة 4 لحساب نصف قطر التبييض الفعال. (ب) ملف تعريف الاسترداد للمنطقة المبيضة وملاءمتها للمعادلة 5 لحساب معامل الانتشار والكسر المتحرك. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
تم تصوير نتيجة نموذجية للتجارب الموصوفة أعلاه والتي توضح التجميع والتنظيم الديناميكي لشبكة acto-myosin المرتبطة بطبقة ثنائية دهنية مدعومة تم تصويرها بواسطة مجهر TIRF في الشكل 7 والفيديو التكميلي S1.
يوضح الشكل 7 مونتاج صورة لبروتين الرابط F-actin والميوسين-II.
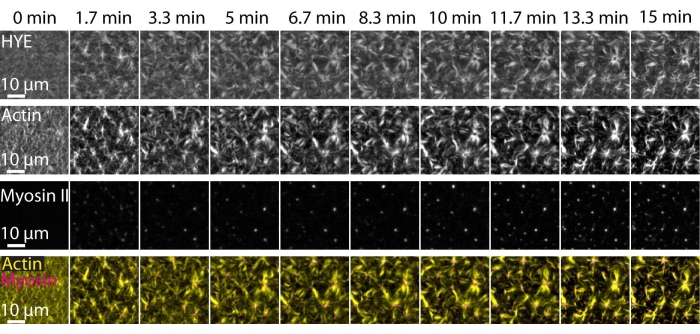
الشكل 7: تؤدي تدفقات الأكتوميوسين المقلصصة إلى التجمع المحلي لبروتين رابط الأكتين الغشائي HYE. لقطات TIRF من HYE (موسومة YFP) ، وخيوط الأكتين (المسمى Atto-635 maleimide) ، وخيوط الميوسين II (المسمى Atto-565 maleimde) عند إضافة الميوسين II إلى SLB الذي يحتوي على HYE و F-actin. يشار إلى الوقت في الأعلى: 0 دقيقة مباشرة قبل أن تبدأ خيوط العضلات الفلورية في الظهور في حقل TIRF. يتم توزيع HYE و F-actin بشكل متجانس على طبقة الدهون المزدوجة قبل إضافة الميوسين (0 دقيقة). يحفز نشاط الميوسين تدفقات الأكتوميوسين المقلصة، والتي تظهر في هياكل تشبه النجمة في الحالة المستقرة (15 دقيقة)، مما يؤدي إلى التجمع المحلي لمكون الغشاء المقترن (HYE). الصف السفلي هو دمج صور الأكتين (الأصفر) والميوسين الثاني (الأرجواني) التي توضح تنظيم الأكتين والميوسين في نقاط زمنية مختلفة. تم تصحيح الصور المستخدمة في صنع هذه المونتاج في فيجي لإشارة الخلفية وأنماط الكثافة غير الموحدة والحركة الانتقالية. شريط المقياس = 10 ميكرومتر. للحصول على التفاصيل، راجع الفيديو التكميلي S1. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
| اسم المخزن المؤقت | تكوين | |
| المخزن المؤقت للإماهة الدهنية | 50 ملي مل HEPES ، 150 ملي مل كلوريد الصوديوم ، 5٪ سكروز ، درجة حموضة 7.5 | |
| العازلة تشكيل SLB | 50 مللي مول HEPES ، 150 مللي متر كلوريد الصوديوم ، درجة الحموضة 5-6 | |
| مخزن تخزين SLB | 50 مللي مول HEPES ، 150 مللي مول كلوريد الصوديوم ، درجة الحموضة 7.2 | |
| عازلة تخفيف البروتين | 20 مللي متر HEPES ، 100 مللي متر KCl ، 1 مللي متر TCEP أو DTT ، درجة الحموضة 7.2 | |
| 1X ME أو أكتين التبادل الأيوني العازلة | 50 مللي متر MgCl2 ، 0.2 مللي متر EGTA ، 10 مللي متر HEPES ، درجة الحموضة 7.2 (يحفظ في 4 درجات مئوية) | |
| 1X KMEH أو العازلة بلمرة الأكتين | 50 مللي مول KCl ، 1 مللي مول MgCl2 ، 1 مللي متر EGTA ، 50 مللي متر HEPES ، درجة الحموضة 7.2 | |
| 100 مللي متر ATP الأسهم | 100 مليمول ATP ملح ثنائي الصوديوم ، 50 مللي مول تريس ، 50 مللي مول كلوريد الصوديوم ، 5 مللي مول MgCl2 ، 2 مللي مول EGTA ، درجة الحموضة 7.5 (يحفظ في -20 درجة مئوية) | |
| 2x المخزن المؤقت الهدف | 2x KMEH ، 2 مجم / مل BSA ، 2 مللي متر ATP ، 5 مللي متر TCEP (مخزن في 4 درجات مئوية) | |
| G-عازلة | 2 مللي متر تريس ، 0.1 مللي مول CaCl2 ، 0.2 مللي متر ATP ، 0.5 مللي متر TCEP ، 0.04٪ NaN3 ، درجة الحموضة 8 (يخزن في 4 درجات مئوية) | |
| ميوسين II العازلة | 500 مللي مول KCl ، 1 مللي متر EDTA ، 10-20 مللي متر Hepes ، درجة الحموضة 7.0 | |
| العازلة اللوني الترشيح هلام | 50 مللي مول Tris-HCl ، 150-300 مللي مول كلوريد الصوديوم ، 5 مللي متر TCEP ، 0.1٪ توين -20 ، درجة الحموضة 7.5 | |
| سد البروتين تخزين العازلة | 10 مللي متر تريس· Cl ، 50 ملي مول كلوريد الصوديوم ، 1 مللي متر TCEP ، درجة الحموضة 7.5 ، 20٪ الجلسرين | |
الجدول 1: قائمة تركيبات المخزن المؤقت المستخدمة في هذا البروتوكول.
| المشاكل الشائعة وحل المشكلات وإصلاحها | مشكلة | سبب | الحلول الممكنة | ||||||
| 1 | طبقة الدهون المزدوجة لا تظهر أي انتشار | السبب الأكثر احتمالا لهذه المشكلة هو الغطاء الزجاجي المتسخ الذي يمكن أن يحدث عندما يكون عمر محلول التنظيف أو لم يحدث التسخين أثناء صوتنة الحمام. هذه الطبقات المزدوجة لها مظهر "حويصلي" لأن الحويصلات المتفجرة تلتصق بغطاء الزجاج ولكنها لا تندمج مع بعضها البعض. يمكن أن يؤدي استخدام سيارات الدفع الرباعي الأقدم من 6 أسابيع أو سيارات الدفع الرباعي التي يزيد عمرها عن 6 أيام ، أو إضافة كميات منخفضة من سيارات الدفع الرباعي أيضا إلى تكوين طبقة ثنائية الحويصلي. | استخدم محلول تنظيف جديد. تأكد من تشغيل السخان وأن درجة الحرارة تتراوح بين 45-65 درجة مئوية. استخدم خلطات الدهون الطازجة. (يمكن أن يظهر استخدام مسبار الدهون الفلورية مقابل مسبار البروتين الفلوري في بعض الأحيان بشكل مختلف. على سبيل المثال ، إذا كانت الطبقة المزدوجة بها عيوب في الحيود الفرعي وتم تخطي خطوة التخميل السطحي (أو لا تعمل) ، فسيظهر مسبار الدهون توزيعا موحدا للكثافة ولكن قد يعرض مسبار البروتين الفلوري بقعا فلورية ساطعة.) | ||||||
| 2 | طبقة ثنائية الدهون لها بقع مشرقة | يمكن أن يؤدي الحضانة الطويلة لسيارات الدفع الرباعي لتشكيل طبقة ثنائية إلى إنشاء طبقة ثنائية دهنية منتشرة بشكل عام ولكن مع بقع ساطعة في بعض الأحيان. يمكن أن تكون هذه البقع طبقات ثنائية متعددة الطبقات يمكنها جذب كميات كبيرة من مسبار الفلورسنت. | 15-20 دقيقة الحضانة مع سيارات الدفع الرباعي يكفي. تأكد من أن المسبار لا يتجمع: يمكن أن يؤدي الدوران الصلب السريع لبروتين الرابط (300 × جم لمدة 15 دقيقة عند 4 درجات مئوية) إلى إزالة الركام | ||||||
| 3 | طبقة ثنائية الدهون بها ثقوب داكنة | يحدث هذا عندما تكون الطبقة المزدوجة مصنوعة من سيارات الدفع الرباعي القديمة ويتم تصويرها لساعات طويلة (> 4 ساعات بعد التكوين) ، أو يتغير الرقم الهيدروجيني للمحلول بشكل كبير بسبب التصوير المطول (على سبيل المثال ، في حالة ATP العالية وفي وجود بعض كاسحات الأكسجين) ، أو عندما يتم تخميل السطح بشكل مفرط باستخدام بيتا كازين (إضافة الكثير من بيتا كازين لأكثر من 10-15 دقيقة أو عدم غسله). | استخدم الدهون الطازجة. تقليل معدل إطار التصوير أو وقت إضاءة الليزر الفعال. استخدم المخازن المؤقتة ذات سعة التخزين المؤقت الأعلى. | ||||||
| 4 | تظهر طبقة الدهون المزدوجة انتشارا بطيئا | تنتشر طبقات الدهون الثنائية التي تحتوي على نسبة عالية من الكوليسترول أو الدهون المشبعة الطويلة أو الدهون المشحونة بشكل أبطأ. | في مثل هذه الحالات ، قم بإعداد عينتك عند درجة حرارة عالية. يمكن للمرء أيضا استخدام تركيبة دهنية بسيطة ومختبرة كعنصر تحكم جنبا إلى جنب مع تركيبات الدهون المعقدة وغير المختبرة. تأكد من نظافة الزجاج. | ||||||
| 5 | الأكتين لا يتبلمر | المخزن المؤقت المستهدف قديم ، مخزون G-actin قديم جدا ، قديم وجديد تم بلمرة G-actin. | تأكد من استبدال Ca 2+ ب Mg2+ قبل البلمرة (باستخدام ME buffer). استخدم مرق ATP-Mg2+ الطازج. استخدم G-actin المعاد تدويره حديثا. تأكد من أن تركيز F-actin (من حيث G-actin) المضاف إلى الطبقة الثنائية أعلى من 0.2 ميكرومتر. لتركيزات أقل، استخدم F-actin المستقر بالقضيبين. | ||||||
| 6 | الأكتين لا يرتبط بالطبقة المزدوجة | لا يتم إضافة رابط غشاء الأكتين أو إضافته بتركيز منخفض جدا - يمكن الاستدلال على ذلك من مضان بروتين الرابط. إذا كان التألق لائقا ، فقد رابط الأكتين الغشائي قدرة ربط الأكتين. أيضا ، إذا كان بروتين الرابط غير مرتبط بشكل خاص بالسطح الزجاجي (عندما تكون الطبقة المزدوجة سيئة) ، فقد لا يقوم بتجنيد خيوط الأكتين. | تأكد من انتشار الطبقة المزدوجة. استخدم بروتين رابط طازج | ||||||
| 7 | إشارة F-actin الفلورية ضعيفة | نسبة المسمى إلى الأكتين الداكن منخفضة للغاية. إما أن الأكتين المسمى أو الأكتين غير المسمى قديم جدا ولا يتبلمران مع بعضهما البعض. | أعد تدوير الأكتين مرة أخرى ، وأعد محاولة الخداع باستخدام الأكتين المعاد تدويره حديثا. يمكن أن يؤدي التلف الضوئي إلى تدمير أو إزالة بلمرة F-actin ؛ إذا أمكن ، استخدم أصباغ حمراء أو حمراء بعيدة للأكتين (والميوسين). | ||||||
| 8 | الميوسين لا يظهر انقباض | يمكن ملاحظة أنه بعد إضافة ATP إلى النظام المشبع بالميوسين ، لا يوجد انقباض في acto-myosin. | تحقق مما إذا كان تركيز الميوسين أو مستوى النقاء جيدا. استخدم الميوسين المعاد تدويره حديثا (استخدم في غضون 6 أسابيع بعد إعادة التدوير). يمكن أن تساعد إضافة ATP الطازج إلى مزيج الميوسين. مخازن إزالة الغازات واستخدام كاسحات الأكسجين وما إلى ذلك. يمكن أن تقلل من التلف الضوئي للمحركات. يمكن العثور على مزيد من المعلومات في البروتوكولات التي كتبها Plastino et al. أو Stam et al. من نفس مجموعة الأساليب | ||||||
| 9 | زجاج الغلاف ليس محبا للماء | لا يتم تنظيف زجاج الغطاء بشكل صحيح. | يعد الغطاء النظيف المائي أمرا بالغ الأهمية لتشكيل طبقة الدهون المزدوجة. قراءة مرئية مفيدة لمحبة الماء للغطاء بعد بروتوكول التنظيف هي مراقبة ترطيب الزجاج بالماء. أضف كمية صغيرة من الماء إلى غطاء مسطح. سيبقى الماء على شكل قطرة مستديرة إذا لم يتم تنظيف الغطاء بشكل صحيح. ومع ذلك ، فإن نفس الحجم من الماء سوف ينتشر ويشكل طبقة رقيقة ، على غطاء زجاجي معالج بالماء. يمكن استخدام سلوك ترطيب الماء هذا على سطح الغطاء الزجاجي للتأكد مما إذا كانت خطوات التنظيف باستخدام محلول التنظيف / هيدروكسيد الصوديوم قد نجحت. | ||||||
الجدول 2: دليل استكشاف الأخطاء وإصلاحها الذي يلخص المشاكل الشائعة والحلول المقابلة.
الفيديو التكميلي S1: تؤدي تدفقات الأكتوميوسين المقلصصة إلى التجميع المحلي لبروتين رابط الأكتين الغشائي HYE. الفاصل الزمني TIRF ل HYE (YFP-taged) ، وخيوط الأكتين (المسمى Atto-635 maleimide) ، وخيوط الميوسين II (المسمى Atto-565 maleimide) عند إضافة الميوسين II إلى SLB الذي يحتوي على HYE و F-actin. يشار إلى الوقت في الأعلى: 0 دقيقة مباشرة قبل أن تبدأ خيوط العضلات الفلورية في الظهور في حقل TIRF. شريط المقياس = 10 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يقدم هذا البروتوكول منصة متعددة الاستخدامات ونقطة انطلاق لتصميم تجارب لدراسة واجهة القشرة الغشائية للخلايا. تتمثل الخطوات الحاسمة في تحضير شرائح زجاجية نظيفة ، واستخدام الدهون الطازجة لتشكيل سيارات الدفع الرباعي بكفاءة (كلاهما يؤثر على جودة SLBs) ، واستخدام بروتينات الميوسين II المعاد تدويرها حديثا لإعادة تنظيم خيوط الأكتين الديناميكية. عند ديناميكيات التصوير على مدى فترة طويلة ، من المهم جدا دمج نظام زبال الأكسجين (على سبيل المثال ، حمض البروتوكاتيكويك والبروتوكاتيشوات 3 4-ديوكسيجيناز5،31).
يسمح تصميم الغرفة المفتوحة بإضافة المكونات المتسلسلة إلى نظام موجود دون تحفيز تدفقات الدهون. يمكن أن يكون هذا ميزة مهمة على نهج الغرفة المغلقة شائعة الاستخدام أو العمل باستخدام البروتينات المغلفة داخل الجسيمات الشحمية36. لا يمكن دراسة التأثيرات المعاكسة مثل تشوه الغشاء الناجم عن البروتين باستخدام طبقات الدهون المزدوجة الممتزة بالزجاج.
يمكن تشكيل الطبقات الثنائية الدهنية مع مجموعة واسعة من التراكيب الدهنية. يبدأ بامتزاز الحويصلات الدهنية إلى السطح الزجاجي المحب للماء ، يليه إما تمزق الحويصلة التلقائي بسبب تفاعلات الحويصلة السطحية والحويصلة المباشرة أو الحويصلات الممتصة التي تصل إلى تغطية حرجة وبعد ذلك يتمزق جزء صغير من الحويصلات ، ويشكل حوافا نشطة ، مما يؤدي في النهاية إلى تكوين طبقة ثنائية32 . إلى جانب الزجاج ، يمكن استخدام ركائز مختلفة لتشكيل طبقات ثنائية دهنية مدعومة ، مثل الميكا (على سبيل المثال ، للفحص المجهري للقوة الذرية) ، والركائز اللينة (على سبيل المثال ، poly-di-methyl-siloxane) ، وسائد البوليمر33،34،35 ، التي تمتد بين ثقوب شبكات المجهر الإلكتروني 14. تعد الطبقات الثنائية لواجهة القطرة طريقة أخرى مثيرة للاهتمام لإنشاء طبقات ثنائية دهنية مستقرة وقائمة بذاتها36. يعد إدراج شبكات acto-myosin في الحويصلات أو المستحلبات طريقة قوية جدا لدراسة هذا النظام الأدنى في هندسة تشبه الخلية 37,38 ، والتي تم وصفها بالتفصيل في مكان آخر39.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح يعلنونه.
Acknowledgements
تم دعم هذا العمل من قبل صندوق أبحاث أكسا وبرنامج وارويك ويلكوم للطب الحيوي الكمي (Wellcome ISSF ، RMRCB0058) ل DVK ، NCBS-TIFR ل AB و ST ، وزمالة Wellcome-DBT Margdarshi (IA / M / 15/1/502018) ل SM. يود DVK أيضا أن يشكر جمعية الفيزياء الحيوية على تمكين حدث التواصل الافتراضي "التحديات في فهم الشبكات الهيكلية الخلوية متعددة المكونات من الجزيئي إلى النطاق المتوسط" ، مما ساهم في إنشاء مجموعة البروتوكول هذه.
Materials
| Name | Company | Catalog Number | Comments |
| 1,2 dipalmitoyl-sn-glycero-3-phosphoethanolamine-N- (lissamine rhodamine B sulfonyl) | Avanti Polar Lipids | 810158 | 16:0 RhoPE |
| 1,2-dioleoyl-sn-glycero-3- [(N-(5-amino-1 carboxypentyl) iminodiacetic acid) succinyl] (nickel salt) | Avanti Polar Lipids | 790404 | DGS-NTA-Ni2+ |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850375 | DOPC |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850355 | DPPC |
| Amber glass vials | ThermoFisher | B7990-2A | |
| ATP disodium salt | Sigma Aldrich | A26209 | |
| Attofluor cell chamber | ThermoFisher | A7816 | |
| Bath sonicator | GT Sonic | 1860QTS | |
| beta-casein | Sigma Aldrich | C6905 | |
| CaCl2 | ThermoFisher | 12135 | |
| chloroform | Sigma Aldrich | 650471 | alternatively from Electron Microscopy Sciences, 50980296 |
| Cover slips, #1, 25 mm diameter, Gold Seal | Harvard Apparatus | 64-0705B | |
| Cover slips, #1, 40x22 mm, Gold Seal | ThermoFisher | 48404-031 | |
| EDTA | ThermoFisher | G12635 | |
| EGTA | Himedia | MB130 | |
| Gas tight glass syringes, with removebla needle, blunt, volumes 10 µL, 100 µL, 500 µL | Hammilton | 1700 series | |
| Hellmanex III | Hellma Analytics | Z805939 | cleaning solution |
| HEPES | Himedia | RM380 | |
| KaH2PO4 | ThermoFisher | G13405 | |
| KCl | ThermoFisher | G13305 | |
| KOH | ThermoFisher | G26708 | |
| Lipid extruder | Avanti Polar Lipids | 61000-1EA | |
| MgCl2 | ThermoFisher | G15535 | |
| Microtip sonicator | Sonics | VC750 | 3 mm Tip diameter |
| Na2CO3 | ThermoFisher | G15955 | |
| NaCl | Himedia | GRM853 | |
| NaH2PO4 | ThermoFisher | G15825 | |
| NaOH | ThermoFisher | G27815 | |
| Nikon Ti Eclipse TIRF microscope | Nikon | With a TIRF unit connected through a polarization-conserving optical fibre to an Agilent monolithic laser combiner MLC400 with multiple laser lines with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) | |
| NOA88 | Norland Products | 8801 | |
| PTFE Coated Tweezer Style #2A | Structure Probe | 0S2AT-XD | |
| Refrigerated microcentrifuge | Eppendorf | 5424R | |
| Sucrose | ThermoFisher | G15925 | |
| UV-illuminator | Novascan | PSD PRO-UV | needs vacuum and O2 supply |
References
- Köster, D. V., Mayor, S. Cortical actin and the plasma membrane: Inextricably intertwined. Current Opinion in Cell Biology. 38, 81-89 (2016).
- Rao, M., Mayor, S. Active organization of membrane constituents in living cells. Current Opinion in Cell Biology. 29, 126-132 (2014).
- Honigmann, A., et al. A lipid bound actin meshwork organizes liquid phase separation in model membranes. eLife. 3, 01671 (2014).
- Das, A., et al. Stratification relieves constraints from steric hindrance in the generation of compact actomyosin asters at the membrane cortex. Science Advances. 6 (11), (2020).
- Köster, D. V., et al. Actomyosin dynamics drive local membrane component organization in an in vitro active composite layer. Proceedings of the National Academy of Sciences. 113 (12), 1645-1654 (2016).
- Vogel, S. K., Heinemann, F., Chwastek, G., Schwille, P. The design of MACs (minimal actin cortices). Cytoskeleton. 70 (11), 706-717 (2013).
- Murrell, M., Thoresen, T., Gardel, M. Reconstitution of contractile actomyosin arrays. Methods in Enzymology. 540, 265-282 (2014).
- Mosby, L. S., et al. Myosin II filament dynamics in actin networks revealed with interferometric scattering microscopy. Biophysical Journal. 118 (8), 1946-1957 (2020).
- Seara, D. S., et al. Entropy production rate is maximized in non-contractile actomyosin. Nature Communications. 9 (1), 4948 (2018).
- Linsmeier, I., et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7, 12615 (2016).
- Vogel, S. K., Petrasek, Z., Heinemann, F., Schwille, P. Myosin motors fragment and compact membrane-bound actin filaments. eLife. 2, 00116 (2013).
- Ditlev, J. A., et al. A composition-dependent molecular clutch between T cell signaling condensates and actin. eLife. 8, 42695 (2019).
- Banjade, S., Rosen, M. K. Phase transitions of multivalent proteins can promote clustering of membrane receptors. eLife. 3, 04123 (2014).
- Heinemann, F., Vogel, S. K., Schwille, P. Lateral membrane diffusion modulated by a minimal actin cortex. Biophysical Journal. 104 (7), 1465-1475 (2013).
- Vogel, S. K., Greiss, F., Khmelinskaia, A., Schwille, P. Control of lipid domain organization by a biomimetic contractile actomyosin cortex. eLife. 6, 24350 (2017).
- Block, S. Brownian motion at lipid membranes: A comparison of hydrodynamic models describing and experiments quantifying diffusion within lipid bilayers. Biomolecules. 8 (2), 30 (2018).
- JoVE, JoVE Methods Collection. In vitro reconstitution of cytoskeleton networks for biomaterials, biophysics and active matter research. Journal of Visualized Experiments. , (2022).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Enzymology. 85, 164-181 (1982).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Pollard, T. D. Myosin purification and characterization. Methods in Cell Biology. 24, 331-371 (1982).
- JoVE Science Education Database. Separating protein with SDS-PAGE. Journal of Visualized Experiments. , (2022).
- Bieling, P., et al. WH2 and proline-rich domains of WASP-family proteins collaborate to accelerate actin filament elongation. The EMBO Journal. 37 (1), 102-121 (2018).
- Shrivastava, R., Köster, D., Kalme, S., Mayor, S., Neerathilingam, M. Tailor-made ezrin actin binding domain to probe its interaction with actin in-vitro. PLoS One. 10 (4), 0123428 (2015).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5, 5412 (2014).
- Selden, N. S., et al. Chemically programmed cell adhesion with membrane-anchored oligonucleotides. Journal of the American Chemical Society. 134 (2), 765-768 (2012).
- Seu, K. J., et al. Effect of surface treatment on diffusion and domain formation in supported lipid bilayers. Biophysical Journal. 92 (7), 2445-2450 (2007).
- Kang, M., Day, C. A., Kenworthy, A. K., DiBenedetto, E. Simplified equation to extract diffusion coefficients from confocal FRAP data. Traffic. 13 (12), 1589-1600 (2012).
- Kang, M., Day, C. A., Kenworthy, A. K. A novel computational framework for D(t) from Fluorescence Recovery after Photobleaching data reveals various anomalous diffusion types in live cell membranes. Traffic. 20 (11), 867-880 (2019).
- Lorén, N., et al. Fluorescence recovery after photobleaching in material and life sciences: Putting theory into practice. Quarterly Reviews of Biophysics. 48 (3), 323-387 (2015).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (7), 1-7 (2013).
- Andrecka, J., Spillane, K. M., Ortega-Arroyo, J., Kukura, P. Direct observation and control of Supported lipid bilayer formation with interferometric scattering microscopy. ACS Nano. 7 (12), 10662-10670 (2013).
- Lin, W. -. C., et al. Supported membrane formation, characterization, functionalization, and patterning for application in biological science and technology. Current Protocols in Chemical Biology. 2 (4), 235-269 (2010).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: An integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sapuri-Butti, A. R., Butti, R. C., Parikh, A. N. Characterization of supported membranes on topographically patterned polymeric elastomers and their applications to microcontact printing. Langmuir. 23 (25), 12645-12654 (2007).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Bashirzadeh, Y., Moghimianavval, H., Liu, A. P. Encapsulated actomyosin patterns drive cell-like membrane shape changes. iScience. 25 (5), 104236 (2022).
- Bashirzadeh, Y., Wubshet, N., Litschel, T., Schwille, P., Liu, A. P. Rapid encapsulation of reconstituted cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. (177), e63332 (2021).
- Murrell, M., Chen, S., Sun, Z. G. In vitro reconstitution of actin cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved