Method Article
Reconstitución de corticidades mínimas de actina atadas a la membrana en bicapas lipídicas soportadas
En este artículo
Resumen
Este protocolo describe la formación de bicapas lipídicas soportadas y la adición de filamentos citoesqueléticos y proteínas motoras para estudiar la dinámica de las redes citoesqueléticas reconstituidas y atadas a la membrana utilizando microscopía de fluorescencia.
Resumen
La superficie de una célula viva proporciona una plataforma activa versátil para numerosos procesos celulares, que surgen de la interacción de la membrana plasmática con la corteza de actina subyacente. En las últimas décadas, los sistemas mínimos reconstituidos basados en bicapas lipídicas soportadas en combinación con redes de filamentos de actina han demostrado ser muy instrumentales para desentrañar los mecanismos básicos y las consecuencias de las redes de actina atadas a la membrana, así como para estudiar las funciones de las proteínas individuales asociadas a la membrana. Aquí, describimos cómo reconstituir tales sistemas compuestos activos in vitro que consisten en bicapas lipídicas soportadas por fluidos acopladas a través de proteínas de unión a actina asociadas a la membrana a filamentos dinámicos de actina y motores de miosina que se pueden observar fácilmente a través de microscopía de fluorescencia de reflexión interna total. Un diseño de cámara abierta permite ensamblar el sistema paso a paso y controlar sistemáticamente muchos parámetros, como la concentración de proteína enlazadora, la concentración de actina, la longitud del filamento de actina, la relación actina / miosina, así como los niveles de ATP. Finalmente, discutimos cómo controlar la calidad del sistema, cómo detectar y solucionar problemas que ocurren comúnmente y algunas limitaciones de este sistema en comparación con la superficie de la célula viva.
Introducción
La membrana plasmática de una célula animal viva interactúa constantemente con el citoesqueleto de actina adyacente, y juntos forman un material compuesto activo que cumple una multitud de funciones celulares 1,2. Para estudiar los procesos en esta interfaz membrana lipídica-actina, la reconstitución de las redes citoesqueléticas sobre las bicapas lipídicas soportadas (SLB) ha demostrado ser muy útil. Este enfoque de sistema mínimo permite el control preciso de los componentes de la red del citoesqueleto y la composición lipídica. En comparación con las membranas lipídicas independientes de las vesículas unilamelares gigantes, la geometría plana de las SLB permite el uso eficiente de técnicas de microscopía de última generación, como la superresolución3,4, la fluorescencia de reflexión interna total (TIRF)5,6,7 o la dispersión interferométrica 8 Estudiar la organización espacial y la dinámica de las redes citoesqueléticas. TIRF proporciona el mayor contraste para los componentes marcados con fluorescencia, ya que la señal de las moléculas marcadas no unidas en la solución que contribuyen a la señal de fondo es mínima.
Aquí, describimos un protocolo básico para la formación de redes de actomiosina atadas a bicapas lipídicas soportadas, que son ampliamente utilizadas en el campo para estudiar la física de redes activas cuasi-2D 9,10,11 y su efecto sobre la organización de la membrana3,5,12,13,14,15,16 (Figura 1 ). Este enfoque no se limita a las redes basadas en actina, sino que también se puede adaptar fácilmente para explorar microtúbulos, filamentos intermedios o redes compuestas de naturaleza mixta y para estudiar una variedad de interacciones entre las proteínas de la membrana lipídica y los componentes citoesqueléticos utilizando métodos de microscopía sensibles a la superficie.
Para mantener este protocolo enfocado, hemos excluido una descripción detallada de la purificación y etiquetado de proteínas de actina y miosina o detalles sobre cómo ajustar y controlar la contractilidad y organización de las redes de actomiosina. Se debe hacer referencia a otros protocolos que se publican junto con éste en la Colección de Métodos JoVE, Reconstitución in Vitro de Redes de Citoesqueleto para Biomateriales, Biofísica e Investigación de Materia Activa17.

Figura 1: Esquema del sistema compuesto activo actina-membrana in vitro . Creado con Biorender. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Reactivos y equipos
- Prepare los nuevos tampones como se indica en la Tabla 1. Utilice agua ultrapura desionizada con una resistividad de 18,2 MΩ·cm a 25 °C. Esterilice todos los tampones pasándolos a través de filtros de 0,22 μm al vacío. Desgasifica los tampones utilizados para la cromatografía en columna.
- Purificar la actina del músculo esquelético como se describió anteriormente18,19. Agregue glicerol al 20% a la solución final purificada de G-actina y haga alícuotas de 500 μL (para etiquetado o experimentos a granel) y 10 μL (para experimentos individuales) de volumen. Congelar rápidamente las alícuotas sumergiendo los tubos en nitrógeno líquido durante 30 s y luego almacenarlos a -80 °C durante un máximo de 18 meses.
NOTA: Alternativamente, actina purificada o polvo de acetona se puede comprar comercialmente. - Marcar la actina G purificada del músculo esquelético con cualquier colorante fluorescente de maleimida como se describió anteriormente5. Determinar la concentración y el grado de marcaje de la proteína por espectrofotometría utilizando A290nm corregido para actina (εactina = 26.600 M-1 cm-1) y Aλmax del colorante. Hacer alícuotas de 10 μL y congelar rápidamente sumergiendo los tubos en nitrógeno líquido durante 30 s y almacenar a -80 °C durante un máximo de 18 meses.
NOTA: El etiquetado con ésteres NHS conjugados con lisina creará actina no funcional y debe evitarse. - Purificar la miosina II del músculo esquelético siguiendo el protocolo20. Ejecute SDS-PAGE utilizando gel de poliacrilamida al 10% seguido de tinción de Coomassie para determinar el nivel de pureza de la proteína21. Guarde la miosina II del músculo esquelético purificado a -20 °C en forma líquida en tampón de miosina II con 50% de glicerol.
NOTA: La miosina II almacenada se puede utilizar hasta por 2 años. - Marque la miosina-II purificada con cualquier colorante fluorescente de maleimida como se describió anteriormente5. Evite etiquetar los motores de miosina con colorantes NHS-esters. Determinar la concentración y el grado de etiquetado por espectrofotometría utilizando A280nm corregidos de miosina II y Aλmax del colorante. Conservar la miosina II reciclada (oscura o etiquetada) a 4 °C y utilizar en un plazo de 6 semanas.
- Purificación de la proteína de tapado
- Obtener proteína de tapado murino siguiendo un protocolo anterior22. Ejecute SDS-PAGE utilizando gel de poliacrilamida al 10% seguido de tinción de Coomassie para determinar el nivel de pureza de la proteína. Mida la concentración usando A280nm de proteína de taponado (εCP = 99,530 M-1 cm-1).
- Añadir glicerol al 20% a la solución proteica y hacer 5 μL de alícuotas en tubos de PCR de 200 μL. Sumerja los tubos en nitrógeno líquido y guárdelos a -80 °C durante un máximo de 2 años.
NOTA: La actividad de la proteína de recubrimiento se verifica polimerizando cantidades fijas de actina G fluorescente en presencia de diferentes cantidades de proteína de tapado. Los filamentos se visualizan bajo un microscopio y se cuantifica su distribución de longitud. Cuanto mayor sea la concentración relativa de proteína de tapado, más cortas serán las distribuciones de filamentos de actina. Véase Köster et al.5.
- Expresar una proteína enlazadora fluorescente de actina de membrana, por ejemplo, para este protocolo use 10xHis-YFP-EzrinABD (HYE), expresarla en Bl21DE3* Escherichia Coli y purificar como se describió anteriormente23. Determinar la concentración de la proteína por espectrofotometría.
- Conservar la proteína en pequeñas alícuotas en tampón de cromatografía de filtración en gel (o cualquier otro tampón apropiado) con glicerol al 20% a -80 °C. En estas condiciones, la proteína es estable durante más de 2 años.
NOTA: La elección de la proteína enlazadora de actina-membrana y el marcador fluorescente depende del tipo de pregunta que se esté abordando. En los últimos años se ha desarrollado una amplia gama de estrategias de unión de lípidos, incluidas las proteínas24 marcadas con histidina, la biotina-estreptavidina25 y el ADN monocatenario26. - Preparación de vesículas multilamelares (MLV)
NOTA: El flujo de trabajo de MLV a bicapas lipídicas soportadas se muestra en la Figura 2.- Coloque 5-10 viales de vidrio ámbar en un vaso de precipitados de vidrio de 200 ml. Llene el vaso de precipitados con una solución de limpieza al 2%, lo suficiente como para sumergir los viales de vidrio. Sonicarlos en un baño maría durante 30 min a pulso completo y 65 °C.
- Saque los viales de la solución y enjuáguelos bien con agua destilada. Coloque los viales en un vaso de precipitados de vidrio que contenga 2 N NaOH y sonicate durante 20 min. No se requiere calefacción durante este paso.
- Saque los viales de la solución de NaOH y enjuague bien con agua destilada. Secar los viales dentro de una estufa de aire caliente a 65 °C durante 2 h o más.
- Guarde los viales limpios en un vaso de precipitados limpio sellado con película transparente durante un máximo de 6 semanas.
PRECAUCIÓN: Realice los siguientes pasos dentro de una campana extractora de humos químicos. Manipule el cloroformo y las soluciones lipídicas con jeringas de vidrio Hamilton herméticas al gas para evitar la contaminación por plástico. - Enjuague las jeringas Hamilton y algunos viales de vidrio ámbar varias veces con cloroformo puro. Tome el polvo lipídico almacenado en ampollas de vidrio del congelador de -20 °C y agregue volúmenes adecuados de cloroformo para disolver los polvos lipídicos a concentraciones de 10-25 mg / ml.
- Transfiera la solución de la ampolla a un vial de vidrio ámbar recién limpiado y etiquétela adecuadamente. Realice este paso en hielo para reducir la evaporación del cloroformo.
- Hacer una solución madre DOPC con una concentración de 10-25 mg/ml y DGS-NTA-Ni2+ con una concentración de 1-10 mg/ml.
- Para hacer una mezcla de lípidos que funcione, tome un vial de vidrio limpio y enjuáguelo 2 veces con cloroformo. Añadir 300 μL de cloroformo puro al vial para que sirva de base para una mejor mezcla de los componentes. Esto no afectará las concentraciones finales de los lípidos ya que todo el cloroformo se secará en los próximos pasos.
- Agregue volúmenes medidos de soluciones lipídicas madre al vial para hacer las mezclas lipídicas de trabajo deseadas. La concentración lipídica objetivo en el tampón de rehidratación lipídica es de 4 mM. Seque la mezcla lipídica bajo una corriente lenta de gasN2 dentro de la campana química a temperatura ambiente. Este paso puede tardar hasta 30 minutos para cada vial.
- Después de que todo el disolvente se haya secado, desecar al vacío la película lipídica durante >2 h a temperatura ambiente para eliminar cualquier rastro de cloroformo que quede. Resuspender la mezcla lipídica desecada en tampón de rehidratación lipídica para una concentración lipídica final de 4 mM.
- Incubar durante 5-10 min para permitir la rehidratación de los lípidos. Vórtice la solución lipídica durante unos 30 s para formar MLV.
- Hacer 0.5-1 mL alícuotas de los MLV en tubos de microcentrífuga de 1.5 mL. Sumerja los tubos en nitrógeno líquido, selle con una película transparente y guárdelos a -20 °C (hasta 6 semanas).
NOTA: Las concentraciones de reservas de lípidos se eligen para permitir volúmenes suficientemente grandes que permitan un pipeteo fiable utilizando las jeringas de Hamilton. Si los volúmenes necesarios para hacer el caldo son demasiado grandes para disolver el polvo lipídico seco, haga múltiples diluciones del caldo para garantizar la mezcla reproducible de varios lípidos.
- Preparación de pequeñas vesículas unilamelares (SUV)
- Saque una alícuota de MLV del almacenamiento de -20 ° C y descongélela a temperatura ambiente. Congelar rápidamente las vesículas sumergiendo el tubo de microcentrífuga en nitrógeno líquido durante 15-30 s e inmediatamente ponerlo en un baño maría a 45 °C hasta que la solución se haya descongelado completamente (1-2 min). Repita el ciclo de congelación-descongelación anterior 10x-15x hasta que la solución se vea menos turbia.
NOTA: Ajuste la temperatura del baño de agua más alta que la temperatura de transición de la mezcla de lípidos que se está descongelando para permitir una mezcla uniforme de lípidos. - Equilibre una mini extrusora basada en jeringa equipada con una membrana filtrante de policarbonato de 80 nm con tampón de rehidratación SUV. Asegúrese de que no haya fugas o burbujas en el sistema. Mientras que el método de extrusión produce SUV monodispersos con un daño lipídico mínimo, las mezclas lipídicas con carga negativa pueden adherirse a la membrana de policarbonato.
- Pase suavemente la solución lipídica descongelada a través de la extrusora preequilibrada de un lado a otro y luego de regreso. Repita el ciclo 5x-10x hasta que la solución lipídica se vuelva visiblemente clara, lo que indica la formación de SUV con ~100 nm de diámetro.
- Centrifugar la suspensión extruida (o sonicar la solución; ver nota a continuación) a 15.000 x g durante 60 min a 4 °C para granular los restos lipídicos. Recoja el 80% superior de la solución sin alterar el pellet y sin crear burbujas. Transfiera el sobrenadante que contiene los SUV a un tubo de microcentrífuga nuevo y guárdelo en hielo hasta por 6 días.
NOTA: Una alternativa a la centrifugación es la sonicación de la punta realizada de la siguiente manera. Encienda un sonicador de micropunta y configure los siguientes ajustes: Amplitud = 30% del máximo, ON time = 10 s, OFF time = 60 s. Limpie la punta del microsonicador con agua desionizada seguida de 2 N NaOH, cloroformo y nuevamente agua desionizada. Sumerja la punta del sonicador en cada una de estas soluciones y sonice durante 1-2 ciclos utilizando la configuración anterior. Sumerja la punta limpia en la solución de vesícula congelada y descongelada y sonicar durante 3-6 ciclos en hielo hasta que la solución se vuelva clara. - Después de la centrifugación, compruebe si hay signos de alta degradación lipídica o una extrusión lipídica fallida como la formación de una película blanquecina delgada y / o un pellet claramente visible. En estos casos, no continúe y repita los pasos de preparación del SUV nuevamente.
NOTA: La vida útil de los SUV puede diferir para diferentes mezclas de lípidos. Los SUV hechos de DOPC: DGS-NTA-Ni2+ son estables por hasta 6 días para los propósitos de estos experimentos. Los consejos para resolver problemas comunes se pueden encontrar en la Tabla 2.
- Saque una alícuota de MLV del almacenamiento de -20 ° C y descongélela a temperatura ambiente. Congelar rápidamente las vesículas sumergiendo el tubo de microcentrífuga en nitrógeno líquido durante 15-30 s e inmediatamente ponerlo en un baño maría a 45 °C hasta que la solución se haya descongelado completamente (1-2 min). Repita el ciclo de congelación-descongelación anterior 10x-15x hasta que la solución se vea menos turbia.
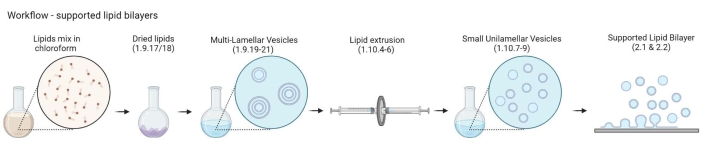
Figura 2: Esquema que muestra el flujo de trabajo desde la preparación de vesículas multilamelares y pequeñas vesículas unilamelares hasta la formación de bicapas lipídicas soportadas. Creado con Biorender. Haga clic aquí para ver una versión más grande de esta figura.
2. Reconstitución de redes de actina atadas a la membrana
- Preparación de cámaras de muestras
- Tome 3-5 cubreobjetos de vidrio rectangulares y colóquelos dentro de un frasco de Coplin. Encienda el sonicador de baño y ajuste la temperatura a 65 °C. Llene el frasco de Coplin con una solución de limpieza al 2% para sumergir completamente los cubreobjetos y colóquelo en el sonicador durante 30 minutos en modo de pulso completo.
- Use pinzas romas recubiertas de PTFE para quitar los cubreobjetos uno por uno del frasco. Enjuáguelos bien con agua destilada y colóquelos en otro frasco de Coplin lleno de 2 N NaOH.
- Sonica los cubreobjetos durante 20 minutos en modo de pulso completo. Retire los cubreobjetos uno por uno, enjuague bien con agua destilada y colóquelos en otro frasco Coplin lleno de agua destilada.
NOTA: Opcionalmente, saonicar los cubreobjetos en agua destilada durante 20 minutos y luego enjuagarlos nuevamente con agua destilada. - Inmediatamente antes de comenzar el experimento, tome el frasco que contiene los cubreobjetos en una campana química equipada con un suministro de gasN2 .
- Optimice la presión de aire de la corriente de gas N2 por ensayo y error para que sea suficiente para desplazar el agua de la superficie del cubreobjetos sin romperla. Alinee el flujo de gasN2 paralelo al plano de cubreobjetos para reducir la posibilidad de romper el cubreobjetos.
- Use guantes y pinzas para quitar los cubreobjetos uno por uno del frasco para secarlos bajo la corriente N2 . Seque ambos lados de cada cubreobjetos y colóquelos en una rejilla de plástico limpia con una cubierta. Coloque la caja con los cubreobjetos en un desecador para evitar el contacto con partículas de polvo en el aire.
NOTA: Los cubreobjetos secados conN2 se pueden almacenar en un desecador donde pueden permanecer hidrófilos hasta por 2 días. Esta estrategia puede ser útil cuando se requieren muchas bicapas para el experimento o si el experimento dura más de 8 h. - Tome tubos de PCR esterilizados en autoclave y corte sus párpados y mitades cónicas inferiores con una cuchilla quirúrgica afilada. Tome los tubos cilíndricos de medio corte uno por uno, aplique adhesivo curable UV en el borde liso de cada tubo cortado y colóquelo invertido en un cubreobjetos recién limpiado de modo que el borde quede plano sobre el cubreobjetos.
- No mueva el cilindro lateralmente una vez que esté colocado en el cubreobjetos para asegurarse de que el pegamento no se derrame en el espacio central de la cámara. Los cubreobjetos rectangulares pueden acomodar cómodamente hasta tres cámaras de reacción, y los redondos pueden acomodar solo una en el centro (Figura 1).
- Coloque los cubreobjetos de la cámara dentro de un limpiador de ozono UV con un suministro deO2 y aspiradora (o use un iluminador UV). Encienda la luz UV e ilumine durante 3-5 minutos para permitir que el adhesivo polimerice. Realice una iluminación más larga (10-15 min) para mejorar la hidrofilicidad del vidrio de la cubierta y, por lo tanto, la calidad de la bicapa lipídica.
- Guarde las cámaras de muestras secas con iluminación UV durante un máximo de 8 h dentro de pequeñas cajas de plástico (como cajas rectangulares vacías) envueltas en una película transparente para reducir el contacto con las partículas de polvo en el aire.
NOTA: Un flujo constante deO2 en presencia de luz UV forma radicales de ozono y oxígeno que pueden eliminar las impurezas orgánicas de la superficie del cubreobjetos. Un vacío evitará la fuga de ozono tóxico que se forma durante el proceso. - Saque los cubreobjetos y pruebe las cámaras para detectar fugas llenándolas con agua destilada. Cada cámara puede contener hasta ~150 μL de muestra. Deseche las cámaras con fugas.
NOTA: Otra opción de limpieza excelente y segura es el limpiador de plasma. Los ajustes de tiempo y potencia dependen del modelo, pero asegúrese de no sobretratar los portaobjetos de vidrio con plasma, ya que esto dará como resultado una reducción de la movilidad lipídica. El tratamiento superficial puede afectar la movilidad de los lípidos27, como se ha observado con el tratamiento prolongado con la solución de limpieza (>45 min) o NaOH (>30 min).
- Preparación de bicapas lipídicas soportadas
- Lave cada cámara con tampón de formación SLB (o 1x PBS) para eliminar cualquier contaminante superficial, dejando 100 μL de tampón al final. Marque el nivel del tampón a 100 μL con un marcador permanente para realizar un seguimiento reproducible de los cambios en el volumen.
- Añadir 2 μL de CaCl2 0,1 M a la cámara. Esto mejora la adsorción de las vesículas a la superficie del vidrio, mejorando la formación de bicapa en el siguiente paso. Añadir 8 μL de la solución SUV (del paso 1.10.) a cada cámara e incubar durante 15 min a 25 °C.
NOTA: El volumen de la mezcla SUV que se agregará se puede estimar calculando el número total de lípidos (con un área promedio de 0.72 nm2) que se necesitan para cubrir completamente el área hidrófila expuesta del pozo con dos capas lipídicas. - Lave las vesículas no unidas con tampón de motilidad de actina (1x KMEH). Primero, retire 50 μL del tampón de formación SLB, dejando solo 50 μL en la cámara de muestra. En segundo lugar, agregue 100 μL de 1x KMEH a la cámara. Mezclar suavemente y luego retirar 100 μL del tampón sin tocar el fondo.
NOTA: Es importante ser suave durante el lavado. Asegúrese de que la punta de la pipeta no toque el fondo de la cámara. Mantenga la pipeta inclinada para dirigir el flujo de amortiguador a la pared de la cámara y no directamente a la bicapa, ya que un flujo directo puede interrumpir la bicapa. Tenga cuidado de no introducir burbujas de aire durante el pipeteo, ya que el aire puede alcanzar la bicapa lipídica y causar defectos en ella. - Repita los lavados 10x añadiendo 100 μL de 1x KMEH y retirando 100 μL.
- Agregue 10 μL de 1 mg/ml de β-caseína a la bicapa, mezcle suavemente e incube durante 5-10 min. La β-caseína bloquea las regiones en el cubreobjetos donde la bicapa no se ha formado. Lave la β-caseína 3x con 1x KMEH como se describe en el paso 2.2.3. y devolver el nivel de tampón a la marca de 100 μL.
- Adición de enlazador de actina de membrana
- Durante la incubación de β-caseína (paso 2.2.5.), extraer una alícuota de proteína enlazadora de actina de membrana de −80 °C, descongelarla rápidamente a 37 °C y, a continuación, mantenerla en hielo. Diluir la alícuota con tampón de dilución de proteínas hasta una concentración de 1 μM.
- Agregue la proteína enlazadora a una concentración final definida (típicamente 5-20 nM) y mezcle suavemente. Para asegurar un equilibrio rápido de la proteína en la cámara, agregue volúmenes mayores de 20 μL premezclando la proteína enlazadora con 1x KMEH.
- Incubar durante 40 min a temperatura ambiente. Lavar 3x con 1x tampón KMEH para eliminar la proteína HSE no unida (como en el paso 2.2.3.). Lleve el nivel de tampón en cada cámara a la marca de 100 μL. El ejemplo ya está listo para la creación de imágenes.
- Evaluación de la calidad de la bicapa lipídica
NOTA: Este es un paso opcional que no tiene que realizarse cada vez. Recomendamos que esta evaluación se realice cada vez que se fabriquen nuevos SUV a partir de existencias MLV congeladas.- Encienda el microscopio, los láseres de excitación y las cámaras de detección. Asegúrese de que el láser esté alineado, que el objetivo se limpie y que el software esté listo para adquirir imágenes.
- Ponga aceite en el objetivo 100x, monte la muestra en la etapa del microscopio y enfoque el objetivo en la bicapa. Asegúrese de que la posición del láser sea tal que sufra una reflexión interna total en la muestra. Utilice un láser de excitación de 488 nm para comprobar la distribución de la intensidad de fluorescencia del 10xHis-YFP-EzrinABD unido a bicapa.
NOTA: Las bicapas de buena calidad muestran una distribución uniforme a gran escala de la intensidad de la fluorescencia. Las bicapas malas muestran manchas fluorescentes intensas e irregulares. - Para determinar la integridad de la bicapa, realice un ensayo FRAP.
- Seleccione una región de interés en la bicapa y grabe algunas imágenes del campo de visión utilizando condiciones de imagen que proporcionan una relación señal-ruido de 5:1 o superior. Pause la grabación y cierre el diafragma de campo del microscopio TIRF para enfocar un rayo láser concentrado en una pequeña región circular de la bicapa para blanquear localmente los fluoróforos.
- Encienda el láser a su salida máxima para fotoblanquear la pequeña región durante 3-10 s y luego apague el láser. Vuelva a abrir el diafragma de campo a su radio original, reaajuste la condición de imagen a la configuración (previa a la lejía) y reanude inmediatamente para registrar la recuperación de la señal fluorescente en el campo de visión.
- Compruebe si la bicapa es fluida. Las bicapas buenas con difusión lateral normal se recuperan rápidamente, mientras que las bicapas malas se recuperan lentamente o no se recuperan en absoluto (Figura 3). Si la bicapa no se está recuperando, compruebe la sección de solución de problemas y reinicie. Guarde las imágenes como archivos TIFF de 16 bits. Para una estimación cuantitativa del coeficiente de difusión, compruebe el paso 3. abajo.
- Polimerización de actina fluorescente
NOTA: Para ahorrar tiempo, comience a polimerizar actina durante el tiempo de incubación de la proteína HSE que se une a la bicapa (paso 2.3.) o durante la evaluación de la calidad de la bicapa (paso 2.4.).- Mezcle la actina G no marcada y la marcada con fluorescencia en una proporción molar de 10:1 y rellénela con G-Buffer para que la concentración de actina G sea de 20 μM. La concentración a la que finalmente se polimeriza la actina será 1/4 de este valor. Agregue 1/10 de tampón ME 10x a la mezcla para obtener una solución 1x e incube durante 2 min. Este paso reemplaza los iones Ca 2+ unidos a la actina G con iones Mg2+. Asegúrese de que el volumen final esté en múltiplos de 10 μL.
- Agregue la cantidad deseada de proteína de tapado de la siguiente manera. Descongele un vial de caldo de proteína tapante rápidamente a 37 °C y luego manténgalo en hielo. Diluir con G-buffer de tal manera que la concentración de proteína de tapado ahora sea el doble de su concentración final deseada en la mezcla de polimerización. Añadir un volumen igual de la solución de proteína de taponado diluida a la mezcla de actina del paso 2.5.1.
- Finalmente, agregue un volumen igual de búfer objetivo 2x fresco a la mezcla de reacción. El volumen final de la solución debe ser cuatro veces el volumen de la mezcla de actina al final de la etapa 2.5.2. Asegúrese de que la concentración final de KMEH sea 1x, de ATP sea de 1 mM, de BSA sea de 1 mg / ml y de G-actina sea de 5 μM.
Incubar en la oscuridad a 25 °C durante 45-60 min para permitir la polimerización.
NOTA: Esto se denomina estrategia de tampón objetivo, en la que se mezcla un volumen de Mg 2+ G-actina (paso 2.5.1.) con un volumen de mezcla de proteína de taponado (paso 2.5.2.) y dos volúmenes de tampón objetivo2x (paso 2.5.3.). Esto hace que sea más fácil aumentar o reducir la cantidad de actina y alterar la concentración relativa de la proteína de tapado (o cualquier otro modulador de actina; Figura 4).
- Adición de filamentos fluorescentes de actina
- Corte algunas puntas de 200 μL con una cuchilla afilada o tijeras para que tengan un extremo romo. Pipetear suavemente el volumen requerido de actina polimerizada de 5 μM (a partir del paso 2.5.3.) con una punta de pipeta roma (para evitar el cizallamiento de los filamentos de actina) y añadirla a un tubo de PCR limpio en autoclave.
- Agregue 1x KMEH al tubo para que el volumen sea >20 μL y mezcle suavemente para evitar el cizallamiento de la actina F. De la cámara de muestra montada, retire un volumen igual del tampón.
- Agregue la solución de actina polimerizada a la cámara y pipetear suavemente hacia arriba y hacia abajo 3 veces sin tocar la bicapa en la parte inferior. Esto permite que los filamentos de actina se distribuyan uniformemente en la bicapa. Monte la muestra en el microscopio TIRF (ver paso 2.4.1. y paso 2.4.2.).
- Se puede registrar el proceso de unión de la actina F a la bicapa. Incubar durante 20-30 min. Grabe algunas imágenes de diferentes campos de visión después de que la adición de F-actina haya alcanzado un estado estable. Observar el cambio en la organización espacial de 10xHis-YFP-EzrinABD antes (homogéneo) y después de la organización de actina.
NOTA: HYE se distribuye uniformemente sobre la bicapa lipídica en ausencia de actina. Tras la adición de filamentos de actina, HYE colocaliza con F-actina. El grado de colocalización depende de la afinidad de unión a actina de la proteína enlazadora; cuanto más fuerte es la afinidad, mayor es la colocalización y más lenta es la movilidad lateral de la proteína enlazadora (Figura 5).
- Adición de miosina II
- Después de 30 minutos de incubación de actina, vuelva a montar la muestra en el microscopio (si no estaba montada). Compruebe la señal en la proteína enlazadora y los canales de actina F. Ajuste las condiciones de imagen si es necesario.
- Seleccione una buena región con señal de proteína enlazadora uniforme y filamentos de actina uniformemente dispersos y sin artefactos para un registro de lapso de tiempo largo. Grabe 10-15 fotogramas a 0.1-0.2 Hz antes de agregar miosina y pause la grabación. Pipetear el volumen requerido de miosina muscular reciclada II del vial madre con una punta de pipeta roma (para evitar el corte de los filamentos de miosina) y añadirla a un tubo de PCR en autoclave limpio.
- Agregue inmediatamente 1x KMEH al tubo para que el volumen sea >20 μL y mezcle suavemente. También se puede agregar ATP, mezcla regeneradora de ATP, agentes fotoestabilizadores, etc. durante este paso. Retire con cuidado un volumen igual del tampón de la cámara de muestras montada sin molestarla.
- Agregue suavemente la solución de miosina a la cámara de muestra. No pipetear hacia arriba y hacia abajo, ya que perturbará los filamentos ligados a la superficie. Reanude inmediatamente el registro de lapso de tiempo y observe el sistema a medida que evoluciona del estado premiosínico a los flujos de actomiosina contráctil alimentados con ATP y la formación de aster a un estado atascado agotado de ATP (ver resultados representativos).
- Tome imágenes de fondo para todos los canales utilizando una muestra de solo búfer. Guarde todas las imágenes como archivos .tiff de 16 bits. Consulte la Tabla 2 para obtener consejos para resolver problemas comunes.

Figura 3: Evaluación de la calidad de las bicapas con ensayo rápido de FRAP. Las bicapas lipídicas soportadas (SLB) preparadas a partir de lípidos DOPC y Ni-NTA (98:2 mol%) están recubiertas con HYE (enlazador de membrana-actina marcado con 10xHis-YFP). Después de lavar la proteína no unida, la bicapa fluorescente se visualiza bajo un microscopio TIRF. Una pequeña región en la bicapa se fotoblanquea con alta potencia láser, y se registra la recuperación de la fluorescencia. (A) Una buena bicapa siempre se recupera rápidamente, con un coeficiente de difusión esperado de 1-1.5 μm2/s para la composición lipídica utilizada en este caso. (B) Las bicapas malas se recuperan muy lentamente o no se recuperan en absoluto. (C) Imágenes representativas de bicapas malas: (C-i) una bicapa con agujeros, (C-ii) una bicapa con parches lipídicos grandes e inmóviles, y (C-iii) una bicapa con puntos pequeños e inmóviles. Haga clic aquí para ver una versión más grande de esta figura.
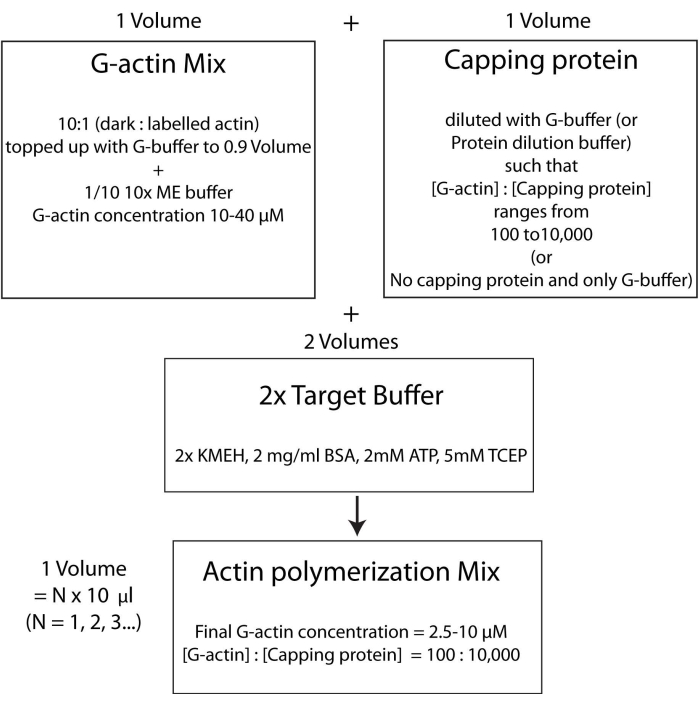
Figura 4: Esquema que muestra cómo polimerizar actina utilizando el método de tampón objetivo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Organización espacial de HYE al unirse a F-actina. Instantáneas TIRF que muestran la organización espacial de HYE antes y después de la adición de filamentos de actina (etiquetados con maleimida Atto-635). La organización HYE es homogénea antes de la adición de F-actina y se vuelve colocalizada y coalineada a lo largo de filamentos de actina. Haga clic aquí para ver una versión más grande de esta figura.
3. Análisis de datos
- Usando el software Fiji (https://imagej.net), reste el fondo de las imágenes de la proteína enlazadora (del paso 2.4.). Mida los valores de intensidad media de la mancha blanqueada y una región de referencia.
- Normalice las trazas de tiempo desde el punto blanqueado y la región de referencia hasta la intensidad de sus respectivos valores de intensidad previos al blanqueador. Divida cada punto de tiempo en los valores de la región blanqueada normalizada por los puntos de tiempo respectivos en la traza de tiempo de la región de referencia normalizada. Corrija la traza de tiempo normalizada resultante para el fondo y para cualquier fluctuación sistemática en la intensidad durante la adquisición (fotoblanqueo global, deriva z, etc.).
- Utilice un método manual sin ajuste28 para estimar el coeficiente de difusión de las proteínas atadas bicapa. Brevemente, la mitad del tiempo del perfil de recuperación, τ1/2, se puede calcular observando el momento en que el perfil de recuperación normalizado alcanza la mitad de su estado estacionario:
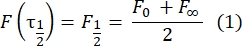
Aquí, F 0 es la intensidad media en la región blanqueada en el primer fotograma después del fotoblanqueo, y F∞ es el valor de estado estacionario a largo plazo de la recuperación de la bicapa. - Estimar el radio efectivo de lejía, re, un parámetro que corrige la difusión durante el fotoblanqueo, a partir de un escaneo lineal del perfil de punto posterior a la lejía29. La mitad del ancho a la mitad como mínimo de este escaneo de línea que pasa por el centro del punto de lejía, r 1/2, se relaciona con re de la siguiente manera:
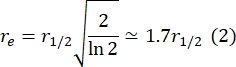
El τ1/2 calculado en el paso 2.8.3., r e calculado en el paso 2.8.4., y el radio de lejía originalmente establecido, rn, se utilizan para calcular el coeficiente de difusión (D) utilizando la siguiente fórmula: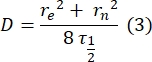
- Utilice un método manual sin ajuste28 para estimar el coeficiente de difusión de las proteínas atadas bicapa. Brevemente, la mitad del tiempo del perfil de recuperación, τ1/2, se puede calcular observando el momento en que el perfil de recuperación normalizado alcanza la mitad de su estado estacionario:
- Análisis de imágenes de ásteres de actomiosina
- Usando Fiji, reste el fondo de todas las imágenes grabadas en todos los canales. Corrija las imágenes para cualquier patrón de iluminación o interferencia no uniforme utilizando la corrección de campo plano.
NOTA: Uno puede usar diapositivas de plástico de colores, que son buenas muestras planas para hacer tales correcciones. Para la proteína enlazadora y los filamentos de actina en una bicapa plana, también se puede usar la proyección promedio de múltiples imágenes de premiosina para crear mapas de corrección de iluminación específicos del canal.- Para el canal HYE, que se muestra aquí, tome una proyección de intensidad promedio de múltiples imágenes HYE (grabadas desde diferentes regiones de la bicapa lipídica antes de la adición de miosina). Aplique un filtro gaussiano apropiado (σ = 50 píxeles a 80 píxeles) a la proyección promedio (de imágenes anteriores a la miosina o cualquier muestra plana estándar).
- Convierta la imagen filtrada en una imagen de 32 bits. Divide todos los valores de píxeles por la media de toda la imagen. Esto dará un mapa de corrección normalizado para el canal HYE. Divida todas las imágenes en el canal HYE con este mapa para la corrección de campo plano. Crear mapas de corrección para otros canales utilizando la misma estrategia.
- Corregir el fotoblanqueo utilizando un método de proporción exponencial o simple (dependiendo del perfil de decaimiento de intensidad) en Fiji.
- Para corregir cualquier desalineación temporal x-y (movimiento de traslación), combine todos los canales corregidos por fotoblanqueo en un solo Hyperstack. Con el complemento Hyperstack-Reg en Fiyi, aplique una transformación de cuerpo rígido o traducción.
- Finalmente, divida el Hyperstack alineado en canales individuales y guárdelos por separado como pilas TIFF de 16 bits para un análisis más detallado.
- Usando Fiji, reste el fondo de todas las imágenes grabadas en todos los canales. Corrija las imágenes para cualquier patrón de iluminación o interferencia no uniforme utilizando la corrección de campo plano.
Resultados
Para la representación, aquí se muestra un perfil típico de postblanqueador de la 1ª imagen después del fotoblanqueo (imagen en t = 0 s en la Figura 3A) y su ajuste a la siguiente función28 (ver Figura 6A):

El valor de r e (23,94 μm) calculado por el ajuste a esta curva es muy similar al re calculado en el paso 2.8.4. (23,24 μm). Aquí, K es un parámetro de profundidad de lejía que se puede estimar directamente a partir de F0 (descrito en el paso 2.8.4.). Del mismo modo, la figura 6B muestra el perfil de recuperación y su ajuste a la siguiente función28:
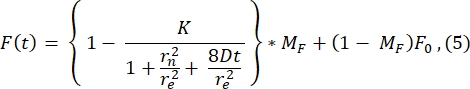
Encontramos que el valor ajustado del coeficiente de difusión es 1.34 μm 2/s, un valor que concuerda estrechamente con el valor de 1.39 μm 2/s que se calcula mediante la fórmula en el paso2.8.4. Aquí, MF representa la fracción móvil de la bicapa lipídica que representa la fracción de la población blanqueada que se recupera. La movilidad de las moléculas ancladas a lípidos depende, por supuesto, de la composición lipídica y su estado físico (fase líquida o gel). Para nuestros experimentos con membranas lipídicas basadas en DOPC, la movilidad debe ser >1 μm2/s, y la fracción móvil no debe ser inferior a 0,9 para indicar una buena bicapa lipídica. Recomendamos el uso del método manual sin ajuste para una prueba rápida de la calidad y movilidad de la bicapa. El método de ajuste puede ser útil al automatizar el análisis para muchas curvas FRAP. Además, si se desea realizar un experimento FRAP más sofisticado para caracterizar sistemáticamente la difusión en el sistema, recomendamos al lector esta revisión de Lorén et al.30 para obtener más detalles sobre el ajuste de modelos y posibles dificultades en el diseño experimental.

Figura 6: Cuantificación del coeficiente de difusión de bicapas lipídicas. (A) Perfil lineal de la primera imagen después del fotoblanqueo (t = 0 s en la Figura 3A) y su ajuste a la ecuación 4 para calcular el radio de lejía efectivo. (B) El perfil de recuperación de la región blanqueada y su ajuste a la ecuación 5 para calcular el coeficiente de difusión y la fracción móvil. Haga clic aquí para ver una versión más grande de esta figura.
Un resultado típico de los experimentos descritos anteriormente que muestra el ensamblaje dinámico y la organización de una red de acto-miosina unida en una bicapa lipídica soportada fotografiada por microscopía TIRF se representa en la Figura 7 y el Video Suplementario S1.
La Figura 7 muestra un montaje de imagen de la proteína enlazadora, F-actina y miosina-II.
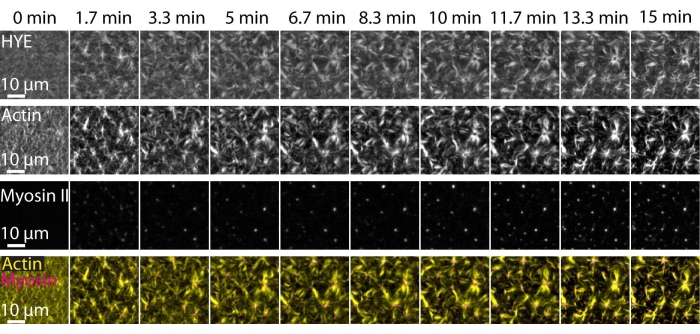
Figura 7: Los flujos contráctiles de actomiosina impulsan la agrupación local de la proteína enlazadora de actina de membrana HYE. Instantáneas TIRF de HYE (marcadas con YFP), filamentos de actina (marcados con maleimida Atto-635) y filamentos de miosina II (marcados con maleimida Atto-565) tras la adición de miosina II a un SLB que contiene HYE y F-actina. El tiempo se indica en la parte superior: 0 min es inmediatamente antes de que los miofilamentos fluorescentes comenzaran a aparecer en el campo TIRF. HYE y F-actina se distribuyen homogéneamente sobre la bicapa lipídica antes de la adición de miosina (0 min). La actividad de la miosina induce flujos contráctiles de actomiosina, que emergen en estructuras similares a aster en el estado estacionario (15 min), impulsando la agrupación local del componente de membrana acoplada (HYE). La fila más baja es una fusión de imágenes de actina (amarillo) y miosina II (magenta) que muestran la organización de actina y miosina en diferentes puntos de tiempo. Las imágenes utilizadas para hacer estos montajes se corrigieron en Fiji para la señal de fondo, los patrones de intensidad no uniformes y el movimiento de traslación. Barra de escala = 10 μm. Para obtener más información, consulte el vídeo complementario S1. Haga clic aquí para ver una versión más grande de esta figura.
| Nombre del búfer | Composición | |
| Tampón de rehidratación lipídica | 50 mM HEPES, 150 mM NaCl, sacarosa al 5%, pH 7.5 | |
| Búfer de formación SLB | 50 mM HEPES, 150 mM NaCl, pH 5-6 | |
| Búfer de almacenamiento SLB | 50 mM HEPES, 150 mM NaCl, pH 7.2 | |
| Tampón de dilución de proteínas | 20 mM HEPES, 100 mM KCl, 1mM TCEP o DTT, pH 7.2 | |
| 1X ME o tampón de intercambio iónico de actina | 50 mM MgCl2, 0,2 mM EGTA, 10 mM HEPES, pH 7,2 (almacenar a 4°C) | |
| 1X KMEH o tampón de polimerización de actina | 50 mM KCl, 1 mM MgCl2, 1 mM EGTA, 50 mM HEPES, pH 7.2 | |
| Stock de ATP de 100 mM | 100 mM de ATP sal disódica, 50 mM de Tris, 50 mM de NaCl, 5 mM de MgCl2, 2 mM de EGTA, pH 7,5 (conservar a -20°C) | |
| 2x Búfer de destino | 2x KMEH, 2 mg/ml BSA, 2mM ATP, 5mM TCEP (almacenado a 4°C) | |
| G-buffer | 2 mM Tris, 0,1 mM CaCl2, 0,2 mM ATP, 0,5 mM TCEP, 0,04 % NaN3, pH 8 (almacenar a 4°C) | |
| Tampón de miosina II | 500 mM KCl, 1 mM EDTA, 10-20 mM Hepes, pH 7.0 | |
| Tampón de cromatografía de filtración en gel | 50 mM Tris-HCl, 150-300 mM NaCl, 5 mM TCEP, 0,1% Tween-20, pH 7.5 | |
| Tapado de proteínas Tampón de almacenamiento | 10 mM Tris· Cl, 50 mM NaCl, 1 mM TCEP, pH 7.5, 20% glicerol | |
Tabla 1: Lista de composiciones de búfer utilizadas en este protocolo.
| Problemas comunes y su solución de problemas | Problema | Causa | Posibles soluciones | ||||||
| 1 | La bicapa lipídica no muestra difusión | La causa más probable de este problema es el vidrio sucio que puede ocurrir cuando la solución de limpieza está envejecida o el calentamiento no tuvo lugar durante la sonicación del baño. Estas bicapas tienen una apariencia "vesicular" porque las vesículas reventadas se adhieren al vidrio de cubierta pero no se fusionan entre sí. El uso de MLV de más de 6 semanas o SUV de más de 6 días, o la adición de cantidades bajas de SUV también puede conducir a la formación de bicapas vesiculares. | Use una solución de limpieza fresca. Asegúrese de que el calentador esté encendido y que la temperatura esté entre 45-65 ° C. Use mezclas de lípidos frescos. (El uso de una sonda de lípidos fluorescentes frente a una sonda de proteína fluorescente a veces puede manifestarse de manera diferente. Por ejemplo, si la bicapa tiene defectos de subdifracción y se omite el paso de pasivación superficial (o no funciona), la sonda lipídica mostrará una distribución de intensidad uniforme, pero la sonda de proteína fluorescente puede mostrar puntos fluorescentes brillantes). | ||||||
| 2 | La bicapa lipídica tiene parches brillantes | La incubación prolongada de SUV para la formación de bicapas puede crear una bicapa lipídica que se difunde en general pero con parches brillantes ocasionales. Estos parches pueden ser bicapas de varias capas que pueden atraer grandes cantidades de sondas fluorescentes. | 15-20 minutos de incubación con SUV es suficiente. Asegúrese de que la sonda no se agrega: un giro rápido y duro de la proteína enlazadora (300 x g durante 15 min a 4 °C) puede eliminar los agregados | ||||||
| 3 | La bicapa lipídica tiene agujeros oscuros | Esto sucede cuando la bicapa está hecha de SUV viejos y se toma una imagen durante horas prolongadas (> 4 horas después de la formación), o el pH de la solución cambia drásticamente debido a imágenes prolongadas (por ejemplo, en el estado de ATP alto y en presencia de ciertos eliminadores de oxígeno), o cuando la superficie está sobrepasivada con beta-caseína (agregando demasiada beta-caseína durante más de 10-15 minutos y o no lavándola). | Use lípidos frescos. Reduzca la velocidad de fotogramas de imagen o el tiempo de iluminación láser efectivo. Utilice búferes con mayor capacidad de almacenamiento en búfer. | ||||||
| 4 | La bicapa lipídica muestra una difusión lenta | Las bicapas lipídicas con alto porcentaje de colesterol, los lípidos saturados largos o los lípidos cargados se difunden más lentamente. | En tales casos, prepare su muestra a alta temperatura. También se puede usar una composición lipídica simple y probada como control junto con composiciones lipídicas complejas y no probadas. Asegúrese de que el vidrio esté limpio. | ||||||
| 5 | La actina no polimeriza | El amortiguador objetivo es viejo, el stock de actina G es demasiado viejo, la actina G vieja y la nueva fueron copolimerizadas. | Asegúrese de que el Ca 2+ se sustituye por Mg2+ antes de la polimerización (utilizando tampón ME). Utilice caldo ATP-Mg2+ fresco. Use G-actina recién reciclada. Asegúrese de que la concentración de actina F (en términos de actina G) añadida a la bicapa sea superior a 0,2 μM. Para concentraciones más bajas, use faloidina estabilizada F-actina. | ||||||
| 6 | La actina no se une a la bicapa | El enlazador de actina de membrana no se agrega ni se agrega a una concentración muy baja; esto se puede inferir de la fluorescencia de la proteína del vinculador. Si la fluorescencia es decente, el enlazador membrana-actina ha perdido capacidad de unión a la actina. Además, si la proteína enlazadora no se une específicamente a la superficie del vidrio (cuando la bicapa es mala), es posible que no reclute filamentos de actina. | Asegúrese de que la bicapa se esté difundiendo. Use proteína enlazadora fresca | ||||||
| 7 | La señal fluorescente de actina F es débil | La proporción de actina marcada a oscura es demasiado baja. La actina marcada o la actina no marcada es demasiado antigua y no se están copolimerizando entre sí. | Recicle la actina de nuevo y vuelva a intentar la ploimerización con actina recién reciclada. El fotodaño puede destruir o despolimerizar la actina F; Si es posible, use tintes rojos o rojos lejanos para la actina (y la miosina). | ||||||
| 8 | La miosina no muestra contractilidad | se puede observar que después de agregar ATP al sistema infundido con miosina, no hay contractilidad de la actomiosina. | Compruebe si la concentración de miosina o el nivel de pureza son buenos. Use miosina recién reciclada (úsela dentro de las 6 semanas posteriores al reciclaje). Agregar ATP fresco a la mezcla de miosina puede ayudar. Desgasificación de tampones y uso de eliminadores de oxígeno, etc. Puede reducir el fotodaño de los motores. Se puede encontrar más información en los protocolos de Plastino et al. o Stam et al. de la misma colección de métodos | ||||||
| 9 | El vidrio de cubierta no es hidrófilo | El vidrio cubierto no se limpia correctamente. | El vidrio de cubierta hidrófilo limpio es crucial para la formación de la bicapa lipídica. Una lectura visual útil de la hidrofilicidad del vidrio de cubierta después del protocolo de limpieza es observar la humectación del vidrio por agua. Agregue un pequeño volumen de agua a un cubreobjetos plano. El agua permanecerá en forma de gota redonda si el cubreobjetos no se limpia adecuadamente. Sin embargo, el mismo volumen de agua se extenderá y formará una capa delgada, sobre un vidrio de cubierta hidrófilo tratado. Este comportamiento humectante del agua en la superficie del vidrio de la cubierta se puede utilizar para determinar si los pasos de limpieza con la solución de limpieza / NaOH han funcionado. | ||||||
Tabla 2: Guía de solución de problemas que resume los problemas comunes y las soluciones correspondientes.
Video complementario S1: Los flujos contráctiles de actomiosina impulsan la agrupación local de la proteína de enlace de actina de membrana HYE. Timelapse TIRF de HYE (marcado con YFP), filamentos de actina (marcados con maleimida Atto-635) y filamentos de miosina II (marcados con maleimida Atto-565) tras la adición de miosina II a un SLB que contiene HYE y F-actina. El tiempo se indica en la parte superior: 0 min es inmediatamente antes de que los miofilamentos fluorescentes comenzaran a aparecer en el campo TIRF. Barra de escala = 10 μm. Haga clic aquí para descargar este archivo.
Discusión
Este protocolo presenta una plataforma versátil y un punto de partida para diseñar experimentos para estudiar la interfaz membrana-corteza de las células. Los pasos críticos son la preparación de portaobjetos de vidrio limpios, el uso de lípidos frescos para la formación eficiente de SUV (ambos afectan la calidad de los SLB) y el uso de proteínas de miosina II recién recicladas para la reorganización dinámica del filamento de actina. Cuando la dinámica de imágenes durante mucho tiempo, es muy importante incorporar un sistema eliminador de oxígeno (por ejemplo, ácido protocatecúico y protocatecuato 3 4-dioxigenasa 5,31).
El diseño de cámara abierta permite la adición secuencial de componentes a un sistema existente sin inducir flujos de lípidos. Esto puede ser una ventaja importante sobre los enfoques de cámara cerrada comúnmente utilizados o el trabajo con proteínas encapsuladas dentro de los liposomas36. Los efectos contrarios, como la deformación de la membrana inducida por proteínas, no se pueden estudiar con bicapas lipídicas adsorbidas en vidrio.
Las bicapas lipídicas se pueden formar con una amplia gama de composiciones lipídicas. Comienza con la adsorción de las vesículas lipídicas a la superficie vítrea hidrófila, seguida de la ruptura espontánea de la vesícula debido a las interacciones superficie-vesícula y vesícula-vesícula directa o las vesículas adsorbidas que alcanzan una cobertura crítica después de la cual una pequeña fracción de vesículas se rompen, formando bordes activos, lo que finalmente conduce a la formación de bicapa32 . Además del vidrio, se pueden usar varios sustratos para formar bicapas lipídicas soportadas, como Mica (por ejemplo, para microscopía de fuerza atómica), sustratos blandos (por ejemplo, poli-di-metil-siloxano), cojines de polímero33,34,35, que se extienden entre agujeros de rejillas de microscopía electrónica 14. Las bicapas de interfaz de gotas son otro método interesante para crear bicapas lipídicas estables e independientes36. La inclusión de redes de actomiosina en vesículas o emulsiones es un método muy poderoso para estudiar este sistema mínimo en una geometría similar a una célula37,38, y que se describe en detalle en otra parte 39.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo fue apoyado por el fondo de investigación AXA y el Programa de Biomedicina Cuantitativa Warwick-Wellcome (Wellcome ISSF, RMRCB0058) para DVK, NCBS-TIFR para AB y ST, y la beca Wellcome-DBT Margdarshi (IA / M / 15/1 / 502018) para SM. DVK también desea agradecer a la Sociedad Biofísica por permitir el evento de redes virtuales "Desafíos en la comprensión de redes citoesqueléticas de componentes múltiples desde la molecular hasta la mesoescala", que contribuyó a la creación de esta colección de protocolos.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,2 dipalmitoyl-sn-glycero-3-phosphoethanolamine-N- (lissamine rhodamine B sulfonyl) | Avanti Polar Lipids | 810158 | 16:0 RhoPE |
| 1,2-dioleoyl-sn-glycero-3- [(N-(5-amino-1 carboxypentyl) iminodiacetic acid) succinyl] (nickel salt) | Avanti Polar Lipids | 790404 | DGS-NTA-Ni2+ |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850375 | DOPC |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850355 | DPPC |
| Amber glass vials | ThermoFisher | B7990-2A | |
| ATP disodium salt | Sigma Aldrich | A26209 | |
| Attofluor cell chamber | ThermoFisher | A7816 | |
| Bath sonicator | GT Sonic | 1860QTS | |
| beta-casein | Sigma Aldrich | C6905 | |
| CaCl2 | ThermoFisher | 12135 | |
| chloroform | Sigma Aldrich | 650471 | alternatively from Electron Microscopy Sciences, 50980296 |
| Cover slips, #1, 25 mm diameter, Gold Seal | Harvard Apparatus | 64-0705B | |
| Cover slips, #1, 40x22 mm, Gold Seal | ThermoFisher | 48404-031 | |
| EDTA | ThermoFisher | G12635 | |
| EGTA | Himedia | MB130 | |
| Gas tight glass syringes, with removebla needle, blunt, volumes 10 µL, 100 µL, 500 µL | Hammilton | 1700 series | |
| Hellmanex III | Hellma Analytics | Z805939 | cleaning solution |
| HEPES | Himedia | RM380 | |
| KaH2PO4 | ThermoFisher | G13405 | |
| KCl | ThermoFisher | G13305 | |
| KOH | ThermoFisher | G26708 | |
| Lipid extruder | Avanti Polar Lipids | 61000-1EA | |
| MgCl2 | ThermoFisher | G15535 | |
| Microtip sonicator | Sonics | VC750 | 3 mm Tip diameter |
| Na2CO3 | ThermoFisher | G15955 | |
| NaCl | Himedia | GRM853 | |
| NaH2PO4 | ThermoFisher | G15825 | |
| NaOH | ThermoFisher | G27815 | |
| Nikon Ti Eclipse TIRF microscope | Nikon | With a TIRF unit connected through a polarization-conserving optical fibre to an Agilent monolithic laser combiner MLC400 with multiple laser lines with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) | |
| NOA88 | Norland Products | 8801 | |
| PTFE Coated Tweezer Style #2A | Structure Probe | 0S2AT-XD | |
| Refrigerated microcentrifuge | Eppendorf | 5424R | |
| Sucrose | ThermoFisher | G15925 | |
| UV-illuminator | Novascan | PSD PRO-UV | needs vacuum and O2 supply |
Referencias
- Köster, D. V., Mayor, S. Cortical actin and the plasma membrane: Inextricably intertwined. Current Opinion in Cell Biology. 38, 81-89 (2016).
- Rao, M., Mayor, S. Active organization of membrane constituents in living cells. Current Opinion in Cell Biology. 29, 126-132 (2014).
- Honigmann, A., et al. A lipid bound actin meshwork organizes liquid phase separation in model membranes. eLife. 3, 01671(2014).
- Das, A., et al. Stratification relieves constraints from steric hindrance in the generation of compact actomyosin asters at the membrane cortex. Science Advances. 6 (11), (2020).
- Köster, D. V., et al. Actomyosin dynamics drive local membrane component organization in an in vitro active composite layer. Proceedings of the National Academy of Sciences. 113 (12), 1645-1654 (2016).
- Vogel, S. K., Heinemann, F., Chwastek, G., Schwille, P. The design of MACs (minimal actin cortices). Cytoskeleton. 70 (11), 706-717 (2013).
- Murrell, M., Thoresen, T., Gardel, M. Reconstitution of contractile actomyosin arrays. Methods in Enzymology. 540, 265-282 (2014).
- Mosby, L. S., et al. Myosin II filament dynamics in actin networks revealed with interferometric scattering microscopy. Biophysical Journal. 118 (8), 1946-1957 (2020).
- Seara, D. S., et al. Entropy production rate is maximized in non-contractile actomyosin. Nature Communications. 9 (1), 4948(2018).
- Linsmeier, I., et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7, 12615(2016).
- Vogel, S. K., Petrasek, Z., Heinemann, F., Schwille, P. Myosin motors fragment and compact membrane-bound actin filaments. eLife. 2, 00116(2013).
- Ditlev, J. A., et al. A composition-dependent molecular clutch between T cell signaling condensates and actin. eLife. 8, 42695(2019).
- Banjade, S., Rosen, M. K. Phase transitions of multivalent proteins can promote clustering of membrane receptors. eLife. 3, 04123(2014).
- Heinemann, F., Vogel, S. K., Schwille, P. Lateral membrane diffusion modulated by a minimal actin cortex. Biophysical Journal. 104 (7), 1465-1475 (2013).
- Vogel, S. K., Greiss, F., Khmelinskaia, A., Schwille, P. Control of lipid domain organization by a biomimetic contractile actomyosin cortex. eLife. 6, 24350(2017).
- Block, S. Brownian motion at lipid membranes: A comparison of hydrodynamic models describing and experiments quantifying diffusion within lipid bilayers. Biomolecules. 8 (2), 30(2018).
- JoVE, JoVE. JoVE Methods Collection. In vitro reconstitution of cytoskeleton networks for biomaterials, biophysics and active matter research. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Enzymology. 85, 164-181 (1982).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Pollard, T. D. Myosin purification and characterization. Methods in Cell Biology. 24, 331-371 (1982).
- JoVE Science Education Database. Separating protein with SDS-PAGE. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Bieling, P., et al. WH2 and proline-rich domains of WASP-family proteins collaborate to accelerate actin filament elongation. The EMBO Journal. 37 (1), 102-121 (2018).
- Shrivastava, R., Köster, D., Kalme, S., Mayor, S., Neerathilingam, M. Tailor-made ezrin actin binding domain to probe its interaction with actin in-vitro. PLoS One. 10 (4), 0123428(2015).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5, 5412(2014).
- Selden, N. S., et al. Chemically programmed cell adhesion with membrane-anchored oligonucleotides. Journal of the American Chemical Society. 134 (2), 765-768 (2012).
- Seu, K. J., et al. Effect of surface treatment on diffusion and domain formation in supported lipid bilayers. Biophysical Journal. 92 (7), 2445-2450 (2007).
- Kang, M., Day, C. A., Kenworthy, A. K., DiBenedetto, E. Simplified equation to extract diffusion coefficients from confocal FRAP data. Traffic. 13 (12), 1589-1600 (2012).
- Kang, M., Day, C. A., Kenworthy, A. K. A novel computational framework for D(t) from Fluorescence Recovery after Photobleaching data reveals various anomalous diffusion types in live cell membranes. Traffic. 20 (11), 867-880 (2019).
- Lorén, N., et al. Fluorescence recovery after photobleaching in material and life sciences: Putting theory into practice. Quarterly Reviews of Biophysics. 48 (3), 323-387 (2015).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (7), 1-7 (2013).
- Andrecka, J., Spillane, K. M., Ortega-Arroyo, J., Kukura, P. Direct observation and control of Supported lipid bilayer formation with interferometric scattering microscopy. ACS Nano. 7 (12), 10662-10670 (2013).
- Lin, W. -C., et al. Supported membrane formation, characterization, functionalization, and patterning for application in biological science and technology. Current Protocols in Chemical Biology. 2 (4), 235-269 (2010).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: An integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sapuri-Butti, A. R., Butti, R. C., Parikh, A. N. Characterization of supported membranes on topographically patterned polymeric elastomers and their applications to microcontact printing. Langmuir. 23 (25), 12645-12654 (2007).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Bashirzadeh, Y., Moghimianavval, H., Liu, A. P. Encapsulated actomyosin patterns drive cell-like membrane shape changes. iScience. 25 (5), 104236(2022).
- Bashirzadeh, Y., Wubshet, N., Litschel, T., Schwille, P., Liu, A. P. Rapid encapsulation of reconstituted cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. (177), e63332(2021).
- Murrell, M., Chen, S., Sun, Z. G. In vitro reconstitution of actin cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. , (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados