Method Article
在支持的脂质双层上重建膜系的最小肌动蛋白皮质
摘要
该协议描述了支持的脂质双层的形成以及细胞骨架丝和运动蛋白的添加,以使用荧光显微镜研究重组,膜系留细胞骨架网络的动力学。
摘要
活细胞的表面为许多细胞过程提供了一个多功能的活性平台,这些过程是由质膜与底层肌动蛋白皮层的相互作用引起的。在过去的几十年中,基于支持的脂质双层与肌动蛋白丝网络相结合的重组最小系统已被证明在揭示膜系链肌动蛋白网络的基本机制和后果以及研究单个膜相关蛋白的功能方面非常有帮助。在这里,我们描述了如何在 体外 重建这种活性复合系统,该系统由流体支持的脂质双层组成,通过膜相关的肌动蛋白结合蛋白偶联到动态肌动蛋白丝和肌球蛋白马达,可以通过全内反射荧光显微镜轻松观察到。开放式腔室设计允许人们逐步组装系统,并系统地控制许多参数,例如接头蛋白浓度、肌动蛋白浓度、肌动蛋白丝长、肌动蛋白/肌球蛋白比率以及 ATP 水平。最后,我们讨论了如何控制系统的质量,如何检测和排除常见问题,以及该系统与活细胞表面相比的一些局限性。
引言
活体动物细胞的质膜不断与相邻的肌动蛋白细胞骨架相互作用,它们共同形成活性复合材料,实现多种细胞功能1,2。为了研究这种脂质膜-肌动蛋白界面的过程,在支持的脂质双层(SLB)之上重建细胞骨架网络已被证明是非常有帮助的。这种最小的系统方法可以精确控制细胞骨架网络成分和脂质组成。与巨型单层囊泡的独立式脂质膜相比,SLB的平面几何形状允许有效使用最先进的显微镜技术,例如超分辨率3,4,全内反射荧光(TIRF)5,6,7或干涉散射8 研究细胞骨架网络的空间组织和动力学。TIRF为荧光标记的组分提供了最高的对比度,因为溶液中未结合的标记分子对背景信号的贡献很小。
在这里,我们描述了一种基本协议,用于形成与支持的脂质双层相连的肌动球蛋白网络,该协议在该领域广泛用于研究活性准2D网络9,10,11的物理学及其对膜组织3,5,12,13,14,15,16的影响(图1).这种方法不仅限于基于肌动蛋白的网络,而且还可以很容易地适应于探索微管、中间丝或混合性质的复合网络,并使用表面敏感的显微镜方法研究脂质膜蛋白和细胞骨架成分之间的各种相互作用。
为了使该协议保持重点,我们排除了对肌动蛋白和肌球蛋白纯化和标记的详细描述,或有关如何调整和控制肌动球蛋白网络的收缩性和组织的详细信息。应该参考与JoVE方法集合,用于生物材料,生物物理学和活性物质研究的细胞骨架网络的体外重建17中发表的其他协议。

图1: 体外 肌动蛋白-膜活性复合体系示意图。 使用生物渲染创建。 请点击此处查看此图的大图。
研究方案
1. 试剂和设备
- 制备新鲜缓冲液,如 表1所示。在25°C下使用电阻率为18.2 MΩ·cm的超纯去离子水。 通过在真空下通过0.22μm过滤器对所有缓冲液进行灭菌。对用于柱色谱的缓冲液进行脱气。
- 如前所述纯化骨骼肌肌动蛋白18,19。向最终纯化的G-肌动蛋白溶液中加入20%甘油,并制成500μL(用于标记或批量实验)和10μL(用于单个实验)体积的等分试样。通过将试管浸入液氮中30秒,然后将其在-80°C下储存长达18个月来快速冷冻等分试样。
注意:或者,纯化的肌动蛋白或丙酮粉末可以通过商业购买。 - 如前所述,用任何荧光马来酰亚胺染料标记纯化的骨骼肌G-肌动蛋白5。使用肌动蛋白的校正A 290nm(εactin =26,600 M-1 cm-1)和染料的Aλmax,通过分光光度法确定蛋白质的浓度和标记程度。制作 10 μL 的等分试样,通过将试管浸入液氮中 30 秒并在 −80 °C 下储存长达 18 个月来快速冷冻。
注意:用赖氨酸偶联的NHS酯标记会产生非功能性肌动蛋白,应避免。 - 按照方案纯化骨骼肌肌球蛋白 II20。使用10%聚丙烯酰胺凝胶运行SDS-PAGE,然后进行考马斯染色以确定蛋白质21的纯度水平。将纯化的骨骼肌肌球蛋白-II以液体形式储存在含有50%甘油的肌球蛋白II缓冲液中。
注意:储存的肌球蛋白II可以使用长达2年。 - 如前所述,用任何荧光马来酰亚胺染料标记纯化的肌球蛋白-II。避免用NHS酯染料标记肌球蛋白马达。使用校正的A280nm 肌球蛋白II和Aλmax 染料通过分光光度法确定标记的浓度和程度。将回收的肌球蛋白II(深色或标记)储存在4°C并在6周内使用。
- 封端蛋白的纯化
- 按照较早的方案获得鼠帽蛋白22。使用10%聚丙烯酰胺凝胶运行SDS-PAGE,然后进行考马斯染色以确定蛋白质的纯度水平。使用A 280nm的封端蛋白(εCP = 99,530 M - 1 cm-1)测量浓度。
- 向蛋白质溶液中加入 20% 甘油,并在 200 μL PCR 管中制备 5 μL 等分试样。将试管放入液氮中,并在-80°C下储存长达2年。
注意:通过在不同加帽蛋白量存在下聚合固定量的荧光G-肌动蛋白来检查加帽蛋白活性。然后在显微镜下对细丝进行成像,并量化其长度分布。封端蛋白的相对浓度越高,肌动蛋白丝分布越短。见Köster等人.5。
- 表达荧光膜 - 肌动蛋白接头蛋白,例如,对于该协议使用10xHis-YFP-EzrinABD(HYE),将其表达在Bl21DE3 * 大肠杆菌中,并如前所述纯化23。通过分光光度法测定蛋白质的浓度。
- 将蛋白质以小等分试样储存在凝胶过滤色谱缓冲液(或任何其他合适的缓冲液)中,20%甘油在-80°C下。 在这些条件下,蛋白质可以稳定保存2年以上。
注意:肌动蛋白-膜接头蛋白和荧光标记物的选择取决于所解决的问题类型。在过去的几年中,已经开发了广泛的脂质连接策略,包括组氨酸标记蛋白24,生物素链霉亲和素25和单链DNA26。 - 多层囊泡(MLV)的制备
注意:从MLV到支持的脂质双层的工作流程如图 2所示。- 将 5-10 个琥珀色玻璃小瓶放入 200 mL 玻璃烧杯中。用 2% 的清洁溶液填充烧杯,刚好足以浸没玻璃小瓶。在全脉冲和65°C的水浴中超声处理30分钟。
- 从溶液中取出小瓶,用蒸馏水彻底冲洗。将小瓶放入含有2N NaOH的玻璃烧杯中并超声处理20分钟。此步骤中不需要加热。
- 从NaOH溶液中取出小瓶,用蒸馏水彻底冲洗。在设置为65°C的热风炉内干燥小瓶2小时或更长时间。
- 将清洁的小瓶存放在用透明薄膜密封的干净烧杯中长达 6 周。
注意:在化学通风橱内执行以下步骤。用气密汉密尔顿玻璃注射器处理氯仿和脂质溶液,以避免塑料污染。 - 用纯氯仿多次冲洗汉密尔顿注射器和一些琥珀色玻璃小瓶。从-20°C冰箱中取出储存在玻璃安瓿中的脂质粉末,并加入足够体积的氯仿以使脂质粉末溶解至10-25mg / mL的浓度。
- 将溶液从安瓿转移到刚清洁的琥珀色玻璃小瓶中并适当标记。在冰上执行此步骤以减少氯仿的蒸发。
- 制备浓度为10-25毫克/毫升的DOPC储备溶液和浓度为1-10毫克/毫升的DGS-NTA-Ni2+ 。
- 要制作有效的脂质混合物,请取一个干净的玻璃小瓶并用氯仿冲洗2次。向小瓶中加入 300 μL 纯氯仿作为基质,以便更好地混合组分。这不会影响脂质的最终浓度,因为所有氯仿将在后续步骤中干燥。
- 将测量体积的原液脂质溶液添加到小瓶中,以制作所需的工作脂质混合物。脂质再水化缓冲液中的目标脂质浓度为4mM。在室温下在化学罩内的N2 气体的缓慢流下干燥脂质混合物。对于每个小瓶,此步骤最多可能需要30分钟。
- 所有溶剂干燥后,在室温下真空干燥脂质膜>2小时,以除去残留的任何痕量氯仿。将干燥的脂质混合物重悬于脂质再水化缓冲液中,最终脂质浓度为4mM。
- 孵育5-10分钟以使脂质重新水化。涡旋脂质溶液约30秒以形成MLV。
- 在 1.5 mL 微量离心管中制备 0.5-1 mL 等分试样的 MLV。将试管浸入液氮中,用透明薄膜密封,并在-20°C下储存(长达6周)。
注意:选择脂质原液浓度以允许足够大的体积,以便使用汉密尔顿注射器进行可靠的移液。如果制作原液所需的体积太大而无法溶解干燥的脂质粉末,请对原液进行多次稀释,以确保各种脂质的可重复混合。
- 小单层囊泡(SUV)的制备
- 从-20°C储存中取出等分试样的MLV,并在室温下解冻。通过将微量离心管置于液氮中15-30秒来快速冷冻囊泡,并立即将其放入设置在45°C的水浴中,直到溶液完全解冻(1-2分钟)。重复上述冻融循环10x-15x,直到溶液看起来不那么浑浊。
注意:将水浴的温度设置为高于正在解冻的脂质混合物的转变温度,以允许均匀的脂质混合。 - 平衡装有 80 nm 孔径聚碳酸酯滤膜和 SUV 补液缓冲液的注射器微型挤出机。确保系统中没有泄漏或气泡。虽然挤出方法产生的单分散SUV具有最小的脂质损伤,但带负电荷的脂质混合物会粘附在聚碳酸酯膜上。
- 轻轻地将解冻的脂质溶液从一侧穿过预平衡的挤出机到另一侧,然后再返回。重复该循环5x-10x,直到脂质溶液变得明显透明,表明形成直径为~100nm的SUV。
- 将挤出的悬浮液(或尖端超声处理溶液;见下面的注释)在4°C下以15,000× g 离心60分钟,以沉淀脂质碎片。收集溶液的前80%,而不会干扰颗粒,也不会产生气泡。将含有SUV的上清液转移到新鲜的微量离心管中,并在冰上储存长达6天。
注意:离心的替代方法是按如下方式执行吸头超声处理。打开微尖端超声仪并设置以下设置:振幅 = 最大值的 30%,导通时间 = 10 秒,关断时间 = 60 秒。用去离子水清洁微超声仪的尖端,然后用2 N NaOH,氯仿和再次去离子水清洁。将超声仪尖端浸入这些溶液中,并使用上述设置进行超声处理 1-2 个循环。将干净的尖端浸入冻融的囊泡溶液中,并在冰上超声处理3-6个循环,直到溶液变清。 - 离心后,检查高脂质降解或脂质挤出失败的迹象,如形成薄的白色薄膜和/或清晰可见的沉淀。在这些情况下,请勿继续并再次重复 SUV 准备步骤。
注意:对于不同的脂质混合物,SUV的保质期可能不同。出于这些实验的目的,由DOPC:DGS-NTA-Ni2+ 制成的SUV可稳定长达6天。表 2 中提供了解决常见问题的提示。
- 从-20°C储存中取出等分试样的MLV,并在室温下解冻。通过将微量离心管置于液氮中15-30秒来快速冷冻囊泡,并立即将其放入设置在45°C的水浴中,直到溶液完全解冻(1-2分钟)。重复上述冻融循环10x-15x,直到溶液看起来不那么浑浊。
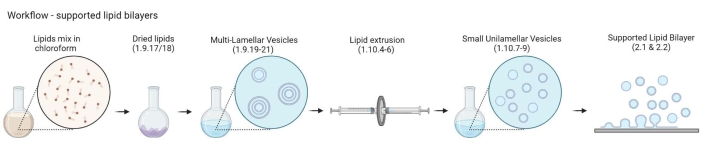
图 2:示意图显示了从制备多层囊泡和小单层囊泡到形成支持的脂质双层的工作流程。 使用生物渲染创建。请点击此处查看此图的大图。
2. 膜系链肌动蛋白网络的重建
- 样品室的制备
- 取3-5个矩形玻璃盖玻片,将它们放入科普林罐中。打开浴超声仪并将温度设置为65°C。 用2%的清洁溶液填充Coplin罐,以完全浸没盖玻片,并将其以全脉冲模式放入超声仪中30分钟。
- 使用钝的PTFE涂层镊子从罐子中逐个取出盖玻片。用蒸馏水彻底冲洗它们,然后将它们放入另一个装有 2 N NaOH 的 Coplin 罐中。
- 在全脉冲模式下超声处理盖玻片20分钟。逐个取出盖玻片,用蒸馏水彻底冲洗,然后放入另一个装满蒸馏水的 Coplin 罐中。
注意:或者,在蒸馏水中超声处理盖玻片20分钟,然后用蒸馏水再次冲洗。 - 在开始实验之前,将装有盖玻片的罐子放在装有N2 气体供应的化学罩中。
- 通过反复试验优化 N2 气流的气压,使其刚好足以从盖玻片表面排出水而不会破坏它。将N2 气体的流动平行于盖玻片平面对齐,以减少破坏盖玻片的可能性。
- 使用手套和镊子从罐子中逐个取出盖玻片,在N2 流下干燥。擦干每个盖玻片的两侧,并将它们放在带盖子的干净塑料网格上。将装有盖玻片的盒子放在干燥器中,以避免与空气中的灰尘颗粒接触。
注意:N 2-干燥的盖玻片可以储存在干燥器中,在那里它们可以保持亲水性长达2天。当实验需要许多双层或实验时间超过8小时时,此策略可能很有用。 - 取高压灭菌的PCR管,用锋利的手术刀片切掉它们的盖子和下锥形的两半。一个接一个地取出圆柱形半切管,在每个切割管的光滑边缘涂上紫外线固化粘合剂,然后将其倒置放在新清洁的盖玻片上,使边缘平放在盖玻片上。
- 一旦将气缸定位在盖玻片上,请勿横向移动,以确保胶水不会溢出到腔室的中心空间。矩形盖玻片最多可容纳三个反应室,圆形盖玻片只能在中心容纳一个反应室(图1)。
- 将腔室盖玻片放入具有O2 供应和真空的UV臭氧清洁剂中(或使用UV照明器)。打开紫外灯并照亮3-5分钟,使粘合剂聚合。执行更长的照明(10-15分钟)以提高盖玻片的亲水性,从而提高脂质双层的质量。
- 将干燥的紫外线照射样品室储存在用透明薄膜包裹的小塑料盒(例如空的矩形盖玻片盒)中长达8小时,以减少与空气中灰尘颗粒的接触。
注意:在紫外光存在下,稳定的O2 流形成臭氧和氧自由基,可以去除盖玻片表面的有机杂质。真空将防止在此过程中形成的有毒臭氧泄漏。 - 取出盖玻片,用蒸馏水填充腔室以测试腔室是否泄漏。每个腔室最多可容纳 ~150 μL 样品。丢弃泄漏的腔室。
注意:另一个出色且安全的清洁选择是等离子清洁器。时间和功率设置取决于型号,但请确保不要用等离子体过度处理载玻片,因为这会导致脂质迁移率降低。表面处理会影响脂质27的迁移率,正如用清洁溶液(>45分钟)或NaOH(>30分钟)长时间处理所观察到的那样。
- 制备支持的脂质双层
- 用SLB形成缓冲液(或1x PBS)清洗每个腔室以去除任何表面污染物,最后留下100 μL缓冲液。用永久性标记标记液液位在100 μL,以重现性地跟踪体积变化。
- 向腔室中加入 2 μL 的 0.1 M CaCl2 。这改善了囊泡对玻璃表面的吸附,增强了下一步中的双层形成。向每个腔室中加入8μL的SUV溶液(来自步骤1.10.),并在25°C下孵育15分钟。
注意:要添加的SUV混合物的体积可以通过计算用两个脂质层完全覆盖孔的暴露亲水区域所需的脂质总数(平均面积为0.72nm2)来估计。 - 用肌动蛋白运动缓冲液(1x KMEH)洗掉未结合的囊泡。首先,取出 50 μL SLB 形成缓冲液,样品室中仅保留 50 μL。其次,向腔室中加入 100 μL 的 1x KMEH。轻轻混合,然后在不接触底部的情况下取出 100 μL 缓冲液。
注意:洗涤时要轻柔,这一点很重要。确保移液器吸头不接触腔室底部。保持移液器倾斜,将缓冲液流引导到腔室壁,而不是直接在双层,因为直接流动可能会破坏双层。移液时小心不要引入任何气泡,因为空气可能会到达脂质双层并导致其缺陷。 - 通过加入 100 μL 的 1x KMEH 并去除 100 μL 重复洗涤 10 次。
- 向双层中加入 10 μL 1 mg/mL β-酪蛋白,轻轻混合并孵育 5-10 分钟。 β-酪蛋白阻断盖玻片上尚未形成双层的区域。如步骤2.2.3所述,用1x KMEH洗掉3x β酪蛋白。并将缓冲液水平恢复到100 μL标记。
- 添加膜-肌动蛋白接头
- 在β酪蛋白孵育期间(步骤2.2.5.),从-80°C取出等分试样的膜肌动蛋白接头蛋白,在37°C下快速解冻,然后将其保存在冰上。用蛋白质稀释缓冲液将等分试样稀释至1μM的浓度。
- 以规定的终浓度(通常为5-20 nM)加入接头蛋白并轻轻混合。为确保快速平衡腔室中的蛋白质,通过将接头蛋白与 1x KMEH 预混合,添加大于 20 μL 的体积。
- 在室温下孵育40分钟。用1x KMEH缓冲液洗涤3x以除去未结合的HSE蛋白(如步骤2.2.3所示)。将每个腔室中的缓冲液液位恢复到100 μL标记。样品现已准备好进行成像。
- 脂质双层的质量评估
注意:这是一个可选步骤,不必每次都执行。我们建议每次使用冷冻MLV库存制造新鲜SUV时都进行此评估。- 打开显微镜、激发激光器和检测相机。确保激光对准,物镜清洁,软件已准备好采集图像。
- 将油放在100倍物镜上,将样品安装在显微镜载物台上,然后将物镜聚焦在双层上。确保激光位置使其在样品上经历全内反射。使用488 nm激发激光器检查双层结合的10xHis-YFP-EzrinABD的荧光强度分布。
注意:高质量的双层显示出荧光强度的大尺度均匀分布。不良双层显示强烈和斑片状的荧光斑点。 - 要确定双层的完整性,请进行FRAP测定。
- 在双层上选择一个感兴趣的区域,并使用提供5:1或更高信噪比的成像条件记录一些视野图像。暂停记录并关闭TIRF显微镜的视场光圈,将集中的激光束聚焦在双层的小圆形区域,以局部漂白荧光团。
- 将激光器打开到最大输出以对小区域进行光漂白 3-10 秒,然后关闭激光器。将视场光阑重新打开至其原始半径,将成像条件重新调整回(漂白前)设置,并立即恢复以记录视野中荧光信号的恢复情况。
- 检查双层是否为流体。具有正常横向扩散的良好双层恢复速度快,而不良双层恢复缓慢或根本不恢复(图3)。如果双层未恢复,请检查故障排除部分并重新启动。将图像另存为 16 位 TIFF 文件。有关扩散系数的定量估计,请检查步骤 3。下面。
- 荧光肌动蛋白的聚合
注意:为了节省时间,请在HSE蛋白结合到双层的孵育时间(步骤2.3)或双层的质量评估期间(步骤2.4.)开始聚合肌动蛋白。- 以10:1摩尔比混合未标记和荧光标记的G-肌动蛋白,并用G-缓冲液加满,使G-肌动蛋白的浓度为20μM。肌动蛋白最终聚合的浓度将是该值的1/4。将 1/10 的 10x ME 缓冲液加入混合物中以获得 1x 溶液并孵育 2 分钟。该步骤用Mg 2+离子取代与G-肌动蛋白结合的Ca2+离子。确保最终体积为 10 μL 的倍数。
- 按如下方式加入所需量的封端蛋白。在37°C下快速解冻一瓶封盖蛋白质原液,然后将其保存在冰上。用G缓冲液稀释,使得封端蛋白的浓度现在是聚合混合物中所需最终浓度的两倍。将等体积的稀释加帽蛋白溶液添加到步骤2.5.1的肌动蛋白混合物中。
- 最后,向反应混合物中加入等体积的新鲜2x目标缓冲液。溶液的最终体积应为步骤2.5.2结束时肌动蛋白混合物体积的四倍。确保KMEH的最终浓度为1x,ATP的最终浓度为1mM,BSA的最终浓度为1mg / mL,G-肌动蛋白的最终浓度为5μM。
在25°C的黑暗中孵育45-60分钟以使聚合发生。
注意:这称为靶标缓冲液策略,其中将一体积的Mg 2+ G-肌动蛋白(步骤2.5.1)与一体积的加帽蛋白混合物(步骤2.5.2)和两体积的2x 靶缓冲液(步骤2.5.3)混合。这使得扩大或减少肌动蛋白的数量和改变封端蛋白(或任何其他肌动蛋白调节剂; 图4)。
- 添加荧光肌动蛋白丝
- 用锋利的刀片或剪刀剪下几个 200 μL 的尖端,使它们变钝。用钝端移液器尖端轻轻移出所需体积的5μM聚合肌动蛋白(来自步骤2.5.3)(以防止肌动蛋白丝剪切),并将其添加到干净的高压灭菌PCR管中。
- 向试管中加入 1x KMEH 以使体积> 20 μL 并轻轻混合以避免剪切 F-肌动蛋白。从安装的样品室中取出等体积的缓冲液。
- 将聚合的肌动蛋白溶液添加到腔室中,轻轻上下移液3次,不要接触底部的双层。这允许肌动蛋白丝均匀分布在双层上。将样品安装在TIRF显微镜上(参见步骤2.4.1和步骤2.4.2)。
- 可以记录F-肌动蛋白与双层结合的过程。孵育20-30分钟。在F-肌动蛋白添加达到稳定状态后,从不同视野记录一些图像。观察10xHis-YFP-EzrinABD在(均质)和肌动蛋白组织之前和之后的空间组织的变化。
注意:在没有肌动蛋白的情况下,HYE均匀分布在脂质双层上。加入肌动蛋白丝后,HYE与F-肌动蛋白共定位。共定位的程度取决于接头蛋白的肌动蛋白结合亲和力;亲和力越强,共定位越高,接头蛋白的横向迁移越慢(图5)。
- 添加肌球蛋白 II
- 肌动蛋白孵育30分钟后,将样品装回显微镜上(如果已卸载)。检查接头蛋白和F-肌动蛋白通道中的信号。如果需要,调整成像条件。
- 选择一个具有均匀接头蛋白信号和均匀散射肌动蛋白丝且无伪影的良好区域进行长时间延时记录。在添加肌球蛋白之前以 0.1-0.2 Hz 录制 10-15 帧并暂停录制。用钝端移液器吸头从库存小瓶中移出所需体积的回收肌肉肌球蛋白-II(以防止肌球蛋白丝剪切),并添加到干净的高压灭菌PCR管中。
- 立即向试管中加入 1x KMEH 以使体积> 20 μL 并轻轻混合。还可以添加ATP,ATP再生混合物,光稳定剂等。在此步骤中。小心地从安装的样品室中取出等体积的缓冲液,不要干扰它。
- 轻轻地将肌球蛋白溶液添加到样品室中。不要上下移液,因为它会干扰表面结合的细丝。立即恢复延时记录,并观察系统从肌球蛋白前状态演变为ATP燃料的收缩肌球蛋白流和紫菀形成,再到ATP耗尽的卡住状态(见代表性结果)。
- 使用仅缓冲样本拍摄所有通道的背景图像。将所有图像另存为 16 位 .tiff 文件。有关解决常见问题的提示,请参阅 表 2 。

图 3:使用快速 FRAP 测定对双层进行质量评估。 由DOPC和Ni-NTA脂质(98:2摩尔%)制备的负载脂质双层(SLB)涂有HYE(10xHis-YFP标记的膜-肌动蛋白接头)。未结合的蛋白质被洗掉后,在TIRF显微镜下对荧光双层进行成像。双层上的一个小区域用高激光功率进行光漂白,并记录荧光的恢复。(A)良好的双层总是恢复得很快,在这种情况下使用的脂质组合物的预期扩散系数为1-1.5μm2 / s。(B)不良双层恢复非常缓慢或根本不恢复。(C)坏双层的代表性图像:(C-i)带有孔的双层,(C-ii)具有大的,不动的脂质斑块的双层,以及(C-iii)具有小而不动的点的双层。请点击此处查看此图的大图。
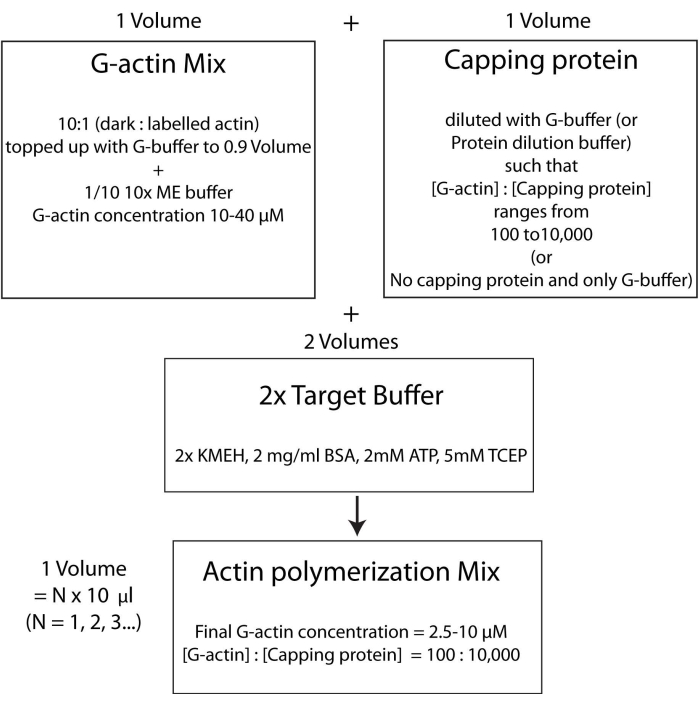
图 4:显示如何使用目标缓冲液方法聚合肌动蛋白的示意图。 请点击此处查看此图的大图。

图5: 与F-肌动蛋白结合时HYE的空间组织。TIRF快照显示了添加肌动蛋白丝(用Atto-635马来酰亚胺标记)之前和之后HYE的空间组织。HYE组织在加入F-肌动蛋白之前是均质的,并且沿着肌动蛋白丝共定位和共排列。请点击此处查看此图的大图。
3. 数据分析
- 使用斐济软件(https://imagej.net),从接头蛋白图像中减去背景(从步骤2.4开始)。测量漂白点和参考区域的平均强度值。
- 将漂白点和参考区域的时间轨迹归一化为各自漂白前强度值的强度。将归一化漂白区域值中的每个时间点除以归一化参考区域时间轨迹中的相应时间点。校正所得归一化时间轨迹的背景和采集过程中强度的任何系统波动(全局光漂白、z 漂移等)。
- 使用无拟合的手动方法28 来估计双层系留蛋白的扩散系数。简而言之,恢复配置文件的半衰期 τ1/2 可以通过查看归一化恢复配置文件达到其稳定状态的一半来计算:
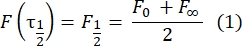
这里,F 0是光漂白后第一帧漂白区的平均强度,F∞是双层恢复的长期稳态值。 - 估计有效漂白剂半径r e,该参数校正光漂白期间的扩散,来自漂白后斑点剖面29的线扫描。通过漂白点中心的线扫描的半宽度最小值r 1/2与re相关,如下所示:
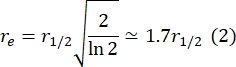
步骤2.8.3.计算的τ1/2、步骤2.8.4.计算的r e和原来设定的漂白半径rn使用以下公式计算扩散系数(D):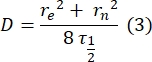
- 使用无拟合的手动方法28 来估计双层系留蛋白的扩散系数。简而言之,恢复配置文件的半衰期 τ1/2 可以通过查看归一化恢复配置文件达到其稳定状态的一半来计算:
- 肌动肌肽紫苑的图像分析
- 使用斐济,从所有通道中的所有录制图像中减去背景。使用平场校正校正任何不均匀的照明或干涉图案的图像。
注意:可以使用彩色塑料载玻片,这是很好的平面样品来进行此类校正。对于平面双层上的接头蛋白和肌动蛋白丝,还可以使用多个肌球蛋白前图像的平均投影来创建通道特异性照明校正图。- 对于此处显示的HYE通道,对多个HYE图像进行平均强度投影(在添加肌球蛋白之前从脂质双层的不同区域记录)。对平均投影(来自肌球蛋白前图像或任何标准平面样本)应用适当的高斯滤波器(σ = 50 像素到 80 像素)。
- 将过滤后的图像转换为 32 位图像。将所有像素值除以整个图像的平均值。这将给出 HYE 通道的归一化校正图。使用此图划分HYE通道中的所有图像以进行平场校正。使用相同的策略为其他渠道创建校正图。
- 在斐济使用指数或简单比率方法(取决于强度衰减曲线)校正光漂白。
- 要校正任何时间x-y错位(平移运动),请将所有光漂白校正通道合并到单个Hyperstack中。使用斐济的 Hyperstack-Reg 插件,应用刚体或平移转换。
- 最后,将对齐的Hyperstack拆分为单独的通道,并将它们分别保存为16位TIFF堆栈以供进一步分析。
- 使用斐济,从所有通道中的所有录制图像中减去背景。使用平场校正校正任何不均匀的照明或干涉图案的图像。
结果
为了表示,这里显示了光漂白后第1幅图像的典型漂白后轮廓( 图3A中t = 0 s处的图像)及其与以下功能28 (参见 图6A)的拟合度:

通过拟合该曲线计算的r e (23.94 μm)值与步骤2.8.4中计算的r e非常相似。(23.24微米)。这里,K是一个漂白深度参数,可以从F0直接估计(在步骤2.8.4中描述)。类似地,图6B显示了恢复配置文件及其与以下功能28的配合:
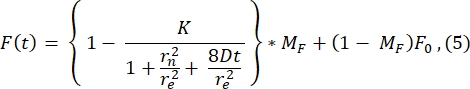
我们发现扩散系数的拟合值为 1.34 μm 2/s,该值与步骤 2.8.4 中的公式计算的 1.39 μm2/s 值非常吻合。在这里,MF代表脂质双层的移动部分,代表恢复的漂白群体的比例。当然,脂质锚定分子的迁移率取决于脂质组成及其物理状态(液相或凝胶相)。对于我们使用基于DOPC的脂质膜的实验,迁移率应为>1μm2 / s,移动级分不应小于0.9,以表明脂质双层良好。我们建议使用手动免配方法快速测试双层的质量和流动性。在自动分析许多 FRAP 曲线时,拟合方法非常有用。此外,如果想要进行更复杂的FRAP实验来系统地表征系统中的扩散,我们建议读者阅读Lorén等人30的这篇评论,以获取有关拟合模型和实验设计中潜在陷阱的更多详细信息。

图 6:量化脂质双层的扩散系数。 (A)光漂白后第一幅图像的线轮廓( 图3A中的t = 0 s)及其与公式4的拟合以计算有效漂白半径。(B)漂白区域的回收曲线及其与公式5的拟合度,以计算扩散系数和移动分数。 请点击此处查看此图的大图。
图7和补充视频S1描述了上述实验的典型结果,显示了通过TIRF显微镜成像的支持的脂质双层上连接的肌球蛋白网络的动态组装和组织。
图7 显示了接头蛋白、F-肌动蛋白和肌球蛋白-II的图像蒙太奇。
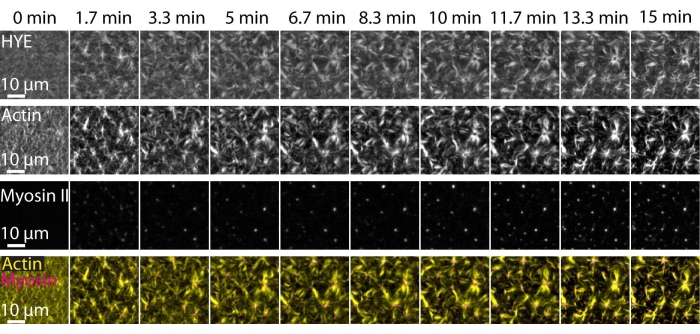
图 7:收缩性肌动肌蛋白流驱动膜-肌动蛋白接头蛋白 HYE 的局部聚集。 将肌球蛋白 II 添加到含有 HYE 和 F-肌动蛋白的 SLB 后,HYE(YFP 标记)、肌动蛋白丝(用 Atto-635 马来酰亚胺标记)和肌球蛋白 II 细丝(用 Atto-565 马来酰亚胺标记)的 TIRF 快照。时间在顶部指示:0分钟是荧光肌丝开始出现在TIRF视野之前的0分钟。在肌球蛋白加成(0分钟)之前,HYE和F-肌动蛋白均匀分布在脂质双层上。肌球蛋白活性诱导收缩性肌动蛋白流,其在稳态(15分钟)下出现成紫苑样结构,驱动偶联膜组分(HYE)的局部聚集。最下面的一行是肌动蛋白(黄色)和肌球蛋白II(洋红色)图像的合并,显示了肌动蛋白和肌球蛋白在不同时间点的组织。制作这些蒙太奇时使用的图像在斐济进行了背景信号、不均匀强度模式和平移运动的校正。比例尺 = 10 μm。有关详细信息,请参阅 补充视频 S1。 请点击此处查看此图的大图。
| 缓冲区名称 | 组成 | |
| 脂质再水化缓冲液 | 50 毫米乙肝素, 150 毫米氯化钠, 5% 蔗糖, pH 7.5 | |
| SLB形成缓冲液 | 50 毫米氯化钠, 150 毫米氯化钠, pH 5-6 | |
| 负载均衡存储缓冲区 | 50 毫米氯化钠, 150 毫米氯化钠, pH 7.2 | |
| 蛋白质稀释缓冲液 | 20 毫米HEPES,100 毫米氯化钾,1 毫米三氯丁二醇或 DTT,pH 7.2 | |
| 1X ME 或肌动蛋白离子交换缓冲液 | 50 毫米氯化镁 2,0.2 毫米乙二醇,10 毫米汞,pH 7.2(储存在 4°C) | |
| 1X KMEH 或肌动蛋白聚合缓冲液 | 50 毫米氯化钾, 1 毫米氯化镁, 1 毫米镁氯 2, 1 毫米镁乙二醇, 50 毫米高血糖, pH 7.2 | |
| 100 mM ATP 原液 | 100 mM ATP 二钠盐、50 mM Tris、50 mM 氯化钠、5 mM 氯化镁 2、2 mM EGTA,pH 7.5(储存在 -20°C) | |
| 2x 目标缓冲区 | 2x KMEH, 2 毫克/毫升 BSA, 2 毫米 ATP, 5 毫米 TCEP (储存在 4°C) | |
| G 缓冲液 | 2 毫米三分盐、0.1 毫米氯化钙2、0.2 毫米三磷酸钙、0.5 毫米三氯化钙、0.04 % NaN3、pH 8(储存在 4°C) | |
| 肌球蛋白II缓冲液 | 500 毫米氯化钾, 1 毫米乙二胺四乙酸, 10-20 毫米赫普斯, pH 7.0 | |
| 凝胶过滤色谱缓冲液 | 50 mM 三盐酸, 150-300 mM 氯化钠, 5 mM TCEP, 0.1% 吐温-20, pH 7.5 | |
| 封端蛋白储存缓冲液 | 10 毫米三度·氯, 50 mM 氯化钠, 1 mM TCEP, pH 7.5, 20% 甘油 | |
表1:本协议中使用的缓冲液组合物列表。
| 常见问题及其故障排除 | 问题 | 原因 | 可能的解决方案 | ||||||
| 1 | 脂质双层无扩散 | 此问题最可能的原因是清洁液老化或在浴超声处理期间未进行加热时,可能会发生脏盖玻璃。这些双层具有"囊泡"外观,因为破裂的囊泡粘附在盖玻片上,但不相互融合。使用超过 6 周的 MLV 或超过 6 天的 SUV,或添加少量的 SUV 也可能导致双层囊泡形成。 | 使用新鲜的清洁溶液。确保加热器已打开且温度在 45-65°C 之间。 使用新鲜的脂质混合物。(使用荧光脂质探针与荧光蛋白探针有时表现不同。 例如,如果双层具有亚衍射缺陷并且跳过表面钝化步骤(或不起作用),则脂质探针将显示均匀的强度分布,但荧光蛋白探针可能显示明亮的荧光斑点。 | ||||||
| 2 | 脂质双层有明亮的斑块 | 长时间孵育用于双层形成的 SUV 可以产生脂质双层,该脂质双层总体上弥漫,但偶尔会出现明亮的斑块。这些贴片可以是多层双层,可以吸引大量的荧光探针。 | 用SUV孵育15-20分钟就足够了。确保探针没有聚集:接头蛋白的快速硬旋转(300 x g 在4°C下15分钟)可以去除聚集体 | ||||||
| 3 | 脂质双层有黑洞 | 当双层由旧 SUV 制成并长时间成像(形成后 > 4 小时)或溶液的 pH 值由于长时间成像(例如,在高 ATP 状态和某些除氧剂的存在下)而发生剧烈变化时,或者当表面被 β-酪蛋白过度钝化(添加过多的 β-酪蛋白超过 10-15 分钟并且没有将其洗掉)时,就会发生这种情况。 | 使用新鲜脂质。降低成像帧速率或有效激光照明时间。使用缓冲容量较高的缓冲液。 | ||||||
| 4 | 脂质双层显示扩散缓慢 | 胆固醇百分比高、饱和脂质长或带电脂质的脂质双层扩散较慢。 | 在这种情况下,请在高温下制备样品。还可以使用简单的、经过测试的脂质组合物以及复杂和未经测试的脂质组合物作为对照。确保玻璃清洁。 | ||||||
| 5 | 肌动蛋白不聚合 | 靶标缓冲液较旧,G-肌动蛋白原液太旧,新旧G-肌动蛋白共聚合。 | 确保在聚合前用Mg 2+取代Ca2+(使用ME缓冲液)。使用新鲜的ATP-Mg2+原液。使用新鲜回收的G-肌动蛋白。确保添加到双层中的F-肌动蛋白(以G-肌动蛋白计)的浓度高于0.2μM。对于较低的浓度,使用鬼笔环肽稳定的F-肌动蛋白。 | ||||||
| 6 | 肌动蛋白不与双层结合 | 膜-肌动蛋白接头不是在非常低的浓度下添加或添加的——这可以推断出接头蛋白的荧光。如果荧光不错,则膜-肌动蛋白接头已失去肌动蛋白结合能力。此外,如果接头蛋白非特异性结合到玻璃表面(当双层坏时),它可能不会募集肌动蛋白丝。 | 确保双层是扩散的。使用新鲜接头蛋白 | ||||||
| 7 | 荧光F-肌动蛋白信号弱 | 标记与深肌动蛋白的比例太低。标记的肌动蛋白或未标记的肌动蛋白太旧,它们没有相互共聚。 | 再次回收肌动蛋白,并用新鲜回收的肌动蛋白重新尝试策略。光损伤可以破坏或解聚F-肌动蛋白;如果可能,使用红色或远红色染料来检测肌动蛋白(和肌球蛋白)。 | ||||||
| 8 | 肌球蛋白不显示收缩力 | 可以观察到,将ATP添加到肌球蛋白输注系统后,肌球蛋白没有收缩性。 | 检查肌球蛋白浓度或纯度是否良好。使用新鲜回收的肌球蛋白(回收后 6 周内使用)。在肌球蛋白混合物中添加新鲜的ATP会有所帮助。缓冲液脱气和使用除氧剂等。可以减少电机的光损伤。 更多信息可以在Plastino等人或Stam等人的相同方法集合的协议中找到 | ||||||
| 9 | 盖玻片不亲水 | 盖玻片未正确清洁。 | 干净的亲水盖玻片对于脂质双层的形成至关重要。清洁方案后,对盖玻片亲水性的有用视觉读数是观察玻璃被水润湿的情况。在平躺的盖玻片中加入少量水。如果盖玻片清洁不当,水将保持圆形水滴的形状。然而,相同体积的水会在经过处理的亲水盖玻片上扩散并形成薄层。水在盖玻片表面上的这种润湿行为可用于确定使用清洁溶液/ NaOH的清洁步骤是否有效。 | ||||||
表 2:故障排除指南,总结了常见问题和相应的解决方案。
补充视频S1:收缩性肌动蛋白流动驱动膜-肌动蛋白接头蛋白HYE的局部聚集。 将肌球蛋白 II 添加到含有 HYE 和 F-肌动蛋白的 SLB 后,HYE(YFP 标记)、肌动蛋白丝(用 Atto-635 马来酰亚胺标记)和肌球蛋白 II 细丝(用 Atto-565 马来酰亚胺标记)的 TIRF 延时。时间在顶部指示:0分钟是荧光肌丝开始出现在TIRF视野之前的0分钟。比例尺 = 10 μm。 请点击这里下载此文件。
讨论
该协议提供了一个多功能平台和设计实验以研究细胞的膜 - 皮层界面的起点。关键步骤是制备干净的载玻片,使用新鲜脂质进行有效的SUV形成(两者都会影响SLB的质量),以及使用新鲜回收的肌球蛋白II蛋白进行动态肌动蛋白丝重组。当长时间成像动力学时,结合除氧系统(例如,原儿茶酸和原儿茶酸3 4-双加氧酶5,31)非常重要。
开腔设计允许在不诱导脂质流动的情况下按顺序向现有系统添加组件。与常用的封闭室方法或使用脂质体36中的封装蛋白质相比,这可能是一个重要的优势。相反的影响,如蛋白质诱导的膜变形,不能用玻璃吸附的脂质双层来研究。
脂质双层可以用多种脂质组成形成。它首先将脂质囊泡吸附到亲水玻璃表面,然后是由于表面-囊泡和直接囊泡-囊泡相互作用引起的自发囊泡破裂,或者吸附的囊泡达到临界覆盖率,之后一小部分囊泡破裂,形成活性边缘,最终导致双层形成32.除玻璃外,各种基底可用于形成支撑的脂质双层,例如云母(例如,用于原子力显微镜),软基底(例如,聚二甲基硅氧烷),聚合物垫33,34,35,跨越电子显微镜网格的孔之间14。液滴界面双层是另一种创建稳定、独立的脂质双层的有趣方法36。将肌球蛋白网络包含在囊泡或乳液中是一种非常有效的方法,可以在细胞状几何中研究这种最小系统37,38,并在其他地方详细描述39。
披露声明
作者没有利益冲突需要声明。
致谢
这项工作得到了AXA研究基金和沃里克-惠康定量生物医学计划(Wellcome ISSF,RMRCB0058)的支持,用于DVK,NCBS-TIFR用于AB和ST,以及Wellcome-DBT Margdarshi奖学金(IA / M / 15 / 1 / 502018)用于SM。 DVK还要感谢生物物理学会启用虚拟网络活动"从分子到中尺度理解多组分细胞骨架网络的挑战", 这有助于创建此协议集合。
材料
| Name | Company | Catalog Number | Comments |
| 1,2 dipalmitoyl-sn-glycero-3-phosphoethanolamine-N- (lissamine rhodamine B sulfonyl) | Avanti Polar Lipids | 810158 | 16:0 RhoPE |
| 1,2-dioleoyl-sn-glycero-3- [(N-(5-amino-1 carboxypentyl) iminodiacetic acid) succinyl] (nickel salt) | Avanti Polar Lipids | 790404 | DGS-NTA-Ni2+ |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850375 | DOPC |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850355 | DPPC |
| Amber glass vials | ThermoFisher | B7990-2A | |
| ATP disodium salt | Sigma Aldrich | A26209 | |
| Attofluor cell chamber | ThermoFisher | A7816 | |
| Bath sonicator | GT Sonic | 1860QTS | |
| beta-casein | Sigma Aldrich | C6905 | |
| CaCl2 | ThermoFisher | 12135 | |
| chloroform | Sigma Aldrich | 650471 | alternatively from Electron Microscopy Sciences, 50980296 |
| Cover slips, #1, 25 mm diameter, Gold Seal | Harvard Apparatus | 64-0705B | |
| Cover slips, #1, 40x22 mm, Gold Seal | ThermoFisher | 48404-031 | |
| EDTA | ThermoFisher | G12635 | |
| EGTA | Himedia | MB130 | |
| Gas tight glass syringes, with removebla needle, blunt, volumes 10 µL, 100 µL, 500 µL | Hammilton | 1700 series | |
| Hellmanex III | Hellma Analytics | Z805939 | cleaning solution |
| HEPES | Himedia | RM380 | |
| KaH2PO4 | ThermoFisher | G13405 | |
| KCl | ThermoFisher | G13305 | |
| KOH | ThermoFisher | G26708 | |
| Lipid extruder | Avanti Polar Lipids | 61000-1EA | |
| MgCl2 | ThermoFisher | G15535 | |
| Microtip sonicator | Sonics | VC750 | 3 mm Tip diameter |
| Na2CO3 | ThermoFisher | G15955 | |
| NaCl | Himedia | GRM853 | |
| NaH2PO4 | ThermoFisher | G15825 | |
| NaOH | ThermoFisher | G27815 | |
| Nikon Ti Eclipse TIRF microscope | Nikon | With a TIRF unit connected through a polarization-conserving optical fibre to an Agilent monolithic laser combiner MLC400 with multiple laser lines with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) | |
| NOA88 | Norland Products | 8801 | |
| PTFE Coated Tweezer Style #2A | Structure Probe | 0S2AT-XD | |
| Refrigerated microcentrifuge | Eppendorf | 5424R | |
| Sucrose | ThermoFisher | G15925 | |
| UV-illuminator | Novascan | PSD PRO-UV | needs vacuum and O2 supply |
参考文献
- Köster, D. V., Mayor, S. Cortical actin and the plasma membrane: Inextricably intertwined. Current Opinion in Cell Biology. 38, 81-89 (2016).
- Rao, M., Mayor, S. Active organization of membrane constituents in living cells. Current Opinion in Cell Biology. 29, 126-132 (2014).
- Honigmann, A., et al. A lipid bound actin meshwork organizes liquid phase separation in model membranes. eLife. 3, 01671(2014).
- Das, A., et al. Stratification relieves constraints from steric hindrance in the generation of compact actomyosin asters at the membrane cortex. Science Advances. 6 (11), (2020).
- Köster, D. V., et al. Actomyosin dynamics drive local membrane component organization in an in vitro active composite layer. Proceedings of the National Academy of Sciences. 113 (12), 1645-1654 (2016).
- Vogel, S. K., Heinemann, F., Chwastek, G., Schwille, P. The design of MACs (minimal actin cortices). Cytoskeleton. 70 (11), 706-717 (2013).
- Murrell, M., Thoresen, T., Gardel, M. Reconstitution of contractile actomyosin arrays. Methods in Enzymology. 540, 265-282 (2014).
- Mosby, L. S., et al. Myosin II filament dynamics in actin networks revealed with interferometric scattering microscopy. Biophysical Journal. 118 (8), 1946-1957 (2020).
- Seara, D. S., et al. Entropy production rate is maximized in non-contractile actomyosin. Nature Communications. 9 (1), 4948(2018).
- Linsmeier, I., et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7, 12615(2016).
- Vogel, S. K., Petrasek, Z., Heinemann, F., Schwille, P. Myosin motors fragment and compact membrane-bound actin filaments. eLife. 2, 00116(2013).
- Ditlev, J. A., et al. A composition-dependent molecular clutch between T cell signaling condensates and actin. eLife. 8, 42695(2019).
- Banjade, S., Rosen, M. K. Phase transitions of multivalent proteins can promote clustering of membrane receptors. eLife. 3, 04123(2014).
- Heinemann, F., Vogel, S. K., Schwille, P. Lateral membrane diffusion modulated by a minimal actin cortex. Biophysical Journal. 104 (7), 1465-1475 (2013).
- Vogel, S. K., Greiss, F., Khmelinskaia, A., Schwille, P. Control of lipid domain organization by a biomimetic contractile actomyosin cortex. eLife. 6, 24350(2017).
- Block, S. Brownian motion at lipid membranes: A comparison of hydrodynamic models describing and experiments quantifying diffusion within lipid bilayers. Biomolecules. 8 (2), 30(2018).
- JoVE, JoVE. JoVE Methods Collection. In vitro reconstitution of cytoskeleton networks for biomaterials, biophysics and active matter research. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Enzymology. 85, 164-181 (1982).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Pollard, T. D. Myosin purification and characterization. Methods in Cell Biology. 24, 331-371 (1982).
- JoVE Science Education Database. Separating protein with SDS-PAGE. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Bieling, P., et al. WH2 and proline-rich domains of WASP-family proteins collaborate to accelerate actin filament elongation. The EMBO Journal. 37 (1), 102-121 (2018).
- Shrivastava, R., Köster, D., Kalme, S., Mayor, S., Neerathilingam, M. Tailor-made ezrin actin binding domain to probe its interaction with actin in-vitro. PLoS One. 10 (4), 0123428(2015).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5, 5412(2014).
- Selden, N. S., et al. Chemically programmed cell adhesion with membrane-anchored oligonucleotides. Journal of the American Chemical Society. 134 (2), 765-768 (2012).
- Seu, K. J., et al. Effect of surface treatment on diffusion and domain formation in supported lipid bilayers. Biophysical Journal. 92 (7), 2445-2450 (2007).
- Kang, M., Day, C. A., Kenworthy, A. K., DiBenedetto, E. Simplified equation to extract diffusion coefficients from confocal FRAP data. Traffic. 13 (12), 1589-1600 (2012).
- Kang, M., Day, C. A., Kenworthy, A. K. A novel computational framework for D(t) from Fluorescence Recovery after Photobleaching data reveals various anomalous diffusion types in live cell membranes. Traffic. 20 (11), 867-880 (2019).
- Lorén, N., et al. Fluorescence recovery after photobleaching in material and life sciences: Putting theory into practice. Quarterly Reviews of Biophysics. 48 (3), 323-387 (2015).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (7), 1-7 (2013).
- Andrecka, J., Spillane, K. M., Ortega-Arroyo, J., Kukura, P. Direct observation and control of Supported lipid bilayer formation with interferometric scattering microscopy. ACS Nano. 7 (12), 10662-10670 (2013).
- Lin, W. -C., et al. Supported membrane formation, characterization, functionalization, and patterning for application in biological science and technology. Current Protocols in Chemical Biology. 2 (4), 235-269 (2010).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: An integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sapuri-Butti, A. R., Butti, R. C., Parikh, A. N. Characterization of supported membranes on topographically patterned polymeric elastomers and their applications to microcontact printing. Langmuir. 23 (25), 12645-12654 (2007).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Bashirzadeh, Y., Moghimianavval, H., Liu, A. P. Encapsulated actomyosin patterns drive cell-like membrane shape changes. iScience. 25 (5), 104236(2022).
- Bashirzadeh, Y., Wubshet, N., Litschel, T., Schwille, P., Liu, A. P. Rapid encapsulation of reconstituted cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. (177), e63332(2021).
- Murrell, M., Chen, S., Sun, Z. G. In vitro reconstitution of actin cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. , (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。