Method Article
Membrana Bağlı Minimal Aktin Kortekslerinin Desteklenen Lipid Çift Katmanlı Üzerinde Yeniden Sulandırılması
Bu Makalede
Özet
Bu protokol, floresan mikroskobu kullanılarak yeniden oluşturulmuş, membrana bağlı sitoiskelet ağlarının dinamiklerini incelemek için desteklenen lipid çift katmanlarının oluşumunu ve hücre iskeleti filamentlerinin ve motor proteinlerin eklenmesini açıklar.
Özet
Canlı bir hücrenin yüzeyi, plazma zarının altta yatan aktin korteks ile etkileşiminden kaynaklanan çok sayıda hücresel süreç için çok yönlü bir aktif platform sağlar. Son yıllarda, aktin filament ağları ile kombinasyon halinde desteklenen lipit çift katmanlarına dayanan yeniden yapılandırılmış, minimal sistemlerin, membrana bağlı aktin ağlarının temel mekanizmalarını ve sonuçlarını çözmede ve ayrıca bireysel membranla ilişkili proteinlerin işlevlerini incelemede çok etkili olduğu kanıtlanmıştır. Burada, membranla ilişkili aktin bağlayıcı proteinler aracılığıyla dinamik aktin filamentlerine ve miyozin motorlarına bağlanan sıvı destekli lipit çift katmanlarından oluşan ve toplam iç yansıma floresan mikroskobu ile kolayca gözlemlenebilen bu tür aktif kompozit sistemlerin in vitro olarak nasıl yeniden oluşturulacağını açıklıyoruz. Açık odacıklı bir tasarım, sistemin adım adım monte edilmesini ve bağlayıcı protein konsantrasyonu, aktin konsantrasyonu, aktin filament uzunluğu, aktin / miyozin oranı ve ATP seviyeleri gibi birçok parametrenin sistematik olarak kontrol edilmesini sağlar. Son olarak, sistemin kalitesinin nasıl kontrol edileceğini, yaygın olarak ortaya çıkan sorunların nasıl tespit edileceğini ve giderileceğini ve bu sistemin canlı hücre yüzeyine kıyasla bazı sınırlamalarını tartışıyoruz.
Giriş
Canlı bir hayvan hücresinin plazma zarı, bitişik aktin sitoiskeleti ile sürekli etkileşime girer ve birlikte çok sayıda hücresel işlevi yerine getiren aktif bir kompozit materyal oluştururlar 1,2. Bu lipid membran-aktin arayüzündeki süreçleri incelemek için, desteklenen lipit çift katmanlarının (SLB'ler) üstünde sitoiskelet ağlarının yeniden yapılandırılmasının çok yararlı olduğu kanıtlanmıştır. Bu minimal sistem yaklaşımı, sitoiskelet ağ bileşenlerinin ve lipit kompozisyonunun hassas kontrolünü sağlar. Dev unilamellar veziküllerin bağımsız lipit membranlarıyla karşılaştırıldığında, SLB'lerin düzlemsel geometrisi, süper çözünürlüklü3,4, toplam iç yansıma floresansı (TIRF)5,6,7 veya interferometrik saçılma 8 gibi son teknolojimikroskopi tekniklerinin verimli bir şekilde kullanılmasına izin verir sitoiskelet ağlarının mekansal organizasyonunu ve dinamiklerini incelemek. TIRF, floresan etiketli bileşenler için en yüksek kontrastı sağlar, çünkü çözeltideki arka plan sinyaline katkıda bulunan bağlanmamış etiketli moleküllerin sinyali minimumdur.
Burada, aktif, yarı-2D ağların fiziğini incelemek için alanda yaygın olarak kullanılan desteklenen lipit çift katmanlarına bağlı aktomiyozin ağlarının oluşumu için temel bir protokolü tarif ediyoruz 9,10,11 ve membran organizasyonu üzerindeki etkileri 3,5,12,13,14,15,16 (Şekil 1 ). Bu yaklaşım aktin bazlı ağlarla sınırlı değildir, aynı zamanda mikrotübülleri, ara filamentleri veya karışık doğadaki kompozit ağları keşfetmek ve yüzeye duyarlı mikroskopi yöntemlerini kullanarak lipit membran proteinleri ve sitoiskelet bileşenleri arasındaki çeşitli etkileşimleri incelemek için kolayca uyarlanabilir.
Bu protokolün odaklanmasını sağlamak için, aktin ve miyozin proteinlerinin saflaştırılması ve etiketlenmesinin ayrıntılı bir tanımını veya aktomiyozin ağlarının kontraktilitesinin ve organizasyonunun nasıl ayarlanacağı ve kontrol edileceği ile ilgili ayrıntıları hariç tuttuk. JoVE Methods Collection, In Vitro Reconstitution of Cytoskeleton Networks for Biomaterials, Biophysics and Active Matter Research17'de bunun yanında yayınlanan diğer protokollere de başvurulmalıdır.

Resim 1: İn vitro aktin-membran aktif kompozit sistemin şeması. Biorender ile oluşturuldu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
1. Reaktifler ve ekipmanlar
- Tablo 1'de listelenen taze tamponları hazırlayın. 25 ° C'de 18.2 MΩ · cm dirençliliğe sahip ultra saf, deiyonize su kullanın. Tüm tamponları vakum altında 0,22 μm filtrelerden geçirerek sterilize edin. Kolon kromatografisi için kullanılan tamponların gazını çözün.
- İskelet kası aktinini daha önce tarif edildiği gibi arındırın18,19. Son saflaştırılmış G-aktin çözeltisine% 20 gliserol ekleyin ve 500 μL (etiketleme veya toplu deneyler için) ve 10 μL (bireysel deneyler için) hacimli alikotlar yapın. Tüpleri 30 s boyunca sıvı azota batırarak alikotları dondurun ve daha sonra 18 aya kadar -80 ° C'de saklayın.
NOT: Alternatif olarak, saflaştırılmış aktin veya aseton tozu ticari olarak satın alınabilir. - Saflaştırılmış iskelet kası G-aktinini daha önce açıklandığı gibi herhangi bir floresan maleimid boyası ile etiketleyin5. Aktin için düzeltilmiş A 290nm (εaktin =26.600 M-1 cm-1) ve boyanın Aλmax'ını kullanarak spektrofotometri ile proteinin konsantrasyonunu ve etiketleme derecesini belirleyin. Tüpleri 30 s boyunca sıvı azota batırarak 10 μL'lik alikotlar yapın ve flaş dondurun ve 18 aya kadar -80 ° C'de saklayın.
NOT: Lizin konjuge edici NHS-esterleri ile etiketleme, fonksiyonel olmayan aktin oluşturacaktır ve kaçınılmalıdır. - İskelet kası miyozin II protokolünü izleyerek arındırın20. SDS-PAGE'i% 10 poliakrilamid jel kullanarak çalıştırın ve ardından protein21'in saflık seviyesini belirlemek için Coomassie boyama yapın. Saflaştırılmış iskelet kası miyosin-II'yi% 50 gliserol ile miyozin II tamponunda sıvı halde -20 ° C'de saklayın.
NOT: Depolanan miyozin II 2 yıla kadar kullanılabilir. - Saflaştırılmış miyosin-II'yi daha önce açıklandığı gibi herhangi bir floresan maleimid boyası ile etiketleyin5. Miyozin motorlarını NHS-esters boyalarıyla etiketlemekten kaçının. Düzeltilmiş A280nm miyozin II ve boyanın Aλmax'ını kullanarak spektrofotometri ile etiketleme konsantrasyonunu ve derecesini belirleyin. Geri dönüştürülmüş miyozin II'yi (koyu veya etiketli) 4 ° C'de saklayın ve 6 hafta içinde kullanın.
- Kapak proteininin saflaştırılması
- Daha önceki bir protokol22'yi izleyerek murin kapak proteini elde edin. Proteinin saflık seviyesini belirlemek için% 10 poliakrilamid jel ve ardından Coomassie boyama kullanarak SDS-PAGE'i çalıştırın. Konsantrasyonu280nm kapak proteini kullanarak ölçün (εCP = 99.530 M-1 cm-1).
- Protein çözeltisine% 20 gliserol ekleyin ve 200 μL PCR tüplerinde 5 μL alikot yapın. Tüpleri sıvı azota daldırın ve 2 yıla kadar -80 ° C'de saklayın.
NOT: Sınırlayıcı protein aktivitesi, farklı kapak proteini miktarlarının varlığında sabit miktarlarda floresan G-aktin'in polimerize edilmesiyle kontrol edilir. Filamentler daha sonra mikroskop altında görüntülenir ve uzunluk dağılımları ölçülür. Kapak proteininin nispi konsantrasyonu ne kadar yüksek olursa, aktin filament dağılımları o kadar kısa olur. Bkz. Köster ve ark.5.
- Bir floresan membran-aktin bağlayıcı proteini eksprese edin, örneğin, bu protokol için 10xHis-YFP-EzrinABD (HYE) kullanın, Bl21DE3 * Escherichia Coli ile ifade edin ve daha önce açıklandığı gibi saflaştırın23. Spektrofotometri ile proteinin konsantrasyonunu belirleyin.
- Proteini, -80 ° C'de% 20 gliserol ile jel-filtrasyon kromatografi tamponunda (veya başka bir uygun tamponda) küçük alikotlarda saklayın. Bu koşullar altında, protein 2 yıldan fazla bir süre boyunca kararlıdır.
NOT: Aktin-membran bağlayıcı protein ve floresan işaretleyici seçimi, ele alınan sorunun türüne bağlıdır. Geçtiğimiz yıllarda Histidin etiketli proteinler24, biyotin-streptavidin 25 ve tek sarmallı DNA26 dahil olmak üzere çok çeşitli lipit bağlama stratejileri geliştirilmiştir. - Çok katmanlı veziküllerin (MLV'ler) hazırlanması
NOT: MLV'lerden desteklenen lipit çift katmanlarına kadar olan iş akışı Şekil 2'de gösterilmiştir.- 5-10 amber cam şişeyi 200 mL'lik bir cam beherin içine yerleştirin. Beheri, cam şişeleri suya batırmaya yetecek kadar% 2 temizleme çözeltisi ile doldurun. Onları tam nabız ve 65 ° C'de 30 dakika boyunca bir su banyosunda sonikleştirin.
- Şişeleri çözeltiden çıkarın ve damıtılmış suyla iyice durulayın. Şişeleri 2 N NaOH içeren bir cam beherin içine yerleştirin ve 20 dakika boyunca sonikasyon yapın. Bu adımda ısıtma gerekmez.
- Şişeleri NaOH çözeltisinden çıkarın ve damıtılmış suyla iyice durulayın. Şişeleri 65 °C'ye ayarlanmış bir sıcak hava fırınında 2 saat veya daha uzun süre kurutun.
- Temizlenmiş şişeleri şeffaf filmle kapatılmış temiz bir beherde 6 haftaya kadar saklayın.
DİKKAT: Kimyasal duman davlumbazının içinde aşağıdaki adımları uygulayın. Plastik kontaminasyonunu önlemek için kloroform ve lipit çözeltilerini gaz geçirmez Hamilton cam şırıngalarla kullanın. - Hamilton şırıngalarını ve birkaç amber cam şişeyi saf kloroform ile birkaç kez durulayın. Cam ampullerde depolanan lipit tozunu -20 °C dondurucudan alın ve lipit tozlarını 10-25 mg / mL konsantrasyonlarına çözmek için yeterli miktarda kloroform ekleyin.
- Çözeltiyi ampulden taze temizlenmiş bir amber cam şişeye aktarın ve uygun şekilde etiketleyin. Kloroformun buharlaşmasını azaltmak için bu adımı buz üzerinde gerçekleştirin.
- 10-25 mg / mL konsantrasyonda bir DOPC stok çözeltisi ve 1-10 mg / mL konsantrasyonda DGS-NTA-Ni2 + yapın.
- Çalışan bir lipit karışımı yapmak için temiz bir cam şişe alın ve kloroform ile 2 kat durulayın. Bileşenlerin daha iyi karıştırılması için baz görevi görmesi için şişeye 300 μL saf kloroform ekleyin. Bu, lipitlerin nihai konsantrasyonlarını etkilemeyecektir, çünkü tüm kloroform sonraki adımlarda kurutulacaktır.
- İstenilen çalışma lipit karışımlarını yapmak için şişeye ölçülen hacimlerde stok lipit çözeltileri ekleyin. Lipid rehidrasyon tamponunda hedef lipid konsantrasyonu 4 mM'dir. Lipid karışımını, oda sıcaklığında kimyasal davlumbazın içindeki yavaş birN2 gazı akışı altında kurutun. Bu adım her şişe için 30 dakika kadar sürebilir.
- Tüm çözücü kuruduktan sonra, kalan kloroform izlerini gidermek için lipit filmini oda sıcaklığında >2 saat vakumla kurutun. 4 mM'lik son lipit konsantrasyonu için kurumuş lipid karışımını lipid rehidrasyon tamponunda yeniden askıya alın.
- Lipitlerin rehidrasyonuna izin vermek için 5-10 dakika boyunca inkübe edin. MLV'leri oluşturmak için yaklaşık 30 s boyunca lipit çözeltisini vorteksleyin.
- 1.5 mL mikrosantrifüj tüplerinde MLV'lerin 0.5-1 mL alikotlarını yapın. Tüpleri sıvı azota batırın, şeffaf bir filmle kapatın ve -20 ° C'de (6 haftaya kadar) saklayın.
NOT: Lipid stok konsantrasyonları, Hamilton şırıngaları kullanılarak güvenilir pipetlemeye izin veren yeterince büyük hacimlere izin verecek şekilde seçilmiştir. Stoğu yapmak için gerekli hacimler kurutulmuş lipit tozunu çözmek için çok büyükse, çeşitli lipitlerin tekrarlanabilir bir şekilde karıştırılmasını sağlamak için stokun çoklu seyreltmelerini yapın.
- Küçük unilamellar veziküllerin (SUV'lar) hazırlanması
- -20 ° C depodan bir MLV aliquot çıkarın ve oda sıcaklığında çözün. Mikrosantrifüj tüpünü 15-30 s sıvı azot içine daldırarak vezikülleri flaşla dondurun ve çözelti tamamen çözülene kadar (1-2 dakika) hemen 45 ° C'de ayarlanmış bir su banyosuna koyun. Çözelti daha az bulanık görünene kadar yukarıdaki donma-çözülme döngüsünü 10x-15x tekrarlayın.
NOT: Su banyosunun sıcaklığını, düzgün lipit karışımına izin vermek için çözülmekte olan lipit karışımının geçiş sıcaklığından daha yüksek bir değere ayarlayın. - SUV rehidrasyon tamponlu 80 nm gözenek boyutunda polikarbonat filtre membranı ile donatılmış şırınga bazlı mini ekstrüderi dengeleyin. Sistemde sızıntı veya kabarcık olmadığından emin olun. Ekstrüzyon yöntemi, minimum lipit hasarı ile monodisperse SUV'lar verirken, negatif yüklü lipit karışımları polikarbonat membrana yapışabilir.
- Çözülmüş lipit çözeltisini önceden dengelenmiş ekstrüderden bir taraftan diğerine yavaşça geçirin ve sonra geri dönün. Lipid çözeltisi gözle görülür şekilde netleşene kadar döngüyü 5x-10x tekrarlayın, bu da ~ 100 nm çapında SUV'ların oluşumunu gösterir.
- Lipit kalıntılarını peletlemek için ekstrüde süspansiyonu 15.000 x g'de 4 ° C'de 60 dakika boyunca santrifüj edin (veya çözeltiyi uç-sonikleştirin; aşağıdaki nota bakın). Pelet rahatsız etmeden ve kabarcıklar oluşturmadan çözeltinin üst% 80'ini toplayın. SUV'ları içeren süpernatantı taze bir mikrosantrifüj tüpüne aktarın ve 6 güne kadar buz üzerinde saklayın.
NOT: Santrifüjlemeye bir alternatif, aşağıdaki gibi gerçekleştirilen uç sonikasyonudur. Bir mikrotip sonikatörünü açın ve aşağıdaki ayarları yapın: Genlik = maksimumun% 30'u, AÇIK zaman = 10 s, KAPALI zaman = 60 s. Mikro-sonikatörün ucunu deiyonize su ile temizleyin, ardından 2 N NaOH, kloroform ve tekrar deiyonize su ile temizleyin. Sonikatör ucunu bu çözümlerin her birine daldırın ve yukarıdaki ayarları kullanarak 1-2 döngü boyunca sonikasyon yapın. Temiz ucu dondurularak çözülmüş vezikül çözeltisine batırın ve çözelti temizlenene kadar buz üzerinde 3-6 döngü boyunca sonikasyon yapın. - Santrifüjlemeden sonra, ince beyazımsı bir film ve / veya açıkça görülebilen bir pelet oluşumu olarak yüksek lipit bozulması veya başarısız bir lipit ekstrüzyonu belirtileri olup olmadığını kontrol edin. Bu gibi durumlarda, devam etmeyin ve SUV hazırlık adımlarını tekrar etmeyin.
NOT: SUV'ların raf ömrü, farklı lipit karışımları için farklılık gösterebilir. DOPC: DGS-NTA-Ni2+ 'dan yapılmış SUV'lar, bu deneylerin amaçları doğrultusunda 6 güne kadar stabildir. Sık karşılaşılan sorunları çözmek için ipuçları Tablo 2'de bulunabilir.
- -20 ° C depodan bir MLV aliquot çıkarın ve oda sıcaklığında çözün. Mikrosantrifüj tüpünü 15-30 s sıvı azot içine daldırarak vezikülleri flaşla dondurun ve çözelti tamamen çözülene kadar (1-2 dakika) hemen 45 ° C'de ayarlanmış bir su banyosuna koyun. Çözelti daha az bulanık görünene kadar yukarıdaki donma-çözülme döngüsünü 10x-15x tekrarlayın.
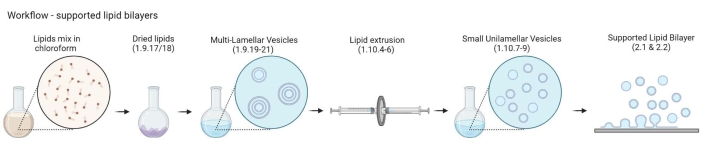
Şekil 2: Çok katmanlı veziküllerin ve küçük unilamellar veziküllerin hazırlanmasından desteklenen lipit çift katmanlarının oluşumuna kadar iş akışını gösteren şematik. Biorender ile oluşturuldu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Membrana bağlı aktin ağlarının sulandırılması
- Numune odalarının hazırlanması
- 3-5 dikdörtgen cam kapak kapağı alın ve bir Coplin kavanozunun içine yerleştirin. Banyo sonikatörünü açın ve sıcaklığı 65 ° C'ye ayarlayın. Kapak kapaklarını tamamen suya batırmak için Coplin kavanozu% 2 temizleme çözeltisi ile doldurun ve tam darbe modunda 30 dakika boyunca sonikatöre yerleştirin.
- Kapak kapaklarını kavanozdan tek tek çıkarmak için künt PTFE kaplı forseps kullanın. Damıtılmış suyla iyice durulayın ve 2 N NaOH ile doldurulmuş başka bir Coplin kavanozuna yerleştirin.
- Tam darbe modunda kapakları 20 dakika boyunca sonikleştirin. Kapak kapaklarını birer birer çıkarın, damıtılmış suyla iyice durulayın ve damıtılmış suyla doldurulmuş başka bir Coplin kavanozuna yerleştirin.
NOT: İsteğe bağlı olarak, kapakları 20 dakika boyunca damıtılmış suda sonikleştirin ve ardından damıtılmış suyla tekrar durulayın. - Deneye başlamadan hemen önce, kapak kapaklarını içeren kavanozu bir N2 gaz kaynağı ile donatılmış kimyasal bir davlumbaza alın.
- N2 gaz akışının hava basıncını deneme yanılma yoluyla optimize edin, böylece suyu kırılmadan kapak kayma yüzeyinden çıkarmak yeterlidir. Kapak kaymasının kırılma olasılığını azaltmak içinN2 gazının akışını kapak kayma düzlemine paralel olarak hizalayın.
- Kapak kaymalarını kavanozdan tek tek çıkarmak ve N2 akımı altında kurutmak için eldiven ve forseps kullanın. Her bir kapak kapağının her iki tarafını da kurutun ve kapaklı temiz bir plastik ızgaraya yerleştirin. Havadaki toz parçacıklarıyla teması önlemek için kapak kapaklı kutuyu bir kurutucuya yerleştirin.
NOT: N 2 kurutulan kapak fişleri,2 güne kadar hidrofilik kalabilecekleri bir kurutucuda saklanabilir. Bu strateji, deneme için çok sayıda çift katman gerektiğinde veya deneme 8 saatten uzun sürdüğünde yararlı olabilir. - Otoklavlanmış PCR tüplerini alın ve kapaklarını ve alt konik yarılarını keskin bir cerrahi bıçakla kesin. Silindirik yarım kesilmiş tüpleri tek tek alın, her bir kesilmiş tüpün pürüzsüz kenarına UV kürlenebilir yapıştırıcı uygulayın ve yeni temizlenmiş bir kapak kapağı üzerine ters çevrilmiş olarak yerleştirin, böylece jant kapak kayması üzerine düz oturur.
- Tutkalın odanın merkezi boşluğuna dökülmemesini sağlamak için silindiri kapak kayması üzerine yerleştirildikten sonra yanal olarak hareket ettirmeyin. Dikdörtgen kapaklar üç adede kadar reaksiyon odasını rahatça barındırabilir ve yuvarlak olanlar merkezde sadece bir tanesini barındırabilir (Şekil 1).
- Hazneli kapak kapaklarınıO2 beslemeli ve vakumlu bir UV ozon temizleyicinin içine yerleştirin (veya bir UV aydınlatıcı kullanın). UV ışığını açın ve yapıştırıcının polimerize olmasına izin vermek için 3-5 dakika aydınlatın. Kapak camının hidrofilikliğini ve dolayısıyla lipit çift katmanının kalitesini artırmak için daha uzun aydınlatma (10-15 dakika) gerçekleştirin.
- UV aydınlatmalı kuru numune odalarını, havadaki toz parçacıklarıyla teması azaltmak için şeffaf filme sarılmış küçük plastik kutuların (boş dikdörtgen kapaklı kutular gibi) içinde 8 saate kadar saklayın.
NOT: UV ışığının varlığında sabit birO2 akışı, kapak kaymasının yüzeyindeki organik safsızlıkları giderebilen ozon ve oksijen radikalleri oluşturur. Vakum, işlem sırasında oluşan toksik ozonun sızmasını önleyecektir. - Kapak fişlerini çıkarın ve odaları damıtılmış suyla doldurarak sızıntı açısından test edin. Her oda ~ 150 μL'ye kadar numune tutabilir. Sızdıran odaları atın.
NOT: Bir başka harika ve güvenli temizleme seçeneği plazma temizleyicidir. Zaman ve güç ayarları modele bağlıdır, ancak cam slaytlara plazma ile aşırı muamele etmediğinizden emin olun, çünkü bu lipit hareketliliğinin azalmasına neden olur. Yüzey işlemi, temizleme çözeltisi (>45 dakika) veya NaOH (>30 dakika) ile uzun süreli işlemde gözlemlendiği gibi, lipitlerin hareketliliğini etkileyebilir27.
- Desteklenen lipit çift katmanlarının hazırlanması
- Herhangi bir yüzey kirleticisini gidermek için her odayı SLB oluşum tamponu (veya 1x PBS) ile yıkayın ve sonunda 100 μL tampon bırakın. Arabellek seviyesini, hacimdeki değişiklikleri tekrar tekrarlanabilir bir şekilde izlemek için kalıcı bir işaretleyici ile 100 μL'de işaretleyin.
- Odaya 2 μL 0,1 M CaCl2 ekleyin. Bu, veziküllerin cam yüzeye adsorpsiyonunu iyileştirir ve bir sonraki adımda çift katmanlı oluşumu arttırır. Her odaya 8 μL SUV çözeltisi (adım 1.10'dan itibaren.) ekleyin ve 25 ° C'de 15 dakika boyunca inkübe edin.
NOT: Eklenecek SUV karışımının hacmi, kuyunun açıkta kalan hidrofilik alanını iki lipit tabakası ile tamamen kaplamak için gereken toplam lipit sayısının (ortalama 0.72 nm2 alan) hesaplanmasıyla tahmin edilebilir. - Bağlanmamış vezikülleri aktin motilite tamponu (1x KMEH) ile yıkayın. İlk olarak, SLB oluşum tamponunun 50 μL'sini çıkarın ve numune odasında sadece 50 μL bırakın. İkinci olarak, odaya 100 μL 1x KMEH ekleyin. Hafifçe karıştırın ve ardından tabana dokunmadan tamponun 100 μL'sini çıkarın.
NOT: Yıkarken nazik olmak önemlidir. Pipet ucunun haznenin dibine temas etmediğinden emin olun. Pipet, tampon akışını doğrudan çift katmana değil, odanın duvarına yönlendirmek için eğimli tutun, çünkü doğrudan bir akış çift katmanı bozabilir. Pipetleme sırasında herhangi bir hava kabarcığı çıkarmamaya dikkat edin, çünkü hava lipit çift katmanına ulaşabilir ve içinde kusurlara neden olabilir. - 100 μL 1x KMEH ekleyerek ve 100 μL'yi çıkararak yıkamaları 10x tekrarlayın.
- Çift katmana 10 μL 1 mg / mL β-Kazein ekleyin, hafifçe karıştırın ve 5-10 dakika boyunca inkübe edin. β-kazein, çift katmanın oluşmadığı kapak kapağındaki bölgeleri bloke eder. β kazein 3x'i adım 2.2.3'te açıklandığı gibi 1x KMEH ile yıkayın. ve tampon seviyesini 100 μL işaretine geri getirin.
- Membran-aktin bağlayıcı ilavesi
- β inkübasyonu sırasında (adım 2.2.5.), -80 ° C'den bir membran-aktin bağlayıcı protein alikotu alın, 37 ° C'de hızla çözün ve sonra buz üzerinde tutun. Aliquot'u protein seyreltme tamponu ile 1 μM'lik bir konsantrasyona kadar seyreltin.
- Bağlayıcı proteini tanımlanmış bir son konsantrasyonda (tipik olarak 5-20 nM) ekleyin ve yavaşça karıştırın. Odadaki proteinin hızlı bir şekilde dengelenmesini sağlamak için, bağlayıcı proteini 1x KMEH ile önceden karıştırarak 20 μL'den daha büyük hacimler ekleyin.
- Oda sıcaklığında 40 dakika inkübe edin. İlişkisiz HSE proteinini çıkarmak için 3x'i 1x KMEH tamponu ile yıkayın (adım 2.2.3'te olduğu gibi). Her odadaki tampon seviyesini 100 μL işaretine geri getirin. Örnek artık görüntüleme için hazırdır.
- Lipid çift katmanının kalite değerlendirmesi
NOT: Bu, her seferinde gerçekleştirilmesi gerekmeyen isteğe bağlı bir adımdır. Bu değerlendirmenin, dondurulmuş MLV stoklarından her yeni SUV yapıldığında yapılmasını öneririz.- Mikroskopu, uyarma lazerlerini ve algılama kameralarını açın. Lazerin hizalandığından, hedefin temizlendiğinden ve yazılımın görüntü almaya hazır olduğundan emin olun.
- 100x hedefine yağ koyun, numuneyi mikroskop aşamasına monte edin ve hedefi çift katmana odaklayın. Lazer pozisyonunun, numune üzerinde toplam iç yansımaya maruz kalacak şekilde olduğundan emin olun. Çift katmanlı bağlı 10xHis-YFP-EzrinABD'nin floresan yoğunluk dağılımını kontrol etmek için 488 nm uyarma lazeri kullanın.
NOT: İyi kaliteli çift katmanlar, floresan yoğunluğunun büyük ölçekli, homojen bir dağılımını gösterir. Kötü çift katmanlı katmanlar yoğun ve yamalı floresan lekeler gösterir. - Çift katmanın bütünlüğünü belirlemek için, bir FRAP testi yapın.
- Çift katmanda ilgi çekici bir bölge seçin ve 5:1 veya daha yüksek sinyal-gürültü oranı sağlayan görüntüleme koşullarını kullanarak görüş alanının birkaç görüntüsünü kaydedin. Kaydı duraklatın ve floroforları yerel olarak ağartmak için konsantre bir lazer ışınını çift katmanın küçük dairesel bir bölgesine odaklamak için TIRF mikroskobunun alan diyaframını kapatın.
- Küçük bölgeyi 3-10 sn fotobeyazlatmak için lazeri maksimum çıkışına kadar açın ve ardından lazeri kapatın. Alan diyaframını orijinal yarıçapına yeniden açın, görüntüleme durumunu (ön ağartıcı) ayarlarına yeniden ayarlayın ve görüş alanındaki floresan sinyalin geri kazanımını kaydetmek için hemen devam edin.
- Çift katmanın akışkan olup olmadığını kontrol edin. Normal yanal difüzyona sahip iyi çift katmanlı katmanlar hızlı bir şekilde iyileşirken, kötü çift katmanlı katmanlar yavaş iyileşir veya hiç iyileşmez (Şekil 3). Çift katman kurtarılmıyorsa, sorun giderme bölümünü kontrol edin ve yeniden başlatın. Görüntüleri 16 bit TIFF dosyaları olarak kaydedin. Difüzyon katsayısının nicel bir tahmini için, adım 3'ü kontrol edin. aşağıda.
- Floresan aktinin polimerizasyonu
NOT: Zamandan tasarruf etmek için, HSE proteininin çift katmana bağlanma inkübasyon süresi sırasında (adım 2.3.) veya çift katmanın kalite değerlendirmesi sırasında (adım 2.4.) polimerize aktin'i başlatmaya başlayın.- Etiketlenmemiş ve floresan olarak etiketlenmiş G-aktin'i 10: 1 molar oranında karıştırın ve G-Aktin konsantrasyonu 20 μM olacak şekilde G-Buffer ile doldurun. Aktinin nihayet polimerize edildiği konsantrasyon bu değerin 1 / 4'ü olacaktır. 1x çözelti için karışıma 1/10 adet 10x ME tamponu ekleyin ve 2 dakika boyunca inkübe edin. Bu adım, G-aktin'e bağlı Ca 2 + iyonlarını Mg2 + iyonları ile değiştirir. Son hacmin 10 μL'nin katları halinde olduğundan emin olun.
- İstenilen miktarda kapak proteinini aşağıdaki gibi ekleyin. Bir şişe kapak proteini stoğunu 37 ° C'de hızlı bir şekilde çözün ve ardından buz üzerinde tutun. G-tamponu ile seyreltin, böylece kapak proteininin konsantrasyonu, polimerizasyon karışımında istenen nihai konsantrasyonun iki katı olacaktır. Adım 2.5.1'den itibaren aktin karışımına seyreltilmiş kapak proteini çözeltisinin eşit hacmini ekleyin.
- Son olarak, reaksiyon karışımına eşit miktarda taze 2x hedef tampon ekleyin. Çözeltinin son hacmi, adım 2.5.2'nin sonundaki aktin karışımının hacminin dört katı olmalıdır. KMEH'nin nihai konsantrasyonunun 1x, ATP'nin 1 mM, BSA'nın 1 mg / mL ve G-aktin'in 5 μM olduğundan emin olun.
Polimerizasyonun gerçekleşmesine izin vermek için karanlıkta 25 ° C'de 45-60 dakika boyunca inkübe edin.
NOT: Buna, bir hacim Mg2+ G-aktin (adım 2.5.1.) ile bir hacim kapak proteini karışımı (adım 2.5.2.) ve iki hacim 2x hedef tampon (adım 2.5.3.) ile karıştırıldığı hedef tampon stratejisi denir. Bu, aktin miktarını büyütmeyi veya azaltmayı ve kapak proteininin (veya başka herhangi bir aktin modülatörünün; Şekil 4).
- Floresan aktin filamentlerinin eklenmesi
- Birkaç 200 μL ucu keskin bir bıçak veya makasla keserek kör uçlu hale getirin. Gerekli 5 μM polimerize aktin hacmini (adım 2.5.3'ten itibaren) künt uçlu bir pipet ucu ile (aktin filamentlerinin kesilmesini önlemek için) nazikçe pipetlenin ve temiz bir otoklavlanmış PCR tüpüne ekleyin.
- Ses seviyesini >20 μL yapmak için tüpe 1x KMEH ekleyin ve F-aktinin kesilmesini önlemek için hafifçe karıştırın. Monte edilmiş numune odasından, tamponun eşit hacmini çıkarın.
- Polimerize aktin çözeltisini hazneye ekleyin ve alttaki çift katmana dokunmadan 3 kat yukarı ve aşağı hafifçe pipet çekin. Bu, aktin filamentlerinin çift katman üzerinde eşit olarak dağılmasını sağlar. Numuneyi TIRF mikroskobuna takın (bkz. adım 2.4.1. ve adım 2.4.2.).
- F-aktin bağlanma işlemini çift katmana kaydedebilirsiniz. 20-30 dakika kuluçkaya yatırın. F-actin ilavesi sabit bir duruma ulaştıktan sonra farklı görüş alanlarından birkaç görüntü kaydedin. 10xHis-YFP-EzrinABD'nin mekansal organizasyonundaki değişimi (homojen) ve aktin organizasyonundan önce ve sonra gözlemleyin.
NOT: HYE, aktin yokluğunda lipit çift katmanı üzerine eşit olarak dağıtılır. Aktin filamentlerinin eklenmesi üzerine, HYE F-aktin ile kolokalize olur. Kolokalizasyonun derecesi, bağlayıcı proteinin aktin bağlayıcı afinitesine bağlıdır; afinite ne kadar güçlü olursa, kolokalizasyon o kadar yüksek olur ve bağlayıcı proteinin yanal hareketliliği o kadar yavaş olur (Şekil 5).
- Miyozin ilavesi II
- 30 dakikalık aktin inkübasyonundan sonra, numuneyi tekrar mikroskopa monte edin (eğer monte edilmemişse). Bağlayıcı protein ve F-aktin kanallarındaki sinyali kontrol edin. Gerekirse görüntüleme koşullarını ayarlayın.
- Tek tip bağlayıcı protein sinyali ve düzgün dağılmış aktin filamentleri olan ve uzun bir hızlandırılmış kayıt için artefakt içermeyen iyi bir bölge seçin. Miyozin ilavesinden önce 0,1-0,2 Hz'de 10-15 kare kaydedin ve kaydı duraklatın. Gerekli miktarda geri dönüştürülmüş kas miyosin-II'yi stok şişesinden künt uçlu bir pipet ucu ile pipetle çıkarın (miyozin filamentlerinin kesilmesini önlemek için) ve temiz bir otoklavlanmış PCR tüpüne ekleyin.
- Hacmi >20 μL yapmak için hemen tüpe 1x KMEH ekleyin ve yavaşça karıştırın. ATP, ATP yenileyici karışım, foto-stabilize edici ajanlar vb. De eklenebilir. Bu adım sırasında. Tamponun eşit hacimli bir hacmini, monte edilmiş numune haznesinden rahatsız etmeden dikkatlice çıkarın.
- Miyozin çözeltisini numune odasına yavaşça ekleyin. Yüzeye bağlı filamentleri rahatsız edeceğinden yukarı ve aşağı pipet yapmayın. Hemen hızlandırılmış kayda devam edin ve sistemi miyozin öncesi durumdan ATP yakıtlı kontraktil akto-miyozin akışlarına ve aster oluşumundan ATP tükenmiş sıkışmış bir duruma evrimleşirken gözlemleyin (temsili sonuçlara bakınız).
- Yalnızca arabellek örneği kullanarak tüm kanallar için arka plan görüntüleri alın. Tüm görüntüleri 16 bit .tiff dosyaları olarak kaydedin. Sık karşılaşılan sorunları çözmeye yönelik ipuçları için Tablo 2'ye bakın.

Şekil 3: Hızlı FRAP testi ile çift katmanların kalite değerlendirmesi. DOPC ve Ni-NTA lipitlerinden (% 98:2 mol) hazırlanan desteklenen lipit çift katmanları (SLB'ler) HYE (10xHis-YFP etiketli membran-aktin bağlayıcı) ile kaplanır. Bağlanmamış protein yıkandıktan sonra, floresan çift katman bir TIRF mikroskobu altında görüntülenir. Çift katmanlı üzerindeki küçük bir bölge yüksek lazer gücü ile fotobeyazlatılır ve floresan geri kazanımı kaydedilir. (A) İyi bir çift katmanlı her zaman hızlı bir şekilde iyileşir, bu durumda kullanılan lipit bileşimi için beklenen difüzyon katsayısı 1-1.5 μm2 / s'dir. (B) Kötü çift katmanlılar çok yavaş iyileşir veya hiç iyileşmezler. (C) Kötü çift katmanlıların temsili görüntüleri: (C-i) delikli bir çift katmanlı, (C-ii) büyük, hareketsiz lipit yamalı bir çift katmanlı ve (C-iii) küçük, hareketsiz noktalara sahip bir çift katmanlı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
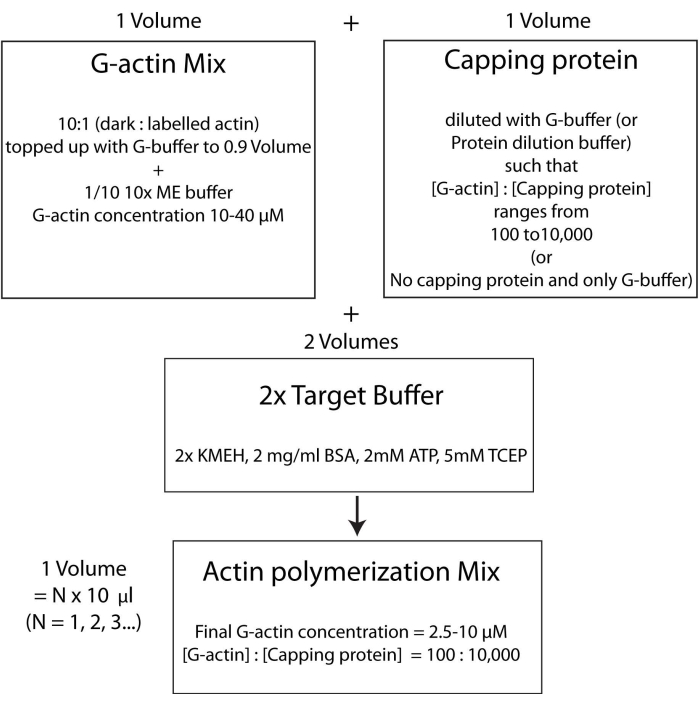
Şekil 4: Hedef tampon yöntemi kullanılarak aktinin nasıl polimerize edileceğini gösteren şema. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: HYE'nin F-aktin'e bağlanması üzerine mekansal organizasyonu. Aktin filamentlerinin eklenmesinden önce ve sonra HYE'nin mekansal organizasyonunu gösteren TIRF anlık görüntüleri (Atto-635 maleimide ile etiketlenmiş). HYE organizasyonu, F-aktin ilavesinden önce homojendir ve aktin filamentleri boyunca birlikte lokalize olur ve birlikte hizalanır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Veri analizi
- Fiji yazılımını kullanarak (https://imagej.net), arka planı bağlayıcı protein görüntülerinden çıkarın (adım 2.4'ten). Ağartılmış noktadan ve bir referans bölgesinden ortalama yoğunluk değerlerini ölçün.
- Ağartılmış noktadan ve referans bölgesinden ilgili ağartma öncesi yoğunluk değerlerinin yoğunluğuna kadar olan zaman izlerini normalleştirin. Normalleştirilmiş ağartılmış bölge değerlerindeki her zaman noktasını, normalleştirilmiş referans bölge zaman izlemesindeki ilgili zaman noktalarına bölün. Arka plan için ve edinme sırasında yoğunluktaki sistematik dalgalanmalar (global fotobeyazlatma, z-sürüklenme, vb.) için ortaya çıkan normalleştirilmiş zaman izini düzeltin.
- Çift katmanlı bağlı proteinlerin difüzyon katsayısını tahmin etmek için bağlantı parçası olmayan, manuel bir yöntem28 kullanın. Kısaca, kurtarma profilinin yarı süresi, τ1/2, normalleştirilmiş kurtarma profilinin kararlı durumunun yarısına ulaştığı zamana bakarak hesaplanabilir:
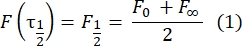
Burada, F 0, fotobeyazlatmadan sonraki ilk karede ağartılan bölgedeki ortalama yoğunluktur ve F∞, çift katmanın geri kazanımının uzun vadeli kararlı durum değeridir. - Fotobeyazlatma sırasında difüzyonu düzelten bir parametre olan etkili ağartıcı yarıçapını, re'yi, ağartma sonrası nokta profili29'un bir çizgi taramasından tahmin edin. Ağartıcı noktasının merkezinden geçen bu çizgi taramasının minimum yarısı olan r 1/2 genişliği, re ile aşağıdaki gibi ilişkilidir:
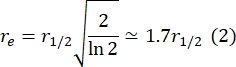
Adım 2.8.3.'te hesaplanan τ1/2, adım 2.8.4.'te hesaplanan r e ve orijinal olarak ayarlanan ağartıcı yarıçapı rn, aşağıdaki formülü kullanarak difüzyon katsayısını (D) hesaplamak için kullanılır: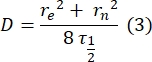
- Çift katmanlı bağlı proteinlerin difüzyon katsayısını tahmin etmek için bağlantı parçası olmayan, manuel bir yöntem28 kullanın. Kısaca, kurtarma profilinin yarı süresi, τ1/2, normalleştirilmiş kurtarma profilinin kararlı durumunun yarısına ulaştığı zamana bakarak hesaplanabilir:
- Aktomiyozin asterlerin görüntü analizi
- Fiji'yi kullanarak, tüm kanallarda kaydedilen tüm görüntülerden arka planı çıkarın. Düz alan düzeltmesini kullanarak düzgün olmayan herhangi bir aydınlatma veya parazit deseni için görüntüleri düzeltin.
NOT: Bu tür düzeltmeleri yapmak için iyi düz örnekler olan renkli plastik slaytlar kullanılabilir. Düzlemsel bir çift katman üzerindeki bağlayıcı protein ve aktin filamentleri için, kanala özgü aydınlatma düzeltme haritaları oluşturmak için çoklu miyozin öncesi görüntülerin ortalama projeksiyonu da kullanılabilir.- Burada gösterilen HYE kanalı için, çoklu HYE görüntülerinin ortalama yoğunluk projeksiyonunu alın (miyozin ilavesinden önce lipit çift katmanının farklı bölgelerinden kaydedilir). Ortalama projeksiyona (miyozin öncesi görüntülerden veya herhangi bir standart düz örnekten) uygun bir Gauss filtresi (σ = 50 piksel ila 80 piksel) uygulayın.
- Filtrelenmiş görüntüyü 32 bit görüntüye dönüştürün. Tüm piksel değerlerini tüm görüntünün ortalamasına bölün. Bu, HYE kanalı için normalleştirilmiş bir düzeltme haritası verecektir. Düz alan düzeltmesi için HYE kanalındaki tüm görüntüleri bu haritayla bölün. Aynı stratejiyi kullanarak diğer kanallar için düzeltme haritaları oluşturun.
- Fiji'de üstel veya basit bir oran yöntemi (yoğunluk bozunma profiline bağlı olarak) kullanarak fotobeyazlatma için doğrudur.
- Herhangi bir zamansal x-y yanlış hizalamasını (translasyonel hareket) düzeltmek için, fotobeyazlatma ile düzeltilmiş tüm kanalları tek bir Hyperstack'te birleştirin. Fiji'deki Hyperstack-Reg eklentisini kullanarak bir Sert Gövde veya Çeviri dönüşümü uygulayın.
- Son olarak, hizalanmış Hyperstack'i tek tek kanallara bölün ve daha fazla analiz için bunları 16 bit TIFF yığınları olarak ayrı ayrı kaydedin.
- Fiji'yi kullanarak, tüm kanallarda kaydedilen tüm görüntülerden arka planı çıkarın. Düz alan düzeltmesini kullanarak düzgün olmayan herhangi bir aydınlatma veya parazit deseni için görüntüleri düzeltin.
Sonuçlar
Temsil için, burada fotobeyazlatmadan sonraki 1. görüntüden tipik bir postağartıcı profili (Şekil 3A'da t = 0 s'deki görüntü) ve aşağıdaki işlev28'e (bkz. Şekil 6A) uyumu gösterilmiştir:

Bu eğriye uyum ile hesaplanan r e (23.94 μm) değeri, adım 2.8.4'te hesaplanan re'ye çok benzer. (23.24 μm). Burada K, F0'dan doğrudan tahmin edilebilen bir ağartıcı derinliği parametresidir (adım 2.8.4'te açıklanmıştır). Benzer şekilde, Şekil 6B, kurtarma profilini ve aşağıdaki işlev28'e uyumunu gösterir:
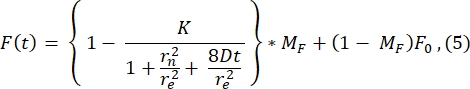
Difüzyon katsayısının takılı değerini 1.34 μm 2 / s olarak buluyoruz, bu da adım 2.8.4'teki formülle hesaplanan 1.39 μm2 / s değeriyle yakından aynı fikirde olan bir değer. Burada, MF, geri kazanılan ağartılmış popülasyonun fraksiyonunu temsil eden lipit çift katmanının hareketli fraksiyonunu temsil eder. Lipide bağlı moleküllerin hareketliliği, elbette, lipit bileşimine ve fiziksel durumuna (sıvı veya jel fazı) bağlıdır. DOPC bazlı lipit membranları kullanan deneylerimiz için, hareketlilik >1 μm2 / s olmalı ve iyi bir lipit çift katmanını belirtmek için mobil fraksiyon 0.9'dan az olmamalıdır. Çift katmanın kalitesini ve hareketliliğini hızlı bir şekilde test etmek için manuel bağlantı gerektirmeyen yöntemin kullanılmasını öneririz. Montaj yöntemi, birçok FRAP eğrisi için analizi otomatikleştirirken yararlı olabilir. Ayrıca, sistemdeki difüzyonu sistematik olarak karakterize etmek için daha sofistike bir FRAP deneyi yapmak istiyorsak, okuyucuyu deneysel tasarımdaki modellerin ve potansiyel tuzakların takılması hakkında daha fazla ayrıntı için Lorén ve ark.30'dan bu incelemeye tavsiye ederiz.

Şekil 6: Lipid çift katmanlarının difüzyon katsayısının ölçülmesi. (A) Fotobeyazlatmadan sonraki ilk görüntünün çizgi profili ( Şekil 3A'da t = 0 s) ve etkili ağartıcı yarıçapını hesaplamak için denklem 4'e uyumu. (B) Ağartılmış bölgenin geri kazanım profili ve difüzyon katsayısını ve hareketli fraksiyonu hesaplamak için denklem 5'e uyumu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
TIRF mikroskobu ile görüntülenen desteklenen bir lipit çift katmanlı üzerine bağlı bir akto-miyozin ağının dinamik montajını ve organizasyonunu gösteren yukarıda açıklanan deneylerin tipik bir sonucu Şekil 7 ve Ek Video S1'de gösterilmiştir.
Şekil 7 , bağlayıcı protein, F-aktin ve miyosin-II'nin görüntü montajını göstermektedir.
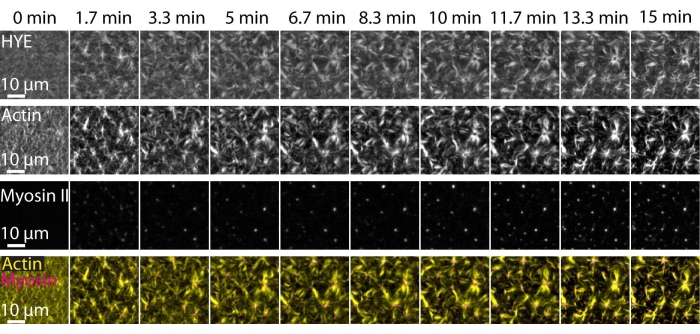
Şekil 7: Kontraktil aktomiyozin akışları, membran-aktin bağlayıcı protein HYE'nin lokal kümelenmesini sağlar. HYE ve F-aktin içeren bir SLB'ye miyozin II eklenmesi üzerine HYE (YFP etiketli), aktin filamentlerinin (Atto-635 maleimid ile etiketlenmiş) ve miyozin II filamentlerinin (Atto-565 maleimid ile etiketlenmiş) TIRF anlık görüntüleri. Süre üstte belirtilmiştir: TIRF alanında floresan miyofilamentlerin ortaya çıkmaya başlamasından hemen önce 0 dakikadır. HYE ve F-aktin, miyozin ilavesinden önce (0 dakika) lipid çift katmanı üzerine homojen olarak dağıtılır. Myosin aktivitesi, kararlı durumda (15 dakika) aster benzeri yapılara ortaya çıkan ve bağlı membran bileşeninin (HYE) yerel kümelenmesini sağlayan kontraktil aktomiyozin akışlarını indükler. En düşük sıra, aktin (sarı) ve miyozin II (macenta) görüntülerinin farklı zaman noktalarında aktin ve miyozin organizasyonunu gösteren bir birleşimidir. Bu montajların yapımında kullanılan görüntüler Fiji'de arka plan sinyali, düzgün olmayan yoğunluk kalıpları ve translasyonel hareket için düzeltildi. Ölçek çubuğu = 10 μm. Ayrıntılar için Ek Video S1 başlıklı makaleye bakın. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Arabellek Adı | Kompozisyon | |
| Lipid Rehidrasyon tamponu | 50 mM HEPES, 150 mM NaCl, %5 sakaroz, pH 7,5 | |
| SLB Oluşum tamponu | 50 mM HEPES, 150 mM NaCl, pH 5-6 | |
| SLB Depolama tamponu | 50 mM HEPES, 150 mM NaCl, pH 7,2 | |
| Protein Seyreltme tamponu | 20 mM HEPES, 100 mM KCl, 1mM TCEP veya DTT, pH 7,2 | |
| 1X ME veya Aktin iyon değişim tamponu | 50 mM MgCl2, 0,2 mM EGTA, 10 mM HEPES, pH 7,2 (4°C'de depolayın) | |
| 1X KMEH veya Aktin polimerizasyon tamponu | 50 mM KCl, 1 mM MgCl2, 1 mM EGTA, 50 mM HEPES, pH 7,2 | |
| 100 mM ATP stok | 100 mM ATP disodyum tuzu, 50 mM Tris, 50 mM NaCl, 5 mM MgCl2, 2 mM EGTA, pH 7.5 (-20°C'de saklayın) | |
| 2x Hedef arabellek | 2x KMEH, 2 mg/ml BSA, 2mM ATP, 5mM TCEP (4°C'de depolanır) | |
| G-tamponu | 2 mM Tris, 0,1 mM CaCl2, 0,2 mM ATP, 0,5 mM TCEP, %0,04 NaN3, pH 8 (4°C'de saklayın) | |
| Myosin II tampon | 500 mM KCl, 1 mM EDTA, 10-20 mM Ağırlık, pH 7,0 | |
| Jel filtrasyon kromatografisi tamponu | 50 mM Tris-HCl, 150-300 mM NaCl, 5 mM TCEP, %0,1 Ara-20, pH 7,5 | |
| Protein depolama tamponunun kapatılması | 10 mM Tris· Cl, 50 mM NaCl, 1 mM TCEP, pH 7.5, %20 gliserol | |
Tablo 1: Bu protokolde kullanılan tampon bileşimlerinin listesi.
| Sık karşılaşılan sorunlar ve bunların sorun giderme | Sorun | Neden | Olası çözümler | ||||||
| 1 | Lipid çift katmanlı difüzyon göstermez | Bu sorunun en olası nedeni, temizleme çözeltisi yaşlandığında veya banyo sonikasyonu sırasında ısıtma gerçekleşmediğinde meydana gelebilecek kirli kapak camıdır. Bu çift katmanlar 'veziküler' bir görünüme sahiptir, çünkü patlamış veziküller kapak camına yapışır, ancak birbirleriyle kaynaşmaz. 6 haftadan eski MLV'leri veya 6 günden eski SUV'ları kullanmak veya düşük miktarda SUV eklemek de veziküler çift katmanlı oluşumuna yol açabilir. | Taze temizleme solüsyonu kullanın. Isıtıcının açık olduğundan ve sıcaklığın 45-65 ° C arasında olduğundan emin olun. Taze lipit karışımları kullanın. (Bir floresan protein probuna karşı bir floresan lipit probu kullanmak bazen farklı şekilde ortaya çıkabilir. örneğin, çift katmanın alt kırınım kusurları varsa ve yüzey pasivasyon adımı atlanırsa (veya çalışmazsa), lipit probu eşit bir yoğunluk dağılımı gösterecektir, ancak floresan protein probu parlak floresan lekeleri gösterebilir. ) | ||||||
| 2 | Lipid çift katmanlı parlak yamalara sahiptir | SUV'ların çift katmanlı oluşum için uzun süre inkübasyonu, genel olarak dağınık ancak ara sıra parlak yamalarla bir lipit çift katmanı oluşturabilir. Bu yamalar, büyük miktarlarda floresan probu çekebilen çok katmanlı çift katmanlı olabilir. | SUV'larla 15-20 dakikalık kuluçka yeterlidir. Probun toplanmadığından emin olun: bağlayıcı proteinin hızlı bir sert dönüşü (4 ° C'de 15 dakika boyunca 300 x g) agregaları çıkarabilir | ||||||
| 3 | Lipid çift katmanının karanlık delikleri vardır | Bu, çift katmanlı eski SUV'lardan yapıldığında ve uzun saatler boyunca (> 4 saat sonra) görüntülendiğinde veya çözeltinin pH'ı uzun süreli görüntüleme nedeniyle (örneğin, yüksek ATP durumunda ve belirli oksijen temizleyicilerinin varlığında) veya yüzey beta-Kazein ile aşırı pasifleştirildiğinde (10-15 dakikadan fazla bir süre için çok fazla beta-Kazein eklendiğinde veya yıkanmadığında) meydana gelir. | Taze lipitler kullanın. Görüntüleme kare hızını veya etkili lazer aydınlatma süresini azaltın. Daha yüksek arabelleğe alma kapasitesine sahip arabellekler kullanın. | ||||||
| 4 | Lipid çift katmanı yavaş difüzyon gösterir | Yüksek kolesterol yüzdesine sahip lipit çift katmanları, uzun doymuş lipitler veya yüklü lipitler daha yavaş yayılır. | Bu gibi durumlarda, numunenizi yüksek bir sıcaklıkta hazırlayın. Basit, test edilmiş bir lipit bileşimi, karmaşık ve test edilmemiş lipit bileşimleri ile birlikte bir kontrol olarak da kullanılabilir. Camın temiz olduğundan emin olun. | ||||||
| 5 | Aktin polimerize olmaz | Hedef tampon eski, G-aktin stoğu çok eski, eski ve yeni G-aktin kopolimerize edildi. | Polimerizasyondan önce Ca 2+'nın Mg2+ ile değiştirildiğinden emin olun (ME tamponu kullanarak). Taze ATP-Mg2+ stoğu kullanın. Yeni geri dönüştürülmüş G-aktin kullanın. Çift katmana eklenen F-aktin konsantrasyonunun (G-aktin açısından) 0.2 μM'den yüksek olduğundan emin olun. Daha düşük konsantrasyonlar için, falloidin stabilize F-aktin kullanın. | ||||||
| 6 | Aktin, çift katmana bağlanmaz | Membran-aktin bağlayıcı çok düşük konsantrasyonda eklenmez veya eklenmez – bu, bağlayıcı proteinin floresansından çıkarılabilir. Floresan iyi ise, membran-aktin bağlayıcı aktin bağlama kapasitesini kaybetmiştir. Ayrıca, bağlayıcı protein cam yüzeye spesifik olarak bağlı değilse (çift katman kötü olduğunda), aktin filamentlerini işe almayabilir. | Çift katmanın yayıldığından emin olun. Taze bağlayıcı protein kullanın | ||||||
| 7 | Floresan F-aktin sinyali zayıf | Etiketli koyu aktin'e oranı çok düşüktür. Etiketli aktin veya etiketsiz aktin çok eskidir ve birbirleriyle kopolimerize olmazlar. | Aktin'i tekrar geri dönüştürün ve yeni geri dönüştürülmüş aktin ile ploymerizasyonu yeniden deneyin. Fotohasar, F-aktin'i yok edebilir veya depolimerize edebilir; mümkünse, aktin (ve miyosin) için kırmızı veya uzak kırmızı boyalar kullanın. | ||||||
| 8 | Myosin kontraktiliteyi göstermez | miyozin infüzyonlu sisteme ATP eklendikten sonra, akto-miyozinin kontraktilitesinin olmadığı gözlenebilir. | Miyozin konsantrasyonunun veya saflık seviyesinin iyi olup olmadığını kontrol edin. Taze geri dönüştürülmüş miyozin kullanın (geri dönüşümden sonraki 6 hafta içinde kullanın). Miyozin karışımına taze ATP eklemek yardımcı olabilir. Gazdan arındırıcı tamponlar ve oksijen temizleyicileri vb. Kullanmak. motorların fotohasarını azaltabilir. Daha fazla bilgi, Plastino ve ark. veya Stam ve ark. tarafından aynı yöntem koleksiyonunun protokollerinde bulunabilir. | ||||||
| 9 | Kapak camı hidrofilik değildir | Kapak camı düzgün temizlenmemiş. | Temiz hidrofilik kapak camı, lipit çift katmanlı oluşum için çok önemlidir. Temizleme protokolünden sonra kapak camının hidrofilikliğinin yararlı, görsel bir okuması, camın suyla ıslanmasını gözlemlemektir. Düz yatan bir örtüye az miktarda su ekleyin. Kapak kayması düzgün bir şekilde temizlenmezse su yuvarlak bir damlacık şeklinde kalacaktır. Bununla birlikte, aynı miktarda su yayılacak ve işlenmiş bir hidrofilik kapak camı üzerinde ince bir tabaka oluşturacaktır. Suyun kapak camı yüzeyindeki bu ıslanma davranışı, temizleme çözeltisi / NaOH ile temizleme adımlarının işe yarayıp yaramadığını belirlemek için kullanılabilir. | ||||||
Tablo 2: Sık karşılaşılan sorunları ve ilgili çözümleri özetleyen sorun giderme kılavuzu.
Ek Video S1: Kasılma aktomiyozin akışları, membran-aktin bağlayıcı protein HYE'nin yerel kümelenmesini sağlar. HYE ve F-aktin içeren bir SLB'ye miyozin II'nin eklenmesi üzerine HYE (YFP etiketli), aktin filamentlerinin (Atto-635 maleimid ile etiketlenmiş) ve miyozin II filamentlerinin (Atto-565 maleimid ile etiketlenmiş) TIRF zaman aşımı. Süre üstte belirtilmiştir: TIRF alanında floresan miyofilamentlerin ortaya çıkmaya başlamasından hemen önce 0 dakikadır. Ölçek çubuğu = 10 μm. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, çok yönlü bir platform ve hücrelerin membran-korteks arayüzünü incelemek için deneyler tasarlamak için bir başlangıç noktası sunar. Kritik adımlar, verimli SUV oluşumu için taze lipitler kullanılarak temiz cam slaytların hazırlanması (her ikisi de SLB'lerin kalitesini etkiler) ve dinamik aktin filament reorganizasyonu için taze geri dönüştürülmüş miyozin II proteinlerinin kullanılmasıdır. Dinamiği uzun süre görüntülerken, bir oksijen temizleyici sistemi (örneğin, protokateçuik asit ve protokateçuat 3 4-dioksijenaz 5,31) dahil etmek çok önemlidir.
Açık odacıklı tasarım, lipit akışlarını indüklemeden bileşenlerin mevcut bir sisteme sıralı olarak eklenmesini sağlar. Bu, yaygın olarak kullanılan, kapalı odacıklı yaklaşımlara göre önemli bir avantaj olabilir veya lipozomlar içinde kapsüllenmiş proteinler kullanılarak çalışabilir36. Protein kaynaklı membran deformasyonu gibi zıt etkiler, cam adsorbe edilmiş lipid çift katmanları ile incelenemez.
Lipid çift katmanları, çok çeşitli lipit bileşimleri ile oluşturulabilir. Lipid veziküllerinin hidrofilik cam yüzeye adsorpsiyonu ile başlar, ardından yüzey-vezikül ve doğrudan vezikül-vezikül etkileşimleri nedeniyle kendiliğinden vezikül rüptürü veya adsorbe edilmiş veziküllerin kritik bir kapsama alanına ulaşması ile başlar, bundan sonra veziküllerin küçük bir kısmı yırtılır, aktif kenarlar oluşturur ve bu da sonunda çift katmanlı formasyona yol açar32 . Camın yanı sıra, Mika (örneğin, atomik kuvvet mikroskobu için), yumuşak substratlar (örneğin, poli-di-metil-siloksan), polimer yastıklar33,34,35, elektron mikroskobu ızgaralarının delikleri arasında uzanan desteklenen lipit çift katmanları oluşturmak için çeşitli substratlar kullanılabilir 14. Damlacık arayüzü çift katmanları, kararlı, bağımsız lipit çift katmanlı36 oluşturmak için başka bir ilginç yöntemdir. Akto-miyozin ağlarının veziküllere veya emülsiyonlara dahil edilmesi, bu minimal sistemi hücre benzeri bir geometride incelemek için çok güçlü bir yöntemdir 37,38 ve başka bir yerde ayrıntılı olarak açıklanmıştır39.
Açıklamalar
Yazarların beyan edecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma AXA araştırma fonu ve DVK için Warwick-Wellcome Kantitatif Biyotıp Programı (Wellcome ISSF, RMRCB0058), AB ve ST için NCBS-TIFR ve SM için Wellcome-DBT Margdarshi bursu (IA/M/15/1/502018) tarafından desteklenmiştir. DVK ayrıca Biyofizik Derneği'ne "Molekülerden mezo ölçeğine kadar çok bileşenli sitoiskelet ağlarını anlamadaki zorluklar" sanal ağ etkinliğini etkinleştirdiği için teşekkür eder. bu protokol koleksiyonunun oluşturulmasına katkıda bulunmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,2 dipalmitoyl-sn-glycero-3-phosphoethanolamine-N- (lissamine rhodamine B sulfonyl) | Avanti Polar Lipids | 810158 | 16:0 RhoPE |
| 1,2-dioleoyl-sn-glycero-3- [(N-(5-amino-1 carboxypentyl) iminodiacetic acid) succinyl] (nickel salt) | Avanti Polar Lipids | 790404 | DGS-NTA-Ni2+ |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850375 | DOPC |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850355 | DPPC |
| Amber glass vials | ThermoFisher | B7990-2A | |
| ATP disodium salt | Sigma Aldrich | A26209 | |
| Attofluor cell chamber | ThermoFisher | A7816 | |
| Bath sonicator | GT Sonic | 1860QTS | |
| beta-casein | Sigma Aldrich | C6905 | |
| CaCl2 | ThermoFisher | 12135 | |
| chloroform | Sigma Aldrich | 650471 | alternatively from Electron Microscopy Sciences, 50980296 |
| Cover slips, #1, 25 mm diameter, Gold Seal | Harvard Apparatus | 64-0705B | |
| Cover slips, #1, 40x22 mm, Gold Seal | ThermoFisher | 48404-031 | |
| EDTA | ThermoFisher | G12635 | |
| EGTA | Himedia | MB130 | |
| Gas tight glass syringes, with removebla needle, blunt, volumes 10 µL, 100 µL, 500 µL | Hammilton | 1700 series | |
| Hellmanex III | Hellma Analytics | Z805939 | cleaning solution |
| HEPES | Himedia | RM380 | |
| KaH2PO4 | ThermoFisher | G13405 | |
| KCl | ThermoFisher | G13305 | |
| KOH | ThermoFisher | G26708 | |
| Lipid extruder | Avanti Polar Lipids | 61000-1EA | |
| MgCl2 | ThermoFisher | G15535 | |
| Microtip sonicator | Sonics | VC750 | 3 mm Tip diameter |
| Na2CO3 | ThermoFisher | G15955 | |
| NaCl | Himedia | GRM853 | |
| NaH2PO4 | ThermoFisher | G15825 | |
| NaOH | ThermoFisher | G27815 | |
| Nikon Ti Eclipse TIRF microscope | Nikon | With a TIRF unit connected through a polarization-conserving optical fibre to an Agilent monolithic laser combiner MLC400 with multiple laser lines with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) | |
| NOA88 | Norland Products | 8801 | |
| PTFE Coated Tweezer Style #2A | Structure Probe | 0S2AT-XD | |
| Refrigerated microcentrifuge | Eppendorf | 5424R | |
| Sucrose | ThermoFisher | G15925 | |
| UV-illuminator | Novascan | PSD PRO-UV | needs vacuum and O2 supply |
Referanslar
- Köster, D. V., Mayor, S. Cortical actin and the plasma membrane: Inextricably intertwined. Current Opinion in Cell Biology. 38, 81-89 (2016).
- Rao, M., Mayor, S. Active organization of membrane constituents in living cells. Current Opinion in Cell Biology. 29, 126-132 (2014).
- Honigmann, A., et al. A lipid bound actin meshwork organizes liquid phase separation in model membranes. eLife. 3, 01671(2014).
- Das, A., et al. Stratification relieves constraints from steric hindrance in the generation of compact actomyosin asters at the membrane cortex. Science Advances. 6 (11), (2020).
- Köster, D. V., et al. Actomyosin dynamics drive local membrane component organization in an in vitro active composite layer. Proceedings of the National Academy of Sciences. 113 (12), 1645-1654 (2016).
- Vogel, S. K., Heinemann, F., Chwastek, G., Schwille, P. The design of MACs (minimal actin cortices). Cytoskeleton. 70 (11), 706-717 (2013).
- Murrell, M., Thoresen, T., Gardel, M. Reconstitution of contractile actomyosin arrays. Methods in Enzymology. 540, 265-282 (2014).
- Mosby, L. S., et al. Myosin II filament dynamics in actin networks revealed with interferometric scattering microscopy. Biophysical Journal. 118 (8), 1946-1957 (2020).
- Seara, D. S., et al. Entropy production rate is maximized in non-contractile actomyosin. Nature Communications. 9 (1), 4948(2018).
- Linsmeier, I., et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7, 12615(2016).
- Vogel, S. K., Petrasek, Z., Heinemann, F., Schwille, P. Myosin motors fragment and compact membrane-bound actin filaments. eLife. 2, 00116(2013).
- Ditlev, J. A., et al. A composition-dependent molecular clutch between T cell signaling condensates and actin. eLife. 8, 42695(2019).
- Banjade, S., Rosen, M. K. Phase transitions of multivalent proteins can promote clustering of membrane receptors. eLife. 3, 04123(2014).
- Heinemann, F., Vogel, S. K., Schwille, P. Lateral membrane diffusion modulated by a minimal actin cortex. Biophysical Journal. 104 (7), 1465-1475 (2013).
- Vogel, S. K., Greiss, F., Khmelinskaia, A., Schwille, P. Control of lipid domain organization by a biomimetic contractile actomyosin cortex. eLife. 6, 24350(2017).
- Block, S. Brownian motion at lipid membranes: A comparison of hydrodynamic models describing and experiments quantifying diffusion within lipid bilayers. Biomolecules. 8 (2), 30(2018).
- JoVE, JoVE. JoVE Methods Collection. In vitro reconstitution of cytoskeleton networks for biomaterials, biophysics and active matter research. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Enzymology. 85, 164-181 (1982).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Pollard, T. D. Myosin purification and characterization. Methods in Cell Biology. 24, 331-371 (1982).
- JoVE Science Education Database. Separating protein with SDS-PAGE. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Bieling, P., et al. WH2 and proline-rich domains of WASP-family proteins collaborate to accelerate actin filament elongation. The EMBO Journal. 37 (1), 102-121 (2018).
- Shrivastava, R., Köster, D., Kalme, S., Mayor, S., Neerathilingam, M. Tailor-made ezrin actin binding domain to probe its interaction with actin in-vitro. PLoS One. 10 (4), 0123428(2015).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5, 5412(2014).
- Selden, N. S., et al. Chemically programmed cell adhesion with membrane-anchored oligonucleotides. Journal of the American Chemical Society. 134 (2), 765-768 (2012).
- Seu, K. J., et al. Effect of surface treatment on diffusion and domain formation in supported lipid bilayers. Biophysical Journal. 92 (7), 2445-2450 (2007).
- Kang, M., Day, C. A., Kenworthy, A. K., DiBenedetto, E. Simplified equation to extract diffusion coefficients from confocal FRAP data. Traffic. 13 (12), 1589-1600 (2012).
- Kang, M., Day, C. A., Kenworthy, A. K. A novel computational framework for D(t) from Fluorescence Recovery after Photobleaching data reveals various anomalous diffusion types in live cell membranes. Traffic. 20 (11), 867-880 (2019).
- Lorén, N., et al. Fluorescence recovery after photobleaching in material and life sciences: Putting theory into practice. Quarterly Reviews of Biophysics. 48 (3), 323-387 (2015).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (7), 1-7 (2013).
- Andrecka, J., Spillane, K. M., Ortega-Arroyo, J., Kukura, P. Direct observation and control of Supported lipid bilayer formation with interferometric scattering microscopy. ACS Nano. 7 (12), 10662-10670 (2013).
- Lin, W. -C., et al. Supported membrane formation, characterization, functionalization, and patterning for application in biological science and technology. Current Protocols in Chemical Biology. 2 (4), 235-269 (2010).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: An integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sapuri-Butti, A. R., Butti, R. C., Parikh, A. N. Characterization of supported membranes on topographically patterned polymeric elastomers and their applications to microcontact printing. Langmuir. 23 (25), 12645-12654 (2007).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Bashirzadeh, Y., Moghimianavval, H., Liu, A. P. Encapsulated actomyosin patterns drive cell-like membrane shape changes. iScience. 25 (5), 104236(2022).
- Bashirzadeh, Y., Wubshet, N., Litschel, T., Schwille, P., Liu, A. P. Rapid encapsulation of reconstituted cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. (177), e63332(2021).
- Murrell, M., Chen, S., Sun, Z. G. In vitro reconstitution of actin cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. , (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır