Method Article
支持脂質二重層上の膜テザー最小アクチン皮質の再構成
要約
このプロトコルでは、蛍光顕微鏡を使用して再構成された膜テザー細胞骨格ネットワークのダイナミクスを研究するための、支持された脂質二重層の形成、および細胞骨格フィラメントとモータータンパク質の添加について説明します。
要約
生細胞の表面は、原形質膜とその下にあるアクチン皮質との相互作用から生じる多数の細胞プロセスのための多用途の活性プラットフォームを提供します。過去数十年の間に、アクチンフィラメントネットワークと組み合わせた支持脂質二重層に基づく再構成された最小システムは、膜テザーアクチンネットワークの基本的なメカニズムと結果を解明し、個々の膜関連タンパク質の機能を研究するのに非常に役立つことが証明されています。ここでは、膜結合性アクチン結合タンパク質を介して結合した流体支持脂質二重層から、全反射蛍光顕微鏡で容易に観察できる動的アクチンフィラメントおよびミオシンモーターからなるこのような活性複合システムを in vitro で再構成する方法について説明します。オープンチャンバー設計により、システムを段階的に組み立て、リンカータンパク質濃度、アクチン濃度、アクチンフィラメント長、アクチン/ミオシン比、ATPレベルなどの多くのパラメータを体系的に制御できます。最後に、システムの品質を制御する方法、一般的に発生する問題を検出してトラブルシューティングする方法、および生細胞表面と比較したこのシステムのいくつかの制限について説明します。
概要
生きている動物細胞の原形質膜は、隣接するアクチン細胞骨格と絶えず相互作用し、そしてそれらが一緒になって多数の細胞機能を果たす活性複合材料を形成する1,2。この脂質膜-アクチン界面のプロセスを研究するには、支持された脂質二重層(SLB)上の細胞骨格ネットワークの再構成が非常に有用であることが証明されています。この最小限のシステムアプローチにより、細胞骨格ネットワーク成分と脂質組成を正確に制御できます。巨大な単層小胞の自立型脂質膜と比較して、SLBの平面形状により、超解像3,4、全反射蛍光(TIRF)5,6,7、干渉散乱8などの最先端の顕微鏡技術を効率的に使用できます。 細胞骨格ネットワークの空間構成とダイナミクスを研究する。TIRFは、バックグラウンドシグナルに寄与する溶液中の未結合標識分子のシグナルが最小限であるため、蛍光標識成分に対して最高のコントラストを提供します。
ここでは、活性な準2Dネットワークの物理と膜組織への影響を研究するために現場で広く使用されている、支持された脂質二重層につながれたアクトミオシンネットワークの形成のための基本的なプロトコルについて説明します9,10,11および膜組織3,5,12,13,14,15,16(図1).このアプローチは、アクチンベースのネットワークに限らず、微小管、中間フィラメント、または混合された性質の複合ネットワークを探索し、表面感度顕微鏡法を使用して脂質膜タンパク質と細胞骨格成分の間のさまざまな相互作用を研究するためにも簡単に適応できます。
このプロトコルに焦点を当て続けるために、アクチンおよびミオシンタンパク質の精製および標識の詳細な説明、またはアクトミオシンネットワークの収縮性と構成を調整および制御する方法に関する詳細は除外しました。JoVEメソッドコレクション、生体材料、生物物理学、活性物質研究のための細胞骨格ネットワークのIn vitro再構成17でこれと一緒に公開されている他のプロトコルを参照する必要があります。

図1: in vitro アクチン膜活性複合システムの概略図。 バイオレンダーで作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
1. 試薬および装置
- 表1にリストされているように、新しいバッファーを準備します。抵抗率18.2MΩ・cmの超高純度脱イオン水(25°C)を使用してください。 すべてのバッファーを真空下で0.22 μmフィルターに通して滅菌します。カラムクロマトグラフィーに使用するバッファーを脱気します。
- 骨格筋アクチンを前述のように精製する18,19。最終精製G-アクチン溶液に20%グリセロールを加え、500 μL(標識またはバルク実験用)および10 μL(個別実験用)の容量のアリコートを作ります。チューブを液体窒素に30秒間浸してアリコートを急速凍結し、-80°Cで最大18か月間保管します。
注:あるいは、精製されたアクチンまたはアセトン粉末を市販品として購入することもできます。 - 精製された骨格筋Gアクチンを前述の任意の蛍光マレイミド色素で標識する5。アクチンについて補正されたA 290nm(εactin =26,600 M-1 cm-1)および色素のAλmaxを用いて分光光度法によりタンパク質の濃度および標識度を決定する。10 μLのアリコートを作り、チューブを液体窒素に30秒間浸して瞬間凍結し、-80°Cで最大18か月間保存します。
注:リジン結合NHSエステルによる標識は、非機能性アクチンを生成するため、避ける必要があります。 - 骨格筋ミオシンIIを精製するには、プロトコル20に従います。10%ポリアクリルアミドゲルを使用してSDS-PAGEを実行し、続いてクマシー染色を行い、タンパク質21の純度レベルを決定しました。精製した骨格筋ミオシン-IIを-20°Cで液体の形で、50%グリセロールを含むミオシンIIバッファーに保存します。
注:保存されたミオシンIIは最大2年間使用できます。 - 精製ミオシン-IIを先に述べた任意の蛍光マレイミド色素で標識する5.ミオシンモーターをNHSエステル色素で標識することは避けてください。.色素のA280nm のミオシンIIおよびAλmax を補正して分光光度法により標識の濃度および程度を決定する。リサイクルミオシンII(ダークまたはラベル付き)を4°Cで保存し、6週間以内に使用してください。
- キャッピングタンパク質の精製
- マウスキャッピングタンパク質は、以前のプロトコル22に従って取得します。10%ポリアクリルアミドゲルを使用してSDS-PAGEを実行し、続いてクーマシー染色を行い、タンパク質の純度レベルを測定しました。A280nmのキャッピングタンパク質(εCP = 99,530 M-1 cm-1)を用いて濃度を測定します。
- タンパク質溶液に20%グリセロールを加え、200 μL PCRチューブに5 μLのアリコートを作ります。チューブを液体窒素に突っ込み、-80°Cで最大2年間保管します。
注:キャッピングタンパク質活性は、異なる量のキャッピングタンパク質の存在下で一定量の蛍光G-アクチンを重合することによってチェックされます。次に、フィラメントを顕微鏡でイメージングし、その長さ分布を定量化します。キャッピングタンパク質の相対濃度が高いほど、アクチンフィラメントの分布は短くなります。Köster et al.5を参照されたい。
- 蛍光膜-アクチンリンカータンパク質を発現し、例えば、このプロトコルでは10xHis-YFP-EzrinABD(HYE)を使用し、それをBl21DE3* 大腸菌で発現させ、前述のように精製します23。分光光度法によりタンパク質の濃度を決定する。
- タンパク質を少量のアリコートで、ゲルろ過クロマトグラフィーバッファー(またはその他の適切なバッファー)に20%グリセロールとともに-80°Cで保存します。 これらの条件下では、タンパク質は2年以上安定しています。
注:アクチン膜リンカータンパク質と蛍光マーカーの選択は、取り組んでいる質問の種類によって異なります。過去数年間、ヒスチジンタグ付きタンパク質24、ビオチン-ストレプトアビジン25、一本鎖DNA26など、幅広い脂質結合戦略が開発されてきました。 - マルチラメラベシクル(MLV)の調製
注:MLVからサポートされている脂質二重層へのワークフローを 図2に示します。- 5〜10個の琥珀色のガラスバイアルを200mLのガラスビーカーに入れます。ガラスバイアルを沈めるのにちょうど十分な2%洗浄液でビーカーを満たします。フルパルスと65°Cで30分間水浴中でそれらを超音波処理する。
- 溶液からバイアルを取り出し、蒸留水で十分にすすいでください。バイアルを2N NaOHを含むガラスビーカーに入れ、20分間超音波処理します。このステップでは加熱は必要ありません。
- NaOH溶液からバイアルを取り出し、蒸留水で十分にすすいでください。バイアルを65°Cに設定された熱風オーブン内で2時間以上乾燥させます。
- 洗浄したバイアルを透明フィルムで密封した清潔なビーカーに最大6週間保管します。
注意: 化学ヒュームフード内で次の手順を実行します。クロロホルムと脂質溶液は、プラスチックによる汚染を避けるために、気密性のあるハミルトンガラスシリンジで処理します。 - ハミルトンシリンジといくつかの琥珀色のガラスバイアルを純粋なクロロホルムで複数回すすぎます。ガラスアンプルに保存された脂質粉末を-20°Cの冷凍庫から取り出し、適切な量のクロロホルムを加えて脂質粉末を10〜25 mg / mLの濃度に溶解します。
- 溶液をアンプルから洗浄したばかりの琥珀色のガラスバイアルに移し、適切にラベルを付けます。氷上でこのステップを実行して、クロロホルムの蒸発を減らします。
- 濃度10〜25 mg / mLのDOCCストック溶液と1〜10 mg / mLの濃度のDGS-NTA-Ni2+ を作成します。
- 実用的な脂質ミックスを作るには、清潔なガラスバイアルを取り、クロロホルムで2回すすいでください。300 μLの純粋なクロロホルムをバイアルに加え、成分をよりよく混合するためのベースとして機能します。これは、次のステップですべてのクロロホルムが乾燥するため、脂質の最終濃度には影響しません。
- 測定された量のストック脂質溶液をバイアルに追加して、目的の実用的な脂質ミックスを作成します。脂質再水和バッファー中の目標脂質濃度は4 mMです。室温で化学フード内のN2 ガスのゆっくりとした流れの下で脂質混合物を乾燥させる。このステップは、バイアルごとに最大30分かかる場合があります。
- すべての溶媒が乾燥したら、脂質フィルムを室温で>2時間真空乾燥して、残っているクロロホルムの痕跡を取り除きます。乾燥脂質混合物を脂質再水和バッファーに再懸濁し、最終脂質濃度を4 mMにします。
- 脂質の再水和を可能にするために5〜10分間インキュベートします。脂質溶液を約30秒間ボルテックスしてMLVを形成します。
- 1.5 mLの微量遠心チューブに0.5〜1 mLのMLVアリコートを作成します。チューブを液体窒素に突っ込み、透明フィルムで密封し、-20°Cで保存します(最大6週間)。
注:脂質ストック濃度は、ハミルトンシリンジを使用した信頼性の高いピペッティングを可能にするのに十分な容量を可能にするように選択されています。ストックを作るのに必要な量が大きすぎて乾燥脂質粉末を溶解できない場合は、ストックを複数回希釈して、さまざまな脂質の再現性のある混合を確保します。
- 小さな単層小胞(SUV)の調製
- -20°Cの貯蔵庫からMLVのアリコートを取り出し、室温で解凍します。微小遠心チューブを液体窒素に15〜30秒間突っ込んで小胞を瞬間凍結し、溶液が完全に解凍するまで(1〜2分)45°Cに設定された水浴に直ちに入れます。溶液の濁りが少なく見えるまで、上記の凍結融解サイクルを10x〜15x繰り返します。
注意: 均一な脂質混合を可能にするために、解凍する脂質混合物の転移温度よりも水浴の温度を高く設定してください。 - 80 nmの孔径ポリカーボネートフィルターメンブレンを取り付けたシリンジベースのミニ押出機をSUV再水和バッファーで平衡化します。システムに漏れや気泡がないことを確認します。押し出し法は脂質損傷を最小限に抑えた単分散SUVを生成しますが、負電荷を持つ脂質混合物はポリカーボネート膜に付着する可能性があります。
- 解凍した脂質溶液を、事前に平衡化したエクストルーダーに通して、片側から反対側にゆっくりと通してから戻します。脂質溶液が目に見えて透明になり、直径~100nmのSUVの形成を示すまで、サイクルを5x〜10x繰り返します。
- 押し出された懸濁液を遠心分離します(または溶液をチップ超音波処理します;以下の注を参照)15,000 x g で4°Cで60分間、脂質破片をペレット化します。ペレットを乱したり気泡を発生させたりすることなく、溶液の上位80%を収集します。SUVを含む上清を新しいマイクロ遠心チューブに移し、氷上で最大6日間保管します。
注:遠心分離に代わるものは、次のように行われるチップ超音波処理です。マイクロチップ超音波処理器をオンにし、次の設定を設定します:振幅= 最大値の30%、オン時間= 10秒、オフ時間= 60秒。マイクロ超音波処理器の先端を脱イオン水で洗浄し、続いて2N NaOH、クロロホルム、および再び脱イオン水で洗浄します。これらの溶液のそれぞれに超音波処理器の先端を浸し、上記の設定を使用して1〜2サイクル超音波処理します。凍結融解した小胞溶液にきれいな先端を浸し、溶液が透明になるまで氷上で3〜6サイクル超音波処理します。 - 遠心分離後、薄い白っぽいフィルムおよび/またははっきりと見えるペレットの形成として、高脂質分解または脂質押し出しの失敗の兆候がないか確認します。このような場合は、先に進まず、SUVの準備手順をもう一度繰り返してください。
注意: SUVの貯蔵寿命は、脂質混合物によって異なる場合があります。DOPC:DGS-NTA-Ni2+ で作られたSUVは、これらの実験の目的で最大6日間安定しています。一般的な問題を解決するためのヒントを 表 2 に示します。
- -20°Cの貯蔵庫からMLVのアリコートを取り出し、室温で解凍します。微小遠心チューブを液体窒素に15〜30秒間突っ込んで小胞を瞬間凍結し、溶液が完全に解凍するまで(1〜2分)45°Cに設定された水浴に直ちに入れます。溶液の濁りが少なく見えるまで、上記の凍結融解サイクルを10x〜15x繰り返します。
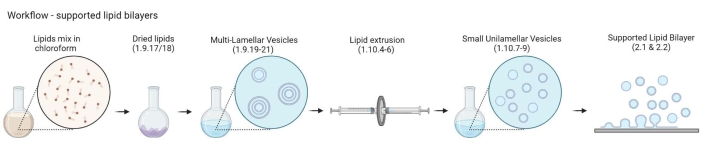
図2:マルチラメラベシクルおよび小さなユニラメラベシクルの調製から支持された脂質二重層の形成までのワークフローを示す概略図。 バイオレンダーで作成されました。この図の拡大版を表示するには、ここをクリックしてください。
2. 膜テザーアクチンネットワークの再構成
- サンプルチャンバーの準備
- 3〜5個の長方形のガラスカバースリップを取り、コプリンジャーの中に置きます。バス超音波処理器の電源を入れ、温度を65°Cに設定します。 Coplinジャーに2%洗浄液を入れてカバーガラスを完全に沈め、フルパルスモードで30分間超音波処理器に入れます。
- 鈍いPTFEコーティングされた鉗子を使用して、カバーガラスをジャーから1つずつ取り除きます。蒸留水で完全にすすぎ、2 N NaOHで満たされた別のコプリンジャーに入れます。
- フルパルスモードで20分間カバーガラスを超音波処理します。カバーガラスを1つずつ取り外し、蒸留水で十分にすすぎ、蒸留水で満たされた別のCoplinジャーに入れます。
注:オプションで、カバーガラスを蒸留水で20分間超音波処理してから、蒸留水で再度すすぎます。 - 実験を開始する直前に、カバーガラスの入ったジャーをN2 ガス供給を備えた化学フードに入れます。
- N2 ガス流の空気圧を試行錯誤によって最適化して、カバーガラス表面を壊さずに水を置換するのに十分になるようにします。N2 ガスの流れをカバースリップ面に平行に揃えて、カバーガラスが破損する可能性を減らします。
- 手袋と鉗子を使用してカバーガラスをジャーから1つずつ取り外し、N2 ストリームの下で乾燥させます。各カバーガラスの両側を乾かし、カバー付きのきれいなプラスチックグリッドに置きます。カバーガラスの入った箱をデシケーターに入れて、空気中のほこりの粒子との接触を避けます。
注意: N 2乾燥したカバーガラスは、最大2日間親水性を維持できるデシケーターに保管できます。この戦略は、実験に多くの二重層が必要な場合、または実験に8時間以上かかる場合に役立ちます。 - オートクレーブ滅菌したPCRチューブを取り、鋭い手術用ブレードで蓋と下部円錐形の半分を切り取ります。円筒形のハーフカットチューブを1つずつ取り、各カットチューブの滑らかなリムにUV硬化型接着剤を塗布し、リムがカバースリップに平らになるように、新しく掃除したカバーガラスに逆さまに置きます。
- 接着剤がチャンバーの中央スペースにこぼれないように、カバーガラスに配置したらシリンダーを横方向に動かさないでください。長方形のカバーガラスは最大3つの反応室を快適に収容でき、丸いカバーガラスは中央に1つだけを収容できます(図1)。
- チャンバーベアリングカバーガラスを、O2 供給と真空を備えたUVオゾンクリーナーの中に置きます(またはUVイルミネーターを使用します)。UVライトをオンにして3〜5分間点灯させ、接着剤を重合させます。カバーガラスの親水性を改善し、したがって脂質二重層の品質を改善するために、より長い照明(10〜15分)を実行します。
- 乾燥したUV照射サンプルチャンバーは、空気中のほこり粒子との接触を減らすために、透明なフィルムで包まれた小さなプラスチックの箱(空の長方形のカバースリップボックスなど)の中に最大8時間保管してください。
注意: UV光の存在下でのO2 の安定した流れは、カバーガラスの表面から有機不純物を除去することができるオゾンと酸素ラジカルを形成します。真空は、プロセス中に形成される有毒オゾンの漏れを防ぎます。 - カバーガラスを取り出し、蒸留水でチャンバーを満たして漏れがないかテストします。各チャンバーには、最大~150 μLのサンプルを入れることができます。漏れのあるチャンバーを廃棄します。
注意: もう一つの優れた安全なクリーニングオプションは、プラズマクリーナーです。時間と電力の設定はモデルによって異なりますが、スライドガラスをプラズマで過剰に処理すると脂質の移動性が低下するため、注意してください。表面処理は、洗浄溶液(>45分)またはNaOH(>30分)による長時間の処理で観察されているように、脂質27の移動度に影響を与える可能性がある。
- 支持脂質二重膜の調製
- 各チャンバーをSLB形成バッファー(または1x PBS)で洗浄して表面の汚染物質を除去し、最後に100 μLのバッファーを残します。100 μLのバッファーレベルを永久マーカーでマークし、容量の変化を再現可能に追跡します。
- 2 μLの0.1 M CaCl2 をチャンバーに加えます。これにより、ガラス表面へのベシクルの吸着が改善され、次のステップでの二重層形成が促進されます。8 μLのSUV溶液(ステップ1.10から)を各チャンバーに加え、25°Cで15分間インキュベートします。
注:添加されるSUVミックスの体積は、ウェルの露出した親水性領域を2つの脂質層で完全に覆うために必要な脂質の総数(平均面積0.72nm2)を計算することによって推定できます。 - 結合していない小胞をアクチン運動性バッファー(1x KMEH)で洗い流します。まず、50 μLのSLB形成バッファーを除去し、サンプルチャンバー内に50 μLだけを残します。次に、100 μLの1x KMEHをチャンバーに追加します。穏やかに混合し、底に触れずに100 μLのバッファーを除去します。
注意: 洗濯中は優しくすることが重要です。ピペットチップがチャンバーの底に触れないようにしてください。直接の流れが二重層を破壊する可能性があるため、ピペットを傾けて、バッファーの流れをチャンバーの壁に直接向けないでください。ピペッティング中に気泡を導入しないように注意してください 空気が脂質二重層に到達し、それに欠陥を引き起こす可能性があるため。 - 1x KMEHを100 μL添加し、100 μLを除去して、洗浄を10回繰り返します。
- 10 μLの1 mg / mL β-カゼインを二重層に加え、穏やかに混合し、5〜10分間インキュベートします。 β-カゼインは、二重層が形成されていないカバーガラス上の領域をブロックします。手順2.2.3の説明に従って、βカゼイン3xを1x KMEHで洗い流します。バッファーレベルを100 μLマークに戻します。
- 膜アクチンリンカーの添加
- βカゼインのインキュベーション(ステップ2.2.5)中に、-80°Cから膜アクチンリンカータンパク質のアリコートを取り出し、37°Cで素早く解凍してから氷上に保ちます。アリコートをタンパク質希釈バッファーで1 μMの濃度に希釈します。
- リンカータンパク質を定義された最終濃度(通常は5〜20 nM)で添加し、穏やかに混合します。チャンバー内のタンパク質を迅速に平衡化するには、リンカータンパク質を1x KMEHと事前に混合して、20 μLを超える容量を追加します。
- 室温で40分間インキュベートします。1x KMEHバッファーで3回洗浄して、結合していないHSEタンパク質を除去します(ステップ2.2.3と同様)。各チャンバーのバッファーレベルを100 μLマークに戻します。これで、サンプルをイメージングする準備が整いました。
- 脂質二重膜の品質評価
注: これはオプションの手順であり、毎回実行する必要はありません。この評価は、冷凍MLVストックから新鮮なSUVが作られるたびに実行することをお勧めします。- 顕微鏡、励起レーザー、検出カメラの電源を入れます。レーザーの位置が合っており、対物レンズが洗浄され、ソフトウェアが画像を取得する準備ができていることを確認してください。
- 100倍の対物レンズにオイルを塗り、サンプルを顕微鏡ステージに取り付け、対物レンズを二重層に集中させます。レーザーの位置がサンプル上で全反射を受けるようなものであることを確認してください。488 nm励起レーザーを使用して、二重層結合した10xHis-YFP-EzrinABDの蛍光強度分布を確認します。
注:良質の二重層は、蛍光強度の大規模で均一な分布を示します。悪い二重層は、強烈で斑状の蛍光スポットを示します。 - 二重層の完全性を判断するには、FRAPアッセイを実行します。
- 二層上の関心領域を選択し、5:1以上の信号対雑音比を提供するイメージング条件を使用して、視野のいくつかの画像を記録します。記録を一時停止し、TIRF顕微鏡のフィールドダイアフラムを閉じて、集中レーザービームを二重層の小さな円形領域に集中させ、蛍光色素を局所的に漂白します。
- レーザーを最大出力までオンにして、小さな領域を3〜10秒間光退色してから、レーザーをオフにします。フィールドダイアフラムを元の半径に再度開き、イメージング条件を(プレブリーチ)設定に再調整し、すぐに再開して、視野内の蛍光信号の回復を記録します。
- 二重層が流動的かどうかを確認してください。通常の横方向拡散を伴う良好な二重層は急速に回復しますが、悪い二重層はゆっくりと回復するか、まったく回復しません(図3)。二重層が回復していない場合は、トラブルシューティングのセクションを確認して再起動します。画像を 16 ビット TIFF ファイルとして保存します。拡散係数の定量的推定については、ステップ3を確認してください。以下に。
- 蛍光アクチンの重合
注:時間を節約するには、二重層に結合するHSEタンパク質のインキュベーション時間(ステップ2.3)または二重層の品質評価中(ステップ2.4)にアクチンの重合を開始します。- 非標識および蛍光標識されたG-アクチンを10:1のモル比で混合し、G-アクチンの濃度が20 μMになるようにG-バッファーを補充します。アクチンが最終的に重合される濃度は、この値の1/4になります。10x MEバッファーの1/10を1x溶液のミックスに加え、2分間インキュベートします。この工程は、G-アクチンに結合したCa2+ イオンをMg2+ イオンで置換する。最終容量が10 μLの倍数であることを確認してください。
- 以下のように所望の量のキャッピングタンパク質を加える。キャッピングプロテインストックのバイアルを37°Cですばやく解凍し、氷上に保ちます。キャッピングタンパク質の濃度が重合混合物中の所望の最終濃度の2倍になるようにGバッファーで希釈します。等量の希釈キャッピングタンパク質溶液をステップ2.5.1のアクチンミックスに加えます。
- 最後に、等量の新鮮な2xターゲットバッファーを反応混合物に加えます。溶液の最終容量は、ステップ2.5.2の終了時にアクチンミックスの体積の4倍になるはずです。KMEHの最終濃度が1倍、ATPの最終濃度が1 mM、BSAの最終濃度が1 mg/mL、G-アクチンの最終濃度が5 μMであることを確認してください。
25°Cの暗所で45〜60分間インキュベートして、重合を起こさせます。
注:これはターゲットバッファー戦略と呼ばれ、1容量のMg 2+ G-アクチン(ステップ2.5.1)を1容量のキャッピングタンパク質ミックス(ステップ2.5.2)および2容量の2x ターゲットバッファー(ステップ2.5.3)と混合します。これにより、アクチンの量をスケールアップまたはスケールダウンすることが容易になり、キャッピングタンパク質(または他のアクチンモジュレーター; 図4)。
- 蛍光アクチンフィラメントの添加
- 鋭利な刃またははさみで200μLの先端を数個切り、鈍くします。必要量の5 μM重合アクチン(ステップ2.5.3から)を鈍端ピペットチップ(アクチンフィラメントのせん断を防ぐため)で静かにピペットで取り出し、清潔なオートクレーブ滅菌PCRチューブに加えます。
- 1x KMEHをチューブに加えて容量を>20 μLにし、F-アクチンのせん断を避けるために穏やかに混合します。マウントされたサンプルチャンバーから、等容量のバッファーを除去します。
- 重合アクチン溶液をチャンバーに加え、底部の二重層に触れることなく、3倍にゆっくりと上下にピペットで移します。これにより、アクチンフィラメントが二重層上に均一に分布することを可能にする。サンプルをTIRF顕微鏡に取り付けます(ステップ2.4.1およびステップ2.4.2を参照)。
- F-アクチンが二重層に結合する過程を記録することができる。20〜30分間インキュベートします。F-アクチン添加が定常状態に達した後、異なる視野からいくつかの画像を記録します。アクチン組織化前(均質)およびアクチン組織化後の10xHis-YFP-EzrinABDの空間組織の変化を観察する。
注:HYEは、アクチンの非存在下で脂質二重層上に均一に分布しています。アクチンフィラメントを添加すると、HYEはF-アクチンと共局在します。共局在の程度は、リンカータンパク質のアクチン結合親和性に依存する。親和性が強いほど、共局在が高くなり、リンカータンパク質の横方向の移動度が遅くなります(図5)。
- ミオシンIIの添加
- アクチンインキュベーションを30分行った後、サンプルを顕微鏡に戻します(マウントされていない場合)。リンカータンパク質とF-アクチンチャネルのシグナルを確認します。必要に応じて撮影条件を調整してください。
- 均一なリンカータンパク質シグナルと均一に散乱されたアクチンフィラメントを備え、アーティファクトのない良好な領域を選択して、長時間のタイムラプス記録を実現します。ミオシン添加前に0.1〜0.2Hzで10〜15フレームを記録し、記録を一時停止する。ストックバイアルから必要量のリサイクル筋肉ミオシン-IIを鈍端ピペットチップでピペットで取り出し(ミオシンフィラメントのせん断を防ぐため)、清潔なオートクレーブ滅菌PCRチューブに追加します。
- すぐに1x KMEHをチューブに加え、容量を>20 μLにし、穏やかに混合します。ATP、ATP再生ミックス、光安定化剤などを追加することもできます。このステップの間。取り付けられたサンプルチャンバーから等量のバッファーを邪魔することなく慎重に取り外します。
- ミオシン溶液をサンプルチャンバーに静かに加えます。表面結合フィラメントを乱すため、上下にピペットしないでください。すぐにタイムラプス記録を再開し、システムがミオシン前状態からATP燃料収縮性アクトミオシンフロー、アスター形成からATP枯渇詰まり状態へと進化するのを観察します(代表的な結果を参照)。
- バッファーのみのサンプルを使用して、すべてのチャネルの背景画像を撮影します。すべての画像を16ビット.tiffファイルとして保存します。一般的な問題を解決するためのヒントについては、 表 2 を参照してください。

図3:迅速なFRAPアッセイによる二重層の品質評価。 DOCCおよびNi-NTA脂質(98:2モル%)から調製した支持脂質二重層(SLB)をHYE(10xHis-YFPタグ付き膜アクチンリンカー)でコーティングします。未結合タンパク質が洗い流された後、蛍光二重層をTIRF顕微鏡下で画像化する。二重層上の小さな領域を高いレーザー出力で光退色させ、蛍光の回復を記録する。(A)良好な二重層は常に速く回復し、この場合に使用される脂質組成の予想拡散係数は1〜1.5μm2 / sです。(B)悪い二重層は非常にゆっくりと回復するか、まったく回復しません。(C)悪い二重層の代表的な画像:(C-i)穴のある二重層、(C-ii)大きくて動かない脂質パッチを持つ二重層、および(C-iii)小さな動かないドットを持つ二重層。この図の拡大版を表示するには、ここをクリックしてください。
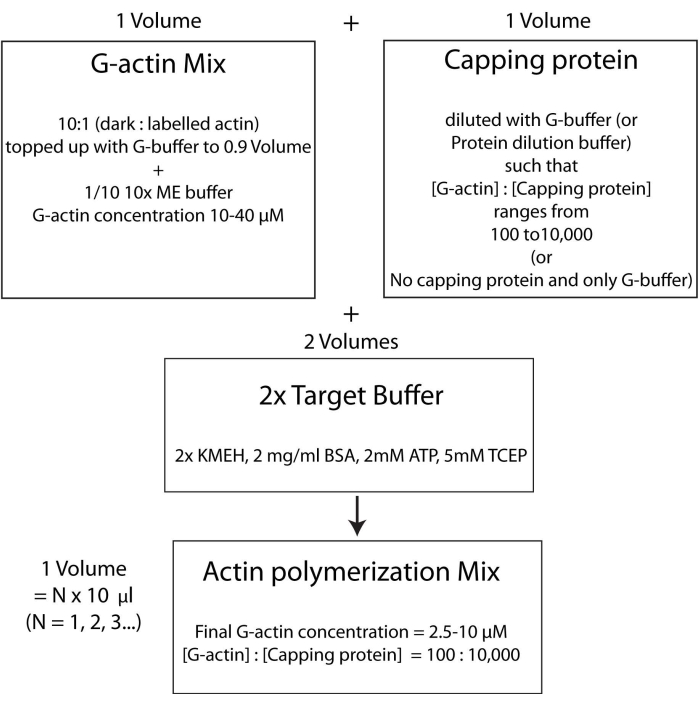
図4: ターゲットバッファー法を用いてアクチンを重合する方法を示す模式図。 この図の拡大版を表示するには、ここをクリックしてください。

図5: F-アクチンに結合した際のHYEの空間構成。アクチンフィラメント(Atto-635マレイミドで標識)の添加前後のHYEの空間構成を示すTIRFスナップショット。HYE組織は、F-アクチンを添加する前は均一であり、アクチンフィラメントに沿って共局在および共整列します。この図の拡大版を表示するには、ここをクリックしてください。
3.データ分析
- フィジーのソフトウェア(https://imagej.net)を使用して、リンカータンパク質画像からバックグラウンドを差し引きます(ステップ2.4から)。漂白スポットと基準領域からの平均強度値を測定します。
- 漂白スポットと参照領域からのタイムトレースを、それぞれのプレブリーチ強度値の強度に正規化します。正規化された漂白領域の値の各タイムポイントを、正規化された参照領域のタイムトレース内の各時間ポイントで割ります。バックグラウンドおよび取得中の強度の体系的な変動(グローバル光退色、zドリフトなど)について、結果の正規化されたタイムトレースを修正します。
- フィッティングフリーの手動方法28 を使用して、二重層テザータンパク質の拡散係数を推定する。簡単に言うと、回復プロファイルの半分の時間 τ1/2は、正規化された回復プロファイルが定常状態の半分に達する時間を調べることで計算できます。
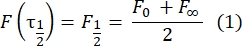
ここで、F0はフォトブリーチング後の第1フレームにおける漂白領域における平均強度であり、F∞は二重層の回復の長期定常状態値である。 - 有効漂白半径reは、光退色時の拡散を補正するパラメータである、ポスト漂白スポットプロファイル29のラインスキャンから推定する。漂白スポットの中心を通るこのラインスキャンの半値幅r1/2は、次のようにreに関連しています。
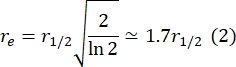
ステップ2.8.3で計算したτ1/2、ステップ2.8.4で計算したre、および最初に設定した漂白半径rnを使用して、次の式を使用して拡散係数(D)を計算します。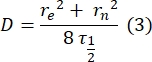
- フィッティングフリーの手動方法28 を使用して、二重層テザータンパク質の拡散係数を推定する。簡単に言うと、回復プロファイルの半分の時間 τ1/2は、正規化された回復プロファイルが定常状態の半分に達する時間を調べることで計算できます。
- アクトミオシンアスターの画像解析
- フィジーを使用して、すべてのチャンネルで記録されたすべての画像から背景を差し引きます。フラットフィールド補正を使用して、不均一な照明または干渉パターンについて画像を修正します。
注:このような修正を行うための優れたフラットサンプルである色付きのプラスチックスライドを使用できます。平面二重層上のリンカータンパク質およびアクチンフィラメントの場合、複数のプレミオシン画像の平均投影を使用して、チャネル固有の照明補正マップを作成することもできます。- ここに示すHYEチャネルについて、複数のHYE画像の平均強度投影(ミオシン添加前の脂質二重層の異なる領域から記録)を撮影する。適切なガウスフィルター(σ = 50ピクセルから80ピクセル)を平均投影(ミオシン以前の画像または標準的な平らなサンプルから)に適用します。
- フィルター処理された画像を 32 ビット イメージに変換します。すべてのピクセル値を画像全体の平均で割ります。これにより、HYEチャネルの正規化された補正マップが得られます。フラットフィールド補正のために、HYEチャンネル内のすべての画像をこのマップで分割します。同じ方法を使用して、他のチャネルの修正マップを作成します。
- フィジーで指数関数的または単純な比率法(強度減衰プロファイルに応じて)を使用して光退色を修正します。
- 時間的なx-yのずれ(並進運動)を補正するには、すべての光退色補正チャンネルを1つのハイパースタックにマージします。フィジーのHyperstack-Reg プラグインを使用して、リジッド ボディ変換または平行移動変換を適用します。
- 最後に、アライメントされたHyperstackを個々のチャネルに分割し、さらに分析するために16ビットTIFFスタックとして個別に保存します。
- フィジーを使用して、すべてのチャンネルで記録されたすべての画像から背景を差し引きます。フラットフィールド補正を使用して、不均一な照明または干渉パターンについて画像を修正します。
結果
表現のために、ここでは、光退色後の第1の画像( 図3Aのt = 0sでの画像)からの典型的なポストブリーチプロファイルと、次の関数28 ( 図6Aを参照)への適合を示します。

この曲線に当てはめることによって計算されたre(23.94μm)の値は、ステップ2.8.4で計算されたreと非常によく似ています。 (23.24 μm)。ここで、Kは、F0から直接推定できる漂白深さパラメータである(ステップ2.8.4で説明)。同様に、図 6B は、リカバリー・プロファイルと、以下の機能28 への適合を示しています。
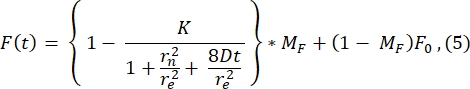
拡散係数の適合値は1.34 μm 2/sであり、ステップ2.8.4の式で計算される1.39 μm2/sの値とほぼ一致する値であることがわかります。ここで、MFは、回復する漂白集団の割合を表す脂質二重層の可動画分を表す。脂質アンカー分子の移動度は、もちろん、脂質組成およびその物理的状態(液相またはゲル相)に依存する。DOPCベースの脂質膜を用いた実験では、移動度は>1 μm2/sでなければならず、可動画分は良好な脂質二重層を示すために0.9以上でなければなりません。二重層の品質と移動性をすばやくテストするために、手動のフィッティングフリー方法を使用することをお勧めします。フィット方法は、多くのFRAPカーブの解析を自動化する場合に役立ちます。さらに、システム内の拡散を体系的に特徴付けるために、より洗練されたFRAP実験を実行したい場合は、モデルのフィッティングと実験計画の潜在的な落とし穴について、Lorénら30のこのレビューを読者にお勧めします。

図6:脂質二重層の拡散係数の定量化。 (a)フォトブリーチング後の第1画像のラインプロファイル( 図3Aのt=0s)とその式4への適合により、有効ブリーチ半径を算出した。(b)漂白領域の回復プロファイルとその適合を式5に適合させ、拡散係数と移動分率を算出する。 この図の拡大版を表示するには、ここをクリックしてください。
TIRF顕微鏡によって画像化された支持された脂質二重層上に連結されたアクトミオシンネットワークの動的アセンブリおよび組織を示す上述の実験の典型的な結果を、図7および補足ビデオS1に描く。
図7 は、リンカータンパク質、F-アクチン、およびミオシン-IIの画像モンタージュを示す。
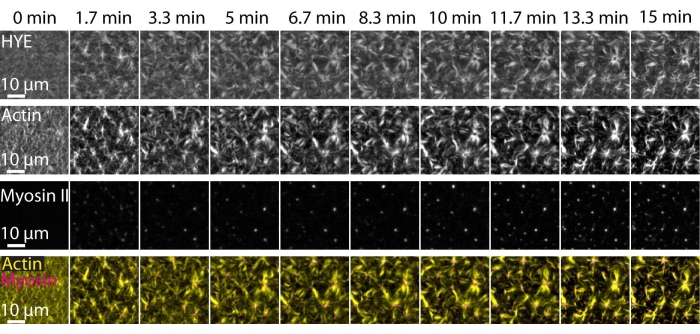
図7:収縮性アクトミオシンの流れは、膜-アクチンリンカータンパク質HYEの局所クラスタリングを促進します。 HYEおよびF-アクチンを含むSLBにミオシンIIを添加した場合のHYE(YFPタグ付き)、アクチンフィラメント(Atto-635マレイミドで標識)、およびミオシンIIフィラメント(Atto-565マレイミドで標識)のTIRFスナップショット。時間は上部に示されています:0分は蛍光筋フィラメントがTIRFフィールドに現れ始める直前です。HYEおよびF-アクチンは、ミオシン添加前(0分)に脂質二重層上に均一に分布している。ミオシン活性は収縮性アクトミオシン流を誘導し、定常状態(15分)でアスター様構造に出現し、結合膜成分(HYE)の局所的なクラスタリングを促進します。一番下の行は、異なる時点でのアクチンとミオシンの組織を示すアクチン(黄色)とミオシンII(マゼンタ)の画像のマージです。これらのモンタージュの作成に使用された画像は、バックグラウンド信号、不均一な強度パターン、および並進運動についてフィジーで補正されました。スケールバー= 10μm。詳細については、「 補足ビデオ S1」を参照してください。 この図の拡大版を表示するには、ここをクリックしてください。
| バッファ名 | 組成 | |
| 脂質再水和バッファー | 50 mM HEPES, 150 mM NaCl, 5% スクロース, pH 7.5 | |
| SLB フォーメーション バッファ | 50 mM HEPES, 150 mM NaCl, pH 5-6 | |
| SLB ストレージ バッファ | 50 mM HEPES, 150 mM NaCl, pH 7.2 | |
| タンパク質希釈バッファー | 20 mM HEPES、100 mM KCl、1 mM TCEP または DTT、pH 7.2 | |
| 1X MEまたはアクチンイオン交換バッファー | 50 mM MgCl2, 0.2 mM EGTA, 10 mM HEPES, pH 7.2 (4°Cで保存) | |
| 1X KMEHまたはアクチン重合バッファー | 50 mM KCl, 1 mM MgCl2, 1 mM EGTA, 50 mM HEPES, pH 7.2 | |
| 100 mM ATP ストック | 100 mM ATP 二ナトリウム塩、50 mM トリス、50 mM NaCl、5 mM MgCl2、2 mM EGTA、pH 7.5 (-20°Cで保存) | |
| 2x ターゲットバッファ | 2x KMEH、2 mg/ml BSA、2mM ATP、5mM TCEP (4°Cで保存) | |
| Gバッファ | 2 mM トリス、0.1 mM CaCl2、0.2 mM ATP、0.5 mM TCEP、0.04 % NaN3、pH 8 (4°Cで保存) | |
| ミオシンIIバッファー | 500 mM KCl, 1 mM EDTA, 10-20 mM ヘペス, pH 7.0 | |
| ゲル濾過クロマトグラフィーバッファー | 50 mM トリス塩酸塩, 150-300 mM NaCl, 5 mM TCEP, 0.1% トゥイーン-20, pH 7.5 | |
| キャッピングタンパク質保存バッファー | 10 mM トリス·Cl, 50 mM NaCl, 1 mM TCEP, pH 7.5, 20% グリセロール | |
表1:このプロトコルで使用されるバッファー組成のリスト。
| 一般的な問題とそのトラブルシューティング | 問題 | 原因 | 可能な解決策 | ||||||
| 1 | 脂質二重層は拡散を示さない | この問題の最も可能性の高い原因は、洗浄液が老化した場合、または浴超音波処理中に加熱が行われなかった場合に発生する可能性のあるカバーガラスの汚れです。これらの二重層は、破裂した小胞がカバーガラスに付着するが互いに融合しないため、「小胞」の外観を有する。6週間以上経過したMLVまたは6日以上経過したSUVを使用したり、少量のSUVを追加したりすると、小胞二重層が形成される可能性があります。 | 新鮮な洗浄液を使用してください。ヒーターがオンになっていて、温度が45〜65°Cであることを確認してください。 新鮮な脂質ミックスを使用してください。(蛍光脂質プローブと蛍光タンパク質プローブを使用すると、異なる症状が現れることがあります。 例えば、二重層に副回折欠陥があり、表面パッシベーションステップがスキップされる(または機能しない)場合、脂質プローブは均一な強度分布を示しますが、蛍光タンパク質プローブは明るい蛍光スポットを表示する場合があります。 | ||||||
| 2 | 脂質二重層には明るい斑点があります | 二重層形成のためのSUVの長期インキュベーションは、全体的に拡散しているが時折明るいパッチを伴う脂質二重層を作成する可能性がある。これらのパッチは、大量の蛍光プローブを引き付けることができる多層二重層であり得る。 | SUVとの15〜20分のインキュベーションで十分です。プローブが凝集していないことを確認してください:リンカータンパク質の迅速なハードスピン(300 x gで4°Cで15分間)で凝集体を除去できます | ||||||
| 3 | 脂質二重層には暗い穴があります | これは、二重層が古いSUVから作られ、長時間(形成後>4時間)画像化された場合、または長時間の画像化(例えば、高ATP状態および特定の脱酸素剤の存在下で)により溶液のpHが劇的に変化する場合、または表面がベータカゼインで過剰に不動態化されている場合(ベータカゼインを10〜15分以上添加しすぎて洗い流さない)。 | 新鮮な脂質を使用してください。イメージングフレームレートまたは有効なレーザー照明時間を短縮します。バッファリング容量の高いバッファを使用してください。 | ||||||
| 4 | 脂質二重層はゆっくりとした拡散を示す | コレステロールの割合が高い脂質二重層、長い飽和脂質、または荷電脂質は拡散が遅くなります。 | このような場合は、高温でサンプルを調製してください。また、単純で試験済みの脂質組成を、複雑で試験されていない脂質組成物とともに対照として使用することもできる。ガラスがきれいであることを確認してください。 | ||||||
| 5 | アクチンは重合しない | ターゲットバッファーが古く、Gアクチンストックが古すぎ、古いGアクチンと新しいGアクチンが共重合されました。 | 重合前にCa2+ がMg2+ に置換されていることを確認してください(MEバッファーを使用)。新鮮なATP-Mg2+ ストックを使用してください。新たにリサイクルされたG-アクチンを使用してください。二重層に添加されるF-アクチン(G-アクチン換算)の濃度が0.2μMより高いことを確認してください。低濃度の場合は、ファロイジン安定化F-アクチンを使用してください。 | ||||||
| 6 | アクチンは二重層に結合しない | 膜アクチンリンカーは、非常に低濃度で添加または添加されていない—これは、リンカータンパク質の蛍光を形成すると推測することができる。蛍光がまともであれば、膜-アクチンリンカーはアクチン結合能を失っています。また、リンカータンパク質がガラス表面に非特異的に結合している場合(二重層が悪い場合)、アクチンフィラメントを動員しない可能性があります。 | 二重層が拡散していることを確認してください。新鮮なリンカータンパク質を使用する | ||||||
| 7 | 蛍光F-アクチンシグナルが弱い | 標識された対暗アクチンの比率が低すぎる。標識アクチンまたは標識されていないアクチンのいずれかが古すぎて、互いに共重合していません。 | アクチンを再度リサイクルし、新たにリサイクルしたアクチンでプロイマー化を再試行します。光損傷はF-アクチンを破壊または解重合する可能性があります。可能であれば、アクチン(およびミオシン)に赤または遠赤色の染料を使用してください。 | ||||||
| 8 | ミオシンは収縮性を示さない | ミオシン注入系にATPを添加した後、アクトミオシンの収縮性がないことが観察され得る。 | ミオシン濃度または純度レベルが良好かどうかを確認してください。リサイクルしたてのミオシンを使用してください(リサイクル後6週間以内に使用してください)。ミオシンミックスに新鮮なATPを加えると効果的です。脱ガスバッファー、脱酸素剤の使用などモーターの光損傷を減らすことができます。 さらなる情報は、同じメソッドコレクションのPlastinoらまたはStamらによるプロトコルで見つかるかもしれません | ||||||
| 9 | カバーガラスは親水性ではありません | カバーガラスが適切に洗浄されていません。 | クリーンな親水性カバーガラスは、脂質二重層の形成に不可欠です。洗浄プロトコル後のカバーガラスの親水性の有用な視覚的読み出しは、水によるガラスの濡れを観察することです。平らなカバーガラスに少量の水を追加します。カバーガラスが適切に洗浄されていない場合、水は丸い液滴の形のままになります。ただし、同じ量の水が広がり、処理された親水性カバーガラス上に薄い層を形成します。カバーガラス表面の水のこの濡れ挙動は、洗浄液/ NaOHによる洗浄ステップが機能したかどうかを確認するために使用できます。 | ||||||
表2:一般的な問題と対応する解決策をまとめたトラブルシューティングガイド。
補足ビデオS1:収縮性アクトミオシンフローは、膜-アクチンリンカータンパク質HYEの局所クラスタリングを促進します。 HYEおよびF-アクチンを含むSLBにミオシンIIを添加した場合のHYE(YFPタグ付き)、アクチンフィラメント(Atto-635マレイミドで標識)、およびミオシンIIフィラメント(Atto-565マレイミドで標識)のTIRFタイムラプス。時間は上部に示されています:0分は蛍光筋フィラメントがTIRFフィールドに現れ始める直前です。スケールバー = 10 μm. このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、細胞の膜-皮質界面を研究するための実験を設計するための汎用性の高いプラットフォームと出発点を提供します。重要なステップは、清潔なスライドガラスの調製、効率的なSUV形成のための新鮮な脂質の使用(どちらもSLBの品質に影響を与える)、および動的アクチンフィラメントの再編成のための新たにリサイクルされたミオシンIIタンパク質の使用です。長時間にわたって動態をイメージングする場合、脱酸素システム(例えば、プロトカテク酸およびプロトカテク酸3 4-ジオキシゲナーゼ5,31)を組み込むことが非常に重要である。
オープンチャンバー設計により、脂質の流れを誘発することなく、既存のシステムに成分を順次追加することができます。これは、リポソーム36内に封入されたタンパク質を使用する、一般的に使用される閉鎖チャンバーアプローチまたは作業よりも重要な利点となり得る。タンパク質誘発膜変形などの逆効果は、ガラス吸着脂質二重層では研究できません。
脂質二重層は、広範囲の脂質組成物で形成することができる。それは、親水性ガラス表面への脂質小胞の吸着から始まり、その後、表面-小胞および直接小胞-小胞相互作用による自発的な小胞破裂、または吸着された小胞が臨界被覆に達し、その後、小胞のごく一部が破裂し、活性エッジを形成し、最終的に二重層形成につながる32.ガラス以外にも、様々な基板を使用して、担持脂質二重層を形成することができ、例えば、マイカ(例えば、原子間力顕微鏡用)、軟質基板(例えば、ポリ−ジメチル−シロキサン)、ポリマークッション33、34、35、電子顕微鏡グリッド14の孔間にまたがる。液滴界面二重層は、安定で自立した脂質二重層36を作成するための別の興味深い方法である。小胞またはエマルジョンへのアクトミオシンネットワークの包含は、細胞様幾何学的形状37,38においてこの最小系を研究するための非常に強力な方法であり、これは他の箇所で詳細に説明されている39。
開示事項
著者は宣言する利益相反はありません。
謝辞
この研究は、AXA研究基金と、DVKのWarwick-Wellcome Quantitative BioMedicine Programme(Wellcome ISSF、RMRCB0058)、ABおよびSTのNCBS-TIFR、SMのWellcome-DBTマルグダルシフェローシップ(IA/M/15/1/502018)の支援を受けました。 DVKはまた、仮想ネットワーキングイベント「分子からメソスケールまでの多成分細胞骨格ネットワークを理解する上での課題」を可能にしてくれた生物物理学会に感謝したいと思います。 これは、このプロトコルコレクションの作成に貢献しました。
資料
| Name | Company | Catalog Number | Comments |
| 1,2 dipalmitoyl-sn-glycero-3-phosphoethanolamine-N- (lissamine rhodamine B sulfonyl) | Avanti Polar Lipids | 810158 | 16:0 RhoPE |
| 1,2-dioleoyl-sn-glycero-3- [(N-(5-amino-1 carboxypentyl) iminodiacetic acid) succinyl] (nickel salt) | Avanti Polar Lipids | 790404 | DGS-NTA-Ni2+ |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850375 | DOPC |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850355 | DPPC |
| Amber glass vials | ThermoFisher | B7990-2A | |
| ATP disodium salt | Sigma Aldrich | A26209 | |
| Attofluor cell chamber | ThermoFisher | A7816 | |
| Bath sonicator | GT Sonic | 1860QTS | |
| beta-casein | Sigma Aldrich | C6905 | |
| CaCl2 | ThermoFisher | 12135 | |
| chloroform | Sigma Aldrich | 650471 | alternatively from Electron Microscopy Sciences, 50980296 |
| Cover slips, #1, 25 mm diameter, Gold Seal | Harvard Apparatus | 64-0705B | |
| Cover slips, #1, 40x22 mm, Gold Seal | ThermoFisher | 48404-031 | |
| EDTA | ThermoFisher | G12635 | |
| EGTA | Himedia | MB130 | |
| Gas tight glass syringes, with removebla needle, blunt, volumes 10 µL, 100 µL, 500 µL | Hammilton | 1700 series | |
| Hellmanex III | Hellma Analytics | Z805939 | cleaning solution |
| HEPES | Himedia | RM380 | |
| KaH2PO4 | ThermoFisher | G13405 | |
| KCl | ThermoFisher | G13305 | |
| KOH | ThermoFisher | G26708 | |
| Lipid extruder | Avanti Polar Lipids | 61000-1EA | |
| MgCl2 | ThermoFisher | G15535 | |
| Microtip sonicator | Sonics | VC750 | 3 mm Tip diameter |
| Na2CO3 | ThermoFisher | G15955 | |
| NaCl | Himedia | GRM853 | |
| NaH2PO4 | ThermoFisher | G15825 | |
| NaOH | ThermoFisher | G27815 | |
| Nikon Ti Eclipse TIRF microscope | Nikon | With a TIRF unit connected through a polarization-conserving optical fibre to an Agilent monolithic laser combiner MLC400 with multiple laser lines with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) | |
| NOA88 | Norland Products | 8801 | |
| PTFE Coated Tweezer Style #2A | Structure Probe | 0S2AT-XD | |
| Refrigerated microcentrifuge | Eppendorf | 5424R | |
| Sucrose | ThermoFisher | G15925 | |
| UV-illuminator | Novascan | PSD PRO-UV | needs vacuum and O2 supply |
参考文献
- Köster, D. V., Mayor, S. Cortical actin and the plasma membrane: Inextricably intertwined. Current Opinion in Cell Biology. 38, 81-89 (2016).
- Rao, M., Mayor, S. Active organization of membrane constituents in living cells. Current Opinion in Cell Biology. 29, 126-132 (2014).
- Honigmann, A., et al. A lipid bound actin meshwork organizes liquid phase separation in model membranes. eLife. 3, 01671(2014).
- Das, A., et al. Stratification relieves constraints from steric hindrance in the generation of compact actomyosin asters at the membrane cortex. Science Advances. 6 (11), (2020).
- Köster, D. V., et al. Actomyosin dynamics drive local membrane component organization in an in vitro active composite layer. Proceedings of the National Academy of Sciences. 113 (12), 1645-1654 (2016).
- Vogel, S. K., Heinemann, F., Chwastek, G., Schwille, P. The design of MACs (minimal actin cortices). Cytoskeleton. 70 (11), 706-717 (2013).
- Murrell, M., Thoresen, T., Gardel, M. Reconstitution of contractile actomyosin arrays. Methods in Enzymology. 540, 265-282 (2014).
- Mosby, L. S., et al. Myosin II filament dynamics in actin networks revealed with interferometric scattering microscopy. Biophysical Journal. 118 (8), 1946-1957 (2020).
- Seara, D. S., et al. Entropy production rate is maximized in non-contractile actomyosin. Nature Communications. 9 (1), 4948(2018).
- Linsmeier, I., et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7, 12615(2016).
- Vogel, S. K., Petrasek, Z., Heinemann, F., Schwille, P. Myosin motors fragment and compact membrane-bound actin filaments. eLife. 2, 00116(2013).
- Ditlev, J. A., et al. A composition-dependent molecular clutch between T cell signaling condensates and actin. eLife. 8, 42695(2019).
- Banjade, S., Rosen, M. K. Phase transitions of multivalent proteins can promote clustering of membrane receptors. eLife. 3, 04123(2014).
- Heinemann, F., Vogel, S. K., Schwille, P. Lateral membrane diffusion modulated by a minimal actin cortex. Biophysical Journal. 104 (7), 1465-1475 (2013).
- Vogel, S. K., Greiss, F., Khmelinskaia, A., Schwille, P. Control of lipid domain organization by a biomimetic contractile actomyosin cortex. eLife. 6, 24350(2017).
- Block, S. Brownian motion at lipid membranes: A comparison of hydrodynamic models describing and experiments quantifying diffusion within lipid bilayers. Biomolecules. 8 (2), 30(2018).
- JoVE, JoVE. JoVE Methods Collection. In vitro reconstitution of cytoskeleton networks for biomaterials, biophysics and active matter research. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Enzymology. 85, 164-181 (1982).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Pollard, T. D. Myosin purification and characterization. Methods in Cell Biology. 24, 331-371 (1982).
- JoVE Science Education Database. Separating protein with SDS-PAGE. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Bieling, P., et al. WH2 and proline-rich domains of WASP-family proteins collaborate to accelerate actin filament elongation. The EMBO Journal. 37 (1), 102-121 (2018).
- Shrivastava, R., Köster, D., Kalme, S., Mayor, S., Neerathilingam, M. Tailor-made ezrin actin binding domain to probe its interaction with actin in-vitro. PLoS One. 10 (4), 0123428(2015).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5, 5412(2014).
- Selden, N. S., et al. Chemically programmed cell adhesion with membrane-anchored oligonucleotides. Journal of the American Chemical Society. 134 (2), 765-768 (2012).
- Seu, K. J., et al. Effect of surface treatment on diffusion and domain formation in supported lipid bilayers. Biophysical Journal. 92 (7), 2445-2450 (2007).
- Kang, M., Day, C. A., Kenworthy, A. K., DiBenedetto, E. Simplified equation to extract diffusion coefficients from confocal FRAP data. Traffic. 13 (12), 1589-1600 (2012).
- Kang, M., Day, C. A., Kenworthy, A. K. A novel computational framework for D(t) from Fluorescence Recovery after Photobleaching data reveals various anomalous diffusion types in live cell membranes. Traffic. 20 (11), 867-880 (2019).
- Lorén, N., et al. Fluorescence recovery after photobleaching in material and life sciences: Putting theory into practice. Quarterly Reviews of Biophysics. 48 (3), 323-387 (2015).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (7), 1-7 (2013).
- Andrecka, J., Spillane, K. M., Ortega-Arroyo, J., Kukura, P. Direct observation and control of Supported lipid bilayer formation with interferometric scattering microscopy. ACS Nano. 7 (12), 10662-10670 (2013).
- Lin, W. -C., et al. Supported membrane formation, characterization, functionalization, and patterning for application in biological science and technology. Current Protocols in Chemical Biology. 2 (4), 235-269 (2010).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: An integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sapuri-Butti, A. R., Butti, R. C., Parikh, A. N. Characterization of supported membranes on topographically patterned polymeric elastomers and their applications to microcontact printing. Langmuir. 23 (25), 12645-12654 (2007).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Bashirzadeh, Y., Moghimianavval, H., Liu, A. P. Encapsulated actomyosin patterns drive cell-like membrane shape changes. iScience. 25 (5), 104236(2022).
- Bashirzadeh, Y., Wubshet, N., Litschel, T., Schwille, P., Liu, A. P. Rapid encapsulation of reconstituted cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. (177), e63332(2021).
- Murrell, M., Chen, S., Sun, Z. G. In vitro reconstitution of actin cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. , (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved