Method Article
Восстановление мембранно-привязанных минимальных актиновых коры на поддерживаемых липидных бислоях
В этой статье
Резюме
Этот протокол описывает образование поддерживаемых липидных бислоев и добавление цитоскелетных нитей и моторных белков для изучения динамики восстановленных, мембранно-привязанных цитоскелетных сетей с использованием флуоресцентной микроскопии.
Аннотация
Поверхность живой клетки обеспечивает универсальную активную платформу для многочисленных клеточных процессов, которые возникают в результате взаимодействия плазматической мембраны с нижележащей актиновой корой. В последние десятилетия восстановленные, минимальные системы, основанные на поддерживаемых липидных бислоях в сочетании с актиновыми сетями нитей, оказались очень полезными в разгадке основных механизмов и последствий мембранно-привязанных актиновых сетей, а также в изучении функций отдельных мембраноассоциированных белков. Здесь мы описываем, как воссоздать такие активные композитные системы in vitro , которые состоят из поддерживаемых жидкостью липидных бислоев, соединенных через мембранно-ассоциированные актин-связывающие белки с динамическими актиновыми нитями и миозиновыми двигателями, которые можно легко наблюдать с помощью флуоресцентной микроскопии полного внутреннего отражения. Конструкция с открытой камерой позволяет поэтапно собирать систему и систематически контролировать многие параметры, такие как концентрация белка линкера, концентрация актина, длина актиновой нити, соотношение актин/миозин, а также уровни АТФ. Наконец, мы обсудим, как контролировать качество системы, как обнаруживать и устранять часто возникающие проблемы, а также некоторые ограничения этой системы по сравнению с поверхностью живых клеток.
Введение
Плазматическая мембрана живой клетки животного постоянно взаимодействует с соседним актиновым цитоскелетом, и вместе они образуют активный композиционный материал, выполняющий множество клеточных функций 1,2. Для изучения процессов на этом интерфейсе липидной мембраны и актина восстановление цитоскелетных сетей поверх поддерживаемых липидных бислоев (SLB) оказалось очень полезным. Такой минимальный системный подход позволяет точно контролировать компоненты сети цитоскелетов и липидный состав. По сравнению с отдельно стоящими липидными мембранами гигантских одноламельных везикул, плоская геометрия SLB позволяет эффективно использовать современные методы микроскопии, такие как сверхразрешение 3,4, флуоресценция полного внутреннего отражения (TIRF)5,6,7 или интерферометрическое рассеяние8 изучить пространственную организацию и динамику цитоскелетных сетей. TIRF обеспечивает наибольшую контрастность для флуоресцентно меченых компонентов, поскольку сигнал несвязанных меченых молекул в растворе, способствующий фоновому сигналу, минимален.
Здесь мы описываем базовый протокол формирования сетей актомиозина, привязанных к поддерживаемым липидным бислоям, которые широко используются в этой области для изучения физики активных, квази-2D сетей 9,10,11 и их влияния на организацию мембран 3,5,12,13,14,15,16 (Рисунок 1 ). Этот подход не ограничивается сетями на основе актина, но также может быть легко адаптирован для изучения микротрубочек, промежуточных нитей или композитных сетей смешанной природы и изучения различных взаимодействий между белками липидной мембраны и компонентами цитоскелета с использованием поверхностно-чувствительных методов микроскопии.
Чтобы сфокусировать этот протокол, мы исключили подробное описание очистки и маркировки белков актина и миозина или подробности о том, как настроить и контролировать сократимость и организацию сетей актомиозина. Следует обратиться к другим протоколам, которые опубликованы вместе с этим в коллекции методов JoVE, In Vitro Reconstitution of Cytoskeleton Networks for Biomaterials, Biophysics and Active Matter Research17.

Рисунок 1: Схема активной композитной системы in vitro актин-мембрана. Создано с помощью Biorender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
1. Реагенты и оборудование
- Подготовьте свежие буферы, как указано в таблице 1. Используйте сверхчистую деионизированную воду с удельным сопротивлением 18,2 МОм·см при 25 °C. Стерилизуйте все буферы, пропуская их через фильтры 0,22 мкм под вакуумом. Дегаз буферов, используемых для колоночной хроматографии.
- Очищают скелетные мышцы актином, как описано ранее18,19. Добавьте 20% глицерин в конечный очищенный раствор G-актина и сделайте аликвоты объемом 500 мкл (для маркировки или объемных экспериментов) и 10 мкл (для отдельных экспериментов). Вспышка замораживает аликвоты, погружая трубки в жидкий азот на 30 с, а затем храните их при -80 °C до 18 месяцев.
ПРИМЕЧАНИЕ: В качестве альтернативы, очищенный актин или порошок ацетона можно приобрести в коммерческих целях. - Метят очищенный G-актин скелетных мышц любыми флуоресцентными малеимидными красителями, как описано ранее5. Определяют концентрацию и степень маркировки белка методом спектрофотометрии с помощью скорректированных А290 нм для актина (εактин = 26 600 М-1 см-1) и Аλmax красителя. Сделайте аликвоты по 10 мкл и заморозьте, окунув трубки в жидкий азот на 30 с и храните при −80 °C до 18 месяцев.
ПРИМЕЧАНИЕ: Маркировка лизин-конъюгирующими эфирами NHS создаст нефункциональный актин и ее следует избегать. - Очистите миозин скелетных мышц II, следуя протоколу20. Запустите SDS-PAGE с использованием 10% полиакриламидного геля с последующим окрашиванием Coomassie для определения уровня чистоты белка21. Хранить очищенный миозин-II скелетных мышц при −20 °C в жидкой форме в буфере миозина II с 50% глицерином.
ПРИМЕЧАНИЕ: Сохраненный миозин II можно использовать до 2 лет. - Метят очищенный миозин-II любыми флуоресцентными малеимидными красителями, как описано ранее5. Избегайте маркировки миозиновых двигателей красителями NHS-эфиров. Определяют концентрацию и степень маркировки методом спектрофотометрии с помощью скорректированных А280 нм миозина II и Аλmax красителя. Храните переработанный миозин II (темный или меченый) при 4 °C и используйте в течение 6 недель.
- Очистка укупорочного белка
- Получите мышиный укупоривающий белок, следуя более раннему протоколу22. Запустите SDS-PAGE с использованием 10% полиакриламидного геля с последующим окрашиванием Coomassie для определения уровня чистоты белка. Измерьте концентрацию, используя280 нм белка укупорки (εCP = 99 530 M-1 см-1).
- Добавьте 20% глицерин в белковый раствор и сделайте 5 мкл аликвот в 200 мкл ПЦР-пробирках. Погрузите трубки в жидкий азот и храните их при температуре −80 °C до 2 лет.
ПРИМЕЧАНИЕ: Укупорочная активность белка проверяется путем полимеризации фиксированных количеств флуоресцентного G-актина в присутствии различных количеств белка. Затем нити визуализируются под микроскопом, и их распределение по длине количественно определяется. Чем выше относительная концентрация белка, тем короче распределение актиновой нити. Köster et al.5.
- Экспрессируют флуоресцентный мембранно-актиновый линкерный белок, например, для этого протокола используют 10xHis-YFP-EzrinABD (HYE), экспрессируют его в Bl21DE3* Escherichia Coli и очищают, как описано ранее23. Определяют концентрацию белка методом спектрофотометрии.
- Хранить белок в небольших аликвотах в гелефильтрационном хроматографическом буфере (или любом другом соответствующем буфере) с 20% глицерином при −80 °C. В этих условиях белок стабилен более 2 лет.
ПРИМЕЧАНИЕ: Выбор актин-мембранного линкера белка и флуоресцентного маркера зависит от типа вопроса, к которому мы обращаемся. В последние годы был разработан широкий спектр липидсвязывающих стратегий, включая помеченные гистидином белки24, биотин-стрептавидин25 и одноцепочечную ДНК26. - Подготовка многоламеллярных везикул (MLV)
ПРИМЕЧАНИЕ: Рабочий процесс от MLV к поддерживаемым липидным бислоям показан на рисунке 2.- Поместите 5-10 флаконов из янтарного стекла в стеклянный стакан объемом 200 мл. Наполните стакан 2% раствором для очистки, достаточно просто погрузить стеклянные флаконы. Настаивайте их на водяной бане в течение 30 мин при полном импульсе и температуре 65 °C.
- Выньте флаконы из раствора и тщательно промойте их дистиллированной водой. Поместите флаконы в стеклянный стакан, содержащий 2 N NaOH, и храните ультразвуком в течение 20 мин. На этом этапе нагревание не требуется.
- Выньте флаконы из раствора NaOH и тщательно промойте дистиллированной водой. Высушите флаконы в горячей воздушной печи, установленной при температуре 65 °C в течение 2 ч или дольше.
- Хранить очищенные флаконы в чистом стакане, запечатанном прозрачной пленкой, до 6 недель.
ВНИМАНИЕ: Выполните следующие действия внутри химического вытяжного шкафа. Обрабатывайте хлороформ и липидные растворы газонепроницаемыми стеклянными шприцами Hamilton, чтобы избежать загрязнения пластиком. - Промыть шприцы Гамильтона и несколько флаконов из янтарного стекла несколько раз чистым хлороформом. Возьмите липидный порошок, хранящийся в стеклянных ампулах, из морозильной камеры с температурой −20 °C и добавьте адекватные объемы хлороформа для растворения липидных порошков до концентраций 10-25 мг/мл.
- Перенесите раствор из ампулы в только что очищенный флакон из янтарного стекла и наклейте на него соответствующую метку. Выполните этот шаг на льду, чтобы уменьшить испарение хлороформа.
- Делают стоковый раствор DOPC с концентрацией 10-25 мг/мл и DGS-NTA-Ni2+ с концентрацией 1-10 мг/мл.
- Чтобы сделать рабочую липидную смесь, возьмите чистый стеклянный флакон и промойте его в 2 раза хлороформом. Добавьте 300 мкл чистого хлороформа во флакон, чтобы служить основой для лучшего смешивания компонентов. Это не повлияет на конечные концентрации липидов, так как весь хлороформ будет высушен на следующих этапах.
- Добавьте измеренные объемы стоковых липидных растворов во флакон, чтобы получить желаемые рабочие липидные смеси. Целевая концентрация липидов в буфере регидратации липидов составляет 4 мМ. Высушите липидную смесь под медленным потоком газа N2 внутри химической вытяжки при комнатной температуре. Этот шаг может занять до 30 минут для каждого флакона.
- После того, как весь растворитель высохнет, вакуумно высушите липидную пленку в течение >2 ч при комнатной температуре, чтобы удалить любые оставшиеся следы хлороформа. Повторное суспендирование высушенной липидной смеси в буфере регидратации липидов для получения конечной концентрации липидов 4 мМ.
- Инкубировать в течение 5-10 мин, чтобы обеспечить регидратацию липидов. Вихрь липидного раствора в течение примерно 30 с с образованием MLV.
- Сделайте 0,5-1 мл аликвот MLV в микроцентрифужных трубках по 1,5 мл. Погрузите трубки в жидкий азот, запечатайте прозрачной пленкой и храните при температуре −20 °C (до 6 недель).
ПРИМЕЧАНИЕ: Концентрации липидного запаса выбираются таким образом, чтобы обеспечить достаточно большие объемы, которые позволяют надежно пипетировать с использованием шприцев Гамильтона. Если объемы, необходимые для изготовления бульона, слишком велики, чтобы растворить высушенный липидный порошок, сделайте многократные разведения материала, чтобы обеспечить воспроизводимое смешивание различных липидов.
- Подготовка небольших одноламеллярных везикул (БПЛА)
- Извлеките аликвоту MLV из хранилища −20°C и разморозьте ее при комнатной температуре. Вспышкой заморозьте везикулы, погрузив микроцентрифужную трубку в жидкий азот на 15-30 с и сразу же поставив ее на водяную баню, установленную при 45 °C, пока раствор полностью не разморозится (1-2 мин). Повторите вышеупомянутый цикл замораживания-оттаивания 10x-15x, пока раствор не станет менее мутным.
ПРИМЕЧАНИЕ: Установите температуру водяной бани выше температуры перехода размораживаемой липидной смеси, чтобы обеспечить равномерное смешивание липидов. - Уравновешивайте мини-экструдер на основе шприца, оснащенный поликарбонатной фильтрующей мембраной размером 80 нм с буфером регидратации SUV. Убедитесь, что в системе нет утечек или пузырьков. В то время как метод экструзии дает монодисперсные внедорожники с минимальным повреждением липидов, липидные смеси с отрицательным зарядом могут прилипать к поликарбонатной мембране.
- Осторожно пропустите размороженный липидный раствор через предварительно уравновешенный экструдер с одной стороны на другую, а затем обратно. Повторяют цикл 5х-10х до тех пор, пока липидный раствор не станет видимо прозрачным, что указывает на образование внедорожников диаметром ~100 нм.
- Центрифугируйте экструдированную суспензию (или кончик-ультразвуком раствор; см. примечание ниже) при 15 000 х г в течение 60 мин при 4 °C, чтобы гранулировать липидный мусор. Соберите верхние 80% раствора, не нарушая гранулы и не создавая пузырьков. Перенесите супернатант, содержащий внедорожники, в свежую микроцентрифужную трубку и храните на льду до 6 дней.
ПРИМЕЧАНИЕ: Альтернативой центрифугированию является обработка ультразвуком наконечника, выполняемая следующим образом. Включите ультразвуковой аппарат microtip и установите следующие настройки: Амплитуда = 30% от максимума, Время включения = 10 с, Время выключения = 60 с. Очистите наконечник микрозвукового аппарата деионизированной водой, затем 2 Н NaOH, хлороформом и снова деионизированной водой. Опустите наконечник ультразвукового аппарата в каждый из этих растворов и храните ультразвуком в течение 1-2 циклов, используя вышеуказанные настройки. Окуните чистый наконечник в замороженный-размороженный пузырьковый раствор и храните ультразвуком в течение 3-6 циклов на льду, пока раствор не очистится. - После центрифугирования проверьте наличие признаков высокой деградации липидов или неудачной экструзии липидов в виде образования тонкой беловатой пленки и/или хорошо видимой гранулы. В этих случаях не продолжайте и повторяйте шаги подготовки внедорожника снова.
ПРИМЕЧАНИЕ: Срок годности внедорожников может отличаться для разных липидных смесей. Внедорожники из DOPC: DGS-NTA-Ni2+ стабильны до 6 дней для целей этих экспериментов. Советы по решению распространенных проблем можно найти в таблице 2.
- Извлеките аликвоту MLV из хранилища −20°C и разморозьте ее при комнатной температуре. Вспышкой заморозьте везикулы, погрузив микроцентрифужную трубку в жидкий азот на 15-30 с и сразу же поставив ее на водяную баню, установленную при 45 °C, пока раствор полностью не разморозится (1-2 мин). Повторите вышеупомянутый цикл замораживания-оттаивания 10x-15x, пока раствор не станет менее мутным.
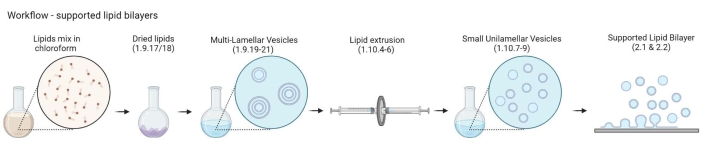
Рисунок 2: Схема, показывающая рабочий процесс от подготовки многоламельных везикул и малых одноцветных везикул до образования поддерживаемых липидных бислоев. Создано с помощью Biorender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Восстановление мембранно-привязанных актиновых сетей
- Подготовка пробоотборных камер
- Возьмите 3-5 прямоугольных стеклянных крышек и поместите их в банку Coplin. Включите ультразвуковой аппарат для ванны и установите температуру на 65 °C. Наполните банку Coplin 2% чистящим раствором, чтобы полностью погрузить крышки, и поместите ее в ультразвуковой аппарат на 30 минут в полноимпульсном режиме.
- Используйте тупые щипцы с покрытием из PTFE, чтобы удалить крышки один за другим из банки. Тщательно промойте их дистиллированной водой и поместите в другую банку Coplin, наполненную 2 N NaOH.
- Обрабатывать крышки ультразвуком в течение 20 минут в полноимпульсном режиме. Снимите крышки один за другим, тщательно промойте дистиллированной водой и поместите в другую банку Coplin, наполненную дистиллированной водой.
ПРИМЕЧАНИЕ: По желанию, обложите крышки ультразвуком в дистиллированной воде в течение 20 минут, а затем снова промойте их дистиллированной водой. - Непосредственно перед началом эксперимента возьмите банку, содержащую крышки, в химическом вытяжке, оснащенном газоснабжением N2 .
- Оптимизируйте давление воздуха в газовом потоке N2 методом проб и ошибок, чтобы достаточно было просто вытеснить воду с поверхности крышки, не нарушая ее. Выровнять поток газа N2 параллельно плоскости крышки, чтобы уменьшить возможность разрушения крышки.
- Используйте перчатки и щипцы, чтобы снять чехлы один за другим из банки, чтобы высушить их под потоком N2 . Высушите обе стороны каждого чехлового листа и поместите их на чистую пластиковую сетку с крышкой. Поместите коробку с крышками в осушитель, чтобы избежать контакта с частицами пыли в воздухе.
ПРИМЕЧАНИЕ: Высушенные крышкиN2 можно хранить в осушителе, где они могут оставаться гидрофильными в течение 2 дней. Эта стратегия может быть полезна, когда для эксперимента требуется много бислоев или если эксперимент занимает более 8 ч. - Возьмите автоклавные трубки ПЦР и вырежьте их крышки и нижние конические половинки острым хирургическим лезвием. Возьмите цилиндрические полуразрезные трубки одну за другой, нанесите УФ-отверждаемый клей на гладкий ободок каждой разрезанной трубки и поместите его перевернутым на свежеочищенный покровный лист так, чтобы ободок сидел ровно на крышке.
- Не перемещайте цилиндр в боковом направлении, как только он расположен на крышке, чтобы клей не пролился в центральное пространство камеры. Прямоугольные крышки могут с комфортом вместить до трех реакционных камер, а круглые могут вместить только одну в центре (рисунок 1).
- Поместите крышки с подшипниками камеры внутрь УФ-озоноочистителя с подачей O2 и вакуумом (или используйте УФ-осветитель). Включите ультрафиолетовый свет и зажгите в течение 3-5 минут, чтобы клей полимеризовался. Выполняют более длительное освещение (10-15 мин) для улучшения гидрофильности покровного стекла и, следовательно, качества липидного бислоя.
- Храните сухие камеры для образцов с ультрафиолетовым освещением в течение 8 ч внутри небольших пластиковых коробок (таких как пустые прямоугольные крышки), обернутых прозрачной пленкой, чтобы уменьшить контакт с частицами пыли в воздухе.
ПРИМЕЧАНИЕ: Постоянный поток O2 в присутствии ультрафиолетового света образует радикалы озона и кислорода, которые могут удалять органические примеси с поверхности покрова. Вакуум предотвратит утечку токсичного озона, который образуется в процессе. - Выньте крышки и проверьте камеры на герметичность, заполнив их дистиллированной водой. Каждая камера может вместить до ~150 мкл образца. Выбросьте протекающие камеры.
ПРИМЕЧАНИЕ: Еще одним отличным и безопасным вариантом очистки является плазменный очиститель. Настройки времени и мощности зависят от модели, но убедитесь, что вы не перегружаете стеклянные слайды плазмой, так как это приведет к снижению подвижности липидов. Обработка поверхности может влиять на подвижность липидов27, как это наблюдалось при длительной обработке чистящим раствором (>45 мин) или NaOH (>30 мин).
- Приготовление поддерживаемых липидных бислоев
- Промывайте каждую камеру буфером образования SLB (или 1x PBS), чтобы удалить любые поверхностные загрязнения, оставляя 100 мкл буфера на конце. Пометьте уровень буфера на уровне 100 мкл постоянным маркером для воспроизводимого отслеживания изменений объема.
- Добавьте в камеру 2 мкл 0,1 МCaCl2 . Это улучшает адсорбцию везикул к поверхности стекла, усиливая двухслойное образование на следующем этапе. Добавляют 8 мкл раствора внедорожника (со стадии 1.10.) в каждую камеру и инкубируют в течение 15 мин при 25 °C.
ПРИМЕЧАНИЕ: Объем добавляемой смеси внедорожников можно оценить путем расчета общего количества липидов (со средней площадью 0,72 нм2), которые необходимы для полного покрытия открытой гидрофильной области скважины двумя липидными слоями. - Смойте несвязанные везикулы с помощью буфера подвижности актина (1x KMEH). Во-первых, удалите 50 мкл буфера образования SLB, оставив только 50 мкл в камере образца. Во-вторых, добавьте в камеру 100 мкл 1x KMEH. Аккуратно перемешайте, а затем удалите 100 мкл буфера, не касаясь дна.
ПРИМЕЧАНИЕ: Важно быть нежным во время стирки. Убедитесь, что наконечник пипетки не касается дна камеры. Держите пипетку наклонной, чтобы направить поток буфера к стенке камеры, а не непосредственно к бислою, так как прямой поток может нарушить бислой. Будьте осторожны, чтобы не вводить пузырьки воздуха во время пипетки, так как воздух может достичь липидного бислоя и вызвать дефекты в нем. - Повторите промывку 10x, добавив 100 мкл 1x KMEH и удалив 100 мкл.
- Добавьте к бислою 10 мкл 1 мг/мл β-казеина, аккуратно перемешайте и инкубируйте в течение 5-10 мин. β-казеин блокирует участки на покровном листе, где бислой не сформировался. Смойте β-казеин 3x с 1x KMEH, как описано в шаге 2.2.3. и вернуть уровень буфера к отметке 100 мкл.
- Добавление мембранно-актинового линкера
- Во время инкубации β казеина (стадия 2.2.5.) вынимают аликвоту мембранно-актинового линкерного белка от −80 °C, быстро размораживают при 37 °C, а затем держат на льду. Разбавить аликвоту буфером разбавления белка до концентрации 1 мкМ.
- Добавьте линкерный белок в определенной конечной концентрации (обычно 5-20 нМ) и осторожно перемешайте. Чтобы обеспечить быстрое уравновешивание белка в камере, добавьте объемы, превышающие 20 мкл, предварительно смешав линкерный белок с 1x KMEH.
- Инкубировать в течение 40 мин при комнатной температуре. Промыть 3x с буфером KMEH 1x, чтобы удалить несвязанный белок HSE (как на шаге 2.2.3.). Доведите уровень буфера в каждой камере до отметки 100 мкл. Теперь образец готов к визуализации.
- Оценка качества липидного бислоя
ПРИМЕЧАНИЕ: Это необязательный шаг, который не нужно выполнять каждый раз. Мы рекомендуем проводить эту оценку каждый раз, когда свежие внедорожники изготавливаются из замороженных запасов MLV.- Включите микроскоп, лазеры возбуждения и камеры обнаружения. Убедитесь, что лазер выровнен, объектив очищен, а программное обеспечение готово к получению изображений.
- Нанесите масло на объектив 100x, установите образец на ступень микроскопа и сфокусируйте объектив на бислое. Убедитесь, что положение лазера таково, что он подвергается полному внутреннему отражению на образце. Используйте лазер возбуждения 488 нм для проверки распределения интенсивности флуоресценции двухслойного 10xHis-YFP-EzrinABD.
ПРИМЕЧАНИЕ: Бислои хорошего качества показывают крупномасштабное, равномерное распределение интенсивности флуоресценции. Плохие бислои показывают интенсивные и пятнистые флуоресцентные пятна. - Чтобы определить целостность бислоя, выполните анализ FRAP.
- Выберите интересующую область на бислое и запишите несколько изображений поля зрения, используя условия изображения, которые обеспечивают отношение сигнал/шум 5:1 или выше. Приостановите запись и закройте полевую диафрагму микроскопа TIRF, чтобы сфокусировать концентрированный лазерный луч на небольшой круговой области бислоя, чтобы локально отбелить флуорофоры.
- Включите лазер до максимальной мощности, чтобы фотоотбелить небольшую область в течение 3-10 с, а затем выключите лазер. Снова откройте полевую диафрагму до ее первоначального радиуса, перенастройте состояние визуализации обратно к настройкам (до отбеливания) и немедленно возобновите запись восстановления флуоресцентного сигнала в поле зрения.
- Проверьте, является ли бислой текучим. Хорошие бислои с нормальной боковой диффузией быстро восстанавливаются, в то время как плохие бислои восстанавливаются медленно или не восстанавливаются вообще (рисунок 3). Если двухслой не восстанавливается, обратитесь к разделу устранения неполадок и перезапустите его. Сохраните изображения в виде 16-битных файлов TIFF. Для количественной оценки коэффициента диффузии проверьте шаг 3. ниже.
- Полимеризация флуоресцентного актина
ПРИМЕЧАНИЕ: Чтобы сэкономить время, начните полимеризацию актина во время инкубации белка HSE, связывающегося с бислоем (этап 2.3.) или во время оценки качества бислоя (этап 2.4.).- Смешайте немаркированный и флуоресцентно меченый G-актин в молярном соотношении 10:1 и дополните его G-буфером таким образом, чтобы концентрация G-актина составляла 20 мкМ. Концентрация, при которой актин окончательно полимеризуется, составит 1/4 этого значения. Добавьте 1/10 10-кратного ME-буфера в смесь для 1-кратного раствора и инкубируйте в течение 2 мин. Этот шаг заменяет ионы Ca2+, связанные с G-актином, ионами Mg2+ . Убедитесь, что конечный объем кратен 10 мкл.
- Добавьте нужное количество белка, укупорочного белка следующим образом. Быстро разморозьте флакон с укупорочным белковым бульоном при 37 °C, а затем держите его на льду. Разбавляют G-буфером таким образом, чтобы концентрация укупорочного белка теперь в два раза превышала его желаемую конечную концентрацию в полимеризационной смеси. Добавьте равный объем разбавленного раствора укупорочного белка в смесь актинов со стадии 2.5.1.
- Наконец, добавьте равный объем свежего 2-кратного целевого буфера в реакционную смесь. Конечный объем раствора должен в четыре раза превышать объем актиновой смеси в конце шага 2.5.2. Убедитесь, что конечная концентрация KMEH составляет 1x, ATP составляет 1 мМ, BSA составляет 1 мг/мл, а G-актина составляет 5 мкМ.
Инкубировать в темноте при 25 °C в течение 45-60 мин, чтобы произошла полимеризация.
ПРИМЕЧАНИЕ: Это называется стратегией целевого буфера, в которой один объем Mg2+ G-актина (шаг 2.5.1.) смешивается с одним объемом укупорочной белковой смеси (этап 2.5.2.) и двумя объемами 2x целевого буфера (шаг 2.5.3.). Это облегчает масштабирование увеличения или уменьшения количества актина и изменение относительной концентрации укупорочного белка (или любого другого актин-модулятора); Рисунок 4).
- Добавление флуоресцентных актиновых нитей
- Вырежьте несколько кончиков по 200 мкл острым лезвием или ножницами, чтобы сделать их тупыми. Аккуратно вылейте необходимый объем 5 мкМ полимеризованного актина (со стадии 2.5.3.) тупым наконечником пипетки (для предотвращения сдвига актиновых нитей) и добавьте его в чистую автоклавную трубку ПЦР.
- Добавьте 1x KMEH в трубку, чтобы объем >20 мкл и осторожно перемешайте, чтобы избежать сдвига F-актина. Из установленной камеры для отбора проб извлеките равный объем буфера.
- Добавьте полимеризованный раствор актина в камеру и аккуратно пипеткой вверх и вниз 3 раза, не касаясь бислоя внизу. Это позволяет актиновым нитям равномерно распределяться по бислою. Установите образец на микроскоп TIRF (см. этап 2.4.1 и шаг 2.4.2).
- Можно записать процесс связывания F-актина с бислоем. Инкубировать в течение 20-30 мин. Запишите несколько изображений из разных полей зрения после того, как добавление F-актина достигло устойчивого состояния. Наблюдают изменение пространственной организации 10xHis-YFP-EzrinABD до (однородной) и после актиновой организации.
ПРИМЕЧАНИЕ: HYE равномерно распределяется по липидному бислою в отсутствие актина. При добавлении актиновых нитей HYE колокализуется с F-актином. Степень колокализации зависит от актин-связывающего сродства белка-линкера; чем сильнее сродство, тем выше колокализация и тем медленнее латеральная подвижность белка-линкера (рисунок 5).
- Добавление миозина II
- После 30 мин инкубации актина установите образец обратно на микроскоп (если он был размонтирован). Проверьте сигнал в линкерных белковых и F-актиновых каналах. При необходимости отрегулируйте условия визуализации.
- Выберите хорошую область с равномерным сигналом белка линкера и равномерно рассеянными актиновыми нитями и без артефактов для длительной записи. Запишите 10-15 кадров при частоте 0,1-0,2 Гц перед добавлением миозина и приостановите запись. Пипетка извлекает необходимый объем переработанного мышечного миозина-II из запасного флакона с тупым наконечником пипетки (для предотвращения сдвига миозиновых нитей) и добавляет в чистую автоклавную трубку ПЦР.
- Немедленно добавьте 1x KMEH в трубку, чтобы объем >20 мкл и аккуратно перемешайте. Можно также добавить АТФ, регенерирующую смесь АТФ, фотостабилизирующие агенты и т.д. на этом шаге. Осторожно извлеките равный объем буфера из установленной камеры для отбора проб, не нарушая его.
- Аккуратно добавьте раствор миозина в пробную камеру. Не пипетку вверх и вниз, так как это потревожит связанные с поверхностью нити. Немедленно возобновите покадровую регистрацию и наблюдайте за системой, как она эволюционирует из состояния до миозина к сокращенным потокам акто-миозина, подпитываемому АТФ, и образованию астры в истощенное АТФ состояние (см. репрезентативные результаты).
- Сделайте фоновые изображения для всех каналов, используя только образец буфера. Сохраните все изображения в виде 16-битных .tiff файлов. Советы по решению распространенных проблем см. в таблице 2 .

Рисунок 3: Оценка качества бислоев с помощью быстрого анализа FRAP. Поддерживаемые липидные бислои (SLB), полученные из липидов DOPC и Ni-NTA (98:2 моль%), покрыты HYE (10xHis-YFP-меченый мембранно-актиновый линкер). После того, как несвязанный белок вымывается, флуоресцентный бислой визуализируется под микроскопом TIRF. Небольшая область на бислое фотоотбеливается высокой мощностью лазера, и регистрируется восстановление флуоресценции. (A) Хороший бислой всегда быстро восстанавливается с ожидаемым коэффициентом диффузии 1-1,5 мкм2/с для липидной композиции, используемой в этом случае. (B) Плохие бислои восстанавливаются очень медленно или не восстанавливаются вообще. (C) Репрезентативные изображения плохих бислоев: (C-i) бислой с отверстиями, (C-ii) бислой с большими, неподвижными липидными пятнами и (C-iii) бислой с маленькими, неподвижными точками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
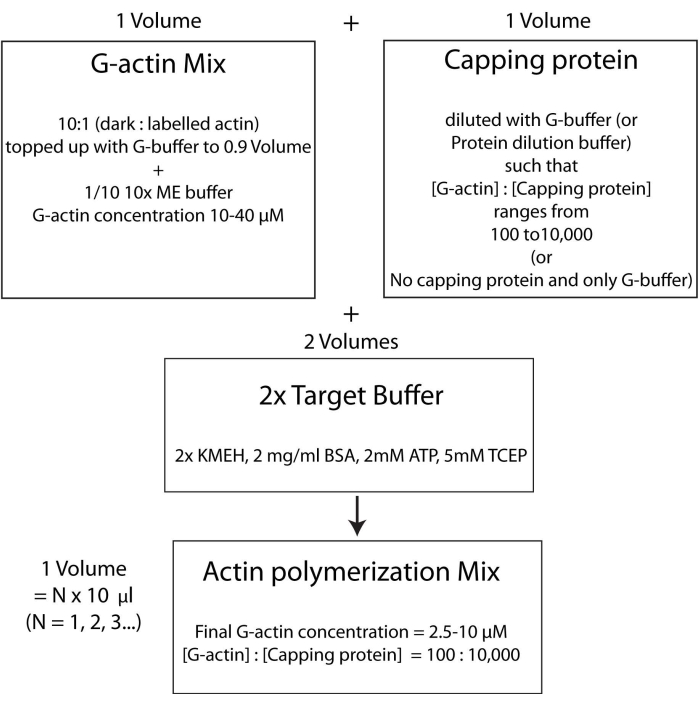
Рисунок 4: Схема, показывающая, как полимеризовать актин с помощью целевого буферного метода. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Пространственная организация HYE при связывании с F-актином. Снимки TIRF, показывающие пространственную организацию HYE до и после добавления актиновых нитей (маркированных atto-635 maleimide). Организация HYE однородна до добавления F-актина и становится колокализованной и сросшейся вдоль актиновых нитей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Анализ данных
- Используя программное обеспечение Fiji (https://imagej.net), вычтите фон из изображений белка линкера (из шага 2.4.). Измерьте средние значения интенсивности по обесцвеченному пятну и контрольной области.
- Нормализуйте временные следы от обесцвеченного пятна и опорной области до интенсивности их соответствующих значений интенсивности до отбеливания. Разделите каждую точку времени в нормализованных значениях отбеленной области на соответствующие точки времени в нормализованной временной трассировке опорной области. Скорректируйте результирующую нормированную временную трассировку для фона и для любых систематических колебаний интенсивности во время съемки (глобальное фотоотбеливание, z-дрейф и т.д.).
- Используйте ручной метод28 без подгонки для оценки коэффициента диффузии двухслойных привязанных белков. Вкратце, половинное время профиля восстановления, τ1/2, можно рассчитать, посмотрев на время, когда нормализованный профиль восстановления достигает половины своего устойчивого состояния:
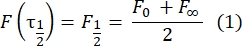
Здесь F0 — средняя интенсивность в обесцвеченной области в первом кадре после фотоотбеливания, а F∞ — долгосрочное устойчивое значение восстановления бислоя. - Оцените эффективный радиус отбеливания, re, параметр, который корректирует диффузию во время фотоотбеливания, из линейного сканирования профиля29 пятна после отбеливания. Половинная ширина в половину минимума этого линейного сканирования, проходящего через центр пятна отбеливателя, r1/2, относится к re следующим образом:
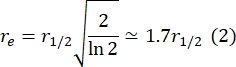
τ1/2, рассчитанный на шаге 2.8.3., re, рассчитанный на шаге 2.8.4., и первоначально заданный радиус отбеливания, rn, используются для расчета коэффициента диффузии (D) по следующей формуле: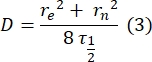
- Используйте ручной метод28 без подгонки для оценки коэффициента диффузии двухслойных привязанных белков. Вкратце, половинное время профиля восстановления, τ1/2, можно рассчитать, посмотрев на время, когда нормализованный профиль восстановления достигает половины своего устойчивого состояния:
- Анализ изображений астр актомиозина
- Используя Фиджи, вычтите фон из всех записанных изображений во всех каналах. Исправьте изображения для любого неравномерного освещения или интерференционной картины с помощью коррекции плоского поля.
ПРИМЕЧАНИЕ: Можно использовать цветные пластиковые слайды, которые являются хорошими плоскими образцами для такой коррекции. Для линкерных белковых и актиновых нитей на плоском бислое можно также использовать среднюю проекцию нескольких премиозиновых изображений для создания карт коррекции освещения для конкретных каналов.- Для канала HYE, показанного здесь, возьмите проекцию средней интенсивности нескольких изображений HYE (записанных из разных областей липидного бислоя до добавления миозина). Примените соответствующий фильтр Гаусса (σ = от 50 до 80 пикселей) к средней проекции (из изображений до миозина или любого стандартного плоского образца).
- Преобразуйте отфильтрованное изображение в 32-разрядное. Разделите все значения пикселей на среднее значение всего изображения. Это даст нормализованную карту коррекции для канала HYE. Разделите все изображения в канале HYE с помощью этой карты для коррекции плоского поля. Создавайте корректирующие карты для других каналов, используя ту же стратегию.
- Корректируется для фотоотбеливания с использованием метода экспоненциального или простого соотношения (в зависимости от профиля интенсивности распада) на Фиджи.
- Чтобы исправить любое временное смещение x-y (поступательное движение), объедините все каналы с коррекцией фотоотбеливания в один Гиперстек. Используя плагин Hyperstack-Reg на Фиджи, примените преобразование «Твердое тело» или «Перевод».
- Наконец, разделите выровненный Hyperstack на отдельные каналы и сохраните их отдельно в виде 16-битных стеков TIFF для дальнейшего анализа.
- Используя Фиджи, вычтите фон из всех записанных изображений во всех каналах. Исправьте изображения для любого неравномерного освещения или интерференционной картины с помощью коррекции плоского поля.
Результаты
Для представления здесь показан типичный профиль постотбеливания из 1-го изображения после фотоотбеливания (изображение при t = 0 s на рисунке 3A) и его соответствие следующей функции28 (см. Рисунок 6A):

Значение re (23,94 мкм), рассчитанное по подгонке к этой кривой, очень похоже на re , рассчитанное на шаге 2.8.4. (23,24 мкм). Здесь K представляет собой параметр глубины отбеливания, который может быть непосредственно оценен из F0 (описан в шаге 2.8.4.). Аналогичным образом, на рисунке 6B показан профиль восстановления и его соответствие следующей функции28:
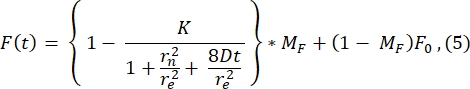
Мы находим, что подходящее значение коэффициента диффузии составляет 1,34 мкм2/с, значение, которое близко согласуется со значением 1,39 мкм2/с, рассчитанным по формуле на шаге 2.8.4. Здесь MF означает подвижную фракцию липидного бислоя, которая представляет собой долю обесцвеченной популяции, которая восстанавливается обратно. Подвижность молекул, закрепленных липидами, зависит, конечно, от липидного состава и его физического состояния (жидкая или гелевая фаза). Для наших экспериментов с использованием липидных мембран на основе DOPC подвижность должна быть >1 мкм2/с, а подвижная фракция не должна быть меньше 0,9, чтобы указывать на хороший липидный бислой. Мы рекомендуем использовать ручной метод без подгонки для быстрой проверки качества и мобильности бислоя. Метод подгонки может быть полезен при автоматизации анализа для многих кривых FRAP. Кроме того, если кто-то хочет выполнить более сложный эксперимент FRAP для систематической характеристики диффузии в системе, мы рекомендуем читателю этот обзор от Lorén et al.30 для более подробной информации о моделях подгонки и потенциальных подводных камнях в экспериментальном проектировании.

Рисунок 6: Количественная оценка коэффициента диффузии липидных бислоев. (A) Линейный профиль первого изображения после фотоотбеливания (t = 0 с на рисунке 3A) и его соответствие уравнению 4 для расчета эффективного радиуса отбеливания. (B) Профиль восстановления обесцвеченной области и его соответствие уравнению 5 для расчета коэффициента диффузии и подвижной фракции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Типичный результат описанных выше экспериментов, показывающих динамическую сборку и организацию акто-миозиновой сети, связанной на поддерживаемом липидном бислое, изображенном с помощью микроскопии TIRF, изображен на рисунке 7 и дополнительном видео S1.
На рисунке 7 показан монтаж изображения белка-линкера, F-актина и миозина-II.
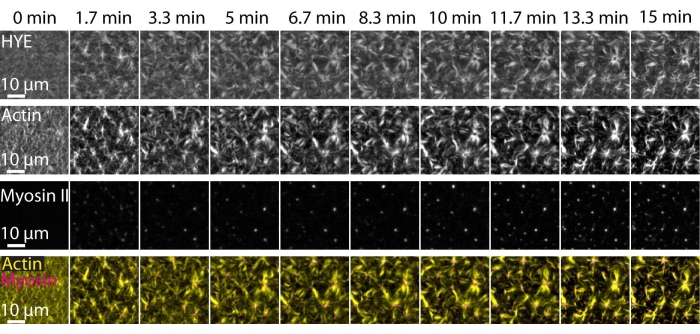
Рисунок 7: Сократительные потоки актомиозина управляют локальной кластеризацией мембранно-актинового линкерного белка HYE. TIRF снимки HYE (YFP-меченый), актиновых нитей (помеченных atto-635 maleimide) и нитей миозина II (помеченных Atto-565 maleimide) при добавлении миозина II к SLB, содержащему HYE и F-актин. Сверху указано время: 0 мин непосредственно перед тем, как флуоресцентные миофиламенты начали появляться в поле TIRF. HYE и F-актин равномерно распределяются по липидному бислою до добавления миозина (0 мин). Активность миозина индуцирует сократительные потоки актомиозина, которые выходят в астроподобные структуры в установившемся состоянии (15 мин), приводя к локальной кластеризации связанного мембранного компонента (HYE). Нижний ряд представляет собой слияние изображений актина (желтого) и миозина II (пурпурного), показывающих организацию актина и миозина в разные моменты времени. Изображения, использованные при создании этих монтажей, были скорректированы на Фиджи для фонового сигнала, неоднородных моделей интенсивности и трансляционного движения. Шкала шкалы = 10 мкм. Дополнительные сведения см. в дополнительном видео S1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Имя буфера | Состав | |
| Буфер липидной регидратации | 50 мМ HEPES, 150 мМ NaCl, 5% сахароза, рН 7,5 | |
| Буфер формирования SLB | 50 мМ HEPES, 150 мM NaCl, pH 5-6 | |
| Буфер хранилища SLB | 50 мМ HEPES, 150 мМ NaCl, pH 7,2 | |
| Буфер разбавления белка | 20 мМ HEPES, 100 мМ KCl, 1mM TCEP или DTT, pH 7,2 | |
| 1X ME или актиновый ионообменный буфер | 50 мМ MgCl2, 0,2 мМ EGTA, 10 мМ HEPES, рН 7,2 (хранить при 4°C) | |
| 1X KMEH или буфер полимеризации актина | 50 мМ KCl, 1 мМ MgCl2, 1 мМ EGTA, 50 мМ HEPES, рН 7,2 | |
| Запас АТФ 100 мМ | 100 мМ АТФ динатриевой соли, 50 мМ Tris, 50 мМ NaCl, 5 мМ MgCl2, 2 мМ EGTA, рН 7,5 (хранить при -20°C) | |
| 2x Целевой буфер | 2x KMEH, 2 мг/мл BSA, 2mM АТФ, 5mM TCEP (хранится при 4°C) | |
| G-буфер | 2 мМ Tris, 0,1 мМ CaCl2, 0,2 мМ АТФ, 0,5 мМ TCEP, 0,04 % NaN3, pH 8 (хранить при 4°C) | |
| Буфер миозина II | 500 мМ KCl, 1 мМ ЭДТА, 10-20 мМ Hepes, pH 7,0 | |
| Гель-фильтрационный хроматографический буфер | 50 мМ Tris-HCl, 150-300 мМ NaCl, 5 мМ TCEP, 0,1% Tween-20, pH 7,5 | |
| Укупорка буфера хранения белка | 10 мМ Трис· Cl, 50 мМ NaCl, 1 мМ TCEP, рН 7,5, 20% глицерин | |
Таблица 1: Список буферных композиций, используемых в этом протоколе.
| Распространенные проблемы и устранение их неисправностей | Проблема | Причина | Возможные решения | ||||||
| 1 | Липидный бислой не проявляет диффузии | Наиболее вероятной причиной этой проблемы является грязное покровное стекло, которое может произойти, когда чистящий раствор состарился или нагрев не состоялся во время обработки ванны ультразвуком. Эти бислои имеют «везикулярный» вид, потому что лопнувшие везикулы прилипают к покровному стеклу, но не сливаются друг с другом. Использование MLV старше 6 недель или внедорожников старше 6 дней или добавление небольшого количества внедорожников также может привести к образованию везикулярных бислоев. | Используйте свежий чистящий раствор. Убедитесь, что обогреватель включен и температура составляет 45-65 °C. Используйте свежие липидные смеси. (Использование флуоресцентного липидного зонда по сравнению с флуоресцентным белковым зондом иногда может проявляться по-разному. Например, если бислой имеет субдифракционные дефекты и этап пассивации поверхности пропущен (или не работает), липидный зонд покажет равномерное распределение интенсивности, но флуоресцентный белковый зонд может отображать яркие флуоресцентные пятна.) | ||||||
| 2 | Липидный бислой имеет яркие пятна | Длительная инкубация внедорожников для образования бислоя может создать липидный бислой, который в целом рассеивается, но со случайными яркими пятнами. Эти пятна могут быть многослойными бислоями, которые могут привлекать большое количество флуоресцентного зонда. | Достаточно 15-20 мин инкубации с внедорожниками. Убедитесь, что зонд не агрегирует: быстрый жесткий спин белка линкера (300 х г в течение 15 мин при 4 °C) может удалить агрегаты | ||||||
| 3 | Липидный бислой имеет темные отверстия | Это происходит, когда бислой изготавливается из старых внедорожников и визуализируется в течение длительных часов (> 4 часов после формирования), или рН раствора резко изменяется из-за длительной визуализации (например, в состоянии с высоким атФ И в присутствии определенных поглотителей кислорода), или когда поверхность чрезмерно пассивируется бета-казеином (добавление слишком большого количества бета-казеина в течение более 10-15 мин и или его не вымывание). | Используйте свежие липиды. Уменьшите частоту кадров изображения или эффективное время лазерного освещения. Используйте буферы с более высокой буферизационной способностью. | ||||||
| 4 | Липидный бислой показывает медленную диффузию | Липидные бислои с высоким процентом холестерина, длительно насыщенные липиды или заряженные липиды диффундируют медленнее. | В таких случаях подготовьте образец при высокой температуре. Можно также использовать простую, проверенную липидную композицию в качестве контроля наряду со сложными и непроверенными липидными композициями. Убедитесь, что стекло чистое. | ||||||
| 5 | Актин не полимеризуется | Целевой буфер старый, запас G-актина слишком старый, старый и новый G-актин были сополимеризованы. | Убедитесь, что Ca2+ заменен mg2+ перед полимеризацией (с использованием ME-буфера). Используйте свежий запас АТФ-Мг2+ . Используйте свежепереработанный G-актин. Убедитесь, что концентрация F-актина (в пересчете на G-актин), добавленного в бислой, выше 0,2 мкМ. Для более низких концентраций используют фаллоидин, стабилизированный F-актин. | ||||||
| 6 | Актин не связывается с бислоем | Мембранно-актиновый линкер не добавляется и не добавляется при очень низкой концентрации — это может быть выведено из флуоресценции белка линкера. Если флуоресценция приличная, мембранно-актиновый линкер утратил актин-связывающую способность. Кроме того, если белок-линкер не специфически связан со стеклянной поверхностью (когда бислой плохой), он может не набирать актиновые нити. | Убедитесь, что бислой рассеивается. Используйте свежий линкерный белок | ||||||
| 7 | Флуоресцентный сигнал F-актина слабый | Соотношение меченого и темного актина слишком низкое. Либо меченый актин, либо немаркированный актин слишком стары, и они не сополимеризуются друг с другом. | Снова переработайте актин и повторите попытку плоймеризации со свежепереработанным актином. Фотоповреждение может разрушить или деполимеризировать F-актин; по возможности используйте красные или дальние красные красители для актина (и миозина). | ||||||
| 8 | Миозин не проявляет сократимости | можно отметить, что после добавления АТФ в миозин-инфузионную систему не наблюдается сократимости акто-миозина. | Проверьте, хороша ли концентрация миозина или уровень чистоты. Используйте свежепереработанный миозин (используйте в течение 6 недель после переработки). Добавление свежей АТФ в смесь миозина может помочь. Дегазация буферов и использование поглотителей кислорода и т.д. может уменьшить фотоповреждение двигателей. Дополнительную информацию можно найти в протоколах Plastino et al. или Stam et al. той же коллекции методов. | ||||||
| 9 | Покровное стекло не является гидрофильным | Покровное стекло не очищается должным образом. | Чистое гидрофильное покрытие имеет решающее значение для образования липидных бислоев. Полезным визуальным считыванием гидрофильности покровного стекла после протокола очистки является наблюдение за смачиванием стекла водой. Добавьте небольшой объем воды в плоскую крышку. Вода останется в форме круглой капли, если крышка не будет очищена должным образом. Однако такой же объем воды будет распространяться и образовывать тонкий слой, на обработанном гидрофильном покровном стекле. Это смачивающее поведение воды на поверхности покровного стекла может быть использовано для определения того, сработали ли этапы очистки с помощью чистящего раствора / NaOH. | ||||||
Таблица 2: Руководство по устранению неполадок, обобщающее общие проблемы и соответствующие решения.
Дополнительное видео S1: Сократительные потоки актомиозина стимулируют локальную кластеризацию мембранно-актинового линкерного белка HYE. Замедленный таймлапс TIRF HYE (YFP-меченый), актиновых нитей (помеченных atto-635 maleimide) и нитей миозина II (меченых atto-565 maleimide) при добавлении миозина II к SLB, содержащим HYE и F-актин. Сверху указано время: 0 мин непосредственно перед тем, как флуоресцентные миофиламенты начали появляться в поле TIRF. Шкала = 10 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Этот протокол представляет собой универсальную платформу и отправную точку для разработки экспериментов по изучению интерфейса мембрана-кора клеток. Критическими этапами являются подготовка чистых стеклянных слайдов с использованием свежих липидов для эффективного образования SUV (оба влияют на качество SLB) и использование свежепереработанных белков миозина II для динамической реорганизации актиновой нити. При визуализации динамики в течение длительного времени очень важно включить систему поглотителя кислорода (например, протокатеховую кислоту и протокатехуат 3 4-диоксигеназу 5,31).
Конструкция с открытой камерой позволяет последовательно добавлять компоненты в существующую систему без индуцирования липидных потоков. Это может быть важным преимуществом по сравнению с широко используемыми подходами с закрытой камерой или работой с использованием инкапсулированных белков в липосомах36. Противоположные эффекты, такие как вызванная белком мембранная деформация, не могут быть изучены со стеклянными адсорбированными липидными бислоями.
Липидные бислои могут быть сформированы с широким спектром липидных композиций. Он начинается с адсорбции липидных везикул к поверхности гидрофильного стекла, за которым следует либо спонтанный разрыв пузырька из-за поверхностно-везикулярных и прямых везикул-везикулярных взаимодействий, либо адсорбированные везикулы, достигающие критического покрытия, после чего небольшая часть везикул разрывается, образуя активные края, что в конечном итоге приводит к двухслойному образованию32 . Помимо стекла, различные подложки могут быть использованы для формирования поддерживаемых липидных бислоев, таких как слюда (например, для атомно-силовой микроскопии), мягкие подложки (например, поли-ди-метил-силоксан), полимерные подушки 33,34,35, охватывающие между дырками электронной микроскопии сетки 14. Бислои капельного интерфейса являются еще одним интересным методом создания стабильных, отдельно стоящих липидных бислоев36. Включение акто-миозиновых сетей в везикулы или эмульсии является очень мощным методом изучения этой минимальной системы в клеточной геометрии37,38, которая подробно описана в другом месте39.
Раскрытие информации
У авторов нет конфликта интересов, о которых можно было бы заявить.
Благодарности
Эта работа была поддержана исследовательским фондом AXA и Программой количественной биомедицины Warwick-Wellcome (Wellcome ISSF, RMRCB0058) для DVK, NCBS-TIFR для AB и ST, а также стипендией Wellcome-DBT Margdarshi (IA/M/15/1/502018) для SM. DVK также хотел бы поблагодарить Биофизическое общество за организацию виртуального сетевого мероприятия «Проблемы в понимании многокомпонентных цитоскелетных сетей от молекулярного до мезомасштаба», что способствовало созданию этой коллекции протоколов.
Материалы
| Name | Company | Catalog Number | Comments |
| 1,2 dipalmitoyl-sn-glycero-3-phosphoethanolamine-N- (lissamine rhodamine B sulfonyl) | Avanti Polar Lipids | 810158 | 16:0 RhoPE |
| 1,2-dioleoyl-sn-glycero-3- [(N-(5-amino-1 carboxypentyl) iminodiacetic acid) succinyl] (nickel salt) | Avanti Polar Lipids | 790404 | DGS-NTA-Ni2+ |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850375 | DOPC |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850355 | DPPC |
| Amber glass vials | ThermoFisher | B7990-2A | |
| ATP disodium salt | Sigma Aldrich | A26209 | |
| Attofluor cell chamber | ThermoFisher | A7816 | |
| Bath sonicator | GT Sonic | 1860QTS | |
| beta-casein | Sigma Aldrich | C6905 | |
| CaCl2 | ThermoFisher | 12135 | |
| chloroform | Sigma Aldrich | 650471 | alternatively from Electron Microscopy Sciences, 50980296 |
| Cover slips, #1, 25 mm diameter, Gold Seal | Harvard Apparatus | 64-0705B | |
| Cover slips, #1, 40x22 mm, Gold Seal | ThermoFisher | 48404-031 | |
| EDTA | ThermoFisher | G12635 | |
| EGTA | Himedia | MB130 | |
| Gas tight glass syringes, with removebla needle, blunt, volumes 10 µL, 100 µL, 500 µL | Hammilton | 1700 series | |
| Hellmanex III | Hellma Analytics | Z805939 | cleaning solution |
| HEPES | Himedia | RM380 | |
| KaH2PO4 | ThermoFisher | G13405 | |
| KCl | ThermoFisher | G13305 | |
| KOH | ThermoFisher | G26708 | |
| Lipid extruder | Avanti Polar Lipids | 61000-1EA | |
| MgCl2 | ThermoFisher | G15535 | |
| Microtip sonicator | Sonics | VC750 | 3 mm Tip diameter |
| Na2CO3 | ThermoFisher | G15955 | |
| NaCl | Himedia | GRM853 | |
| NaH2PO4 | ThermoFisher | G15825 | |
| NaOH | ThermoFisher | G27815 | |
| Nikon Ti Eclipse TIRF microscope | Nikon | With a TIRF unit connected through a polarization-conserving optical fibre to an Agilent monolithic laser combiner MLC400 with multiple laser lines with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) | |
| NOA88 | Norland Products | 8801 | |
| PTFE Coated Tweezer Style #2A | Structure Probe | 0S2AT-XD | |
| Refrigerated microcentrifuge | Eppendorf | 5424R | |
| Sucrose | ThermoFisher | G15925 | |
| UV-illuminator | Novascan | PSD PRO-UV | needs vacuum and O2 supply |
Ссылки
- Köster, D. V., Mayor, S. Cortical actin and the plasma membrane: Inextricably intertwined. Current Opinion in Cell Biology. 38, 81-89 (2016).
- Rao, M., Mayor, S. Active organization of membrane constituents in living cells. Current Opinion in Cell Biology. 29, 126-132 (2014).
- Honigmann, A., et al. A lipid bound actin meshwork organizes liquid phase separation in model membranes. eLife. 3, 01671(2014).
- Das, A., et al. Stratification relieves constraints from steric hindrance in the generation of compact actomyosin asters at the membrane cortex. Science Advances. 6 (11), (2020).
- Köster, D. V., et al. Actomyosin dynamics drive local membrane component organization in an in vitro active composite layer. Proceedings of the National Academy of Sciences. 113 (12), 1645-1654 (2016).
- Vogel, S. K., Heinemann, F., Chwastek, G., Schwille, P. The design of MACs (minimal actin cortices). Cytoskeleton. 70 (11), 706-717 (2013).
- Murrell, M., Thoresen, T., Gardel, M. Reconstitution of contractile actomyosin arrays. Methods in Enzymology. 540, 265-282 (2014).
- Mosby, L. S., et al. Myosin II filament dynamics in actin networks revealed with interferometric scattering microscopy. Biophysical Journal. 118 (8), 1946-1957 (2020).
- Seara, D. S., et al. Entropy production rate is maximized in non-contractile actomyosin. Nature Communications. 9 (1), 4948(2018).
- Linsmeier, I., et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7, 12615(2016).
- Vogel, S. K., Petrasek, Z., Heinemann, F., Schwille, P. Myosin motors fragment and compact membrane-bound actin filaments. eLife. 2, 00116(2013).
- Ditlev, J. A., et al. A composition-dependent molecular clutch between T cell signaling condensates and actin. eLife. 8, 42695(2019).
- Banjade, S., Rosen, M. K. Phase transitions of multivalent proteins can promote clustering of membrane receptors. eLife. 3, 04123(2014).
- Heinemann, F., Vogel, S. K., Schwille, P. Lateral membrane diffusion modulated by a minimal actin cortex. Biophysical Journal. 104 (7), 1465-1475 (2013).
- Vogel, S. K., Greiss, F., Khmelinskaia, A., Schwille, P. Control of lipid domain organization by a biomimetic contractile actomyosin cortex. eLife. 6, 24350(2017).
- Block, S. Brownian motion at lipid membranes: A comparison of hydrodynamic models describing and experiments quantifying diffusion within lipid bilayers. Biomolecules. 8 (2), 30(2018).
- JoVE, JoVE. JoVE Methods Collection. In vitro reconstitution of cytoskeleton networks for biomaterials, biophysics and active matter research. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Enzymology. 85, 164-181 (1982).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Pollard, T. D. Myosin purification and characterization. Methods in Cell Biology. 24, 331-371 (1982).
- JoVE Science Education Database. Separating protein with SDS-PAGE. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Bieling, P., et al. WH2 and proline-rich domains of WASP-family proteins collaborate to accelerate actin filament elongation. The EMBO Journal. 37 (1), 102-121 (2018).
- Shrivastava, R., Köster, D., Kalme, S., Mayor, S., Neerathilingam, M. Tailor-made ezrin actin binding domain to probe its interaction with actin in-vitro. PLoS One. 10 (4), 0123428(2015).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5, 5412(2014).
- Selden, N. S., et al. Chemically programmed cell adhesion with membrane-anchored oligonucleotides. Journal of the American Chemical Society. 134 (2), 765-768 (2012).
- Seu, K. J., et al. Effect of surface treatment on diffusion and domain formation in supported lipid bilayers. Biophysical Journal. 92 (7), 2445-2450 (2007).
- Kang, M., Day, C. A., Kenworthy, A. K., DiBenedetto, E. Simplified equation to extract diffusion coefficients from confocal FRAP data. Traffic. 13 (12), 1589-1600 (2012).
- Kang, M., Day, C. A., Kenworthy, A. K. A novel computational framework for D(t) from Fluorescence Recovery after Photobleaching data reveals various anomalous diffusion types in live cell membranes. Traffic. 20 (11), 867-880 (2019).
- Lorén, N., et al. Fluorescence recovery after photobleaching in material and life sciences: Putting theory into practice. Quarterly Reviews of Biophysics. 48 (3), 323-387 (2015).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (7), 1-7 (2013).
- Andrecka, J., Spillane, K. M., Ortega-Arroyo, J., Kukura, P. Direct observation and control of Supported lipid bilayer formation with interferometric scattering microscopy. ACS Nano. 7 (12), 10662-10670 (2013).
- Lin, W. -C., et al. Supported membrane formation, characterization, functionalization, and patterning for application in biological science and technology. Current Protocols in Chemical Biology. 2 (4), 235-269 (2010).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: An integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sapuri-Butti, A. R., Butti, R. C., Parikh, A. N. Characterization of supported membranes on topographically patterned polymeric elastomers and their applications to microcontact printing. Langmuir. 23 (25), 12645-12654 (2007).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Bashirzadeh, Y., Moghimianavval, H., Liu, A. P. Encapsulated actomyosin patterns drive cell-like membrane shape changes. iScience. 25 (5), 104236(2022).
- Bashirzadeh, Y., Wubshet, N., Litschel, T., Schwille, P., Liu, A. P. Rapid encapsulation of reconstituted cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. (177), e63332(2021).
- Murrell, M., Chen, S., Sun, Z. G. In vitro reconstitution of actin cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. , (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены