Method Article
שחזור של קליפות אקטין מינימליות הקשורות לממברנה על דו-שכבתיות שומנים נתמכות
In This Article
Summary
פרוטוקול זה מתאר את היווצרותם של דו-שכבתיות שומנים נתמכות ואת התוספת של חוטים ציטוסקטליים וחלבונים מוטוריים כדי לחקור את הדינמיקה של רשתות ציטוסקטליות משוחזרות, הקשורות לממברנה, באמצעות מיקרוסקופיה פלואורסצנטית.
Abstract
פני השטח של תא חי מספקים פלטפורמה פעילה רב-תכליתית לתהליכים תאיים רבים, הנובעים מיחסי הגומלין של קרום הפלזמה עם קליפת האקטין שמתחת. בעשורים האחרונים, מערכות משוחזרות ומינימליות המבוססות על דו-שכבתיות שומנים נתמכות בשילוב עם רשתות נימה של אקטין הוכיחו את עצמן כמסייעות מאוד בחשיפת מנגנונים בסיסיים והשלכות של רשתות אקטין הקשורות לממברנה, כמו גם בחקר הפונקציות של חלבונים בודדים הקשורים לממברנה. במאמר זה נתאר כיצד לשחזר מערכות מרוכבות פעילות כאלה במבחנה, המורכבות מדו-שכבות שומנים נתמכות בנוזל המצומדות באמצעות חלבונים קושרי אקטין הקשורים לממברנה לבין חוטי אקטין דינמיים ומנועי מיוזין שניתן לצפות בהם בקלות באמצעות מיקרוסקופיית השתקפות פלואורסצנטית פנימית כוללת. תכנון תא פתוח מאפשר להרכיב את המערכת באופן שלב אחר שלב ולשלוט באופן שיטתי בפרמטרים רבים כגון ריכוז חלבון מקשר, ריכוז אקטין, אורך נימה אקטין, יחס אקטין/מיוזין וכן רמות ATP. לבסוף, אנו דנים כיצד לשלוט באיכות המערכת, כיצד לזהות ולפתור בעיות שכיחות, וכמה מגבלות של מערכת זו בהשוואה לפני השטח של התא החי.
Introduction
קרום הפלזמה של תא חיה חי מקיים אינטראקציה מתמדת עם שלד האקטין הסמוך, ויחד הם יוצרים חומר מרוכב פעיל הממלא שפע של פונקציות תאיות 1,2. כדי לחקור תהליכים בממשק זה של ממברנה-אקטין שומנים, השחזור של רשתות ציטוסקטליות על גבי דו-שכבתיות שומנים נתמכות (SLBs) הוכח כמועיל מאוד. גישה מערכתית מינימלית זו מאפשרת שליטה מדויקת ברכיבי רשת השלד הציטוסקולרי ובהרכב השומנים. בהשוואה לקרום השומנים העומדים בפני עצמם של שלפוחיות חד-לשוניות ענקיות, הגיאומטריה המישורית של SLBs מאפשרת שימוש יעיל בטכניקות מיקרוסקופיה חדישות כגון סופר-רזולוציה3,4, פלואורסצנציה של השתקפות פנימית כוללת (TIRF)5,6,7, או פיזור אינטרפרומטרי8 לחקור את הארגון המרחבי והדינמיקה של רשתות ציטוסקטליות. TIRF מספק את הניגודיות הגבוהה ביותר עבור רכיבים המסומנים באופן פלואורסצנטי, מכיוון שהאות של מולקולות מסומנות לא מאוגדות בתמיסה התורמת לאות הרקע הוא מינימלי.
במאמר זה נתאר פרוטוקול בסיסי להיווצרות רשתות אקטומיוזין הקשורות לדו-שכבתיות שומנים נתמכות, הנמצאות בשימוש נרחב בתחום כדי לחקור את הפיזיקה של רשתות מעין-דו-ממדיות פעילות 9,10,11 והשפעתן על ארגון הממברנות3,5,12,13,14,15,16 (איור 1) ). גישה זו אינה מוגבלת לרשתות מבוססות אקטין, אלא ניתן גם להתאים אותה בקלות כדי לחקור מיקרוטובולים, חוטי ביניים או רשתות מרוכבות בעלות אופי מעורב ולחקור מגוון אינטראקציות בין חלבוני ממברנה שומניים ורכיבים ציטוסקטליים באמצעות שיטות מיקרוסקופיה רגישות לפני השטח.
כדי לשמור על פרוטוקול זה ממוקד, לא כללנו תיאור מפורט של טיהור ותיוג של חלבוני אקטין ומיוזין או פרטים על אופן הכוונון והשליטה בהתכווצות ובארגון של רשתות אקטומיוסין. יש להתייחס לפרוטוקולים אחרים המתפרסמים לצד זה באוסף שיטות JoVE, In Vitro Reconstitution של רשתות שלד ציטוסקלטון לביו-חומרים, ביופיסיקה וחקר חומר פעיל17.

איור 1: סכמטי של מערכת מרוכבת פעילה של אקטין ממברנה במבחנה . נוצר עם ביורנדר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
1. ריאגנטים וציוד
- הכינו מאגרים טריים כמפורט בטבלה 1. יש להשתמש במים אולטרה-טהורים שעברו דה-יוניזציה עם התנגדות של 18.2 MΩ·cm ב-25°C. עקר את כל המאגרים על ידי העברתם דרך מסנני 0.22 מיקרומטר תחת ואקום. דגה את המאגרים המשמשים לכרומטוגרפיה של עמודות.
- לטהר את אקטין שרירי השלד כפי שתואר קודםלכן 18,19. הוסיפו 20% גליצרול לתמיסת ה-G-אקטין המטוהרת הסופית וצרו אליקוטים של 500 μL (לניסויים בהתוויה או לניסויים בתפזורת) ונפח של 10 μL (לניסויים בודדים). הבזק להקפיא את aliquots על ידי טבילת הצינורות בחנקן נוזלי במשך 30 שניות ולאחר מכן לאחסן אותם ב -80 מעלות צלזיוס עד 18 חודשים.
הערה: לחלופין, ניתן לרכוש אבקת אקטין או אצטון מטוהרת באופן מסחרי. - תייג G-actin של שרירי שלד מטוהרים עם כל צבעי maleimide פלואורסצנטיים כפי שתואר קודםלכן 5. קבע את הריכוז ואת מידת הסימון של החלבון על ידי ספקטרופוטומטריה באמצעות תיקון A290nm עבור אקטין (εactin = 26,600 M-1 cm-1) ו-A λmax של הצבע. בצע aliquots של 10 μL והקפאת הבזק על ידי טבילת הצינורות בחנקן נוזלי למשך 30 שניות ואחסון בטמפרטורה של −80 מעלות צלזיוס למשך עד 18 חודשים.
הערה: תיוג עם אסטרים של NHS מצומדים לליזין ייצור אקטין שאינו מתפקד ויש להימנע ממנו. - לטהר את שריר השלד מיוזין II על ידי ביצוע פרוטוקול20. הפעל את SDS-PAGE באמצעות 10% ג'ל פוליאקרילאמיד ואחריו צביעת Coomassie כדי לקבוע את רמת הטוהר של החלבון21. יש לאחסן מיוזין שרירי שלד מטוהרים בטמפרטורה של −20°C בצורה נוזלית במאגר מיוזין II עם 50% גליצרול.
הערה: ניתן להשתמש במיוזין II המאוחסן עד שנתיים. - יש לסמן מיוזין-II מטוהר עם כל צבעי מאלימיד פלואורסצנטיים כפי שתואר קודםלכן 5. הימנע תיוג מנועי מיוזין עם צבעי NHS-esters. קבע את הריכוז ואת מידת הסימון על ידי ספקטרופוטומטריה באמצעות תיקון A280nm של מיוזין II ו- A λmax של הצבע. יש לאחסן את המיוזין II הממוחזר (כהה או מסומן) בטמפרטורה של 4°C ולהשתמש תוך 6 שבועות.
- טיהור חלבון מכסה
- השג חלבון מכסה מורין על ידי ביצוע פרוטוקולמוקדם יותר 22. הפעל את SDS-PAGE באמצעות 10% ג'ל פוליאקרילאמיד ואחריו צביעת Coomassie כדי לקבוע את רמת הטוהר של החלבון. מדוד את הריכוז באמצעות280nm של חלבון מכסה (εCP = 99,530 M-1 cm-1).
- הוסיפו 20% גליצרול לתמיסת החלבון וצרו 5 μL aliquots בצינורות PCR של 200 μL. צללו את הצינורות לחנקן נוזלי ואחסנו אותם בטמפרטורה של −80 מעלות צלזיוס למשך עד שנתיים.
הערה: פעילות חלבון המכסה נבדקת על-ידי פילמור כמויות קבועות של G-אקטין פלואורסצנטי בנוכחות כמויות חלבון מכסות שונות. לאחר מכן מדמיינים את החוטים תחת מיקרוסקופ, והתפלגות אורכם ניתנת לכימות. ככל שהריכוז היחסי של חלבון המכסה גבוה יותר, כך התפלגות חוטי האקטין קצרה יותר. ראו Köster et al.5.
- בטא חלבון מקשר ממברנה-אקטין פלואורסצנטי, למשל, עבור פרוטוקול זה השתמש ב-10xHis-YFP-EzrinABD (HYE), בטא אותו ב-Bl21DE3* Escherichia Coli, וטהר כפי שתואר קודםלכן 23. קבע את ריכוז החלבון על ידי ספקטרופוטומטריה.
- אחסנו את החלבון באליקוטים קטנים במאגר כרומטוגרפיה של סינון ג'ל (או כל חיץ מתאים אחר) עם 20% גליצרול בטמפרטורה של 80 מעלות צלזיוס. בתנאים אלה, החלבון יציב במשך למעלה משנתיים.
הערה: הבחירה בחלבון מקשר אקטין-ממברנה וסמן פלואורסצנטי תלויה בסוג השאלה שאדם מתייחס אליה. מגוון רחב של אסטרטגיות לקישור שומנים פותחו בשנים האחרונות, כולל חלבונים המתויגים על ידי היסטידין 24, ביוטין-סטרפטווידין25 ו-DNA חד-גדילי26. - הכנת שלפוחית מולטי-למלרית (MLVs)
הערה: זרימת העבודה מ-MLVs ל-bilayers של שומנים נתמכים מתוארת באיור 2.- מניחים 5-10 בקבוקוני זכוכית ענבר בכוס זכוכית של 200 מ"ל. מלאו את הכוס בתמיסת ניקוי של 2%, מספיק כדי להטביע את בקבוקוני הזכוכית. סוניקו אותם באמבט מים למשך 30 דקות בדופק מלא ו-65 מעלות צלזיוס.
- מוציאים את הבקבוקונים מהתמיסה ושוטפים אותם היטב במים מזוקקים. מניחים את הבקבוקונים בכוס זכוכית המכילה 2 N NaOH וסוניקים למשך 20 דקות. בשלב זה אין צורך בחימום.
- יש להוציא את הבקבוקונים מתמיסת NaOH ולשטוף היטב במים מזוקקים. יבשו את הבקבוקונים בתוך תנור אוויר חם בטמפרטורה של 65 מעלות צלזיוס למשך שעתיים או יותר.
- אחסנו את הבקבוקונים המנוקים בכוס נקייה אטומה בסרט שקוף למשך עד 6 שבועות.
התראה: בצע את השלבים הבאים בתוך מכסה אדים כימיים. טפל בכלורופורם ובתמיסות השומנים באמצעות מזרקי זכוכית המילטון אטומים לגז כדי למנוע זיהום על ידי פלסטיק. - שטפו את מזרקי המילטון וכמה בקבוקוני זכוכית ענבר מספר פעמים עם כלורופורם טהור. קח את אבקת השומנים המאוחסנת באמפולות זכוכית מהמקפיא של −20 מעלות צלזיוס והוסף כמויות מספיקות של כלורופורם כדי להמיס את אבקות השומנים לריכוזים של 10-25 מ"ג/מ"ל.
- העבירו את התמיסה מהאמפולה לבקבוקון זכוכית ענבר שזה עתה נוקה ותייגו אותה בהתאם. בצע שלב זה על קרח כדי להפחית אידוי של כלורופורם.
- צור תמיסת מלאי DOPC עם ריכוז של 10-25 מ"ג/מ"ל ו-DGS-NTA-Ni2+ בריכוז של 1-10 מ"ג/מ"ל.
- כדי ליצור תערובת שומנים עובדת, קחו בקבוקון זכוכית נקי ושטפו אותו פי 2 עם כלורופורם. הוסיפו 300 מיקרוגרם של כלורופורם טהור לבקבוקון כדי לשמש בסיס לערבוב טוב יותר של הרכיבים. זה לא ישפיע על הריכוזים הסופיים של השומנים מכיוון שכל הכלורופורם יתייבש בשלבים הבאים.
- הוסיפו כמויות מדודות של תמיסות שומנים לבקבוקון כדי ליצור את תערובות השומנים הפועלות הרצויות. ריכוז השומנים היעד בחיץ התייבשות השומנים הוא 4 mM. יבשו את תערובת השומנים תחת זרם איטי של גז N2 בתוך מכסה המנוע הכימי בטמפרטורת החדר. שלב זה עשוי להימשך עד 30 דקות עבור כל בקבוקון.
- לאחר שכל הממס התייבש, יש לייבש את שכבת השומנים בוואקום למשך >2 שעות בטמפרטורת החדר כדי להסיר את שאריות הכלורופורם. החזירו את תערובת השומנים המיובשים בחיץ התייבשות השומנים לקבלת ריכוז שומנים סופי של 4 mM.
- דגירה במשך 5-10 דקות כדי לאפשר התייבשות של השומנים. וורטקס תמיסת השומנים במשך כ-30 שניות ליצירת MLVs.
- הפוך 0.5-1 מ"ל aliquots של MLVs ב 1.5 מ"ל צינורות microcentrifuge. צללו את הצינורות בחנקן נוזלי, אטמו עם סרט שקוף ואחסנו בטמפרטורה של −20 מעלות צלזיוס (עד 6 שבועות).
הערה: ריכוזי מלאי השומנים נבחרים כדי לאפשר כמויות גדולות מספיק המאפשרות צנרת אמינה באמצעות מזרקי המילטון. אם הנפחים הדרושים להכנת הציר גדולים מכדי להמיס את אבקת השומנים המיובשת, בצעו דילולים מרובים של הציר כדי להבטיח ערבוב בר-שחזור של שומנים שונים.
- הכנת שלפוחיות חד-עיניות קטנות (רכבי שטח)
- הוציאו כמות גדולה של רכבי MLV מהאחסון בטמפרטורה של 20 מעלות צלזיוס והפשירו אותה בטמפרטורת החדר. הבזק להקפיא את הבועיות על ידי צלילת צינור microcentrifuge בחנקן נוזלי במשך 15-30 שניות ומיד לשים אותו באמבט מים להגדיר ב 45 מעלות צלזיוס עד הפתרון הפשיר לחלוטין (1-2 דקות). חזור על מחזור ההקפאה הנ"ל 10x-15x עד שהפתרון נראה פחות עכור.
הערה: הגדר את הטמפרטורה של אמבט המים לגבוהה מטמפרטורת המעבר של תערובת השומנים המופשרת כדי לאפשר ערבוב שומנים אחיד. - שיווי משקל מכבש מיני מבוסס מזרק המצויד בקרום מסנן פוליקרבונט בגודל 80 ננומטר עם חיץ התייבשות SUV. ודא שאין דליפה או בועות במערכת. בעוד ששיטת האקסטרוזיה מניבה רכבי שטח חד-פעמיים עם נזק מינימלי לשומנים, תערובות שומנים עם מטען שלילי יכולות להידבק לממברנת הפוליקרבונט.
- מעבירים בעדינות את תמיסת השומנים המופשרת דרך האקסטרודר הטרום-שיווי משקל מצד לצד ואז בחזרה. חזור על המחזור 5x-10x עד שתמיסת השומנים תהפוך ברורה בעליל, המציינת היווצרות של רכבי שטח בקוטר ~ 100 ננומטר.
- צנטריפוגה של המתלים המובלטים (או קצה סוניקטור של התמיסה; ראו הערה בהמשך) ב-15,000 x גרם למשך 60 דקות ב-4 מעלות צלזיוס כדי להוריד את פסולת השומנים. לאסוף את 80% העליונים של הפתרון מבלי להפריע את הכדור ובלי ליצור בועות. העבירו את הסופר-נאטנט המכיל את רכבי השטח לצינור מיקרוצנטריפוגה טרי ואחסנו על קרח עד 6 ימים.
הערה: חלופה לצנטריפוגה היא סוניקציית קצה המבוצעת באופן הבא. הפעל סוניק microtip וקבע את ההגדרות הבאות: משרעת = 30% מהמקסימום, ON time = 10 שניות, זמן כיבוי = 60 שניות. נקו את קצה המיקרו-סוניקטור במים שעברו דה-יוניזציה ואחריהם 2 N NaOH, כלורופורם, ושוב מים שעברו דה-יוניזציה. טבלו את קצה הסוניקטור בכל אחד מהפתרונות הללו וסוניק במשך 1-2 מחזורים באמצעות ההגדרות לעיל. טובלים את הקצה הנקי בתמיסת השלפוחית המופשרת בהקפאה ומסננים במשך 3-6 מחזורים על קרח עד שהתמיסה מתבהרת. - לאחר צנטריפוגה, בדוק אם יש סימנים של השפלת שומנים גבוהה או שחול שומנים כושל כמו היווצרות של סרט לבנבן דק ו / או גלולה גלויה בבירור. במקרים אלה, אין להמשיך ולחזור שוב על שלבי ההכנה של רכב השטח.
הערה: חיי המדף של רכבי שטח עשויים להיות שונים עבור תערובות שומנים שונות. רכבי שטח העשויים מ-DOPC: DGS-NTA-Ni2+ יציבים עד 6 ימים לצורך ניסויים אלה. עצות לפתרון בעיות נפוצות ניתן למצוא בטבלה 2.
- הוציאו כמות גדולה של רכבי MLV מהאחסון בטמפרטורה של 20 מעלות צלזיוס והפשירו אותה בטמפרטורת החדר. הבזק להקפיא את הבועיות על ידי צלילת צינור microcentrifuge בחנקן נוזלי במשך 15-30 שניות ומיד לשים אותו באמבט מים להגדיר ב 45 מעלות צלזיוס עד הפתרון הפשיר לחלוטין (1-2 דקות). חזור על מחזור ההקפאה הנ"ל 10x-15x עד שהפתרון נראה פחות עכור.
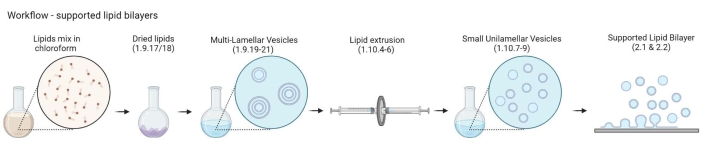
איור 2: סכמת המציגה את זרימת העבודה, החל מהכנת שלפוחיות רב-לשוניות ושלפוחיות חד-עיניות קטנות ועד להיווצרות דו-שכבתיות שומנים נתמכות. נוצר עם ביורנדר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
2. שחזור של רשתות אקטין הקשורות לממברנה
- הכנת תאי דגימה
- קחו 3-5 כיסויי זכוכית מלבניים והניחו אותם בתוך צנצנת קופלין. הפעל את סוניק האמבטיה והגדר את הטמפרטורה ל -65 מעלות צלזיוס. מלאו את צנצנת ה-Coplin בתמיסת ניקוי של 2% כדי להטביע את הכיסויים במלואם והכניסו אותה לסוניק למשך 30 דקות במצב פולס מלא.
- השתמשו במלקחיים קהים בציפוי PTFE כדי להסיר את הכיסויים בזה אחר זה מהצנצנת. שטפו אותם היטב במים מזוקקים והניחו אותם בצנצנת קופלין אחרת מלאה ב-2 N NaOH.
- סונו את הכיסויים למשך 20 דקות במצב דופק מלא. מוציאים את הכיסויים בזה אחר זה, שוטפים היטב במים מזוקקים ומניחים בצנצנת קופלין אחרת מלאה במים מזוקקים.
הערה: לחלופין, יש לנתק את הכיסויים במים מזוקקים למשך 20 דקות ולאחר מכן לשטוף אותם שוב במים מזוקקים. - מיד לפני תחילת הניסוי, קחו את הצנצנת המכילה את הכיסויים במכסה מנוע כימי המצויד באספקת גז N2 .
- מטב את לחץ האוויר של זרם הגז N2 על ידי ניסוי וטעייה, כך שהוא מספיק כדי להזיז מים ממשטח הכיסוי מבלי לשבור אותו. יישרו את הזרימה של גז N2 במקביל למישור הכיסוי כדי להפחית את האפשרות של שבירת הכיסוי.
- השתמשו בכפפות ובמלקחיים כדי להסיר את הכיסויים בזה אחר זה מהצנצנת כדי לייבש אותם מתחת לזרם N2 . יבשו את שני הצדדים של כל כיסוי והניחו אותם על רשת פלסטיק נקייה עם כיסוי. הניחו את הקופסה עם הכיסויים בתוך חומר ייבוש כדי למנוע מגע עם חלקיקי אבק באוויר.
הערה: ניתן לאחסן את הכיסויים המיובשים N2 במייבש שיער, שם הם יכולים להישאר הידרופיליים עד יומיים. אסטרטגיה זו עשויה להיות שימושית כאשר נדרשים דו-שכבתיים רבים לניסוי או אם הניסוי אורך יותר מ-8 שעות. - קח צינורות PCR autoclaved לחתוך את העפעפיים שלהם ואת חצאים חרוטיים נמוכים עם להב כירורגי חד. קח את הצינורות הגליליים החתוכים למחצה בזה אחר זה, מרח דבק הניתן לריפוי UV על השפה החלקה של כל צינור חיתוך, והנח אותו הפוך על כיסוי שניקה זה עתה, כך שהשפה יושבת שטוחה על הכיסוי.
- אין להזיז את הצילינדר לרוחב ברגע שהוא ממוקם על המכסה כדי להבטיח שהדבק לא יישפך לחלל המרכזי של התא. כיסויים מלבניים יכולים להכיל בנוחות עד שלושה תאי תגובה, והעגולים יכולים להכיל רק אחד במרכז (איור 1).
- שים את הכיסויים נושאי התא בתוך שואב אוזון UV עם אספקת O2 ואקום (או השתמש בתאורת UV). הפעל את אור ה- UV והאיר למשך 3-5 דקות כדי לאפשר לדבק להתפלמר. בצע תאורה ארוכה יותר (10-15 דקות) כדי לשפר את ההידרופיליות של זכוכית הכיסוי, ומכאן, את איכות דו-שכבת השומנים.
- אחסנו את תאי הדגימה היבשים המוארים ב-UV למשך עד 8 שעות בתוך קופסאות פלסטיק קטנות (כגון קופסאות כיסוי מלבניות ריקות) עטופות בסרט שקוף כדי להפחית את המגע עם חלקיקי אבק באוויר.
הערה: זרם קבוע של O2 בנוכחות אור UV יוצר רדיקלים של אוזון וחמצן שיכולים להסיר זיהומים אורגניים מפני השטח של הכיסוי. ואקום ימנע דליפה של אוזון רעיל שנוצר במהלך התהליך. - הוציאו את הכיסויים ובדקו אם יש דליפה בתאים על ידי מילוים במים מזוקקים. כל תא יכול להכיל עד ~ 150 μL של דגימה. השליכו את התאים הדולפים.
הערה: אפשרות ניקוי נהדרת ובטוחה נוספת היא מנקה הפלזמה. הגדרות הזמן והחשמל תלויות בדגם, אך הקפידו לא לטפל יתר על המידה בשקופיות הזכוכית עם פלזמה מכיוון שהדבר יביא להפחתת ניידות השומנים. טיפול פני השטח יכול להשפיע על הניידות של שומנים27, כפי שנצפה עם טיפול ממושך עם פתרון ניקוי (>45 דקות) או NaOH (>30 דקות).
- הכנת דו-שכבתי שומנים נתמכים
- שטפו כל תא עם חיץ היווצרות SLB (או 1x PBS) כדי להסיר מזהמים על פני השטח, והשאירו 100 μL של חיץ בסוף. סמן את רמת המאגר ב- 100 μL עם סמן קבוע כדי לעקוב אחר שינויים בנפח.
- הוסף 2 μL של 0.1 M CaCl2 לתא. זה משפר את ספיחת הבועיות אל משטח הזכוכית, שיפור היווצרות bilayer בשלב הבא. הוסף 8 μL מתמיסת SUV (משלב 1.10.) לכל תא ודגרה במשך 15 דקות בטמפרטורה של 25 מעלות צלזיוס.
הערה: ניתן להעריך את נפח תערובת ה- SUV שיש להוסיף על ידי חישוב המספר הכולל של שומנים (עם שטח ממוצע של 0.72 ננומטר2) הדרושים כדי לכסות לחלוטין את האזור ההידרופילי החשוף של הבאר בשתי שכבות שומנים. - שטפו את הבועיות הלא מאוגדות עם חיץ תנועתיות אקטין (1x KMEH). ראשית, הסר 50 μL של חיץ היווצרות SLB, משאיר רק 50 μL בתא הדגימה. שנית, להוסיף 100 μL של 1x KMEH לתא. מערבבים בעדינות ולאחר מכן מסירים 100 μL של החיץ מבלי לגעת בתחתית.
הערה: חשוב להיות עדינים בזמן הכביסה. ודא שקצה הפיפטה אינו נוגע בתחתית התא. שמור על הפיפטה נוטה לכוון את זרימת החיץ לדופן התא ולא ישירות אל הדו-שכבתי, שכן זרימה ישירה עלולה לשבש את הדו-שכבתי. יש להיזהר שלא להכניס בועות אוויר בזמן הצנרת, שכן האוויר עלול להגיע לדו-שכבת השומנים ולגרום לפגמים בו. - חזור על הכביסה 10x על ידי הוספת 100 μL של 1x KMEH והסרת 100 μL.
- הוסיפו 10 μL של 1 מ"ג/מ"ל β-קזאין לדו-שכבתי, ערבבו בעדינות ודגרו במשך 5-10 דקות. β-קזאין חוסם את האזורים על הכיסוי שבהם הדו-שכבתי לא נוצר. יש לשטוף β-קזאין 3x עם 1x KMEH כמתואר בשלב 2.2.3. ולהחזיר את רמת המאגר ל-100 μL.
- תוספת של מקשר ממברנה-אקטין
- במהלך הדגירה של β-קזאין (שלב 2.2.5.), מוציאים אליקוט של חלבון מקשר ממברנה-אקטין מ-80 מעלות צלזיוס, מפשירים אותו במהירות ב-37 מעלות צלזיוס, ואז שומרים אותו על קרח. דללו את האליקוט עם מאגר דילול חלבונים לריכוז של 1 μM.
- מוסיפים את חלבון המקשר בריכוז סופי מוגדר (בדרך כלל 5-20 ננומטר) ומערבבים בעדינות. כדי להבטיח שיווי משקל מהיר של החלבון בתא, הוסיפו נפחים הגדולים מ-20 μL על ידי ערבוב מראש של חלבון המקשר עם 1x KMEH.
- לדגור במשך 40 דקות בטמפרטורת החדר. יש לשטוף 3x עם חיץ KMEH אחד כדי להסיר את חלבון HSE לא מאוגד (כמו בשלב 2.2.3.). החזירו את רמת החיץ בכל תא ל-100 μL. הדגימה מוכנה כעת להדמיה.
- הערכת איכות של דו-שכבת השומנים
הערה: זהו שלב אופציונלי שאין צורך לבצע בכל פעם. אנו ממליצים לבצע הערכה זו בכל פעם שרכבי שטח טריים מיוצרים ממלאי MLV קפוא.- הפעל את המיקרוסקופ, את לייזרי העירור ואת מצלמות האיתור. ודא שהלייזר מיושר, שהמטרה מנקה והתוכנה מוכנה להשיג תמונות.
- שים שמן על המטרה 100x, להרכיב את הדגימה על שלב המיקרוסקופ, ולמקד את המטרה על bilayer. ודא שמיקום הלייזר הוא כזה שהוא עובר השתקפות פנימית מוחלטת על הדגימה. השתמש בלייזר עירור של 488 ננומטר כדי לבדוק את התפלגות עוצמת הפלואורסצנטיות של 10xHis-YFP-EzrinABD הקשור לדו-שכבתי.
הערה: דו-שכבתיות באיכות טובה מציגות התפלגות אחידה בקנה מידה גדול של עוצמת פלואורסצנטיות. דו-לשוניות רעות מראות כתמים פלואורסצנטיים עזים ומטושטשים. - כדי לקבוע את שלמות הדו-שכבתי, בצע בדיקת FRAP.
- בחר אזור עניין ב- bilayer והקלט כמה תמונות של שדה הראייה באמצעות תנאי הדמיה המספקים יחס אות לרעש של 5:1 ומעלה. השהה את ההקלטה וסגור את דיאפרגמת השדה של מיקרוסקופ TIRF כדי למקד קרן לייזר מרוכזת על אזור מעגלי קטן של הדו-שכבתי כדי להלבין באופן מקומי את הפלואורופורים.
- הפעל את הלייזר לתפוקה המרבית שלו כדי לצלם את האזור הקטן למשך 3-10 שניות ולאחר מכן כבה את הלייזר. פתח מחדש את דיאפרגמת השדה לרדיוס המקורי שלה, התאם מחדש את מצב ההדמיה בחזרה להגדרות (לפני הלבנה), ומיד חדש כדי לרשום את התאוששות האות הפלואורסצנטי בשדה הראייה.
- בדוק אם הדו-שכבתי נוזל. דו-שכבות טובות עם דיפוזיה צידית רגילה מתאוששות מהר, בעוד שדו-שכבות רעות מתאוששות לאט או לא מתאוששות כלל (איור 3). אם הדו-שכבתי אינו מתאושש, בדוק את סעיף פתרון הבעיות והפעל מחדש. שמור את התמונות כקובצי TIFF של 16 סיביות. להערכה כמותית של מקדם הדיפוזיה, בדוק את שלב 3. מתחת.
- פילמור של אקטין פלואורסצנטי
הערה: כדי לחסוך זמן, התחל בפולימריזציה של אקטין במהלך זמן הדגירה של חלבון HSE הנקשר לדו-שכבה (שלב 2.3.) או במהלך הערכת האיכות של הדו-שכבה (שלב 2.4.).- ערבבו G-actin ללא תווית ומסומן פלואורסצנטי ביחס טוחן של 10:1 והוסיפו לו G-Buffer כך שריכוז ה-G-אקטין הוא 20 μM. הריכוז שבו אקטין הוא פולימריזציה סופית יהיה 1/4 מערך זה. הוסף 1/10 מתוך מאגר ME של 10x לתערובת לקבלת פתרון 1x ודגירה למשך 2 דקות. שלב זה מחליף את יוני Ca 2+ הקשורים ל-G-actin ביונים Mg2+. ודא שהנפח הסופי הוא בכפולות של 10 μL.
- הוסיפו את הכמות הרצויה של חלבון המכסה באופן הבא. הפשירו בקבוקון של לכידת מלאי החלבון במהירות בטמפרטורה של 37 מעלות צלזיוס ולאחר מכן שמרו אותו על קרח. יש לדלל עם G-buffer כך שריכוז החלבון המכסה כעת הוא כפול מהריכוז הסופי הרצוי בתערובת הפילמור. הוסף נפח שווה של תמיסת חלבון המכסה המדולל לתערובת האקטין משלב 2.5.1.
- לבסוף, הוסף נפח שווה של מאגר מטרה טרי פי 2 לתערובת התגובה. הנפח הסופי של התמיסה צריך להיות פי ארבעה מנפח תערובת האקטין בסוף שלב 2.5.2. ודא שהריכוז הסופי של KMEH הוא 1x, של ATP הוא 1 mM, של BSA הוא 1 מ"ג/מ"ל, ושל G-actin הוא 5 μM.
דגירה בחושך ב-25 מעלות צלזיוס למשך 45-60 דקות כדי לאפשר פילמור לקרות.
הערה: פעולה זו נקראת אסטרטגיית חיץ היעד, שבה נפח אחד של Mg 2+ G-actin (שלב 2.5.1.) מעורבב עם נפח אחד של תערובת חלבון capping (שלב 2.5.2.) ושני כרכים של מאגר יעד2x (שלב 2.5.3.). זה מקל על הגדלת או צמצום כמות האקטין ולשנות את הריכוז היחסי של חלבון מכסה (או כל אפנן אקטין אחר; איור 4).
- תוספת של חוטי אקטין פלואורסצנטיים
- חותכים כמה קצוות של 200 μL עם להב חד או מספריים כדי להפוך אותם לקצוות קהים. ספקו בעדינות את הנפח הנדרש של אקטין פולימרי 5 μM (משלב 2.5.3.) עם קצה פיפטה קהה (למניעת גזירה של חוטי אקטין) והוסיפו אותו לצינור PCR נקי.
- הוסיפו 1x KMEH לצינור כדי שהנפח >20 μL וערבבו בעדינות כדי למנוע גזירה של F-actin. מתא הדגימה המותקן, הסר נפח שווה של המאגר.
- מוסיפים את תמיסת האקטין הפולימרית לתא ומפזרים בעדינות למעלה ולמטה פי 3 מבלי לגעת בדו-שכבה שבתחתית. זה מאפשר חוטי אקטין להפיץ באופן אחיד על bilayer. הרכיבו את הדגימה על מיקרוסקופ TIRF (ראו שלב 2.4.1. ושלב 2.4.2.).
- ניתן לתעד את תהליך קשירת F-actin לדו-שכבתי. דגירה במשך 20-30 דקות. הקלט כמה תמונות משדות ראייה שונים לאחר שתוספת F-actin הגיעה למצב יציב. שימו לב לשינוי בארגון המרחבי של 10xHis-YFP-EzrinABD לפני (הומוגני) ואחרי ארגון אקטין.
הערה: HYE מופץ באופן אחיד על פני דו-שכבת השומנים בהיעדר אקטין. עם תוספת של חוטי אקטין, HYE colocalizes עם F-actin. מידת הקולוקליזציה תלויה בזיקה המחייבת אקטין של החלבון המקשר; ככל שהזיקה חזקה יותר, כך הקולוקליזציה גבוהה יותר והניידות הצידית של החלבון המקשר איטית יותר (איור 5).
- תוספת של מיוזין II
- לאחר 30 דקות של דגירה של אקטין, הרכיבו את הדגימה בחזרה על המיקרוסקופ (אם היא לא הייתה טעונה). בדוק את האות בתעלות חלבון המקשר ו- F-actin. התאם את תנאי ההדמיה במידת הצורך.
- בחר אזור טוב עם אות חלבון מקשר אחיד וחוטי אקטין מפוזרים באופן אחיד וללא ממצאים להקלטה בהילוך ארוך. הקלט 10-15 פריימים ב- 0.1-0.2 הרץ לפני הוספת מיוזין והשהה את ההקלטה. הוציאו את הנפח הנדרש של מיוזין-II שריר ממוחזר מבקבוקון המלאי עם קצה פיפטה קהה (כדי למנוע גזירה של חוטי מיוזין) והוסיפו לצינור PCR נקי.
- מיד להוסיף 1x KMEH לצינור כדי להפוך את הנפח >20 μL ומערבבים בעדינות. ניתן גם להוסיף ATP, תערובת התחדשות ATP, סוכני ייצוב תמונה וכו '. במהלך שלב זה. הסר בזהירות נפח שווה של המאגר מתא הדגימה המותקן מבלי להפריע לו.
- הוסיפו בעדינות את תמיסת המיוזין לתא הדגימה. אין לקטר מעלה ומטה מכיוון שהוא יפריע לחוטים הקשורים לפני השטח. מיד לחדש את רישום קיטועי הזמן ולצפות במערכת כפי שהיא מתפתחת ממצב טרום-מיוזין למצב acto-myosin המונע על ידי ATP והיווצרות אסטר למצב תקוע מדולדל ATP (ראה תוצאות מייצגות).
- צלם תמונות רקע עבור כל הערוצים באמצעות מדגם מאגר בלבד. שמור את כל התמונות כקבצי .tiff של 16 סיביות. עיין בטבלה 2 לקבלת עצות לפתרון בעיות נפוצות.

איור 3: הערכת איכות של הדו-שכבתיים באמצעות בדיקת FRAP מהירה. דו-שכבתי שומנים נתמכים (SLBs) שהוכנו מליפידים DOPC ו-Ni-NTA (98:2 מול%) מצופים ב-HYE (מקשר ממברנה-אקטין מתויג 10xHis-YFP). לאחר שהחלבון הלא מאוגד נשטף החוצה, הדו-שכבה הפלואורסצנטית מצולמת תחת מיקרוסקופ TIRF. אזור קטן על bilayer הוא photobleached עם כוח לייזר גבוה, ואת ההתאוששות של פלואורסצנציה נרשמת. (A) דו-שכבה טובה תמיד מתאוששת מהר, עם מקדם דיפוזיה צפוי של 1-1.5 מיקרומטר2/שנייה להרכב השומנים המשמש במקרה זה. (B) דו-חיים רעים מתאוששים לאט מאוד או לא מתאוששים כלל. (C) תמונות מייצגות של דו-שכבתיות רעות: (C-i) דו-שכבה עם חורים, (C-ii) דו-שכבתית עם כתמי שומנים גדולים וחסרי תנועה, ו-(C-iii) דו-שכבתית עם נקודות קטנות וחסרות תנועה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
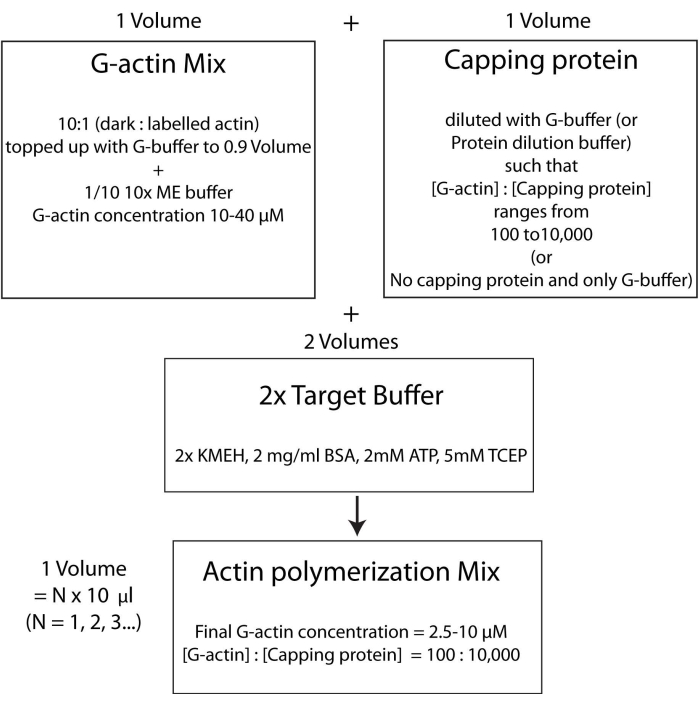
איור 4: סכמטי המראה כיצד לבצע פולימריזציה של אקטין באמצעות שיטת מאגר המטרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: ארגון מרחבי של HYE לאחר קשירה ל-F-אקטין. תמונות TIRF המציגות את הארגון המרחבי של HYE לפני ואחרי הוספת חוטי אקטין (מסומנים ב- Atto-635 maleimide). ארגון HYE הוא הומוגני לפני הוספת F-actin והופך להיות colocalized ו coaligned לאורך חוטי אקטין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
3. ניתוח נתונים
- באמצעות תוכנת פיג'י (https://imagej.net), הפחת את הרקע מתמונות החלבון המקשר (משלב 2.4.). מדוד את ערכי העוצמה הממוצעת מהכתם המולבן ומאזור ייחוס.
- נרמל את עקבות הזמן מהכתם המולבן ומאזור הייחוס לעוצמת ערכי עוצמת ההלבנה שלהם לפני ההלבנה. חלק כל נקודת זמן בערכי האזור המולבן המנורמל בנקודות הזמן המתאימות במעקב הזמן של אזור הייחוס המנורמל. תקן את עקבות הזמן המנורמל המתקבל עבור הרקע ועבור כל תנודות שיטתיות בעוצמה במהלך הרכישה (photobleaching גלובלי, z-drift, וכו ').
- השתמש בשיטה ידנית נטולת התאמה28 כדי להעריך את מקדם הדיפוזיה של החלבונים הדו-שכבתיים הקשורים. בקצרה, ניתן לחשב את מחצית הזמן של פרופיל ההתאוששות, τ1/2, על ידי התבוננות בזמן שבו פרופיל ההתאוששות המנורמל מגיע למחצית ממצבו היציב:
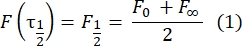
כאן, F 0 הוא העוצמה הממוצעת באזור ההלבנה במסגרת הראשונה לאחר ההלבנה, ו- F∞ הוא ערך המצב היציב לטווח הארוך של התאוששות הדו-שכבתי. - הערך את רדיוס האקונומיקה האפקטיבי, re, פרמטר המתקן דיפוזיה במהלך הלבנת פוטו, מסריקת קו של פרופיל כתם הלבנה שלאחר הלבנה29. חצי הרוחב במחצית המינימום של סריקת קו זו העוברת במרכז כתם האקונומיקה, r 1/2, מתייחסת ל- re באופן הבא:
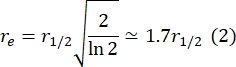
τ1/2 המחושב בשלב 2.8.3., r e מחושב בשלב 2.8.4., ורדיוס האקונומיקה שנקבע במקור, rn, משמשים לחישוב מקדם הדיפוזיה (D) באמצעות הנוסחה הבאה: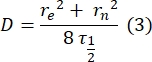
- השתמש בשיטה ידנית נטולת התאמה28 כדי להעריך את מקדם הדיפוזיה של החלבונים הדו-שכבתיים הקשורים. בקצרה, ניתן לחשב את מחצית הזמן של פרופיל ההתאוששות, τ1/2, על ידי התבוננות בזמן שבו פרופיל ההתאוששות המנורמל מגיע למחצית ממצבו היציב:
- ניתוח תמונה של אסטרים אקטומיוסין
- באמצעות פיג'י, הפחת את הרקע מכל התמונות המוקלטות בכל הערוצים. תקן את התמונות לכל תבנית תאורה או הפרעה שאינה אחידה באמצעות תיקון שדה שטוח.
הערה: ניתן להשתמש בשקופיות פלסטיק צבעוניות, שהן דוגמאות שטוחות טובות לביצוע תיקונים כאלה. עבור חלבון המקשר וחוטי האקטין על דו-שכבה מישורית, ניתן גם להשתמש בהקרנה הממוצעת של תמונות קדם-מיוזין מרובות כדי ליצור מפות תיקון תאורה ספציפיות לערוץ.- עבור ערוץ HYE, המוצג כאן, צלם הקרנה בעוצמה ממוצעת של תמונות HYE מרובות (שנרשמו מאזורים שונים של דו-שכבת השומנים לפני תוספת מיוזין). החל מסנן גאוס מתאים (σ = 50 פיקסלים עד 80 פיקסלים) על ההקרנה הממוצעת (מתמונות טרום-מיוזין או מכל דגימה שטוחה סטנדרטית).
- המירו את התמונה המסוננת לתמונה של 32 סיביות. חלקו את כל ערכי הפיקסלים בממוצע של התמונה כולה. זה ייתן מפת תיקון מנורמלת עבור ערוץ HYE. חלק את כל התמונות בערוץ HYE עם מפה זו לתיקון שדה שטוח. צור מפות תיקון לערוצים אחרים תוך שימוש באותה אסטרטגיה.
- נכון להלבנת תמונות בשיטת יחס מעריכית או פשוטה (בהתאם לפרופיל דעיכת העוצמה) בפיג'י.
- כדי לתקן כל אי-התאמה זמנית של x-y (תנועה תרגומית), מזג את כל הערוצים שתוקנו על-ידי Photobleach ל-Hyperstack יחיד. באמצעות תוסף Hyperstack-Reg בפיג'י, החל גוף קשיח או טרנספורמציית תרגום.
- לבסוף, פצל את Hyperstack מיושר לערוצים בודדים ושמור אותם בנפרד כערימות TIFF של 16 סיביות לניתוח נוסף.
- באמצעות פיג'י, הפחת את הרקע מכל התמונות המוקלטות בכל הערוצים. תקן את התמונות לכל תבנית תאורה או הפרעה שאינה אחידה באמצעות תיקון שדה שטוח.
תוצאות
לייצוג, כאן מוצג פרופיל פוסט-בליך טיפוסי מהתמונה הראשונה לאחר הלבנת תמונות (תמונה ב-t = 0 שניות באיור 3A) והתאמתו לפונקציה הבאה28 (ראו איור 6A):

הערך של r e (23.94 μm) המחושב על ידי ההתאמה לעקומה זו דומה מאוד לערך r e המחושב בשלב 2.8.4. (23.24 מיקרומטר). כאן, K הוא פרמטר עומק אקונומיקה שניתן להעריך ישירות מ- F0 (המתואר בשלב 2.8.4.). באופן דומה, איור 6B מציג את פרופיל ההתאוששות ואת התאמתו לפונקציההבאה 28:
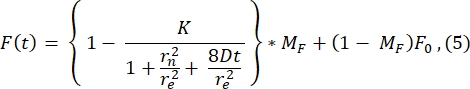
אנו מוצאים שהערך המותאם של מקדם הדיפוזיה הוא 1.34 μm 2/s, ערך שמסכים מאוד עם הערך של 1.39 μm 2/s המחושב על ידי הנוסחה בשלב2.8.4. כאן, MF מייצג את החלק הנייד של דו-שכבת השומנים המייצג את החלק של האוכלוסייה הלבנה שמתאוששת בחזרה. הניידות של מולקולות מעוגנות שומנים תלויה, כמובן, בהרכב השומנים ובמצבו הפיזי (שלב נוזלי או ג'ל). בניסויים שלנו המשתמשים בממברנות שומנים מבוססות DOPC, הניידות צריכה להיות >1 מיקרומטר2/שנייה, והשבר הנייד לא צריך להיות פחות מ-0.9 כדי להצביע על דו-שכבת שומנים טובה. אנו ממליצים להשתמש בשיטה הידנית ללא התאמה לבדיקה מהירה של האיכות והניידות של הדו-שכבתי. שיטת ההתאמה יכולה להיות שימושית תוך אוטומציה של הניתוח עבור עקומות FRAP רבות. יתר על כן, אם רוצים לבצע ניסוי FRAP מתוחכם יותר כדי לאפיין באופן שיטתי דיפוזיה במערכת, אנו ממליצים לקורא לסקירה זו מ- Lorén et al.30 לקבלת פרטים נוספים על מודלים מתאימים ומלכודות פוטנציאליות בתכנון ניסיוני.

איור 6: כימות מקדם הדיפוזיה של דו-שכבתי שומנים. (A) פרופיל הקו של התמונה הראשונה לאחר הלבנת תמונות (t = 0 שניות באיור 3A) והתאמתה למשוואה 4 לחישוב רדיוס האקונומיקה האפקטיבי. (B) פרופיל ההתאוששות של האזור המולבן והתאמתו למשוואה 5 לחישוב מקדם הדיפוזיה והשבר הנייד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
תוצאה אופיינית של הניסויים שתוארו לעיל המראים את ההרכבה והארגון הדינמיים של רשת אקטו-מיוזין המקושרת על דו-שכבת שומנים נתמכת שצולמה על-ידי מיקרוסקופיית TIRF מתוארת באיור 7 ובווידאו משלים S1.
איור 7 מראה מונטאז' תמונה של החלבון המקשר, F-actin ומיוזין-II.
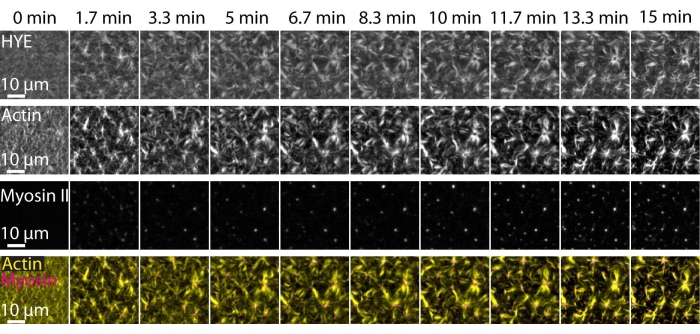
איור 7: זרמי אקטומיוזין מתכווצים מניעים אשכולות מקומיים של חלבון הממברנה-אקטין המקשר HYE. תמונות TIRF של HYE (מתויג על ידי YFP), חוטי אקטין (מסומנים ב- Atto-635 maleimide) וחוטי מיוזין II (מסומנים ב- Atto-565 maleimide) עם הוספת מיוזין II ל- SLB המכיל HYE ו- F-actin. הזמן מצוין בחלק העליון: 0 דקות היא מיד לפני שהחלו להופיע מיופילמנטים פלואורסצנטיים בשדה TIRF. HYE ו-F-actin מופצים באופן הומוגני על גבי דו-שכבת השומנים לפני תוספת מיוזין (0 דקות). פעילות מיוזין גורמת לזרימות אקטומיוזין מתכווצות, המגיחות למבנים דמויי אסטר במצב יציב (15 דקות), מה שמניע אשכולות מקומיים של רכיב הממברנה המצומדת (HYE). השורה התחתונה היא מיזוג של תמונות אקטין (צהוב) ומיוזין II (מגנטה) המציגות את הארגון של אקטין ומיוזין בנקודות זמן שונות. הדימויים ששימשו ליצירת מונטאז'ים אלה תוקנו בפיג'י לאות רקע, תבניות עוצמה לא אחידות ותנועה תרגומית. סרגל קנה מידה = 10 מיקרומטר. לקבלת פרטים, ראה סרטון משלים S1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| שם המאגר | הרכב | |
| חיץ התייבשות שומנים | 50 מ"מ HEPES, 150 מ"מ NaCl, 5% סוכרוז, pH 7.5 | |
| מאגר היווצרות SLB | 50 mM HEPES, 150 mM NaCl, pH 5-6 | |
| מאגר אחסון SLB | 50 מ"מ HEPES, 150 מ"מ NaCl, pH 7.2 | |
| חיץ דילול חלבונים | 20 mM HEPES, 100 mM KCl, 1mM TCEP או DTT, pH 7.2 | |
| 1X ME או מאגר חילופי יונים של אקטין | 50 מ"מ MgCl2, 0.2 מ"מ EGTA, 10 מ"מ HEPES, pH 7.2 (יש לאחסן ב-4°C) | |
| 1X KMEH או חיץ פילמור אקטין | 50 mM KCl, 1 mM MgCl2, 1 mM EGTA, 50 mM HEPES, pH 7.2 | |
| מלאי ATP של 100 מ"מ | 100 מ"מ מלח דיסודיום ATP, 50 מ"מ טריס, 50 מ"מ NaCl, 5 מ"מ MgCl2, 2 מ"מ EGTA, pH 7.5 (יש לאחסן בטמפרטורה של -20°C) | |
| 2x מאגר יעד | 2x קמ"ש, 2 מ"ג/מ"ל BSA, 2 מגה-מטר ATP, 5 מ"מ TCEP (מאוחסן ב-4°C) | |
| מאגר G | 2 mM Tris, 0.1 mM CaCl2, 0.2 mM ATP, 0.5 mM TCEP, 0.04 % NaN3, pH 8 (יש לאחסן ב-4°C) | |
| מאגר מיוזין II | 500 mM KCl, 1 mM EDTA, 10-20 mM Hepes, pH 7.0 | |
| מאגר כרומטוגרפיה לסינון ג'ל | 50 mM Tris-HCl, 150-300 mM NaCl, 5 mM TCEP, 0.1% Tween-20, pH 7.5 | |
| מכסה את מאגר אחסון החלבון | 10 מ"מ טריס· Cl, 50 mM NaCl, 1 mM TCEP, pH 7.5, 20% גליצרול | |
טבלה 1: רשימת הרכבי החיץ המשמשים בפרוטוקול זה.
| בעיות נפוצות ובעיותיהן בירי | בעיה | לגרום | פתרונות אפשריים | ||||||
| 1 | ליפידים דו-שכבתיים לא מראים דיפוזיה | הסיבה הסבירה ביותר לבעיה זו היא כיסוי מלוכלך שיכול לקרות כאשר תמיסת הניקוי מיושנת או שהחימום לא התרחש במהלך סוניקציה של אמבטיה. לביליירים אלה יש מראה 'שלפוחי' מכיוון שהבועיות המתפוצצות נדבקות לכיסוי אך אינן מתמזגות זו עם זו. שימוש ברכבי MLV שגילם עולה על 6 שבועות או ברכבי שטח שגילם עולה על 6 ימים, או הוספת כמויות נמוכות של רכבי שטח יכולים גם הם להוביל להיווצרות דו-שכבתית שלפוחיתית. | השתמש בתמיסת ניקוי טרייה. מוודאים שהמחמם מופעל והטמפרטורה היא בין 45-65 מעלות צלזיוס. השתמשו בתערובות שומנים טריות. (שימוש בבדיקת ליפידים פלואורסצנטית לעומת בדיקה של חלבון פלואורסצנטי יכול לפעמים להתבטא בצורה שונה). לדוגמה, אם לדו-שכבה יש פגמים תת-עקיפה ומדלגים על שלב הפסיבציה של פני השטח (או לא עובד), בדיקת השומנים תציג התפלגות עוצמה אחידה, אך בדיקת החלבון הפלואורסצנטי עשויה להציג כתמים פלואורסצנטיים בהירים. ) | ||||||
| 2 | לליפידים דו-שכבתיים יש כתמים בהירים | דגירה ארוכה של רכבי שטח להיווצרות דו-שכבתית יכולה ליצור דו-שכבת שומנים שבסך הכל מתפזרת אך עם כתמים בהירים מדי פעם. טלאים אלה יכולים להיות דו-שכבתיים רב-שכבתיים שיכולים למשוך כמויות גדולות של בדיקה פלואורסצנטית. | דגירה של 15-20 דקות עם רכבי שטח מספיקה. וודאו שהבדיקה אינה צוברת: סיבוב קשיח ומהיר של חלבון המקשר (300 x גרם למשך 15 דקות ב-4 מעלות צלזיוס) יכול להסיר את האגרגטים | ||||||
| 3 | לליפיד דו-שכבתי יש חורים כהים | זה קורה כאשר הדו-שכבתי עשוי מרכבי שטח ישנים ומצולם במשך שעות ממושכות (> 4 שעות לאחר היווצרותו), או כאשר ה-pH של התמיסה משתנה באופן דרסטי עקב הדמיה ממושכת (למשל, במצב ATP גבוה ובנוכחות נבלות חמצן מסוימות), או כאשר פני השטח עוברים יותר מדי בטא-קזאין (מוסיפים יותר מדי בטא-קזאין במשך יותר מ-10-15 דקות או לא שוטפים אותו). | השתמשו בשומנים טריים. הפחת את קצב פריימים ההדמיה או את זמן תאורת הלייזר האפקטיבי. השתמש במאגרים עם קיבולת אגירה גבוהה יותר. | ||||||
| 4 | ליפידים דו-שכבתיים מראים דיפוזיה איטית | שומנים דו-שכבתיים עם אחוז גבוה של כולסטרול, שומנים רוויים ארוכים או שומנים טעונים מתפזרים לאט יותר. | במקרים כאלה, הכינו את הדגימה בטמפרטורה גבוהה. ניתן גם להשתמש בהרכב שומנים פשוט ובדוק כבקרה יחד עם הרכבי שומנים מורכבים שלא נבדקו. וודאו שהזכוכית נקייה. | ||||||
| 5 | אקטין אינו מתפלמר | מאגר המטרה ישן, מלאי G-actin ישן מדי, G-actin ישן מדי ו-G-actin חדש עברו פולימריזציה משותפת. | ודא שה- Ca2 + מוחלף ב- Mg2+ לפני פילמור (באמצעות מאגר ME). יש להשתמש במלאי ATP-Mg2+ טרי. יש להשתמש ב-G-actin ממוחזר טרי. יש לוודא שריכוז ה-F-אקטין (במונחים של G-אקטין) שנוסף לדו-שכבה גבוה מ-0.2 מיקרומטר. לריכוזים נמוכים יותר, יש להשתמש ב-F-אקטין מיוצב פלוידין. | ||||||
| 6 | אקטין אינו נקשר לדו-שכבתי | מקשר ממברנה-אקטין אינו מתווסף או מתווסף בריכוז נמוך מאוד – ניתן להסיק זאת מהפלואורסצנטיות של החלבון המקשר. אם הפלואורסצנציה הגונה, מקשר הממברנה-אקטין איבד את יכולת הקישור של אקטין. כמו כן, אם חלבון המקשר אינו קשור באופן ספציפי למשטח הזכוכית (כאשר הדו-שכבתי גרוע), ייתכן שהוא לא יגייס חוטי אקטין. | וודאו שהדו-שכבתי מתפזר. השתמשו בחלבון מקשר טרי | ||||||
| 7 | אות F-אקטין פלואורסצנטי חלש | היחס בין סימון לאקטין כהה נמוך מדי. או שהאקטין המתויג או האקטין הלא מתויג ישנים מדי והם אינם מתמזגים זה עם זה. | מחזרו שוב את האקטין, ונסו שוב את הפלוימריזציה עם אקטין ממוחזר טרי. Photodamage יכול להרוס או depolymerize F-actin; במידת האפשר, השתמש בצבעים אדומים או אדומים רחוקים עבור אקטין (ומיוזין). | ||||||
| 8 | מיוזין אינו מראה התכווצות | ניתן לראות כי לאחר הוספת ATP למערכת חדורת מיוזין, אין התכווצות של אקטו-מיוזין. | בדוק אם ריכוז המיוזין או רמת הטוהר טובים. יש להשתמש במיוזין ממוחזר טרי (יש להשתמש תוך 6 שבועות לאחר המיחזור). הוספת ATP טרי לתערובת המיוזין יכולה לעזור. נטרול גזים ושימוש בנבלות חמצן וכו'. יכול להפחית את הפוטו-וויד של המנועים. מידע נוסף ניתן למצוא בפרוטוקולים של Plastino et al. או Stam et al. של אותן שיטות איסוף | ||||||
| 9 | כיסוי אינו הידרופילי | Coverglass אינו מנוקה כראוי. | כיסוי הידרופילי נקי הוא חיוני להיווצרות דו-שכבתי של שומנים. קריאה חזותית שימושית של ההידרופיליות של הכיסוי לאחר פרוטוקול הניקוי היא לבחון את הרטבת הזכוכית על ידי מים. הוסיפו כמות קטנה של מים לכיסוי שטוח. המים יישארו בצורת טיפה עגולה אם הכיסוי לא ינוקה כראוי. עם זאת, אותו נפח של מים יתפשט ויצור שכבה דקה, על כיסוי הידרופילי מטופל. ניתן להשתמש בהתנהגות הרטבה זו של המים על משטח זכוכית הכיסוי כדי לוודא אם שלבי הניקוי עם תמיסת הניקוי / NaOH עבדו . | ||||||
טבלה 2: מדריך לפתרון בעיות המסכם בעיות נפוצות ופתרונות מתאימים.
וידאו משלים S1: זרימות אקטומיוזין מתכווצות מניעות אשכולות מקומיים של חלבון הממברנה-אקטין המקשר HYE. TIRF timelapse של HYE (מתויג YFP), חוטי אקטין (מסומנים ב- Atto-635 maleimide), וחוטי מיוזין II (המסומנים ב- Atto-565 maleimide) עם הוספת מיוזין II ל- SLB המכיל HYE ו- F-actin. הזמן מצוין בחלק העליון: 0 דקות היא מיד לפני שהחלו להופיע מיופילמנטים פלואורסצנטיים בשדה TIRF. סרגל קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
פרוטוקול זה מציג פלטפורמה רב-תכליתית ונקודת מוצא לתכנון ניסויים לחקר ממשק קרום-קליפת המוח של תאים. צעדים קריטיים הם הכנת שקופיות זכוכית נקיות, שימוש בשומנים טריים להיווצרות יעילה של רכבי שטח (שניהם משפיעים על איכות ה- SLBs), ושימוש בחלבוני מיוזין II ממוחזרים טריים לארגון מחדש של חוטי אקטין דינמיים. כאשר מדמים דינמיקה לאורך זמן, חשוב מאוד לשלב מערכת מנטרלת חמצן (למשל, חומצה פרוטוקטכואית ופרוטוקטכואט 3 4-דיאוקסיגנאז 5,31).
עיצוב התא הפתוח מאפשר הוספה רציפה של רכיבים למערכת קיימת מבלי לגרום לזרימת שומנים. זה יכול להיות יתרון חשוב על פני גישות נפוצות של תאים סגורים או עבודה באמצעות חלבונים דחוסים בתוך ליפוזומים36. לא ניתן לחקור תופעות מנוגדות כגון עיוות ממברנה המושרה על-ידי חלבונים באמצעות דו-שכבתי שומנים עם ספיחת זכוכית.
דו-שכבתי השומנים יכולים להיווצר עם מגוון רחב של הרכבי שומנים. זה מתחיל עם ספיחה של שלפוחית השומנים אל משטח הזכוכית הידרופילית, ואחריו או קרע שלפוחית ספונטנית עקב שלפוחית-שלפוחית ישירה אינטראקציות שלפוחית-שלפוחית או שלפוחית ספיגה להגיע כיסוי קריטי ולאחר מכן חלק קטן של שלפוחית לקרע, יצירת קצוות פעילים, אשר בסופו של דבר מוביל היווצרות bilayer32 . מלבד זכוכית, ניתן להשתמש במצעים שונים ליצירת דו-שכבתי שומנים נתמכים, כגון נציץ (למשל, עבור מיקרוסקופיה של כוח אטומי), מצעים רכים (למשל, פולי-די-מתיל-סילוקסן), כריות פולימריות33,34,35, המשתרעות בין חורים של רשתות מיקרוסקופיית אלקטרונים 14. Bilayers ממשק Droplet הם שיטה מעניינת נוספת ליצירת bilayers שומנים יציבים העומדים בפני עצמם36. הכללת רשתות אקטו-מיוזין לתוך שלפוחיות או תחליבים היא שיטה חזקה מאוד לחקור את המערכת המינימלית הזו בגיאומטריה דמוית תא37,38, המתוארת בפירוט במקום אחר 39.
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
עבודה זו נתמכה על ידי קרן המחקר AXA ותוכנית הביו-רפואה הכמותית של וורוויק-וולקום (Wellcome ISSF, RMRCB0058) עבור DVK, NCBS-TIFR עבור AB ו-ST, ומלגת Wellcome-DBT Margdarshi (IA/M/15/1/502018) עבור SM. DVK רוצה גם להודות לחברה הביופיזית על שאפשרה את אירוע הרשת הווירטואלי "אתגרים בהבנת רשתות ציטוסקטליות מרובות רכיבים מהמולקולה לסולם מזו", אשר תרם ליצירת אוסף פרוטוקולים זה.
Materials
| Name | Company | Catalog Number | Comments |
| 1,2 dipalmitoyl-sn-glycero-3-phosphoethanolamine-N- (lissamine rhodamine B sulfonyl) | Avanti Polar Lipids | 810158 | 16:0 RhoPE |
| 1,2-dioleoyl-sn-glycero-3- [(N-(5-amino-1 carboxypentyl) iminodiacetic acid) succinyl] (nickel salt) | Avanti Polar Lipids | 790404 | DGS-NTA-Ni2+ |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850375 | DOPC |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850355 | DPPC |
| Amber glass vials | ThermoFisher | B7990-2A | |
| ATP disodium salt | Sigma Aldrich | A26209 | |
| Attofluor cell chamber | ThermoFisher | A7816 | |
| Bath sonicator | GT Sonic | 1860QTS | |
| beta-casein | Sigma Aldrich | C6905 | |
| CaCl2 | ThermoFisher | 12135 | |
| chloroform | Sigma Aldrich | 650471 | alternatively from Electron Microscopy Sciences, 50980296 |
| Cover slips, #1, 25 mm diameter, Gold Seal | Harvard Apparatus | 64-0705B | |
| Cover slips, #1, 40x22 mm, Gold Seal | ThermoFisher | 48404-031 | |
| EDTA | ThermoFisher | G12635 | |
| EGTA | Himedia | MB130 | |
| Gas tight glass syringes, with removebla needle, blunt, volumes 10 µL, 100 µL, 500 µL | Hammilton | 1700 series | |
| Hellmanex III | Hellma Analytics | Z805939 | cleaning solution |
| HEPES | Himedia | RM380 | |
| KaH2PO4 | ThermoFisher | G13405 | |
| KCl | ThermoFisher | G13305 | |
| KOH | ThermoFisher | G26708 | |
| Lipid extruder | Avanti Polar Lipids | 61000-1EA | |
| MgCl2 | ThermoFisher | G15535 | |
| Microtip sonicator | Sonics | VC750 | 3 mm Tip diameter |
| Na2CO3 | ThermoFisher | G15955 | |
| NaCl | Himedia | GRM853 | |
| NaH2PO4 | ThermoFisher | G15825 | |
| NaOH | ThermoFisher | G27815 | |
| Nikon Ti Eclipse TIRF microscope | Nikon | With a TIRF unit connected through a polarization-conserving optical fibre to an Agilent monolithic laser combiner MLC400 with multiple laser lines with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) with a 100X, 1.45 NA Nikon Oil Objective with two 512 x 512-pixel EMCCD cameras (Photometrics Evolve 512) | |
| NOA88 | Norland Products | 8801 | |
| PTFE Coated Tweezer Style #2A | Structure Probe | 0S2AT-XD | |
| Refrigerated microcentrifuge | Eppendorf | 5424R | |
| Sucrose | ThermoFisher | G15925 | |
| UV-illuminator | Novascan | PSD PRO-UV | needs vacuum and O2 supply |
References
- Köster, D. V., Mayor, S. Cortical actin and the plasma membrane: Inextricably intertwined. Current Opinion in Cell Biology. 38, 81-89 (2016).
- Rao, M., Mayor, S. Active organization of membrane constituents in living cells. Current Opinion in Cell Biology. 29, 126-132 (2014).
- Honigmann, A., et al. A lipid bound actin meshwork organizes liquid phase separation in model membranes. eLife. 3, 01671(2014).
- Das, A., et al. Stratification relieves constraints from steric hindrance in the generation of compact actomyosin asters at the membrane cortex. Science Advances. 6 (11), (2020).
- Köster, D. V., et al. Actomyosin dynamics drive local membrane component organization in an in vitro active composite layer. Proceedings of the National Academy of Sciences. 113 (12), 1645-1654 (2016).
- Vogel, S. K., Heinemann, F., Chwastek, G., Schwille, P. The design of MACs (minimal actin cortices). Cytoskeleton. 70 (11), 706-717 (2013).
- Murrell, M., Thoresen, T., Gardel, M. Reconstitution of contractile actomyosin arrays. Methods in Enzymology. 540, 265-282 (2014).
- Mosby, L. S., et al. Myosin II filament dynamics in actin networks revealed with interferometric scattering microscopy. Biophysical Journal. 118 (8), 1946-1957 (2020).
- Seara, D. S., et al. Entropy production rate is maximized in non-contractile actomyosin. Nature Communications. 9 (1), 4948(2018).
- Linsmeier, I., et al. Disordered actomyosin networks are sufficient to produce cooperative and telescopic contractility. Nature Communications. 7, 12615(2016).
- Vogel, S. K., Petrasek, Z., Heinemann, F., Schwille, P. Myosin motors fragment and compact membrane-bound actin filaments. eLife. 2, 00116(2013).
- Ditlev, J. A., et al. A composition-dependent molecular clutch between T cell signaling condensates and actin. eLife. 8, 42695(2019).
- Banjade, S., Rosen, M. K. Phase transitions of multivalent proteins can promote clustering of membrane receptors. eLife. 3, 04123(2014).
- Heinemann, F., Vogel, S. K., Schwille, P. Lateral membrane diffusion modulated by a minimal actin cortex. Biophysical Journal. 104 (7), 1465-1475 (2013).
- Vogel, S. K., Greiss, F., Khmelinskaia, A., Schwille, P. Control of lipid domain organization by a biomimetic contractile actomyosin cortex. eLife. 6, 24350(2017).
- Block, S. Brownian motion at lipid membranes: A comparison of hydrodynamic models describing and experiments quantifying diffusion within lipid bilayers. Biomolecules. 8 (2), 30(2018).
- JoVE, JoVE. JoVE Methods Collection. In vitro reconstitution of cytoskeleton networks for biomaterials, biophysics and active matter research. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Pardee, J. D., Spudich, J. A. Purification of muscle actin. Methods in Enzymology. 85, 164-181 (1982).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Pollard, T. D. Myosin purification and characterization. Methods in Cell Biology. 24, 331-371 (1982).
- JoVE Science Education Database. Separating protein with SDS-PAGE. Journal of Visualized Experiments. , Cambridge, MA. (2022).
- Bieling, P., et al. WH2 and proline-rich domains of WASP-family proteins collaborate to accelerate actin filament elongation. The EMBO Journal. 37 (1), 102-121 (2018).
- Shrivastava, R., Köster, D., Kalme, S., Mayor, S., Neerathilingam, M. Tailor-made ezrin actin binding domain to probe its interaction with actin in-vitro. PLoS One. 10 (4), 0123428(2015).
- Nye, J. A., Groves, J. T. Kinetic control of histidine-tagged protein surface density on supported lipid bilayers. Langmuir. 24 (8), 4145-4149 (2008).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5, 5412(2014).
- Selden, N. S., et al. Chemically programmed cell adhesion with membrane-anchored oligonucleotides. Journal of the American Chemical Society. 134 (2), 765-768 (2012).
- Seu, K. J., et al. Effect of surface treatment on diffusion and domain formation in supported lipid bilayers. Biophysical Journal. 92 (7), 2445-2450 (2007).
- Kang, M., Day, C. A., Kenworthy, A. K., DiBenedetto, E. Simplified equation to extract diffusion coefficients from confocal FRAP data. Traffic. 13 (12), 1589-1600 (2012).
- Kang, M., Day, C. A., Kenworthy, A. K. A novel computational framework for D(t) from Fluorescence Recovery after Photobleaching data reveals various anomalous diffusion types in live cell membranes. Traffic. 20 (11), 867-880 (2019).
- Lorén, N., et al. Fluorescence recovery after photobleaching in material and life sciences: Putting theory into practice. Quarterly Reviews of Biophysics. 48 (3), 323-387 (2015).
- Alvarado, J., Sheinman, M., Sharma, A., MacKintosh, F. C., Koenderink, G. H. Molecular motors robustly drive active gels to a critically connected state. Nature Physics. 9 (7), 1-7 (2013).
- Andrecka, J., Spillane, K. M., Ortega-Arroyo, J., Kukura, P. Direct observation and control of Supported lipid bilayer formation with interferometric scattering microscopy. ACS Nano. 7 (12), 10662-10670 (2013).
- Lin, W. -C., et al. Supported membrane formation, characterization, functionalization, and patterning for application in biological science and technology. Current Protocols in Chemical Biology. 2 (4), 235-269 (2010).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: An integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sapuri-Butti, A. R., Butti, R. C., Parikh, A. N. Characterization of supported membranes on topographically patterned polymeric elastomers and their applications to microcontact printing. Langmuir. 23 (25), 12645-12654 (2007).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Bashirzadeh, Y., Moghimianavval, H., Liu, A. P. Encapsulated actomyosin patterns drive cell-like membrane shape changes. iScience. 25 (5), 104236(2022).
- Bashirzadeh, Y., Wubshet, N., Litschel, T., Schwille, P., Liu, A. P. Rapid encapsulation of reconstituted cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. (177), e63332(2021).
- Murrell, M., Chen, S., Sun, Z. G. In vitro reconstitution of actin cytoskeleton inside giant unilamellar vesicles. Journal of Visualized Experiments. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved