Method Article
التحليل الزماني المكاني لنشاط الخلايا الدبقية الكالسيمية2+ بدقة خلية واحدة
In This Article
Summary
في هذه الورقة ، نصف بروتوكولا للتصوير في الجسم الحي لنشاط الخلايا الدبقية الدقيقة Ca2+ والتحليل اللاحق لديناميكياته الزمانية المكانية. تتيح هذه الطريقة توصيفا شاملا لكيفية استجابة الخلايا الدبقية الصغيرة للتغيرات في بيئة الدماغ ، والتقاط المقاييس الزمانية المكانية الدقيقة التي تحدث فيها مثل هذه الأحداث بشكل مناسب.
Abstract
الخلايا الدبقية الصغيرة هي الخلايا المناعية الوحيدة المقيمة في الجهاز العصبي المركزي. مورفولوجيتها شديدة اللبن ، وتتغير حسب نشاطها. في ظل ظروف التماثل ، تمتلك الخلايا الدبقية الصغيرة مورفولوجيا متشعبة للغاية. هذا يسهل مراقبتهم للبيئة المحيطة من خلال التمديد المستمر لعملياتهم وسحبها. ومع ذلك ، أثناء إصابة الدماغ والالتهابات ، يتم تنشيط الخلايا الدبقية الصغيرة وتخضع لتغيرات مورفولوجية جذرية ، مما يؤدي إلى تراجع عملياتها المتشعبة وتورم جسم الخلية. هذا يسهل أنشطة مثل الهجرة والبلعمة ، والتي تقوم بها الخلايا الدبقية الصغيرة للتنقل في بيئة الدماغ إلى حالة أقل مرضية.
مكنت هذه العلاقة الوثيقة بين مورفولوجيا الخلايا الدبقية الصغيرة والتغيرات في نشاطها من رؤى كبيرة حول وظائف الخلايا الدبقية الصغيرة المختلفة. ومع ذلك ، فإن هذه التغييرات المورفولوجية والنشاط هي في حد ذاتها ظواهر يمكن أن تنتج عن أي عدد من مسارات الإشارات داخل الخلايا. علاوة على ذلك ، فإن الفجوة الزمنية بين التحفيز والاستجابة ، بالإضافة إلى التشكل المجزأ للغاية للخلايا الدبقية الصغيرة ، تجعل من الصعب عزل الآليات المسببة التي تدعم الوظيفة. لحل هذه المشكلة ، قمنا بتطوير خط فأر معدل وراثيا يتم فيه التعبير عن بروتين مؤشر الفلورسنت Ca2 + عالي الحساسية على وجه التحديد في الخلايا الدبقية الصغيرة.
بعد وصف طرق التصوير في الجسم الحي للخلايا الدبقية الدقيقة Ca2 + ، تقدم هذه الورقة نهج تحليل منظم يصنف نشاط Ca2 + هذا إلى مناطق تحت الخلوية المحددة بشكل عقلاني ، وبالتالي ضمان استخراج الأبعاد المكانية والزمانية للمعلومات المشفرة بشكل هادف. نعتقد أن هذا النهج سيوفر فهما مفصلا لقواعد الإشارات داخل الخلايا التي تحكم مجموعة متنوعة من أنشطة الخلايا الدبقية الصغيرة المرتبطة بكل من وظائف الدماغ العليا والحالات المرضية.
Introduction
الخلايا الدبقية الصغيرة هي الخلايا المناعية المقيمة في الجهاز العصبي المركزي (CNS) وتلعب أدوارا مهمة في الحفاظ على بيئة الدماغ المتجانسة وفي تنظيم تكوين الدوائر العصبية أثناء نموالدماغ 1،2. الميزة الفريدة للخلايا الدبقية الصغيرة في الجهاز العصبي المركزي هي أن مورفولوجيتها شديدة التلاست. ومع ذلك ، يمكن أن ترتبط الأنماط الظاهرية المورفولوجية المميزة بوظائف معينة. علاوة على ذلك ، فإن التحول بين الأنماط الظاهرية المورفولوجية ديناميكي للغاية ، ويحدث على نطاقات زمنية سريعة استجابة للتغيرات في البيئة المحيطة3،4.
في ظل الظروف الفسيولوجية المتجانسة ، تفترض الخلايا الدبقية الصغيرة مورفولوجيا متشعبة للغاية ، مع عمليات متعددة تشع إلى الخارج في جميع الاتجاهات. تظهر هذه العمليات المتشعبة نفسها حركة عالية ، وتمتد وتتراجع باستمرار3،4. يتم توجيه هذا النشاط بشكل أساسي نحو الاتصال الدوري مع المشابك العصبية والمحاور والسوما لمراقبة النشاط العصبي5،6،7،8،9. ومع ذلك ، عندما يصاب الدماغ ، تكتشف الخلايا الدبقية الصغيرة هذا الشذوذ بسرعة ، وكخطوة أولى في استجابتها التكيفية ، توجه امتداد عملياتها نحو المنطقة المقابلة3،4. عندما تكون الخلايا الدبقية الصغيرة مطلوبة لإجراء البلعمة للخلايا الميتة والمستقلبات ، فإنها تفترض مورفولوجيا شبيهة بالأميبويدات ، مما يقصر عملياتها ويوسع أجسامها الخلوية ، كجزء من انتقالها إلى النمط الظاهري المنشط مناعيا10،11.
ومع ذلك ، في حين أن التغيرات المورفولوجية الدراماتيكية لعمليات الخلايا الدبقية الصغيرة يمكن اكتشافها بسهولة ، إلا أن التغيرات الدقيقة في سوما الخلية يصعب التقاطها بشكل ملحوظ ، خاصة عند الدقة الزمنية ذات الصلة من الناحية الفسيولوجية. علاوة على ذلك ، فإن التغييرات المورفولوجية نفسها لا تمثل سوى النتيجة المتكاملة لأي عدد من مسارات الإشارات داخل الخلايا. هذا يمثل مشكلة بالنسبة لهدف تتبع النشاط الوظيفي وربط الحافز ميكانيكيا بالاستجابة النهائية التي يثيرها.
نظرا لدورها الواسع النطاق كرسول ثان ، فإن فحص ديناميكيات Ca2+ داخل الخلايا يلتقط بشكل أفضل المعلومات الزمانية المكانية المرتبطة عند دراسة عمليات الخلايا الديناميكية. ينطبق هذا النهج على الخلايا الدبقية الصغيرة نظرا لأنها تعبر عن مجموعة متنوعة من المستقبلات الأيونية والتمثيل الغذائي المرتبطة بارتفاع Ca2+ داخل الخلايا. في الواقع ، تم استخدام التصوير في الجسم الحي Ca2 + لتوصيف الجوانب الزمانية المكانية لأنشطة الخلايا الدبقية الصغيرة في الوقت الفعلي ، مما أدى إلى ربط التغييرات في نشاط الخلايا الدبقية الدقيقة Ca2+ بإصابة الدماغ والالتهاب وفرط النشاط ونقص النشاط في الخلايا العصبية12،13،14،15،16. على سبيل المثال ، من المحتمل أن تعكس ارتفاعات Ca2+ المرتبطة بامتداد عملية الخلايا الدبقية الصغيرة استجابة للنشاط العصبي المفرط / ناقص النشاط عملية بلمرة الأكتين الأساسية المعتمدة على Ca2 + 16. علاوة على ذلك ، يمكن أيضا دمج التصوير في الجسم الحي Ca2 + بسهولة مع الأساليب الدوائية. على سبيل المثال ، بينما تعبر الخلايا الدبقية الصغيرة عن كل من مستقبلات P2X (الموجهة الأيونية) و P2Y (الأيض) ، فإن التطبيق المحلي لناهضات P2Y يحاكي ويزيل حساسيتها لاحقا استجابة الخلايا الدبقية الصغيرة Ca2+ للخلايا العصبية المجاورةالتالفة 13 ، مما يعني أهمية أكبر لإشارات P2Y للكشف عن تلف الخلايا العصبية.
حتى الآن ، استخدمت التقارير السابقة التي تفحص نشاط الخلايا الدبقية الدقيقة Ca2 + طرق تحليل قائمة على منطقة الاهتمام (ROI). عيب هذه الأساليب هو أنها لا تزال خشنة جدا بحيث لا تكون قادرة على حل الديناميكيات الزمانية المكانية لنشاط Ca2+ على مستوى العمليات الدبقية الصغيرة الفردية. وبالتالي ، يصف هذا البروتوكول كلا من الطرق التقليدية القائمة على عائد الاستثمار لتحليل نشاط الخلايا الدبقية الصغيرة Ca2 + والأساليب الأحدث القائمة على الأحداث ، والتي يمكنها استخراج أحداث Ca2+ الفردية في عمليات الخلايا الدبقية الصغيرة. قبل ذلك ، نقدم دليلا عاما للتصوير ثنائي الفوتون في الجسم الحي لالتقاط نشاط الخلايا الدبقية الدقيقة Ca2+ بشكل مناسب لتحليل مفصل.
Protocol
تمت الموافقة على جميع التجارب على من قبل المعهد الوطني للعلوم الفسيولوجية لجان البحوث الحيوانية وكانت متوافقة مع إرشادات المعاهد الوطنية للصحة. بالنسبة لجميع التجارب ، تم تربية ذكور الفئران البالغة من العمر 8-10 أسابيع في ظل دورة ضوء / ظلام مدتها 12/12 ساعة مع إمكانية الوصول إلى الطعام والماء. لتصور نشاط Ca2+ في الخلايا الدبقية الصغيرة ، تم تهجين جزيء محول ربط Ca2+ المتأين 1 (Iba1) -منشط التتراسيكلين (Iba1-tTA) مع الفئران17،18 مشغل التتراسيكلين-GCaMP6 (tetO-GCaMP6). وبالتالي ، في حالة عدم وجود مكملات التتراسيكلين التناظرية ، يقود محفز Iba1 التعبير عن GCaMP6 ، حصريا في الخلايا الدبقية الصغيرة. بالنسبة لجميع التجارب، توقف تناول المكملات الغذائية الدوكسيسيكلين بعد 6 أسابيع من الولادة. في نهاية جميع التجارب ، تم القتل الرحيم للفئران عن طريق جرعة زائدة من الأيزوفلوران متبوعا بخلع عنق الرحم. راجع جدول المواد للحصول على تفاصيل تتعلق بجميع المواد والكواشف المستخدمة في هذا البروتوكول.
1. التحضير الجراحي للفئران للتصوير ثنائي الفوتون في الجسم الحي . اليوم 1
- قم بإجراء جميع العمليات الجراحية داخل خزانة تدفق الهواء الرقائقي للحفاظ على ظروف العمل المعقمة. قبل البدء في الجراحة ، قم بتعقيم الجزء الداخلي من الخزانة بضوء الأشعة فوق البنفسجية لمدة 5 دقائق.
- عقم جميع أسطح العمل وإطار الجراحة والأدوات التجسيمية عن طريق مسحها بنسبة 70٪ من الإيثانول.
- تعقيم جميع الأدوات الجراحية (المقص ، الملقط ، شفرة الحلاقة ، الملقط) ولوحة الرأس المصنوعة حسب الطلب ليتم تثبيتها بجمجمة الفأر عن طريق غمرها في محلول غلوكونات الكلورهيكسيدين بنسبة 1٪.
- تخدير الفأر بالكيتامين (7.4 مجم كجم −1 ، داخل الصفاق [i.p.]) والزيلازين (10 مجم كجم −1 ، IP.). أعده إلى قفص منزله حتى يترسخ التخدير. تأكد من التحريض الكامل للتخدير عن طريق فقدان منعكس قرص إصبع القدم.
- تعقيم فروة الرأس باستخدام غلوكونات الكلورهيكسيدين 1٪. احلق الفراء بشفرة حلاقة.
- قم بتأمين الماوس داخل إطار الجراحة عبر أدوات التجسيم.
- ضع مرهما بيطري على العينين لمنع الجفاف أثناء التخدير.
- ضع 2٪ جيلي زيلوكائين على فروة الرأس للتحكم في الألم. انتظر لمدة 5 دقائق.
- قم بإزالة فروة الرأس بالمقص وكشف الجمجمة. نظف السمحاق وجفف سطح الجمجمة المكشوف عن طريق فركه بمسحات قطنية.
ملاحظة: يجب أن تكون مناطق الجمجمة المكشوفة جافة تماما لضمان الترابط القوي مع لوحة الرأس المصنوعة خصيصا. - قم بتثبيت صفيحة الرأس المصنوعة خصيصا على الجمجمة باستخدام الأسمنت الأسنان.
- بمجرد أن يتماسك الأسمنت ، املأ أي فجوات بين سطح الجمجمة وحدود صفيحة الرأس المصنوعة خصيصا باستخدام أسمنت أسنان إضافي.
- عزل أسطح الأسمنت والجمجمة عن طريق تطبيق الأسمنت الراتنج اللاصق للأسنان القائم على الأكريليك.
- أعد الماوس إلى قفص منزله ، وضعه على وسادة تسخين. راقب الماوس حتى يستعيد وعيه الكافي للحفاظ على الاستلقاء القصي (في غضون ساعتين).
ملاحظة: يجب استعادة الفئران بالكامل بحلول اليوم التالي ويمكن بعد ذلك إيواؤها مع أخرى.
2. التحضير الجراحي للفئران للتصوير ثنائي الفوتون في الجسم الحي . اليوم 2
- قم بإجراء جميع العمليات الجراحية داخل خزانة تدفق الهواء الرقائقي للحفاظ على ظروف العمل المعقمة. قبل البدء في الجراحة ، قم بتعقيم الجزء الداخلي من الخزانة بضوء الأشعة فوق البنفسجية لمدة 5 دقائق.
- قم بتصفيح غطاءين زجاجيين بأبعاد مختلفة (الزجاج العلوي: 3 مم × 3 مم ؛ الزجاج السفلي: 2 مم × 2 مم) مع راتنج بصري قابل للمعالجة بالأشعة فوق البنفسجية.
ملاحظة: يوفر الغطاء المزدوج حماية طويلة الأمد لمنطقة الدماغ المكشوفة من نافذة الجمجمة مع تمكين الوصول البصري المزمن. وبالتالي ، يمكن تغيير أبعاده لتناسب منطقة الدماغ المراد تصويرها. - تعقيم جميع أسطح العمل وإطار الجراحة عن طريق مسحها بنسبة 70٪ من الإيثانول.
- تعقيم جميع الأدوات الجراحية (المثقاب الفولاذي ، الملقط ، خطاف الإبرة الجراحية) عن طريق غمرها في محلول غلوكونات الكلورهيكسيدين بنسبة 1٪.
- تخدير الفأر بالأيزوفلوران (4٪ تحريض ، 1.2٪ -1.5٪ صيانة). قم بتأمين الماوس داخل إطار الجراحة عبر لوحة الرأس الخاصة به.
- لعمل نافذة قمجمة فوق القشرة الحركية الأولية ، ضع علامة على مربع بأبعاد 2 مم × 2 مم في المنتصف 0.2 مم أمام معلم جمجمة بريجما و 1 مم جانبيا.
- قم بترقيق الجمجمة على طول حدود المربع المحدد باستخدام المثقاب الفولاذي.
ملاحظة: عندما تقترب من السماكة المطلوبة ، ستظهر مناطق الجمجمة الرقيقة شفافة عند ترطيبها بالمحلول الملحي ، وستبدأ تشققات خط الشعر في الظهور. - بعد التأكد من أن حدود المربع المحدد بالكامل قد تم ترققها بشكل مناسب ، أدخل خطاف الإبرة الجراحية بعناية أسفل سطح الجمجمة مباشرة ، مع توجيه طرفه نحو مركز المربع. ارفع قطعة الجمجمة المربعة برفق بالخطاف واستخدم الملقط لتقشيرها بعيدا عن بقية الجمجمة. في حالة حدوث نزيف ، اغسل سطح الدماغ المكشوف باستمرار بالمحلول الملحي حتى ينحسر تماما.
- ضع الغطاء المزدوج على سطح الدماغ المكشوف ، ووجه الجانب مع الغطاء الأصغر نحو الدماغ. تأكد من أن حواف الغطاء الأكبر ملامسة لحدود نافذة الجمجمة.
- باستخدام قضيب زجاجي ذو رأس من السيليكون مركب في مناور ، اضغط برفق على الغطاء المزدوج للتأكد من أنه يتلامس بشكل جيد مع سطح الدماغ.
- املأ الفجوة بين الغطاء المزدوج والجمجمة وسطح الدماغ براتنج قابل للعلاج بالأشعة فوق البنفسجية وقم بإشعاعه بضوء الأشعة فوق البنفسجية حتى يتصلب (~ 20 ثانية). ارفع القضيب الزجاجي ذو الرأس السيليكوني ببطء بعيدا عن زلة الغطاء المزدوجة.
- اسمح للماوس بالتعافي ، وضعه على وسادة تسخين. راقب الفأر حتى يستعيد وعيه الكافي للحفاظ على الاستلقاء القصي (30 دقيقة).
- انتقل إلى الخطوة 3 أو أعد الماوس إلى قفصه المنزلي.
ملاحظة: بعد الجراحة الماهرة ، ستكون الجافية وجميع الأوعية الدموية الأساسية سليمة تماما دون حدوث نزيف. في هذه الحالة ، يكون الالتهاب ضئيلا ومن الممكن المتابعة على الفور إلى الخطوة 3. إذا لم تكن متأكدا ، فانتظر 1-3 أسابيع للتأكد من حل أي التهاب تماما.
3. جمع البيانات باستخدام التصوير ثنائي الفوتون في الجسم الحي
- قم بتشغيل إعداد التصوير مسبقا للتأكد من أن الليزر لديه الوقت الكافي للإحماء والتثبيت. قم بضبط الليزر لينبعث منه بطول موجي يبلغ 920 نانومتر ، وهو الطيف ثنائي الفوتون الذي يثير فلوروفور GCaMP6 على النحو الأمثل.
- ضع الماوس تحت عدسة موضوعية مجهرية 25x واعتاد عليه لمدة 30 دقيقة. إذا لزم الأمر ، قم بتخدير الفأر بالأيزوفلوران أثناء التصوير (4٪ تحريض ، 1.2٪ -1.5٪ صيانة).
ملاحظة: قد لا يكون الأيزوفلوران مناسبا لبعض التطبيقات البحثية ، لأنه يؤثر على حركة عملية الخلايا الدبقية الدقيقة ونشاط Ca2+ 19،20،21. - اضبط التكبير/التصغير على 1x، ثم ابحث عن الخلايا الدبقية الصغيرة التي تعبر عن GCaMP6 في منطقة نافذة الجمجمة. البحث على عمق يتراوح بين 100 ميكرومتر و 300 ميكرومتر تحت سطح الدماغ.
- بمجرد العثور على الخلايا الدبقية الصغيرة المناسبة التي تعبر عن GCaMP6 ، قم بتعظيم التكبير بحيث يمكن التقاط نشاط Ca2+ بدقة خلية واحدة.
- تأكد بصريا من التقاط نشاط Ca2+ بوضوح واضبط قوة الليزر وكسب التصوير إذا لزم الأمر.
ملاحظة: يجب تقليل طاقة الليزر قدر الإمكان لتجنب التبييض الضوئي وإصابة الخلايا الدبقية الصغيرة. - إجراء الحصول على صورة رباعية الأبعاد (4D) على النحو التالي (الخطوات 3.6.1-3.6.3 ؛ الشكل 1 ب):
- اضبط أبعاد الصورة على منطقة XY = 512 × 512 بكسل ، 0.25 ميكرومتر / بكسل ؛ منطقة Z = خمس طائرات z ، 3 ميكرومتر z-step (الشكل 1 ب).
- اضبط معدل الاستحواذ على 2.5 إطار/ثانية.
ملاحظة: يتم تسهيل المسح الضوئي على شكل Z بهذه السرعة من خلال نظام تحديد المواقع النانوي بيزو. - احصل على البيانات حتى يتم ملاحظة ما لا يقل عن 10 أحداث Ca2+ فردية (عادة 10 دقائق).
4. التحضير للتحليل (تصحيح الحركة ، متوسط / أقصى إسقاط z)
- قبل الشروع في تحليل نشاط الخلايا الدبقية الدقيقة Ca2+ ، قم بتصحيح الصور 4D للقطع الأثرية المتعلقة بالحركة (تسجيل الصور) باستخدام خوارزمية محاذاة الصور ECC22 داخل بيئة برمجة MATLAB (R2020a). قم بتنزيل الرمز من: https://www.mathworks.com/matlabcentral/fileexchange/27253-ecc-image-alignment-algorithm-image-registration.
- قم بإنشاء صورة مرجعية ثلاثية الأبعاد عن طريق تسجيل جميع الصور في الإطار الزمني الأول باستخدام عملية imregister MATLAB (صندوق أدوات معالجة الصور القياسي).
- قم بتسجيل جميع الصور اللاحقة ، ومطابقتها مع المستوى z المقابل للصورة ثلاثية الأبعاد المرجعية باستخدام وظيفة ecc (مكتبة خوارزمية محاذاة صورة ECC).
- قم بإنشاء إسقاطات z متوسطة الشدة من الصور المسجلة باستخدام متوسط عملية MATLAB. إذا كانت إشارة التصوير ضعيفة جدا ، فقم بإنشاء إسقاطات z قصوى الكثافة بدلا من ذلك باستخدام الحد الأقصى لعملية MATLAB.
ملاحظة: تكون نسبة الإشارة إلى الضوضاء أسوأ عند استخدام إسقاطات z ذات الكثافة القصوى. - انتقل إلى الخطوة 5 أو 6. استخدم الإسقاطات z التي تم إنشاؤها في الخطوة 4 كهدف للتحليل لرسم خرائط الديناميكيات الزمانية المكانية لنشاط Ca2+ في الخطوتين 5 و 6.
5. التحليل القائم على عائد الاستثمار
- باستخدام الإسقاطات z التي تم إنشاؤها في الخطوة 4 ، حدد العمليات الدبقية الصغيرة التي تحافظ على ملف تعريف منطقة مستقرة (منطقة مستقرة) طوال فترة التصوير للتحليل اللاحق لنشاط Ca2+ على النحو التالي (الخطوات 5.3-5.6):
- قم بإنشاء إسقاطات t قصوى منفصلة للصور رباعية الأبعاد المسجلة من عينات مدتها دقيقتان تم التقاطها في بداية ونهاية فترة التصوير باستخدام عملية MATLAB القصوى .
- ثنائي الإسقاطات t لإنشاء مضلعات من مورفولوجيا الخلايا الدبقية الدقيقة المقابلة لبداية ونهاية فترة التصوير باستخدام عملية MATLAB المدمجة . استخدم الحد الافتراضي الذي تم تعيينه تلقائيا.
ملاحظة: إذا كانت إشارة Ca2+ ضعيفة أثناء بداية فترة التصوير ونهايتها، فقد يؤدي الثنائي إلى إنشاء مضلعات ذات حدود مفقودة. في هذه الحالة، ارسم الحدود المفقودة يدويا باستخدام أداة القلم الرصاص في ImageJ. - تراكب مضلعات الإسقاط t باستخدام عملية imadd MATLAB. تمثل المنطقة (المناطق) المتداخلة المنطقة المستقرة (الشكل 2 ب).
- ضمن المناطق المستقرة المحددة ، استخدم عملية drawpolygon MATLAB لتحديد وتتبع عائد الاستثمار يدويا لكل عملية من عمليات الخلايا الدبقية الصغيرة الأولية وأي فروع فرعية واضحة من الدرجة الثانية.
- تتبع شدة التألق المطلقة التي تم قياسها عبر عائد استثمار فردي عبر جميع الأطر الزمنية (الشكل 2 ج ، د).
- من السلاسل الزمنية لشدة التألق المطلقة ، احسب التغير النسبي في شدة التألق (ΔF / F) السلسلة الزمنية وفقا للمعادلة (1). تمثل هذه السلسلة الزمنية ديناميكيات الخلايا الدبقية الصغيرة Ca2+ الطبيعية على مستوى عائد الاستثمار الفردي.
ΔF / F = (F (t) - F0) / F0 (1)
حيث F (t) هي شدة التألق المسجلة في وقت معين و F0 هيالنسبة المئوية 10 من شدة التألق في جميع الأطر الزمنية (الشكل 2E). - حدد أحداث إطلاق Ca2+ المرشحة التي تحدث في عائد استثمار فردي معين على النحو التالي (الخطوات 5.5.1-5.5.3):
- قم بتطبيق ترشيح التمرير المنخفض للاستجابة النبضية المحدودة من النوع الأول (FIR) على السلسلة الزمنية ΔF / F باستخدام عملية fir1 MATLAB. اضبط تردد القطع على قيمة Nyquist (نصف معدل أخذ العينات).
- افحص بصريا التتبع الذي تمت تصفيته للتأكد من أن قمم التتبع الفردية تتوافق مع رشقات نارية لنشاط Ca2+ في الصور رباعية الأبعاد المسجلة (الشكل 2F).
- حدد أحداث إطلاق المرشح Ca2+ على أنها تصريفات مقعرة في تتبع السلسلة الزمنيةΔF / F. حدد عتبة خط الأساس كقيمة متوسطة ΔF / F داخل السقف العلوي والسفلي الذي يستبعد الحد الأقصى والحد الأدنى للاتساع بنسبة 10٪ على جميع الأطر الزمنية. حدد عتبة الكشف لثلاثة SDs فوق عتبة خط الأساس (الشكل 2F ، H).
- حدد أحداث إطلاق Ca2+ الحقيقية من المرشحين على النحو التالي (الخطوات 5.5.1-5.5.2):
- احسب ميل كل حدث مرشح عن طريق التمييز عبر إطارات السلاسل الزمنية ΔF / F التي تمت تصفيتها المقابلة باستخدام عملية MATLAB التدرج العددي .
- حدد لاحقا أحداث Ca2+ الحقيقية بناء على وقت صعود الملف الشخصي. حدد عتبة خط الأساس كمتوسط قيم الميل عبر جميع الأحداث المرشحة. حدد عتبة الكشف لثلاثة SDs فوق عتبة خط الأساس (الشكل 2G,H).
- قم بتمييز أحداث Ca2+ الحقيقية على النحو التالي (الخطوات 5.6.1-5.6.3):
ملاحظة: فيما يلي ليست قائمة شاملة بالمعلمات التي يمكن استخدامها لتوصيف أحداث الخلايا الدبقية الصغيرة Ca2+ . تعتمد معايير الاهتمام على الغرض من الدراسة.- اشتقاق السعة القصوى لحدث إطلاق Ca2+ الحقيقي كقيمة ΔF / F لإطار السلسلة الزمنية ΔF / F المقابل.
- اشتقاق متوسط سعة حدث إطلاق Ca2+ الحقيقي كمتوسط قيمة ΔF / F عبر المجموعة الفرعية للسلسلة الزمنية ΔF / F المقابلة بأكملها من الإطارات.
- اشتقاق تكرار أحداث Ca2+ الحقيقية كعدد الأحداث مقسوما على وقت التصوير.
6. التحليل القائم على الحدث
- قم بإجراء تحليل قائم على الأحداث على الإسقاطات z من الخطوة 4 باستخدام مكتبة AQuA داخل بيئة برمجة MATLAB. قم بتنزيل الرمز من: https://github.com/yu-lab-vt/AQuA.
ملاحظة: تتوفر معاينة للاستخدام العام لمكتبة AQuA من: https://drive.google.com/file/d/1a3lhe0dUth-5J1-S2fZlPOCZlPbeuvUr/view. تتوفر الوثائق التفصيلية لمكتبة AQuA من: https://drive.google.com/file/d/1CckDLbrkw16b7MPlOQdYpZciIz80Snm_/view. - بعد تشغيل MATLAB ، قم بالتبديل من مجلد دليل العمل الافتراضي إلى مجلد دليل العمل المعين ل AQuA باستخدام عملية القرص المضغوط .
- قم بتحميل الصور رباعية الأبعاد المسجلة في مسار تحليل AQuA على النحو التالي (الخطوات 6.3.1-6.3.2):
- قم بتشغيل واجهة المستخدم الرسومية AQuA. اكتب aqua_gui في نافذة أوامر MATLAB في مجلد دليل العمل المعين ل AQuA.
- داخل واجهة المستخدم الرسومية AQuA ، انقر فوق مشروع جديد وحدد الصور المسجلة المراد تحليلها. حدد نوع البيانات (GCaMPInVivo_cyto_Lck_) ومعلمات التصوير (الثواني ذات الاستبانة الزمنية لكل إطار = 1.993؛ الاستبانة المكانية ميكرومتر لكل بكسل = 0.25؛ استبعاد وحدات البكسل الأقصر من هذه المسافة إلى الحدود = 5). انقر فوق فتح لتحميل البيانات.
- حدد المعالم لمسارات التحليل اللاحقة من خلال تتبع مجالات الاهتمام. عادة ما تعتمد المعالم على حدود الخلية ومساحة جسم الخلية.
- بعد ذلك، اكتشف أحداث Ca2+ المرشحة عن طريق تشغيل مسارات التحليل التلقائي للمعلمات التالية: الإشارة النشطة ، والفوكسل الفائق ، واكتشاف الأحداث ، والأحداث النظيفة ، ودمج الأحداث.
ملاحظة: يتم توفير شرح مفصل حول كل من هذه المعلمات ومخرجات درجة المرشح الخاصة بها في معاينة AQuA. باختصار ، تقوم هذه المعلمات بضبط عتبة اكتشاف الحدث Ca2+ على النحو التالي: الإشارة النشطة = سعة التألق ، السوبر فوكسل = تجميع الفلور في الفضاء ثلاثي الأبعاد ، اكتشاف الحدث = حركية الارتفاع / الاضمحلال ، الأحداث النظيفة = نسبة الإشارة إلى الضوضاء ، ودمج الأحداث = الفصل الزمني للأحداث. - افحص بصريا أحداث Ca2+ المكتشفة (يتم تراكبها تلقائيا على الصور المسجلة الأصلية). إذا لزم الأمر ، اضبط إعدادات المعلمات لخطوط أنابيب التحليل من خلال النظر في جودة الصورة من حيث المعلمات المذكورة أعلاه ؛ إذا كانت جودة الصورة لمعلمة معينة جيدة، فقد يتم تعيين عتبة أعلى، والعكس صحيح.
- بمجرد اكتشاف جميع أحداث Ca2+ بشكل مناسب ، قم بتمييز هذه الأحداث داخل بيئة MATLAB الرئيسية على النحو التالي (الخطوات 6.8-6.14):
- تصدير ملفات إخراج تحليل AQuA.
ملاحظة: يتم توفير شرح مفصل حول ملفات الإخراج والميزات المستخرجة المستخدمة لتعريف أحداث Ca2+ والمعلمات الأساسية لهذه الميزات المستخرجة في وثائق AQuA. - (اختياري) صنف جميع أحداث Ca2+ إلى مجموعتين: 1) الأحداث التي تبدأ من Soma ، و 2) الأحداث التي تبدأ في العمليات.
- قم بالوصول إلى سعة أحداث Ca2+ الفردية ضمن بنية res.dffMat MATLAB لملف إخراج تحليل AQuA (ملف .mat).
- اشتقاق تكرار أحداث Ca2+ الفردية باستخدام عملية res.fts.loc.x3D MATLAB (مكتبة AQuA).
- اشتقاق مدة أحداث Ca2+ الفردية باستخدام عملية MATLAB res.fts.curve.width11 (مكتبة AQuA).
- اشتقاق مساحة أحداث Ca2+ الفردية باستخدام عملية MATLAB res.fts.basic.area (مكتبة AQuA).
- صنف جميع أحداث Ca2+ على النحو التالي: 1) الأحداث المحلية ، 2) الأحداث التكاثرية التي تنتقل نحو سوما ، و 3) الأحداث التكاثرية التي تسافر بعيدا عن سوما. للقيام بذلك ، استخدم عمليات res.fts.region.landmarkDir.chgTowards و res.fts.region.landmarkDir.chgAway MATLAB (مكتبة AQuA) (الشكل 3C).
النتائج
في الفئران المعدلة وراثيا التي تعبر حصريا عن GCaMP6 (بروتين الفلورسنت الحساس لCa 2 +) في الخلايا الدبقية الصغيرة ، نلاحظ عادة أنماطا متنوعة من نشاط الخلايا الدبقية الصغيرة Ca2+ (الشكل 2 أ). الأهم من ذلك ، حتى داخل الخلايا الدبقية الصغيرة ، يمكن أن تختلف أنماط نشاط Ca2+ بشكل كبير بين العمليات.
لتحديد هذه الاختلافات من عملية إلى عملية في الديناميكيات الزمانية المكانية لنشاط الخلايا الدبقية الصغيرة Ca2+ ، يجب أولا تحديد المناطق المستقرة ثم تقسيمها إلى عائد استثمار مجزأ بدقة (الشكل 2 ب ، ج). لكل عائد استثمار ، يجب اشتقاق معلمات نشاط Ca2+ وقياسها كميا ، مثل السعة والتردد ، عن طريق استخراج ميزات مثل السعات المحلية والمنحدرات النزرة من السلسلة الزمنية لشدة التألق (الشكل 2D-G).
بعد ذلك ، يجب فحص أحداث Ca2+ الفردية من خلال تطبيق خوارزمية القياس الكمي الدقيقة AQuA (الشكل 3 أ). من هذه التحليلات القائمة على الأحداث ، عادة ما يتم ملاحظة اختلافات شاسعة في خصائص الأصل والسعة والمدة والموقع واتجاه التدفق لأحداث Ca2+ الفردية (الشكل 3 ب). إذا كان التركيز على تحليل ديناميكيات نشاط Ca2 + في عمليات الخلايا الدبقية الصغيرة ، فإن مخطط تصنيف الأحداث المحلية والأحداث التي تنتقل نحو سوما والأحداث التي تنتقل بعيدا عن سوما يكون مفيدا (الشكل 3 ج).
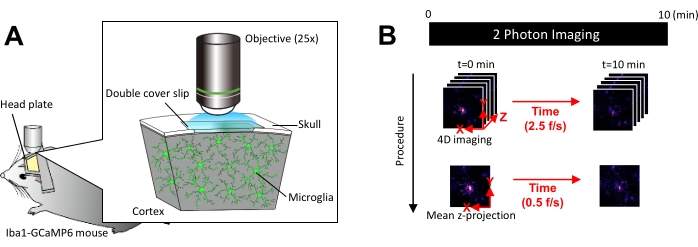
الشكل 1: الإعداد التجريبي للتصوير في الجسم الحي للخلايا الدبقية الدقيقة Ca2+ . (أ) الإعداد التجريبي. ماوس Iba1-tTA × tetO-GCaMP6 مع تعبير GCaMP6 خاص بالخلايا الدبقية الصغيرة. عن طريق إدخال نافذة قحمية في جمجمة الفأر ، يمكن ملاحظة نشاط الخلايا الدبقية الصغيرة Ca2+ في الجسم الحي باستخدام الفحص المجهري ثنائي الفوتون. (ب) الجدول الزمني التجريبي وإجراءات التحليل. يتم الحصول على صور 4D لمدة 10 دقائق على الأقل كمكدسات z بخمسة إطارات. معدل الحصول على الرتل هو 2.5 إطار/ثانية. قبل تحليل نشاط الخلايا الدبقية الدقيقة Ca2 + ، يتم تحويل مكدسات z المكونة من خمسة إطارات إلى إسقاطات z ثنائية الأبعاد عن طريق أخذ متوسط (أو الحد الأقصى) الشدة. معدل تشغيل الإسقاط z هو 0.5 إطار/ثانية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
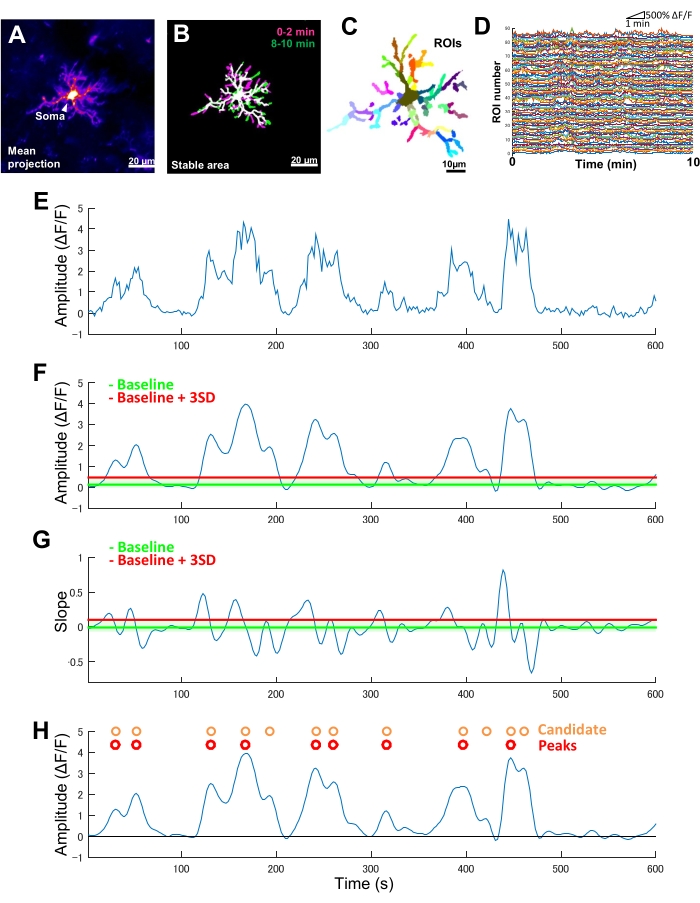
الشكل 2: التحليل القائم على عائد الاستثمار لنشاط الخلايا الدبقية الصغيرة Ca2+ . (أ) متوسط إسقاط شدة GCaMP6 على مدى 10 دقائق للخلايا الدبقية الصغيرة الفردية. (ب) يتم تحديد المناطق المستقرة (الأبيض) من خلال تراكب من إسقاطات t ذات كثافة GCaMP6 ذات الثنائية المستمدة من عينات مدتين تم التقاطها في بداية (أرجواني) ونهاية (أخضر) فترة التصوير. (ج) تقسم المناطق المستقرة أيضا إلى عائد استثمار إقليمي. تشير الألوان الفردية إلى عائد الاستثمار الفردي. (د) آثار ΔF / F لجميع عائد الاستثمار الفردي في C. لاحظ التباين في أنماط النشاط بين عائد الاستثمار. (ه) التتبع الأصلي لسلسلة زمنية ΔF / F مشتقة من قيم الشدة المطلقة لعائد استثمار واحد. (و) نفس السلسلة الزمنية ΔF / F بعد ترشيح التمرير المنخفض. يتم الكشف عن أحداث Ca2+ المرشحة من خلال عتبة قطع السعة (الخط الأحمر) المعرفة على أنها خط الأساس + ثلاثة SDs. يتم تعريف خط الأساس (الخط الأخضر) على أنه القيمة المتوسطة عبر السلسلة الزمنية ΔF / F بأكملها داخل سقف علوي وسفلي يستبعد الحد الأقصى والحد الأدنى 10٪ من قيم ΔF / F . (G) تتبع المنحدر المستمد من السلاسل الزمنية ΔF/F المفترضة في F. يتم فرز أحداث Ca2+ الحقيقية من أحداث Ca2+ المرشحة بناء على عتبة قطع المنحدر (الخط الأحمر) المحددة على أنها خط الأساس + ثلاثة SDs. يعرف خط الأساس (الخط الأخضر) بأنه متوسط القيمة عبر السلاسل الزمنية للمنحدر بأكملها داخل سقف علوي وسفلي يستبعد الحد الأقصى والحد الأدنى ل 10٪ من قيم الانحدار. (ح) يشار إلى أحداث Ca2+ المرشحة المحددة بواسطة معايير السعة في F باللون البرتقالي. أحداث Ca2+ الحقيقية مرتبة من أحداث Ca2+ المرشحة حسب معايير الانحدار في G باللون الأحمر. لاحظ أنه تم دمج بعض أحداث Ca2+ المرشحة بناء على معايير المنحدر. يتم تراكب السلسلة الزمنية ΔF / F المقابلة التي تمت تصفيتها أدناه كمرجع. يشير الخط الأسود إلى السعة الصفرية (ΔF / F). يتم اشتقاق متوسط والحد الأقصى للسعة لأحداث Ca2+ الحقيقية كمتوسط وأقصى للقمم المقابلة لها في السلسلة الزمنية ΔF / F التي تمت تصفيتها. يتم اشتقاق التردد (الأحداث / الدقيقة) على أنه عدد أحداث إطلاق Ca2+ الحقيقية مقسوما على فترة التصوير (10 دقائق). أشرطة المقياس = 20 ميكرومتر (A ، B) ، 10 ميكرومتر (C). الاختصار: عائد الاستثمار = منطقة الاهتمام. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
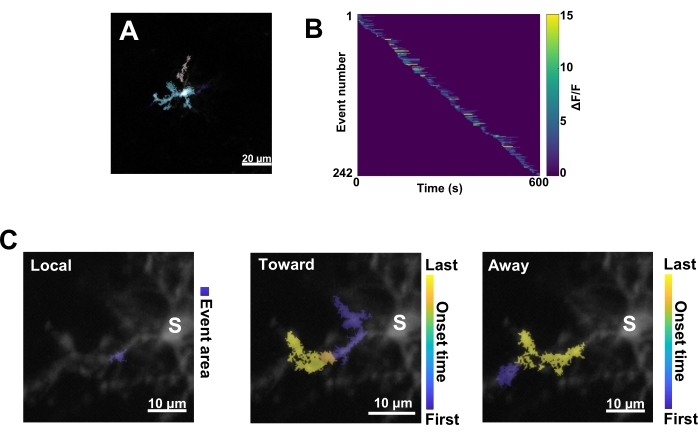
الشكل 3: التحليل القائم على الحدث لنشاط الخلايا الدبقية الصغيرة Ca2+. (أ) صور تمثيلية للأحداث المكتشفة باستخدام خوارزمية AQuA. تشير الألوان إلى مناطق الأحداث الفردية التي تم اكتشافها في نقطة زمنية معينة. (ب) نشاط Ca2+ التمثيلي (ΔF / F) في الأحداث الفردية مرتبة حسب ترتيب الظهور. يشير الشريط الأيمن إلى ΔF / F. (C) آثار النشاط التمثيلية للأحداث التي تنتشر باتجاه سوما أو الأحداث المحلية وبعيدا عنها. بالنسبة للأحداث المحلية، يظهر شكل الحدث باللون الأزرق. بالنسبة لأحداث الانتشار ، يشار إلى وقت بدء الحدث بمقياس أزرق أصفر. نظرا لأن AQuA يكتشف في البداية أحداث Ca2+ بشكل فردي ، يتم تحديد الأحداث الانتشارية لاحقا بناء على المواقع المكانية المتداخلة والسلاسل الزمنية لأحداث Ca2+ الفردية المتعددة. لاحظ أن هذا هو نفس الفرع الشجيري المستخدم لتحليل عائد الاستثمار في الشكل 2E-H. أشرطة المقياس = 20 ميكرومتر (A) ، 10 ميكرومتر (C). الاختصار: عائد الاستثمار = منطقة الاهتمام. S = سوما. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تقدم هذه الورقة نهجا محسنا لتصوير نشاط الخلايا الدبقية الدقيقة Ca2+ بدقة زمانية مكانية عالية. هذه الطريقة حساسة بما يكفي للكشف عن أنواع مختلفة من نشاط الخلايا الدبقية الصغيرة Ca2+ على مستوى العمليات المتشعبة المفردة ، والتمييز بسهولة بين الأحداث المحلية والانتشارية.
في الطريقة العامة للتصوير ثنائي الفوتون في الجسم الحي لنشاط الخلايا الدبقية الصغيرة Ca2+ ، يجب إيلاء اهتمام دقيق للنقاط التالية لزيادة جودة التصوير. أولا ، نظرا لأن الخلايا الدبقية الصغيرة حساسة للغاية للإصابة ، فمن المهم تقليل اللمس المباشر لسطح الدماغ بالأدوات الجراحية أثناء الجراحة. المؤشرات الرئيسية على إجراء الجراحة بكفاءة هي الأوعية الدموية السليمة والجافية والحد الأدنى من النزيف أثناء الجراحة. ثانيا ، يؤدي التثبيت الآمن للوحة الرأس بجمجمة الماوس والتلامس الجيد بين الانزلاق المزدوج وسطح الدماغ إلى تقليل القطع الأثرية المرتبطة بالحركة بشكل كبير أثناء التصوير. هذا مهم بشكل خاص عند التصوير بدقة مكانية زمانية عالية وفي الفئران المستيقظة تماما. في حين أن خط أنابيب التحليل يعوض بشكل موثوق عن القطع الأثرية المتعلقة بالحركة الناشئة عن نبضات القلب والتنفس والانجراف العام ، إلا أنه أقل قوة عند التعامل مع التشوهات الهندسية الكبيرة التي تنشأ عن الحركات الكبيرة المفاجئة.
تقدم طريقتا التحليل الموصوفتان هنا مزايا مختلفة وتناسبتان لأسئلة البحث المختلفة. في التحليل المستند إلى عائد الاستثمار ، يقوم المستخدم مسبقا بتحديد عائد الاستثمار (مثل العمليات الفردية) ، مما يسمح باستخراج الديناميكيات الإجمالية لنشاط Ca2+ لعائد الاستثمار هذا. وبالتالي ، فهو أكثر ملاءمة للحالات التي يتوقع فيها أن يتم توطين الظواهر في منطقة تحت الخلوية التي لها حدود مورفولوجية محددة جيدا ومساحة كبيرة نسبيا (أي فرع عملية). في التحليل القائم على الأحداث ، يتم تعريف الأحداث الفردية بناء على الديناميكيات الزمانية المكانية لنشاط الخلايا الدبقية الصغيرة Ca2+ نفسه ويجب بعد ذلك وضعها في سياق المعالم المحددة من قبل المستخدم داخل الخلايا الدبقية الصغيرة لتفسير وظيفتها. وبالتالي ، فهو أكثر ملاءمة للحالات التي لا يمكن فيها وضع افتراضات حول توطين الظواهر أو حيث يكون مجال الاهتمام صغيرا نسبيا (أي نصيحة عملية). على هذا النحو ، يوفر التحليل القائم على الأحداث دقة زمانية مكانية محسنة عند توصيف نشاط الخلايا الدبقية الصغيرة Ca2+ مقارنة بالطرق السابقة.
في هذه الفئران ، فإن علامة الفلورسنت الوحيدة التي تعبر عنها الخلايا الدبقية الصغيرة هي مؤشر Ca2+ GCaMP6. وبالتالي ، في المناطق التي يكون فيها نشاط Ca2+ منخفضا ، يجب استخراج مورفولوجيا الخلايا الدبقية الصغيرة من خلال الجمع بين أطر زمنية متعددة ، والتي يمكن أن تؤدي إلى تدهور الدقة الزمنية. ومع ذلك ، يمكن التغلب على هذا القيد عن طريق التعبير عن بروتين فلوري أحمر ثابت منفصل في الخلايا الدبقية الصغيرة. والجدير بالذكر أن الفيروسات الجديدة المرتبطة بالغدة القادرة على نقل الخلايا الدبقية الصغيرة قد تم وصفهامؤخرا 23،24،25.
كيف يتم تغيير نشاط الخلايا الدبقية الصغيرة Ca2+ بواسطة البيئة المحيطة هو موضوع ناشئ مثير للاهتمام. على وجه الخصوص ، يبدو أن نشاط الخلايا الدبقية الصغيرة Ca2+ يظهر ارتباطات كبيرة مع النشاط العصبي ، على الرغم من أن الأهمية الوظيفية لهذا لم يتم تمييزها بدقة بعد. وبالتالي ، فإن الجمع بين التلاعب بالنشاط العصبي وطرق التصوير والتحليل لنشاط الخلايا الدبقية الدقيقة Ca2+ المعروض هنا يجب أن ينتج عنه رؤى جديدة في فسيولوجيا الخلايا الدبقية الدقيقة وتعزيز فهمنا للأدوار التي تلعبها الخلايا الدبقية الصغيرة في الحالات الفسيولوجية والمرضية.
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح المرتبطة بهذه المخطوطة.
Acknowledgements
نحن ممتنون للبروفيسور كينجي تاناكا (جامعة كيو ، طوكيو ، اليابان) لتزويدهم بالفئران Iba1-tTA وفئران tetO-GCaMP6. تم دعم هذا العمل من قبل Grants-in-Aid for Young Scientists (B) [16K19001 (إلى H.H.)] ، والمنح في المعونة للعلماء في بداية حياتهم المهنية [18K14825 (إلى H.H.)] ، ومنحة المعونة للبحث العلمي (B) [21H03027 (إلى H.H.)] ، ومنحة المعونة لمجالات البحث التحويلية (A) [21H05639 (إلى H.H.)] ، ومنحة المعونة للبحث العلمي (A) [17H01530 ، 20H00500 (إلى JN)] ، ومنحة JST CREST [JPMJCR1755 (إلى JN)] ، اليابان.
Materials
| Name | Company | Catalog Number | Comments |
| 2% xylocaine jelly | AstraZeneca, UK | ||
| B6(129S6)-Tg(Aif1-tTA)54Kftnk | RIKEN RBC, Japan | RBRC05769 | Iba1-tTA mice |
| B6;129-Actb(tm3.1(tetO-GCaMP6)Kftnk) | RIKEN RBC, Japan | RBRC09552 | tetO-GCaMP6 mice |
| Forceps | Fine science tools, US | 13008-12 | |
| G-CEM ONE | GC corporation, Japan | ||
| Glass capillary | Narishige, Japan | GDC-1 | |
| ImageJ | NIH, US | ||
| Isofulrane | Pfizer, US | ||
| Ketamin | Daiichi-Sankyo, Japan | ||
| Kwik-sil | World Precision Instruments, US | KWIK-SIL | |
| MATLAB, 2020a | MathWorks, US | ||
| Micro cover glass (2 x 2 mm, No.3) | Matsunami, Japan | custum-made | Bottom glass for cranial window |
| Micro cover glass (3 x 3 mm, No.0) | Matsunami, Japan | custum-made | Upper glass for cranial window |
| N25X-APO-MP | Nikon, Japan | N25X-APO-MP | Objective lens (25x) |
| Norland optical adhesive | Edmund optics, US | 6101 | |
| Piezo nano-positioning system, Nano-Drive | Mao City Labs, US | ||
| Razor blade | Feather, Japan | FA-10 | |
| Scissors | Fine science tools, US | 14060-11 | |
| Steel drill | Minitor, Japan | BS1201 | |
| Stereotaxic instruments | Narishige, Japan | SR-5M-HT | |
| Super-bond (C&B kit) | Sun Medical, Japan | 4560227797382 | |
| Surgical needle hook | Fine science tools, US | 10065-15 | |
| Ti:Sappire laser, MaiTai DeepSee | Spectra Physics, US | Mai Tai eHP DS | |
| Tweezers | Fine science tools, US | 11051-10 | |
| Tweezers | Fine science tools, US | 11255-20 | |
| Two-photon microscope | Nikon, Japan | A1R-MP | |
| UV craft resin | Kiyohara, Japan | UVR | |
| Xylazine | Bayer, Germany |
References
- Miyamoto, A., et al. Microglia contact induces synapse formation in developing somatosensory cortex. Nature Communications. 7, 12540 (2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Cserep, C., et al. Microglia monitor and protect neuronal function through specialized somatic purinergic junctions. Science. 367 (6477), 528-537 (2020).
- Kato, G., et al. Microglial contact prevents excess depolarization and rescues neurons from excitotoxicity. eNeuro. 3 (3), (2016).
- Li, Y., Du, X. -. F., Liu, C. -. S., Wen, Z. -. L., Du, J. -. L. Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo. Developmental Cell. 23 (6), 1189-1202 (2012).
- Tremblay, M. -. E., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. Plos Biology. 8 (11), 1000527 (2010).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. The Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Oppenheim, R. W. Cell death during development of the nervous system. Annual Review of Neuroscience. 14 (1), 453-501 (1991).
- Sierra, A., Abiega, O., Shahraz, A., Neumann, H. Janus-faced microglia: beneficial and detrimental consequences of microglial phagocytosis. Frontiers in Cellular Neuroscience. 7, 6 (2013).
- Brawek, B., et al. A new approach for ratiometric in vivo calcium imaging of microglia. Scientific Reports. 7 (1), 6030 (2017).
- Eichhoff, G., Brawek, B., Garaschuk, O. Microglial calcium signal acts as a rapid sensor of single neuron damage in vivo. Biochimica et Biophysica Acta. 1813 (5), 1014-1024 (2011).
- Liu, L., et al. Microglial calcium waves during the hyperacute phase of ischemic stroke. Stroke. 52 (1), 274-283 (2021).
- Pozner, A., et al. Intracellular calcium dynamics in cortical microglia responding to focal laser injury in the PC::G5-tdT reporter mouse. Frontiers in Molecular Neuroscience. 8, 12 (2015).
- Umpierre, A. D., et al. Microglial calcium signaling is attuned to neuronal activity in awake mice. Elife. 9, e56502 (2020).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. Plos One. 7 (12), e51286 (2012).
- Tanaka, K. F., et al. Expanding the repertoire of optogenetically targeted cells with an enhanced gene expression system. Cell Reports. 2 (2), 397-406 (2012).
- Liu, Y. U., et al. Neuronal network activity controls microglial process surveillance in awake mice via norepinephrine signaling. Nature Neuroscience. 22 (11), 1771-1781 (2019).
- Stowell, R. D., et al. Noradrenergic signaling in the wakeful state inhibits microglial surveillance and synaptic plasticity in the mouse visual cortex. Nature Neuroscience. 22 (11), 1782-1792 (2019).
- Sun, W. L., et al. In vivo two-photon imaging of anesthesia-specific alterations in microglial surveillance and photodamage-directed motility in mouse cortex. Frontiers in Neuroscience. 13, 421 (2019).
- Evangelidis, G. D., Psarakis, E. Z. Parametric image alignment using enhanced correlation coefficient maximization. IEEE Transactions on Pattern Analysis and Machine Intelligence. 30 (10), 1858-1865 (2008).
- Rosario, A. M., et al. Microglia-specific targeting by novel capsid-modified AAV6 vectors. Molecular Therapy. Methods & Clinical Development. 3, 16026 (2016).
- Maes, M. E., Wogenstein, G. M., Colombo, G., Casado-Polanco, R., Siegert, S. Optimizing AAV2/6 microglial targeting identified enhanced efficiency in the photoreceptor degenerative environment. Molecular Therapy. Methods & Clinical Development. 23, 210-224 (2021).
- Lin, R., et al. Directed evolution of adeno-associated virus for efficient gene delivery to microglia. Nature Methods. 19 (8), 976-985 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved