Method Article
Tek Hücre Çözünürlüğünde Mikroglial Ca2+ Aktivitesinin Uzay-Zamansal Analizi
Bu Makalede
Özet
Bu yazıda, mikroglial Ca2+ aktivitesinin in vivo görüntülenmesi ve ardından uzay-zamansal dinamiklerinin analizi için bir protokol tanımlanmıştır. Bu yöntem, mikroglia'nın beyin ortamındaki değişikliklere nasıl tepki verdiğinin kapsamlı bir şekilde karakterize edilmesini sağlar ve bu tür olayların meydana geldiği ince uzay-zamansal ölçekleri uygun şekilde yakalar.
Özet
Mikroglia, merkezi sinir sistemindeki tek yerleşik bağışıklık hücreleridir. Morfolojileri oldukça plastiktir ve aktivitelerine bağlı olarak değişir. Homeostatik koşullar altında, mikroglia oldukça dallanmış bir morfolojiye sahiptir. Bu, süreçlerinin sürekli olarak uzatılması ve geri çekilmesi yoluyla çevredeki ortamı izlemelerini kolaylaştırır. Bununla birlikte, beyin hasarı ve iltihaplanma sırasında, mikroglia aktive olur ve dramatik morfolojik değişikliklere uğrar, dallanmış süreçlerini geri çeker ve hücre gövdelerini şişirir. Bu, mikroglia'nın beyin ortamını daha az patolojik bir duruma yönlendirmek için üstlendiği göç ve fagositoz gibi aktiviteleri kolaylaştırır.
Mikroglial morfoloji ve aktivitelerindeki değişiklikler arasındaki bu yakın ilişki, çeşitli mikroglial fonksiyonlar hakkında önemli bilgiler sağlamıştır. Bununla birlikte, bu tür morfolojik ve aktivite değişikliklerinin kendileri, herhangi bir sayıda hücre içi sinyal yolundan kaynaklanabilecek fenomenlerdir. Dahası, uyaran ve tepki arasındaki zaman gecikmesi ve mikroglia'nın oldukça bölümlere ayrılmış morfolojisi, işlevi destekleyen nedensel mekanizmaları izole etmeyi zorlaştırır. Bu sorunu çözmek için, son derece hassas bir floresan Ca2 + indikatör proteininin mikroglia cinsinden spesifik olarak ifade edildiği genetik olarak değiştirilmiş bir fare hattı geliştirdik.
Bu makale, in vivo mikroglial Ca2+ görüntüleme yöntemlerini açıkladıktan sonra, bu Ca2+ aktivitesini rasyonel olarak tanımlanmış hücre altı bölgelere sınıflandıran ve böylece kodlanmış bilgilerin uzamsal ve zamansal boyutlarının anlamlı bir şekilde çıkarılmasını sağlayan yapılandırılmış bir analiz yaklaşımı sunmaktadır. Bu yaklaşımın, hem yüksek beyin fonksiyonları hem de patolojik durumlarla ilişkili çeşitli mikroglial aktiviteleri yöneten hücre içi sinyalleşme kurallarının ayrıntılı bir şekilde anlaşılmasını sağlayacağına inanıyoruz.
Giriş
Mikroglia, merkezi sinir sisteminde (CNS) yerleşik bağışıklık hücreleridir ve homeostatik bir beyin ortamının korunmasında ve beyin gelişimi sırasında nöral devre oluşumunun düzenlenmesinde önemli roller oynar 1,2. CNS'deki mikroglia'nın benzersiz bir özelliği, morfolojilerinin oldukça plastik olmasıdır; Bununla birlikte, farklı morfolojik fenotipler belirli işlevlerle ilişkilendirilebilir. Ayrıca, morfolojik fenotipler arasındaki dönüşüm oldukça dinamiktir ve çevredeki ortamdaki değişikliklere yanıt olarak hızlı zaman ölçeklerinde meydana gelir 3,4.
Homeostatik fizyolojik koşullar altında, mikroglia, her yöne dışa doğru yayılan çoklu süreçlerle yüksek oranda dallanmış bir morfoloji alır. Bu dallanmış süreçlerin kendileri, sürekli olarak uzayan ve geri çekilen yüksek hareketlilik gösterir 3,4. Bu tür bir aktivite, öncelikle nöronal aktiviteyi izlemek için nöronal sinapslar, aksonlar ve somalarile periyodik temasa yöneliktir 5,6,7,8,9. Bununla birlikte, beyin yaralandığında, mikroglia bu anormalliği hızlı bir şekilde tespit eder ve uyarlanabilir tepkilerinin ilk adımı olarak, süreçlerinin uzantısını ilgili yerel ayarayönlendirir 3,4. Mikrogliaların ölü hücrelerin ve metabolitlerin fagositozunu üstlenmesi gerektiğinde, immünolojik olarak aktive edilmiş fenotipegeçişlerinin bir parçası olarak amip benzeri bir morfoloji alırlar, süreçlerini kısaltırlar ve hücre gövdelerini genişletirler 10,11.
Bununla birlikte, mikroglial süreçlerin dramatik morfolojik değişiklikleri kolayca tespit edilirken, hücre somasındaki daha ince ölçekli değişikliklerin, özellikle fizyolojik olarak ilgili zamansal bir çözünürlükte yakalanması önemli ölçüde daha zordur. Ayrıca, morfolojik değişikliklerin kendileri yalnızca herhangi bir sayıda hücre içi sinyal yolunun entegre sonucunu temsil eder. Bu, işlevsel aktiviteyi izleme ve bir uyaranı kışkırttığı nihai tepkiyle mekanik olarak ilişkilendirme hedefi için sorunludur.
İkinci bir haberci olarak yaygın rolü göz önüne alındığında, hücre içi Ca2 + dinamiklerini incelemek, dinamik hücre süreçlerini incelerken ilişkili uzay-zamansal bilgileri daha iyi yakalar. Böyle bir yaklaşım, aşağı akış hücre içi Ca2 + yükselmesine bağlı çeşitli iyonotropik ve metabotropik reseptörleri eksprese ettikleri göz önüne alındığında mikroglia için geçerlidir. Gerçekten de, in vivo Ca2+ görüntüleme, mikroglial aktivitelerin uzay-zamansal yönlerini gerçek zamanlı olarak karakterize etmek için kullanılmış, mikroglial Ca2+ aktivitesindeki değişiklikleri beyin hasarı, iltihaplanma ve nöronlardaki hem hiper hem de hipoaktivite ile başarılı bir şekilde ilişkilendirmiştir 12,13,14,15,16. Örneğin, hiper / hipoaktif nöronal aktiviteye yanıt olarak mikroglial süreç uzantısı ile ilişkili Ca2 + yükselmeleri, muhtemelen altta yatan Ca2 + bağımlı aktin polimerizasyon sürecini16 yansıtır. Ayrıca, in vivo Ca2+ görüntüleme de farmakolojik yaklaşımlarla kolayca birleştirilebilir. Örneğin, mikroglia hem P2X (iyonotropik) hem de P2Y (metabotropik) reseptörleri eksprese ederken, P2Y agonistlerinin lokal uygulaması, hasarlı komşu nöronlara13 mikroglial Ca2 + yanıtını taklit eder ve ardından duyarsızlaştırır, böylece P2Y sinyalinin nöronal hasar tespiti ile daha fazla ilgisi olduğunu ima eder.
Bugüne kadar, mikroglial Ca2+ aktivitesini inceleyen önceki raporlarda ilgi alanı (ROI) tabanlı analiz yöntemleri kullanılmıştır. Bu yaklaşımların bir dezavantajı, Ca2 + aktivitesinin uzay-zamansal dinamiklerini bireysel mikroglial süreçler düzeyinde çözebilmek için hala çok kaba olmalarıdır. Bu nedenle, bu protokol hem mikroglial Ca2+ aktivitesini analiz etmek için geleneksel ROI tabanlı yöntemleri hem de mikroglial süreçlerde bireysel Ca2+ olaylarını çıkarabilen daha yeni olay tabanlı yaklaşımları açıklar. Bundan önce, ayrıntılı analiz için mikroglial Ca2+ aktivitesini uygun şekilde yakalamak için in vivo iki fotonlu görüntüleme için genel bir kılavuz sunuyoruz.
Protokol
Tüm hayvan deneyleri, Ulusal Fizyolojik Bilimler Enstitüsü Hayvan Araştırma Komiteleri tarafından onaylandı ve Ulusal Sağlık Enstitüleri yönergelerine uygun oldu. Tüm deneyler için, 8-10 haftalık erkek fareler, yiyecek ve suya ad libitum erişimi ile 12/12 saatlik bir aydınlık / karanlık döngüsü altında yetiştirildi. Mikrogliadaki Ca2+ aktivitesini görselleştirmek için, iyonize Ca2 + bağlayıcı adaptör molekülü 1 (Iba1) -tetrasiklin transaktivatörü (Iba1-tTA) fareleri, tetrasiklin operatörü-GCaMP6 (tetO-GCaMP6) fareleri17,18 ile çaprazlandı. Bu nedenle, tetrasiklin-analog takviyesinin yokluğunda, Iba1 promotörü, yalnızca mikroglia'da GCaMP6'nın ekspresyonunu yönlendirir. Tüm deneyler için, doksisiklin diyet takviyesi doğumdan 6 hafta sonra durduruldu. Tüm deneylerin sonunda, farelere aşırı dozda izofluran ve ardından servikal çıkık ile ötenazi yapıldı. Bu protokolde kullanılan tüm malzemeler, hayvanlar ve reaktiflerle ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. İn vivo iki fotonlu görüntüleme için farelerin cerrahi hazırlığı; 1. Gün
- Steril çalışma koşullarını korumak için tüm cerrahi prosedürleri laminer bir hava akış kabini içinde gerçekleştirin. Ameliyata başlamadan önce kabinin içini 5 dakika UV ışığı ile sterilize edin.
- Tüm çalışma yüzeylerini, ameliyat çerçevesini ve stereotaksik aletleri %70 etanol ile silerek sterilize edin.
- Tüm cerrahi aletleri (makas, forseps, tıraş bıçağı, cımbız) ve farenin kafatasına takılacak özel yapım kafa plakasını %1'lik klorheksidin glukonat solüsyonuna batırarak sterilize edin.
- Fareyi ketamin (7.4 mg kg-1, intraperitoneal [ip]) ve ksilazin (10 mg kg-1, ip) ile uyuşturun. Anestezi tutana kadar ev kafesine geri koyun. Ayak parmağı kıstırma refleksinin kaybıyla anestezinin tam indüksiyonunu onaylayın.
- Saç derisini% 1 klorheksidin glukonat ile sterilize edin. Kürkü bir jiletle tıraş edin.
- Fareyi stereotaksik aletlerle ameliyat çerçevesi içinde sabitleyin.
- Anestezi altındayken kuruluğu önlemek için gözlere veteriner merhemi sürün.
- Ağrı yönetimi için kafa derisine %2 ksilokain jöle uygulayın. 5 dk bekleyin.
- Kafa derisini makasla çıkarın ve kafatasını ortaya çıkarın. Periosteumu temizleyin ve açıkta kalan kafatası yüzeyini pamuklu çubuklarla ovalayarak kurulayın.
NOT: Özel yapım kafa plakası ile güçlü bir bağ sağlamak için açıkta kalan kafatası alanları tamamen kuru olmalıdır. - Özel yapım kafa plakasını diş çimentosu ile kafatasına sabitleyin.
- Çimento sertleştikten sonra, kafatası yüzeyi ile özel yapım kafa plakasının sınırları arasındaki boşlukları ilave diş çimentosu ile doldurun.
- Akrilik esaslı diş yapıştırıcı reçine çimentosu uygulayarak çimento ve kafatası yüzeylerini su geçirmez hale getirin.
- Fareyi bir ısıtma pedine yerleştirerek ev kafesine geri koyun. Fareyi, sternal yaslanmayı sürdürmek için yeterli bilinci geri kazanana kadar izleyin (2 saat içinde).
NOT: Fareler ertesi gün tamamen iyileşmiş olmalı ve daha sonra diğer hayvanlarla birlikte barındırılabilir.
2. İn vivo iki fotonlu görüntüleme için farelerin cerrahi hazırlığı; 2. Gün
- Steril çalışma koşullarını korumak için tüm cerrahi prosedürleri laminer bir hava akış kabini içinde gerçekleştirin. Ameliyata başlamadan önce kabinin içini 5 dakika UV ışığı ile sterilize edin.
- Farklı boyutlarda iki cam lamele (üst cam: 3 mm × 3 mm; alt cam: 2 mm × 2 mm) UV ile kürlenebilen optik sınıf reçine ile lamine edin.
NOT: Çift lamel karma, kronik optik erişim sağlarken kraniyal pencerenin açığa çıkardığı beyin bölgesine uzun süreli koruma sağlar. Böylece boyutları, görüntülenecek beyin bölgesine uyacak şekilde değiştirilebilir. - Tüm çalışma yüzeylerini ve ameliyat çerçevesini %70 etanol ile silerek sterilize edin.
- Tüm cerrahi aletleri (çelik matkap, cımbız, cerrahi iğne kancası) %1'lik klorheksidin glukonat solüsyonuna daldırarak sterilize edin.
- Fareyi izofluran ile uyuşturun (% 4 indüksiyon,% 1.2 -% 1.5 bakım). Fareyi kafa plakası aracılığıyla ameliyat çerçevesi içine sabitleyin.
- Birincil motor korteks üzerinde bir kraniyal pencere yapmak için, Bregma kafatası dönüm noktasının 0,2 mm önünde ve 1 mm yanal olarak 2 mm × 2 mm merkezli bir kare işaretleyin.
- Çelik matkabı kullanarak kafatasını işaretli karenin kenarı boyunca inceltin.
NOT: İstenilen kalınlığa yaklaştığında incelmiş kafatası olan bölgeler tuzlu su ile ıslatıldığında şeffaf görünecek ve kılcal çatlaklar oluşmaya başlayacaktır. - İşaretli karenin tüm kenarlığının uygun şekilde inceltildiğini onayladıktan sonra, cerrahi iğne kancasını kafatası yüzeyinin hemen altına, ucunu karenin merkezine doğru yönlendirerek dikkatlice yerleştirin. Kare kafatası parçasını kancayla nazikçe kaldırın ve kafatasının geri kalanından soymak için cımbız kullanın. Kanama meydana gelirse, açıkta kalan beyin yüzeyini tamamen azalana kadar sürekli olarak tuzlu su ile yıkayın.
- Çift lamel açıkta kalan beyin yüzeyine yerleştirin ve daha küçük lamelin bulunduğu tarafı beyne doğru yönlendirin. Daha büyük lamel kenarlarının kafatası penceresinin kenarlarıyla temas halinde olduğundan emin olun.
- Bir manipülatöre monte edilmiş silikon uçlu bir cam çubuk kullanarak, beyin yüzeyi ile iyi temas ettiğinden emin olmak için çift lamel üzerine hafifçe bastırın.
- Çift lamel , kafatası ve beyin yüzeyi arasındaki boşluğu UV ile kürlenebilen reçine ile doldurun ve sertleşene kadar (~ 20 s) UV ışığı ile ışınlayın. Silikon uçlu cam çubuğu yavaşça çift lamel den kaldırın.
- Farenin iyileşmesine izin verin ve bir ısıtma pedine yerleştirin. Sternal yaslanmayı sürdürmek için yeterli bilinci yeniden kazanana kadar fareyi izleyin (30 dk).
- 3. adıma geçin veya fareyi ev kafesine geri koyun.
NOT: Yetkin bir ameliyattan sonra, dura ve alttaki tüm kan damarları kanama olmadan tamamen sağlam olacaktır. Bu durumda, iltihap minimaldir ve hemen 3. adıma geçmek mümkündür. Emin değilseniz, herhangi bir iltihabın tamamen çözüldüğünden emin olmak için 1-3 hafta bekleyin.
3. İn vivo iki fotonlu görüntüleme kullanarak veri toplama
- Lazerin ısınması ve stabilize olması için yeterli zamana sahip olduğundan emin olmak için görüntüleme kurulumunu önceden açın. Lazeri, GCaMP6 floroforunu en iyi şekilde uyaran iki foton spektrumu olan 920 nm dalga boyunda yayacak şekilde ayarlayın.
- Fareyi 25x mikroskop objektif merceğinin altına yerleştirin ve 30 dakika boyunca alıştırın. Gerekirse, görüntüleme sırasında fareyi izofluran ile uyuşturun (% 4 indüksiyon,% 1.2 -% 1.5 bakım).
NOT: İzofluran, mikroglial süreç motilitesini ve Ca2+ aktivitesini 19,20,21 etkilediği için bazı araştırma uygulamaları için uygun olmayabilir. - Yakınlaştırmayı 1x'e ayarlayın, ardından kraniyal pencere alanında GCaMP6'yı ifade eden microglia'yı arayın. Beyin yüzeyinin altında 100 μm ile 300 μm arasında bir derinlikte arama yapın.
- Uygun bir GCaMP6 eksprese eden mikroglia bulunduğunda, yakınlaştırmayı en üst düzeye çıkarın, böylece Ca2 + aktivitesi tek hücre çözünürlüğü ile yakalanabilir.
- Ca2+ aktivitesinin net bir şekilde yakalandığını görsel olarak onaylayın ve gerekirse lazer gücünü ve görüntüleme kazancını ayarlayın.
NOT: Foto ağartma ve mikroglia yaralanmasını önlemek için lazer gücü mümkün olduğunca en aza indirilmelidir. - Dört boyutlu (4D) görüntü alımını aşağıdaki gibi gerçekleştirin (adım 3.6.1-3.6.3; Şekil 1B):
- Görüntü boyutlarını XY alanı = 512 × 512 piksel, 0,25 μm/piksel olarak ayarlayın; Z alanı = beş z-düzlemi, 3 μmm; z-adımı (Şekil 1B).
- Çekim hızını 2,5 kare/sn olarak ayarlayın.
NOT: Bu hızda Z-tarama, bir piezo nano konumlandırma sistemi tarafından kolaylaştırılır. - En az 10 ayrı Ca2+ olayı gözlemlenene kadar (genellikle 10 dakika) veri toplayın.
4. Analiz için hazırlık (hareket düzeltme, ortalama/maks z-projeksiyon)
- Mikroglial Ca2+ aktivitesini analiz etmeye devam etmeden önce, MATLAB programlama ortamında (R2020a ) ECC görüntü hizalama algoritması 22'yi kullanarak hareketle ilgili artefaktlar (görüntü kaydı) için 4B görüntüleri düzeltin. Kodu şuradan indirin: https://www.mathworks.com/matlabcentral/fileexchange/27253-ecc-image-alignment-algorithm-image-registration.
- imregister MATLAB işlemini (standart görüntü işleme araç kutusu) kullanarak tüm görüntüleri ilk zaman dilimi içinde kaydederek bir referans 3D görüntü oluşturun.
- Sonraki tüm görüntüleri, ecc işlevini (ECC görüntü hizalama algoritması kitaplığı) kullanarak referans 3D görüntünün karşılık gelen z düzlemiyle eşleştirerek kaydedin.
- Ortalama MATLAB işlemini kullanarak kayıtlı görüntülerden ortalama yoğunlukta z-projeksiyonları oluşturun. Görüntüleme sinyali çok zayıfsa, maksimum MATLAB işlemini kullanmak yerine maksimum yoğunlukta z-projeksiyonları oluşturun.
NOT: Maksimum yoğunluk z-projeksiyonları kullanılırken sinyal-gürültü oranı daha kötüdür. - 5. veya 6. adımdan birine geçin. Adım 5 ve 6'da Ca2+ aktivitesinin uzay-zamansal dinamiklerini haritalamak için analizin hedefi olarak adım 4'te oluşturulan z-projeksiyonlarını kullanın.
5. Yatırım getirisine dayalı analiz
- Adım 4'te oluşturulan z-projeksiyonlarını kullanarak, aşağıdaki gibi Ca2+ aktivitesinin sonraki analizi için görüntüleme periyodu boyunca stabil bir alan profilini (stabil alan) koruyan mikroglial süreçleri tanımlayın (adım 5.3-5.6):
- Maksimum MATLAB işlemini kullanarak, görüntüleme periyodunun başında ve sonunda alınan 2 dakikalık örneklerden kayıtlı 4D görüntülerin ayrı maksimum yoğunluklu t-projeksiyonlarını oluşturun.
- İMBINARIZE MATLAB işlemini kullanarak görüntüleme periyodunun başlangıcına ve bitişine karşılık gelen mikroglial morfolojinin çokgenlerini oluşturmak için t-projeksiyonlarını ikili hale getirin. Otomatik olarak ayarlanan varsayılan eşiği kullanın.
NOT: Görüntüleme periyodunun başlangıcı ve bitişi sırasında Ca2+ sinyali zayıfsa, ikili oluşturma eksik kenarlıklı çokgenler oluşturabilir. Bu durumda, ImageJ'deki kalem aracını kullanarak eksik kenarlıkları manuel olarak çizin. - Imadd MATLAB işlemini kullanarak t-projeksiyon çokgenlerini üst üste bindirin. Çakışan bölge(ler) sabit alanı temsil eder (Şekil 2B).
- Belirlenen kararlı alanlarda, birincil mikroglial süreçlerin her biri ve belirgin ikinci dereceden alt dallar için ROI'leri manuel olarak tanımlamak ve izlemek için drawpolygon MATLAB işlemini kullanın.
- Tüm zaman dilimlerinde bireysel bir ROI boyunca ortalaması alınan mutlak floresan yoğunluklarını izleyin (Şekil 2C,D).
- Mutlak floresan yoğunluklarının zaman serisinden, denklem (1)'e göre floresan yoğunluğu (ΔF/F) zaman serisindeki nispi değişimi hesaplayın. Bu zaman serisi, bireysel ROI'ler düzeyinde normalleştirilmiş mikroglial Ca2+ dinamiklerini temsil eder.
ΔF/F = (F(t) - F0) / F0 (1)
burada F(t) belirli bir zamanda kaydedilen floresan yoğunluğudur ve F0, tüm zaman dilimlerinde floresan yoğunluğunun 10. yüzdelik dilimidir (Şekil 2E). - Belirli bir bireysel yatırım getirisinde meydana gelen aday Ca2+ ateşleme olaylarını aşağıdaki gibi tanımlayın (adım 5.5.1-5.5.3):
- fir1 MATLAB işlemini kullanarak ΔF/F zaman serisine tip I sonlu darbe tepkisi (FIR) alçak geçiren filtreleme uygulayın. Kesme frekansını Nyquist değerine ayarlayın (örnekleme hızının yarısı).
- Tek tek izleme tepe noktalarının, kayıtlı 2D görüntülerdeki Ca4 + aktivitesinin patlamalarına karşılık geldiğini doğrulamak için filtrelenmiş izlemeyi görsel olarak inceleyin (Şekil 2F).
- Aday Ca2+ ateşleme olaylarınıΔF/F zaman serisi izlemesinde içbükey aşağı çekimler olarak tanımlayın. Tüm zaman dilimlerinde maksimum ve minimum %10 genlikleri hariç tutan üst ve alt tavanlar içindeki medyan ΔF/F değeri olarak bir temel eşik tanımlayın. Temel eşiğin üzerinde üç SD'lik bir algılama eşiği tanımlayın (Şekil 2F,H).
- Adaylardan gelen gerçek Ca2+ ateşleme olaylarını aşağıdaki gibi tanımlayın (adım 5.5.1-5.5.2):
- Sayısal gradyan MATLAB işlemini kullanarak karşılık gelen filtrelenmiş ΔF/F zaman serisi çerçeveleri arasında ayrım yaparak her aday olayın eğimini hesaplayın.
- Ardından, profilin yükselme süresine bağlı olarak gerçek Ca2+ olaylarını tanımlayın. Tüm aday etkinliklerdeki eğim değerlerinin ortalaması olarak bir temel eşik tanımlayın. Temel eşiğin üzerinde üç SD'lik bir algılama eşiği tanımlayın (Şekil 2G,H).
- Gerçek Ca2+ olaylarını aşağıdaki gibi karakterize edin (adım 5.6.1-5.6.3):
NOT: Aşağıdakiler, mikroglial Ca2+ olaylarını karakterize etmek için kullanılabilecek parametrelerin kapsamlı bir listesi değildir. İlgilenilen parametreler çalışmanın amacına bağlıdır.- Gerçek bir Ca2+ ateşleme olayının maksimum genliğini, karşılık gelen ΔF/F zaman serisi çerçevesinin ΔF/F değeri olarak türetin.
- Gerçek bir Ca2+ ateşleme olayının ortalama genliğini, karşılık gelen ΔF/F zaman serisi çerçeve alt kümesinin tamamında ortalama ΔF/F değeri olarak türetin.
- Gerçek Ca2+ olaylarının sıklığını, olay sayısının görüntüleme süresine bölünmesiyle elde edin.
6. Olaya dayalı analiz
- MATLAB programlama ortamındaki AQuA kitaplığını kullanarak 4. adımdaki z-projeksiyonları üzerinde olay tabanlı analiz gerçekleştirin. Kodu şuradan indirin: https://github.com/yu-lab-vt/AQuA.
NOT: AQuA kitaplığı için genel bir kullanım kılavuzu şu adresten edinilebilir: https://drive.google.com/file/d/1a3lhe0dUth-5J1-S2fZlPOCZlPbeuvUr/view. AQuA kütüphanesi için ayrıntılı belgeler şu adresten edinilebilir: https://drive.google.com/file/d/1CckDLbrkw16b7MPlOQdYpZciIz80Snm_/view. - MATLAB'ı başlattıktan sonra, cd işlemini kullanarak varsayılan çalışma dizini klasöründen AQuA'nın belirlenmiş çalışma dizini klasörüne geçin.
- Kayıtlı 4D görüntüleri AQuA analiz hattına aşağıdaki gibi yükleyin (adım 6.3.1-6.3.2):
- AQuA GUI'yi başlatın. AQuA'nın belirlenmiş çalışma dizini klasöründeki MATLAB komut penceresine aqua_gui yazın.
- AQuA GUI içinde yeni proje'ye tıklayın ve analiz edilecek kayıtlı görüntüleri seçin. Veri türünü (GCaMPInVivo_cyto_Lck_) ve görüntüleme parametrelerini belirtin (zamansal çözünürlük: kare başına saniye = 1,993; uzamsal çözünürlük: piksel başına μm = 0,25; kenarlığa olan bu mesafeden daha kısa pikselleri hariç tut = 5). Verileri yüklemek için aç'a tıklayın.
- İlgi alanlarını izleyerek sonraki analiz boru hatları için yer işaretlerini tanımlayın. Genellikle, yer işaretleri hücre sınırına ve hücre gövdesinin alanına dayanır.
- Ardından, şu parametreler için otomatik analiz işlem hatlarını çalıştırarak aday Ca2+ olaylarını tespit edin: aktif sinyal, süper voksel, olay algılama, temiz olaylar ve birleştirme olayları.
NOT: Bu parametrelerin her biri ve aday puanı çıktıları hakkında ayrıntılı bir açıklama AQuA kılavuzunda verilmiştir. Kısaca, bu parametreler Ca2+ olay algılama eşiğini şu şekilde ayarlar: aktif sinyal = floresan genliği, süper voksel = 3B uzayda floresan kümelenmesi, olay algılama = yükselme/bozunma kinetiği, temiz olaylar = sinyal-gürültü oranı ve birleştirme olayları = olayların zamansal ayrımı. - Algılanan Ca2+ olaylarını görsel olarak inceleyin (orijinal kayıtlı görüntülerin üzerine otomatik olarak yerleştirilir). Gerekirse, yukarıdaki parametreler açısından görüntü kalitesini göz önünde bulundurarak analiz boru hatlarının parametre ayarlarını yapın; Belirli bir parametre için görüntü kalitesi iyiyse, daha yüksek bir eşik ayarlanabilir ve bunun tersi de geçerlidir.
- Tüm Ca2+ olayları uygun şekilde tespit edildikten sonra, bu olayları ana MATLAB ortamında aşağıdaki gibi karakterize edin (adım 6.8-6.14):
- AQuA analiz çıktı dosyalarını dışa aktarın.
NOT: Çıktı dosyaları, Ca2+ olaylarını tanımlamak için kullanılan ayıklanan özellikler ve bu ayıklanan özelliklerin altında yatan parametreler hakkında ayrıntılı bir açıklama AQuA belgelerinde verilmiştir. - (isteğe bağlı) Tüm Ca2+ olaylarını iki gruba ayırın: 1) Soma'da başlayan olaylar ve 2) süreçlerde başlayan olaylar.
- AQuA analiz çıktı dosyasının (.mat dosyası) res.dffMat MATLAB yapısı içindeki tek tek Ca2+ olaylarının genliğine erişin.
- Res.fts.loc.x3D MATLAB işlemini (AQuA kitaplığı) kullanarak tek tek Ca2+ olaylarının sıklığını türetin.
- Res.fts.curve.width11 MATLAB işlemini (AQuA kitaplığı) kullanarak tek tek Ca2+ olaylarının süresini türetin.
- Res.fts.basic.area MATLAB işlemini (AQuA kitaplığı) kullanarak tek tek Ca2+ olaylarının alanını türetin.
- Tüm Ca2+ olaylarını şu şekilde sınıflandırın: 1) yerel olaylar, 2) soma'ya doğru seyahat eden yayılma olayları ve 3) soma'dan uzaklaşan yayılma olayları. Bunu yapmak için res.fts.region.landmarkDir.chgTowards ve res.fts.region.landmarkDir.chgAway MATLAB işlemlerini (AQuA kitaplığı) kullanın (Şekil 3C).
Sonuçlar
Mikroglia'da yalnızca GCaMP6 (Ca2 + 'ya duyarlı floresan protein) eksprese eden transgenik farelerde, tipik olarak çeşitli mikroglial Ca2 + aktivitesi modellerini gözlemleriz (Şekil 2A). Daha da önemlisi, tek bir mikroglia içinde bile, Ca2 + aktivitesinin paternleri süreçler arasında önemli ölçüde farklılık gösterebilir.
Mikroglial Ca2 + aktivitesinin uzay-zamansal dinamiklerindeki bu tür süreçten işleme farklılıkları ölçmek için, önce kararlı alanlar tanımlanmalı ve daha sonra ince bölümlere ayrılmış ROI'lere bölünmelidir (Şekil 2B, C). Her ROI için, floresan yoğunluğu zaman serisinden yerel genlikler ve iz eğimleri gibi özellikler çıkarılarak genlik ve frekans gibi Ca2+ aktivitesinin parametreleri türetilmeli ve ölçülmelidir (Şekil 2D-G).
Daha sonra, doğru niceleme algoritması AQuA uygulanarak bireysel Ca2+ olayları incelenmelidir (Şekil 3A). Bu tür olaya dayalı analizlerden, tipik olarak bireysel Ca2+ olaylarının kökeni, genliği, süresi, konumu ve akış yönü özelliklerinde büyük farklılıklar gözlenir (Şekil 3B). Mikroglial süreçlerde Ca2+ aktivite dinamiklerini analiz etmeye odaklanılıyorsa, yerel olayların, somaya doğru seyahat eden olayların ve somadan uzaklaşan olayların bir sınıflandırma şeması bilgilendiricidir (Şekil 3C).
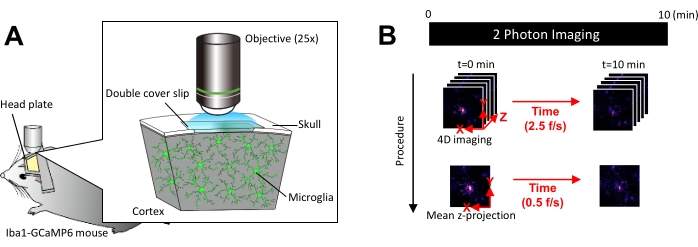
Şekil 1: İn vivo mikroglial Ca2+ görüntüleme için deney düzeneği. (A) Deney düzeneği. Mikroglia'ya özgü GCaMP6 ifadesine sahip bir Iba1-tTA × tetO-GCaMP6 faresi. Farenin kafatasına bir kraniyal pencere yerleştirerek, mikroglial Ca2+ aktivitesi, iki foton mikroskobu kullanılarak in vivo olarak gözlemlenebilir. (B) Deney programı ve analiz prosedürü. 4D görüntüler, beş kareli z-yığınları olarak en az 10 dakika boyunca elde edilir. Kare alma hızı 2,5 kare/sn'dir. Mikroglial Ca2+ aktivitesini analiz etmeden önce, beş kareli z-yığınları, ortalama (veya maksimum) yoğunluk alınarak 2D z-projeksiyonlarına dönüştürülür. Z-projeksiyon oynatma hızı 0,5 kare/sn'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
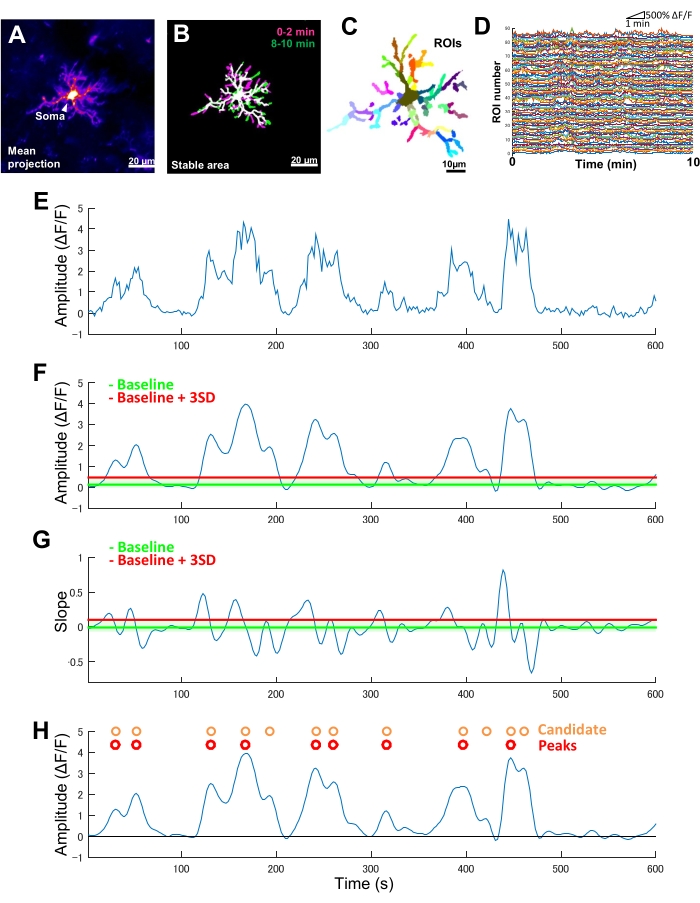
Şekil 2: Mikroglial Ca2+ aktivitesi için ROI tabanlı analiz. (A) Tek bir mikroglia için 10 dakikadan fazla ortalama GCaMP6 yoğunluk projeksiyonu. (B) Kararlı alanlar (beyaz), bir görüntüleme periyodunun başında (macenta) ve sonunda (yeşil) alınan 2 dakikalık örneklerden türetilen ikili, maksimum GCaMP6 yoğunluklu t-projeksiyonlarının bir katmanıyla tanımlanır. (C) İstikrarlı alanlar ayrıca bölgesel yatırım getirilerine bölünür. Bireysel renkler, bireysel yatırım getirilerini gösterir. (D) C'deki tüm bireysel ROI'lerin ΔF/F izleri. ROI'ler arasındaki etkinlik modellerindeki farklılığa dikkat edin. (E) Tek bir ROI için mutlak yoğunluk değerlerinden türetilen bir ΔF/F zaman serisinin orijinal izi. (F) Alçak geçiren filtrelemeden sonra aynı ΔF/F zaman serisi. Aday Ca2+ olayları, taban çizgisi + üç SD olarak tanımlanan bir genlik kesme eşiği (kırmızı çizgi) ile tespit edilir. Referans değer (yeşil çizgi), ΔF/F değerlerinin maksimum ve minimum %10'unu hariç tutan bir üst ve alt tavan içindeki tüm ΔF/F zaman serisi boyunca medyan değer olarak tanımlanır. (G) F'de filtrelenmiş ΔF/F zaman serisinden türetilen eğim izi. Gerçek Ca2+ olayları, taban çizgisi + üç SD olarak tanımlanan bir eğim kesme eşiğine (kırmızı çizgi) dayalı olarak aday Ca2+ olaylarından sıralanır. Referans değer (yeşil çizgi), eğim değerlerinin maksimum ve minimum %10'unu hariç tutan bir üst ve alt tavan içindeki tüm eğim zaman serisi boyunca ortalama değer olarak tanımlanır. (H) F'de genlik kriterleri ile tanımlanan aday Ca2+ olayları turuncu ile belirtilmiştir. Gerçek Ca2+ olayları, aday Ca2+ olaylarından eğim kriterlerine göre G ile kırmızı renkte sıralanmıştır. Bazı aday Ca2+ etkinliklerinin eğim kriterlerine göre birleştirildiğini unutmayın. Karşılık gelen filtrelenmiş ΔF/F zaman serisi, referans için aşağıda yer almaktadır. Siyah çizgi sıfır genliği (ΔF/F) gösterir. Gerçek Ca2+ olaylarının ortalama ve maksimum genliği, filtrelenmiş ΔF/F zaman serisinde karşılık gelen tepe noktalarının ortalaması ve maksimumu olarak türetilir. Frekans (olay/dk), gerçek Ca2+ ateşleme olaylarının sayısının görüntüleme periyoduna (10 dk) bölünmesiyle elde edilir. Ölçek çubukları = 20 μm (A,B), 10 μm (C). Kısaltma: ROI = ilgi alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
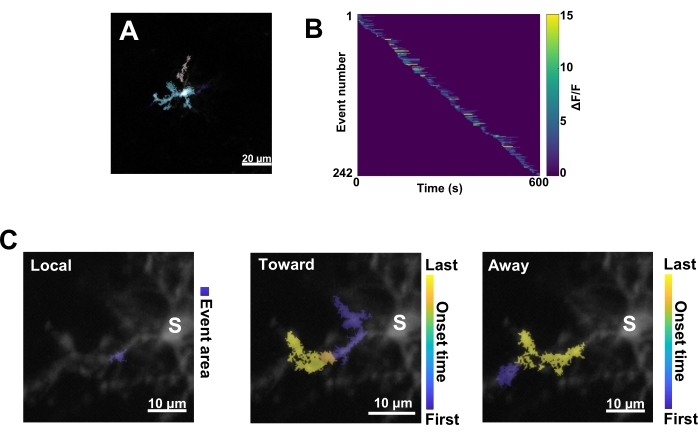
Şekil 3: Mikroglial Ca2+ aktivitesi için olaya dayalı analiz. (A) AQuA algoritması kullanılarak algılanan olayların temsili görüntüleri. Renkler, belirli bir zaman noktasında algılanan bireysel olay alanlarını gösterir. (B) Başlangıç sırasına göre sıralanmış bireysel olaylarda temsili normalleştirilmiş Ca2+ aktivitesi (ΔF/F). Sağdaki çubuk, renkle gösterilen ΔF/F'yi gösterir. (C) Soma'ya veya yerel olaylara doğru ve onlardan uzaklaşan olayların temsili aktivite ayak izleri. Yerel etkinlikler için etkinlik şekli mavi renkle gösterilir. Yayılma olayları için, olay başlangıç zamanı mavi-sarı ölçekle gösterilir. AQuA başlangıçta Ca2+ olaylarını ayrı ayrı tespit ettiğinden, yayılma olayları daha sonra birden çok bireysel Ca2+ olayının örtüşen uzamsal konumlarına ve zaman serilerine dayalı olarak tanımlanır. Bunun, Şekil 2E-H'deki ROI analizi için kullanılan dendritik dalın aynısı olduğuna dikkat edin. Ölçek çubukları = 20 μm (A), 10 μm (C). Kısaltma: ROI = ilgi alanı; S = soma. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu makale, yüksek uzay-zamansal çözünürlüğe sahip mikroglial Ca2+ aktivitesini görüntülemek için gelişmiş bir yaklaşım sunmaktadır. Bu yöntem, yerel ve propagatif olayları kolayca ayırt ederek, tek dallanmış süreçler düzeyinde farklı mikroglial Ca2+ aktivitesini tespit edecek kadar hassastır.
Mikroglial Ca2+ aktivitesinin in vivo iki fotonlu görüntülenmesi için genel yöntemde, görüntüleme kalitesini en üst düzeye çıkarmak için aşağıdaki noktalara dikkat edilmelidir. İlk olarak, mikroglialar yaralanmaya karşı son derece hassas olduğundan, ameliyat sırasında beynin yüzeyine cerrahi aletlerle doğrudan dokunmayı en aza indirmek önemlidir. Ameliyatın ustaca yapıldığının temel göstergeleri, sağlam kan damarları ve dura ve ameliyat sırasında çok az kanamadır. İkincisi, kafa plakasının farenin kafatasına güvenli bir şekilde takılması ve çift lamel ile beyin yüzeyi arasındaki iyi temas, görüntüleme sırasında hareketle ilgili artefaktları büyük ölçüde azaltır. Bu, özellikle yüksek uzay-zamansal çözünürlüklerle ve tamamen uyanık farelerde görüntüleme yaparken önemlidir. Analiz hattı, kalp atışı, solunum ve genel sapmadan kaynaklanan hareketle ilgili artefaktları güvenilir bir şekilde telafi ederken, ani büyük hareketlerden kaynaklanan önemli geometrik bozulmaları ele alırken daha az sağlamdır.
Burada açıklanan iki analiz yöntemi farklı avantajlar sunar ve farklı araştırma sorularına uygundur. ROI tabanlı analizde, kullanıcı ROI'yi (bireysel süreçler gibi) önceden tanımlar ve bu ROI'nin Ca2+ aktivitesinin toplam dinamiklerinin çıkarılmasına izin verir. Bu nedenle, fenomenlerin hem iyi tanımlanmış morfolojik sınırlara hem de nispeten geniş bir alana (yani bir süreç dalı) sahip bir hücre altı alana lokalize olmasının beklendiği durumlar için en uygun olanıdır. Olaya dayalı analizde, bireysel olaylar, mikroglial Ca2 + aktivitesinin kendisinin uzay-zamansal dinamiklerine dayalı olarak tanımlanır ve daha sonra işlevlerinin yorumlanması için mikroglia içindeki kullanıcı tanımlı yer işaretleri bağlamına yerleştirilmelidir. Bu nedenle, fenomen lokalizasyonu ile ilgili varsayımların yapılamadığı veya ilgi alanının nispeten küçük olduğu durumlar (yani, bir süreç ipucu) için en uygun olanıdır. Bu nedenle, olay tabanlı analiz, önceki yöntemlere kıyasla mikroglial Ca2+ aktivitesini karakterize ederken gelişmiş uzay-zamansal çözünürlük sunar.
Bu farelerde, mikroglia ile ifade edilen tek floresan işaretleyici Ca2 + göstergesi GCaMP6'dır. Bu nedenle, Ca2+ aktivitesinin düşük olduğu bölgelerde, zamansal çözünürlüğü bozabilecek birden fazla zaman dilimi birleştirilerek mikroglial morfoloji çıkarılmalıdır. Bununla birlikte, bu sınırlama, mikroglia'da ayrı bir kırmızı stabil floresan proteinin eksprese edilmesiyle aşılabilir. Özellikle, mikroglia'yı transfekte edebilen yeni adeno ilişkili virüsler yakın zamanda tanımlanmıştır 23,24,25.
Mikroglial Ca2 + aktivitesinin çevredeki çevre tarafından nasıl değiştirildiği, ortaya çıkan bir ilgi konusudur. Özellikle, mikroglial Ca2 + aktivitesi, nöronal aktivite ile önemli korelasyonlar gösteriyor gibi görünmektedir, ancak bunun fonksiyonel önemi henüz tam olarak karakterize edilmemiştir. Bu nedenle, nöronal aktivite manipülasyonunu burada sunulan mikroglial Ca2 + aktivitesi için görüntüleme ve analiz yöntemleriyle birleştirmek, mikroglial fizyolojiye yeni bakış açıları kazandırmalı ve mikroglianın fizyolojik ve patolojik durumlarda oynadığı rollere ilişkin anlayışımızı daha da ilerletmelidir.
Açıklamalar
Yazarlar, bu makale ile ilgili herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Prof. Kenji Tanaka'ya (Keio Üniversitesi, Tokyo, Japonya) Iba1-tTA fareleri ve tetO-GCaMP6 fareleri sağladığı için minnettarız. Bu çalışma, Genç Bilim İnsanları için Yardım Hibeleri (B) [16K19001 (H.H.'ye)], Kariyerinin Başındaki Bilim İnsanları için Yardım Hibeleri [18K14825 (H.H.'ye)], Bilimsel Araştırma için Yardım Hibesi (B) [21H03027 (H.H.'ye)], Dönüştürücü Araştırma Alanları için Yardım Hibesi (A) [21H05639 (H.H.'ye)], Bilimsel Araştırma Hibesi (A) [17H01530, 20H00500 (J.N.'ye)] ve JST CREST Hibesi [JPMJCR1755 (J.N.'ye)], Japonya.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2% xylocaine jelly | AstraZeneca, UK | ||
| B6(129S6)-Tg(Aif1-tTA)54Kftnk | RIKEN RBC, Japan | RBRC05769 | Iba1-tTA mice |
| B6;129-Actb(tm3.1(tetO-GCaMP6)Kftnk) | RIKEN RBC, Japan | RBRC09552 | tetO-GCaMP6 mice |
| Forceps | Fine science tools, US | 13008-12 | |
| G-CEM ONE | GC corporation, Japan | ||
| Glass capillary | Narishige, Japan | GDC-1 | |
| ImageJ | NIH, US | ||
| Isofulrane | Pfizer, US | ||
| Ketamin | Daiichi-Sankyo, Japan | ||
| Kwik-sil | World Precision Instruments, US | KWIK-SIL | |
| MATLAB, 2020a | MathWorks, US | ||
| Micro cover glass (2 x 2 mm, No.3) | Matsunami, Japan | custum-made | Bottom glass for cranial window |
| Micro cover glass (3 x 3 mm, No.0) | Matsunami, Japan | custum-made | Upper glass for cranial window |
| N25X-APO-MP | Nikon, Japan | N25X-APO-MP | Objective lens (25x) |
| Norland optical adhesive | Edmund optics, US | 6101 | |
| Piezo nano-positioning system, Nano-Drive | Mao City Labs, US | ||
| Razor blade | Feather, Japan | FA-10 | |
| Scissors | Fine science tools, US | 14060-11 | |
| Steel drill | Minitor, Japan | BS1201 | |
| Stereotaxic instruments | Narishige, Japan | SR-5M-HT | |
| Super-bond (C&B kit) | Sun Medical, Japan | 4560227797382 | |
| Surgical needle hook | Fine science tools, US | 10065-15 | |
| Ti:Sappire laser, MaiTai DeepSee | Spectra Physics, US | Mai Tai eHP DS | |
| Tweezers | Fine science tools, US | 11051-10 | |
| Tweezers | Fine science tools, US | 11255-20 | |
| Two-photon microscope | Nikon, Japan | A1R-MP | |
| UV craft resin | Kiyohara, Japan | UVR | |
| Xylazine | Bayer, Germany |
Referanslar
- Miyamoto, A., et al. Microglia contact induces synapse formation in developing somatosensory cortex. Nature Communications. 7, 12540 (2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Cserep, C., et al. Microglia monitor and protect neuronal function through specialized somatic purinergic junctions. Science. 367 (6477), 528-537 (2020).
- Kato, G., et al. Microglial contact prevents excess depolarization and rescues neurons from excitotoxicity. eNeuro. 3 (3), (2016).
- Li, Y., Du, X. -. F., Liu, C. -. S., Wen, Z. -. L., Du, J. -. L. Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo. Developmental Cell. 23 (6), 1189-1202 (2012).
- Tremblay, M. -. E., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. Plos Biology. 8 (11), 1000527 (2010).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. The Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Oppenheim, R. W. Cell death during development of the nervous system. Annual Review of Neuroscience. 14 (1), 453-501 (1991).
- Sierra, A., Abiega, O., Shahraz, A., Neumann, H. Janus-faced microglia: beneficial and detrimental consequences of microglial phagocytosis. Frontiers in Cellular Neuroscience. 7, 6 (2013).
- Brawek, B., et al. A new approach for ratiometric in vivo calcium imaging of microglia. Scientific Reports. 7 (1), 6030 (2017).
- Eichhoff, G., Brawek, B., Garaschuk, O. Microglial calcium signal acts as a rapid sensor of single neuron damage in vivo. Biochimica et Biophysica Acta. 1813 (5), 1014-1024 (2011).
- Liu, L., et al. Microglial calcium waves during the hyperacute phase of ischemic stroke. Stroke. 52 (1), 274-283 (2021).
- Pozner, A., et al. Intracellular calcium dynamics in cortical microglia responding to focal laser injury in the PC::G5-tdT reporter mouse. Frontiers in Molecular Neuroscience. 8, 12 (2015).
- Umpierre, A. D., et al. Microglial calcium signaling is attuned to neuronal activity in awake mice. Elife. 9, e56502 (2020).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. Plos One. 7 (12), e51286 (2012).
- Tanaka, K. F., et al. Expanding the repertoire of optogenetically targeted cells with an enhanced gene expression system. Cell Reports. 2 (2), 397-406 (2012).
- Liu, Y. U., et al. Neuronal network activity controls microglial process surveillance in awake mice via norepinephrine signaling. Nature Neuroscience. 22 (11), 1771-1781 (2019).
- Stowell, R. D., et al. Noradrenergic signaling in the wakeful state inhibits microglial surveillance and synaptic plasticity in the mouse visual cortex. Nature Neuroscience. 22 (11), 1782-1792 (2019).
- Sun, W. L., et al. In vivo two-photon imaging of anesthesia-specific alterations in microglial surveillance and photodamage-directed motility in mouse cortex. Frontiers in Neuroscience. 13, 421 (2019).
- Evangelidis, G. D., Psarakis, E. Z. Parametric image alignment using enhanced correlation coefficient maximization. IEEE Transactions on Pattern Analysis and Machine Intelligence. 30 (10), 1858-1865 (2008).
- Rosario, A. M., et al. Microglia-specific targeting by novel capsid-modified AAV6 vectors. Molecular Therapy. Methods & Clinical Development. 3, 16026 (2016).
- Maes, M. E., Wogenstein, G. M., Colombo, G., Casado-Polanco, R., Siegert, S. Optimizing AAV2/6 microglial targeting identified enhanced efficiency in the photoreceptor degenerative environment. Molecular Therapy. Methods & Clinical Development. 23, 210-224 (2021).
- Lin, R., et al. Directed evolution of adeno-associated virus for efficient gene delivery to microglia. Nature Methods. 19 (8), 976-985 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır