Method Article
ミクログリアCa2+ 活性のシングルセル分解能での時空間解析
要約
この論文では、ミクログリアCa2+活性のin vivoイメージングとその後の時空間ダイナミクスの解析のためのプロトコルについて説明します。この手法により、ミクログリアが脳環境の変化にどのように反応するかを徹底的に評価することができ、そのような事象が発生する微細な時空間スケールを適切に捉えることができます。
要約
ミクログリアは、中枢神経系に唯一存在する免疫細胞です。それらの形態は非常に可塑性であり、その活動に応じて変化します。恒常性条件下では、ミクログリアは高度に分岐した形態を持っています。これにより、プロセスの継続的な拡張と収縮を通じて、周囲の環境の監視が容易になります。しかし、脳の損傷や炎症の際には、ミクログリアが活性化して劇的な形態変化を遂げ、分岐した突起を後退させ、細胞体を腫脹させます。これにより、ミクログリアが脳環境をより病理的でない状態に導くために行う移動や食作用などの活動が促進されます。
ミクログリアの形態とその活動の変化との間のこの密接な関係は、さまざまなミクログリア機能に関するかなりの洞察を可能にしました。しかし、このような形態学的および活性的変化は、それ自体が任意の数の細胞内シグナル伝達経路から生じる可能性のある現象です。さらに、刺激と反応の間のタイムラグ、およびミクログリアの高度に区分化された形態により、機能を支える原因メカニズムを特定することが困難になります。この問題を解決するために、ミクログリアに高感度な蛍光Ca2+-インジケータータンパク質を特異的に発現させた遺伝子改変マウスを開発した。
この論文では、 in vivo ミクログリアCa2+ イメージングの方法について説明した後、このCa2+ 活性を合理的に定義された細胞内領域に分類する構造化された解析アプローチを提示し、エンコードされた情報の空間的および時間的次元が意味のある形で抽出されるようにします。このアプローチにより、高次脳機能と病的状態の両方に関連する多様なミクログリア活動を支配する細胞内シグナル伝達規則の詳細な理解が得られると信じています。
概要
ミクログリアは、中枢神経系(CNS)に常在する免疫細胞であり、恒常性を維持する脳環境の維持や、脳の発達における神経回路形成の調節に重要な役割を果たしています1,2。中枢神経系のミクログリアのユニークな特徴は、その形態が非常に可塑性であることです。ただし、異なる形態学的表現型を特定の機能に関連付けることができます。さらに、形態学的表現型間の変換は非常に動的であり、周囲の環境の変化に応じて急速な時間スケールで発生します3,4。
恒常性生理学的条件下では、ミクログリアは非常に分岐した形態をとり、複数のプロセスがすべての方向に外側に放射状に広がっています。これらの分岐した突起自体は高い運動性を示し、連続的に伸縮します3,4。このような活動は、主にニューロンの活動を監視するために、ニューロンのシナプス、軸索、および体細胞との定期的な接触に向けられています5,6,7,8,9。しかし、脳が損傷すると、ミクログリアはこの異常をいち早く察知し、適応応答の第一歩として、その過程を対応する部位に向ける3,4。ミクログリアが死んだ細胞や代謝物の食作用を行う必要がある場合、それらはアメーバのような形態をとり、免疫学的に活性化された表現型への移行の一部として、プロセスを短縮し、細胞体を拡大します10,11。
しかし、ミクログリアプロセスの劇的な形態学的変化は容易に検出できますが、細胞体細胞のより微細なスケールの変化は、特に生理学的に関連する時間分解能で捕捉することが著しく困難です。さらに、形態学的変化自体は、任意の数の細胞内シグナル伝達経路の統合結果を表すだけです。これは、機能的活動を追跡し、刺激とそれが引き起こす最終反応を機械的に結びつけるという目標にとって問題です。
セカンドメッセンジャーとして広く役割を果たしていることを考えると、細胞内Ca2+ダイナミクスを調べることは、動的細胞プロセスを研究する際に関連する時空間情報をより適切に捉えることができます。このようなアプローチは、ミクログリアが下流の細胞内Ca2+上昇に関連するさまざまなイオン栄養型および代謝型受容体を発現することを考えると、ミクログリアに適用できます。実際、in vivo Ca2+イメージングは、ミクログリア活動の時空間的側面をリアルタイムで特徴付けるために使用されており、ミクログリアCa2+活性の変化を脳損傷、炎症、およびニューロン12,13,14,15,16の活動亢進および低活動性との相関させることに成功しています。例えば、神経細胞の活動亢進/低活動性に応答してミクログリアのプロセス拡張に関連するCa2+の上昇は、その根底にあるCa2+依存性のアクチン重合プロセスを反映している可能性が高い16。さらに、in vivo Ca2+イメージングは、薬理学的アプローチと容易に組み合わせることもできます。例えば、ミクログリアはP2X(イオノトロピック)受容体とP2Y(代謝型)受容体の両方を発現するが、P2Yアゴニストの局所適用は、損傷した隣接するニューロンに対するミクログリアCa2+応答を模倣し、その後鈍感化する13ことから、P2Yシグナル伝達がニューロンの損傷検出により関連性が高いことが示唆される。
これまで、ミクログリアCa2+活性を調べた以前の報告では、関心領域(ROI)ベースの分析方法が採用されてきました。これらのアプローチの欠点は、個々のミクログリアプロセスのレベルでCa2+活性の時空間ダイナミクスを解明するには、まだ粗すぎることです。したがって、このプロトコルでは、ミクログリアCa2+活性を分析するための従来のROIベースの方法と、ミクログリアプロセスで個々のCa2+イベントを抽出できる新しいイベントベースのアプローチの両方について説明します。その前に、詳細な解析のためにミクログリアCa2+活性を適切に捕捉するためのin vivo 2光子イメージングの一般的なガイドを提供します。
プロトコル
すべての動物実験は、国立衛生研究所のガイドラインに準拠して、国立生理学研究所の動物研究委員会によって承認されました。すべての実験について、8〜10週齢の雄マウスを12/12時間の明暗サイクルで飼育し、餌と水に自由にアクセスできるようにしました。ミクログリアにおけるCa2+活性を可視化するために、イオン化Ca2+結合アダプター分子1(Iba1)-テトラサイクリントランスアクチベーター(Iba1-tTA)マウスをテトラサイクリンオペレーター-GCaMP6(tetO-GCaMP6)マウスと交配した17,18。したがって、テトラサイクリン-アナログサプリメントがない場合、Iba1プロモーターは、ミクログリアでのみGCaMP6の発現を促進します。すべての実験で、ドキシサイクリンの栄養補助食品は生後6週間で中止されました。.すべての実験の終わりに、マウスはイソフルランの過剰摂取とそれに続く子宮頸部脱臼によって安楽死させられました。このプロトコルで使用されるすべての材料、動物、および試薬に関連する詳細については、材料の表を参照してください。
1. in vivo 2光子イメージングのためのマウスの外科的調製;1日目
- すべての外科的処置は、無菌の作業条件を維持するために、層流の空気の流れキャビネット内で行います。手術を開始する前に、キャビネット内部をUVライトで5分間滅菌します。
- すべての作業面、手術フレーム、および定位固定器具を70%エタノールで拭き取り、滅菌します。
- マウスの頭蓋骨に取り付けるすべての手術器具(はさみ、鉗子、かみそりの刃、ピンセット)とカスタムメイドのヘッドプレートを1%グルコン酸クロルヘキシジン溶液に浸して滅菌します。
- マウスにケタミン(7.4 mg kg-1、腹腔内[i.p.])とキシラジン(10 mg kg-1、i.p.)で麻酔します。麻酔が定着するまで、ホームケージに戻します。つま先つまみ反射の喪失により、麻酔の完全な導入を確認します。
- 頭皮を1%グルコン酸クロルヘキシジンで滅菌します。.カミソリの刃で毛を剃り落とします。
- マウスを脳定位固定装置 で 手術フレーム内に固定します。
- 麻酔下での乾燥を防ぐために、獣医軟膏を目に塗ります。
- 2%キシロカインゼリーを頭皮に塗り、痛みの管理に役立てます。5分間待ちます。
- ハサミで頭皮を取り除き、頭蓋骨を露出させます。骨膜をきれいにし、露出した頭蓋骨の表面を綿棒でこすって乾かします。
注:露出した頭蓋骨の領域は、カスタムメイドのヘッドプレートとの強力な接着を確保するために、完全に乾燥している必要があります。 - カスタムメイドのヘッドプレートを歯科用セメントで頭蓋骨に固定します。
- セメントが固まったら、頭蓋骨の表面とカスタムメイドのヘッドプレートの境界との間の隙間を追加の歯科用セメントで埋めます。
- アクリルベースの歯科用接着剤樹脂セメントを塗布することにより、セメントと頭蓋骨の表面を防水します。
- マウスをホームケージに戻し、ウォーミングパッドの上に置きます。マウスが胸骨の横臥を維持するのに十分な意識を取り戻すまで(2時間以内)マウスを監視します。
注:マウスは翌日までに完全に回復し、その後他の動物と一緒に収容することができます。
2. in vivo 2光子イメージングのためのマウスの外科的調製;2日目
- すべての外科的処置は、無菌の作業条件を維持するために、層流の空気の流れキャビネット内で行います。手術を開始する前に、キャビネット内部をUVライトで5分間滅菌します。
- 寸法の異なる2枚のガラスカバースリップ(上部ガラス:3mm×3mm、下部ガラス:2mm×2mm)をUV硬化型光学グレードの樹脂でラミネートします。
注:ダブルカバースリップは、頭蓋窓によって露出した脳領域を長期的に保護し、慢性的な光学アクセスを可能にします。したがって、その寸法は、画像化される脳領域に適合するように変更され得る。 - すべての作業面と手術フレームを70%エタノールで拭き取り、滅菌します。
- すべての手術器具(スチールドリル、ピンセット、手術針フック)を1%グルコン酸クロルヘキシジン溶液に浸して滅菌します。
- マウスをイソフルランで麻酔します(4%誘導、1.2%-1.5%メンテナンス)。マウスをヘッドプレート で 手術フレーム内に固定します。
- 一次運動皮質の上に頭蓋窓を作成するには、ブレグマの頭蓋骨のランドマークの前方0.2 mm、横方向1 mmの中央に2 mm×2 mmの正方形をマークします。
- スチールドリルを使用して、マークされた正方形の境界に沿って頭蓋骨を薄くします。
注:希望の厚さに近づくと、生理食塩水で濡らすと薄くなった頭蓋骨の部分が透明に見え、ヘアラインの亀裂が現れ始めます。 - マークされた正方形の境界全体が適切に細くなっていることを確認したら、頭蓋骨の表面のすぐ下に手術針フックを慎重に挿入し、その先端を正方形の中心に向けてください。正方形の頭蓋骨をフックでそっと持ち上げ、ピンセットを使用して頭蓋骨の残りの部分から剥がします。出血が発生した場合は、露出した脳表面を完全に治めるまで生理食塩水で継続的に洗浄します。
- 二重のカバースリップを露出した脳の表面に置き、小さい方のカバースリップのある側を脳に向けます。大きい方のカバースリップの端が頭蓋窓の境界に接触していることを確認します。
- マニピュレーターに取り付けられたシリコンチップのガラス棒を使用して、ダブルカバースリップをそっと押し下げて、脳の表面にしっかりと接触するようにします。
- 二重カバーガラス、頭蓋骨、脳表面の間の隙間をUV硬化型樹脂で埋め、硬化するまで(~20秒)UV光を照射します。シリコンチップのガラス棒をゆっくりと持ち上げて、ダブルカバースリップから離します。
- マウスが回復するのを待って、ウォーミングパッドの上に置きます。マウスが胸骨の横臥を維持するのに十分な意識を取り戻すまでマウスを監視します(30分)。
- 手順3に進むか、マウスをホームケージに戻します。
注:熟練した手術後、硬膜とその下にあるすべての血管は完全に無傷で出血はありません。この場合、炎症は最小限であり、すぐにステップ3に進むことが可能です。不明な場合は、1〜3週間待って、炎症が完全に解消したことを確認してください。
3. in vivo 2光子イメージングを用いたデータ収集
- 事前にイメージングセットアップをオンにして、レーザーがウォームアップして安定するのに十分な時間があることを確認してください。GCaMP6蛍光色素を最適に励起する2光子スペクトルである920nmの波長で発光するようにレーザーを調整します。
- マウスを25倍顕微鏡の対物レンズの下に置き、30分間慣らします。必要に応じて、イメージング中にマウスをイソフルランで麻酔します(4%誘導、1.2%〜1.5%の維持)。
注:イソフルランは、ミクログリアプロセスの運動性とCa2 +活性19,20,21に影響を与えるため、一部の研究用途には適さない場合があります。 - ズームを1倍に設定し、頭蓋窓領域でGCaMP6を発現するミクログリアを検索します。脳表面から100μmから300μmの深さで探索します。
- 適切なGCaMP6発現ミクログリアが見つかったら、Ca2+ 活性をシングルセルの分解能で捕捉できるようにズームを最大化します。
- Ca2+ の活性がはっきりと捉えられていることを目視で確認し、必要に応じてレーザー出力とイメージングゲインを調整します。
注:レーザー出力は、光退色やミクログリアの損傷を避けるために、できるだけ最小限に抑える必要があります。 - 次のように4次元(4D)画像取得を実行します(ステップ3.6.1-3.6.3; 図1B):
- 画像のサイズを XY 領域 = 512 × 512 ピクセル、0.25 μm/ピクセルに設定します。Z面積=5つのZ面、3μmのzステップ(図1B)。
- 取得レートを 2.5 フレーム/秒に設定します。
注:この速度でのZスキャンは、ピエゾナノポジショニングシステムによって促進されます。 - 少なくとも 10 個の個別の Ca2+ イベントが観測されるまで (通常は 10 分)、データを取得します。
4. 解析準備(モーション補正、平均/最大z投影)
- ミクログリアCa2+ 活性の解析に進む前に、MATLABプログラミング環境(R2020a)内でECC画像アライメントアルゴリズム22 を使用して、運動関連のアーティファクトの4D画像を補正(画像レジストレーション)してください。https://www.mathworks.com/matlabcentral/fileexchange/27253-ecc-image-alignment-algorithm-image-registration からコードをダウンロードします。
- imregister MATLAB 演算 (標準の画像処理ツールボックス) を使用して、最初のタイム フレーム内のすべてのイメージを登録して、参照 3D イメージを作成します。
- 後続のすべての画像を登録します。 ecc 関数 (ECC 画像アライメント アルゴリズム ライブラリ) を使用して、参照 3D 画像の対応する z 平面と一致させます。
- 平均 MATLAB 演算を使用して、登録されたイメージから平均強度 Z 投影を生成します。イメージング信号が弱すぎる場合は、代わりに max MATLAB 演算を使用して最大強度の z 投影を生成します。
注:最大強度のz投影を使用すると、信号対雑音比が悪くなります。 - ステップ 5 または 6 に進みます。ステップ 4 で生成された Z 投影法を解析のターゲットとして使用して、ステップ 5 と 6 の Ca2+ アクティビティの時空間ダイナミクスをマッピングします。
5. ROIベースの分析
- ステップ4で生成されたz投影を使用して、イメージング期間を通じて安定領域プロファイル(安定領域)を維持するミクログリアプロセスを特定し、その後のCa2+ 活性の分析を次のように行います(ステップ5.3-5.6)。
- 最大 MATLAB 演算を使用して、イメージング期間の開始時と終了時に取得された 2 分間のサンプルから、登録された 4D イメージの最大強度 t 投影を個別に生成します。
- t 投影を二値化して、 imbinarize MATLAB 演算を使用して、イメージング期間の開始と終了に対応するミクログリア形態の多角形を生成します。自動的に設定されたデフォルトのしきい値を使用します。
注:イメージング期間の開始時と終了時にCa2+ 信号が弱い場合、二値化によって境界が欠落したポリゴンが生成される場合があります。この場合、ImageJの 鉛筆ツールを使用して 、欠落している境界線を手動で描画します。 - imadd MATLAB 演算を使用して t 投影ポリゴンをオーバーレイします。重なり合った領域は安定領域を表します(図2B)。
- 特定された安定した領域内で、 drawpolygon MATLAB 演算を使用して、主要なミクログリアの各プロセスと明らかな 2 次サブブランチの ROI を手動で定義し、トレースします。
- すべての時間枠で個々のROI全体で平均化された絶対蛍光強度を追跡します(図2C、D)。
- 絶対蛍光強度の時系列から、式(1)に従って蛍光強度の相対変化(ΔF/F)時系列を計算します。この時系列は、個々のROIのレベルで正規化されたミクログリアCa 2+ダイナミクスを表しています。
ΔF/F = (F(t) - F0) / F0 (1)
ここで、F(t)は特定の時間に記録された蛍光強度、F0はすべての時間枠における蛍光強度の10パー センタイルです(図2E)。 - 次のように、特定の個々の ROI で発生する候補 Ca2+ 発火イベントを特定します (手順 5.5.1-5.5.3)。
- fir1 MATLAB 演算を使用して、ΔF/F 時系列にタイプ I 有限インパルス応答 (FIR) ローパス フィルタリングを適用します。カットオフ周波数をナイキスト値(サンプリングレートの半分)に設定します。
- フィルタリングされたトレースを目視検査して、個々のトレースピークが登録された4D画像のCa2+ アクティビティのバーストに対応していることを確認します(図2F)。
- 候補の Ca2+ 発火イベントをΔF/F 時系列トレースの凹面的な変曲として特定します。ベースラインしきい値は、すべての時間枠で最大および最小の 10% の振幅を除外する上限と下限の上限内の ΔF/F 値の中央値として定義します。ベースラインしきい値より 3 つの SD の検出しきい値を定義します (図 2F、H)。
- 次のように、候補から真の Ca2+ 発生イベントを特定します (手順 5.5.1 から 5.5.2)。
- 数値勾配 MATLAB 演算を使用して、対応するフィルター処理された ΔF/F 時系列フレームを微分することにより、各候補イベントの傾きを計算します。
- その後、プロファイルの立ち上がり時間に基づいて真の Ca2+ イベントを特定します。ベースラインしきい値は、すべての候補イベントにおける傾斜角値の平均として定義します。ベースラインしきい値より 3 つの SD の検出しきい値を定義します(図 2G、H)。
- 真の Ca2+ イベントを次のように特徴付けます (手順 5.6.1 から 5.6.3)。
注:以下は、ミクログリアCa2+ イベントを特徴付けるために使用できるパラメータの完全なリストではありません。関心のあるパラメータは、研究の目的によって異なります。- 真の Ca2+ 発火イベントの最大振幅を、対応する ΔF/F 時系列フレームの ΔF/F 値として導き出します。
- 真の Ca2+ 発火イベントの平均振幅を、対応するフレームの ΔF/F 時系列サブセット全体の平均 ΔF/F 値として導き出します。
- 真の Ca2+ イベントの頻度を、イベントの数をイメージング時間で割った値として導き出します。
6. イベントベースの分析
- MATLAB プログラミング環境内の AQuA ライブラリを使用して、ステップ 4 の z 投影でイベントベースの解析を実行します。コードは https://github.com/yu-lab-vt/AQuA からダウンロードします。
注: AQuA ライブラリの一般的な使用ウォークスルーは、https://drive.google.com/file/d/1a3lhe0dUth-5J1-S2fZlPOCZlPbeuvUr/view から入手できます。AQuA ライブラリの詳細なドキュメントは、https://drive.google.com/file/d/1CckDLbrkw16b7MPlOQdYpZciIz80Snm_/view から入手できます。 - MATLAB を起動した後、 cd 操作を使用して、既定の作業ディレクトリ フォルダーから AQuA の指定された作業ディレクトリ フォルダーに切り替えます。
- 次のように、登録した4D画像をAQuA解析パイプラインに読み込みます(ステップ6.3.1-6.3.2):
- AQuA GUIを起動します。MATLAB コマンド ウィンドウで、AQuA の指定された作業ディレクトリ フォルダーに 「aqua_gui 」と入力します。
- AQuA GUIで「 新規プロジェクト 」をクリックし、 解析する登録済みイメージ を選択します。 データ型 (GCaMPInVivo_cyto_Lck_) と イメージング パラメーター (時間分解能 (秒数/フレーム) = 1.993、空間分解能 μm / ピクセル = 0.25、この境界までの距離 = 5 より短いピクセルを除外) を指定します。 「開く 」をクリックしてデータをロードします。
- 対象エリアをトレースして、後続の解析パイプラインのランドマークを定義します。通常、ランドマークはセルの境界とセル本体の面積に基づいています。
- その後、アクティブ信号、スーパーボクセル、イベント検出、クリーンイベント、マージイベントのパラメーターに対して自動解析パイプラインを実行して、候補の Ca2+ イベントを検出します。
注: これらの各パラメーターとその候補スコア出力の詳細については、AQuA チュートリアルを参照してください。簡単に言うと、これらのパラメータは、アクティブシグナル=蛍光振幅、スーパーボクセル=3D空間での蛍光のクラスタリング、イベント検出=立ち上がり/減衰速度、クリーンイベント=信号対雑音比、マージイベント=イベントの時間的分離など、Ca2+ イベント検出の閾値を次のように調整します。 - 検出されたCa2+ イベントを視覚的に検査します(元の登録済み画像に自動的にオーバーレイされます)。必要に応じて、上記のパラメータの観点から画像品質を考慮して、解析パイプラインのパラメータ設定を調整します。特定のパラメータの画質が良好な場合は、より高いしきい値が設定され、その逆も同様です。
- すべての Ca2+ イベントが適切に検出されたら、メインの MATLAB 環境内でこれらのイベントを次のように特徴付けます (手順 6.8-6.14)。
- AQuA 解析出力ファイルをエクスポートします。
注: 出力ファイル、Ca2+ イベントの定義に使用される抽出された機能、およびこれらの抽出された機能の基になるパラメーターの詳細については、AQuA ドキュメントを参照してください。 - (オプション)すべての Ca2+ イベントを 2 つのグループに分類します: 1) ソーマから始まるイベントと、2) プロセスから始まるイベント。
- AQuA 解析出力ファイル (.mat ファイル) の res.dffMat MATLAB 構造体内の個々の Ca2+ イベントの振幅にアクセスします。
- res.fts.loc.x3D MATLAB 演算 (AQuA ライブラリ) を使用して、個々の Ca2+ イベントの頻度を導き出します。
- res.fts.curve.width11 MATLAB 演算 (AQuA ライブラリ) を使用して、個々の Ca2+ イベントの持続時間を導き出します。
- res.fts.basic.area MATLAB 演算 (AQuA ライブラリ) を使用して、個々の Ca2+ イベントの面積を導き出します。
- すべてのCa2+ イベントを、1)ローカルイベント、2)ソーマに向かって移動する伝播イベント、3)ソーマから遠ざかる伝播イベントとして分類します。これを行うには、 res.fts.region.landmarkDir.chgToward および res.fts.region.landmarkDir.chgAway MATLAB 演算 (AQuA ライブラリ) を使用します (図 3C)。
結果
ミクログリアでGCaMP6(Ca2+感受性蛍光タンパク質)のみを発現するトランスジェニックマウスでは、通常、ミクログリアCa2+ 活性の多様なパターンが観察されます(図2A)。重要なことは、単一のミクログリア内でも、Ca2+ 活性のパターンはプロセス間で劇的に異なる可能性があるということです。
ミクログリアCa2+活性の時空間ダイナミクスにおけるこのようなプロセス間の違いを定量化するには、まず安定領域を特定し、次に細かくセグメント化されたROIに分割する必要があります(図2B、C)。各ROIについて、蛍光強度の時系列から局所的な振幅や微量な傾きなどの特徴を抽出することにより、振幅や周波数などのCa2+活性のパラメータを導き出し、定量化する必要があります(図2D-G)。
次に、正確な定量化アルゴリズムAQuAを適用して、個々のCa2+ イベントを調べる必要があります(図3A)。このようなイベントベースの分析から、通常、個々のCa2+ イベントの起源、振幅、期間、位置、および流れ方向特性に大きな違いが観察されます(図3B)。ミクログリアプロセスにおけるCa2+ 活性ダイナミクスの分析に焦点を当てる場合、局所的なイベント、体細胞に向かって移動するイベント、および体細胞から離れるイベントの分類スキームが有益です(図3C)。
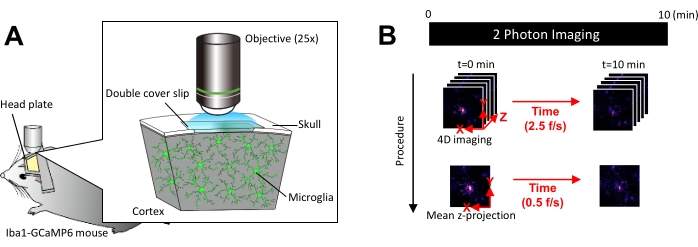
図1: in vivo ミクログリアCa2+ イメージングの実験セットアップ。 (A)実験的なセットアップ。ミクログリア特異的なGCaMP6発現を持つIba1-tTA×tetO-GCaMP6マウス。マウスの頭蓋骨に頭蓋窓を挿入することにより、ミクログリアCa2+ 活性を2光子顕微鏡を用いて in vivo で観察することができます。(B)実験スケジュールと解析手順。4D画像は、5フレームのzスタックとして少なくとも10分間取得されます。フレーム取得レートは2.5フレーム/秒です。ミクログリアCa2+ の活動を分析する前に、5フレームのzスタックを平均(または最大)強度を取ることにより、2Dのz投影に変換します。Zプロジェクションの再生速度は0.5フレーム/秒です。 この図の拡大版を見るには、ここをクリックしてください。
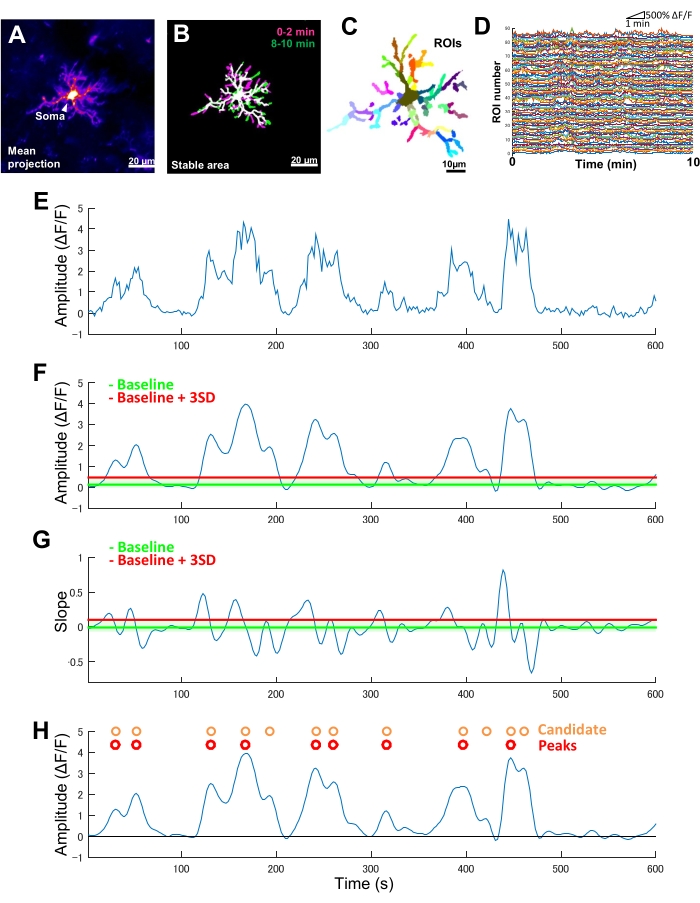
図2:ミクログリアCa2+活性のROIベースの分析。 (A)個々のミクログリアについて10分間にわたる平均GCaMP6強度投影。(B)安定領域(白)は、イメージング期間の開始(マゼンタ)と終了(緑)に採取された2分間のサンプルから得られた2値化された最大GCaMP6強度t投影のオーバーレイによって定義されます。(C)安定したエリアは、さらに地域のROIに分割されます。個々の色は、個々のROIを示します。(D)Cのすべての個々のROIのΔF/Fトレース。ROI 間のアクティビティ パターンのばらつきに注意してください。(E)単一のROIの絶対強度値から導出されたΔF/F時系列の元のトレース。(F)ローパスフィルタリング後の同じΔF/F時系列。候補の Ca2+ イベントは、ベースライン + 3 つの SD として定義される振幅カットオフしきい値 (赤い線) によって検出されます。ベースライン (緑色の線) は、ΔF/F 値の最大値と最小値の 10% を除外した上限と下限の上限内の ΔF/F 時系列全体の中央値として定義されます。(G) フィルタリングされた ΔF/F 時系列 (F) から導出された勾配トレース。True Ca2+ イベントは、ベースライン + 3 つの SD として定義された傾きカットオフしきい値 (赤い線) に基づいて、候補の Ca2+ イベントから並べ替えられます。ベースライン (緑色のライン) は、傾斜角の値の最大値と最小値の 10% を除いた、上限と下限の上限内の傾斜角の時系列全体の平均値として定義されます。(H)Fの振幅基準によって識別された候補Ca2+イベントはオレンジ色で示されています。True Ca2+ イベントは、候補の Ca2+ イベントから赤の G の傾き基準で並べ替えられます。一部の候補 Ca2+ イベントは、傾斜条件に基づいてマージされていることに注意してください。対応するフィルタリングされたΔF/F時系列は、参照用に以下にオーバーレイされています。黒い線はゼロ振幅(ΔF / F)を示します。真のCa2+イベントの平均と最大振幅は、フィルタリングされたΔF/F時系列の対応するピークの平均と最大値として導出されます。周波数(イベント/分)は、真のCa2+発火イベントの数をイメージング期間(10分)で割った値として導き出されます。スケールバー = 20 μm (A,B)、10 μm (C)。略語: ROI = 関心領域。この図の拡大版を表示するには、ここをクリックしてください。
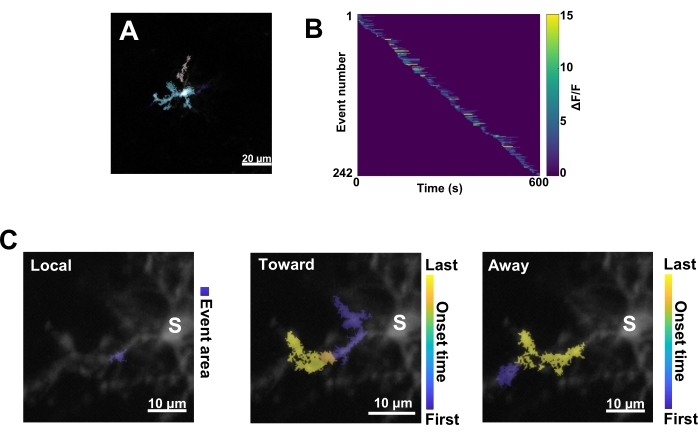
図3:ミクログリアCa2+活性のイベントベースの解析。 (A)AQuAアルゴリズムを使用して検出されたイベントの代表的な画像。色は、特定の 1 つの時点で検出された個々のイベント領域を示します。(B)個々のイベントにおける代表的な正規化されたCa2+活性(ΔF/F)を発症順にソートしたもの。右のバーは色で示されたΔF/Fを示します。(C)体細胞または局所的なイベントに向かって伝播するイベントとそこから遠ざかるイベントの代表的な活動足跡。ローカル イベントの場合、イベントの形状は青色で表示されます。伝播イベントの場合、イベントの開始時間は青黄色のスケールで示されます。AQuA は最初に Ca2+ イベントを個別に検出するため、伝播イベントは、複数の個々の Ca2+ イベントの重複する空間位置と時系列に基づいて後で識別されます。これは、図 2E-H の ROI 分析に使用されたものと同じ樹状突起分岐であることに注意してください。スケールバー = 20 μm (A)、10 μm (C)。略語: ROI = 関心領域;S =ソーマ。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この論文では、ミクログリアCa2+ 活性を高い時空間分解能でイメージングするための改良されたアプローチを紹介します。この方法は、単一の分岐プロセスのレベルでさまざまなタイプのミクログリアCa2+ 活性を検出するのに十分な感度があり、局所的なイベントと伝播的なイベントを容易に区別できます。
ミクログリアCa2+活性のin vivo二光子イメージングの一般的な方法では、イメージング品質を最大化するために以下の点に細心の注意を払う必要があります。まず、ミクログリアは傷害に非常に敏感なため、手術中に手術器具で脳の表面に直接触れることを最小限に抑えることが重要です。手術が巧みに行われたことを示す主な指標は、無傷の血管と硬膜、および手術中の出血が非常に少ないことです。次に、ヘッドプレートをマウスの頭蓋骨にしっかりと取り付け、二重カバースリップと脳表面との良好な接触により、イメージング中の運動関連のアーティファクトが大幅に減少します。これは、高い時空間分解能でイメージングする場合や、完全に覚醒したマウスでイメージングする場合に特に重要です。解析パイプラインは、心拍、呼吸、および一般的なドリフトから生じる動き関連のアーティファクトを確実に補正しますが、突然の大きな動きから生じる大きな幾何学的歪みを処理する場合は堅牢性が低くなります。
ここで説明する2つの分析方法には、異なる利点があり、さまざまな研究課題に適しています。ROIベースの解析では、ユーザーがROI(個々のプロセスなど)を事前に定義し、このROIのCa2+ アクティビティの集約ダイナミクスを抽出できます。したがって、現象が明確に定義された形態学的境界と比較的大きな領域(すなわち、プロセス分岐)の両方を持つ細胞内領域に局在すると予想される状況に最も適しています。イベントベースの解析では、個々のイベントは、ミクログリアCa2+ 活性自体の時空間ダイナミクスに基づいて定義され、その機能が解釈されるためには、ミクログリア内のユーザー定義のランドマークのコンテキストに配置する必要があります。したがって、現象の局在化に関する仮定が立てられない状況や、関心領域が比較的小さい状況(つまり、プロセスのヒント)に最も適しています。そのため、イベントベースの解析では、ミクログリアのCa2+ 活性を特徴付ける際の時空間分解能が、以前の方法と比較して向上しています。
これらのマウスでは、ミクログリアによって発現される唯一の蛍光マーカーは、Ca2+インジケーターGCaMP6です。したがって、Ca2+活性が低い領域では、複数の時間枠を組み合わせてミクログリアの形態を抽出する必要があり、時間分解能が低下する可能性があります。しかし、この制限は、ミクログリアで別の赤色安定蛍光タンパク質を発現させることで克服できます。特に、ミクログリアをトランスフェクションできる新規のアデノ随伴ウイルスが最近報告されています23,24,25。
ミクログリアCa2+ の活性が周囲の環境によってどのように変化するかは、新たな関心事です。特に、ミクログリアのCa2+ 活性は、ニューロンの活動と有意な相関関係を示すようですが、これの機能的意義はまだ完全には特徴付けられていません。したがって、ニューロンの活動操作と、ここで紹介したミクログリアCa2+ 活性のイメージングおよび解析方法を組み合わせることで、ミクログリアの生理学に関する新たな洞察が得られ、ミクログリアが生理学的および病理学的状態において果たす役割についての理解がさらに進むはずです。
開示事項
著者は、この原稿に関連する利益相反を宣言しません。
謝辞
田中健二教授(慶應義塾大学)には、Iba1-tTAマウスとtetO-GCaMP6マウスを提供していただき、感謝しています。本研究は、科学研究費補助金若手研究(B)【16K19001(殿下宛て)】、科学研究費補助金若手研究(18K14825)(殿下行き)、科学研究費補助金基盤研究(B)(B)【21H03027(殿下宛て)】、科研費学術変革領域研究(A)(21H05639(殿下行き))、科研費基盤研究(A)【17H01530, 20H00500(殿堂行き)】、JST CRESTグラント(JPMJCR1755(殿堂宛))の助成を受けて行われました。 日本。
資料
| Name | Company | Catalog Number | Comments |
| 2% xylocaine jelly | AstraZeneca, UK | ||
| B6(129S6)-Tg(Aif1-tTA)54Kftnk | RIKEN RBC, Japan | RBRC05769 | Iba1-tTA mice |
| B6;129-Actb(tm3.1(tetO-GCaMP6)Kftnk) | RIKEN RBC, Japan | RBRC09552 | tetO-GCaMP6 mice |
| Forceps | Fine science tools, US | 13008-12 | |
| G-CEM ONE | GC corporation, Japan | ||
| Glass capillary | Narishige, Japan | GDC-1 | |
| ImageJ | NIH, US | ||
| Isofulrane | Pfizer, US | ||
| Ketamin | Daiichi-Sankyo, Japan | ||
| Kwik-sil | World Precision Instruments, US | KWIK-SIL | |
| MATLAB, 2020a | MathWorks, US | ||
| Micro cover glass (2 x 2 mm, No.3) | Matsunami, Japan | custum-made | Bottom glass for cranial window |
| Micro cover glass (3 x 3 mm, No.0) | Matsunami, Japan | custum-made | Upper glass for cranial window |
| N25X-APO-MP | Nikon, Japan | N25X-APO-MP | Objective lens (25x) |
| Norland optical adhesive | Edmund optics, US | 6101 | |
| Piezo nano-positioning system, Nano-Drive | Mao City Labs, US | ||
| Razor blade | Feather, Japan | FA-10 | |
| Scissors | Fine science tools, US | 14060-11 | |
| Steel drill | Minitor, Japan | BS1201 | |
| Stereotaxic instruments | Narishige, Japan | SR-5M-HT | |
| Super-bond (C&B kit) | Sun Medical, Japan | 4560227797382 | |
| Surgical needle hook | Fine science tools, US | 10065-15 | |
| Ti:Sappire laser, MaiTai DeepSee | Spectra Physics, US | Mai Tai eHP DS | |
| Tweezers | Fine science tools, US | 11051-10 | |
| Tweezers | Fine science tools, US | 11255-20 | |
| Two-photon microscope | Nikon, Japan | A1R-MP | |
| UV craft resin | Kiyohara, Japan | UVR | |
| Xylazine | Bayer, Germany |
参考文献
- Miyamoto, A., et al. Microglia contact induces synapse formation in developing somatosensory cortex. Nature Communications. 7, 12540 (2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Cserep, C., et al. Microglia monitor and protect neuronal function through specialized somatic purinergic junctions. Science. 367 (6477), 528-537 (2020).
- Kato, G., et al. Microglial contact prevents excess depolarization and rescues neurons from excitotoxicity. eNeuro. 3 (3), (2016).
- Li, Y., Du, X. -. F., Liu, C. -. S., Wen, Z. -. L., Du, J. -. L. Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo. Developmental Cell. 23 (6), 1189-1202 (2012).
- Tremblay, M. -. E., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. Plos Biology. 8 (11), 1000527 (2010).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. The Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Oppenheim, R. W. Cell death during development of the nervous system. Annual Review of Neuroscience. 14 (1), 453-501 (1991).
- Sierra, A., Abiega, O., Shahraz, A., Neumann, H. Janus-faced microglia: beneficial and detrimental consequences of microglial phagocytosis. Frontiers in Cellular Neuroscience. 7, 6 (2013).
- Brawek, B., et al. A new approach for ratiometric in vivo calcium imaging of microglia. Scientific Reports. 7 (1), 6030 (2017).
- Eichhoff, G., Brawek, B., Garaschuk, O. Microglial calcium signal acts as a rapid sensor of single neuron damage in vivo. Biochimica et Biophysica Acta. 1813 (5), 1014-1024 (2011).
- Liu, L., et al. Microglial calcium waves during the hyperacute phase of ischemic stroke. Stroke. 52 (1), 274-283 (2021).
- Pozner, A., et al. Intracellular calcium dynamics in cortical microglia responding to focal laser injury in the PC::G5-tdT reporter mouse. Frontiers in Molecular Neuroscience. 8, 12 (2015).
- Umpierre, A. D., et al. Microglial calcium signaling is attuned to neuronal activity in awake mice. Elife. 9, e56502 (2020).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. Plos One. 7 (12), e51286 (2012).
- Tanaka, K. F., et al. Expanding the repertoire of optogenetically targeted cells with an enhanced gene expression system. Cell Reports. 2 (2), 397-406 (2012).
- Liu, Y. U., et al. Neuronal network activity controls microglial process surveillance in awake mice via norepinephrine signaling. Nature Neuroscience. 22 (11), 1771-1781 (2019).
- Stowell, R. D., et al. Noradrenergic signaling in the wakeful state inhibits microglial surveillance and synaptic plasticity in the mouse visual cortex. Nature Neuroscience. 22 (11), 1782-1792 (2019).
- Sun, W. L., et al. In vivo two-photon imaging of anesthesia-specific alterations in microglial surveillance and photodamage-directed motility in mouse cortex. Frontiers in Neuroscience. 13, 421 (2019).
- Evangelidis, G. D., Psarakis, E. Z. Parametric image alignment using enhanced correlation coefficient maximization. IEEE Transactions on Pattern Analysis and Machine Intelligence. 30 (10), 1858-1865 (2008).
- Rosario, A. M., et al. Microglia-specific targeting by novel capsid-modified AAV6 vectors. Molecular Therapy. Methods & Clinical Development. 3, 16026 (2016).
- Maes, M. E., Wogenstein, G. M., Colombo, G., Casado-Polanco, R., Siegert, S. Optimizing AAV2/6 microglial targeting identified enhanced efficiency in the photoreceptor degenerative environment. Molecular Therapy. Methods & Clinical Development. 23, 210-224 (2021).
- Lin, R., et al. Directed evolution of adeno-associated virus for efficient gene delivery to microglia. Nature Methods. 19 (8), 976-985 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved