Method Article
Análise espaço-temporal da atividade microglial de Ca2+ em resolução de célula única
Neste Artigo
Resumo
Neste artigo, descrevemos um protocolo para imagens in vivo da atividade microglial de Ca2+ e subsequente análise de sua dinâmica espaço-temporal. Este método permite uma caracterização completa de como a micróglia responde às mudanças no ambiente cerebral, capturando adequadamente as finas escalas espaço-temporais em que tais eventos ocorrem.
Resumo
A microglia é a única célula imune residente no sistema nervoso central. Sua morfologia é altamente plástica, mudando dependendo de sua atividade. Em condições homeostáticas, a microglia possui uma morfologia altamente ramificada. Isso facilita o monitoramento do ambiente circundante por meio da extensão e retração contínuas de seus processos. Durante a lesão cerebral e a inflamação, no entanto, a microglia é ativada e sofre mudanças morfológicas dramáticas, retraindo seus processos ramificados e inchando seu corpo celular. Isso facilita atividades como migração e fagocitose, que a micróglia realiza para navegar no ambiente cerebral para um estado menos patológico.
Essa estreita relação entre a morfologia microglial e as mudanças em sua atividade permitiu insights consideráveis sobre várias funções microgliais. No entanto, essas mudanças morfológicas e de atividade são fenômenos que podem resultar de qualquer número de vias de sinalização intracelular. Além disso, o intervalo de tempo entre o estímulo e a resposta, bem como a morfologia altamente compartimentada da microglia, dificultam o isolamento dos mecanismos causais que sustentam a função. Para resolver esse problema, desenvolvemos uma linhagem de camundongos geneticamente modificada na qual uma proteína indicadora fluorescente de Ca2+ altamente sensível é especificamente expressa na microglia.
Depois de descrever métodos para imagens microgliais in vivo de Ca2+ , este artigo apresenta uma abordagem de análise estruturada que classifica essa atividade de Ca2+ em regiões subcelulares racionalmente definidas, garantindo assim que as dimensões espaciais e temporais das informações codificadas sejam extraídas de forma significativa. Acreditamos que essa abordagem fornecerá uma compreensão detalhada das regras de sinalização intracelular que governam a diversidade de atividades microgliais associadas a funções cerebrais superiores e condições patológicas.
Introdução
A microglia é a célula imune residente no sistema nervoso central (SNC) e desempenha papéis importantes na manutenção de um ambiente cerebral homeostático e na regulação da formação de circuitos neurais durante o desenvolvimento do cérebro 1,2. Uma característica única da microglia no SNC é que sua morfologia é altamente plástica; no entanto, fenótipos morfológicos distintos podem ser associados a funções particulares. Além disso, a transformação entre os fenótipos morfológicos é altamente dinâmica, ocorrendo em escalas de tempo rápidas em resposta a mudanças no ambiente circundante 3,4.
Sob condições fisiológicas homeostáticas, a microglia assume uma morfologia altamente ramificada, com múltiplos processos irradiando para fora em todas as direções. Esses processos ramificados demonstram alta motilidade, estendendo-se e retraindo-se continuamente 3,4. Essa atividade é direcionada principalmente para o contato periódico com sinapses neuronais, axônios e somas para monitorar a atividade neuronal 5,6,7,8,9. No entanto, quando o cérebro é lesado, a microglia detecta rapidamente essa anormalidade e, como primeiro passo em sua resposta adaptativa, direciona a extensão de seus processos para o local correspondente 3,4. Onde a microglia é necessária para realizar fagocitose de células mortas e metabólitos, elas assumem uma morfologia semelhante à amebóide, encurtando seus processos e ampliando seus corpos celulares, como parte de sua transição para o fenótipo imunologicamente ativado10,11.
No entanto, embora as mudanças morfológicas dramáticas dos processos microgliais sejam facilmente detectadas, mudanças de escala mais finas do soma celular são significativamente mais difíceis de capturar, especialmente em uma resolução temporal fisiologicamente relevante. Além disso, as próprias mudanças morfológicas representam apenas o resultado integrado de qualquer número de vias de sinalização intracelular. Isso é problemático para o objetivo de rastrear a atividade funcional e vincular mecanicamente um estímulo à resposta final que ele provoca.
Dado seu papel generalizado como um segundo mensageiro, examinar a dinâmica intracelular de Ca2+ captura melhor as informações espaço-temporais associadas ao estudar processos celulares dinâmicos. Tal abordagem é aplicável à microglia, uma vez que eles expressam uma variedade de receptores ionotrópicos e metabotrópicos ligados à elevação intracelular de Ca2+ a jusante. De fato, a imagem in vivo de Ca2+ tem sido usada para caracterizar aspectos espaço-temporais das atividades microgliais em tempo real, correlacionando com sucesso as mudanças na atividade microglial do Ca2+ com lesão cerebral, inflamação e hiper e hipoatividade nos neurônios 12,13,14,15,16. Por exemplo, as elevações de Ca2+ associadas à extensão do processo microglial em resposta à atividade neuronal hiper/hipoativa provavelmente refletem o processo de polimerização de actina dependente de Ca2+ subjacente16. Além disso, a imagem in vivo de Ca2+ também pode ser prontamente combinada com abordagens farmacológicas. Por exemplo, enquanto a microglia expressa os receptores P2X (ionotrópicos) e P2Y (metabotrópicos), a aplicação local de agonistas P2Y imita e subsequentemente dessensibiliza a resposta microglial de Ca2+ a neurônios vizinhos danificados13, implicando assim a maior relevância da sinalização P2Y para a detecção de danos neuronais.
Até o momento, relatórios anteriores que examinaram a atividade microglial de Ca2+ empregaram métodos de análise baseados na região de interesse (ROI). Uma desvantagem dessas abordagens é que elas ainda são muito grosseiras para serem capazes de resolver a dinâmica espaço-temporal da atividade de Ca2+ no nível de processos microgliais individuais. Assim, este protocolo descreve métodos convencionais baseados em ROI para analisar a atividade microglial de Ca2+ e abordagens mais recentes baseadas em eventos, que podem extrair eventos individuais de Ca2+ em processos microgliais. Antes disso, fornecemos um guia geral para imagens in vivo de dois fótons para capturar adequadamente a atividade microglial de Ca2+ para análise detalhada.
Protocolo
Todos os experimentos com animais foram aprovados pelos Comitês de Pesquisa Animal do Instituto Nacional de Ciências Fisiológicas e estavam de acordo com as diretrizes do National Institutes of Health. Para todos os experimentos, camundongos machos de 8 a 10 semanas de idade foram criados em um ciclo claro/escuro de 12/12 h com acesso ad libitum a comida e água. Para visualizar a atividade de Ca2+ na microglia, camundongos com a molécula adaptadora de ligação de Ca2+ ionizada 1 (Iba1)-transativador de tetraciclina (Iba1-tTA) foram cruzados com camundongos operador de tetraciclina-GCaMP6 (tetO-GCaMP6)17,18. Assim, na ausência de suplementação análoga à tetraciclina, o promotor Iba1 impulsiona a expressão de GCaMP6, exclusivamente na microglia. Para todos os experimentos, a suplementação dietética de doxiciclina foi interrompida 6 semanas após o nascimento. Ao final de todos os experimentos, os camundongos foram eutanasiados por overdose de isoflurano seguida de luxação cervical. Consulte a Tabela de Materiais para obter detalhes relacionados a todos os materiais, animais e reagentes usados neste protocolo.
1. Preparação cirúrgica de camundongos para imagens in vivo de dois fótons; Dia 1
- Realize todos os procedimentos cirúrgicos dentro de um gabinete de fluxo de ar laminar para manter as condições de trabalho estéreis. Antes de iniciar a cirurgia, esterilize o interior do gabinete com luz ultravioleta por 5 min.
- Esterilize todas as superfícies de trabalho, a estrutura cirúrgica e os instrumentos estereotáxicos, limpando-os com etanol 70%.
- Esterilize todos os instrumentos cirúrgicos (tesoura, fórceps, lâmina de barbear, pinça) e a placa de cabeça feita sob medida para ser fixada no crânio do camundongo, imergindo-os em solução de gluconato de clorexidina a 1%.
- Anestesiar o camundongo com cetamina (7,4 mg kg−1, intraperitonealmente [i.p.]) e xilazina (10 mg kg−1, i.p.). Devolva-o à gaiola de origem até que a anestesia faça efeito. Confirme a indução completa da anestesia pela perda do reflexo de pinça do dedo do pé.
- Esterilize o couro cabeludo com gluconato de clorexidina a 1%. Raspe o pelo com uma lâmina de barbear.
- Prenda o mouse dentro da estrutura cirúrgica por meio de instrumentos estereotáxicos.
- Aplique pomada veterinária nos olhos para evitar o ressecamento durante a anestesia.
- Aplique geléia de xilocaína a 2% no couro cabeludo para controle da dor. Aguarde 5 min.
- Remova o couro cabeludo com uma tesoura e exponha o crânio. Limpe o periósteo e seque a superfície exposta do crânio esfregando com cotonetes.
NOTA: As áreas expostas do crânio devem estar completamente secas para garantir uma forte ligação com a placa de cabeça feita sob medida. - Prenda a placa de cabeça feita sob medida ao crânio com cimento dental.
- Uma vez que o cimento tenha endurecido, preencha as lacunas entre a superfície do crânio e as bordas da placa de cabeça feita sob medida com cimento dental adicional.
- Impermeabilize as superfícies do cimento e do crânio aplicando cimento de resina adesiva dental à base de acrílico.
- Retorne o mouse para sua gaiola inicial, colocando-o em uma almofada de aquecimento. Monitore o camundongo até que ele recupere consciência suficiente para manter a decúbito esternal (dentro de 2 h).
NOTA: Os ratos devem estar totalmente recuperados no dia seguinte e podem ser alojados com outros animais.
2. Preparação cirúrgica de camundongos para imagens in vivo de dois fótons; Dia 2
- Realize todos os procedimentos cirúrgicos dentro de um gabinete de fluxo de ar laminar para manter as condições de trabalho estéreis. Antes de iniciar a cirurgia, esterilize o interior do gabinete com luz ultravioleta por 5 min.
- Laminar duas lamínulas de vidro de diferentes dimensões (vidro superior: 3 mm × 3 mm; vidro inferior: 2 mm × 2 mm) com resina de grau óptico curável por UV.
NOTA: A lamínula dupla fornece proteção de longo prazo para a região do cérebro exposta pela janela craniana, permitindo acesso óptico crônico. Assim, suas dimensões podem ser alteradas para se adequar à região do cérebro a ser fotografada. - Esterilize todas as superfícies de trabalho e a estrutura cirúrgica limpando-as com etanol 70%.
- Esterilize todos os instrumentos cirúrgicos (broca de aço, pinça, gancho de agulha cirúrgica) imergindo-os em solução de gluconato de clorexidina a 1%.
- Anestesiar o camundongo com isoflurano (indução a 4%, manutenção a 1,2% -1,5%). Prenda o mouse dentro da estrutura da cirurgia por meio de sua placa de cabeça.
- Para fazer uma janela craniana sobre o córtex motor primário, marque um quadrado com dimensões de 2 mm × 2 mm centralizados 0,2 mm anterior e 1 mm lateral do ponto de referência do crânio de Bregma.
- Afine o crânio ao longo da borda do quadrado marcado usando a broca de aço.
NOTA: Quando perto da espessura desejada, as áreas cranianas finas parecerão transparentes quando molhadas com solução salina e rachaduras finas começarão a aparecer. - Depois de confirmar que toda a borda do quadrado marcado foi devidamente afinada, insira cuidadosamente o gancho da agulha cirúrgica logo abaixo da superfície do crânio, orientando sua ponta em direção ao centro do quadrado. Levante suavemente o pedaço quadrado do crânio com o gancho e use uma pinça para retirá-lo do resto do crânio. Se ocorrer sangramento, lave continuamente a superfície cerebral exposta com solução salina até que desapareça completamente.
- Coloque a lamínula dupla na superfície exposta do cérebro, orientando o lado com a lamínula menor em direção ao cérebro. Certifique-se de que as bordas da lamínula maior estejam em contato com as bordas da janela craniana.
- Usando uma haste de vidro com ponta de silicone montada em um manipulador, pressione suavemente a lamínula dupla para garantir que ela faça um bom contato com a superfície do cérebro.
- Preencha a lacuna entre a lamínula dupla, o crânio e a superfície do cérebro com resina curável por UV e irradie com luz UV até endurecer (~ 20 s). Levante lentamente a haste de vidro com ponta de silicone para longe da lamínula dupla.
- Deixe o mouse se recuperar, colocando-o em uma almofada de aquecimento. Monitore o camundongo até que ele recupere a consciência suficiente para manter a decúbito esternal (30 min).
- Prossiga para a etapa 3 ou retorne o mouse à sua gaiola inicial.
NOTA: Após uma cirurgia proficiente, a dura-máter e todos os vasos sanguíneos subjacentes estarão completamente intactos, sem sangramento. Nesse caso, a inflamação é mínima e é possível prosseguir imediatamente para a etapa 3. Se não tiver certeza, espere de 1 a 3 semanas para garantir que qualquer inflamação tenha sido totalmente resolvida.
3. Coleta de dados usando imagens de dois fótons in vivo
- Ligue a configuração de imagem com antecedência para garantir que o laser tenha tempo suficiente para aquecer e estabilizar. Ajuste o laser para emitir em um comprimento de onda de 920 nm, que é o espectro de dois fótons que excita de maneira ideal o fluoróforo GCaMP6.
- Posicione o mouse sob uma lente objetiva de microscópio de 25x e costume-o por 30 min. Se necessário, anestesiar o camundongo com isoflurano durante a imagem (indução a 4%, manutenção a 1,2% -1,5%).
NOTA: O isoflurano pode não ser apropriado para algumas aplicações de pesquisa, pois afeta a motilidade do processo microglial e a atividade do Ca2+ 19,20,21. - Defina o zoom para 1x e, em seguida, procure por micróglia expressando GCaMP6 na área da janela craniana. Pesquise a uma profundidade entre 100 μm e 300 μm abaixo da superfície do cérebro.
- Uma vez que uma micróglia apropriada que expressa GCaMP6 tenha sido encontrada, maximize o zoom para que a atividade de Ca2+ possa ser capturada com resolução de célula única.
- Confirme visualmente se a atividade de Ca2+ foi claramente capturada e ajuste a potência do laser e o ganho de imagem, se necessário.
NOTA: A potência do laser deve ser minimizada o máximo possível para evitar fotobranqueamento e lesões na microglia. - Execute a aquisição de imagem quadridimensional (4D) da seguinte forma (etapas 3.6.1-3.6.3; Figura 1B):
- Defina as dimensões da imagem para área XY = 512 × 512 pixels, 0,25 μm/pixel; Área Z = cinco planos z, passo z de 3 μm (Figura 1B).
- Defina a taxa de aquisição para 2,5 quadros/s.
NOTA: O Z-scanning nesta velocidade é facilitado por um sistema de nanoposicionamento piezoelétrico. - Adquira dados até que pelo menos 10 eventos individuais de Ca2+ sejam observados (geralmente 10 min).
4. Preparação para análise (correção de movimento, projeção z média/máxima)
- Antes de prosseguir com a análise da atividade microglial de Ca2+ , corrija as imagens 4D para artefatos relacionados ao movimento (registro de imagem) usando o algoritmo de alinhamento de imagem ECC22 no ambiente de programação MATLAB (R2020a). Baixe o código em: https://www.mathworks.com/matlabcentral/fileexchange/27253-ecc-image-alignment-algorithm-image-registration.
- Crie uma imagem 3D de referência registrando todas as imagens no primeiro período de tempo usando a operação imregister MATLAB (caixa de ferramentas de processamento de imagem padrão).
- Registre todas as imagens subsequentes, combinando-as com o plano z correspondente da imagem 3D de referência usando a função ecc (biblioteca de algoritmos de alinhamento de imagem ECC).
- Gere projeções z de intensidade média a partir das imagens registradas usando a operação média do MATLAB. Se o sinal de imagem for muito fraco, gere projeções z de intensidade máxima usando a operação max MATLAB.
NOTA: A relação sinal-ruído é pior ao usar projeções z de intensidade máxima. - Prossiga para a etapa 5 ou 6. Use as projeções z geradas na etapa 4 como alvo de análise para mapear a dinâmica espaço-temporal da atividade de Ca2+ nas etapas 5 e 6.
5. Análise baseada em ROI
- Usando as projeções z geradas na etapa 4, identifique os processos microgliais que mantêm um perfil de área estável (área estável) durante todo o período de imagem para análise subsequente da atividade de Ca2+ da seguinte forma (etapas 5.3-5.6):
- Gere projeções t de intensidade máxima separadas das imagens 4D registradas a partir de amostras de 2 minutos coletadas no início e no final do período de imagem usando a operação máxima do MATLAB.
- Binarize as projeções t para gerar polígonos da morfologia microglial correspondentes ao início e ao fim do período de imagem usando a operação IMBINARIZE MATLAB. Use o limite padrão definido automaticamente.
NOTA: Se o sinal de Ca2+ for fraco durante o início e o final do período de imagem, a binarização pode gerar polígonos com bordas ausentes. Nesse caso, desenhe manualmente as bordas ausentes usando a ferramenta lápis no ImageJ. - Sobreponha os polígonos de projeção t usando a operação imadd MATLAB. A(s) região(ões) sobreposta(s) representa(m) a área estável (Figura 2B).
- Dentro de áreas estáveis identificadas, use a operação MATLAB drawpolygon para definir e rastrear manualmente ROIs para cada um dos processos microgliais primários e quaisquer sub-ramos óbvios de segunda ordem.
- Acompanhe as intensidades absolutas de fluorescência médias em um ROI individual em todos os períodos de tempo (Figura 2C, D).
- A partir das séries temporais de intensidades absolutas de fluorescência, calcular a variação relativa da intensidade de fluorescência (ΔF/F) de acordo com a equação (1). Esta série temporal representa a dinâmica microglial normalizada de Ca2+ no nível de ROIs individuais.
ΔF/F = (F(t) - F0) / F0 (1)
Onde F (t) é a intensidade de fluorescência registrada em um determinado momento e F0 é o10º percentil da intensidade de fluorescência em todos os períodos de tempo (Figura 2E). - Identifique os eventos de disparo de Ca2+ candidatos que ocorrem em um determinado ROI individual da seguinte forma (etapas 5.5.1-5.5.3):
- Aplique a filtragem passa-baixa de resposta ao impulso finito (FIR) tipo I na série temporal ΔF/F usando a operação fir1 MATLAB. Defina a frequência de corte para o valor de Nyquist (metade da taxa de amostragem).
- Inspecione visualmente o traço filtrado para confirmar se os picos de traço individuais correspondem a rajadas de atividade de Ca2+ nas imagens 4D registradas (Figura 2F).
- Identifique eventos de disparo candidatos a Ca2+ como inflexões côncavas para baixo no traço de série temporalΔF / F. Defina um limite de linha de base como o valor médio de ΔF/F dentro dos tetos superior e inferior que excluem as amplitudes máxima e mínima de 10% em todos os períodos de tempo. Defina um limiar de detecção de três DPs acima do limite basal (Figura 2F,H).
- Identifique os verdadeiros eventos de disparo de Ca2+ dos candidatos da seguinte forma (etapas 5.5.1-5.5.2):
- Calcule a inclinação de cada evento candidato diferenciando os quadros de séries temporais ΔF/F filtrados correspondentes usando a operação MATLAB de gradiente numérico .
- Posteriormente, identifique eventos verdadeiros de Ca2+ com base no tempo de subida do perfil. Defina um limite de linha de base como a média dos valores de inclinação em todos os eventos candidatos. Defina um limiar de detecção de três DPs acima do limite da linha de base (Figura 2G,H).
- Caracterize os verdadeiros eventos de Ca2+ da seguinte forma (etapas 5.6.1-5.6.3):
NOTA: A seguir não é uma lista exaustiva de parâmetros que podem ser usados para caracterizar eventos microgliais de Ca2+ . Os parâmetros de interesse dependem do objetivo do estudo.- Derive a amplitude máxima de um evento de disparo verdadeiro de Ca2+ como o valor ΔF/F do quadro de série temporal ΔF/F correspondente.
- Derive a amplitude média de um evento de disparo verdadeiro de Ca2+ como o valor médio de ΔF/F em todo o subconjunto de quadros de séries temporais ΔF/F correspondentes.
- Derive a frequência de eventos verdadeiros de Ca2+ como o número de eventos dividido pelo tempo de imagem.
6. Análise baseada em eventos
- Execute análises baseadas em eventos nas projeções z da etapa 4 usando a biblioteca AQuA no ambiente de programação MATLAB. Baixe o código em: https://github.com/yu-lab-vt/AQuA.
NOTA: Um passo a passo de uso geral para a biblioteca AQuA está disponível em: https://drive.google.com/file/d/1a3lhe0dUth-5J1-S2fZlPOCZlPbeuvUr/view. A documentação detalhada da biblioteca AQuA está disponível em: https://drive.google.com/file/d/1CckDLbrkw16b7MPlOQdYpZciIz80Snm_/view. - Depois de iniciar o MATLAB, alterne da pasta do diretório de trabalho padrão para a pasta do diretório de trabalho designada do AQuA usando a operação cd .
- Carregue as imagens 4D registradas no pipeline de análise AQuA da seguinte forma (etapas 6.3.1-6.3.2):
- Inicie a GUI do AQuA. Digite aqua_gui na janela de comando do MATLAB na pasta de diretório de trabalho designada do AQuA.
- Na GUI do AQuA, clique em novo projeto e selecione as imagens registradas a serem analisadas. Especifique o tipo de dados (GCaMPInVivo_cyto_Lck_) e os parâmetros de imagem (segundos de resolução temporal por quadro = 1,993; resolução espacial μm por pixel = 0,25; excluir pixels menores que essa distância até a borda = 5). Clique em abrir para carregar os dados.
- Defina pontos de referência para os pipelines de análise subsequentes rastreando áreas de interesse. Normalmente, os pontos de referência são baseados no limite da célula e na área do corpo celular.
- Posteriormente, detecte eventos candidatos a Ca2+ executando os pipelines de análise automatizados para os seguintes parâmetros: sinal ativo, super voxel, detecção de eventos, eventos limpos e eventos de mesclagem.
NOTA: Uma explicação detalhada sobre cada um desses parâmetros e suas saídas de pontuação candidata é fornecida no passo a passo do AQuA. Resumidamente, esses parâmetros ajustam o limite de detecção de eventos Ca2+ da seguinte forma: sinal ativo = amplitude de fluorescência, super voxel = agrupamento de fluorescência no espaço 3D, detecção de eventos = cinética de aumento / decaimento, eventos limpos = relação sinal-ruído e eventos de mesclagem = separação temporal de eventos. - Inspecione visualmente os eventos de Ca2+ detectados (sobrepostos automaticamente nas imagens originais registradas). Se necessário, ajuste as configurações de parâmetros dos pipelines de análise considerando a qualidade da imagem em termos dos parâmetros acima; Se a qualidade da imagem para um determinado parâmetro for boa, um limite mais alto pode ser definido e vice-versa.
- Uma vez que todos os eventos de Ca2+ tenham sido detectados adequadamente, caracterize esses eventos no ambiente principal do MATLAB da seguinte forma (etapas 6.8-6.14):
- Exporte os arquivos de saída da análise AQuA.
NOTA: Uma explicação detalhada sobre os arquivos de saída, os recursos extraídos que são usados para definir eventos Ca2+ e os parâmetros subjacentes desses recursos extraídos é fornecida na documentação do AQuA. - (opcional) Categorize todos os eventos de Ca2+ em dois grupos: 1) eventos começando no soma e 2) eventos começando nos processos.
- Acesse a amplitude de eventos individuais de Ca2+ na estrutura res.dffMat MATLAB do arquivo de saída de análise AQuA (arquivo .mat).
- Derive a frequência de eventos individuais de Ca2+ usando a operação res.fts.loc.x3D MATLAB (biblioteca AQuA).
- Derive a duração de eventos individuais de Ca2+ usando a operação res.fts.curve.width11 MATLAB (biblioteca AQuA).
- Derive a área de eventos individuais de Ca2+ usando a operação res.fts.basic.area MATLAB (biblioteca AQuA).
- Categorize todos os eventos de Ca2+ como: 1) eventos locais, 2) eventos propagativos viajando em direção ao soma e 3) eventos propagativos viajando para longe do soma. Para fazer isso, use as operações res.fts.region.landmarkDir.chgToward e res.fts.region.landmarkDir.chgAway MATLAB (biblioteca AQuA) (Figura 3C).
Resultados
Em camundongos transgênicos que expressam exclusivamente GCaMP6 (proteína fluorescente sensível a Ca2+) na microglia, normalmente observamos diversos padrões de atividade microglial de Ca2+ ( Figura 2A ). É importante ressaltar que, mesmo dentro de uma única micróglia, os padrões de atividade do Ca2+ podem diferir drasticamente entre os processos.
Para quantificar essas diferenças processo a processo na dinâmica espaço-temporal da atividade microglial do Ca2+, as áreas estáveis devem primeiro ser identificadas e depois divididas em ROIs finamente segmentadas ( Figura 2B , C ). Para cada ROI, os parâmetros da atividade de Ca2+ devem ser derivados e quantificados, como amplitude e frequência, extraindo características como amplitudes locais e inclinações de traços da série temporal de intensidade de fluorescência (Figura 2D-G).
Em seguida, os eventos individuais de Ca2+ devem ser examinados aplicando o algoritmo de quantificação preciso AQuA (Figura 3A). A partir de tais análises baseadas em eventos, grandes diferenças são normalmente observadas nas características de origem, amplitude, duração, localização e direção do fluxo de eventos individuais de Ca2+ (Figura 3B). Se focar na análise da dinâmica da atividade de Ca2+ em processos microgliais, um esquema de classificação de eventos locais, eventos que viajam em direção ao soma e eventos que viajam para longe do soma é informativo ( Figura 3C ).
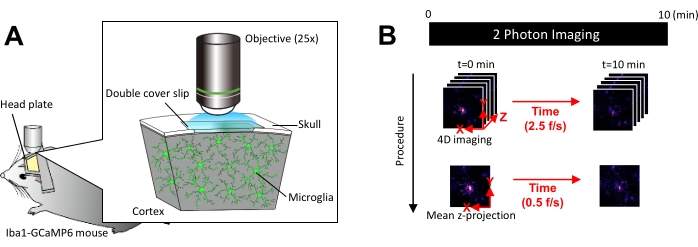
Figura 1: Configuração experimental para imagens microgliais in vivo de Ca2+ . (A) Configuração experimental. Um camundongo Iba1-tTA × tetO-GCaMP6 com expressão GCaMP6 específica da microglia. Ao inserir uma janela craniana no crânio do camundongo, a atividade microglial do Ca2+ pode ser observada in vivo usando microscopia de dois fótons. (B) Cronograma experimental e procedimento de análise. As imagens 4D são adquiridas por pelo menos 10 minutos como z-stacks de cinco quadros. A taxa de aquisição de quadros é de 2,5 quadros/s. Antes de analisar a atividade microglial de Ca2+ , as pilhas z de cinco quadros são convertidas em projeções z 2D, tomando a intensidade média (ou máxima). A taxa de reprodução da projeção z é de 0,5 quadros/s. Clique aqui para ver uma versão maior desta figura.
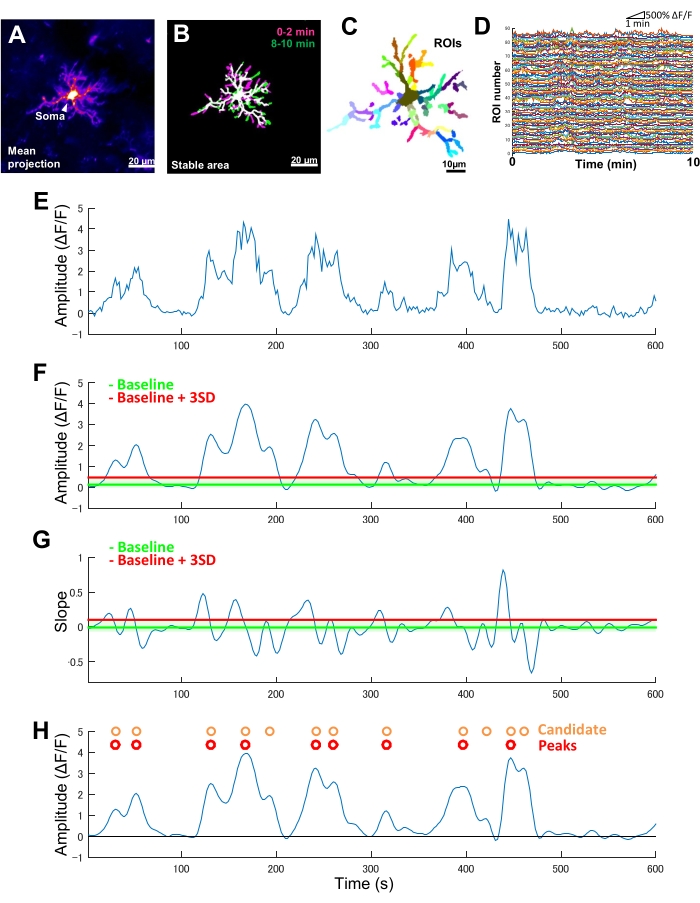
Figura 2: Análise baseada em ROI para atividade microglial de Ca2+ . (A) Projeção média da intensidade GCaMP6 ao longo de 10 min para uma micróglia individual. (B) As áreas estáveis (brancas) são definidas por uma sobreposição de projeções t binarizadas de intensidade máxima de GCaMP6 derivadas de amostras de 2 minutos coletadas no início (magenta) e no final (verde) de um período de imagem. (C) As áreas estáveis são ainda segmentadas em ROIs regionais. Cores individuais indicam ROIs individuais. (D) Traços ΔF / F de todas as ROIs individuais em C. Observe a variação nos padrões de atividade entre os ROIs. (E) Traço original de uma série temporal ΔF / F derivada de valores de intensidade absoluta para um único ROI. (F) A mesma série temporal ΔF / F após a filtragem passa-baixa. Os eventos candidatos a Ca2+ são detectados por um limite de corte de amplitude (linha vermelha) definido como linha de base + três SDs. A linha de base (linha verde) é definida como o valor mediano em toda a série cronológica ΔF/F dentro de um limite superior e inferior que exclui os 10% máximos e mínimos dos valores ΔF/F . (G) O traço de inclinação derivado da série temporal ΔF / F filtrada em F. Os eventos verdadeiros de Ca2+ são classificados a partir de eventos candidatos de Ca2+ com base em um limite de corte de inclinação (linha vermelha) definido como linha de base + três SDs. A linha de base (linha verde) é definida como o valor médio em toda a série cronológica de inclinação dentro de um teto superior e inferior que exclui os 10% máximos e mínimos dos valores de inclinação. (H) Os eventos candidatos a Ca2+ identificados por critérios de amplitude em F são indicados em laranja. Eventos verdadeiros de Ca2+ classificados de eventos candidatos de Ca2+ por critérios de inclinação em G em vermelho. Observe que alguns eventos candidatos a Ca2+ foram mesclados com base nos critérios de inclinação. A série temporal ΔF/F filtrada correspondente é sobreposta abaixo para referência. A linha preta indica amplitude zero (ΔF/F). A amplitude média e máxima dos eventos verdadeiros de Ca2+ são derivadas como a média e o máximo de seus picos correspondentes na série temporal ΔF / F filtrada. A frequência (eventos/min) é derivada como o número de eventos de disparo verdadeiros de Ca2+ dividido pelo período de imagem (10 min). Barras de escala = 20 μm (A,B), 10 μm (C). Abreviatura: ROI = região de interesse. Clique aqui para ver uma versão maior desta figura.
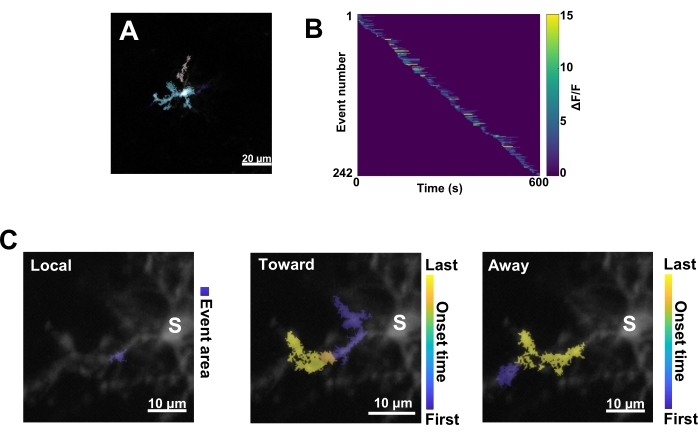
Figura 3: Análise baseada em eventos para a atividade microglial de Ca2+. (A) Imagens representativas de eventos detectados usando o algoritmo AQuA. As cores indicam áreas de eventos individuais detectadas em um determinado ponto de tempo. (B) Atividade Ca2+ normalizada representativa (ΔF / F) em eventos individuais classificados pela ordem de início. A barra direita indica ΔF / F indicado por cores. (C) Pegadas de atividade representativas de eventos que se propagam em direção e para longe do soma ou eventos locais. Para eventos locais, a forma do evento é mostrada em azul. Para eventos propagativos, o tempo de início do evento é indicado pela escala azul-amarela. Como o AQuA detecta inicialmente eventos de Ca2+ individualmente, os eventos propagativos são identificados posteriormente com base nas localizações espaciais sobrepostas e nas séries temporais de vários eventos individuais de Ca2+. Observe que este é o mesmo ramo dendrítico usado para a análise de ROI na Figura 2E-H. Barras de escala = 20 μm (A), 10 μm (C). Abreviatura: ROI = região de interesse; S = soma. Clique aqui para ver uma versão maior desta figura.
Discussão
Este artigo apresenta uma abordagem aprimorada para a imagem da atividade microglial de Ca2+ com alta resolução espaço-temporal. Este método é sensível o suficiente para detectar diferentes tipos de atividade microglial de Ca2+ no nível de processos ramificados únicos, distinguindo prontamente entre eventos locais e propagativos.
No método geral para imagens in vivo de dois fótons da atividade microglial de Ca2+ , deve-se prestar muita atenção aos seguintes pontos para maximizar a qualidade da imagem. Primeiro, como a microglia é extremamente sensível a lesões, é importante minimizar o toque direto na superfície do cérebro com ferramentas cirúrgicas durante a cirurgia. As principais indicações de que a cirurgia foi realizada com proficiência são vasos sanguíneos intactos e dura-máter e sangramento mínimo durante a cirurgia. Em segundo lugar, a fixação segura da placa da cabeça ao crânio do camundongo e o bom contato entre a lamínula dupla e a superfície do cérebro reduzem muito os artefatos relacionados ao movimento durante a geração de imagens. Isso é especialmente importante ao obter imagens com altas resoluções espaço-temporais e em camundongos totalmente acordados. Embora o pipeline de análise compense de forma confiável os artefatos relacionados ao movimento decorrentes dos batimentos cardíacos, respiração e desvio geral, ele é menos robusto ao lidar com distorções geométricas significativas que surgem de grandes movimentos repentinos.
Os dois métodos de análise descritos aqui oferecem vantagens diferentes e são adequados a diferentes questões de pesquisa. Na análise baseada em ROI, o usuário predefine o ROI (como processos individuais), permitindo que a dinâmica agregada da atividade de Ca2+ desse ROI seja extraída. Assim, é mais adequado para situações em que se espera que os fenômenos estejam localizados em uma área subcelular que tenha limites morfológicos bem definidos e uma área relativamente grande (ou seja, um ramo do processo). Na análise baseada em eventos, os eventos individuais são definidos com base na dinâmica espaço-temporal da própria atividade microglial de Ca2+ e devem então ser colocados no contexto de pontos de referência definidos pelo usuário dentro da microglia para que sua função seja interpretada. Assim, é mais adequado para situações em que as suposições sobre a localização de fenômenos não podem ser feitas ou onde a área de interesse é relativamente pequena (ou seja, uma dica de processo). Como tal, a análise baseada em eventos oferece melhor resolução espaço-temporal ao caracterizar a atividade microglial de Ca2+ em comparação com os métodos anteriores.
Nesses camundongos, o único marcador fluorescente expresso pela microglia é o indicador Ca2+ GCaMP6. Assim, em regiões onde a atividade de Ca2+ é baixa, a morfologia microglial deve ser extraída combinando vários períodos de tempo, o que pode degradar a resolução temporal. No entanto, essa limitação pode ser superada expressando uma proteína fluorescente estável vermelha separada na microglia. Notavelmente, novos vírus adeno-associados capazes de transfectar microglia foram descritos recentemente23 , 24 , 25 .
Como a atividade microglial do Ca2+ é alterada pelo ambiente circundante é um tópico emergente de interesse. Em particular, a atividade microglial do Ca2+ parece mostrar correlações significativas com a atividade neuronal, embora o significado funcional disso ainda não tenha sido completamente caracterizado. Assim, a combinação da manipulação da atividade neuronal com os métodos de imagem e análise da atividade microglial do Ca2+ apresentados aqui deve produzir novos insights sobre a fisiologia microglial e avançar ainda mais nossa compreensão dos papéis que a microglia desempenha nos estados fisiológicos e patológicos.
Divulgações
Os autores declaram não haver conflitos de interesse associados a este manuscrito.
Agradecimentos
Somos gratos ao Prof. Kenji Tanaka (Universidade Keio, Tóquio, Japão) por fornecer camundongos Iba1-tTA e camundongos tetO-GCaMP6. Este trabalho foi apoiado por Grants-in-Aid for Young Scientists (B) [16K19001 (para H.H.)], Grants-in-Aid for Early-Career-Scientists [18K14825 (para H.H.)], Grant-in-Aid for Scientific Research (B) [21H03027 (para H.H.)], Grant-in-Aid for Transformative Research Areas (A) [21H05639 (para H.H.)], Grant-in-Aid for Scientific Research (A) [17H01530, 20H00500 (para J.N.)], e JST CREST Grant [JPMJCR1755 (para J.N.)], Japão.
Materiais
| Name | Company | Catalog Number | Comments |
| 2% xylocaine jelly | AstraZeneca, UK | ||
| B6(129S6)-Tg(Aif1-tTA)54Kftnk | RIKEN RBC, Japan | RBRC05769 | Iba1-tTA mice |
| B6;129-Actb(tm3.1(tetO-GCaMP6)Kftnk) | RIKEN RBC, Japan | RBRC09552 | tetO-GCaMP6 mice |
| Forceps | Fine science tools, US | 13008-12 | |
| G-CEM ONE | GC corporation, Japan | ||
| Glass capillary | Narishige, Japan | GDC-1 | |
| ImageJ | NIH, US | ||
| Isofulrane | Pfizer, US | ||
| Ketamin | Daiichi-Sankyo, Japan | ||
| Kwik-sil | World Precision Instruments, US | KWIK-SIL | |
| MATLAB, 2020a | MathWorks, US | ||
| Micro cover glass (2 x 2 mm, No.3) | Matsunami, Japan | custum-made | Bottom glass for cranial window |
| Micro cover glass (3 x 3 mm, No.0) | Matsunami, Japan | custum-made | Upper glass for cranial window |
| N25X-APO-MP | Nikon, Japan | N25X-APO-MP | Objective lens (25x) |
| Norland optical adhesive | Edmund optics, US | 6101 | |
| Piezo nano-positioning system, Nano-Drive | Mao City Labs, US | ||
| Razor blade | Feather, Japan | FA-10 | |
| Scissors | Fine science tools, US | 14060-11 | |
| Steel drill | Minitor, Japan | BS1201 | |
| Stereotaxic instruments | Narishige, Japan | SR-5M-HT | |
| Super-bond (C&B kit) | Sun Medical, Japan | 4560227797382 | |
| Surgical needle hook | Fine science tools, US | 10065-15 | |
| Ti:Sappire laser, MaiTai DeepSee | Spectra Physics, US | Mai Tai eHP DS | |
| Tweezers | Fine science tools, US | 11051-10 | |
| Tweezers | Fine science tools, US | 11255-20 | |
| Two-photon microscope | Nikon, Japan | A1R-MP | |
| UV craft resin | Kiyohara, Japan | UVR | |
| Xylazine | Bayer, Germany |
Referências
- Miyamoto, A., et al. Microglia contact induces synapse formation in developing somatosensory cortex. Nature Communications. 7, 12540(2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Cserep, C., et al. Microglia monitor and protect neuronal function through specialized somatic purinergic junctions. Science. 367 (6477), 528-537 (2020).
- Kato, G., et al. Microglial contact prevents excess depolarization and rescues neurons from excitotoxicity. eNeuro. 3 (3), (2016).
- Li, Y., Du, X. -F., Liu, C. -S., Wen, Z. -L., Du, J. -L. Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo. Developmental Cell. 23 (6), 1189-1202 (2012).
- Tremblay, M. -E., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. Plos Biology. 8 (11), 1000527(2010).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. The Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Oppenheim, R. W. Cell death during development of the nervous system. Annual Review of Neuroscience. 14 (1), 453-501 (1991).
- Sierra, A., Abiega, O., Shahraz, A., Neumann, H. Janus-faced microglia: beneficial and detrimental consequences of microglial phagocytosis. Frontiers in Cellular Neuroscience. 7, 6(2013).
- Brawek, B., et al. A new approach for ratiometric in vivo calcium imaging of microglia. Scientific Reports. 7 (1), 6030(2017).
- Eichhoff, G., Brawek, B., Garaschuk, O. Microglial calcium signal acts as a rapid sensor of single neuron damage in vivo. Biochimica et Biophysica Acta. 1813 (5), 1014-1024 (2011).
- Liu, L., et al. Microglial calcium waves during the hyperacute phase of ischemic stroke. Stroke. 52 (1), 274-283 (2021).
- Pozner, A., et al. Intracellular calcium dynamics in cortical microglia responding to focal laser injury in the PC::G5-tdT reporter mouse. Frontiers in Molecular Neuroscience. 8, 12(2015).
- Umpierre, A. D., et al. Microglial calcium signaling is attuned to neuronal activity in awake mice. Elife. 9, e56502(2020).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. Plos One. 7 (12), e51286(2012).
- Tanaka, K. F., et al. Expanding the repertoire of optogenetically targeted cells with an enhanced gene expression system. Cell Reports. 2 (2), 397-406 (2012).
- Liu, Y. U., et al. Neuronal network activity controls microglial process surveillance in awake mice via norepinephrine signaling. Nature Neuroscience. 22 (11), 1771-1781 (2019).
- Stowell, R. D., et al. Noradrenergic signaling in the wakeful state inhibits microglial surveillance and synaptic plasticity in the mouse visual cortex. Nature Neuroscience. 22 (11), 1782-1792 (2019).
- Sun, W. L., et al. In vivo two-photon imaging of anesthesia-specific alterations in microglial surveillance and photodamage-directed motility in mouse cortex. Frontiers in Neuroscience. 13, 421(2019).
- Evangelidis, G. D., Psarakis, E. Z. Parametric image alignment using enhanced correlation coefficient maximization. IEEE Transactions on Pattern Analysis and Machine Intelligence. 30 (10), 1858-1865 (2008).
- Rosario, A. M., et al. Microglia-specific targeting by novel capsid-modified AAV6 vectors. Molecular Therapy. Methods & Clinical Development. 3, 16026(2016).
- Maes, M. E., Wogenstein, G. M., Colombo, G., Casado-Polanco, R., Siegert, S. Optimizing AAV2/6 microglial targeting identified enhanced efficiency in the photoreceptor degenerative environment. Molecular Therapy. Methods & Clinical Development. 23, 210-224 (2021).
- Lin, R., et al. Directed evolution of adeno-associated virus for efficient gene delivery to microglia. Nature Methods. 19 (8), 976-985 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados