Method Article
Пространственно-временной анализ активности микроглииCa2+ при разрешении одиночных клеток
В этой статье
Резюме
В данной работе мы описываем протокол визуализации in vivo активности микроглии Ca2+ и последующего анализа ее пространственно-временной динамики. Этот метод позволяет тщательно охарактеризовать реакцию микроглии на изменения в окружающей среде мозга, соответствующим образом фиксируя мелкие пространственно-временные масштабы, в которых происходят такие события.
Аннотация
Микроглия является единственными резидентными иммунными клетками в центральной нервной системе. Их морфология очень пластична, изменяется в зависимости от их активности. В гомеостатических условиях микроглия обладает сильно разветвленной морфологией. Это облегчает контроль окружающей среды за счет непрерывного расширения и втягивания процессов. Однако во время черепно-мозговой травмы и воспаления микроглия активируется и претерпевает драматические морфологические изменения, втягивая свои разветвленные отростки и увеличивая свое клеточное тело. Это облегчает такие действия, как миграция и фагоцитоз, которые микроглия предпринимает, чтобы направить среду мозга в менее патологическое состояние.
Эта тесная связь между морфологией микроглии и изменениями в ее активности позволила получить значительное представление о различных функциях микроглии. Тем не менее, такие морфологические изменения и изменения активности сами по себе являются явлениями, которые могут быть результатом любого количества внутриклеточных сигнальных путей. Более того, временной лаг между стимулом и реакцией, а также высокая степень компартментализации морфологии микроглии затрудняют выделение причинных механизмов, лежащих в основе функции. Чтобы решить эту проблему, мы разработали генетически модифицированную линию мышей, в которой высокочувствительный флуоресцентный белокCa2+-индикатора специфически экспрессируется в микроглии.
После описания методов визуализации Ca2+ в микроглии in vivo, в данной статье представлен подход к структурированному анализу, который классифицирует активность Ca2+ по рационально определенным субклеточным областям, обеспечивая тем самым осмысленное извлечение пространственных и временных измерений закодированной информации. Мы считаем, что этот подход обеспечит детальное понимание правил внутриклеточной сигнализации, которые управляют разнообразным спектром микроглиальных активностей, связанных как с высшими функциями мозга, так и с патологическими состояниями.
Введение
Микроглия является резидентными иммунными клетками в центральной нервной системе (ЦНС) и играет важную роль в поддержании гомеостатической среды мозга и в регулировании формирования нейронных цепей во время развития мозга 1,2. Уникальной особенностью микроглии в ЦНС является то, что ее морфология очень пластична; Тем не менее, различные морфологические фенотипы могут быть связаны с определенными функциями. Кроме того, трансформация между морфологическими фенотипами очень динамична и происходит в быстрых временных масштабах в ответ на изменения в окружающей среде 3,4.
В гомеостатических физиологических условиях микроглия принимает сильно разветвленную морфологию с множественными отростками, расходящимися наружу во всех направлениях. Эти разветвленные отростки сами по себе демонстрируют высокую подвижность, непрерывно расширяясь и втягиваясь 3,4. Такая активность в первую очередь направлена на периодический контакт с нейронными синапсами, аксонами и сомами для мониторинга нейронной активности 5,6,7,8,9. Однако, когда мозг поврежден, микроглия быстро обнаруживает эту аномалию и в качестве первого шага в своей адаптивной реакции направляет расширение своих процессов к соответствующей локализации 3,4. В тех случаях, когда микроглии требуется для фагоцитоза мертвых клеток и метаболитов, они приобретают амебоидную морфологию, укорачивая свои отростки и увеличивая свои клеточные тела, как часть их перехода в иммунологически активированный фенотип10,11.
Однако, в то время как драматические морфологические изменения микроглиальных процессов легко обнаруживаются, более мелкие масштабные изменения сомы клетки значительно труднее уловить, особенно при временном разрешении, которое имеет физиологическое значение. Более того, морфологические изменения сами по себе представляют собой лишь интегрированный результат любого числа внутриклеточных сигнальных путей. Это проблематично для цели отслеживания функциональной активности и механистической связи стимула с конечной реакцией, которую он вызывает.
Учитывая его широкую роль в качестве второго посредника, изучение внутриклеточной динамикиCa2+ лучше отражает связанную с ним пространственно-временную информацию при изучении динамических клеточных процессов. Такой подход применим к микроглии, учитывая, что они экспрессируют множество ионотропных и метаботропных рецепторов, связанных с нисходящим внутриклеточным повышениемCa2+. Действительно, визуализация Ca2+ in vivo была использована для характеристики пространственно-временных аспектов активности микроглии в режиме реального времени, успешно коррелируя изменения активности Microglial Ca2+ с травмой головного мозга, воспалением, а также гипер- и гипоактивностью нейронов 12,13,14,15,16. Например, повышение уровняCa2+, связанное с расширением микроглиального процесса в ответ на гипер/гипоактивную активность нейронов, вероятно, отражает лежащий в основеCa2+-зависимый процесс полимеризации актина16. Кроме того, визуализация in vivo Ca2+ также может быть легко сочетаться с фармакологическими подходами. Например, в то время как микроглия экспрессирует как P2X (ионотропные), так и P2Y (метаботропные) рецепторы, местное применение агонистов P2Y имитирует и впоследствии десенсибилизирует реакцию микроглииCa2+ на поврежденные соседние нейроны13, тем самым подразумевая большую значимость передачи сигналов P2Y для обнаружения повреждений нейронов.
На сегодняшний день в предыдущих отчетах, изучающих активность микроглии Ca2+ , использовались методы анализа, основанные на области интереса (ROI). Недостатком этих подходов является то, что они все еще слишком грубы, чтобы иметь возможность разрешить пространственно-временную динамику активности Ca2+ на уровне отдельных микроглиальных процессов. Таким образом, данный протокол описывает как традиционные методы анализа активности Са2+ в микроглии, основанные на ROI, так и более новые подходы, основанные на событиях, которые могут выделять отдельные события Са2+ в микроглиальных процессах. Перед этим мы предоставим общее руководство по двухфотонной визуализации in vivo , чтобы правильно захватить активность микроглииCa2+ для подробного анализа.
протокол
Все эксперименты на животных были одобрены комитетами по исследованиям животных Национального института физиологических наук и соответствовали рекомендациям Национальных институтов здравоохранения. Во всех экспериментах 8-10-недельные самцы мышей выращивались в соответствии с 12-12-часовым циклом свет/темнота с неограниченным доступом к пище и воде. Для визуализации активности Ca2+ в микроглии мышей с ионизированной молекулой связывающего адаптера Ca2+ 1 (Iba1)-трансактиватором тетрациклина (Iba1-tTA) скрещивали с мышами17,18 с оператором тетрациклина-GCaMP6 (tetO-GCaMP6). Таким образом, в отсутствие добавок тетрациклина-аналогов, промотор Iba1 стимулирует экспрессию GCaMP6 исключительно в микроглии. Во всех экспериментах прием пищевых добавок доксициклина был прекращен через 6 недель после рождения. В конце всех экспериментов мышей усыпляли путем передозировки изофлурана с последующим вывихом шейки матки. В Таблице материалов приведена подробная информация обо всех материалах, животных и реагентах, используемых в этом протоколе.
1. Хирургическая подготовка мышей к двухфотонной визуализации in vivo ; День 1
- Выполняйте все хирургические процедуры внутри шкафа с ламинарным потоком воздуха для поддержания стерильных условий работы. Перед началом операции простерилизуйте внутреннюю часть кабинета ультрафиолетовым излучением в течение 5 минут.
- Стерилизуйте все рабочие поверхности, операционную раму и стереотаксические инструменты, протерев их 70% этанолом.
- Простерилизуйте все хирургические инструменты (ножницы, щипцы, бритвенное лезвие, пинцет) и изготовленную на заказ головную пластину, которая будет прикреплена к черепу мыши, погрузив их в 1% раствор хлоргексидина глюконата.
- Обезболивайте мышей кетамином (7,4 мг кг-1, внутрибрюшинно [внутримышечно]) и ксилазином (10 мг кг-1, внутримышечно). Верните его в домашнюю клетку до тех пор, пока анестезия не начнет действовать. Подтвердите полную индукцию анестезии потерей пальцево-щипкового рефлекса.
- Простерилизовать кожу головы 1% глюконатом хлоргексидина. Сбрейте шерсть лезвием бритвы.
- Закрепите мышь в операционной раме с помощью стереотаксических инструментов.
- Нанесите ветеринарную мазь на глаза, чтобы предотвратить сухость во время анестезии.
- Нанесите 2% ксилокаиновое желе на кожу головы для снятия боли. Подождите 5 минут.
- Снимите скальп ножницами и обнажите череп. Очистите надкостницу и высушите открытую поверхность черепа, протерев ватными палочками.
ПРИМЕЧАНИЕ: Открытые участки черепа должны быть полностью сухими, чтобы обеспечить прочное сцепление с изготовленной на заказ головной пластиной. - Закрепите изготовленную на заказ головную пластину на черепе с помощью стоматологического цемента.
- После того, как цемент схватится, заполните все зазоры между поверхностью черепа и границами изготовленной на заказ головной пластины дополнительным стоматологическим цементом.
- Гидроизоляция цементных поверхностей и поверхностей черепа путем нанесения цемента на основе стоматологической адгезивной смолы на акриловой основе.
- Верните мышь в домашнюю клетку, положив ее на грелку. Следите за мышью до тех пор, пока она не придет в сознание, достаточное для поддержания лежачего положения за грудиной (в течение 2 часов).
ПРИМЕЧАНИЕ: Мыши должны быть полностью выздоровлены к следующему дню и затем могут быть размещены вместе с другими животными.
2. Хирургическая подготовка мышей к двухфотонной визуализации in vivo ; День 2
- Выполняйте все хирургические процедуры внутри шкафа с ламинарным потоком воздуха для поддержания стерильных условий работы. Перед началом операции простерилизуйте внутреннюю часть кабинета ультрафиолетовым излучением в течение 5 минут.
- Ламинировать вместе два стеклянных покровных стекла разных размеров (верхнее стекло: 3 мм × 3 мм; нижнее стекло: 2 мм × 2 мм) УФ-отверждаемой оптической смолой.
ПРИМЕЧАНИЕ: Двойное покровное стекло обеспечивает долгосрочную защиту области мозга, открытой через черепное окно, обеспечивая при этом постоянный оптический доступ. Таким образом, его размеры могут быть изменены в соответствии с областью мозга, которую необходимо изобразить. - Простерилизуйте все рабочие поверхности и операционную раму, протерев их 70% этанолом.
- Стерилизуйте все хирургические инструменты (стальное сверло, пинцет, крючок для хирургической иглы), погрузив их в 1% раствор глюконата хлоргексидина.
- Обезболить мышь изофлураном (4% индукция, 1,2%-1,5% поддержание). Закрепите мышь внутри операционной рамы с помощью ее головной пластины.
- Чтобы сделать краниальное окно над первичной моторной корой, отметьте квадрат размером 2 мм × 2 мм с центром на 0,2 мм спереди и на 1 мм латеральнее от ориентира черепа Брегмы.
- Истончите череп по границе отмеченного квадрата с помощью стального сверла.
ПРИМЕЧАНИЕ: При приближении к желаемой толщине истонченные участки черепа будут казаться прозрачными при смачивании солевым раствором, и начнут появляться волосяные трещины. - Убедившись, что вся граница отмеченного квадрата была соответствующим образом истончена, осторожно вставьте крючок для хирургической иглы чуть ниже поверхности черепа, ориентируя его кончик к центру квадрата. Аккуратно поднимите квадратный кусок черепа с помощью крючка и с помощью пинцета отсоедините его от остальной части черепа. При возникновении кровотечения непрерывно промывайте обнаженную поверхность мозга физиологическим раствором до полного его исчезновения.
- Поместите двойную покровную накладку на открытую поверхность мозга, направив сторону с меньшим покровным стеклом по направлению к мозгу. Убедитесь, что края большего покровного стекла соприкасаются с границами черепного окна.
- С помощью стеклянного стержня с силиконовым наконечником, установленного в манипуляторе, осторожно надавите на двойную защитную крышку, чтобы убедиться, что она хорошо соприкасается с поверхностью мозга.
- Заполните зазор между двойным покровным стеклом, черепом и поверхностью мозга УФ-отверждаемой смолой и облучайте ультрафиолетовым светом до затвердевания (~20 с). Медленно поднимите стеклянный стержень с силиконовым наконечником в сторону от двойного покровного стекла.
- Дайте мышке восстановиться, положив ее на грелку. Следите за мышью до тех пор, пока она не придет в сознание, достаточное для поддержания лежачего положения за грудиной (30 минут).
- Перейдите к шагу 3 или верните мышь в ее домашнюю клетку.
ПРИМЕЧАНИЕ: После квалифицированной операции твердая мозговая оболочка и все нижележащие кровеносные сосуды будут полностью неповреждены без кровотечения. В этом случае воспаление минимально и можно сразу приступать к шагу 3. Если вы не уверены, подождите 1-3 недели, чтобы убедиться, что воспаление полностью исчезло.
3. Сбор данных с помощью двухфотонной визуализации in vivo
- Включите настройку визуализации заранее, чтобы у лазера было достаточно времени для прогрева и стабилизации. Настройте лазер так, чтобы он излучал на длине волны 920 нм, что является двухфотонным спектром, оптимально возбуждающим флуорофор GCaMP6.
- Поместите мышь под объектив микроскопа с 25-кратным увеличением и приучите ее к 30 минутам. При необходимости сделайте анестезию мыши изофлураном во время визуализации (4% индукция, 1,2%-1,5% поддержание).
ПРИМЕЧАНИЕ: Изофлуран может не подходить для некоторых исследовательских применений, так как он влияет на подвижность микроглиального процесса и активность Ca2+ 19,20,21. - Установите масштаб на 1x, затем найдите микроглию, экспрессирующую GCaMP6, в области краниального окна. Ищите на глубине от 100 мкм до 300 мкм ниже поверхности мозга.
- После того, как найдена подходящая GCaMP6-экспрессирующая микроглия, увеличьте масштаб, чтобы можно было регистрировать активностьCa2+ с разрешением одной клетки.
- Визуально убедитесь, что активность Ca2+ четко зафиксирована, и при необходимости отрегулируйте мощность лазера и усиление изображения.
ПРИМЕЧАНИЕ: Мощность лазера должна быть сведена к минимуму, насколько это возможно, чтобы избежать фотообесцвечивания и травмирования микроглии. - Выполните получение четырехмерного (4D) изображения следующим образом (шаги 3.6.1-3.6.3; Рисунок 1В):
- Установите размеры изображения на область XY = 512 × 512 пикселей, 0,25 мкм/пиксель; Площадь Z = пять z-плоскостей, z-шаг 3 мкм (рис. 1B).
- Установите скорость захвата на 2,5 кадра/с.
ПРИМЕЧАНИЕ: Z-сканирование на такой скорости облегчается пьезосистемой нанопозиционирования. - Собирайте данные до тех пор, пока не будет обнаружено по крайней мере 10 отдельных событий Ca2+ (обычно 10 минут).
4. Подготовка к анализу (коррекция движения, средняя/максимальная z-проекция)
- Прежде чем приступить к анализу активности микроглииCa2+ , скорректировать 4D-изображения на артефакты, связанные с движением (регистрация изображения) с помощью алгоритма выравнивания изображенийECC 22 в среде программирования MATLAB (R2020a). Скачайте код с: https://www.mathworks.com/matlabcentral/fileexchange/27253-ecc-image-alignment-algorithm-image-registration.
- Создайте эталонное 3D-изображение, зарегистрировав все изображения в пределах первого временного интервала с помощью операции imregister MATLAB (стандартный набор инструментов для обработки изображений).
- Зарегистрируйте все последующие изображения, сопоставив их с соответствующей z-плоскостью эталонного 3D-изображения с помощью функции ecc (библиотека алгоритмов выравнивания изображений ECC).
- Создание z-проекций средней интенсивности из зарегистрированных изображений с помощью операции MATLAB по среднему значению . Если сигнал изображения слишком слабый, сгенерируйте z-проекции максимальной интенсивности, используя максимальную операцию MATLAB.
ПРИМЕЧАНИЕ: Отношение сигнал/шум хуже при использовании z-проекций максимальной интенсивности. - Перейдите к шагу 5 или 6. Используйте z-проекции, сгенерированные на шаге 4, в качестве цели анализа для отображения пространственно-временной динамики активности Ca2+ на шагах 5 и 6.
5. Анализ на основе ROI
- Используя z-проекции, полученные на шаге 4, определите микроглиальные процессы, которые поддерживают стабильный профиль области (стабильную область) на протяжении всего периода визуализации для последующего анализа активности Ca2+ следующим образом (шаги 5.3-5.6):
- Создание отдельных t-проекций максимальной интенсивности зарегистрированных 4D-изображений из 2-минутных образцов, взятых в начале и в конце периода визуализации, с использованием операции max MATLAB.
- Бинаризация t-проекций для создания полигонов морфологии микроглии, соответствующих началу и концу периода визуализации, с помощью операции имбинаризации MATLAB. Используйте автоматически установленный порог по умолчанию.
ПРИМЕЧАНИЕ: Если сигнал Ca2+ слаб в начале и в конце периода съемки, бинаризация может привести к образованию полигонов с отсутствующими границами. В этом случае вручную нарисуйте недостающие границы с помощью инструмента «Карандаш » в ImageJ. - Наложение полигонов Т-образной проекции с помощью операции imadd MATLAB. Перекрывающиеся области представляют собой стабильную область (рисунок 2B).
- В пределах идентифицированных стабильных областей используйте операцию drawpolygon MATLAB для ручного определения и трассировки ROI для каждого из первичных микроглиальных процессов и любых очевидных подветвей второго порядка.
- Отслеживайте абсолютную интенсивность флуоресценции, усредненную по отдельному ROI на всех временных интервалах (рис. 2C, D).
- Из временных рядов абсолютных интенсивностей флуоресценции рассчитать относительное изменение временных рядов интенсивности флуоресценции (ΔF/F) в соответствии с уравнением (1). Этот временной ряд представляет нормализованной динамику микроглииCa2+ на уровне отдельных ROI.
ΔF/F = (F(t) - F0) / F0 (1)
Где F(t) — зарегистрированная интенсивность флуоресценции в данный момент времени, а F0 —10-й процентиль интенсивности флуоресценции на всех временных интервалах (рис. 2E). - Определите потенциальные события срабатывания Ca2+ , происходящие в данном отдельном ROI, следующим образом (шаги 5.5.1-5.5.3):
- Примените фильтрацию нижних частот с конечной импульсной характеристикой (КИХ) типа I к временным рядам ΔF/F с помощью операции fir1 MATLAB. Установите частоту среза на значение Найквиста (половина частоты дискретизации).
- Визуально осмотрите отфильтрованную кривую, чтобы убедиться, что отдельные пики кривой соответствуют всплескам активности Ca2+ на зарегистрированных 4D-изображениях (рис. 2F).
- Определите потенциальные события возбуждения Ca2+ как вогнутые перегибы в трассировке временных рядовΔF/F . Определите базовый порог как медианное значение ΔF/F в пределах верхнего и нижнего потолков, которое исключает максимальную и минимальную амплитуду 10% на всех временных интервалах. Определите порог обнаружения на три SD выше базового порога (рис. 2F, H).
- Определите истинные события срабатывания Ca2+ от кандидатов следующим образом (шаги 5.5.1-5.5.2):
- Рассчитайте наклон каждого события-кандидата путем дифференциации по соответствующим отфильтрованным временным рядам ΔF/F с помощью операции численного градиента MATLAB.
- Впоследствии определите истинные события Ca2+ на основе времени нарастания профиля. Определите базовое пороговое значение как среднее арифметическое значений наклона по всем событиям-кандидатам. Определите порог обнаружения на три SD выше базового порога (рисунок 2G, H).
- Охарактеризуйте истинные события Ca2+ следующим образом (шаги 5.6.1-5.6.3):
ПРИМЕЧАНИЕ: Ниже приведен не исчерпывающий список параметров, которые могут быть использованы для характеристики микроглиальных событийCa2+ . Интересующие параметры зависят от цели исследования.- Выведите максимальную амплитуду истинного события срабатывания Ca2+ как значение ΔF/F соответствующего временного ряда ΔF/F .
- Выведите среднюю амплитуду истинного события срабатывания Ca2+ как среднее значение ΔF/F для всего соответствующего подмножества временных рядов кадров ΔF/F .
- Выведите частоту истинных событий Ca2+ как количество событий, деленное на время визуализации.
6. Событийный анализ
- Выполнение анализа на основе событий z-проекций из шага 4 с использованием библиотеки AQuA в среде программирования MATLAB. Скачайте код с: https://github.com/yu-lab-vt/AQuA.
ПРИМЕЧАНИЕ: Общее руководство по использованию библиотеки AQuA доступно по адресу: https://drive.google.com/file/d/1a3lhe0dUth-5J1-S2fZlPOCZlPbeuvUr/view. Подробная документация по библиотеке AQuA доступна по адресу: https://drive.google.com/file/d/1CckDLbrkw16b7MPlOQdYpZciIz80Snm_/view. - После запуска MATLAB переключитесь с папки рабочего каталога по умолчанию на указанную папку рабочего каталога AQuA с помощью операции cd .
- Загрузите зарегистрированные 4D-изображения в конвейер анализа AQuA следующим образом (шаги 6.3.1-6.3.2):
- Запустите графический интерфейс AQuA. Введите aqua_gui в командном окне MATLAB в указанной папке рабочего каталога AQuA.
- В графическом интерфейсе AQuA нажмите «Новый проект » и выберите зарегистрированные изображения для анализа. Укажите тип данных (GCaMPInVivo_cyto_Lck_) и параметры изображения (временное разрешение, секунды на кадр = 1.993; пространственное разрешение μм на пиксель = 0.25; исключить пиксели короче этого расстояния до границы = 5). Нажмите «Открыть », чтобы загрузить данные.
- Определение ориентиров для последующих конвейеров анализа путем трассировки областей интереса. Обычно ориентиры основываются на границе клетки и площади тела клетки.
- Затем обнаруживайте события-кандидаты Ca2+ , запуская автоматизированные конвейеры анализа по следующим параметрам: активный сигнал, супервоксель, обнаружение событий, чистые события и события слияния.
ПРИМЕЧАНИЕ: Подробное объяснение каждого из этих параметров и их потенциальных результатов оценки представлено в пошаговом руководстве AQuA. Вкратце, эти параметры регулируют порог обнаружения событий Ca2+ следующим образом: активный сигнал = амплитуда флуоресценции, супервоксель = кластеризация флуоресценции в 3D-пространстве, обнаружение событий = кинетика подъема/затухания, чистые события = отношение сигнал/шум, а события слияния = временное разделение событий. - Визуальный контроль обнаруженных событий Ca2+ (автоматически накладывается на исходные зарегистрированные изображения). При необходимости отрегулируйте настройки параметров конвейеров анализа, рассмотрев качество изображения с точки зрения указанных выше параметров; Если качество изображения по заданному параметру хорошее, может быть установлен более высокий порог, и наоборот.
- После того, как все события Ca2+ будут обнаружены должным образом, охарактеризуйте эти события в основной среде MATLAB следующим образом (шаги 6.8-6.14):
- Экспортируйте выходные файлы анализа AQuA.
ПРИМЕЧАНИЕ: Подробное объяснение выходных файлов, извлеченных признаков, которые используются для определения событий Ca2+ , и основных параметров этих извлеченных признаков представлено в документации AQuA. - (необязательно) Разделите все события Ca2+ на две группы: 1) события, начинающиеся в соме, и 2) события, начинающиеся в процессах.
- Доступ к амплитуде отдельных событий Ca2+ в структуре res.dffMat MATLAB выходного файла анализа AQuA (файл .mat).
- Выведите частоту отдельных событий Ca2+ с помощью операции res.fts.loc.x3D MATLAB (библиотека AQuA).
- Получение длительности отдельных событий Ca2+ с помощью операции MATLAB res.fts.curve.width11 (библиотека AQuA).
- Определите площадь отдельных событий Ca2+ с помощью операции res.fts.basic.area MATLAB (библиотека AQuA).
- Классифицируйте все события Ca2+ следующим образом: 1) локальные события, 2) пропагандирующие события, движущиеся к соме, и 3) пропагандирующие события, удаляющиеся от сомы. Для этого используйте операции res.fts.region.landmarkDir.chgTowards и res.fts.region.landmarkDir.chgAway MATLAB (библиотека AQuA) (рисунок 3C).
Результаты
У трансгенных мышей, экспрессирующих исключительно GCaMP6 (Ca2+-чувствительный флуоресцентный белок) в микроглии, мы обычно наблюдаем различные паттерны активности микроглииCa2+ (рис. 2A). Важно отметить, что даже в пределах одной микроглии паттерны активности Ca2+ могут сильно различаться между процессами.
Чтобы количественно оценить такие различия между процессами в пространственно-временной динамике активности микроглииCa2+, необходимо сначала определить стабильные области, а затем разделить их на тонко сегментированные ROI (рис. 2B, C). Для каждого ROI необходимо вывести и количественно оценить параметры активности Ca2+, такие как амплитуда и частота, путем извлечения таких признаков, как локальные амплитуды и наклоны следов, из временных рядов интенсивности флуоресценции (рисунок 2D-G).
Далее необходимо изучить отдельные события Ca2+ с применением точного алгоритма количественной оценки AQuA (рис. 3A). В результате такого анализа, основанного на событиях, обычно наблюдаются значительные различия в происхождении, амплитуде, продолжительности, местоположении и характеристиках направления потока отдельных событий Ca2+ (рис. 3B). Если сосредоточиться на анализе динамики активности Ca2+ в микроглиальных процессах, то информативной будет схема классификации локальных событий, событий, движущихся к соме, и событий, удаляющихся от сомы (рис. 3C).
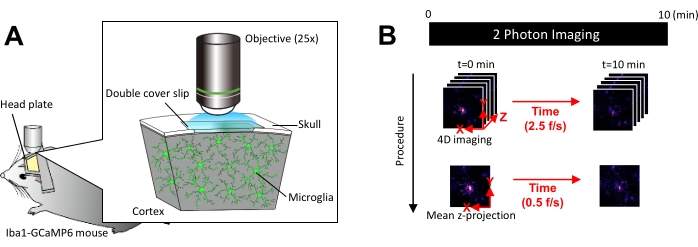
Рисунок 1: Экспериментальная установка для визуализации in vivo микроглии Ca2+. (А) Экспериментальная установка. Мышь Iba1-tTA × tetO-GCaMP6 с экспрессией GCaMP6, специфичной для микроглии. Вставив черепное окно в череп мыши, активность микроглииCa2+ можно наблюдать in vivo с помощью двухфотонной микроскопии. (B) График экспериментов и процедура анализа. 4D-изображения получаются в течение не менее 10 минут в виде пятикадровых z-стеков. Скорость захвата кадров составляет 2,5 кадра/с. Перед анализом активности микроглии Ca2+ пятикадровые z-стеки преобразуются в 2D-z-проекции путем измерения средней (или максимальной) интенсивности. Скорость воспроизведения z-проекции составляет 0,5 кадра/с. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого показателя.
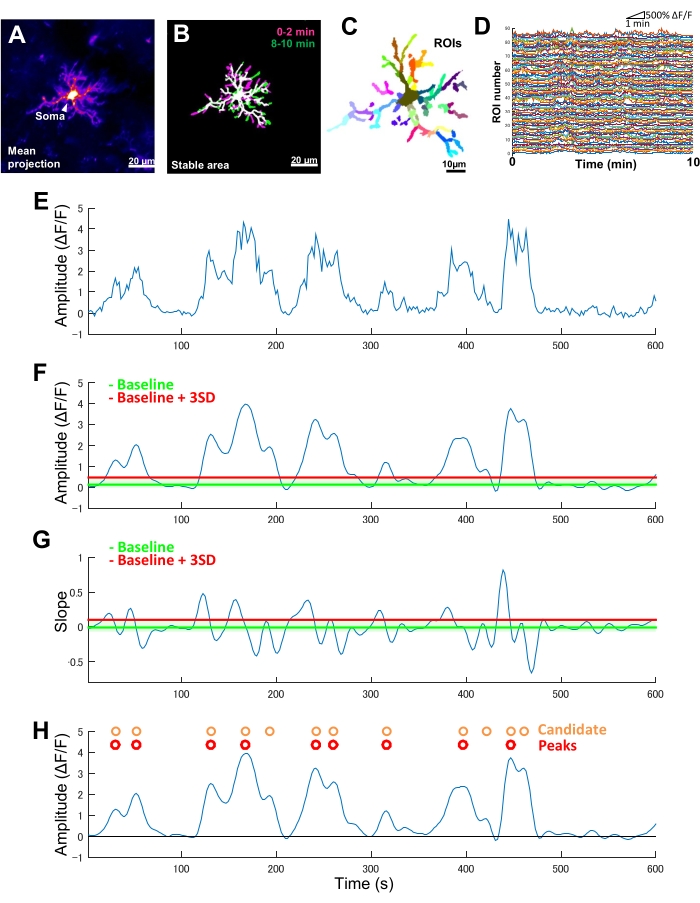
Рисунок 2: Анализ активности Ca2+ микроглии на основе ROI. (A) Средняя проекция интенсивности GCaMP6 в течение 10 минут для отдельной микроглии. (B) Стабильные области (белые) определяются наложением бинаризованных t-проекций максимальной интенсивности GCaMP6, полученных из 2-минутных образцов, взятых в начале (пурпурный) и в конце (зеленый) периода визуализации. (C) Стабильные районы далее сегментируются по региональным показателям рентабельности инвестиций. Отдельные цвета указывают на индивидуальный ROI. (D) ΔF/F следы всех отдельных ROI в C. Обратите внимание на различия в моделях активности между ROI. (E) Исходная трассировка временного ряда ΔF/F, полученная на основе значений абсолютной интенсивности для одного ROI. (F) Тот же временной ряд ΔF/F после фильтрации нижних частот. События-кандидаты Ca2+ обнаруживаются по пороговому значению амплитуды (красная линия), определяемому как базовая линия + три SD. Базовая линия (зеленая линия) определяется как медианное значение по всему временному ряду ΔF/F в пределах верхнего и нижнего потолка, который исключает максимум и минимум 10% значений ΔF/F . (G) Кривая наклона, полученная из отфильтрованного временного ряда ΔF/F в F. Истинные события Ca2+ сортируются от потенциальных событий Ca2+ на основе порога отсечения наклона (красная линия), определенного как базовая линия + три SD. Базовая линия (зеленая линия) определяется как среднее значение по всему временному ряду уклона в пределах верхнего и нижнего потолка, которое исключает максимальные и минимальные 10% значений уклона. (H) Потенциальные события Ca2+ , идентифицированные по критериям амплитуды в F , обозначены оранжевым цветом. Истинные события Ca2+ отсортированы из событий-кандидатов Ca2+ по критериям наклона в G красным цветом. Обратите внимание, что некоторые события-кандидаты Ca2+ были объединены на основе критериев наклона. Соответствующие отфильтрованные временные ряды ΔF/F наложены ниже для справки. Черная линия указывает на нулевую амплитуду (ΔF/F). Средняя и максимальная амплитуда истинных событий Ca2+ рассчитываются как среднее и максимум соответствующих им пиков в отфильтрованном временном ряду ΔF/F . Частота (событий/мин) определяется как количество истинных событий срабатывания Ca2+ , деленное на период визуализации (10 минут). Масштабные линейки = 20 μм (А,В), 10 μм (С). Аббревиатура: ROI = область интересов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
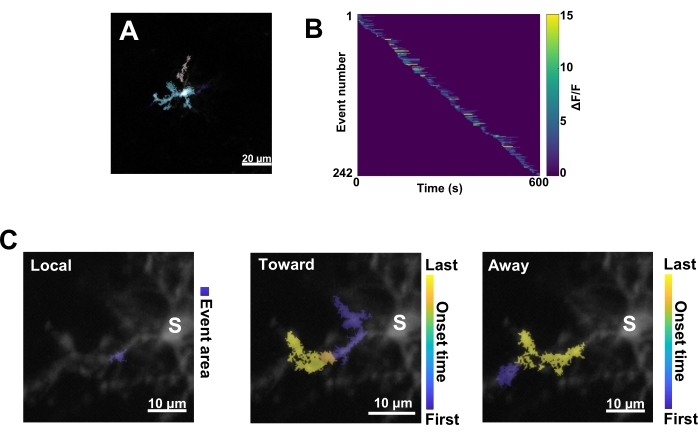
Рисунок 3: Событийный анализ активности микроглииCa2+. (A) Репрезентативные изображения событий, обнаруженных с помощью алгоритма AQuA. Цветами обозначены отдельные области событий, обнаруженные в определенный момент времени. (B) Репрезентативная нормализованная активностьCa2+ (ΔF/F) в отдельных событиях, отсортированных по порядку начала. Правая полоса указывает на обозначенные цветом ΔF/F. (C) Репрезентативная активность – следы событий, распространяющихся по направлению к соме и от нее, или локальных событий. Для локальных событий форма события отображается синим цветом. Для пропагандирующих событий время наступления события обозначается сине-желтой шкалой. Поскольку AQuA первоначально обнаруживает события Ca2+ по отдельности, события распространения идентифицируются впоследствии на основе перекрывающихся пространственных местоположений и временных рядов нескольких отдельных событий Ca2+. Обратите внимание, что это та же дендритная ветвь, которая используется для анализа ROI на рисунке 2E-H. Масштабные линейки = 20 μм (А), 10 μм (С). Аббревиатура: ROI = область интереса; S = сома. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этой статье представлен усовершенствованный подход к визуализации активности Ca2+ в микроглии с высоким пространственно-временным разрешением. Этот метод достаточно чувствителен для обнаружения различных типов активности Са2+ микроглии на уровне отдельных разветвленных процессов, легко различая локальные и распространяющиеся события.
В общем методе визуализации in vivo двухфотонной визуализации активности микроглииCa2+ необходимо уделять пристальное внимание следующим моментам для достижения максимального качества изображения. Во-первых, поскольку микроглия чрезвычайно чувствительна к травмам, важно свести к минимуму прямое прикосновение хирургических инструментов к поверхности мозга во время операции. Основными признаками того, что операция была выполнена качественно, являются неповрежденные кровеносные сосуды и твердая мозговая оболочка, а также минимальное кровотечение во время операции. Во-вторых, надежное крепление головной пластины к черепу мыши и хороший контакт между двойным покровным стеклом и поверхностью мозга значительно уменьшают артефакты, связанные с движением, во время визуализации. Это особенно важно при визуализации с высоким пространственно-временным разрешением и у полностью бодрствующих мышей. В то время как конвейер анализа надежно компенсирует артефакты, связанные с движением, возникающие в результате сердцебиения, дыхания и общего дрейфа, он менее надежен при обработке значительных геометрических искажений, возникающих в результате внезапных больших движений.
Два описанных здесь метода анализа имеют разные преимущества и подходят для разных исследовательских вопросов. При анализе на основе ROI пользователь заранее определяет ROI (например, отдельные процессы), что позволяет извлечь совокупную динамику активности Ca2+ этого ROI. Таким образом, он наиболее подходит для ситуаций, когда ожидается, что явления будут локализованы в субклеточной области, которая имеет как четко определенные морфологические границы, так и относительно большую область (т.е. ветвь процесса). В событийно-ориентированном анализе отдельные события определяются на основе пространственно-временной динамики самой активности микроглии Ca2+ и затем должны быть помещены в контекст определяемых пользователем ориентиров внутри микроглии для интерпретации их функции. Таким образом, он наиболее подходит для ситуаций, когда предположения о локализации явлений не могут быть сделаны или когда область интереса относительно мала (т.е. подсказка процесса). Таким образом, событийный анализ обеспечивает улучшенное пространственно-временное разрешение при характеристике активности микроглииCa2+ по сравнению с предыдущими методами.
У этих мышей единственным флуоресцентным маркером, экспрессируемым микроглией, является индикатор Ca2+ GCaMP6. Таким образом, в областях с низкой активностью Ca2+ морфология микроглии должна быть извлечена путем объединения нескольких временных рамок, что может ухудшить временное разрешение. Однако это ограничение можно преодолеть путем экспрессии в микроглии отдельного красного стабильно флуоресцентного белка. Примечательно, что недавно были описаны новые аденоассоциированные вирусы, способные трансфицировать микроглию 23,24,25.
Как активность микроглии Ca2+ изменяется под воздействием окружающей среды, является новой темой, представляющей интерес. В частности, активность Са2+ в микроглии, по-видимому, демонстрирует значительную корреляцию с активностью нейронов, хотя функциональное значение этого еще предстоит тщательно охарактеризовать. Таким образом, сочетание манипуляций с нейрональной активностью с представленными здесь методами визуализации и анализа активности микроглииCa2+ должно дать новое понимание физиологии микроглии и еще больше продвинуть наше понимание роли, которую микроглия играет в физиологических и патологических состояниях.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов, связанного с данной рукописью.
Благодарности
Мы благодарны профессору Кенджи Танаке (Университет Кэйо, Токио, Япония) за предоставленные мыши Iba1-tTA и мыши tetO-GCaMP6. Эта работа была поддержана Грантами для молодых ученых (B) [16K19001 (to H.H.)], Grants-in-Aid for Early Career Scientists [18K14825 (to H.H.)], Grant-in-Aid for Scientific Research (B) [21H03027 (to H.H.)], Grant-in-Aid for Transformive Research Areas (A) [21H05639 (to H.H.)], Grant-in-Aid for Scientific Research (A) [17H01530, 20H00500 (to J.N.)] и JST CREST Grant [JPMJCR1755 (to J.N.)], Япония.
Материалы
| Name | Company | Catalog Number | Comments |
| 2% xylocaine jelly | AstraZeneca, UK | ||
| B6(129S6)-Tg(Aif1-tTA)54Kftnk | RIKEN RBC, Japan | RBRC05769 | Iba1-tTA mice |
| B6;129-Actb(tm3.1(tetO-GCaMP6)Kftnk) | RIKEN RBC, Japan | RBRC09552 | tetO-GCaMP6 mice |
| Forceps | Fine science tools, US | 13008-12 | |
| G-CEM ONE | GC corporation, Japan | ||
| Glass capillary | Narishige, Japan | GDC-1 | |
| ImageJ | NIH, US | ||
| Isofulrane | Pfizer, US | ||
| Ketamin | Daiichi-Sankyo, Japan | ||
| Kwik-sil | World Precision Instruments, US | KWIK-SIL | |
| MATLAB, 2020a | MathWorks, US | ||
| Micro cover glass (2 x 2 mm, No.3) | Matsunami, Japan | custum-made | Bottom glass for cranial window |
| Micro cover glass (3 x 3 mm, No.0) | Matsunami, Japan | custum-made | Upper glass for cranial window |
| N25X-APO-MP | Nikon, Japan | N25X-APO-MP | Objective lens (25x) |
| Norland optical adhesive | Edmund optics, US | 6101 | |
| Piezo nano-positioning system, Nano-Drive | Mao City Labs, US | ||
| Razor blade | Feather, Japan | FA-10 | |
| Scissors | Fine science tools, US | 14060-11 | |
| Steel drill | Minitor, Japan | BS1201 | |
| Stereotaxic instruments | Narishige, Japan | SR-5M-HT | |
| Super-bond (C&B kit) | Sun Medical, Japan | 4560227797382 | |
| Surgical needle hook | Fine science tools, US | 10065-15 | |
| Ti:Sappire laser, MaiTai DeepSee | Spectra Physics, US | Mai Tai eHP DS | |
| Tweezers | Fine science tools, US | 11051-10 | |
| Tweezers | Fine science tools, US | 11255-20 | |
| Two-photon microscope | Nikon, Japan | A1R-MP | |
| UV craft resin | Kiyohara, Japan | UVR | |
| Xylazine | Bayer, Germany |
Ссылки
- Miyamoto, A., et al. Microglia contact induces synapse formation in developing somatosensory cortex. Nature Communications. 7, 12540 (2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Cserep, C., et al. Microglia monitor and protect neuronal function through specialized somatic purinergic junctions. Science. 367 (6477), 528-537 (2020).
- Kato, G., et al. Microglial contact prevents excess depolarization and rescues neurons from excitotoxicity. eNeuro. 3 (3), (2016).
- Li, Y., Du, X. -. F., Liu, C. -. S., Wen, Z. -. L., Du, J. -. L. Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo. Developmental Cell. 23 (6), 1189-1202 (2012).
- Tremblay, M. -. E., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. Plos Biology. 8 (11), 1000527 (2010).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. The Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Oppenheim, R. W. Cell death during development of the nervous system. Annual Review of Neuroscience. 14 (1), 453-501 (1991).
- Sierra, A., Abiega, O., Shahraz, A., Neumann, H. Janus-faced microglia: beneficial and detrimental consequences of microglial phagocytosis. Frontiers in Cellular Neuroscience. 7, 6 (2013).
- Brawek, B., et al. A new approach for ratiometric in vivo calcium imaging of microglia. Scientific Reports. 7 (1), 6030 (2017).
- Eichhoff, G., Brawek, B., Garaschuk, O. Microglial calcium signal acts as a rapid sensor of single neuron damage in vivo. Biochimica et Biophysica Acta. 1813 (5), 1014-1024 (2011).
- Liu, L., et al. Microglial calcium waves during the hyperacute phase of ischemic stroke. Stroke. 52 (1), 274-283 (2021).
- Pozner, A., et al. Intracellular calcium dynamics in cortical microglia responding to focal laser injury in the PC::G5-tdT reporter mouse. Frontiers in Molecular Neuroscience. 8, 12 (2015).
- Umpierre, A. D., et al. Microglial calcium signaling is attuned to neuronal activity in awake mice. Elife. 9, e56502 (2020).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. Plos One. 7 (12), e51286 (2012).
- Tanaka, K. F., et al. Expanding the repertoire of optogenetically targeted cells with an enhanced gene expression system. Cell Reports. 2 (2), 397-406 (2012).
- Liu, Y. U., et al. Neuronal network activity controls microglial process surveillance in awake mice via norepinephrine signaling. Nature Neuroscience. 22 (11), 1771-1781 (2019).
- Stowell, R. D., et al. Noradrenergic signaling in the wakeful state inhibits microglial surveillance and synaptic plasticity in the mouse visual cortex. Nature Neuroscience. 22 (11), 1782-1792 (2019).
- Sun, W. L., et al. In vivo two-photon imaging of anesthesia-specific alterations in microglial surveillance and photodamage-directed motility in mouse cortex. Frontiers in Neuroscience. 13, 421 (2019).
- Evangelidis, G. D., Psarakis, E. Z. Parametric image alignment using enhanced correlation coefficient maximization. IEEE Transactions on Pattern Analysis and Machine Intelligence. 30 (10), 1858-1865 (2008).
- Rosario, A. M., et al. Microglia-specific targeting by novel capsid-modified AAV6 vectors. Molecular Therapy. Methods & Clinical Development. 3, 16026 (2016).
- Maes, M. E., Wogenstein, G. M., Colombo, G., Casado-Polanco, R., Siegert, S. Optimizing AAV2/6 microglial targeting identified enhanced efficiency in the photoreceptor degenerative environment. Molecular Therapy. Methods & Clinical Development. 23, 210-224 (2021).
- Lin, R., et al. Directed evolution of adeno-associated virus for efficient gene delivery to microglia. Nature Methods. 19 (8), 976-985 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены