Method Article
ניתוח מרחבי-זמני של פעילות Microglial Ca2+ ברזולוציה של תא בודד
In This Article
Summary
במאמר זה, אנו מתארים פרוטוקול להדמיה in vivo של פעילות Microglial Ca2+ וניתוח לאחר מכן של הדינמיקה המרחבית-זמנית שלה. שיטה זו מאפשרת אפיון יסודי של האופן שבו מיקרוגליה מגיבה לשינויים בסביבת המוח, ולוכדת כראוי את קנה המידה המרחבי-זמני העדין שבו מתרחשים אירועים כאלה.
Abstract
מיקרוגליה הם התאים החיסוניים היחידים השוכנים במערכת העצבים המרכזית. המורפולוגיה שלהם פלסטית מאוד, ומשתנה בהתאם לפעילותם. בתנאים הומאוסטטיים, למיקרוגליה יש מורפולוגיה מסועפת מאוד. זה מקל על הניטור שלהם של הסביבה הסובבת באמצעות התרחבות ונסיגה מתמשכת של התהליכים שלהם. במהלך פגיעה מוחית ודלקת, לעומת זאת, מיקרוגליה מופעלת ועוברת שינויים מורפולוגיים דרמטיים, נסוגים מהתהליכים המסועפים שלהם ומנפחים את גוף התא שלהם. זה מקל על פעילויות כמו הגירה ופגוציטוזיס, שמיקרוגליה לוקחת על עצמה לנווט את סביבת המוח למצב פחות פתולוגי.
קשר הדוק זה בין מורפולוגיה של מיקרוגליה לשינויים בפעילותם איפשר תובנות ניכרות לגבי תפקודי מיקרוגליה שונים. עם זאת, שינויים מורפולוגיים ופעילים כאלה הם בעצמם תופעות שיכולות לנבוע ממספר כלשהו של מסלולי איתות תוך-תאיים. יתר על כן, פער הזמן בין גירוי לתגובה, כמו גם המורפולוגיה הממודרת מאוד של מיקרוגליה, מקשים על בידוד המנגנונים הסיבתיים העומדים בבסיס התפקוד. כדי לפתור בעיה זו, פיתחנו קו עכברים מהונדסים גנטית שבו חלבון פלואורסצנטי רגיש מאוד Ca2+ מתבטא באופן ספציפי במיקרוגליה.
לאחר תיאור שיטות להדמיית Ca2+ in vivo microglial, מאמר זה מציג גישת ניתוח מובנית המסווגת פעילות Ca2+ זו לאזורים תת-תאיים מוגדרים באופן רציונלי, ובכך מבטיחה שהממדים המרחביים והזמניים של המידע המקודד מופקים באופן משמעותי. אנו מאמינים שגישה זו תספק הבנה מפורטת של כללי האיתות התוך-תאיים השולטים במערך המגוון של פעילויות מיקרוגליה הקשורות הן לתפקודי מוח גבוהים יותר והן למצבים פתולוגיים.
Introduction
מיקרוגליה הם תאי החיסון השוכנים במערכת העצבים המרכזית (CNS) וממלאים תפקידים חשובים בשמירה על סביבת מוח הומאוסטטית ובוויסות היווצרות מעגלים עצביים במהלך התפתחות המוח 1,2. מאפיין ייחודי של מיקרוגליה במערכת העצבים המרכזית הוא שהמורפולוגיה שלהם היא פלסטית מאוד; עם זאת, פנוטיפים מורפולוגיים מובהקים יכולים להיות קשורים לפונקציות מסוימות. יתר על כן, הטרנספורמציה בין פנוטיפים מורפולוגיים היא דינמית ביותר, ומתרחשת בטווחי זמן מהירים בתגובה לשינויים בסביבה הסובבת 3,4.
בתנאים פיזיולוגיים הומאוסטטיים, מיקרוגליה מניחה מורפולוגיה מסועפת מאוד, עם תהליכים מרובים המקרינים החוצה לכל הכיוונים. תהליכים מסועפים אלה עצמם מפגינים תנועתיות גבוהה, מתרחבים ונסוגים ללא הרף 3,4. פעילות כזו מכוונת בעיקר למגע תקופתי עם סינפסות עצביות, אקסונים וסומה לניטור פעילות עצבית 5,6,7,8,9. עם זאת, כאשר המוח נפגע, מיקרוגליה מזהה במהירות את החריגה הזו, וכצעד ראשון בתגובה ההסתגלותית שלהם, מכוונים את הרחבת התהליכים שלהם לעבר האזור המתאים 3,4. כאשר מיקרוגליה נדרשת לבצע פגוציטוזיס של תאים מתים ומטבוליטים, הם מקבלים מורפולוגיה דמוית אמבואיד, מקצרים את תהליכיהם ומגדילים את גוף התאים שלהם, כחלק מהמעבר שלהם לפנוטיפ המופעל אימונולוגית10,11.
עם זאת, בעוד שהשינויים המורפולוגיים הדרמטיים של תהליכי מיקרוגליה ניתנים לזיהוי בקלות, שינויים בקנה מידה עדין יותר של סומה התא קשים יותר ללכידה, במיוחד ברזולוציה זמנית הרלוונטית מבחינה פיזיולוגית. יתר על כן, שינויים מורפולוגיים עצמם מייצגים רק את התוצאה המשולבת של מספר כלשהו של מסלולי איתות תוך-תאיים. זה בעייתי למטרה של מעקב אחר פעילות פונקציונלית וקישור מכניסטי של גירוי עם התגובה הסופית שהוא מעורר.
בהתחשב בתפקידו הנרחב כשליח שני, בחינת דינמיקת Ca2+ תוך-תאית לוכדת טוב יותר את המידע המרחבי-זמני הקשור בעת חקר תהליכים תאיים דינמיים. גישה כזו ישימה למיקרוגליה בהתחשב בכך שהם מבטאים מגוון קולטנים יונוטרופיים ומטבוטרופיים הקשורים לגובה Ca2+ תוך-תאי במורד הזרם. ואכן, נעשה שימוש בהדמיה in vivo Ca2+ כדי לאפיין היבטים מרחביים-זמניים של פעילויות מיקרוגליאליות בזמן אמת, תוך מתאם מוצלח בין שינויים בפעילות Ca2+ של מיקרוגליה עם פגיעה מוחית, דלקת והיפראקטיביות והיפואקטיביות בתאי עצב 12,13,14,15,16. לדוגמה, עליות Ca2+ הקשורות להרחבת תהליך מיקרוגליה בתגובה לפעילות עצבית היפר/היפואקטיבית משקפות ככל הנראה את תהליך פילמור האקטין התלוי ב-Ca2+ 16. יתר על כן, ניתן לשלב בקלות הדמיית Ca2+ in vivo עם גישות פרמקולוגיות. לדוגמה, בעוד שמיקרוגליה מבטאת קולטני P2X (יונוטרופי) ו-P2Y (מטבוטרופיים), יישום מקומי של אגוניסטים P2Y מחקה ובהמשך מפחית את הרגישות של תגובת Ca2+ של המיקרוגליה לנוירונים שכנים פגומים13, ובכך מרמז על הרלוונטיות הגדולה יותר של איתות P2Y לזיהוי נזק עצבי.
עד כה, דוחות קודמים שבחנו את פעילות המיקרוגליה Ca2+ השתמשו בשיטות ניתוח מבוססות אזור עניין (ROI). החיסרון של גישות אלה הוא שהן עדיין גסות מכדי להיות מסוגלות לפתור את הדינמיקה המרחבית-זמנית של פעילות Ca2+ ברמה של תהליכי מיקרוגליאה בודדים. לפיכך, פרוטוקול זה מתאר הן שיטות קונבנציונליות מבוססות ROI לניתוח פעילות Microglial Ca2+ והן גישות חדשות יותר מבוססות אירועים, שיכולות לחלץ אירועי Ca2+ בודדים בתהליכי מיקרוגליה. לפני כן, אנו מספקים מדריך כללי להדמיית שני פוטונים in vivo כדי ללכוד כראוי את פעילות המיקרוגליה Ca2+ לניתוח מפורט.
Protocol
כל הניסויים בבעלי חיים אושרו על ידי ועדות המחקר בבעלי חיים של המכון הלאומי למדעים פיזיולוגיים והיו בהתאם להנחיות המכונים הלאומיים לבריאות. בכל הניסויים, עכברים זכרים בני 8-10 שבועות גודלו במחזור אור/חושך של 12/12 שעות עם גישה אד ליביטום למזון ומים. כדי להמחיש את פעילות Ca2+ במיקרוגליה, עכברי מתאם מחייב Ca2+ מיוננים 1 (Iba1)-טטרציקלין טרנסאקטיבטור (Iba1-tTA) הוצלבו עם עכברי מפעיל טטרציקלין-GCaMP6 (tetO-GCaMP6)17,18. לפיכך, בהיעדר תוסף טטרציקלין-אנלוגי, מקדם Iba1 מניע את הביטוי של GCaMP6, אך ורק במיקרוגליה. בכל הניסויים, תוסף תזונה דוקסיציקלין הופסק 6 שבועות לאחר הלידה. בסוף כל הניסויים, עכברים הומתו על ידי מנת יתר של איזופלורן ואחריה נקע צוואר הרחם. עיין בטבלת החומרים לפרטים הקשורים לכל החומרים, בעלי החיים והריאגנטים המשמשים בפרוטוקול זה.
1. הכנה כירורגית של עכברים להדמיה דו-פוטונית in vivo ; יום 1
- בצע את כל ההליכים הכירורגיים בתוך ארון זרימת אוויר למינרי כדי לשמור על תנאי עבודה סטריליים. לפני תחילת הניתוח, יש לעקר את פנים הארון באור UV למשך 5 דקות.
- עקר את כל משטחי העבודה, מסגרת הניתוח והמכשירים הסטריאוטקסיים על ידי ניגובם עם 70% אתנול.
- עקר את כל המכשירים הכירורגיים (מספריים, מלקחיים, סכין גילוח, פינצטה) ואת לוחית הראש בהתאמה אישית שתוצמד לגולגולת העכבר על ידי טבילתם בתמיסת כלורהקסידין גלוקונאט 1%.
- להרדים את העכבר עם קטמין (7.4 מ"ג ק"ג-1, תוך צפקית) וקסילזין (10 מ"ג ק"ג-1, i.p). החזירו אותו לכלוב הביתי שלו עד שההרדמה תתבסס. אשר את השראת ההרדמה המלאה על ידי אובדן רפלקס צביטת הבוהן.
- יש לעקר את הקרקפת עם 1% כלורהקסידין גלוקונאט. גלח את הפרווה בעזרת סכין גילוח.
- אבטח את העכבר בתוך מסגרת הניתוח באמצעות מכשירים סטריאוטקסיים.
- מרחו משחה וטרינרית על העיניים כדי למנוע יובש בזמן ההרדמה.
- יש למרוח ג'לי קסילוקאין 2% על הקרקפת לטיפול בכאבים. המתן 5 דקות.
- הסר את הקרקפת בעזרת מספריים וחשוף את הגולגולת. נקה את הפריאוסטאום וייבש את משטח הגולגולת החשוף על ידי שפשוף עם צמר גפן.
הערה: אזורי הגולגולת החשופים חייבים להיות יבשים לחלוטין כדי להבטיח הדבקה חזקה עם לוחית הראש בהתאמה אישית. - אבטח את לוחית הראש בהתאמה אישית לגולגולת עם מלט דנטלי.
- לאחר שהמלט התייצב, מלא את כל הרווחים בין משטח הגולגולת לגבולות לוחית הראש בהתאמה אישית עם מלט דנטלי נוסף.
- אטום למים את משטחי המלט והגולגולת על ידי מריחת מלט שרף דבק דנטלי על בסיס אקרילי.
- החזר את העכבר לכלוב הביתי שלו, והניח אותו על משטח חימום. עקוב אחר העכבר עד שהוא יחזור להכרה מספקת כדי לשמור על שכיבה חזה (תוך שעתיים).
הערה: עכברים אמורים להתאושש לחלוטין עד למחרת ואז ניתן לשכן אותם עם בעלי חיים אחרים.
2. הכנה כירורגית של עכברים להדמיה דו-פוטונית in vivo ; יום 2
- בצע את כל ההליכים הכירורגיים בתוך ארון זרימת אוויר למינרי כדי לשמור על תנאי עבודה סטריליים. לפני תחילת הניתוח, יש לעקר את פנים הארון באור UV למשך 5 דקות.
- למינציה יחד שני כיסויי זכוכית במידות שונות (זכוכית עליונה: 3 מ"מ × 3 מ"מ; זכוכית תחתונה: 2 מ"מ × 2 מ"מ) עם שרף אופטי הניתן לריפוי UV.
הערה: הכיסוי הכפול מספק הגנה ארוכת טווח לאזור המוח הנחשף על ידי חלון הגולגולת תוך מתן גישה אופטית כרונית. לפיכך, ניתן לשנות את מידותיו כך שיתאימו לאזור המוח שיש לצלם. - עקר את כל משטחי העבודה ואת מסגרת הניתוח על ידי ניגובם עם 70% אתנול.
- עקר את כל המכשירים הכירורגיים (מקדחת פלדה, פינצטה, וו מחט כירורגי) על ידי טבילתם בתמיסת כלורהקסידין גלוקונאט 1%.
- להרדים את העכבר עם איזופלורן (4% אינדוקציה, 1.2%-1.5% תחזוקה). אבטח את העכבר בתוך מסגרת הניתוח באמצעות לוחית הראש שלו.
- כדי ליצור חלון גולגולת מעל קליפת המוח המוטורית הראשונית, סמן ריבוע במידות של 2 מ"מ × 2 מ"מ במרכזו 0.2 מ"מ קדמי ו-1 מ"מ לרוחב מנקודת ציון הגולגולת של ברגמה.
- דק את הגולגולת לאורך גבול הריבוע המסומן באמצעות מקדחת הפלדה.
הערה: כאשר הם קרובים לעובי הרצוי, אזורי הגולגולת הדקים ייראו שקופים כאשר הם נרטבים במי מלח, וסדקים בקו השיער יתחילו להופיע. - לאחר שווידאתם שכל גבול הריבוע המסומן דולל כראוי, הכנס בזהירות את וו המחט הניתוחי ממש מתחת למשטח הגולגולת, וכיוון את קצהו לכיוון מרכז הריבוע. הרם בעדינות את חתיכת הגולגולת המרובעת עם הוו והשתמש בפינצטה כדי לקלף אותה משאר הגולגולת. אם מתרחש דימום, שטפו ברציפות את פני המוח החשוף במי מלח עד שהוא שוכך לחלוטין.
- הניחו את הכיסוי הכפול על משטח המוח החשוף, וכוונו את הצד עם הכיסוי הקטן יותר לכיוון המוח. ודא שהקצוות של הכיסוי הגדול יותר נמצאים במגע עם גבולות חלון הגולגולת.
- בעזרת מוט זכוכית עם קצה סיליקון המותקן במניפולטור, לחץ בעדינות כלפי מטה על הכיסוי הכפול כדי להבטיח שהוא יוצר מגע טוב עם פני השטח של המוח.
- מלאו את הפער בין הכיסוי הכפול, הגולגולת ומשטח המוח בשרף הניתן לריפוי UV והקרינו באור UV עד להתקשות (~20 שניות). הרם לאט את מוט הזכוכית עם קצה הסיליקון הרחק מהכיסוי הכפול.
- אפשר לעכבר להתאושש והנח אותו על משטח חימום. עקוב אחר העכבר עד שהוא יחזור להכרה מספקת כדי לשמור על שכיבה חזה (30 דקות).
- המשך לשלב 3 או החזר את העכבר לכלוב הביתי שלו.
הערה: לאחר ניתוח מיומן, הדורה וכל כלי הדם שמתחתיה יהיו שלמים לחלוטין ללא דימום. במקרה זה, הדלקת היא מינימלית וניתן להמשיך מיד לשלב 3. אם אינכם בטוחים, המתינו 1-3 שבועות כדי לוודא שכל דלקת נפתרה לחלוטין.
3. איסוף נתונים באמצעות הדמיה דו-פוטונית in vivo
- הפעל את הגדרת ההדמיה מראש כדי להבטיח שללייזר יש מספיק זמן להתחמם ולהתייצב. כוון את הלייזר כך שיפלוט באורך גל של 920 ננומטר, שהוא הספקטרום הדו-פוטוני שמרגש בצורה אופטימלית את הפלואורופור GCaMP6.
- מקם את העכבר מתחת לעדשת אובייקטיבית של מיקרוסקופ 25x והרגיל אותו למשך 30 דקות. במידת הצורך יש להרדים את העכבר באיזופלורן במהלך ההדמיה (4% אינדוקציה, 1.2%-1.5% תחזוקה).
הערה: ייתכן שאיזופלורן אינו מתאים ליישומי מחקר מסוימים, מכיוון שהוא משפיע על תנועתיות תהליך המיקרוגליה ופעילות Ca2+ 19,20,21. - הגדר את הזום ל-1x, ולאחר מכן חפש מיקרוגליה המבטאת GCaMP6 באזור חלון הגולגולת. חפשו בעומק שבין 100 מיקרומטר ל-300 מיקרומטר מתחת לפני השטח של המוח.
- לאחר שנמצאה מיקרוגליה מתאימה המבטאת GCaMP6, מקסם את הזום כך שניתן יהיה ללכוד פעילות Ca2+ ברזולוציית תא בודד.
- ודא חזותית שפעילות Ca2+ נלכדת בבירור והתאם את עוצמת הלייזר ורווח ההדמיה במידת הצורך.
הערה: יש למזער את עוצמת הלייזר ככל האפשר כדי למנוע פוטוהלבנה ופגיעה במיקרוגליה. - בצע רכישת תמונה ארבע-ממדית (4D) באופן הבא (שלבים 3.6.1-3.6.3; איור 1B):
- הגדר את מידות התמונה לאזור XY = 512 × 512 פיקסלים, 0.25 מיקרומטר/פיקסל; שטח Z = חמישה מישורי z, צעד z של 3 מיקרומטר (איור 1B).
- הגדר את קצב הרכישה ל-2.5 פריימים לשנייה.
הערה: סריקת Z במהירות זו מתאפשרת על ידי מערכת מיקום ננו פייזו. - רכוש נתונים עד שנצפו לפחות 10 אירועי Ca2+ בודדים (בדרך כלל 10 דקות).
4. הכנה לניתוח (תיקון תנועה, הקרנת z ממוצע/מקסימלית)
- לפני שתמשיך לנתח את פעילות המיקרוגליה Ca2+ , תקן את התמונות ה-4D עבור חפצים הקשורים לתנועה (רישום תמונה) באמצעות אלגוריתם יישור התמונה ECC22 בסביבת התכנות MATLAB (R2020a). הורד את הקוד מ: https://www.mathworks.com/matlabcentral/fileexchange/27253-ecc-image-alignment-algorithm-image-registration.
- צור תמונת ייחוס תלת-ממדית על-ידי רישום כל התמונות במסגרת הזמן הראשונה באמצעות פעולת IMREGISTER MATLAB (ארגז כלים סטנדרטי לעיבוד תמונה).
- רשום את כל התמונות הבאות, והתאם אותן למישור ה-z המתאים של תמונת הייחוס התלת-ממדית באמצעות פונקציית ecc (ספריית אלגוריתם יישור תמונה ECC).
- צור הקרנות z בעוצמה ממוצעת מהתמונות הרשומות באמצעות פעולת MATLAB הממוצעת . אם אות ההדמיה חלש מדי, צור הקרנות z בעוצמה מקסימלית במקום זאת באמצעות פעולת MATLAB המקסימלית .
הערה: יחס האות לרעש גרוע יותר בעת שימוש בהקרנות z בעוצמה מקסימלית. - המשך לשלב 5 או 6. השתמש בתחזיות z שנוצרו בשלב 4 כיעד הניתוח למיפוי הדינמיקה המרחבית-זמנית של פעילות Ca2+ בשלבים 5 ו-6.
5. ניתוח מבוסס ROI
- באמצעות תחזיות z שנוצרו בשלב 4, זהה תהליכי מיקרוגליה השומרים על פרופיל שטח יציב (אזור יציב) לאורך כל תקופת ההדמיה לניתוח עוקב של פעילות Ca2+ כדלקמן (שלבים 5.3-5.6):
- צור הקרנות t נפרדות בעוצמה מקסימלית של תמונות 4D הרשומות מדגימות של 2 דקות שנלקחו בתחילת ובסוף תקופת ההדמיה באמצעות פעולת MATLAB המקסימלית .
- בינאריזציה של תחזיות ה-t כדי ליצור מצולעים של מורפולוגיה המיקרוגליאלית המתאימה להתחלה ולסיום של תקופת ההדמיה באמצעות פעולת MATLAB האימבינארית . השתמש בסף ברירת המחדל המוגדר אוטומטית.
הערה: אם האות Ca2+ חלש במהלך ההתחלה והסוף של תקופת ההדמיה, בינאריזציה עלולה ליצור מצולעים עם גבולות חסרים. במקרה זה, צייר ידנית את הגבולות החסרים באמצעות כלי העיפרון ב-ImageJ. - שכב על מצולעי הקרנת t באמצעות פעולת IMADD MATLAB. האזורים החופפים מייצגים את האזור היציב (איור 2B).
- בתוך אזורים יציבים שזוהו, השתמש בפעולת MATLAB של drawpolygon כדי להגדיר ולעקוב באופן ידני אחר החזר ROI עבור כל אחד מהתהליכים המיקרו-גליאליים העיקריים וכל ענפי משנה ברורים מסדר שני.
- עקוב אחר עוצמות הקרינה המוחלטות הממוצעות על פני החזר ROI בודד על פני כל מסגרות הזמן (איור 2C,D).
- מסדרת הזמן של עוצמות הקרינה המוחלטת, חשב את השינוי היחסי בעוצמת הקרינה (ΔF/F) סדרות הזמן לפי משוואה (1). סדרת זמן זו מייצגת את הדינמיקה המנורמלת של microglial Ca2+ ברמת ההחזר על ההשקעה הבודד.
ΔF/F = (F(t) - F0) / F0 (1)
כאשר F(t) היא עוצמת הקרינה המתועדת בזמן נתון ו-F0 הוא האחוזוןהעשירי של עוצמת הקרינה בכל מסגרות הזמן (איור 2E). - זהה אירועי ירי Ca2+ מועמד המתרחשים בהחזר ROI בודד נתון באופן הבא (שלבים 5.5.1-5.5.3):
- החל סינון מעביר-נמוכים של תגובת דחף סופית (FIR) מסוג I על סדרת הזמן ΔF/F באמצעות פעולת fir1 MATLAB. הגדר את תדירות הניתוק לערך Nyquist (מחצית מקצב הדגימה).
- בדוק ויזואלית את העקבות המסוננות כדי לאשר ששיאי העקבות הבודדים תואמים להתפרצויות של פעילות Ca2+ בתמונות 4D הרשומות (איור 2F).
- זהה אירועי ירי מועמדים Ca2+ כהטיות קעורות למטה במעקב אחר סדרת הזמןΔF/F. הגדר סף בסיס כערך ΔF/F החציוני בתקרות העליונות והתחתונות שאינן כוללות את המשרעת המקסימלית והמינימלית של 10% בכל מסגרות הזמן. הגדר סף זיהוי של שלושה SDs מעל סף הבסיס (איור 2F,H).
- זהה אירועי פיטורים אמיתיים של Ca2+ ממועמדים באופן הבא (שלבים 5.5.1-5.5.2):
- חשב את השיפוע של כל אירוע מועמד על ידי הבחנה על פני מסגרות סדרת הזמן המסוננות ΔF/F המתאימות באמצעות פעולת MATLAB השיפוע המספרי .
- לאחר מכן זהה אירועי Ca2+ אמיתיים על סמך זמן העלייה של הפרופיל. הגדר סף בסיסי כממוצע ערכי השיפוע בכל אירועי המועמדים. הגדר סף זיהוי של שלושה SDs מעל סף הבסיס (איור 2G,H).
- אפיינו אירועי Ca2+ אמיתיים באופן הבא (שלבים 5.6.1-5.6.3):
הערה: להלן אינה רשימה ממצה של פרמטרים שניתן להשתמש בהם כדי לאפיין אירועי microglial Ca2+ . פרמטרים מעניינים תלויים במטרת המחקר.- גזור את המשרעת המקסימלית של אירוע ירי Ca2+ אמיתי כערך ΔF/F של מסגרת סדרת הזמן המתאימה ΔF/F .
- גזור את המשרעת הממוצעת של אירוע ירי Ca2+ אמיתי כערך ה-ΔF/F הממוצע על פני כל תת-קבוצת המסגרות המקבילה של סדרת הזמן ΔF/F .
- גזור את התדירות של אירועי Ca2+ אמיתיים כמספר האירועים חלקי זמן ההדמיה.
6. ניתוח מבוסס אירועים
- בצע ניתוח מבוסס אירועים על תחזיות z משלב 4 באמצעות ספריית AQuA בסביבת התכנות MATLAB. הורד את הקוד מ: https://github.com/yu-lab-vt/AQuA.
הערה: הדרכה לשימוש כללי בספריית AQuA זמינה בכתובת: https://drive.google.com/file/d/1a3lhe0dUth-5J1-S2fZlPOCZlPbeuvUr/view. תיעוד מפורט עבור ספריית AQuA זמין בכתובת: https://drive.google.com/file/d/1CckDLbrkw16b7MPlOQdYpZciIz80Snm_/view. - לאחר הפעלת MATLAB, עבור מתיקיית ברירת המחדל של ספריית העבודה לתיקיית ספריית העבודה הייעודית של AQuA באמצעות פעולת התקליטור .
- טען את תמונות ה-4D הרשומות לצינור הניתוח של AQuA באופן הבא (שלבים 6.3.1-6.3.2):
- הפעל את ממשק המשתמש הגרפי של AQuA. הקלד aqua_gui בחלון הפקודה MATLAB בתיקיית ספריית העבודה הייעודית של AQuA.
- בתוך ממשק המשתמש הגרפי של AQuA, לחץ על פרויקט חדש ובחר את התמונות הרשומות לניתוח. ציין את סוג הנתונים (GCaMPInVivo_cyto_Lck_) ואת פרמטרי ההדמיה (רזולוציה זמנית של שניות למסגרת = 1.993; רזולוציה מרחבית מיקרומטר לפיקסל = 0.25; אל תכלול פיקסלים קצרים ממרחק זה לגבול = 5). לחץ על פתח כדי לטעון את הנתונים.
- הגדר ציוני דרך עבור צינורות הניתוח הבאים על ידי מעקב אחר תחומי עניין. בדרך כלל, ציוני דרך מבוססים על גבול התא ועל השטח של גוף התא.
- לאחר מכן, זהה אירועי Ca2+ מועמדים על ידי הפעלת צינורות הניתוח האוטומטיים עבור הפרמטרים הבאים: אות פעיל, סופר ווקסל, זיהוי אירועים, אירועים נקיים ואירועי מיזוג.
הערה: הסבר מפורט על כל אחד מהפרמטרים הללו ותפוקות ניקוד המועמדים שלהם מסופק בהדרכה של AQuA. בקצרה, פרמטרים אלה מתאימים את סף זיהוי האירועים Ca2+ באופן הבא: אות פעיל = משרעת פלואורסצנטית, סופר ווקסל = אשכול של פלואורסצ במרחב תלת מימדי, זיהוי אירועים = קינטיקה של עלייה/דעיכה, אירועים נקיים = יחס אות לרעש, ואירועי מיזוג = הפרדה זמנית של אירועים. - בדוק ויזואלית את אירועי Ca2+ שזוהו (שכבת-על אוטומטית על התמונות הרשומות המקוריות). במידת הצורך, התאם את הגדרות הפרמטרים של צינורות הניתוח על ידי התחשבות באיכות התמונה מבחינת הפרמטרים לעיל; אם איכות התמונה לפרמטר נתון טובה, ניתן להגדיר סף גבוה יותר, ולהיפך.
- לאחר שכל אירועי Ca2+ זוהו כראוי, אפיין אירועים אלה בסביבת MATLAB הראשית באופן הבא (שלבים 6.8-6.14):
- ייצא את קבצי הפלט של ניתוח AQuA.
הערה: הסבר מפורט אודות קבצי הפלט, התכונות שחולצו המשמשות להגדרת אירועי Ca2+ והפרמטרים הבסיסיים של תכונות אלה שחולצו מסופק בתיעוד AQuA. - (אופציונלי) סווג את כל אירועי Ca2+ לשתי קבוצות: 1) אירועים שמתחילים בסומה, ו-2) אירועים שמתחילים בתהליכים.
- גש למשרעת של אירועי Ca2+ בודדים בתוך מבנה res.dffMat MATLAB של קובץ הפלט של ניתוח AQuA (קובץ .mat).
- גזור את התדירות של אירועי Ca2+ בודדים באמצעות פעולת MATLAB res.fts.loc.x3D (ספריית AQuA).
- גזור את משך הזמן של אירועי Ca2+ בודדים באמצעות פעולת res.fts.curve.width11 MATLAB (ספריית AQuA).
- גזור את האזור של אירועי Ca2+ בודדים באמצעות פעולת MATLAB res.fts.basic.area (ספריית AQuA).
- סווג את כל אירועי Ca2+ כ: 1) אירועים מקומיים, 2) אירועים מתפשטים הנעים לכיוון הסומה, ו-3) אירועים מתפשטים המתרחקים מהסומה. לשם כך, השתמש בפעולות res.fts.region.landmarkDir.chgTowards ו-res.fts.region.landmarkDir.chgAway MATLAB (ספריית AQuA) (איור 3C).
תוצאות
בעכברים טרנסגניים המבטאים באופן בלעדי GCaMP6 (חלבון פלואורסצנטי רגיש ל-Ca2+) במיקרוגליה, אנו בדרך כלל צופים בדפוסים מגוונים של פעילות Ca2+ מיקרוגליאלית (איור 2A). חשוב לציין, אפילו בתוך מיקרוגליה בודדת, דפוסי הפעילות של Ca2+ יכולים להיות שונים באופן דרמטי בין תהליכים.
כדי לכמת הבדלים כאלה מתהליך לתהליך בדינמיקה המרחבית-זמנית של פעילות Ca2+ מיקרוגליאלית, יש לזהות תחילה אזורים יציבים ולאחר מכן לחלק אותם להחזר ROI מפולח דק (איור 2B,C). עבור כל החזר ROI, יש לגזור ולכמת פרמטרים של פעילות Ca2+, כגון משרעת ותדירות, על ידי חילוץ תכונות כגון אמפליטודות מקומיות ושיפועי עקבות מסדרת הזמן של עוצמת הקרינה (איור 2D-G).
לאחר מכן, יש לבחון אירועי Ca2+ בודדים על ידי יישום אלגוריתם הכימות המדויק AQuA (איור 3A). מניתוחים מבוססי אירועים כאלה, הבדלים עצומים נצפים בדרך כלל במאפייני המקור, המשרעת, משך הזמן, המיקום וכיוון הזרימה של אירועי Ca2+ בודדים (איור 3B). אם מתמקדים בניתוח דינמיקת פעילות Ca2+ בתהליכים מיקרו-גליאליים, סכימת סיווג של אירועים מקומיים, אירועים הנעים לכיוון הסומה ואירועים המתרחקים מהסומה היא אינפורמטיבית (איור 3C).
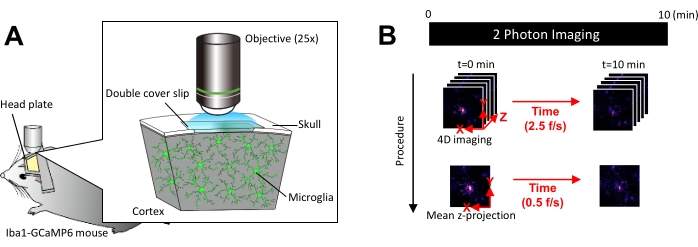
איור 1: מערך ניסיוני להדמיית Ca2+ in vivo microglial. (א) מערך ניסוי. עכבר Iba1-tTA × tetO-GCaMP6 עם ביטוי GCaMP6 ספציפי למיקרוגליה. על ידי החדרת חלון גולגולת לגולגולת העכבר, ניתן לצפות בפעילות Microglial Ca2+ in vivo באמצעות מיקרוסקופ דו-פוטוני. (ב) לוח זמנים ניסיוני והליך ניתוח. תמונות 4D נרכשות למשך 10 דקות לפחות כערימות z של חמש פריימים. קצב רכישת הפריימים הוא 2.5 פריימים לשנייה. לפני ניתוח פעילות Microglial Ca2+, ערימות ה-z בנות חמש הפריימים מומרים להקרנות z דו-ממדיות על ידי לקיחת העוצמה הממוצעת (או המקסימלית). קצב ההפעלה של הקרנת z הוא 0.5 פריימים לשנייה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
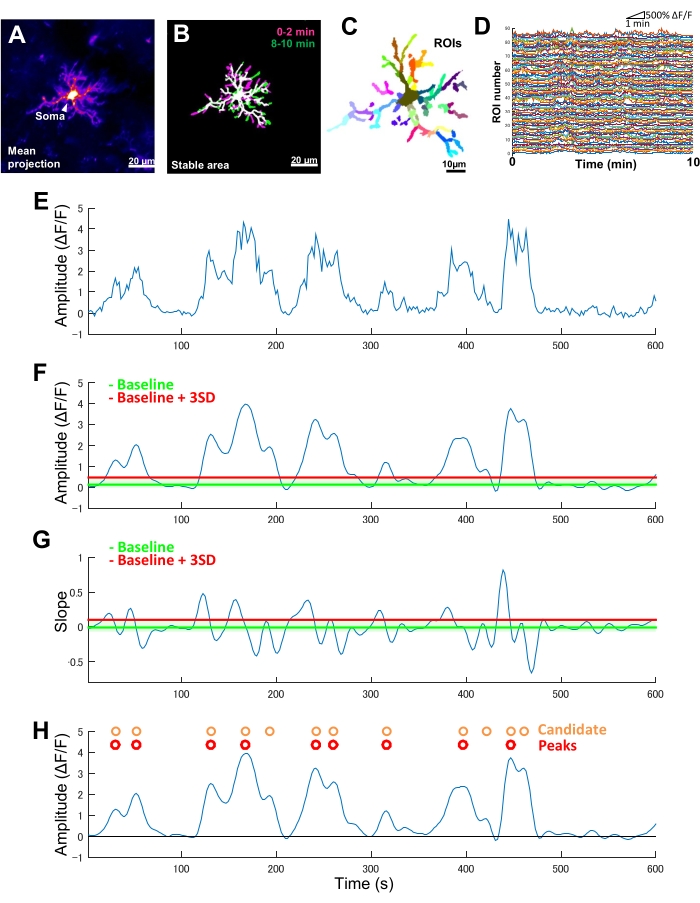
איור 2: ניתוח מבוסס ROI עבור פעילות Ca2+ מיקרוגליאלית. (A) הקרנת עוצמת GCaMP6 ממוצעת במשך 10 דקות עבור מיקרוגליה בודדת. (ב) אזורים יציבים (לבנים) מוגדרים על ידי שכבת-על של תחזיות t בינאריות בעוצמת GCaMP6 מקסימלית הנגזרות מדגימות של 2 דקות שנלקחו בתחילת (מגנטה) ובסוף (ירוק) של תקופת הדמיה. (ג) אזורים יציבים מחולקים עוד יותר להחזר השקעה אזורי. צבעים בודדים מציינים החזר השקעה בודד. (D) עקבות ΔF/F של כל ההחזר על ההשקעה הבודד ב-C. שימו לב לשונות בדפוסי הפעילות בין החזר ההשקעה. (E) עקבות מקוריים של סדרת זמן ΔF/F הנגזרת מערכי עוצמה מוחלטת עבור החזר ROI יחיד. (F) אותה סדרת זמן ΔF/F לאחר סינון מעביר נמוך. אירועי Ca2+ מועמד מזוהים על ידי סף חיתוך משרעת (קו אדום) המוגדר כקו בסיס + שלושה SDs. קו הבסיס (קו ירוק) מוגדר כערך החציוני על פני כל סדרת הזמן ΔF/F בתוך תקרה עליונה ותחתונה שאינה כוללת את המקסימום והמינימום של 10% מערכי ΔF/F . (G) עקבות השיפוע הנגזרות מסדרת הזמן המסוננת ΔF/F ב-F. אירועי Ca2+ אמיתיים ממוינים מאירועי Ca2+ מועמדים על סמך סף חיתוך שיפוע (קו אדום) המוגדר כקו בסיס + שלושה SDs. קו הבסיס (קו ירוק) מוגדר כערך הממוצע על פני כל סדרות הזמן של השיפוע בתוך תקרה עליונה ותחתונה שאינה כוללת את המקסימום והמינימום של 10% מערכי השיפוע. (H) אירועי Ca2+ מועמדים שזוהו על ידי קריטריוני משרעת ב-F מסומנים בכתום. אירועי Ca2+ אמיתיים מוינו מאירועי Ca2+ המועמדים לפי קריטריוני שיפוע ב-G באדום. שים לב שחלק מאירועי Ca2+ המועמדים מוזגו על סמך קריטריוני השיפוע. סדרת הזמן המסוננת המתאימה של ΔF/F מוצגת להלן לעיון. הקו השחור מציין משרעת אפס (ΔF/F). ממוצע ומשרעת מקסימלית של אירועי Ca2+ אמיתיים נגזרים כממוצע ומקסימום של הפסגות המתאימות להם בסדרת הזמן המסוננת ΔF/F . התדירות (אירועים/דקה) נגזרת כמספר אירועי הירי האמיתיים של Ca2+ חלקי תקופת ההדמיה (10 דקות). פסי קנה מידה = 20 מיקרומטר (A,B), 10 מיקרומטר (C). קיצור: ROI = אזור עניין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
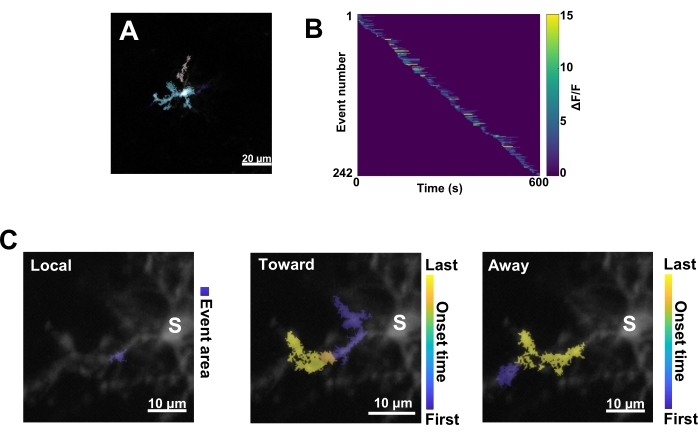
איור 3: ניתוח מבוסס אירועים עבור פעילות Ca2+ מיקרוגליאלית. (A) תמונות מייצגות של אירועים שזוהו באמצעות אלגוריתם AQuA. הצבעים מציינים אזורי אירועים בודדים שזוהו בנקודת זמן מסוימת. (B) פעילות Ca2+ מנורמלת מייצגת (ΔF/F) באירועים בודדים הממוינים לפי סדר ההופעה. הסרגל הימני מציין ΔF/F. (C) טביעות רגל מייצגות של אירועים המתפשטים לעבר הסומה או אירועים מקומיים והרחק מהם. עבור אירועים מקומיים, צורת האירוע מוצגת בכחול. עבור אירועים התפשטותיים, זמן תחילת האירוע מסומן על ידי הסולם הכחול-צהוב. מכיוון ש-AQuA מזהה בתחילה אירועי Ca2+ בנפרד, אירועי התפשטות מזוהים לאחר מכן על סמך המיקומים המרחביים החופפים וסדרות הזמן של מספר אירועי Ca2+ בודדים. שימו לב שזהו אותו ענף דנדריטי המשמש לניתוח החזר ה-ROI באיור 2E-H. פסי קנה מידה = 20 מיקרומטר (A), 10 מיקרומטר (C). קיצור: ROI = אזור עניין; S = סומה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
מאמר זה מציג גישה משופרת להדמיית פעילות Ca2+ מיקרוגליאלית עם רזולוציה מרחבית-זמנית גבוהה. שיטה זו רגישה מספיק כדי לזהות סוגים שונים של פעילות Ca2+ מיקרוגליאלית ברמה של תהליכים מסועפים בודדים, ולהבחין בקלות בין אירועים מקומיים להתפשטות.
בשיטה הכללית להדמיה דו-פוטונית in vivo של פעילות Microglial Ca2+ , יש לשים לב היטב לנקודות הבאות כדי למקסם את איכות ההדמיה. ראשית, מאחר שמיקרוגליה רגישה מאוד לפציעה, חשוב למזער מגע ישיר לפני השטח של המוח עם כלים כירורגיים במהלך הניתוח. אינדיקציות עיקריות לכך שהניתוח בוצע במיומנות הן כלי דם ודורה שלמים ודימום מינימלי מאוד במהלך הניתוח. שנית, הצמדה מאובטחת של לוחית הראש לגולגולת העכבר ומגע טוב בין הכיסוי הכפול למשטח המוח מפחיתים מאוד את החפצים הקשורים לתנועה בזמן ההדמיה. זה חשוב במיוחד בעת הדמיה ברזולוציות מרחביות-זמניות גבוהות ובעכברים ערים לחלוטין. בעוד שצינור הניתוח מפצה באופן אמין על חפצים הקשורים לתנועה הנובעים מפעימות הלב, הנשימה והסחיפה הכללית, הוא פחות חזק בעת טיפול בעיוותים גיאומטריים משמעותיים הנובעים מתנועות גדולות פתאומיות.
שתי שיטות הניתוח המתוארות כאן מציעות יתרונות שונים ומתאימות לשאלות מחקר שונות. בניתוח מבוסס ROI, המשתמש מגדיר מראש את החזר ה-ROI (כגון תהליכים בודדים), ומאפשר לחלץ את הדינמיקה המצטברת של פעילות Ca2+ של החזר ROI זה. לפיכך, הוא מתאים ביותר למצבים בהם תופעות צפויות להיות ממוקמות באזור תת-תאי שיש לו גם גבולות מורפולוגיים מוגדרים היטב וגם שטח גדול יחסית (כלומר, ענף תהליך). בניתוח מבוסס אירועים, אירועים בודדים מוגדרים על סמך הדינמיקה המרחבית-זמנית של פעילות המיקרוגליהCa 2+ עצמה ולאחר מכן יש למקם אותם בהקשר של ציוני דרך המוגדרים על ידי המשתמש בתוך המיקרוגליה כדי שתפקודם יפורש. לפיכך, הוא מתאים ביותר למצבים בהם לא ניתן להניח הנחות לגבי לוקליזציה של תופעות או כאשר תחום העניין קטן יחסית (כלומר, קצה תהליך). ככזה, ניתוח מבוסס אירועים מציע רזולוציה מרחבית-זמנית משופרת בעת אפיון פעילות Ca2+ של מיקרוגליה בהשוואה לשיטות קודמות.
בעכברים אלה, הסמן הפלואורסצנטי היחיד המתבטא על ידי מיקרוגליה הוא מחוון Ca2+ GCaMP6. לפיכך, באזורים שבהם פעילות Ca2+ נמוכה, יש לחלץ מורפולוגיה של מיקרוגליה על ידי שילוב מסגרות זמן מרובות, מה שעלול לפגוע ברזולוציה הזמנית. עם זאת, ניתן להתגבר על מגבלה זו על ידי ביטוי חלבון פלואורסצנטי אדום נפרד במיקרוגליה. יש לציין כי נגיפים חדשים הקשורים לאדנו המסוגלים להעביר מיקרוגליה תוארו לאחרונה 23,24,25.
האופן שבו פעילות המיקרוגליה Ca2+ משתנה על ידי הסביבה הסובבת הוא נושא מתעורר של עניין. בפרט, נראה כי פעילות Ca2+ של מיקרוגליה מראה מתאמים משמעותיים עם פעילות עצבית, אם כי המשמעות התפקודית של זה עדיין לא אופיינה ביסודיות. לפיכך, שילוב של מניפולציה של פעילות עצבית עם שיטות הדמיה וניתוח לפעילות מיקרוגליהCa 2+ המוצגת כאן אמור להניב תובנות חדשות לגבי הפיזיולוגיה של מיקרוגליה ולקדם עוד יותר את הבנתנו את התפקידים שממלאים מיקרוגליה במצבים פיזיולוגיים ופתולוגיים.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים הקשורים לכתב היד הזה.
Acknowledgements
אנו אסירי תודה לפרופ' קנג'י טנאקה (אוניברסיטת Keio, טוקיו, יפן) על שסיפק עכברי Iba1-tTA ועכברי tetO-GCaMP6. עבודה זו נתמכה על ידי מענקים בסיוע למדענים צעירים (B) [16K19001 (ל-H.H.)], מענקים בסיוע למדענים בתחילת הקריירה [18K14825 (ל-H.H.)], מענק סיוע למחקר מדעי (B) [21H03027 (ל-H.H.)], מענק סיוע לתחומי מחקר טרנספורמטיביים (A) [21H05639 (ל-H.H.)], מענק סיוע למחקר מדעי (A) [17H01530, 20H00500 (ל-J.N.)], ומענק JST CREST [JPMJCR1755 (ל-J.N.)], יפן.
Materials
| Name | Company | Catalog Number | Comments |
| 2% xylocaine jelly | AstraZeneca, UK | ||
| B6(129S6)-Tg(Aif1-tTA)54Kftnk | RIKEN RBC, Japan | RBRC05769 | Iba1-tTA mice |
| B6;129-Actb(tm3.1(tetO-GCaMP6)Kftnk) | RIKEN RBC, Japan | RBRC09552 | tetO-GCaMP6 mice |
| Forceps | Fine science tools, US | 13008-12 | |
| G-CEM ONE | GC corporation, Japan | ||
| Glass capillary | Narishige, Japan | GDC-1 | |
| ImageJ | NIH, US | ||
| Isofulrane | Pfizer, US | ||
| Ketamin | Daiichi-Sankyo, Japan | ||
| Kwik-sil | World Precision Instruments, US | KWIK-SIL | |
| MATLAB, 2020a | MathWorks, US | ||
| Micro cover glass (2 x 2 mm, No.3) | Matsunami, Japan | custum-made | Bottom glass for cranial window |
| Micro cover glass (3 x 3 mm, No.0) | Matsunami, Japan | custum-made | Upper glass for cranial window |
| N25X-APO-MP | Nikon, Japan | N25X-APO-MP | Objective lens (25x) |
| Norland optical adhesive | Edmund optics, US | 6101 | |
| Piezo nano-positioning system, Nano-Drive | Mao City Labs, US | ||
| Razor blade | Feather, Japan | FA-10 | |
| Scissors | Fine science tools, US | 14060-11 | |
| Steel drill | Minitor, Japan | BS1201 | |
| Stereotaxic instruments | Narishige, Japan | SR-5M-HT | |
| Super-bond (C&B kit) | Sun Medical, Japan | 4560227797382 | |
| Surgical needle hook | Fine science tools, US | 10065-15 | |
| Ti:Sappire laser, MaiTai DeepSee | Spectra Physics, US | Mai Tai eHP DS | |
| Tweezers | Fine science tools, US | 11051-10 | |
| Tweezers | Fine science tools, US | 11255-20 | |
| Two-photon microscope | Nikon, Japan | A1R-MP | |
| UV craft resin | Kiyohara, Japan | UVR | |
| Xylazine | Bayer, Germany |
References
- Miyamoto, A., et al. Microglia contact induces synapse formation in developing somatosensory cortex. Nature Communications. 7, 12540 (2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Cserep, C., et al. Microglia monitor and protect neuronal function through specialized somatic purinergic junctions. Science. 367 (6477), 528-537 (2020).
- Kato, G., et al. Microglial contact prevents excess depolarization and rescues neurons from excitotoxicity. eNeuro. 3 (3), (2016).
- Li, Y., Du, X. -. F., Liu, C. -. S., Wen, Z. -. L., Du, J. -. L. Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo. Developmental Cell. 23 (6), 1189-1202 (2012).
- Tremblay, M. -. E., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. Plos Biology. 8 (11), 1000527 (2010).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. The Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Oppenheim, R. W. Cell death during development of the nervous system. Annual Review of Neuroscience. 14 (1), 453-501 (1991).
- Sierra, A., Abiega, O., Shahraz, A., Neumann, H. Janus-faced microglia: beneficial and detrimental consequences of microglial phagocytosis. Frontiers in Cellular Neuroscience. 7, 6 (2013).
- Brawek, B., et al. A new approach for ratiometric in vivo calcium imaging of microglia. Scientific Reports. 7 (1), 6030 (2017).
- Eichhoff, G., Brawek, B., Garaschuk, O. Microglial calcium signal acts as a rapid sensor of single neuron damage in vivo. Biochimica et Biophysica Acta. 1813 (5), 1014-1024 (2011).
- Liu, L., et al. Microglial calcium waves during the hyperacute phase of ischemic stroke. Stroke. 52 (1), 274-283 (2021).
- Pozner, A., et al. Intracellular calcium dynamics in cortical microglia responding to focal laser injury in the PC::G5-tdT reporter mouse. Frontiers in Molecular Neuroscience. 8, 12 (2015).
- Umpierre, A. D., et al. Microglial calcium signaling is attuned to neuronal activity in awake mice. Elife. 9, e56502 (2020).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. Plos One. 7 (12), e51286 (2012).
- Tanaka, K. F., et al. Expanding the repertoire of optogenetically targeted cells with an enhanced gene expression system. Cell Reports. 2 (2), 397-406 (2012).
- Liu, Y. U., et al. Neuronal network activity controls microglial process surveillance in awake mice via norepinephrine signaling. Nature Neuroscience. 22 (11), 1771-1781 (2019).
- Stowell, R. D., et al. Noradrenergic signaling in the wakeful state inhibits microglial surveillance and synaptic plasticity in the mouse visual cortex. Nature Neuroscience. 22 (11), 1782-1792 (2019).
- Sun, W. L., et al. In vivo two-photon imaging of anesthesia-specific alterations in microglial surveillance and photodamage-directed motility in mouse cortex. Frontiers in Neuroscience. 13, 421 (2019).
- Evangelidis, G. D., Psarakis, E. Z. Parametric image alignment using enhanced correlation coefficient maximization. IEEE Transactions on Pattern Analysis and Machine Intelligence. 30 (10), 1858-1865 (2008).
- Rosario, A. M., et al. Microglia-specific targeting by novel capsid-modified AAV6 vectors. Molecular Therapy. Methods & Clinical Development. 3, 16026 (2016).
- Maes, M. E., Wogenstein, G. M., Colombo, G., Casado-Polanco, R., Siegert, S. Optimizing AAV2/6 microglial targeting identified enhanced efficiency in the photoreceptor degenerative environment. Molecular Therapy. Methods & Clinical Development. 23, 210-224 (2021).
- Lin, R., et al. Directed evolution of adeno-associated virus for efficient gene delivery to microglia. Nature Methods. 19 (8), 976-985 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved