Method Article
single-cell resolution에서 microglial Ca2+ 활성의 시공간 분석
요약
이 논문에서는 미세아교세포 Ca2+ 활성의 생체 내 이미징을 위한 프로토콜과 시공간 역학에 대한 후속 분석을 설명합니다. 이 방법은 미세아교세포가 뇌 환경의 변화에 어떻게 반응하는지 철저히 특성화하여 이러한 이벤트가 발생하는 미세한 시공간 규모를 적절하게 포착할 수 있습니다.
초록
미세아교세포(Microglia)는 중추신경계에 유일하게 상주하는 면역 세포입니다. 그들의 형태는 매우 가소적이며 활동에 따라 변합니다. 항상성 조건 하에서, 미세아교세포는 매우 파급된 형태를 가지고 있습니다. 이는 프로세스의 지속적인 확장 및 축소를 통해 주변 환경을 쉽게 모니터링 할 수 있습니다. 그러나 뇌 손상 및 염증 중에는 미세아교세포가 활성화되고 극적인 형태학적 변화를 겪어 파급된 과정을 철회하고 세포체를 팽창시킵니다. 이것은 이동 및 식세포작용과 같은 활동을 촉진하며, 미세아교세포는 뇌 환경을 덜 병리적인 상태로 안내하기 위해 수행합니다.
미세아교세포의 형태학과 그 활동의 변화 사이의 이러한 밀접한 관계는 다양한 미세아교세포의 기능에 대한 상당한 통찰력을 가능하게 했습니다. 그러나 이러한 형태학적 및 활동적 변화는 그 자체로 여러 세포 내 신호 경로로 인해 발생할 수 있는 현상입니다. 더욱이, 자극과 반응 사이의 시간 지연과 미세아교세포의 고도로 구획화된 형태는 기능을 뒷받침하는 원인 메커니즘을 분리하기 어렵게 만듭니다. 이 문제를 해결하기 위해 고감도 형광 Ca2+ 지표 단백질이 미세아교세포에서 특이적으로 발현되는 유전자 변형 마우스 라인을 개발했습니다.
생체 내 미세아교세포 Ca2+ 이미징 방법을 설명한 후, 이 논문은 이 Ca2+ 활성을 합리적으로 정의된 하위 세포 영역으로 분류하여 인코딩된 정보의 공간적 및 시간적 차원이 의미 있게 추출되도록 하는 구조화된 분석 접근 방식을 제시합니다. 우리는 이 접근법이 더 높은 뇌 기능 및 병리학적 상태와 관련된 다양한 미세아교세포 활동을 지배하는 세포 내 신호 전달 규칙에 대한 자세한 이해를 제공할 것이라고 믿습니다.
서문
미세아교세포(Microglia)는 중추신경계(CNS)에 상주하는 면역 세포로, 뇌 발달 과정에서 항상성 뇌 환경을 유지하고 신경 회로 형성을 조절하는 데 중요한 역할을 합니다 1,2. CNS에서 미세아교세포의 독특한 특징은 그 형태가 매우 가소성이라는 것입니다. 그러나 뚜렷한 형태학적 표현형은 특정 기능과 관련될 수 있습니다. 또한, 형태학적 표현형 간의 변환은 매우 역동적이며, 주변 환경의 변화에 대응하여 빠른 시간 규모로 발생합니다 3,4.
항상성 생리학적 조건 하에서, 미세아교세포는 모든 방향으로 바깥쪽으로 방사되는 여러 과정과 함께 고도로 파급된 형태를 가정합니다. 이러한 파급된 과정 자체는 높은 운동성을 보여주며, 지속적으로 확장 및 수축합니다 3,4. 이러한 활동은 주로 뉴런 활동을 모니터링하기 위해 뉴런 시냅스, 축삭 및 소마와 주기적으로 접촉하는 방향으로 진행됩니다 5,6,7,8,9. 그러나 뇌가 손상되면 미세아교세포는 이러한 이상을 신속하게 감지하고 적응 반응의 첫 번째 단계로 해당 지역 3,4로 프로세스를 확장하도록 지시합니다. 미세아교세포가 죽은 세포와 대사 산물의 식세포작용(phagocytosis)을 수행해야 하는 경우, 그들은 아메바와 같은 형태를 취하여 면역학적으로 활성화된 표현형10,11로의 전환의 일환으로 프로세스를 단축하고 세포체를 확대합니다.
그러나 미세아교세포돌기의 극적인 형태학적 변화는 쉽게 감지되는 반면, 세포체의 미세한 변화는 특히 생리학적으로 관련된 시간적 해상도에서 포착하기가 훨씬 더 어렵습니다. 더욱이, 형태학적 변화 자체는 여러 세포 내 신호 경로의 통합된 결과만을 나타냅니다. 이것은 기능적 활동을 추적하고 자극이 유발하는 최종 반응과 기계적으로 연결하려는 목표에 문제가 있습니다.
두 번째 전달자로서의 광범위한 역할을 감안할 때 세포 내 Ca2+ 역학을 조사하면 동적 세포 과정을 연구할 때 관련 시공간 정보를 더 잘 포착할 수 있습니다. 이러한 접근법은 하류 세포 내 Ca2+ 상승과 연결된 다양한 이온성 및 대사성 수용체를 발현한다는 점을 감안할 때 미세아교세포에 적용할 수 있습니다. 실제로, 생체 내 Ca2+ 이미징은 미세아교세포 활동의 시공간 측면을 실시간으로 특성화하는 데 사용되었으며, 미세아교세포 Ca2+ 활동의 변화를 뇌 손상, 염증 및 뉴런의 과잉 및 저활동과 성공적으로 연관시켰습니다 12,13,14,15,16. 예를 들어, 과잉/저활동성 뉴런 활동에 대한 반응으로 미세아교세포 과정 확장과 관련된 Ca2+ 고도는 기저에 있는 Ca2+ 의존성 액틴 중합 과정16을 반영하는 것으로 보인다. 또한 in vivo Ca2+ 이미징은 약리학적 접근법과 쉽게 결합할 수 있습니다. 예를 들어, 미세아교세포가 P2X(ionotropic) 및 P2Y(metabotropic) 수용체를 모두 발현하는 반면, P2Y 작용제의 국소 적용은 손상된 이웃 뉴런13에 대한 미세아교세포 Ca2+ 반응을 모방하고 이후에 둔감화하며, 따라서 뉴런 손상 감지에 대한 P2Y 신호의 더 큰 관련성을 암시합니다.
현재까지 미세아교세포 Ca2+ 활성을 조사한 이전 보고서에서는 관심 영역(ROI) 기반 분석 방법을 사용했습니다. 이러한 접근법의 단점은 개별 미세아교세포 과정 수준에서 Ca2+ 활성의 시공간 역학을 해결할 수 있기에는 여전히 너무 거칠다는 것입니다. 따라서 이 프로토콜은 미세아교세포 Ca2+ 활성을 분석하기 위한 기존의 ROI 기반 방법과 미세아교세포 프로세스에서 개별 Ca2+ 이벤트를 추출할 수 있는 새로운 이벤트 기반 접근 방식을 모두 설명합니다. 이에 앞서 자세한 분석을 위해 미세아교세포 Ca2+ 활성을 적절하게 캡처하기 위해 in vivo 이광자 이미징에 대한 일반적인 가이드를 제공합니다.
프로토콜
모든 동물 실험은 미국 국립생리과학연구소(National Institute for Physiological Sciences) 동물연구위원회(Animal Research Committees)의 승인을 받았으며 미국 국립보건원(National Institutes of Health)의 가이드라인을 따랐습니다. 모든 실험에서 8-10주 된 수컷 쥐는 음식과 물에 대한 임시로 12/12시간의 명암 주기 아래에서 자랐습니다. 미세아교세포에서 Ca2+ 활성을 시각화하기 위해 이온화된 Ca2+ 결합 어댑터 분자 1(Iba1)-테트라사이클린 트랜스액티베이터(Iba1-tTA) 마우스를 테트라사이클린 operator-GCaMP6(tetO-GCaMP6) 마우스17,18과 교차시켰습니다. 따라서, 테트라사이클린-아날로그 보충이 없는 경우, Iba1 프로모터는 미세아교세포에서만 GCaMP6의 발현을 유도합니다. 모든 실험에서 독시사이클린 식이 보충제는 출생 후 6주에 중단되었습니다. 모든 실험이 끝날 때, 생쥐는 이소플루란 과다 투여에 이어 자궁경부 탈구로 안락사되었습니다. 이 프로토콜에 사용된 모든 물질, 동물 및 시약과 관련된 자세한 내용은 재료 표를 참조하십시오.
1. 생체 내 이광자 이미징을 위한 마우스의 외과적 준비; 1일차
- 멸균 작업 조건을 유지하기 위해 층류 캐비닛 내부에서 모든 수술 절차를 수행하십시오. 수술을 시작하기 전에 캐비닛 내부를 자외선으로 5분 동안 소독하십시오.
- 모든 작업 표면, 수술 프레임 및 정위 기구를 70% 에탄올로 닦아 소독합니다.
- 모든 수술 기구(가위, 집게, 면도날, 핀셋)와 맞춤형 헤드플레이트를 1% 클로르헥시딘 글루코네이트 용액에 담가 마우스의 두개골에 부착할 수 있도록 소독합니다.
- 케타민(7.4mg kg-1, 복강내 [i.p.]) 및 자일라진(10mg kg-1, i.p.)으로 마우스를 마취합니다. 마취가 자리를 잡을 때까지 집에 있는 우리로 되돌립니다. 발가락 핀치 반사의 상실에 의한 마취의 완전한 유도를 확인합니다.
- 1% 클로르헥시딘 글루코네이트로 두피를 살균합니다. 면도날로 털을 깎습니다.
- 정위 기구를 통해 수술 프레임 내에 마우스를 고정합니다.
- 마취 상태에서 건조를 방지하기 위해 수의사 연고를 눈에 바르십시오.
- 통증 관리를 위해 2%의 자일로카인 젤리를 두피에 바르십시오. 5분 동안 기다립니다.
- 가위로 두피를 제거하고 두개골을 드러냅니다. 골막을 청소하고 면봉으로 문질러 노출된 두개골 표면을 건조시킵니다.
알림: 노출된 두개골 부분은 맞춤형 헤드 플레이트와 강한 접착을 보장하기 위해 완전히 건조되어야 합니다. - 맞춤형 헤드플레이트를 치과용 시멘트로 두개골에 고정합니다.
- 시멘트가 굳으면 두개골 표면과 맞춤형 헤드 플레이트의 테두리 사이의 틈을 추가 치과 시멘트로 채웁니다.
- 시멘트와 두개골 표면을 아크릴 계열의 치과용 접착 수지 시멘트를 도포하여 방수합니다.
- 마우스를 가정용 케이지로 되돌려 보온 패드에 놓습니다. 흉골 누운 자세를 유지할 수 있을 만큼 충분한 의식을 회복할 때까지(2시간 이내) 마우스를 모니터링합니다.
참고: 생쥐는 다음 날까지 완전히 회복되어야 하며 다른 동물과 함께 수용할 수 있습니다.
2. 생체 내 이광자 이미징을 위한 마우스의 외과적 준비; 2일차
- 멸균 작업 조건을 유지하기 위해 층류 캐비닛 내부에서 모든 수술 절차를 수행하십시오. 수술을 시작하기 전에 캐비닛 내부를 자외선으로 5분 동안 소독하십시오.
- 치수가 다른 두 개의 유리 커버 슬립 (상단 유리 : 3mm × 3mm, 하단 유리 : 2mm × 2mm)을 UV 경화 광학 등급 수지로 함께 라미네이트합니다.
참고: 이중 커버슬립은 두개골 창에 의해 노출된 뇌 영역을 장기간 보호하는 동시에 만성적인 광학 접근을 가능하게 합니다. 따라서, 그 크기는 이미지화할 뇌 영역에 맞게 변경될 수 있습니다. - 모든 작업 표면과 수술 프레임을 70% 에탄올로 닦아 소독합니다.
- 모든 수술 기구(강철 드릴, 핀셋, 수술용 바늘 고리)를 1% 클로르헥시딘 글루코네이트 용액에 담가 멸균합니다.
- 이소플루란으로 마우스를 마취합니다(4% 유도, 1.2%-1.5% 유지). 헤드플레이트를 통해 수술 프레임 내에 마우스를 고정합니다.
- 1차 운동 피질 위에 두개골 창을 만들려면 브레그마 두개골 랜드마크에서 0.2mm 전방, 1mm 옆으로 2mm × 2mm 크기의 정사각형을 표시합니다.
- 강철 드릴을 사용하여 표시된 사각형의 경계를 따라 두개골을 얇게 만듭니다.
참고: 원하는 두께에 가까워지면 얇아진 두개골 부분이 식염수에 적셨을 때 투명하게 나타나고 헤어라인 균열이 나타나기 시작합니다. - 표시된 사각형의 전체 경계가 적절하게 얇아졌는지 확인한 후 두개골 표면 바로 아래에 수술용 바늘 고리를 조심스럽게 삽입하고 끝이 사각형 중앙을 향하도록 합니다. 갈고리로 사각형 두개골 조각을 부드럽게 들어 올리고 핀셋을 사용하여 두개골의 나머지 부분에서 떼어냅니다. 출혈이 발생하면 노출된 뇌 표면을 식염수로 완전히 가라앉을 때까지 계속 씻으십시오.
- 이중 커버슬립을 노출된 뇌 표면에 놓고 더 작은 커버슬립이 있는 쪽이 뇌 쪽으로 향하도록 합니다. 더 큰 커버슬립의 가장자리가 두개골 창의 경계와 접촉하는지 확인하십시오.
- 매니퓰레이터에 장착된 실리콘 팁 유리 막대를 사용하여 이중 커버슬립을 부드럽게 눌러 뇌 표면과 잘 접촉하도록 합니다.
- 이중 커버슬립, 두개골 및 뇌 표면 사이의 틈을 UV 경화 수지로 채우고 굳을 때까지(~20초) 자외선을 조사합니다. 이중 커버슬립에서 끝이 무성한 실리콘 유리 막대를 천천히 들어 올립니다.
- 마우스가 회복될 때까지 기다렸다가 보온 패드에 놓습니다. 흉골 누운 자세를 유지할 수 있을 만큼 충분한 의식을 회복할 때까지 마우스를 모니터링합니다(30분).
- 3단계로 진행하거나 마우스를 홈 케이지로 되돌립니다.
참고: 능숙한 수술 후에는 경막과 모든 기저 혈관이 출혈 없이 완전히 손상되지 않습니다. 이 경우 염증이 미미하고 즉시 3단계로 진행할 수 있습니다. 확실하지 않은 경우 염증이 완전히 사라질 때까지 1-3주 정도 기다리십시오.
3. in vivo 이광자 이미징을 사용한 데이터 수집
- 레이저가 예열되고 안정화될 충분한 시간을 갖도록 미리 이미징 설정을 켜십시오. GCaMP6 형광단을 최적으로 여기시키는 이광자 스펙트럼인 920nm의 파장에서 방출하도록 레이저를 조정합니다.
- 마우스를 25x 현미경 대물 렌즈 아래에 놓고 30분 동안 습관화합니다. 필요한 경우 이미징 중에 이소플루란으로 마우스를 마취합니다(4% 유도, 1.2%-1.5% 유지).
참고: 이소플루란은 미세아교세포 돌기 운동성과 Ca2+ 활성에 영향을 미치기 때문에 일부 연구 응용 분야에는 적합하지 않을 수 있습니다 19,20,21. - 줌을 1x로 설정한 다음 두개골 창 영역에서 GCaMP6를 발현하는 미세아교세포를 검색합니다. 뇌 표면 아래 100μm에서 300μm 사이의 깊이에서 검색합니다.
- 적절한 GCaMP6 발현 미세아교세포가 발견되면 단일 세포 해상도로 Ca2+ 활성을 캡처할 수 있도록 확대/축소를 최대화합니다.
- Ca2+ 활동이 명확하게 포착되었는지 육안으로 확인하고 필요한 경우 레이저 출력과 이미징 게인을 조정합니다.
알림: 광표백 및 미세아교세포 손상을 방지하기 위해 레이저 출력을 최대한 최소화해야 합니다. - 다음과 같이 4차원(4D) 이미지 획득을 수행합니다(단계 3.6.1-3.6.3; 그림 1B):
- 이미지 크기를 XY 영역 = 512 × 512 픽셀, 0.25 μm/픽셀로 설정합니다. Z 면적 = 5개의 z-평면, 3μm z-스텝(그림 1B).
- 획득 속도를 2.5 frames/s로 설정합니다.
참고: 이 속도의 Z 스캐닝은 피에조 나노 포지셔닝 시스템에 의해 촉진됩니다. - 최소 10개의 개별 Ca2+ 이벤트가 관찰될 때까지(보통 10분) 데이터를 수집합니다.
4. 분석 준비(모션 보정, 평균/최대 z-투영)
- 미세아교세포 Ca2+ 활성 분석을 진행하기 전에 MATLAB 프로그래밍 환경(R2020a)에서 ECC 이미지 정렬 알고리즘22 를 사용하여 4D 이미지에서 모션 관련 아티팩트(이미지 정합)를 보정합니다. 다음에서 코드를 다운로드합니다: https://www.mathworks.com/matlabcentral/fileexchange/27253-ecc-image-alignment-algorithm-image-registration.
- imregister MATLAB 작업(표준 Image Processing Toolbox)을 사용하여 최초 시간 프레임 내의 모든 이미지를 정합하여 참조 3D 이미지를 만듭니다.
- 이후의 모든 이미지를 등록하고 ecc 함수(ECC 이미지 정렬 알고리즘 라이브러리)를 사용하여 참조 3D 이미지의 해당 z 평면과 일치시킵니다.
- 평균 MATLAB 연산을 사용하여 정합된 영상에서 평균 강도 z-투영을 생성합니다. 이미징 신호가 너무 약하면 대신 max MATLAB 연산을 사용하여 최대 명암 z-투영을 생성하십시오.
참고: 신호 대 잡음비는 최대 강도 z-투영을 사용할 때 더 나쁩니다. - 5단계 또는 6단계로 진행합니다. 4단계에서 생성된 z-투영을 5단계와 6단계에서 Ca2+ 활동의 시공간 역학을 매핑하기 위한 분석 대상으로 사용합니다.
5. ROI 기반 분석
- 4단계에서 생성된 z-투영을 사용하여 다음과 같이 Ca2+ 활성의 후속 분석을 위해 이미징 기간 동안 안정적인 영역 프로파일(안정적인 영역)을 유지하는 미세아교세포 프로세스를 식별합니다(5.3-5.6단계).
- max MATLAB 연산을 사용하여 이미징 기간의 시작과 끝에서 채취한 2분 샘플에서 등록된 4D 이미지의 개별 최대 명암 t-투영을 생성합니다.
- imbinarize MATLAB 연산을 사용하여 이미징 기간의 시작과 끝에 해당하는 미세아교세포 형태의 다각형을 생성하기 위해 t-투영을 이진화합니다. 자동으로 설정된 기본 임계값을 사용합니다.
참고: 이미징 기간의 시작과 끝 동안 Ca2+ 신호가 약한 경우 이진화는 테두리가 누락된 다각형을 생성할 수 있습니다. 이 경우 ImageJ의 연필 도구를 사용하여 누락된 테두리를 수동으로 그립니다. - imadd MATLAB 연산을 사용하여 t-투영 다각형을 오버레이합니다. 겹치는 영역은 안정된 영역을 나타냅니다(그림 2B).
- 식별된 안정적인 영역 내에서 drawpolygon MATLAB 연산을 사용하여 각 1차 미세아교세포와 명백한 2차 하위 분기에 대한 ROI를 수동으로 정의하고 추적할 수 있습니다.
- 모든 기간 동안 개별 ROI에 걸쳐 평균화된 절대 형광 강도를 추적합니다(그림 2C,D).
- 절대 형광 강도의 시계열에서 방정식 (1)에 따라 형광 강도(ΔF/F) 시계열의 상대적 변화를 계산합니다. 이 시계열은 개별 ROI 수준에서 정규화된 미세아교세포 Ca2+ 역학을 나타냅니다.
ΔF/F = (F(t) - 에프0) / 에프0 (1)
여기서 F(t)는 주어진 시간에 기록된 형광 강도이고 F0는 모든 시간 프레임에서 형광 강도의 10번째 백분위수입니다(그림 2E). - 다음과 같이 주어진 개별 ROI에서 발생하는 후보 Ca2+ 발사 이벤트를 식별합니다(5.5.1-5.5.3단계).
- fir1 MATLAB 연산을 사용하여 ΔF/F 시계열에 유형 I 유한 임펄스 응답(FIR) 저역 통과 필터링을 적용합니다. 차단 주파수를 Nyquist 값(샘플링 속도의 절반)으로 설정합니다.
- 필터링된 트레이스를 육안으로 검사하여 개별 트레이스 피크가 등록된 4D 이미지에서 Ca2+ 활성의 버스트에 해당하는지 확인합니다(그림 2F).
- 후보 Ca2+ 발사 이벤트를ΔF/F 시계열 추적에서 오목한 굴곡으로 식별합니다. 기준선 임계값을 모든 시간 프레임에 걸쳐 최대 및 최소 10% 진폭을 제외하는 상한 및 하한 천장 내의 중앙값 ΔF/F 값으로 정의합니다. 기준선 임계값보다 3개의 SD가 높은 검출 임계값을 정의합니다(그림 2F,H).
- 다음과 같이 후보의 실제 Ca2+ 발사 이벤트를 식별합니다(단계 5.5.1-5.5.2).
- 수치적 기울기 MATLAB 연산을 사용하여 필터링된 해당 ΔF/F 시계열 프레임을 미분하여 각 후보 이벤트의 기울기를 계산합니다.
- 그런 다음 프로필의 상승 시간을 기반으로 실제 Ca2+ 이벤트를 식별합니다. 기준선 임계값을 모든 후보 이벤트에 대한 기울기 값의 평균으로 정의합니다. 기준선 임계값보다 3개의 SD보다 높은 검출 임계값을 정의합니다(그림 2G,H).
- 실제 Ca2+ 이벤트를 다음과 같이 특성화합니다(5.6.1-5.6.3단계).
참고: 다음은 미세아교세포 Ca2+ 이벤트를 특성화하는 데 사용할 수 있는 매개변수의 전체 목록이 아닙니다. 관심 매개변수는 연구 목적에 따라 다릅니다.- 실제 Ca2+ 발사 이벤트의 최대 진폭을 해당 ΔF/F 시계열 프레임의 ΔF/F 값으로 도출합니다.
- 실제 Ca2+ 발사 이벤트의 평균 진폭을 프레임의 해당 ΔF/F 시계열 하위 집합에서 평균 ΔF/F 값으로 도출합니다.
- 실제 Ca2+ 이벤트의 빈도를 이벤트 수를 이미징 시간으로 나눈 값으로 도출합니다.
6. 이벤트 기반 분석
- MATLAB 프로그래밍 환경 내에서 AQuA 라이브러리를 사용하여 4단계의 z 투영에 대한 이벤트 기반 분석을 수행합니다. 다음에서 코드를 다운로드하십시오 : https://github.com/yu-lab-vt/AQuA.
참고: AQuA 라이브러리에 대한 일반적인 사용 연습은 https://drive.google.com/file/d/1a3lhe0dUth-5J1-S2fZlPOCZlPbeuvUr/view 에서 사용할 수 있습니다. AQuA 라이브러리에 대한 자세한 설명서는 https://drive.google.com/file/d/1CckDLbrkw16b7MPlOQdYpZciIz80Snm_/view 에서 확인할 수 있습니다. - MATLAB을 실행한 후 cd 작업을 사용하여 기본 작업 디렉터리 폴더에서 AQuA의 지정된 작업 디렉터리 폴더로 전환합니다.
- 다음과 같이 등록된 4D 이미지를 AQuA 분석 파이프라인에 로드합니다(6.3.1-6.3.2단계).
- AQuA GUI를 시작합니다. MATLAB 명령 창에서 AQuA의 지정된 작업 디렉터리 폴더에 aqua_gui 를 입력합니다.
- AQuA GUI 내에서 새 프로젝트를 클릭하고 분석할 등록된 이미지를 선택합니다. 데이터형 (GCaMPInVivo_cyto_Lck_)과 이미징 파라미터를 지정합니다(시간 해상도 프레임당 초 = 1.993; 픽셀당 공간 해상도 μm = 0.25, 테두리까지의 이 거리보다 짧은 픽셀 제외 = 5). 열기 를 클릭하여 데이터를 로드합니다.
- 관심 영역을 추적하여 후속 분석 파이프라인에 대한 랜드마크를 정의합니다. 일반적으로 랜드마크는 세포체의 세포 경계와 영역을 기반으로 합니다.
- 그런 다음 active signal, super voxel, event detection, clean events 및 merge events 매개변수에 대해 자동화된 분석 파이프라인을 실행하여 후보 Ca2+ 이벤트를 감지합니다.
참고: 이러한 각 매개 변수 및 해당 후보 점수 출력에 대한 자세한 설명은 AQuA 연습에 제공됩니다. 간단히 말해서, 이러한 매개변수는 활성 신호 = 형광 진폭, 슈퍼 복셀 = 3D 공간에서 형광 클러스터링, 이벤트 감지 = 상승/감쇠 역학, 클린 이벤트 = 신호 대 잡음비, 병합 이벤트 = 이벤트의 시간적 분리와 같이 Ca2+ 이벤트 감지 임계값을 조정합니다. - 감지된 Ca2+ 이벤트를 육안으로 검사합니다(원래 등록된 이미지에 자동으로 오버레이됨). 필요한 경우 위의 매개변수 측면에서 이미지 품질을 고려하여 분석 파이프라인의 매개변수 설정을 조정합니다. 주어진 매개변수에 대한 이미지 품질이 양호하면 더 높은 임계값이 설정될 수 있으며 그 반대의 경우도 마찬가지입니다.
- 모든 Ca2+ 이벤트가 적절하게 감지되면 기본 MATLAB 환경 내에서 이러한 이벤트의 특성을 다음과 같이 특성화합니다(6.8-6.14단계).
- AQuA 분석 출력 파일을 내보냅니다.
참고: 출력 파일, Ca2+ 이벤트를 정의하는 데 사용되는 추출된 기능 및 이러한 추출된 기능의 기본 매개 변수에 대한 자세한 설명은 AQuA 설명서에 제공됩니다. - (선택 사항) 모든 Ca2+ 이벤트를 두 그룹으로 분류합니다: 1) 소마에서 시작하는 이벤트와 2) 프로세스에서 시작하는 이벤트.
- AQuA 분석 출력 파일(.mat 파일)의 res.dffMat MATLAB 구조체 내에서 개별 Ca2+ 이벤트의 진폭에 액세스합니다.
- res.fts.loc.x3D MATLAB 연산(AQuA 라이브러리)을 사용하여 개별 Ca2+ 이벤트의 빈도를 도출합니다.
- res.fts.curve.width11 MATLAB 연산(AQuA 라이브러리)을 사용하여 개별 Ca2+ 이벤트의 지속 시간을 도출합니다.
- res.fts.basic.area MATLAB 연산(AQuA 라이브러리)을 사용하여 개별 Ca2+ 이벤트의 면적을 파생합니다.
- 모든 Ca2+ 이벤트를 1) 지역 이벤트, 2) 소마를 향해 이동하는 전파 이벤트, 3) 소마에서 멀어지는 전파 이벤트로 분류합니다. 이렇게 하려면 res.fts.region.landmarkDir.chgToward 및 res.fts.region.landmarkDir.chgAway MATLAB 연산(AQuA 라이브러리)을 사용합니다(그림 3C).
결과
미세아교세포에서 GCaMP6(Ca2+-sensitive 형광 단백질)를 독점적으로 발현하는 형질전환 마우스에서 일반적으로 다양한 미세아교세포 Ca2+ 활성 패턴을 관찰할 수 있습니다(그림 2A). 중요한 것은 단일 미세아교세포 내에서도 Ca2+ 활성의 패턴이 프로세스마다 크게 다를 수 있다는 것입니다.
미세아교세포 Ca2+ 활성의 시공간 역학에서 이러한 프로세스 간 차이를 정량화하려면 먼저 안정적인 영역을 식별한 다음 미세하게 분할된 ROI로 분할해야 합니다(그림 2B, C). 각 ROI에 대해 Ca2+ 활성의 매개변수(예: 진폭 및 주파수)는 형광 강도 시계열에서 국소 진폭 및 트레이스 기울기와 같은 기능을 추출하여 파생되고 정량화되어야 합니다(그림 2D-G).
다음으로, 정확한 정량화 알고리즘 AQuA를 적용하여 개별 Ca2+ 이벤트를 검사해야 합니다(그림 3A). 이러한 이벤트 기반 분석에서는 일반적으로 개별 Ca2+ 이벤트의 원점, 진폭, 지속 시간, 위치 및 흐름 방향 특성에서 큰 차이가 관찰됩니다(그림 3B). 미세아교세포에서 Ca2+ 활동 역학을 분석하는 데 초점을 맞추는 경우, 지역 이벤트, 소마로 이동하는 이벤트 및 소마에서 멀어지는 이벤트의 분류 체계가 유익합니다(그림 3C).
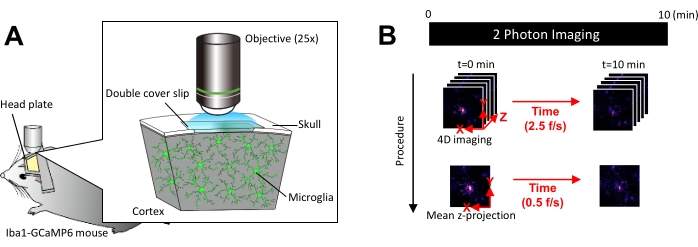
그림 1: in vivo microglial Ca2+ 이미징을 위한 실험 설정. (A) 실험 설정. 미세아교세포 특이적 GCaMP6 발현× Iba1-tTA tetO-GCaMP6 마우스. 마우스의 두개골에 두개골 창을 삽입하면 이광자 현미경을 사용하여 생체 내에서 미세아교세포 Ca2+ 활성을 관찰할 수 있습니다. (B) 실험 일정 및 분석 절차. 4D 이미지는 최소 10분 동안 5프레임 z 스택으로 획득됩니다. 프레임 획득 속도는 2.5 frames/s입니다. 미세아교세포 Ca2+ 활성을 분석하기 전에 5프레임 z-스택은 평균(또는 최대) 강도를 취하여 2D z-투영으로 변환됩니다. z-프로젝션 재생 속도는 0.5 frames/s입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
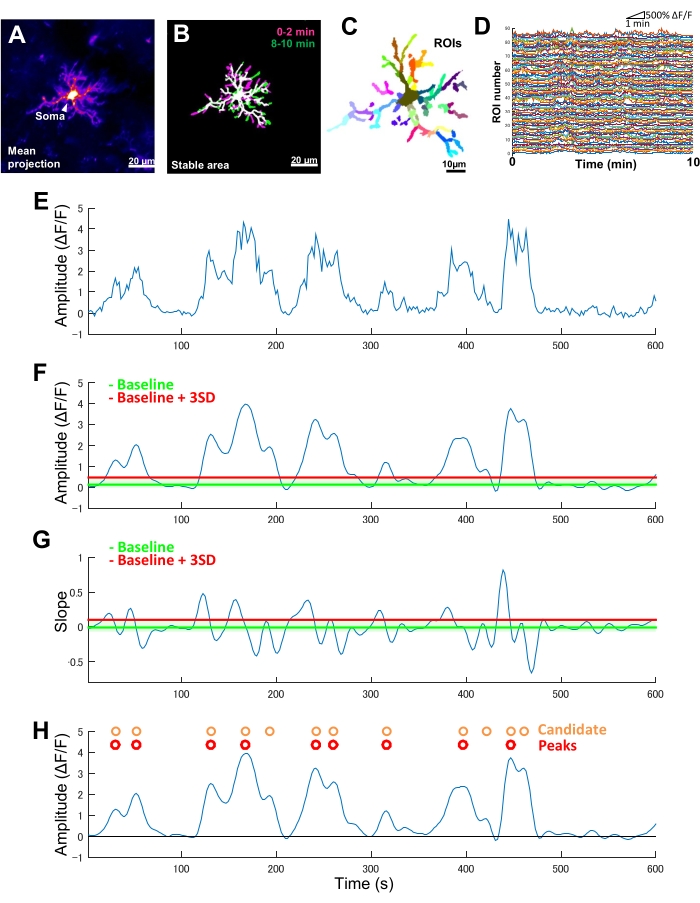
그림 2: 미세아교세포 Ca2+ 활성에 대한 ROI 기반 분석. (A) 개별 미세아교세포에 대해 10분 동안의 평균 GCaMP6 강도 투영. (B) 안정된 영역(흰색)은 이미징 기간의 시작(자홍색)과 끝(녹색)에서 채취한 2분 샘플에서 파생된 이진화된 최대 GCaMP6 강도 t-투영의 오버레이로 정의됩니다. (C) 안정적인 영역은 지역별 ROI로 더 세분화됩니다. 개별 색상은 개별 ROI를 나타냅니다. (D) C에서 모든 개별 ROI의 ΔF/F 추적. ROI 간의 활동 패턴 변동에 주목하십시오. (E) 단일 ROI에 대한 절대 강도 값에서 파생된 ΔF/F 시계열의 원래 추적. (F) 저역 통과 필터링 후 동일한 ΔF/F 시계열. 후보 Ca2+ 이벤트는 baseline + 3개의 SD로 정의된 진폭 차단 임계값(빨간색 선)에 의해 감지됩니다. 기준선(녹색 선)은 ΔF/F 값의 최대 및 최소 10%를 제외하는 상한 및 하한 범위 내에서 전체 ΔF/F 시계열의 중앙값으로 정의됩니다. (G) F에서 필터링된 ΔF/F 시계열에서 파생된 기울기 추적. True Ca2+ 이벤트는 기준선 + 3개의 SD로 정의된 기울기 차단 임계값(빨간색 선)을 기반으로 후보 Ca2+ 이벤트에서 정렬됩니다. 기준선(녹색 선)은 경사 값의 최대 및 최소 10%를 제외한 상한 및 하한 천장 내에서 전체 슬로프 시계열의 평균 값으로 정의됩니다. (H) F의 진폭 기준에 의해 식별된 후보 Ca2+ 이벤트는 주황색으로 표시됩니다. 실제 Ca2+ 이벤트는 후보 Ca2+ 이벤트에서 G의 기울기 기준에 따라 빨간색으로 정렬됩니다. 일부 후보 Ca2+ 이벤트는 기울기 기준에 따라 병합되었습니다. 해당 필터링된 ΔF/F 시계열은 참조를 위해 아래에 오버레이되어 있습니다. 검은색 선은 0 진폭(ΔF/F)을 나타냅니다. 실제 Ca2+ 이벤트의 평균 및 최대 진폭은 필터링된 ΔF/F 시계열에서 해당 피크의 평균 및 최대로 파생됩니다. 빈도(events/min)는 실제 Ca2+ 발사 이벤트의 수를 이미징 기간(10분)으로 나눈 값으로 파생됩니다. 스케일 바 = 20μm(A,B), 10μm(C). 약어: ROI = 관심 영역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
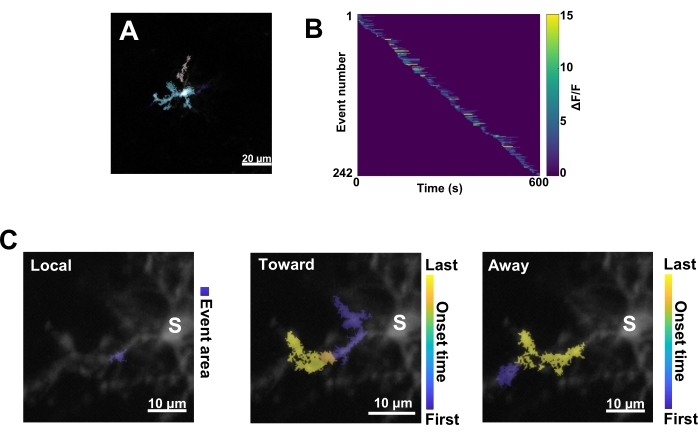
그림 3: 미세아교세포 Ca2+ 활성에 대한 이벤트 기반 분석. (A) AQuA 알고리즘을 사용하여 감지된 이벤트의 대표 이미지. 색상은 하나의 특정 시점에서 감지된 개별 이벤트 영역을 나타냅니다. (B) 발병 순서에 따라 정렬된 개별 이벤트에서 대표 정규화된 Ca2+ 활성(ΔF/F). 오른쪽 막대는 색상으로 표시된 ΔF/F를 나타냅니다. (C) 대표적인 활동 - 소마 또는 로컬 이벤트로 전파되는 이벤트의 발자국. 로컬 이벤트의 경우 이벤트 모양이 파란색으로 표시됩니다. 전파 이벤트의 경우 이벤트 시작 시간은 파란색-노란색 눈금으로 표시됩니다. AQuA는 처음에 Ca2+ 이벤트를 개별적으로 감지하기 때문에 여러 개별 Ca2+ 이벤트의 겹치는 공간 위치 및 시계열을 기반으로 전파 이벤트가 나중에 식별됩니다. 이는 그림 2E-H의 ROI 분석에 사용된 것과 동일한 수지상 분기입니다. 스케일 바 = 20μm(A), 10μm(C). 약어 : ROI = 관심 영역; S = 소마. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 논문은 높은 시공간 해상도로 미세아교세포 Ca2+ 활성을 이미징하기 위한 개선된 접근 방식을 소개합니다. 이 방법은 단일 ramified 프로세스 수준에서 다양한 유형의 미세아교세포 Ca2+ 활성을 감지할 수 있을 만큼 민감하여 국소 및 전파 이벤트를 쉽게 구별할 수 있습니다.
미세아교세포 Ca2+ 활성의 in vivo 이광자 이미징을 위한 일반적인 방법에서는 이미징 품질을 극대화하기 위해 다음 사항에 세심한 주의를 기울여야 합니다. 첫째, 미세아교세포는 부상에 매우 민감하기 때문에 수술 중 수술 도구로 뇌 표면을 직접 만지는 것을 최소화하는 것이 중요합니다. 수술이 능숙하게 수행되었음을 나타내는 주요 징후는 혈관과 경막이 손상되지 않고 수술 중 출혈이 매우 적다는 것입니다. 둘째, 헤드플레이트를 마우스의 두개골에 단단히 부착하고 이중 커버슬립과 뇌 표면 사이의 양호한 접촉은 이미징하는 동안 동작 관련 아티팩트를 크게 줄입니다. 이는 높은 시공간 해상도와 완전히 깨어 있는 마우스에서 이미징할 때 특히 중요합니다. 해석 파이프라인은 심장 박동, 호흡 및 일반적인 드리프트로 인해 발생하는 모션 관련 아티팩트를 안정적으로 보정하지만, 갑작스러운 큰 움직임으로 인해 발생하는 심각한 기하학적 왜곡을 처리할 때는 덜 강력합니다.
여기에 설명된 두 가지 분석 방법은 서로 다른 이점을 제공하며 서로 다른 연구 질문에 적합합니다. ROI 기반 분석에서 사용자는 ROI(예: 개별 프로세스)를 미리 정의하여 이 ROI의 Ca2+ 활동의 집계 역학을 추출할 수 있습니다. 따라서, 현상이 잘 정의된 형태학적 경계와 상대적으로 큰 영역(즉, 프로세스 브랜치)을 모두 가진 하위 세포 영역(subcellular area)에 국한될 것으로 예상되는 상황에 가장 적합합니다. 이벤트 기반 분석에서 개별 이벤트는 미세아교세포 Ca2+ 활동 자체의 시공간 역학을 기반으로 정의되며, 그 기능을 해석하기 위해 미세아교세포 내의 사용자 정의 랜드마크의 컨텍스트에 배치되어야 합니다. 따라서 현상 국소화에 대한 가정을 할 수 없거나 관심 영역이 상대적으로 작은 상황(즉, 프로세스 팁)에 가장 적합합니다. 이와 같이, 이벤트 기반 분석은 이전 방법에 비해 미세아교세포 Ca2+ 활성을 특성화할 때 향상된 시공간 해상도를 제공합니다.
이 마우스에서 미세아교세포에 의해 발현되는 유일한 형광 마커는 Ca2+ 지표 GCaMP6입니다. 따라서 Ca2+ 활성이 낮은 영역에서는 여러 시간 프레임을 결합하여 미세아교세포 형태를 추출해야 하며, 이는 시간적 해상도를 저하시킬 수 있습니다. 그러나 이러한 한계는 미세아교세포에서 별도의 적색 안정 형광 단백질을 발현함으로써 극복할 수 있습니다. 특히, 미세아교세포를 형질주입할 수 있는 새로운 아데노-관련 바이러스가 최근에 기술되었다 23,24,25.
미세아교세포 Ca2+ 활성이 주변 환경에 의해 어떻게 변화되는지가 새로운 관심 주제입니다. 특히, 미세아교세포 Ca2+ 활성은 뉴런 활동과 유의한 상관관계를 보이는 것으로 보이지만, 이것의 기능적 중요성은 아직 완전히 규명되지 않았습니다. 따라서 여기에 제시된 미세아교세포 Ca2+ 활성에 대한 이미징 및 분석 방법과 뉴런 활성 조작을 결합하면 미세아교세포의 생리학에 대한 새로운 통찰력을 얻을 수 있으며 미세아교세포가 생리학적 및 병리학적 상태에서 수행하는 역할에 대한 이해를 더욱 발전시킬 수 있습니다.
공개
저자는 이 원고와 관련된 이해 상충이 없음을 선언합니다.
감사의 말
Iba1-tTA 마우스와 tetO-GCaMP6 마우스를 제공해 주신 Kenji Tanaka 교수님(일본 도쿄 게이오 대학교)께 감사드립니다. 이 작업은 Grants-in-Aid for Young Scientists (B) [16K19001 (to H.H.)], Grants-in-Aid for Early-Career Scientists [18K14825 (to H.H.)], Grant-in-Aid for Scientific Research Research (B) [21H03027 (to H.H.)], Grant-in-Aid for Transformative Research Areas (A) [21H05639 (to H.H.)], Grant-in-Aid for Scientific Research (A) [17H01530, 20H00500 (to J.N.)], and JST CREST Grant [JPMJCR1755 (to J.N.)], 일본.
자료
| Name | Company | Catalog Number | Comments |
| 2% xylocaine jelly | AstraZeneca, UK | ||
| B6(129S6)-Tg(Aif1-tTA)54Kftnk | RIKEN RBC, Japan | RBRC05769 | Iba1-tTA mice |
| B6;129-Actb(tm3.1(tetO-GCaMP6)Kftnk) | RIKEN RBC, Japan | RBRC09552 | tetO-GCaMP6 mice |
| Forceps | Fine science tools, US | 13008-12 | |
| G-CEM ONE | GC corporation, Japan | ||
| Glass capillary | Narishige, Japan | GDC-1 | |
| ImageJ | NIH, US | ||
| Isofulrane | Pfizer, US | ||
| Ketamin | Daiichi-Sankyo, Japan | ||
| Kwik-sil | World Precision Instruments, US | KWIK-SIL | |
| MATLAB, 2020a | MathWorks, US | ||
| Micro cover glass (2 x 2 mm, No.3) | Matsunami, Japan | custum-made | Bottom glass for cranial window |
| Micro cover glass (3 x 3 mm, No.0) | Matsunami, Japan | custum-made | Upper glass for cranial window |
| N25X-APO-MP | Nikon, Japan | N25X-APO-MP | Objective lens (25x) |
| Norland optical adhesive | Edmund optics, US | 6101 | |
| Piezo nano-positioning system, Nano-Drive | Mao City Labs, US | ||
| Razor blade | Feather, Japan | FA-10 | |
| Scissors | Fine science tools, US | 14060-11 | |
| Steel drill | Minitor, Japan | BS1201 | |
| Stereotaxic instruments | Narishige, Japan | SR-5M-HT | |
| Super-bond (C&B kit) | Sun Medical, Japan | 4560227797382 | |
| Surgical needle hook | Fine science tools, US | 10065-15 | |
| Ti:Sappire laser, MaiTai DeepSee | Spectra Physics, US | Mai Tai eHP DS | |
| Tweezers | Fine science tools, US | 11051-10 | |
| Tweezers | Fine science tools, US | 11255-20 | |
| Two-photon microscope | Nikon, Japan | A1R-MP | |
| UV craft resin | Kiyohara, Japan | UVR | |
| Xylazine | Bayer, Germany |
참고문헌
- Miyamoto, A., et al. Microglia contact induces synapse formation in developing somatosensory cortex. Nature Communications. 7, 12540 (2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent. Neuron. 74 (4), 691-705 (2012).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Cserep, C., et al. Microglia monitor and protect neuronal function through specialized somatic purinergic junctions. Science. 367 (6477), 528-537 (2020).
- Kato, G., et al. Microglial contact prevents excess depolarization and rescues neurons from excitotoxicity. eNeuro. 3 (3), (2016).
- Li, Y., Du, X. -. F., Liu, C. -. S., Wen, Z. -. L., Du, J. -. L. Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo. Developmental Cell. 23 (6), 1189-1202 (2012).
- Tremblay, M. -. E., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. Plos Biology. 8 (11), 1000527 (2010).
- Wake, H., Moorhouse, A. J., Jinno, S., Kohsaka, S., Nabekura, J. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. The Journal of Neuroscience. 29 (13), 3974-3980 (2009).
- Oppenheim, R. W. Cell death during development of the nervous system. Annual Review of Neuroscience. 14 (1), 453-501 (1991).
- Sierra, A., Abiega, O., Shahraz, A., Neumann, H. Janus-faced microglia: beneficial and detrimental consequences of microglial phagocytosis. Frontiers in Cellular Neuroscience. 7, 6 (2013).
- Brawek, B., et al. A new approach for ratiometric in vivo calcium imaging of microglia. Scientific Reports. 7 (1), 6030 (2017).
- Eichhoff, G., Brawek, B., Garaschuk, O. Microglial calcium signal acts as a rapid sensor of single neuron damage in vivo. Biochimica et Biophysica Acta. 1813 (5), 1014-1024 (2011).
- Liu, L., et al. Microglial calcium waves during the hyperacute phase of ischemic stroke. Stroke. 52 (1), 274-283 (2021).
- Pozner, A., et al. Intracellular calcium dynamics in cortical microglia responding to focal laser injury in the PC::G5-tdT reporter mouse. Frontiers in Molecular Neuroscience. 8, 12 (2015).
- Umpierre, A. D., et al. Microglial calcium signaling is attuned to neuronal activity in awake mice. Elife. 9, e56502 (2020).
- Ohkura, M., et al. Genetically encoded green fluorescent Ca2+ indicators with improved detectability for neuronal Ca2+ signals. Plos One. 7 (12), e51286 (2012).
- Tanaka, K. F., et al. Expanding the repertoire of optogenetically targeted cells with an enhanced gene expression system. Cell Reports. 2 (2), 397-406 (2012).
- Liu, Y. U., et al. Neuronal network activity controls microglial process surveillance in awake mice via norepinephrine signaling. Nature Neuroscience. 22 (11), 1771-1781 (2019).
- Stowell, R. D., et al. Noradrenergic signaling in the wakeful state inhibits microglial surveillance and synaptic plasticity in the mouse visual cortex. Nature Neuroscience. 22 (11), 1782-1792 (2019).
- Sun, W. L., et al. In vivo two-photon imaging of anesthesia-specific alterations in microglial surveillance and photodamage-directed motility in mouse cortex. Frontiers in Neuroscience. 13, 421 (2019).
- Evangelidis, G. D., Psarakis, E. Z. Parametric image alignment using enhanced correlation coefficient maximization. IEEE Transactions on Pattern Analysis and Machine Intelligence. 30 (10), 1858-1865 (2008).
- Rosario, A. M., et al. Microglia-specific targeting by novel capsid-modified AAV6 vectors. Molecular Therapy. Methods & Clinical Development. 3, 16026 (2016).
- Maes, M. E., Wogenstein, G. M., Colombo, G., Casado-Polanco, R., Siegert, S. Optimizing AAV2/6 microglial targeting identified enhanced efficiency in the photoreceptor degenerative environment. Molecular Therapy. Methods & Clinical Development. 23, 210-224 (2021).
- Lin, R., et al. Directed evolution of adeno-associated virus for efficient gene delivery to microglia. Nature Methods. 19 (8), 976-985 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유