A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فك رموز الآلية الجزيئية ووظيفة السموم المكونة للمسام باستخدام الليشمانيا الكبرى
In This Article
Summary
يظهر هنا بروتوكول يستخدم promastigotes الليشمانيا الرئيسية لتحديد الارتباط ، والسمية الخلوية ، والإشارات التي تسببها السموم المكونة للمسام. يتم توفير إثبات المفهوم مع ستربتوليسين O. يمكن أيضا استخدام السموم الأخرى للاستفادة من الطفرات الجينية المتاحة في L. major لتحديد آليات جديدة لمقاومة السموم.
Abstract
يعد فهم وظيفة وآلية السموم المكونة للمسام (PFTs) أمرا صعبا لأن الخلايا تقاوم تلف الغشاء الناجم عن PFTs. في حين أن النهج الفيزيائية الحيوية تساعد على فهم تكوين المسام ، فإنها غالبا ما تعتمد على الأساليب الاختزالية التي تفتقر إلى المجموعة الكاملة من الدهون الغشائية والبروتينات. توفر الخلايا البشرية المستزرعة نظاما بديلا ، لكن تعقيدها وتكرارها في آليات الإصلاح يجعل تحديد آليات معينة أمرا صعبا. في المقابل ، فإن العامل الممرض البشري الأولي المسؤول عن داء الليشمانيات الجلدي ، الليشمانيا الكبرى ، يوفر توازنا مثاليا بين التعقيد والأهمية الفسيولوجية. L. major قابل للتتبع وراثيا ويمكن استزراعه بكثافة عالية في المختبر ، ويمكن قياس أي تأثير للاضطرابات على العدوى في نماذج الفئران الراسخة. بالإضافة إلى ذلك ، يقوم L. major بتوليف الدهون المتميزة عن نظيراتها في الثدييات ، والتي يمكن أن تغير ديناميكيات الغشاء. يمكن التحقيق في هذه التغييرات في ديناميكيات الغشاء باستخدام PFTs من عائلة السموم الأفضل تميزا ، وهي السيتوليسينات المعتمدة على الكوليسترول (CDCs). ترتبط CDCs بالإرغوستيرول في غشاء الليشمانيا ويمكن أن تقتل L. promastigotes الرئيسية ، مما يشير إلى أن L. major هو نظام نموذجي مناسب لتحديد الآليات الخلوية والجزيئية لوظيفة PFT. يصف هذا العمل طرق اختبار وظيفة PFT في L. promastigotes الرئيسية ، بما في ذلك زراعة الطفيليات ، والأدوات الوراثية لتقييم حساسية الدهون ، ومقايسات ربط الغشاء ، ومقايسات موت الخلايا. ستمكن هذه المقايسات من الاستخدام السريع ل L. major كنظام نموذجي قوي لفهم وظيفة PFT عبر مجموعة من الكائنات الحية المتنوعة تطوريا والقواسم المشتركة في تنظيم الدهون.
Introduction
السموم المكونة للمسام (PFTs) هي أكبر عائلة من السموم البكتيرية1 ، ولكن الآليات التي تثقب بها الخلايا وتدمرها غير مفهومة بشكل جيد. أفضل عائلة من السموم المكونة للمسام التي تمت دراستها هي عائلة السيتوليسين المعتمدة على الكوليسترول (CDCs). يتم تصنيع CDCs في المقام الأول عن طريق البكتيريا إيجابية الجرام ، بما في ذلك العامل المسبب لالتهاب اللفافة الناخر ، العقدية المقيحة2. تفرز S. pyogenes CDC streptolysin O (SLO) ، الذي يرتبط بالستيرول في غشاء البلازما للخلايا المضيفة كمونومرات ، oligomerizes ، ويدخل ~ 20-30 نانومتر المسام في الغشاء1. لا يزال الدور الذي تلعبه الليبيدات في هذه العملية غير محدد بشكل جيد.
تتمثل إحدى طرق دراسة تفاعلات الدهون و CDC في استخدام الجسيمات الشحمية المحددة كيميائيا. في حين أن الجسيمات الشحمية المحددة توفر معلومات عن العتبات الضرورية للدهون للحفاظ على ربط السموم وتكوين المسام 3,4 ، إلا أنها لا تلخص الوظائف الخلوية بالكامل. على سبيل المثال ، تفتقر الجسيمات الشحمية المعاد تشكيلها إلى عدم تناسق الدهون في مضيفات الثدييات وتعديلات الدهون استجابة للسموم5. أحد بدائل الجسيمات الشحمية هو استخدام خطوط خلايا الثدييات. في حين أن خطوط الخلايا هذه أكثر صلة من الناحية الفسيولوجية ، إلا أن هناك درجة كبيرة من التكرار في آليات استشعار السموم والمقاومة2. نتيجة لذلك ، لا تزال مسارات الإصلاح المستخدمة لمقاومة CDCs غير محددة بشكل جيد. والجدير بالذكر أن تدفق Ca2+ هو المنشط الأساسي لإصلاح الغشاء1. في اتجاه مجرى تدفق Ca2+ ، يتم تشغيل مسارات متعددة ، بما في ذلك الإصلاح المعتمد على السيراميد 6,7 ومسار الإصلاح المعتمد على MEK6. تتفاعل هذه المسارات مع مستجيبات البروتين الأخرى ، بما في ذلك مجمع الفرز الاندوسومي المطلوب للنقل (ESCRT)8 ، والمرفقات6،9،10. يمثل تشريح هذه المسارات في خلايا الثدييات تحديا بسبب التكرار ، مما يؤدي إلى تشويش تفسير البيانات.
تتمثل إحدى طرق تحقيق التوازن بين التعقيد والبساطة لتشريح مسارات الإصلاح في استخدام كائنات أبسط ، مثل مسببات الأمراض الأولية في جنس الليشمانيا. الليشمانيا sp. تسبب داء الليشمانيات في البشر والحيوانات الأخرى. يتراوح داء الليشمانيات من داء الليشمانيات الجلدي (آفات جلدية محدودة ذاتيا) إلى داء الليشمانيات الحشوي المميت (تضخم الكبد والطحال) ، اعتمادا على الأنواع وعوامل أخرى11. ينتقل الليشمانيا الكبرى ، العامل المسبب لداء الليشمانيات الجلدي ، إلى البشر عبر ناقل ذبابة الرمل ويستخدم لفهم وظيفة الليشمانيا والعدوى12. بالإضافة إلى ذلك ، الليشمانيا sp. هي digenic12. وهي موجودة كطفيليات بلاعم داخل الخلايا تسمى amastigotes وكبرومستيغوت سوطية حرة السباحة في ذبابة الرمل12. يمكن استزراع L. promastigotes الرئيسية في وسائط مكملة بالمصل مثل M199 إلى كثافة عالية13. Promastigotes هي أيضا قابلة للتتبع وراثيا. توجد العديد من الضربات القاضية الجينية ، بما في ذلك تلك التي تستهدف مسارات التخليق الحيوي للدهون13. يمكن تقييم هذه الضربات القاضية للنمو والاختلافات في العدوى وتطور الآفة عن طريق إصابة الفئران Balb / c13.
بالإضافة إلى السهولة النسبية لثقافة الليشمانيا ومجموعة الضربات القاضية للتخليق الحيوي للدهون ، فإن الطفيلي لديه جينوم أبسط من الثدييات. أفضل أنواع الليشمانيا تميزا هي L. Major ، التي تحتوي على العديد من الأدوات الوراثية الموجودة ، مثل الطفرات ذات التمثيل الغذائي الدهني المعيب14. والجدير بالذكر أن العديد من بروتينات الإصلاح غائبة. لا يوجد لدى L. major أي متجانسات تم تحديدها حتى الآن لبروتينات إصلاح الثدييات الرئيسية مثل المرفقات. وهذا يتيح توصيف مسارات الإصلاح المحفوظة تطوريا دون تعقيد أنظمة الثدييات. ومع ذلك ، لم يتم وصف مسارات الإصلاح في الليشمانيا حتى الآن. في الوقت نفسه ، يتم حفظ مسارات الإشارات الرئيسية المشاركة في الإصلاح ، مثل مسار MEK6 ، في Leishmania sp.15,16 ، على الرغم من الحاجة إلى التحقق من صحة المتماثلات. تمت دراسة مسار بروتين كيناز المنشط بالميتوجين (MAPK) جيدا في L. mexicana ، حيث يساهم في البقاء داخل الخلايا والاستقرار الحراري في خلايا الثدييات ويتحكم في تكوين الميتاسيكسيكوجينيسيس16. في Leishmania sp. ، تم وصف 10 من 15 MAPKs17. من المتوقع أن يكون LmMAPK9 و LmMAPK13 الأكثر تشابها مع ERK1 / 2 للثدييات بناء على الهوية في تسلسل شفة الفسفرة المحفوظ. تسلسل شفة الفسفرة هو TEY لكل من الثدييات ERK1 / 2 و LmMAPK9 و LmMAPK13. ومع ذلك ، فإن ثمانية من خرائط الليشمانيا لها شكل فسفرة TDY15. تم تحديد اثنين على الأقل من متجانسات مجاهدي خلق في الليشمانيا sp. ، LmxMKK18 و MEKK ذات الصلة كيناز (MRK1) 19. هذا يشير إلى أن الأفكار المحددة في الليشمانيا يمكن أن تترجم إلى أنظمة الثدييات. وحيثما لا تترجم إلى نظم الثدييات، فإنها تمثل أهدافا علاجية لعلاج داء الليشمانيات.
من أجل استخدام L. promastigotes الرئيسية لدراسة إصلاح الغشاء والتفاعلات مع السموم ، هناك حاجة إلى تقنيات متوسطة الإنتاجية. في حين أن التصوير بالخلايا الحية عالي الدقة يتيح تصور البروتينات والأغشية المصنفة في الوقت الفعلي ، إلا أنه منخفض الإنتاجية وقد لا يقيس البقاء الخلوي. تشمل فحوصات قابلية الإنتاجية المتوسطة امتصاص الصبغة المقاس بقياس التدفق الخلوي ، أو قياس نشاط الميتوكوندريا ، أو إطلاق البروتينات الخلوية مثل نازعة هيدروجين اللاكتات (LDH). في خلايا الثدييات ، لا تقيس فحوصات LDH كميا موت الخلايا20. علاوة على ذلك ، فإن المقايسات القائمة على السكان مثل إطلاق LDH أو نشاط الميتوكوندريا لا تسمح بتحليل قوي أحادي الخلية أو متعدد المعلمات20. في المقابل ، تتيح المقايسات القائمة على قياس التدفق الخلوي تحليل خلية واحدة متعددة المعلمات20. ومع ذلك ، لم يتم تطبيق هذه المقايسات لفهم بيولوجيا السموم أو الاستجابات للسموم في L. promastigotes الرئيسية.
في هذه الدراسة ، تم استخدام SLO كأداة لفهم اضطراب غشاء البلازما للمتحولة الخالية من sphingolipid ل L. major في اثنين من المخازن المؤقتة المختلفة - وسائط M199 المستخدمة بشكل روتيني لاستزراع L. promastigotes الرئيسية وأبسط Tyrode's buffer. يتم وصف مقايسة قياس التدفق الخلوي متوسط الإنتاجية واستخدامها لتوليد منحنيات الاستجابة للجرعة السمية. يتم نمذجة البيانات من مقايسة قياس التدفق الخلوي إلى منحنى لوجستي لتحديد قيم LC50. باستخدام هذه المعلومات ، يمكن تحديد جرعة فرعية من SLO بحيث يمكن التحقق من صحة الأجسام المضادة MAPK باستخدام النشاف الغربي.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم استخدام جميع الإرشادات المناسبة والممارسات الميكروبيولوجية والسلامة وزراعة الخلايا القياسية لاستخدام ومعالجة الحمض النووي الرئيسي والمأشوب RG2 Leishmania . تم إجراء جميع التجارب مع L. major الحية في خزانة السلامة البيولوجية في مختبر معتمد من BSL-2. وأشرفت على العمل لجنة السلامة الأحيائية المؤسسية بجامعة تكساس للتكنولوجيا.
ملاحظة: من منظور السلامة ، فإن L. promastigotes الرئيسية الحية هي مسببات الأمراض من مجموعة المخاطر 2 . التعامل مع استخدام الاحتواء المناسب والاحتياطات والإشراف من اللجنة المؤسسية للسلامة الأحيائية (IBC). التعامل مع المواد السامة والمواد الكيميائية وفقا للإجراءات المؤسسية للمواد السامة. إذا تم استخدام السموم المؤتلفة ، فقد تكون هناك حاجة إلى موافقة IBC والإشراف عليها لعمل الحمض النووي المؤتلف.
1. زراعة وإعداد L. promastigotes الرئيسية
- الحصول على ، أو صنع والتحقق من صحة ، L. الطفرات الجينية الرئيسية كما هو موضح سابقا باستخدام إما إعادة التركيب المتماثل أو الطرق القائمة على كريسبر13،21. استخدم الضربة القاضية المكملة بالجين المضاف مرة أخرى على البلازميد لضمان خصوصية الضربة القاضية.
- الاستزراع البري من النوع L. major و spt2- promastigotes عند 27 درجة مئوية في وسط M199 الكامل. استزرع الخلايا الإضافية العرضية (spt2- / + SPT2) في M199 الكامل بالإضافة إلى 10 ميكروغرام / مل G418 (انظر الجدول 1 وجدول المواد).
ملاحظة: يجب إجراء الإعداد التجريبي بأكمله الذي يتضمن تجارب على الخلايا الرئيسية L . في خزانة السلامة البيولوجية المعتمدة من BSL2. - قم بزراعة promastigotes في وسط M199 الكامل22 حتى تصل إلى مرحلة اللوغاريتم (2-8 × 106 خلايا / مل) ، على النحو الذي تحدده L. مقايسات منحنى النمو الرئيسية التي تم إجراؤها سابقا23. خطط 1 × 10 5 خلايا لكل بئر للسمية الخلوية ، بالإضافة إلى 5 × 105 خلايا للتحكم في التلطيخ. بالنسبة للوصمة الغربية ، خطط 2 × 107 خلايا لكل بئر.
ملاحظة: إجراء فحص السمية الخلوية مع اثنين من النسخ المتماثلة التقنية. - للتحقق من كثافة الخلية المناسبة ، امزج القسمة (10-40 ميكرولتر) من promastigotes مع حجم متساو من المثبت (3.7 ٪ بارافورمالدهيد في 1x PBS). قم بتحميل 10 ميكرولتر من العينة الثابتة على كل جانب من مقياس الدم.
تنبيه: الفورمالديهايد مادة كيميائية سامة. التعامل وفقا للسياسات المؤسسية للمواد الكيميائية الخطرة. - قم بإجراء عد الخلايا باستخدام المجهر عند تكبير 20x. عد جميع الخلايا الموجودة في المربعات الصغيرة ال 25 في وسط مقياس الدم. كرر للمربعات على كلا الجانبين ومتوسط العد.
ملاحظة: إذا كان التباين بين الأعداد >10، فقم بإعادة العد والمتوسط. إذا كان متوسط العدد <10 أو >100 ، فقم بتغيير التخفيف وإعادة الفرز ، ثم احسب كثافة الثقافة باستخدام الصيغة التالية: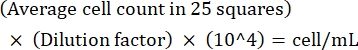 (مكافئ 1)
(مكافئ 1)
على سبيل المثال ، إذا كان هناك في المتوسط 250 ليشمانيا في 25 مربعا ، فإن كثافة الثقافة هي 5 × 106 خلايا / مل. - بعد العد, انقل 5 × 106 خلايا إلى أنبوب مخروطي سعة 15 مل وأجهزة طرد مركزي بسرعة 1,500 × جم لمدة 8 دقائق في درجة حرارة الغرفة لتكوير الخلايا.
- تخلص من المادة الطافية باستخدام ماصة سعة 10 مل وقم بتدوير حبيبات الخلية لفترة وجيزة. أضف 5 مل من 1x PBS إلى نفس الأنبوب واغسل الخلايا عن طريق قلب 3-6x برفق. جهاز طرد مركزي بسرعة 1500 × جم لمدة 8 دقائق في درجة حرارة الغرفة لتكوير الخلايا.
- تخلص من المادة الطافية باستخدام ماصة سعة 10 مل وأعد تعليق الحبيبات 5 × 10 6 خلايا في 5 مل من الوسط (على سبيل المثال ، M199 أو 1x Tyrode's buffer) المستخدمة في التجارب باستخدام ماصة 5 مل لإعطاء تركيز نهائي قدره 1 × 106 خلايا / مل.
2. مقايسة السمية الخلوية
- التحضير التجريبي
- تنقية السم كما هو موضح سابقا24 ، أو شراء السم من بائع. القسمة في القسمة ذات الاستخدام الواحد وتخزينها −80 درجة مئوية لمدة تصل إلى 1 سنة. تجنب دورات التجميد والذوبان المتعددة.
- تحديد النشاط الانحلالي لكل سم باستخدام خلايا الدم الحمراء البشرية (انظر جدول المواد)24.
ملاحظة: يستخدم النشاط الانحلالي لأنه يتحكم في الاختلافات في النشاط بسبب التنقية والطفرات وما إلى ذلك. قد يؤدي اختيار الأنواع من كريات الدم الحمراء إلى تغيير النشاط الانحلالي (على سبيل المثال ، يتطلب intermedilysin خلايا الدم الحمراء البشرية). - خطط لتكرارين تقنيين لكل حالة ، وسبعة تخفيفات لمنحنى الاستجابة للجرعة ، والتحكم في عدم السموم.
ملاحظة: مع promastigotes من النوع البري (WT) و spt2- و spt2 - / + SPT2 ، يمكن اختبار علاجين في لوحة واحدة ذات قاع V 96 بئرا. على سبيل المثال ، يمكن مقارنة الحساسية للوسائط (الشكل 1). بدلا من لوحة القاع V ، يمكن استخدام أنابيب microtiter سعة 1.2 مل (انظر جدول المواد). نظرا لأوقات الاستحواذ على مقياس الخلايا ، لا ينصح بتشغيل أكثر من لوحة واحدة في وقت واحد. - حدد المخزن المؤقت للمقايسة الذي يجب استخدامه بناء على ظروف الاختبار المطلوبة والغرض من التجربة.
ملاحظة: في هذا المثال ، تتم مقارنة اثنين من مخازن الفحص المؤقتة: M199 ومخزن Tyrode المكمل بيوديد صبغة الجدوى (PI). سوف يتداخل الكوليسترول في المصل مع نشاط CDC24. - احسب كمية السم اللازمة بناء على ظروف وعدد الأنماط الجينية المعالجة. تأكد من حدوث تحلل محدد بنسبة 50٪ في منتصف الطريق أسفل منحنى التخفيف.
ملاحظة: بالنسبة لمراكز السيطرة على الأمراض ، سيعطي التخفيف التسلسلي ذو الشقين نطاقا جيدا للنمذجة اللوجستية اللاحقة. بالنسبة ل spt2- promastigotes ، فإن 4000 HU / mL SLO هو تخفيف البدء الموصى به. عند استخدام السموم غير النشطة ، يمكن استخدام كتلة مكافئة لأعلى جرعة بدلا من ذلك. - خطط لحجم نهائي 200 ميكرولتر لكل بئر ، وأضف حجما صغيرا إضافيا (50-100 ميكرولتر) لحساب خطأ الماصة.
ملاحظة: مع ثلاثة أنماط جينية ، كل منها في نسختين ، سيكون هناك ست عينات للتخفيف التسلسلي. - حدد الكمية الإجمالية للسم المطلوب باستخدام الصيغة التالية:
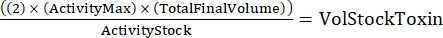 (مكافئ 2)
(مكافئ 2)
حيث يكون ActivityMax هو أعلى تركيز مستخدم (HU / mL) ؛ TotalFinalVolume هو الحجم الإجمالي (لست عينات ، 200 × 6 + 100 = 1300 ميكرولتر) ؛ ActivityStock هو نشاط مخزون السموم (HU / mL) ؛ و VolStockToxin هو حجم مخزون السم المطلوب. - قم بإعداد مخزن مؤقت كاف للمقايسة اللازمة للتجربة. استكمل الوسط القاعدي بصبغة صلاحية وأي Ca 2+ أو EGTA اللازمة للتحكم في مستويات Ca2+. دوامة لخلط.
ملاحظة: على سبيل المثال ، لكل 10 مل من المخزن المؤقت ل Tyrode ، أضف 50 ميكرولتر من 2 مجم / مل PI و 200 ميكرولتر من 100 mM CaCl 2 ، مما يعطي تركيزات نهائية تبلغ 10 ميكروغرام / مل و2 مللي مول ، على التوالي. - تأكد من أن صبغة الجدوى PI لا تتعارض مع أي مجسات أخرى مستخدمة ، مثل مقايسات الربط الفلورية باستخدام السموم المترافقةCy5 أو AlexaFluor647 20,25.
- خطط لتخفيف السموم لعمل محلول 2x من السم. أضف مخزن الفحص المؤقت إلى أنابيب الطرد المركزي سعة 1.5 مل وقم بالتبريد على الجليد. أضف السم فقط مباشرة قبل بدء الفحص.
ملاحظة: في هذا المثال ، ستتم إضافة 1.3 مل من المخزن المؤقت للفحص للتخفيف العلوي ، وسيتم إضافة 650 ميكرولتر للتخفيفات التسلسلية لإعداد محلول السم 2x.
- التجربه
- احتفظ ب 0.5 مل من البرومستيغوت المعالج من الخطوة 1.8 في أنبوب منفصل ك "تحكم غير ملوث".
ملاحظة: سيتم استخدام هذه العينة لإعداد بوابة على مقياس التدفق الخلوي. - أضف 2 ملغم / مل PI إلى تركيز نهائي قدره 10 ميكروغرام / مل إلى promastigotes المتبقية. دوامة لمدة 3 ثوان.
ملاحظة: بعد إضافة PI إلى promastigotes المعالجة ، لا يمكن استخدام هذه الخلايا إلا لفترة زمنية تبلغ 2.5 ساعة. بعد 2.5 ساعة ، تبدأ الخلايا في الموت ، وتصبح النتائج خاطئة. - أضف 1 × 105 (في 100 ميكرولتر / بئر) promastigotes المعالجة إلى كل بئر من لوحة V-bottom 96 بئر أو أنابيب microtiter 1.2 مل (الشكل 1). ضع اللوحة أو رف الأنبوب على الجليد بزاوية 45 درجة تقريبا من المشاهدة. أداء العمل في خزانة السلامة الحيوية عند التعامل مع الليشمانيا promastigotes.
- أضف 100 ميكرولتر من المخزن المؤقت للفحص مع PI إلى كل عنصر تحكم خال من السموم (الصف الأخير). تحقق من إضافة عنصر التحكم بشكل صحيح عن طريق تحديد الأنابيب بصريا بحجم إجمالي 200 ميكرولتر والتي تظهر أغمق في اللون.
- قم بإزالة القسمة السامة من -80 درجة مئوية ، وقم بإذابة الثلج على الثلج ، وتجمع حسب الحاجة. أضف حجم السم المحسوب في الخطوة 2.1.5 إلى أعلى تخفيف (معد في الخطوة 2.1.10). ثم ، تمييع السم بشكل متسلسل (الشكل 1). ماصة لأعلى ولأسفل 8x على الأقل لضمان الخلط.
ملاحظة: قم بالأداء على الجليد لأن CDCs يتم تعطيلها بسرعة في درجة حرارة الغرفة. - بدءا من أدنى تركيز للسموم ، أضف بسرعة 100 ميكرولتر من السم إلى الصف الصحيح (الشكل 1 والشكل 2) واستمر حتى تتم إضافة كل السم إلى الخلايا.
- ختم اللوحة بشريط مانع للتسرب. احتضان عند 37 درجة مئوية لمدة 30 دقيقة. بعد فترة الحضانة ، قم بتعبئة اللوحة ونقلها إلى مقياس التدفق الخلوي.
- احتفظ ب 0.5 مل من البرومستيغوت المعالج من الخطوة 1.8 في أنبوب منفصل ك "تحكم غير ملوث".
- الحصول على البيانات
- قم بإعداد مقياس التدفق الخلوي (انظر جدول المواد) وبرنامج الاستحواذ وفقا لتعليمات الشركة المصنعة وسياسة كل منشأة. لا تقم بإجراء قياس التدفق الخلوي دون تدريب مسبق على مقياس الخلايا.
ملاحظة: في هذا المثال، تم استخدام 4 ليزر Attune NxT. تم جمع PI على قناة YL-1 (متحمس بواسطة ليزر 561 نانومتر ، ويمر عبر 577 LP ، وينعكس من 600 DLP ، ويتم تصفيته من خلال تمرير النطاق 585/16) ، على الرغم من أن الطيف الواسع من PI يسمح بالتجميع على قنوات أخرى. - باستخدام عينة L. major promastigote غير الملوثة ، اضبط بوابات التشتت الأمامي والجانبي والمعلمات الفلورية الأولية بناء على الأصباغ المختارة.
- قم بتضمين معلمة إضافية واحدة إذا رغبت في ذلك للمخططات النقطية للتحقق من التألق الذاتي (على سبيل المثال ، "بدون بقعة") (الشكل 3).
ملاحظة: في هذا المثال ، تم استخدام قناة BL-1 (متحمسة بواسطة ليزر 488 نانومتر ، مرت عبر 495 DLP و 503 LP ، تنعكس من 555 DLP ، وتمت تصفيتها عبر تمرير النطاق 530/30). - باستخدام أدوات تحكم مفردة ملطخة ، اضبط بوابات صبغة الصلاحية (PI في هذه الدراسة) وأي سموم تحمل علامة الفلورسنت. مراقبة التشتت الأمامي مقابل الوقت للسدادات الدقيقة.
ملاحظة: سيقوم PI بتلطيخ جميع الخلايا الموجودة فوق عناصر التحكم غير الملوثة بشكل خافت. ستكون الخلايا الميتة قابلة للفصل بسهولة ، مع وجود خلايا نفاذية عابرة بين السكان. - الحصول على >10000 حدث مسور لكل عينة على مقياس الخلايا.
ملاحظة: يوصى بالقراءة من الأكثر حساسية إلى الأقل حساسية ، ولكن يمكن عكس ترتيب الاكتساب لتحديد أي تأثير لترتيب القراءة على نتائج العينة. - احفظ البيانات وقم بتصديرها حسب الحاجة للتحليل.
- قم بإعداد مقياس التدفق الخلوي (انظر جدول المواد) وبرنامج الاستحواذ وفقا لتعليمات الشركة المصنعة وسياسة كل منشأة. لا تقم بإجراء قياس التدفق الخلوي دون تدريب مسبق على مقياس الخلايا.
- تحليل البيانات
ملاحظة: في هذه الدراسة ، Excel مع المكون الإضافي Solver (راجع جدول المواد) لتحليل البيانات (انظر الملف التكميلي 1).- بوابة المجموع ، خلية واحدة L. promastigotes الرئيسية عن طريق بوابة على تشتت الأمامي والجانبي والوقت حسب الحاجة (الشكل 3). استخدم الارتفاع أو المساحة على النحو الموصى به لمقياس التدفق الخلوي.
ملاحظة: بالنسبة لمقياس التدفق الخلوي المستخدم هنا ، فإن الارتفاع هو المعلمة الموصى بها بدلا من المساحة. - تحديد وبوابة الخلايا الميتة على أنها "PI عالية". بوابة الخلايا الوسيطة ك "PI منخفضة". الخلايا العالية PI هي خلايا ميتة ، بينما يتم اختراق خلايا PI المنخفضة بشكل عابر26.
ملاحظة: تظهر الخلايا العالية PI عادة إزاحة لوغاريتم 2-3 من الخلايا السالبة. - تصدير البيانات إلى Excel. احصل على اسم / معرف العينة و ٪PI عالية لتحديد القتل.
ملاحظة: إذا تم استخدام السموم الفلورية ، فستكون هناك حاجة إلى متوسط كثافة الفلورسنت (MFI) للسكان الأحياء ، والنفاذية العابرة ، والسالبة. ٪ PI منخفضة يمكن تصديرها للنفاذية العابرة. - حدد متوسط ٪PI مرتفع لكل شرط بين المكررين الفنيين.
ملاحظة: إذا كانت هناك حاجة إلى متوسط MFI للسموم الفلورية ، فاحسب هذا أيضا. - احسب النسبة المئوية للتحلل النوعي من النسبة المئوية ل PI باستخدام الصيغة التالية24,25:
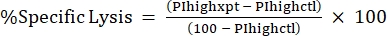 (مكافئ 3)
(مكافئ 3)
حيث PIhighxpt هو النسبة المئوية ل PI عالية للحالة التجريبية ؛ و PIhighctl هو النسبة المئوية ل PI عالية للتحكم في عدم السموم. - ارسم النسبة المئوية للتحلل النوعي مقابل تركيز السم لمنحنى الاستجابة للجرعة (الشكل 4).
- تنظيم منحنى الجرعة والاستجابة في Excel للنمذجة اللوجستية. قم بتضمين تركيز السم ومتوسط النسبة المئوية للتحلل النوعي جنبا إلى جنب مع التفاصيل التجريبية و / أو الحسابات العالية ل ٪PI الخام (الجدول 2).
- تحقق من تمكين الوظيفة الإضافية Solver.
ملاحظة: لتمكين Solver في إصدار سطح المكتب من Excel، انتقل إلى خيارات > الملفات > الوظائف الإضافية، وحدد المربع Solver . أعد تشغيل Excel. - قم بتسمية أربعة أعمدة أخرى على أنها "نمذجة" و "بقايا" و "معلمات" و "قيم معلمات". تحقق من أن الأعمدة الأولى تتوافق مع المعلمات التجريبية وتركيز السم والنسبة المئوية للتحلل النوعي (الجدول 2).
- أضف المعلمات التالية في عمود "المعلمات": L و k و c و SUM و LC50. قم بتهيئة المعلمات L و k و c عن طريق إدخال القيم التالية في عمود "قيم المعلمات": 100 ، 0.05 ، 1000.
- في العمود "النموذجي" ، قم بإنشاء النموذج اللوجستي باستخدام الصيغة التالية:
 (مكافئ 4)
(مكافئ 4)
قم بتعيين L و k و c إلى الخلايا التي تحتوي على هذه المعلمات في عمود "قيم المعلمات".
اضبط x على الخلية التي تحتوي على تركيز السم.
ملاحظة: بالنسبة للجدول 2، الخلية G4، تكون الصيغة كما يلي: =$J$3/(1+EXP(-$J$4*(D4-$J$5))) - قم بتطبيق هذه المعادلة على كافة قيم التحلل النوعي ٪ باستثناء عنصر التحكم بدون سموم.
- في عمود "البقايا" ، احسب مربع الفرق بين الرقم النموذجي والتحلل المحدد الفعلي باستخدام المعادلة التالية:
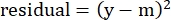 (مكافئ 5)
(مكافئ 5)
حيث y هو التحلل النوعي التجريبي٪ ؛ و m هي القيمة المقابلة في العمود "النموذجي" المحسوبة في الخطوات 2.4.10-2.4.11. - في عمود "قيم المعلمات" بجوار "SUM" ، اجمع كل القيم في عمود المتبقية.
- في عمود "قيم المعلمات" بجوار "LC50" ، قم بتهيئة المعادلة لحساب LC50 من القيم المحددة. هذا هو حل Eq 4 ل x عندما m = 50.
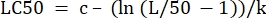 (مكافئ 6)
(مكافئ 6)
بالنسبة للجدول 2 ، تكون صيغة Excel كما يلي: = J5- (LN (J3 / (50) -1)) / J4 - افتح Solver من علامة التبويب البيانات. حدد تعيين الهدف لتكون الخلية التي تحتوي على مجموع البقايا المحسوبة. اضبطه على الحد الأدنى.
- قم بتغيير الخلايا المتغيرة لقيم المعلمات L و k و c.
ملاحظة: قد يتصرف المحلل بشكل أفضل إذا تم ترك "جعل المتغيرات غير المقيدة غير سلبية" محددة. - بالنسبة لقيم k السالبة ، قم بتعديل Eq 4 و Eq 6 عن طريق تحليل −1 من k لتغيير k إلى موجب. استخدم طريقة الحل غير الخطي GRG. انقر على حل.
- تحقق من المنحنى وأن LC50 يتم حسابه تلقائيا باستخدام Eq 6 (الجدول 2). تحقق من الملاءمة عن طريق رسم بياني لكل من التحلل النوعي ٪ والنمذجة مقابل تركيز السموم.
ملاحظة: يمكن أيضا التحقق منه عن طريق حساب R2 للمنحنى.
- بوابة المجموع ، خلية واحدة L. promastigotes الرئيسية عن طريق بوابة على تشتت الأمامي والجانبي والوقت حسب الحاجة (الشكل 3). استخدم الارتفاع أو المساحة على النحو الموصى به لمقياس التدفق الخلوي.
3. تحليل البروتين من L. promastigotes الرئيسية التي تتحدى السم
- تحضير L . promastigotes الرئيسية كما هو موضح في القسم 1.
- أعد تعليق 2 × 107 WT و spt2- و spt2- / + SPT2 L. promastigotes الرئيسية في 2 مل من المخزن المؤقت للمقايسة المطلوب باستخدام ماصة 5 مل (على سبيل المثال ، M199 الخالي من المصل). يضاف السم إلى تركيز نهائي تحت التحلل ويحتضن عند 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: على سبيل المثال ، جرعة فرعية من SLO ل spt2- promastigotes هي 500 HU / mL. - قم بتضمين الأنماط الجينية الأخرى والضوابط الخالية من السموم.
- أجهزة الطرد المركزي promastigotes في 1500 × غرام لمدة 10 دقائق لحبيبات الخلايا. تخلص من المادة الطافية باستخدام ماصة سعة 10 مل. قم بتشغيل الأنبوب المغلق الذي يحتوي على حبيبات الخلية بسرعة ثلاث مرات عبر سطح غير منتظم ، مثل شواية خزانة السلامة الحيوية ، لتفتيت حبيبات الخلية.
ملاحظة: تكون حبيبات الخلية غير مرئية تقريبا للعين المجردة. - أعد تكوين 1x SDS-PAGE عينة عازلة مع 2-mercaptoethanol مباشرة قبل الاستخدام وتسخينها إلى 95 درجة مئوية لمدة 10 دقائق قبل إضافتها إلى حبيبات الخلية. أعد تعليق حبيبات الخلية في المخزن المؤقت لعينة SDS-PAGE 1x ساخن ، واخلطها جيدا عن طريق السحب لأعلى ولأسفل. قم بتسخين حبيبات الخلية المعاد تعليقها في 1x عينة عازلة عند 95 درجة مئوية لمدة 10 دقائق.
ملاحظة: بعد الذوبان في المخزن المؤقت للعينة ، قم بتخزين العينات على المدى الطويل عند -20 درجة مئوية إذا لزم الأمر. - تحضير هلام حل. ديغا جميع المكونات باستثناء بيرسلفات الأمونيوم (APS) و TEMED لمدة 15 دقيقة.
- أضف APS و TEMED مباشرة قبل صب الجل. تراكب بعناية هلام حل بالماء. اسمح لجل التحلل بالبلمرة ، ~ 30-45 دقيقة.
- صب الماء وإعداد هلام التراص. أضف جل التراص ، مع الحرص على تجنب الفقاعات. أدخل مشطا مع العدد المناسب من الآبار ، واتركه يتبلمر لمدة 5 دقائق. راقب البلمرة باستخدام أي جل تكديس متبقي.
- قم بتجميع الجل لتشغيل SDS-PAGE وأضف المخزن المؤقت للخزان إلى الغرفة.
- قم بتحميل 10 ميكرولتر من كل عينة لكل بئر ، أو 8 ميكرولتر من سلم البروتين. قم بالتشغيل عند 180 فولت حتى تدخل العينات إلى هلام المحلول ، ثم قم بتقليل الجهد إلى ~ 160 فولت وقم بتشغيله حتى تصبح واجهة الصبغة ~ 0.5 سم من حافة اللوحة.
ملاحظة: قد يختلف الوقت الذي تستغرقه العينات للوصول إلى القاع بين 1-1.5 ساعة. يمكن إطالة الوقت عن طريق تقليل الجهد. لا تقلل الجهد إلى الصفر. قد تؤدي الفولتية العالية إلى زيادة هلام "الابتسام" وكسر اللوحات. - انقل الجل إما إلى صبغة Coomassie (لتلطيخ البروتين) أو إلى 1x محلول نقل (للنشاف الغربي). لتلطيخ Coomassie ، وصمة عار بين عشية وضحاها ، ثم إزالة البقع ، صورة ، وجافة.
- بالنسبة للوصمة الغربية ، قم بإعداد نظام النقل وفقا لتعليمات الشركة المصنعة.
- للنقل الرطب ، استخدم مخزن النقل البارد 1x والوسادات المبللة مسبقا وورق الترشيح والنيتروسليلوز. بالنسبة لنظام Bio-rad Protean III (انظر جدول المواد) المستخدم هنا ، يمكن قطع ورق الترشيح إلى 10 سم × 7.5 سم. قطع النيتروسليلوز إلى 9 سم × 6.75 سم.
ملاحظة: النيتروسليلوز شديد الاشتعال. تجنب اللهب المكشوف والمصادر المحتملة الأخرى للاشتعال. - ضع كاسيت النقل باستخدام وسادات وورق ترشيح ونيتروسليلوز. طرح فقاعات الهواء. أضف الجل بعناية.
- أضف ورقة الترشيح واطرح فقاعات الهواء. أضف الوسادة ، وأغلق العلبة ، وأدخلها في الحامل في الاتجاه الصحيح (تأكد من أن النيتروسليلوز يواجه الطرف الأحمر). أضف قضيب تقليب وكيس ثلج إلى الجانب ، وقم بتعبئة الخزان بمخزن مؤقت لنقل بارد 1x. نقل في 110 فولت لمدة 90 دقيقة.
ملاحظة: قد تؤثر الحرارة المتولدة أثناء النقل سلبا على النقل. لضمان نقل جيد ، استخدم دائما مخزن النقل البارد 1x. - قم بإزالة النيتروسليلوز وصمة عار بمحلول بونسو لمدة ~ 5 دقائق. شطف بالماء عالي النقاء. ضع علامة على سلم البروتين بالقلم الرصاص وقم بقص اللطخة حسب الحاجة. قم بإزالة اللطخة باستخدام المخزن المؤقت لنقل المتبقي.
ملاحظة: يمكن إعادة استخدام بونسو عدة مرات. - منع النيتروسليلوز في 25 مل من 5٪ BSA في 1x TBST عند 4 °C ، مع الاهتزاز ، بين عشية وضحاها. بعد ذلك ، تخلص من محلول الحجب وأضف الجسم المضاد الأساسي (1: 1,000) في 1٪ BSA في 1x TBST. يرج عند 4 درجات مئوية طوال الليل.
ملاحظة: يمكن حفظ الجسم المضاد الأساسي عند -20 درجة مئوية وإعادة استخدامه عدة مرات. - اغسل النيتروسليلوز 3x لمدة 10 دقائق لكل منهما في 1x TBST مع الرج. تخلص من الغسيل وأضف 10 مل من الجسم المضاد الثانوي المترافق مع HRP (1: 10,000) في 1٪ BSA في 1x TBST. يهز في درجة حرارة الغرفة لمدة 1 ساعة. اغسل النيتروسليلوز 3x لمدة 10 دقائق لكل منهما في 1x TBST مع الرج.
- تحضير كاشف ECL مباشرة قبل تصوير النيتروسليلوز. مباشرة قبل التصوير ، صب TBST وإضافة كاشف ECL إلى النيتروسليلوز. رج العبوة لمدة 1 دقيقة. صورة الجل.
Access restricted. Please log in or start a trial to view this content.
النتائج
زيادة حساسية promastigote ل SLO في المخزن المؤقت ل Tyrode مقارنة ب M199
تمت مقارنة حساسية SLO ل L. promastigotes الرئيسية بين مخازن الفحص المختلفة. تم تحدي promastigotes من النوع البري و spt2- / + SPT2 مع SLO في M199 الخالي من المصل أو المخزن المؤقت ل Tyrode المكمل ب 2 mM CaCl2 لمدة 30 دقيقة قبل ...
Access restricted. Please log in or start a trial to view this content.
Discussion
في هذه الدراسة ، تم وصف طرق دراسة الآليات الجزيئية ووظائف PFTs ، باستخدام الممرض البشري الليشمانيا الكبرى كنظام نموذجي. تم تطوير مقايسة السمية الخلوية القائمة على قياس التدفق المتوسط لقياس صلاحية الخلية الواحدة. الجدوى كمية على مستوى السكان لأنه يمكن حساب قيم LC50 من منحنى الجرعة ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
تم دعم هذا العمل من قبل المعهد الوطني للحساسية والأمراض المعدية التابع للمعاهد الوطنية للصحة ، حيث منح R21AI156225 إلى PAK و KZ (co-I) و R01AI139198 إلى KZ (co-I). تود CH أن تعرب عن تقديرها لقسم العلوم البيولوجية للمساعدة في التدريس المقدمة خلال فترة هذه الدراسة.
ولم يكن لوكالات التمويل أي دور في تصميم الدراسة؛ في جمع البيانات أو تحليلها أو تفسيرها؛ في كتابة المخطوطة ؛ ولا في قرار نشر النتائج. المحتوى هو مسؤولية المؤلفين وحدهم ولا يمثل بالضرورة وجهات النظر الرسمية لوكالات التمويل. يعلن المؤلفون أنه ليس لديهم تضارب في المصالح المتنافسة.
Acknowledgements
يود المؤلفون أن يشكروا أعضاء مختبرات كيل وتشانغ على مراجعتهم النقدية للمخطوطة. يشكر المؤلفون المجهري لكلية الآداب والعلوم على استخدام المرافق.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1.2 mL microtiter (Marsh) tubes | Fisher | 02-681-376 | Cytotoxicity assay |
| 1.5 mL microcentrifuge tube | Fisher | 05-408-129 | Toxin dilutions |
| 15 mL centrifuge tube | Avantor VWR (Radnor, PA) | 89039-666 | To hold cells and media |
| 1x Phosphate buffered saline (PBS) | Fisher | BP399 | For cell processing |
| 3% H2O2 | Walmart (Fayetteville, AR) | N/A | For ECL |
| 5x M199 | Cell-gro | 11150067 | Basal growth media for L. major promastigotes |
| Biosafety cabinet | Baker | To culture cells in sterile conditions | |
| Bovine serum albumin (BSA) | Fisher | BP1605-100 | Fraction V acceptable purity |
| CaCl2 | Fisher | BP510-100 | Stock concentration 100 mM |
| Centrifuge | Thermo Fisher | Heraeus Megafuge 40R | To pellet the cells from culture |
| Cy5 Mono-reactive dye pack | Cytiva (Marlborough, MA) | PA25031 | Fluorophore label for toxins |
| Digital dry bath | Benchmark | BSH1002 | To denature protein samples |
| EGTA | Amresco | 0732-100G | Stock concentration 0.5 M |
| Excel | Microsoft (Redmond, VA) | Data analysis software | |
| Flow cytometer (4-laser Attune NxT) | Fisher | Cytometer for data acquisition | |
| FlowJo | BD (Ashland, OR) | Software | |
| Formaldehyde | Fisher | BP531-500 | Fixative for counting cells |
| G418 | Fisher | BP673-1 | Selection agent for cells |
| Hellmanex III | Sigma | Z805939 | Dilute 1:4 for cleaning cytometer |
| Hemacytometer | Fisher | 0267151B | For counting cells |
| Human red blood cells | Zen-bio (Durham, NC) | SER-10MLRBC | To validate toxin activity |
| Ice bucket | |||
| Light microscope | Nikon | Eclipse 55i | To visualize cells |
| Nitrocellulose | Fisher | 88018 | For probing proteins via antibodies |
| Pipettors and tips | Avantor VWR | To dispense reagents | |
| Power supply | Bio-Rad | To run SDS-PAGE and transfers | |
| Propidium iodide | Biotium | 40016 | Stock concentration 2 mg/mL in water |
| Protein ladder | Bio-Rad | 161-0373 | To determine molecular weight of proteins |
| SDS-PAGE Running Apparatus (Mini Protean III) | Bio-Rad | 165-3302 | To separate proteins based on their size |
| Sealing tape | R&D | DY992 | To seal plates with cells |
| Streptolysin O C530A plasmid insert | Cloned into pBAD-gIII vector (Reference: 7) | ||
| Streptolysin O C530A toxin | Lab purified | Specific activity 4.34 x 105 HU/mg | |
| Swinging bucket rotor | Thermo Fisher | 75003607 | To centrifuge cells |
| V-bottom plate | Greiner Bio-one | 651206 | For cytotoxicity assay |
| Vortex | Benchmark | BV1000 | To mix cells |
| Western blot imaging system (Chemi-doc) | Bio-Rad | To visualize proteins by western blot | |
| Western Blot Transfer Apparatus (Mini Protean III) | Bio-Rad | 170-3930 | Transfer proteins to nitrocellulose |
| Whatman Filter paper | GE Healthcare Life Sciences | 3030-700 | Used in transfer of proteins to nitrocellulose |
| Antibody | |||
| Anti-ERK antibody | Cell Signaling Technologies | Cat# 9102S | Rabbit (1:1000 dilution) |
| Anti-lipophosphoglycan (LPG) antibody | CreativeBioLabs | Cat# WIC79.3 | Mouse (1: 1000) |
| Anti-MEK antibody | Cell Signaling Technologies | Cat# 9122L | Rabbit (1:1000) |
| Anti-mouse IgG, HRP conjugate | Jackson Immunoresearch | Cat#715-035-151 | Donkey (1:10000) |
| Anti-phosphoERK antibody | Cell Signaling Technologies | Cat# 9101S | Rabbit (1:1000) |
| Anti-pMEK antibody | Cell Signaling Technologies | Cat# 9121S | Rabbit (1:1000) |
| Anti-rabbit IgG, HRP conjugate | Jackson Immunoresearch | Cat#711-035-152 | Donkey (1:10000) |
| Anti-tubulin antibody | Sigma | Cat# T5168 | Mouse (1: 2000) |
| Leishmania major Genotypes | Reference: 13 | ||
| Episomal addback (spt2-/+SPT2) | Δspt2::HYG/Δspt2:PAC/+pXG-SPT2 | ||
| Serine palmitoyltransferase subunit 2 knockout (spt2-) | Δspt2::HYG/Δspt2::PAC | ||
| Wild type (WT) | LV39 clone 5 (Rho/SU/59/P) |
References
- Thapa, R., Ray, S., Keyel, P. A. Interaction of macrophages and cholesterol-dependent cytolysins: The impact on immune response and cellular survival. Toxins. 12 (9), 531(2020).
- Limbago, B., Penumalli, V., Weinrick, B., Scott, J. R. Role of streptolysin O in a mouse model of invasive group A streptococcal disease. Infection & Immunity. 68 (11), 6384-6390 (2000).
- Farrand, A. J., et al. The cholesterol-dependent cytolysin membrane-binding interface discriminates lipid environments of cholesterol to support beta-barrel pore insertion. Journal of Biological Chemistry. 290 (29), 17733-17744 (2015).
- Soltani, C. E., Hotze, E. M., Johnson, A. E., Tweten, R. K. Structural elements of the cholesterol-dependent cytolysins that are responsible for their cholesterol-sensitive membrane interactions. Proceedings of the National Academy of Sciences of the United States of America. 104 (51), 20226-20231 (2007).
- Schoenauer, R., et al. Down-regulation of acid sphingomyelinase and neutral sphingomyelinase-2 inversely determines the cellular resistance to plasmalemmal injury by pore-forming toxins. FASEB Journal. 33 (1), 275-285 (2019).
- Ray, S., Roth, R., Keyel, P. A. Membrane repair triggered by cholesterol-dependent cytolysins is activated by mixed lineage kinases and MEK. Science Advances. 8 (11), (2022).
- Babiychuk, E. B., Monastyrskaya, K., Draeger, A. Fluorescent annexin A1 reveals dynamics of ceramide platforms in living cells. Traffic. 9 (10), 1757-1775 (2008).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136(2014).
- Demonbreun, A. R., et al. An actin-dependent annexin complex mediates plasma membrane repair in muscle. Journal of Cell Biology. 213 (6), 705-718 (2016).
- Wolfmeier, H., et al. Ca(2)(+)-dependent repair of pneumolysin pores: A new paradigm for host cellular defense against bacterial pore-forming toxins. Biochimica et Biophysica Acta. 1853 (2), 2045-2054 (2015).
- Bravo, F., Sanchez, M. R. New and re-emerging cutaneous infectious diseases in Latin America and other geographic areas. Dermatologic Clinics. 21 (4), 655-668 (2003).
- Manfredi, M., Iuliano, S. Cutaneous leishmaniasis with long duration and bleeding ulcer. Clinical Microbiology Open Access. 05, 2-6 (2016).
- Zhang, K., et al. Sphingolipids are essential for differentiation but not growth in Leishmania. EMBO Journal. 22 (22), 6016-6026 (2003).
- Zhang, K. Balancing de novo synthesis and salvage of lipids by Leishmania amastigotes. Current Opinions in Microbiology. 63, 98-103 (2021).
- Kaur, P., Goyal, N. Pathogenic role of mitogen activated protein kinases in protozoan parasites. Biochimie. 193, 78-89 (2022).
- Wiese, M. Leishmania MAP kinases--Familiar proteins in an unusual context. International Journal of Parasitology. 37 (10), 1053-1062 (2007).
- Brumlik, M. J., Pandeswara, S., Ludwig, S. M., Murthy, K., Curiel, T. J. Parasite mitogen-activated protein kinases as drug discovery targets to treat human protozoan pathogens. Journal of Signal Transduction. 2011, 971968(2011).
- Wiese, M., Kuhn, D., Grunfelder, C. G. Protein kinase involved in flagellar-length control. Eukaryotic Cell. 2 (4), 769-777 (2003).
- Agron, P. G., Reed, S. L., Engel, J. N. An essential, putative MEK kinase of Leishmania major. Molecular Biochemistry of Parasitology. 142 (1), 121-125 (2005).
- Ray, S., Thapa, R., Keyel, P. A. Multiple parameters beyond lipid binding affinity drive cytotoxicity of cholesterol-dependent cytolysins. Toxins. 11 (1), (2018).
- Beneke, T., et al. A CRISPR Cas9 high-throughput genome editing toolkit for kinetoplastids. Royal Society Open Science. 4 (5), 170095(2017).
- Kapler, G. M., Coburn, C. M., Beverley, S. M. Stable transfection of the human parasite Leishmania major delineates a 30-kilobase region sufficient for extrachromosomal replication and expression. Molecular and Cellular Biology. 10 (3), 1084-1094 (1990).
- Moitra, S., Pawlowic, M. C., Hsu, F. F., Zhang, K. Phosphatidylcholine synthesis through cholinephosphate cytidylyltransferase is dispensable in Leishmania major. Scientific Reports. 9, 7602(2019).
- Keyel, P. A., Heid, M. E., Watkins, S. C., Salter, R. D. Visualization of bacterial toxin induced responses using live cell fluorescence microscopy. Journal of Visualized Experiments. (68), 4227(2012).
- Romero, M., et al. Intrinsic repair protects cells from pore-forming toxins by microvesicle shedding. Cell Death & Differentiation. 24 (5), 798-808 (2017).
- Keyel, P. A., et al. Streptolysin O clearance through sequestration into blebs that bud passively from the plasma membrane. Journal of Cell Science. 124, 2414-2423 (2011).
- Dong, Z., Patel, Y., Saikumar, P., Weinberg, J. M., Venkatachalam, M. A. Development of porous defects in plasma membranes of adenosine triphosphate-depleted Madin-Darby canine kidney cells and its inhibition by glycine. Laboratory Investigations. 78 (6), 657-668 (1998).
- Loomis, W. P., den Hartigh, A. B., Cookson, B. T., Fink, S. L. Diverse small molecules prevent macrophage lysis during pyroptosis. Cell Death & Disease. 10 (4), 326(2019).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved