需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
利用利什曼原虫破译毛孔形成毒素的分子机制和功能
摘要
这里介绍的是使用 利什曼原虫主要 前鞭毛体来确定孔形成毒素诱导的结合、细胞毒性和信号传导的方案。提供了链球菌溶血素O的概念验证。其他毒素也可用于利用 杆菌 中可用的遗传突变体来确定毒素抗性的新机制。
摘要
了解造孔毒素(PFT)的功能和机制具有挑战性,因为细胞可以抵抗PFT引起的膜损伤。虽然生物物理方法有助于理解孔的形成,但它们通常依赖于缺乏膜脂质和蛋白质全部补充的还原论方法。培养的人类细胞提供了一种替代系统,但它们的复杂性和修复机制的冗余使得识别特定机制变得困难。相比之下,导致皮肤利什曼病的人类原生动物病原体,即大利什曼原虫,在复杂性和生理相关性之间提供了最佳平衡。杆菌在遗传上是可处理的,可以在体外培养到高密度,并且可以在已建立的小鼠模型中测量扰动对感染的任何影响。此外,L. major合成的脂质与哺乳动物不同,这可能会改变膜动力学。膜动力学的这些改变可以用来自最佳特征毒素家族胆固醇依赖性溶细胞素(CDC)的PFT进行探测。CDC与利什曼原虫膜中的麦角甾醇结合,可杀死大鞭毛乳杆菌,表明杆菌是确定PFT功能的细胞和分子机制的合适模型系统。这项工作描述了在L. majorpromagotes中测试PFT功能的方法,包括寄生虫培养,用于评估脂质敏感性的遗传工具,膜结合测定和细胞死亡测定。这些测定将能够快速使用L. major作为强大的模型系统,用于了解一系列进化上多样化的生物体的PFT功能和脂质组织的共性。
引言
孔形成毒素(PFTs)是细菌毒素中最大的家族1,但它们穿孔和破坏细胞的机制知之甚少。研究得最好的毛孔形成毒素家族是胆固醇依赖性溶细胞素(CDCs)。CDC主要由革兰氏阳性菌合成,包括坏死性筋膜炎的病原体化 脓性链球菌2。 化脓性 链球菌分泌CDC链球菌溶血素O(SLO),其作为单体与宿主细胞质膜中的甾醇结合,低聚化并将~20-30nm孔插入膜1。脂质在这一过程中所起的作用仍然不确定。
研究脂质-CDC相互作用的一种方法是使用化学定义的脂质体。虽然定义的脂质体提供了维持毒素结合和孔形成所需的脂质阈值的信息3,4,但它们并不能完全概括细胞功能。例如,重组脂质体缺乏哺乳动物宿主的脂质不对称性和响应毒素的脂质修饰5。脂质体的一种替代方案是使用哺乳动物细胞系。虽然这些细胞系在生理上更具相关性,但在毒素传感和抗性机制方面存在很大程度的冗余2。因此,用于抵抗CDC的修复途径仍然确定得很差。值得注意的是,Ca2+的流入是膜修复1的主要激活剂。在Ca2+涌入的下游,有多个途径参与,包括神经酰胺依赖性修复6,7和MEK依赖性修复途径6。这些途径与其他蛋白质效应物相互作用,包括运输所需的内体分选复合物(ESCRT)8和膜联蛋白6,9,10。由于冗余,在哺乳动物细胞中解剖这些途径具有挑战性,这混淆了数据解释。
在剖析修复途径的复杂性与简单性之间取得平衡的一种方法是使用更简单的生物,例如利什曼原虫属中的原生动物病原体。利什曼原虫在人类和其他动物中引起利什曼病。利什曼病的范围从皮肤利什曼病(自限性皮肤病变)到致命的内脏利什曼病(肝脾肿大),取决于物种和其他因素11。重型利什曼原虫是皮肤利什曼病的病原体,通过白蛉媒介传播给人类,用于了解利什曼原虫的功能和感染12。此外,利什曼原虫属是12。它们作为细胞内哺乳动物巨噬细胞寄生虫存在,称为无鞭毛虫,并在白蛉中作为自由游泳的鞭毛原鞭毛体存在12。主要前鞭毛乳杆菌可以在补充血清的培养基(如M199)中培养至高密度13。前乳鞭毛在遗传上也是可处理的;存在许多基因敲除,包括那些靶向脂质生物合成途径的基因敲除13。这些敲除可以通过感染Balb / c小鼠13来评估感染性和病变发展的生长和差异。
除了利什曼原虫培养的相对容易和脂质生物合成敲除的范围外,寄生虫的基因组比哺乳动物更简单。利什曼原虫最具特征的物种是L. major,它具有许多现有的遗传工具,例如脂质代谢缺陷的突变体14。值得注意的是,许多修复蛋白缺失。迄今为止,杆菌尚未发现关键哺乳动物修复蛋白(如膜联蛋白)的同系物。这使得能够表征进化上保守的修复途径,而没有哺乳动物系统的复杂性。然而,迄今为止,利什曼原虫尚未发现修复途径的特征。同时,参与修复的关键信号通路,如MEK通路6,在利什曼原虫sp.15,16中是保守的,尽管同系物需要验证。丝裂原活化蛋白激酶(MAPK)途径在墨西哥乳杆菌中得到了很好的研究,它有助于哺乳动物细胞的细胞内存活和热稳定性,并控制变环发生16。在利什曼原虫属中,15 种 MAPK 中有 10 种被表征为17.根据保守磷酸化唇序列中的身份,预测LmMAPK9和LmMAPK13与哺乳动物ERK1 / 2最相似。磷酸化唇序列对于哺乳动物ERK1 / 2和LmMAPK9和LmMAPK13都是TEY。然而,其中八个利什曼原虫MAPK具有TDY磷酸化基序15。在利什曼原虫、LmxMKK18 和 MEKK 相关激酶 (MRK1)19 中至少发现了两种 MEK 同系物。这表明在利什曼原虫中发现的见解可以转化为哺乳动物系统。在它们不能转化为哺乳动物系统的情况下,它们代表了治疗利什曼病的治疗靶点。
为了使用 L. majorpromasgotes 来研究膜修复和与毒素的相互作用,需要中等通量技术。虽然高分辨率活细胞成像能够实时可视化标记的蛋白质和膜,但它的通量很低,可能无法测量细胞存活率。中等通量活性测定包括通过流式细胞术测量染料摄取、线粒体活性测量或乳酸脱氢酶 (LDH) 等细胞蛋白的释放。在哺乳动物细胞中,LDH测定不能定量测量细胞死亡20。此外,基于群体的测定(如LDH释放或线粒体活性)不允许进行稳健的单细胞或多参数分析20。相比之下,基于流式细胞术的测定可实现多参数单细胞分析20。然而,这些测定尚未应用于了解毒素生物学或 对主要前鞭毛乳杆菌 毒素的反应。
在这项研究中,SLO被用作了解两种不同缓冲液中重 乳杆菌 鞘脂零突变体的质膜扰动的工具 - 通常用于培养 杆菌 的M199培养基和更简单的Tyrode缓冲液。描述了中等通量流式细胞术测定并用于生成毒素剂量-反应曲线。将流式细胞仪检测数据建模为逻辑曲线,以确定LC50 值。利用这些信息,可以确定SLO的亚溶解剂量,以便使用蛋白质印迹法验证MAPK抗体。
研究方案
所有适当的指南和标准的微生物学、安全性和细胞培养实践都用于使用和处理RG2病原体 利什曼原虫主要 和重组DNA。所有活的 L. major 实验均在BSL-2认证实验室的生物安全柜中进行。这项工作由德克萨斯理工大学机构生物安全委员会监督。
注意:从安全角度来看, 活的L. majorpromaputetes是风险组2病原体。使用机构生物安全委员会(IBC)的适当遏制,预防措施和监督进行处理。按照有毒物质的机构程序处理有毒物质和化学品。如果使用重组毒素,重组DNA工作可能需要IBC批准和监督。
1. 大鞭毛乳杆菌 的培养与制备
- 获取或制造和验证L .主要 遗传突变体,如前所述,使用同源重组或基于CRISPR的方法13,21。使用敲除与重新添加到质粒上的基因互补的基因,以确保敲除的特异性。
- 在完全M199培养基中培养野生型 L.主要L. 和 spt2- 前鞭毛体,在27°C。在完整的M199加199加10μg/ mL G418中培养游离加法细胞(spt2-/ + SPT2)(参见表 1 和 材料表)。
注意:涉及 L.主要 细胞实验的整个实验设置必须在BSL2认证的生物安全柜中进行。 - 在完整的M199培养基22中培养前鞭毛,直到它们达到对数期(2-8 x 106个细胞/ mL),如之前进行的L.主要生长曲线测定23所确定。为每个孔计划1 x 10 5个细胞的细胞毒性,加上5 x 105个细胞用于染色对照。对于蛋白质印迹,计划每孔 2 x 107 个细胞。
注意:通过两次技术重复进行细胞毒性测定。 - 为了验证适当的细胞密度,将等分试样(10-40μL)的前乳鞭毛与等体积的固定剂(1x PBS中的3.7%多聚甲醛)混合。将 10 μL 固定样品加载到血细胞计数器的每一侧。
注意:甲醛是一种有毒化学物质。按照危险化学品的机构政策处理。 - 使用显微镜以20倍放大倍率进行细胞计数。计数血细胞计数器中央25个小方块中的所有细胞。对两侧的正方形重复并平均计数。
注意:如果计数之间的差异为 >10,则重新计数和平均值。如果平均计数为 <10 或 >100,则更改稀释度并重新计数,然后使用以下公式计算培养密度: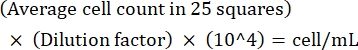 (公式1)
(公式1)
例如,如果 25 个正方形中平均有 250 个 利什曼原虫 ,则培养密度为 5 x 106 个细胞/mL。 - 计数后,将 5 x 106 个细胞转移到 15 mL 锥形管中,并在室温下以 1,500 x g 离心 8 分钟以沉淀细胞。
- 使用 10 mL 移液管弃去上清液并短暂涡旋细胞沉淀。向同一管中加入 5 mL 的 1x PBS,并通过轻轻倒置 3-6x 洗涤细胞。在室温下以1,500× g 离心8分钟以沉淀细胞。
- 使用 10 mL 移液管弃去上清液,并将 5 x 10 6 细胞沉淀重悬于 5 mL 用于实验的培养基(例如,M199 或 1x Tyrode 缓冲液)中,用 5 mL 移液管进行实验,得到 1 x 106 个细胞/mL 的终浓度。
2.细胞毒性测定
- 实验准备
- 如前所述净化毒素24,或从供应商处购买毒素。等分成一次性等分试样,并在-80°C下储存长达1年。避免多次冻融循环。
- 使用人红细胞确定每种毒素的溶血活性(见 材料表)24。
注意:使用溶血活性是因为它控制由于纯化,突变等引起的活性差异。红细胞的种类选择可能会改变溶血活性(例如,间歇溶素需要人红细胞)。 - 为每种情况计划两次技术重复,剂量反应曲线进行七次稀释,并进行无毒素对照。
注意:使用野生型(WT),spt2-和spt2-/ + SPT2前鞭毛,可以在一个V底96孔板中测试两种处理。例如,可以比较对介质的敏感性(图1)。可以使用 1.2 mL 微量滴定管代替 V 形底板(参见材料表)。由于细胞仪上的采集时间,不建议一次运行多个板。 - 根据所需的测试条件和实验目的确定要使用的测定缓冲液。
注意:在本例中,比较了两种测定缓冲液:补充有活性染料碘化丙啶(PI)的M199和Tyrode缓冲液。血清中的胆固醇会干扰CDC的活动24。 - 根据治疗的条件和基因型数量计算所需的毒素量。确保在稀释曲线的中间发生50%的特异性裂解。
注意:对于CDC,两倍连续稀释将为以后的物流建模提供良好的范围。对于 spt2- 前鞭毛体,推荐的起始稀释度为 4,000 HU/mL SLO。在使用非活性毒素的情况下,可以使用相当于最高剂量的质量代替。 - 计划每孔的最终体积为 200 μL,并额外添加少量体积 (50-100 μL) 以解决移液器错误。
注意:对于三种基因型,每种基因型一式两份,将有六个样品用于连续稀释。 - 使用以下公式确定所需的毒素总量:
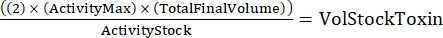 (公式2)
(公式2)
其中,最大活性是使用的最高浓度(HU/mL);总最终体积是总体积(对于六个样品,200 x 6 + 100 = 1,300 μL);活性原液是毒素原液的活性(HU/mL);而VolStock毒素是所需的毒素库存量。 - 准备实验所需的足够测定缓冲液。用活性染料和控制Ca 2+水平所需的任何Ca2+或EGTA补充基础培养基。涡旋混合。
注意:例如,对于每 10 mL Tyrode 缓冲液,加入 50 μL 2 mg/mL PI 和 200 μL 100 mM CaCl 2,最终浓度分别为 10 μg/mL 和2 mM。 - 确保活性染料PI不与使用的任何其他探针冲突,例如使用Cy5或AlexaFluor647偶联毒素20,25的荧光结合测定。
- 计划毒素稀释以制成 2 倍毒素溶液。将测定缓冲液加入 1.5 mL 离心管中,并在冰上冷却。仅在开始测定前立即添加毒素。
注意:在本例中,将添加 1.3 mL 的测定缓冲液用于顶部稀释,并添加 650 μL 用于连续稀释以制备 2x 毒素溶液。
- 实验
- 将步骤1.8中处理过的鞭毛体保留在单独的管中作为"未染色对照"。
注意:该样品将用于在流式细胞仪上设置设门。 - 向剩余的鞭石中加入 2 mg/mL PI,最终浓度为 10 μg/mL。涡旋3秒。
注意:将PI添加到处理过的前鞭毛体中后,这些细胞只能使用2.5小时的时间段.2.5小时后,细胞开始死亡,结果变得错误。 - 将 1 x 105 (100 μL/孔)处理过的鞭毛体加入 V 底 96 孔板或 1.2 mL 微量滴定管的每个孔中(图 1)。将板或管架放在冰上,与观察成大约 45° 角。在处理 利什曼原虫 前鞭毛虫时在生物安全柜中执行工作。
- 向每个无毒对照(最后一行)中加入 100 μL 带 PI 的测定缓冲液。通过目视识别总体积为 200 μL 且颜色较深的试管,验证是否正确添加了对照。
- 从 −80°C 中取出毒素等分试样,在冰上解冻,并根据需要池化。将步骤2.1.5中计算的毒素体积加入到最高稀释度(在步骤2.1.10中制备)。然后,连续稀释毒素(图1)。上下移液至少 8 次以确保混合。
注意:在冰上进行,因为CDC在室温下会迅速灭活。 - 从最低毒素浓度开始,快速将100μL毒素添加到正确的行中(图1 和 图2),并继续,直到所有毒素都添加到细胞中。
- 用密封胶带密封板。在37°C孵育30分钟。孵育期后,将板包装并运输到流式细胞仪。
- 将步骤1.8中处理过的鞭毛体保留在单独的管中作为"未染色对照"。
- 数据采集
- 根据制造商的说明和设施政策设置流式细胞仪(参见 材料表)和采集软件。未经细胞仪事先培训,请勿进行流式细胞术程序。
注意:在本例中,使用了 4 激光 Attune NxT。PI在YL-1通道上收集(由561 nm激光激发,通过577 LP,从600 DLP反射,并通过585/16带通过滤),尽管PI的宽光谱允许在其他通道上收集。 - 使用未染色的 L.主要 前鞭毛体样品,根据所选染料设置前向和侧向散射的门以及初始荧光参数。
- 如果需要,请包括一个额外的参数,用于检查自发荧光(例如,"无染色")(图3)。
注意:在本例中,使用了BL-1通道(由488 nm激光激发,通过495 DLP和503 LP,从555 DLP反射, 并通过530 /30带通过滤)。 - 使用单染色对照,设置活性染料(本研究中为PI)和任何荧光标记毒素的门。监测微木屐的前向散射与时间的关系。
注意:PI将暗淡染色未染色对照上方的所有细胞。死细胞很容易分离,在群体之间有短暂透化的细胞。 - 在细胞仪上为每个样品采集 >10,000 个门控事件。
注意:建议从最敏感到最不敏感进行读取,但可以颠倒采集顺序以确定读取顺序对样品结果的任何影响。 - 保存数据并根据需要进行导出以进行分析。
- 根据制造商的说明和设施政策设置流式细胞仪(参见 材料表)和采集软件。未经细胞仪事先培训,请勿进行流式细胞术程序。
- 数据分析
注意:在本研究中,Excel 与规划求解插件(请参阅 目录) 用于数据分析(请参阅 补充文件 1).- 门总,单细胞 L.主要 前鞭毛体,根据需要在前向和侧面散射和时间上进行门控(图3)。按照流式细胞仪的建议使用高度或面积。
注意:对于此处使用的流式细胞仪,建议使用高度而不是面积。 - 识别死细胞并将其选为"PI 高"。将中间单元选为"PI 低"。PI高细胞是死细胞,而PI低细胞是瞬时透化的26。
注意:PI 高单元格通常显示与阴性单元格的 2-3 个对数偏移。 - 将数据导出到 Excel。获取样本名称/ID 和高 %PI 以确定杀伤。
注意:如果使用荧光毒素,则需要活的、瞬时透化的和阴性人群的中位荧光强度 (MFI)。%PI 低可以导出以进行瞬态透化。 - 确定两个技术重复之间每个条件的平均 %PI 高值。
注意:如果荧光毒素需要平均MFI,也要计算。 - 使用以下公式24,25 从 %PI 高点计算比裂解百分比:
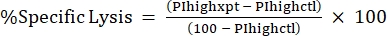 (公式3)
(公式3)
其中 PIhighxpt 是实验条件的 %PI 高;PIhighctl是无毒控制的%PI高。 - 绘制剂量反应曲线的相对于毒素浓度的特异性裂解百分比(图4)。
- 在 Excel 中组织剂量-反应曲线以进行逻辑建模。包括毒素浓度和平均比裂解百分比以及实验细节和/或原始%PI高计算(表2)。
- 验证规划求解加载项是否已启用。
注意:要在桌面版本的 Excel 中启用规划求解,请转到" 文件>选项">"加载项",然后选中" 规划求解 "框。重新启动 Excel。 - 将另外四列标记为"建模"、"残差"、"参数"和"参数值"。验证第一列是否与实验参数、毒素浓度和比裂解百分比相对应(表2)。
- 在"参数"列中添加以下参数:L、k、c、SUM 和 LC50。通过在"参数值"列中输入以下值来初始化参数 L、k 和 c:100、0.05、1,000。
- 在"建模"列中,使用以下公式创建逻辑模型:
 (公式4)
(公式4)
将 L、k 和 c 设置为包含"参数值"列中这些参数的单元格。
将x设置为含有毒素浓度的细胞。
备注:对于 表2,单元格G4,公式如下:= $J$ 3 /(1 + EXP(-$J$ 4 * (D4-$J$ 5))) - 将此公式应用于除无毒素对照以外的所有%特异性裂解值。
- 在"残差"列中,使用以下公式计算建模数字与实际特定裂解之间的差值的平方:
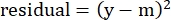 (公式5)
(公式5)
其中y是实验%特异性裂解;m是步骤2.4.10-2.4.11中计算的"建模"列中的相应值。 - 在"SUM"旁边的"参数值"列中,对残差列中的所有值求和。
- 在"LC50"旁边的"参数值"列中,初始化公式以根据确定的值计算LC50 。这是在 m = 50 时求解 x 的方程 4。
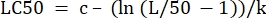 (等式6)
(等式6)
对于 表 2,Excel 公式如下:=J5-(LN(J3/(50)-1))/J4 - 从数据选项卡中打开规划求解。选择设置目标作为包含所计算残差总和的像元。将其设置为最小值。
- 更改参数值 L、k 和 c 的变量单元格。
注意:如果选中"使无约束变量为非负",则求解器的行为可能会更好。 - 对于负 k 值,修改方程 4 和等式 6,方法是从 k 中分解出 −1,将 k 更改为正。使用 GRG 非线性求解方法。单击 "解决"。
- 检查曲线,并使用公式6自动计算LC50 (表2)。通过图形绘制%特异性裂解和针对毒素浓度的建模来验证拟合。
注意: 也可以通过计算曲线的 R2 来检查它。
- 门总,单细胞 L.主要 前鞭毛体,根据需要在前向和侧面散射和时间上进行门控(图3)。按照流式细胞仪的建议使用高度或面积。
3. 毒素攻击大 鞭毛乳杆菌 的蛋白质分析
- 如第1节所述制备 L.主要 前鞭毛体。
- 使用 5 mL 移液管(例如,无血清 M199)将 2 x 107 WT、spt2 和 spt2-/+SPT2 L 重悬于 2 mL 所需测定缓冲液中。加入毒素至终亚解浓度,并在37°C孵育30分钟。
注意:例如, spt2- 前鞭毛体的SLO亚分解剂量为500 HU/mL。 - 包括其他基因型和无毒素对照。
- 将前鞭毛体以1,500× g 离心10分钟以沉淀细胞。使用 10 mL 移液管弃去上清液。将装有细胞沉淀的封闭管快速运行三次,穿过不规则表面,例如生物安全柜的格栅,以分解细胞沉淀。
注意:细胞沉淀肉眼几乎看不见。 - 使用前立即用2-巯基乙醇复溶1x SDS-PAGE样品缓冲液,并在加入细胞沉淀之前加热至95°C10分钟。将细胞沉淀重悬于热的1x SDS-PAGE样品缓冲液中,并通过上下移液充分混合。在95°C的1x样品缓冲液中加热重悬的细胞沉淀10分钟。
注意:在样品缓冲液中溶解后,如果需要,将样品长期储存在-20°C。 - 准备分离凝胶。除过硫酸铵(APS)和TEMED以外的所有组分脱气15分钟。
- 在灌制凝胶之前立即加入APS和TEMED。小心地用水覆盖分离凝胶。让分离凝胶聚合,~30-45分钟。
- 倒出水并准备堆叠凝胶。加入堆积凝胶,注意避免气泡。插入具有相关孔数的梳子,并使其聚合5分钟。使用任何剩余的堆积凝胶监测聚合。
- 组装用于运行SDS-PAGE的凝胶,并将储液缓冲液添加到腔室中。
- 每孔上样 10 μL 或蛋白质分子量标准品 8 μL。以180 V运行,直到样品进入分离凝胶,然后将电压降低至~160 V并运行直到染料前沿距离板边缘~0.5 cm。
注意:样品到达底部所需的时间可能在1-1.5小时之间变化。通过降低电压可以延长时间。切勿将电压降低到零。较高的电压可能会增加凝胶"微笑"并使板破裂。 - 将凝胶转移到考马斯染色剂(用于蛋白质染色)或1x转印缓冲液(用于蛋白质印迹)。对于考马斯染色,染色过夜,然后脱色,成像并干燥。
- 对于蛋白质印迹,请根据制造商的说明准备转印系统。
- 对于湿转印,请使用冷的1x转印缓冲液和预湿垫、滤纸和硝化纤维素。对于此处使用的 Bio-rad Protean III 系统(参见 材料表),滤纸可以切割成 10 cm x 7.5 cm。将硝化纤维素切成 9 厘米 x 6.75 厘米。
注意:硝化纤维素是高度易燃的。避免明火和其他潜在的火源。 - 用垫、滤纸和硝化纤维素布置转印盒。擀开气泡。小心地加入凝胶。
- 加入滤纸并擀开气泡。添加焊盘,关闭盒式磁带,然后以正确的方向插入支架(确保硝化纤维素面向红色端子)。在侧面加入搅拌棒和冰袋,并在储液槽中加入冷的1x转印缓冲液。在 110 V 下传输 90 分钟。
注意:传输过程中产生的热量可能会对传输产生不利影响。为确保良好的转印效果,请始终使用冷1x转印缓冲液。 - 去除硝化纤维素并用丽春红溶液染色~5分钟。用超纯水冲洗。用铅笔标记蛋白质分子量标准,并根据需要修剪印迹。使用剩余的转印缓冲液对印迹膜进行脱色。
注意:丽春红可以重复使用多次。 - 将硝化纤维素封闭在4°C的1x TBST中的25mL 5%BSA中,振荡过夜。然后,弃去封闭溶液,并在1x TBST的1%BSA中加入一抗(1:1,000)。在4°C摇匀过夜。
注意:一抗可以在-20°C下保存并重复使用几次。 - 摇动在1x TBST中洗涤硝化纤维素3次,每次10分钟。弃去洗涤液,在 1x TBST 的 1% BSA 中加入 10 mL HRP 偶联二抗 (1:10,000)。在室温下摇晃1小时。摇动在1x TBST中洗涤硝化纤维素3次,每次10分钟。
- 在硝化纤维素成像之前立即准备ECL试剂。在成像前,立即倒出TBST并将ECL试剂添加到硝化纤维素中。摇晃1分钟。对凝胶进行成像。
结果
与M199相比,Tyrode缓冲液中促乳腺对SLO的敏感性增加
比较不同测定缓冲液之间主要鞭毛乳杆菌的SLO敏感性。在流式细胞仪上分析之前,在无血清M199或补充有2mM CaCl2的Tyrode缓冲液中用SLO攻击野生型,spt2-和spt2-/+ SPT2前鞭毛体30分钟。适合分析的寄生虫是通过前向/侧面散射图鉴定的单细胞(图3A,B)。使用?...
讨论
本研究以人类病原虫大利 什曼原虫 为模型系统,描述了肺功能转移疗法分子机制和功能的研究方法。开发了一种基于中通量流式细胞术的细胞毒性测定法来测量单细胞活力。活力在人群水平上是定量的,因为LC50 值可以使用逻辑建模从剂量-反应曲线计算出来。作为原理验证,使用流式细胞术测定来说明培养基的选择可以改变野生型和鞘脂缺陷的 L.major 对SLO的敏感性,并确定...
披露声明
这项工作得到了美国国立卫生研究院国家过敏和传染病研究所向PAK和KZ(co-I)拨款R21AI156225以及向KZ(co-I)授予R01AI139198的支持。CH要感谢生物科学系在这项研究期间提供的助教。
资助机构在研究的设计中没有作用;在数据的收集、分析或解释中;在手稿的写作中;也没有决定公布结果。内容完全由作者负责,不一定代表资助机构的官方观点。作者声明他们没有相互竞争的利益冲突。
致谢
作者要感谢Keyel和Zhang实验室的成员对手稿的批判性审查。作者感谢艺术与科学学院显微镜学院使用设施。
材料
| Name | Company | Catalog Number | Comments |
| 1.2 mL microtiter (Marsh) tubes | Fisher | 02-681-376 | Cytotoxicity assay |
| 1.5 mL microcentrifuge tube | Fisher | 05-408-129 | Toxin dilutions |
| 15 mL centrifuge tube | Avantor VWR (Radnor, PA) | 89039-666 | To hold cells and media |
| 1x Phosphate buffered saline (PBS) | Fisher | BP399 | For cell processing |
| 3% H2O2 | Walmart (Fayetteville, AR) | N/A | For ECL |
| 5x M199 | Cell-gro | 11150067 | Basal growth media for L. major promastigotes |
| Biosafety cabinet | Baker | To culture cells in sterile conditions | |
| Bovine serum albumin (BSA) | Fisher | BP1605-100 | Fraction V acceptable purity |
| CaCl2 | Fisher | BP510-100 | Stock concentration 100 mM |
| Centrifuge | Thermo Fisher | Heraeus Megafuge 40R | To pellet the cells from culture |
| Cy5 Mono-reactive dye pack | Cytiva (Marlborough, MA) | PA25031 | Fluorophore label for toxins |
| Digital dry bath | Benchmark | BSH1002 | To denature protein samples |
| EGTA | Amresco | 0732-100G | Stock concentration 0.5 M |
| Excel | Microsoft (Redmond, VA) | Data analysis software | |
| Flow cytometer (4-laser Attune NxT) | Fisher | Cytometer for data acquisition | |
| FlowJo | BD (Ashland, OR) | Software | |
| Formaldehyde | Fisher | BP531-500 | Fixative for counting cells |
| G418 | Fisher | BP673-1 | Selection agent for cells |
| Hellmanex III | Sigma | Z805939 | Dilute 1:4 for cleaning cytometer |
| Hemacytometer | Fisher | 0267151B | For counting cells |
| Human red blood cells | Zen-bio (Durham, NC) | SER-10MLRBC | To validate toxin activity |
| Ice bucket | |||
| Light microscope | Nikon | Eclipse 55i | To visualize cells |
| Nitrocellulose | Fisher | 88018 | For probing proteins via antibodies |
| Pipettors and tips | Avantor VWR | To dispense reagents | |
| Power supply | Bio-Rad | To run SDS-PAGE and transfers | |
| Propidium iodide | Biotium | 40016 | Stock concentration 2 mg/mL in water |
| Protein ladder | Bio-Rad | 161-0373 | To determine molecular weight of proteins |
| SDS-PAGE Running Apparatus (Mini Protean III) | Bio-Rad | 165-3302 | To separate proteins based on their size |
| Sealing tape | R&D | DY992 | To seal plates with cells |
| Streptolysin O C530A plasmid insert | Cloned into pBAD-gIII vector (Reference: 7) | ||
| Streptolysin O C530A toxin | Lab purified | Specific activity 4.34 x 105 HU/mg | |
| Swinging bucket rotor | Thermo Fisher | 75003607 | To centrifuge cells |
| V-bottom plate | Greiner Bio-one | 651206 | For cytotoxicity assay |
| Vortex | Benchmark | BV1000 | To mix cells |
| Western blot imaging system (Chemi-doc) | Bio-Rad | To visualize proteins by western blot | |
| Western Blot Transfer Apparatus (Mini Protean III) | Bio-Rad | 170-3930 | Transfer proteins to nitrocellulose |
| Whatman Filter paper | GE Healthcare Life Sciences | 3030-700 | Used in transfer of proteins to nitrocellulose |
| Antibody | |||
| Anti-ERK antibody | Cell Signaling Technologies | Cat# 9102S | Rabbit (1:1000 dilution) |
| Anti-lipophosphoglycan (LPG) antibody | CreativeBioLabs | Cat# WIC79.3 | Mouse (1: 1000) |
| Anti-MEK antibody | Cell Signaling Technologies | Cat# 9122L | Rabbit (1:1000) |
| Anti-mouse IgG, HRP conjugate | Jackson Immunoresearch | Cat#715-035-151 | Donkey (1:10000) |
| Anti-phosphoERK antibody | Cell Signaling Technologies | Cat# 9101S | Rabbit (1:1000) |
| Anti-pMEK antibody | Cell Signaling Technologies | Cat# 9121S | Rabbit (1:1000) |
| Anti-rabbit IgG, HRP conjugate | Jackson Immunoresearch | Cat#711-035-152 | Donkey (1:10000) |
| Anti-tubulin antibody | Sigma | Cat# T5168 | Mouse (1: 2000) |
| Leishmania major Genotypes | Reference: 13 | ||
| Episomal addback (spt2-/+SPT2) | Δspt2::HYG/Δspt2:PAC/+pXG-SPT2 | ||
| Serine palmitoyltransferase subunit 2 knockout (spt2-) | Δspt2::HYG/Δspt2::PAC | ||
| Wild type (WT) | LV39 clone 5 (Rho/SU/59/P) |
参考文献
- Thapa, R., Ray, S., Keyel, P. A. Interaction of macrophages and cholesterol-dependent cytolysins: The impact on immune response and cellular survival. Toxins. 12 (9), 531 (2020).
- Limbago, B., Penumalli, V., Weinrick, B., Scott, J. R. Role of streptolysin O in a mouse model of invasive group A streptococcal disease. Infection & Immunity. 68 (11), 6384-6390 (2000).
- Farrand, A. J., et al. The cholesterol-dependent cytolysin membrane-binding interface discriminates lipid environments of cholesterol to support beta-barrel pore insertion. Journal of Biological Chemistry. 290 (29), 17733-17744 (2015).
- Soltani, C. E., Hotze, E. M., Johnson, A. E., Tweten, R. K. Structural elements of the cholesterol-dependent cytolysins that are responsible for their cholesterol-sensitive membrane interactions. Proceedings of the National Academy of Sciences of the United States of America. 104 (51), 20226-20231 (2007).
- Schoenauer, R., et al. Down-regulation of acid sphingomyelinase and neutral sphingomyelinase-2 inversely determines the cellular resistance to plasmalemmal injury by pore-forming toxins. FASEB Journal. 33 (1), 275-285 (2019).
- Ray, S., Roth, R., Keyel, P. A. Membrane repair triggered by cholesterol-dependent cytolysins is activated by mixed lineage kinases and MEK. Science Advances. 8 (11), (2022).
- Babiychuk, E. B., Monastyrskaya, K., Draeger, A. Fluorescent annexin A1 reveals dynamics of ceramide platforms in living cells. Traffic. 9 (10), 1757-1775 (2008).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136 (2014).
- Demonbreun, A. R., et al. An actin-dependent annexin complex mediates plasma membrane repair in muscle. Journal of Cell Biology. 213 (6), 705-718 (2016).
- Wolfmeier, H., et al. Ca(2)(+)-dependent repair of pneumolysin pores: A new paradigm for host cellular defense against bacterial pore-forming toxins. Biochimica et Biophysica Acta. 1853 (2), 2045-2054 (2015).
- Bravo, F., Sanchez, M. R. New and re-emerging cutaneous infectious diseases in Latin America and other geographic areas. Dermatologic Clinics. 21 (4), 655-668 (2003).
- Manfredi, M., Iuliano, S. Cutaneous leishmaniasis with long duration and bleeding ulcer. Clinical Microbiology Open Access. 05, 2-6 (2016).
- Zhang, K., et al. Sphingolipids are essential for differentiation but not growth in Leishmania. EMBO Journal. 22 (22), 6016-6026 (2003).
- Zhang, K. Balancing de novo synthesis and salvage of lipids by Leishmania amastigotes. Current Opinions in Microbiology. 63, 98-103 (2021).
- Kaur, P., Goyal, N. Pathogenic role of mitogen activated protein kinases in protozoan parasites. Biochimie. 193, 78-89 (2022).
- Wiese, M. Leishmania MAP kinases--Familiar proteins in an unusual context. International Journal of Parasitology. 37 (10), 1053-1062 (2007).
- Brumlik, M. J., Pandeswara, S., Ludwig, S. M., Murthy, K., Curiel, T. J. Parasite mitogen-activated protein kinases as drug discovery targets to treat human protozoan pathogens. Journal of Signal Transduction. 2011, 971968 (2011).
- Wiese, M., Kuhn, D., Grunfelder, C. G. Protein kinase involved in flagellar-length control. Eukaryotic Cell. 2 (4), 769-777 (2003).
- Agron, P. G., Reed, S. L., Engel, J. N. An essential, putative MEK kinase of Leishmania major. Molecular Biochemistry of Parasitology. 142 (1), 121-125 (2005).
- Ray, S., Thapa, R., Keyel, P. A. Multiple parameters beyond lipid binding affinity drive cytotoxicity of cholesterol-dependent cytolysins. Toxins. 11 (1), (2018).
- Beneke, T., et al. A CRISPR Cas9 high-throughput genome editing toolkit for kinetoplastids. Royal Society Open Science. 4 (5), 170095 (2017).
- Kapler, G. M., Coburn, C. M., Beverley, S. M. Stable transfection of the human parasite Leishmania major delineates a 30-kilobase region sufficient for extrachromosomal replication and expression. Molecular and Cellular Biology. 10 (3), 1084-1094 (1990).
- Moitra, S., Pawlowic, M. C., Hsu, F. F., Zhang, K. Phosphatidylcholine synthesis through cholinephosphate cytidylyltransferase is dispensable in Leishmania major. Scientific Reports. 9, 7602 (2019).
- Keyel, P. A., Heid, M. E., Watkins, S. C., Salter, R. D. Visualization of bacterial toxin induced responses using live cell fluorescence microscopy. Journal of Visualized Experiments. (68), 4227 (2012).
- Romero, M., et al. Intrinsic repair protects cells from pore-forming toxins by microvesicle shedding. Cell Death & Differentiation. 24 (5), 798-808 (2017).
- Keyel, P. A., et al. Streptolysin O clearance through sequestration into blebs that bud passively from the plasma membrane. Journal of Cell Science. 124, 2414-2423 (2011).
- Dong, Z., Patel, Y., Saikumar, P., Weinberg, J. M., Venkatachalam, M. A. Development of porous defects in plasma membranes of adenosine triphosphate-depleted Madin-Darby canine kidney cells and its inhibition by glycine. Laboratory Investigations. 78 (6), 657-668 (1998).
- Loomis, W. P., den Hartigh, A. B., Cookson, B. T., Fink, S. L. Diverse small molecules prevent macrophage lysis during pyroptosis. Cell Death & Disease. 10 (4), 326 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。