Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Leishmania major kullanarak Gözenek Oluşturan Toksinlerin Moleküler Mekanizmasını ve İşlevini Deşifre Etmek
Bu Makalede
Özet
Burada sunulan, gözenek oluşturan toksinlerin neden olduğu bağlanma, sitotoksisite ve sinyalleşmeyi belirlemek için Leishmania majör promastigotlarını kullanan bir protokoldür. Streptolizin O ile bir kavram kanıtı sağlanır. Diğer toksinler, toksin direncinin yeni mekanizmalarını tanımlamak için L. major'da bulunan genetik mutantlardan yararlanmak için de kullanılabilir.
Özet
Gözenek oluşturan toksinlerin (PFT'ler) işlevini ve mekanizmasını anlamak zordur, çünkü hücreler PFT'lerin neden olduğu membran hasarına direnir. Biyofiziksel yaklaşımlar gözenek oluşumunu anlamaya yardımcı olurken, genellikle membran lipitlerinin ve proteinlerinin tam tamamlayıcısından yoksun indirgemeci yaklaşımlara güvenirler. Kültürlenmiş insan hücreleri alternatif bir sistem sağlar, ancak onarım mekanizmalarındaki karmaşıklıkları ve fazlalıkları, spesifik mekanizmaların tanımlanmasını zorlaştırır. Buna karşılık, kutanöz leishmaniasis'ten sorumlu insan protozoan patojeni Leishmania major, karmaşıklık ve fizyolojik ilişki arasında optimal bir denge sunar. L. major genetik olarak izlenebilir ve in vitro olarak yüksek yoğunluğa kadar kültürlenebilir ve pertürbasyonların enfeksiyon üzerindeki herhangi bir etkisi yerleşik murin modellerinde ölçülebilir. Ek olarak, L. major , membran dinamiklerini değiştirebilen memeli meslektaşlarından farklı lipitleri sentezler. Membran dinamiğindeki bu değişiklikler, en iyi karakterize toksin ailesinden, kolesterole bağımlı sitolisinlerden (CDC'ler) PFT'lerle araştırılabilir. CDC'ler Leishmania membranındaki ergosterol'e bağlanır ve L. majör promastigotları öldürebilir, bu da L. major'un PFT fonksiyonunun hücresel ve moleküler mekanizmalarını belirlemek için uygun bir model sistem olduğunu gösterir. Bu çalışma, parazit kültürü, lipit duyarlılığını değerlendirmek için genetik araçlar, membran bağlama testleri ve hücre ölümü tahlilleri dahil olmak üzere L. majör promastigotlarda PFT fonksiyonunu test etme yöntemlerini açıklamaktadır. Bu analizler, L. major'un bir dizi evrimsel olarak farklı organizma ve lipit organizasyonundaki ortaklıklar arasında PFT fonksiyonunu anlamak için güçlü bir model sistem olarak hızlı bir şekilde kullanılmasını sağlayacaktır.
Giriş
Gözenek oluşturan toksinler (PFT'ler), bakteriyel toksinlerin en büyük ailesidir1, ancak hücreleri deldikleri ve yok ettikleri mekanizmalar tam olarak anlaşılamamıştır. En iyi çalışılan gözenek oluşturan toksinler ailesi, kolesterole bağımlı sitolisinlerdir (CDC'ler). CDC'ler öncelikle nekrotizan fasiitin etken maddesi Streptococcus pyogenes2 dahil olmak üzere gram-pozitif bakteriler tarafından sentezlenir. S. pyogenes , konakçı hücrelerin plazma zarındaki sterollere monomerler olarak bağlanan, oligomerize olan ve membran1'e ~ 20-30 nm gözenekler ekleyen CDC streptolizin O'yu (SLO) salgılar. Lipitlerin bu süreçte oynadığı rol zayıf bir şekilde belirlenmiştir.
Lipid-CDC etkileşimlerini incelemeye yönelik bir yaklaşım, kimyasal olarak tanımlanmış lipozomların kullanılmasıdır. Tanımlanmış lipozomlar, toksin bağlanmasını vegözenek oluşumunu sürdürmek için gerekli lipit eşikleri hakkında bilgi sağlarken, hücresel fonksiyonları tam olarak özetlemezler. Örneğin, yeniden yapılandırılmış lipozomlar, memeli konakçılarının lipit asimetrisinden ve toksinlere yanıt olarak lipit modifikasyonlarından yoksundur5. Lipozomlara bir alternatif, memeli hücre hatlarını kullanmaktır. Bu hücre hatları fizyolojik olarak daha alakalı olsa da, toksin algılama ve direnç mekanizmalarında büyük ölçüde fazlalık vardır2. Sonuç olarak, CDC'lere direnmek için kullanılan onarım yolları zayıf bir şekilde belirlenmiştir. Özellikle, Ca2+ akışı, membran onarımı1'in birincil aktivatörüdür. Ca2+ akışının aşağı akışında, seramid bağımlı onarım 6,7 ve MEK'e bağımlı onarım yolu6 dahil olmak üzere birden fazla yoldevreye girer. Bu yollar, taşıma için gerekli endozomal sıralama kompleksi (ESCRT)8 ve ek 6,9,10 dahil olmak üzere diğer protein efektörleri ile etkileşime girer. Bu yolakların memeli hücrelerinde diseke edilmesi, veri yorumlamasını karıştıran fazlalık nedeniyle zordur.
Onarım yollarını incelemek için karmaşıklığı basitlikle dengelemenin bir yolu, Leishmania cinsindeki protozoan patojenler gibi daha basit organizmaların kullanılmasıdır. Leishmania sp. insanlarda ve diğer hayvanlarda leishmaniasis'e neden olur. Leishmaniasis, türlere ve diğer faktörlere bağlı olarak kutanöz leishmaniasis'ten (kendi kendini sınırlayan cilt lezyonları) ölümcül viseral leishmaniasis'e (hepatosplenomegali) kadar değişir11. Kutanöz leishmaniasisin etken maddesi olan Leishmania major, insanlara bir kum sineği vektörü aracılığıyla bulaşır ve Leishmania fonksiyonunu ve enfeksiyonunu anlamak için kullanılır12. Ek olarak, Leishmania sp. dijenik12'dir. Amastigotlar olarak adlandırılan hücre içi memeli makrofaj parazitleri ve kum sineği12'de serbest yüzen, kamçılı promastigotlar olarak bulunurlar. L. majör promastigotlar, M199 gibi serum takviyeli ortamlarda yüksek yoğunluklu13'e kadar kültürlenebilir. Promastigotlar ayrıca genetik olarak da izlenebilir; lipid biyosentez yollarını hedefleyenler de dahil olmak üzere birçok gen nakavtı vardır13. Bu nakavtlar, Balb / c farelerinin enfeksiyonu yoluyla büyüme ve enfeksiyon ve lezyon gelişimindeki farklılıklar açısından değerlendirilebilir13.
Leishmania kültürünün göreceli kolaylığına ve lipit biyosentez nakavtlarının aralığına ek olarak, parazit memelilerden daha basit bir genoma sahiptir. Leishmania'nın en iyi karakterize edilen türü, kusurlu lipit metabolizmasına sahip mutantlar gibi birçok mevcut genetik araca sahip olan L. major'dur 14. Özellikle, birçok onarım proteini yoktur. L. major, ekler gibi önemli memeli onarım proteinleri için bugüne kadar tanımlanmış homologlara sahip değildir. Bu, memeli sistemlerinin karmaşıklığı olmadan evrimsel olarak korunmuş onarım yollarının karakterizasyonunu sağlar. Bununla birlikte, Leishmania'da onarım yolları bugüne kadar karakterize edilmemiştir. Aynı zamanda, MEK yolu6 gibi onarımla ilgili anahtar sinyal yolakları Leishmania sp.15,16'da korunmaktadır, ancak homologların doğrulanması gerekmektedir. Mitojenle aktive edilen protein kinaz (MAPK) yolu, memeli hücrelerinde hücre içi sağkalım ve termostabiliteye katkıda bulunduğu ve metasiklogenezi kontrol ettiği L. mexicana'da iyi çalışılmıştır16. Leishmania sp.'de, 15 MAPK'dan 10'u17 olarak karakterize edilmiştir. LmMAPK9 ve LmMAPK13'ün, korunmuş fosforilasyon dudak dizisindeki kimliğe dayanarak memeli ERK1/2'ye en çok benzeyen olduğu tahmin edilmektedir. Fosforilasyon dudak dizisi hem memeli ERK1/2 hem de LmMAPK9 ve LmMAPK13 için TEY'dir. Bununla birlikte, Leishmania MAPK'ların sekizinde TDY fosforilasyon motifi15 vardır. Leishmania sp., LmxMKK18 ve MEKK ile ilişkili kinaz (MRK1)19'da en az iki MEK homologu tanımlanmıştır. Bu, Leishmania'da tanımlanan içgörülerin memeli sistemlerine dönüşebileceğini düşündürmektedir. Memeli sistemlerine tercüme edilmedikleri yerlerde, leishmaniasis tedavisi için terapötik hedefleri temsil ederler.
L. majör promastigotların membran onarımını ve toksinlerle etkileşimlerini incelemek için kullanılması için, orta verimli tekniklere ihtiyaç vardır. Yüksek çözünürlüklü canlı hücre görüntüleme, etiketli proteinlerin ve membranların gerçek zamanlı olarak görselleştirilmesini sağlarken, düşük verimdir ve hücresel sağkalımı ölçmeyebilir. Orta verimli canlılık testleri, akış sitometrisi ile ölçülen boya alımını, mitokondriyal aktivitenin ölçümünü veya laktat dehidrogenaz (LDH) gibi hücresel proteinlerin salınımını içerir. Memeli hücrelerinde, LDH analizleri hücre ölümünü nicel olarak ölçmez20. Ayrıca, LDH salınımı veya mitokondriyal aktivite gibi popülasyon bazlı tahliller, sağlam tek hücreli veya multiparametrik analize izin vermez20. Buna karşılık, akış sitometrisine dayalı analizler multiparametrik tek hücreli analizi mümkün kılar20. Bununla birlikte, bu testler toksin biyolojisini veya L. majör promastigotlardaki toksinlere verilen yanıtları anlamak için uygulanmamıştır.
Bu çalışmada SLO, L. majör'ün sfingolipid null mutantının plazma membran pertürbasyonunu iki farklı tamponda anlamak için bir araç olarak kullanılmıştır - L. majör promastigotları ve daha basit Tyrode tamponunu kültürlemek için rutin olarak kullanılan M199 ortamı . Orta verimli bir akış sitometri testi tarif edilir ve toksin doz-yanıt eğrileri oluşturmak için kullanılır. Akış sitometrik tahlilinden elde edilen veriler, LC50 değerlerini belirlemek için lojistik bir eğriye modellenir. Bu bilgiyle, MAPK antikorlarının batı lekelenmesi kullanılarak doğrulanabilmesi için sublitik bir SLO dozu belirlenebilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
RG2 patojeni Leishmania majör ve rekombinant DNA'nın kullanımı ve kullanımı için tüm uygun kılavuzlar ve standart mikrobiyolojik, güvenlik ve hücre kültürü uygulamaları kullanılmıştır. Canlı L. major ile yapılan tüm deneyler, BSL-2 sertifikalı bir laboratuvarda bir biyogüvenlik kabininde gerçekleştirildi. Çalışma, Texas Tech Üniversitesi Kurumsal Biyogüvenlik Komitesi tarafından denetlendi.
NOT: Güvenlik açısından bakıldığında, canlı L. majör promastigotlar Risk Grubu 2 patojenleridir. Kurumsal Biyogüvenlik Komitesi'nden (IBC) uygun muhafaza, önlemler ve gözetim kullanarak ele alın. Toksik maddeleri ve kimyasalları, toksik maddeler için kurumsal prosedürlere uygun olarak kullanın. Rekombinant toksinler kullanılıyorsa, rekombinant DNA çalışması için IBC onayı ve gözetimi gerekebilir.
1. L. majör promastigotların yetiştirilmesi ve hazırlanması
- Daha önce homolog rekombinasyon veya CRISPR tabanlı yöntemler kullanılarak tanımlandığı gibi L. majör genetik mutantları elde etmek veya yapmak ve doğrulamak13,21. Nakavtın özgüllüğünü sağlamak için bir plazmid üzerine tekrar eklenen gen ile tamamlanan nakavtları kullanın.
- Kültür vahşi tip L. majör ve spt2- promastigotlar 27 ° C'de tam M199 ortamında. Epizomal eklenti hücrelerini (spt2-/+SPT2) tam M199 artı 10 μg/mL G418'de kültürleyin (bkz. Tablo 1 ve Malzeme Tablosu).
NOT: L. majör hücrelerle yapılan deneyleri içeren tüm deney düzeneği, BSL2 sertifikalı bir biyogüvenlik kabininde gerçekleştirilmelidir. - Promastigotları, daha önce 23 yapılan L. majör büyüme eğrisi tahlilleri ile belirlendiği gibi, log fazına (2-8 x 106 hücre / mL) ulaşana kadar tam M199 orta22'de yetiştirin. Sitotoksisite için her bir kuyucuk için 1 x 10 5 hücre, artı boyama kontrolü için5 x 105 hücre planlayın. Batı lekesi için, kuyu başına 2 x 107 hücre planlayın.
NOT: İki teknik replikasyonla sitotoksisite testi yapın. - Uygun hücre yoğunluğunu doğrulamak için, eşit miktarda fiksatif (1x PBS'de% 3.7 paraformaldehit) ile promastigotların bir alikotunu (10-40 μL) karıştırın. Sabit numunenin 10 μL'sini hemasitometrenin her iki tarafına yükleyin.
DİKKAT: Formaldehit toksik bir kimyasaldır. Tehlikeli kimyasallar için kurumsal politikalara uygun olarak kullanın. - 20x büyütmede mikroskop kullanarak hücre sayımı yapın. Hemasitometrenin ortasındaki 25 küçük karedeki tüm hücreleri sayın. Her iki taraftaki kareler için tekrarlayın ve sayımların ortalamasını alın.
NOT: Sayımlar arasındaki fark >10 ise, yeniden sayım ve ortalama. Ortalama sayım <10 veya >100 ise, seyreltmeyi değiştirin ve yeniden sayım yapın ve ardından aşağıdaki formülü kullanarak kültür yoğunluğunu hesaplayın: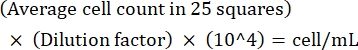 (Eq 1)
(Eq 1)
Örneğin, 25 karede ortalama 250 Leishmania varsa, kültür yoğunluğu 5 x 106 hücre / mL'dir. - Saydıktan sonra, 5 x 106 hücreyi 15 mL'lik bir konik tüpe aktarın ve hücreleri peletlemek için oda sıcaklığında 8 dakika boyunca 1.500 x g'de santrifüj yapın.
- 10 mL'lik bir pipet kullanarak süpernatantı atın ve hücre peletini kısaca vorteksleyin. Aynı tüpe 5 mL 1x PBS ekleyin ve 3-6x'i hafifçe ters çevirerek hücreleri yıkayın. Hücreleri peletlemek için oda sıcaklığında 8 dakika boyunca 1.500 x g'de santrifüj yapın.
- Süpernatantı 10 mL'lik bir pipet kullanarak atın ve 5 x 10 6 hücreli peleti, 1 x 106 hücre/mL'lik bir nihai konsantrasyon vermek için 5 mL'lik bir pipetle yapılan deneyler için kullanılan 5 mL ortamda (örneğin, M199 veya 1x Tyrode tamponu) yeniden askıya alın.
2. Sitotoksisite testi
- Deneysel hazırlık
- Toksini daha önce tarif edildiği gibi arındırın24 veya toksini bir satıcıdan satın alın. Aliquot tek kullanımlık alikotlara dönüştürülür ve 1 yıla kadar -80 ° C'de saklanır. Birden fazla donma-çözülme döngüsünden kaçının.
- İnsan kırmızı kan hücrelerini kullanarak her toksin için hemolitik aktiviteyi belirleyin (bakınız Malzeme Tablosu)24.
NOT: Hemolitik aktivite kullanılır, çünkü saflaştırma, mutasyonlar vb. nedeniyle aktivitedeki farklılıkları kontrol eder. Eritrositlerin tür seçimi hemolitik aktiviteyi değiştirebilir (örneğin; intermedilysin insan kırmızı kan hücrelerini gerektirir). - Her durum için iki teknik replikasyon, doz-yanıt eğrisi için yedi seyreltme ve toksin içermeyen bir kontrol planlayın.
NOT: Vahşi tip (WT), spt2- ve spt2-/+SPT2 promastigotları ile, bir V-dip 96 delikli plakada iki tedavi test edilebilir. Örneğin, medyaya duyarlılık karşılaştırılabilir (Şekil 1). V-alt plaka yerine, 1.2 mL mikrotitre tüpleri (bakınız Malzeme Tablosu) kullanılabilir. Sitometredeki edinme süreleri nedeniyle, aynı anda birden fazla plaka çalıştırılması önerilmez. - Gerekli test koşullarına ve deneyin amacına bağlı olarak hangi tahlil tamponunun kullanılacağını belirleyin.
NOT: Bu örnekte, iki tahlil tamponu karşılaştırılmıştır: M199 ve Tyrode'un tamponu, canlılık boyası propidium iyodür (PI) ile desteklenmiştir. Serumdaki kolesterol CDC aktivitesine müdahale edecektir24. - Tedavi edilen genotiplerin koşullarına ve sayısına bağlı olarak ihtiyaç duyulan toksin miktarını hesaplayın. %50 spesifik lizisin seyreltme eğrisinin yarısına kadar indiğinden emin olun.
NOT: CDC'ler için, iki katlı seri seyreltme, daha sonraki lojistik modelleme için iyi bir aralık sağlayacaktır. Spt2- promastigotlar için 4.000 HU/mL SLO önerilen başlangıç seyreltmesidir. Aktif olmayan toksinlerin kullanıldığı yerlerde, bunun yerine en yüksek doza eşdeğer bir kütle kullanılabilir. - Kuyu başına 200 μL'lik bir son hacim planlayın ve pipet hatasını hesaba katmak için küçük bir hacim ekstrası (50-100 μL) ekleyin.
NOT: Her biri çift olarak yapılan üç genotipte, seri seyreltme için altı örnek olacaktır. - Aşağıdaki formülü kullanarak gereken toplam toksin miktarını belirleyin:
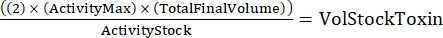 (Eq 2)
(Eq 2)
ActivityMax'in kullanılan en yüksek konsantrasyon olduğu durumlarda (HU / mL); TotalFinalVolume toplam hacimdir (altı örnek için, 200 x 6 + 100 = 1.300 μL); ActivityStock, toksin stoğunun (HU/mL) aktivitesidir; ve VolStockToxin, ihtiyaç duyulan toksin stoğunun hacmidir. - Deney için gereken yeterli tahlil arabelleğini hazırlayın. Bazal ortamı bir canlılık boyası ve Ca 2+ seviyelerini kontrol etmek için gereken herhangi bir Ca2+ veya EGTA iledestekleyin . Karıştırmak için vorteks.
NOT: Örneğin, her 10 mL Tirod tamponu için, sırasıyla 10 μg / mL ve 2 mM'lik nihai konsantrasyonlar vererek, 50 μL 2 mg / mL PI ve200 μL 100 mM CaCl 2 ekleyin. - Canlılık boya PI'nin, Cy5 veya AlexaFluor647-konjuge toksinler20,25 kullanan floresan bağlama testleri gibi kullanılan diğer problarla çakışmadığından emin olun.
- 2x toksin çözeltisi yapmak için toksin seyreltmelerini planlayın. 1,5 mL santrifüj tüplerine tahlil tamponu ekleyin ve buz üzerinde soğutun. Toksini sadece tahlil başlamadan hemen önce ekleyin.
NOT: Bu örnekte, üst seyreltme için 1,3 mL tahlil tamponu eklenecek ve 2x toksin çözeltisini hazırlamak üzere seri seyreltmeler için 650 μL eklenecektir.
- Deney
- Adım 1.8'den itibaren 0,5 mL işlenmiş promastigotları ayrı bir tüpte "Lekesiz kontrol" olarak ayırın.
NOT: Bu örnek, akış sitometresinde geçit ayarlamak için kullanılacaktır. - Kalan promastigotlara 10 μg / mL'lik son konsantrasyona 2 mg / mL PI ekleyin. 3 s. için vorteks.
NOT: İşlenen promastigotlara PI eklendikten sonra, bu hücreler sadece 2.5 saatlik bir süre boyunca kullanılabilir. 2.5 saat sonra, hücreler ölmeye başlar ve sonuçlar hatalı hale gelir. - V tabanlı 96 kuyucuklu plakanın veya 1,2 mL mikrotitre tüplerinin her bir kuyucuğuna 1 x 105 (100 μL/kuyucuk içinde) işlenmiş promastigotlar ekleyin (Şekil 1). Plakayı veya tüp rafını, görüntülemeden yaklaşık 45° açıyla buzun üzerine yerleştirin. Leishmania promastigotlarını kullanırken işi bir biyogüvenlik kabininde gerçekleştirin.
- Her toksinsiz kontrole (son sıra) PI ile 100 μL tahlil tamponu ekleyin. Renkli olarak daha koyu görünen toplam hacmi 200 μL olan tüpleri görsel olarak tanımlayarak kontrolün doğru şekilde eklendiğini doğrulayın.
- Toksin alikotlarını -80 ° C'den çıkarın, buz üzerinde çözün ve gerektiğinde havuzlayın. Adım 2.1.5'te hesaplanan toksin hacmini en yüksek seyreltmeye ekleyin (adım 2.1.10'da hazırlanır). Ardından, toksini seri olarak seyreltin (Şekil 1). Pipet, karıştırmayı sağlamak için en az 8 kat yukarı ve aşağı pinet.
NOT: CDC'ler oda sıcaklığında hızla inaktive olduğu için buz üzerinde çalışın. - En düşük toksin konsantrasyonundan başlayarak, doğru sıraya hızlı bir şekilde 100 μL toksin ekleyin (Şekil 1 ve Şekil 2) ve tüm toksin hücrelere eklenene kadar devam edin.
- Plakayı sızdırmazlık bandı ile kapatın. 30 dakika boyunca 37 ° C'de inkübe edin. Kuluçka döneminden sonra, plakayı paketleyin ve akış sitometresine taşıyın.
- Adım 1.8'den itibaren 0,5 mL işlenmiş promastigotları ayrı bir tüpte "Lekesiz kontrol" olarak ayırın.
- Veri toplama
- Akış sitometresini (bkz. Malzeme Tablosu) ve satın alma yazılımını üreticinin talimatlarına göre ve tesis politikasına göre ayarlayın. Sitometre üzerinde önceden eğitim almadan akış sitometrisi prosedürünü uygulamayın.
NOT: Bu örnekte, 4 lazerli Attune NxT kullanılmıştır. PI, YL-1 kanalında toplandı (561 nm lazer tarafından uyarıldı, 577 LP'den geçirildi, 600 DLP'den yansıtıldı ve 585/16 bandpass'tan filtrelendi), ancak PI'nin geniş spektrumu diğer kanallarda toplanmaya izin verdi. - Lekesiz L. majör promastigot numunesini kullanarak, ileri ve yan saçılma için kapıları ve seçilen boyalara göre ilk floresan parametrelerini ayarlayın.
- Otofloresansı kontrol etmek için nokta grafikleri için istenirse ekstra bir parametre ekleyin (örneğin, "leke yok") (Şekil 3).
NOT: Bu örnekte, BL-1 kanalı (488 nm lazer tarafından uyarılmış, 495 DLP ve 503 LP'den geçirilmiş, 555 DLP'den yansıtılmış ve 530/30 bant geçişi ile filtrelenmiş) kullanılmıştır. - Tek lekeli kontrolleri kullanarak, canlılık boyası (bu çalışmada PI) ve floresan olarak etiketlenmiş toksinler için kapıları ayarlayın. Mikro tıkanmalar için zamana karşı ileri saçılımı izleyin.
NOT: PI, lekesiz kontrollerin üzerindeki tüm hücreleri loş bir şekilde boyayacaktır. Ölü hücreler, popülasyonlar arasında geçici olarak geçirgen hale getirilmiş hücrelerle kolayca ayrılabilecektir. - Sitometredeki her örnek için >10.000 kapılı olay elde edin.
NOT: En hassastan en az hassasa doğru okunması önerilir, ancak okuma sırasının numune sonuçları üzerindeki etkisini belirlemek için edinme sırası tersine çevrilebilir. - Verileri kaydedin ve analiz için gerektiği gibi dışa aktarın.
- Akış sitometresini (bkz. Malzeme Tablosu) ve satın alma yazılımını üreticinin talimatlarına göre ve tesis politikasına göre ayarlayın. Sitometre üzerinde önceden eğitim almadan akış sitometrisi prosedürünü uygulamayın.
- Veri analizi
NOT: Bu çalışmada, Çözücü eklentili Excel (bkz. Malzeme Tablosu) veri analizi için kullanılmıştır (bkz. Ek Dosya 1).- Kapı toplamı, tek hücreli L. majör promastigotlar ileri ve yan saçılma ve gerektiğinde zaman üzerinde geçiş yaparak (Şekil 3). Akış sitometresi için önerilen yükseklik veya alanı kullanın.
NOT: Burada kullanılan akış sitometresi için, alan yerine yükseklik önerilen parametredir. - Ölü hücreleri "PI yüksek" olarak tanımlayın ve kapılayın. Ara hücreleri "PI düşük" olarak kapatın. PI yüksek hücreler ölü hücreler iken, PI düşük hücreler geçici olarak geçirgenleştirilir26.
NOT: PI yüksek hücreleri tipik olarak negatif hücrelerden 2-3 günlük bir kayma gösterir. - Verileri Excel'e verin. Öldürmeyi belirlemek için örnek adı/kimliği ve %PI yüksekliğini edinin.
NOT: Floresan toksinler kullanılmışsa, canlı, geçici geçirgenleştirilmiş ve negatif popülasyonların medyan floresan yoğunluğuna (MFI) ihtiyaç duyulacaktır. Geçici geçirgenlik için %PI düşük ihraç edilebilir. - İki teknik çoğaltma arasındaki her koşul için ortalama %PI yüksekliğini belirleyin.
NOT: Floresan toksinler için ortalama MFI gerekiyorsa, bunu da hesaplayın. - Aşağıdaki formülü24,25 kullanarak %PI yüksekliğinden %Specific Lysis değerini hesaplayın:
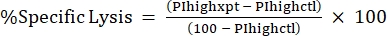 (Eq 3)
(Eq 3)
PIhighxpt'nin deneysel durum için %PI yüksek olduğu; ve PIhighctl, toksin kontrolü için %PI yüksekliğindedir. - Doz-yanıt eğrisi için toksin konsantrasyonuna karşı %Spesifik Lizis grafiği (Şekil 4).
- Lojistik modelleme için Excel'de doz-yanıt eğrisini düzenleyin. Toksin konsantrasyonu ve ortalama %Spesifik Lizis, deneysel detaylar ve/veya ham %PI yüksek hesaplamalar ile birlikte dahil edilir (Tablo 2).
- Çözücü eklentisinin etkin olduğunu doğrulayın.
Not: Excel'in masaüstü sürümünde Çözücü'yü etkinleştirmek için Dosya > Seçenekleri > eklentileri'ne gidin ve Çözücü kutusunu işaretleyin. Excel'i yeniden başlatın. - Dört sütunu daha "modellenmiş", "artıklar", "parametreler" ve "parametre değerleri" olarak etiketleyin. İlk sütunların deneysel parametrelere, toksin konsantrasyonuna ve %Spesifik Lizise karşılık geldiğini doğrulayın (Tablo 2).
- "Parametreler" sütununa şu parametreleri ekleyin: L, k, c, SUM ve LC50. "Parametre değerleri" sütununa şu değerleri girerek L, k ve c parametrelerini başlatın: 100, 0,05, 1.000.
- "Modellenmiş" sütununda, aşağıdaki formülü kullanarak lojistik modeli oluşturun:
 (Eq 4)
(Eq 4)
L, k ve c'yi "parametre değerleri" sütununda bu parametreleri içeren hücrelere ayarlayın.
X'i toksin konsantrasyonunu içeren hücreye ayarlayın.
NOT: Tablo 2, G4 hücresi için formül aşağıdaki gibidir: =$J$3/(1+EXP(-$J$4*(D4-$J$5))) - Bu denklemi, toksin kontrolü dışındaki tüm %Specific Lysis değerlerine uygulayın.
- "Artıklar" sütununda, aşağıdaki denklemi kullanarak modellenen sayı ile gerçek spesifik lizis arasındaki farkın karesini hesaplayın:
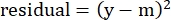 (Ek. 5)
(Ek. 5)
burada y, deneysel %Spesifik Lizis'tir; ve m, 2.4.10-2.4.11 adımlarında hesaplanan "modellenmiş" sütundaki karşılık gelen değerdir. - "SUM" öğesinin yanındaki "parametre değerleri" sütununda, artıklar sütunundaki tüm değerleri toplayın.
- "LC50" nin yanındaki "parametre değerleri" sütununda, LC50'yi belirlenen değerlerden hesaplamak için denklemi başlatın. Bu, m = 50 olduğunda x için Eq 4'ü çözüyor.
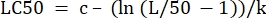 (Eq 6)
(Eq 6)
Tablo 2 için Excel formülü aşağıdaki gibidir: =J5-(LN(J3/(50)-1))/J4 - Veri sekmesinden Çözücü'yü açın. Hesaplanan artıkların toplamını içeren hücre olması için Set Target'ı seçin. Min olarak ayarlayın.
- L, k ve c parametre değerleri için değişken hücrelerini değiştirin.
NOT: "Kısıtlanmamış Değişkenleri Negatif Olmayan Yap" seçeneği işaretli bırakılırsa çözücü daha iyi davranabilir. - Negatif k değerleri için, k'yi pozitife değiştirmek için k'den -1'i hesaba katarak Eq 4 ve Eq 6'yı değiştirin. GRG Doğrusal olmayan çözme yöntemini kullanın. Çöz'ü tıklayın.
- Eğriyi kontrol edin ve LC50'nin Eq 6 kullanılarak otomatik olarak hesaplandığını kontrol edin (Tablo 2). Hem %Specific lizis hem de toksin konsantrasyonuna karşı modellemeyi grafiksel olarak çizerek uyumu doğrulayın.
NOT: Eğri için R2 hesaplanarak da kontrol edilebilir.
- Kapı toplamı, tek hücreli L. majör promastigotlar ileri ve yan saçılma ve gerektiğinde zaman üzerinde geçiş yaparak (Şekil 3). Akış sitometresi için önerilen yükseklik veya alanı kullanın.
3. Toksine meydan okuyan L. majör promastigotların protein analizi
- Bölüm 1'de açıklandığı gibi L. majör promastigotları hazırlayın.
- 2 x 107 WT, spt2- ve spt2-/+SPT2 L. majör promastigotları, 5 mL'lik bir pipet (örneğin, serumsuz M199) kullanarak istenen tahlil tamponunun 2 mL'sinde yeniden askıya alın. Son bir sublitik konsantrasyona toksin ekleyin ve 30 dakika boyunca 37 ° C'de inkübe edin.
NOT: Örneğin, spt2- promastigotlar için bir sublitik SLO dozu 500 HU / mL'dir. - Diğer genotipleri ve toksinsiz kontrolleri dahil edin.
- Hücreleri peletlemek için promastigotları 10 dakika boyunca 1.500 x g'de santrifüj yapın. Süpernatantı 10 mL'lik bir pipet kullanarak atın. Hücre peletini parçalamak için hücre peletini içeren kapalı tüpü, biyogüvenlik kabininin ızgarası gibi düzensiz bir yüzey boyunca üç kez hızlı bir şekilde çalıştırın.
NOT: Hücre peleti çıplak gözle neredeyse görünmezdir. - Kullanımdan hemen önce 2-merkaptoetanol ile 1x SDS-PAGE numune tamponunu yeniden oluşturun ve hücre peletine eklenmeden önce 10 dakika boyunca 95 ° C'ye ısıtın. Hücre peletini sıcak 1x SDS-PAGE numune tamponunda yeniden askıya alın ve yukarı ve aşağı pipetleyerek, iyice karıştırın. Yeniden askıya alınmış hücre peletini 10 dakika boyunca 95 °C'de 1x numune tamponunda ısıtın.
NOT: Numune tamponunda çözündürme işleminden sonra, gerekirse numuneleri -20 °C'de uzun süreli olarak saklayın. - Çözücü jeli hazırlayın. Amonyum persülfat (APS) ve TEMED dışındaki tüm bileşenleri 15 dakika boyunca gazdan arındırın.
- Jeli dökmeden hemen önce APS ve TEMED'i ekleyin. Çözücü jeli suyla dikkatlice örtün. Çözünen jelin polimerize olmasına izin verin, ~ 30-45 dakika.
- Suyu boşaltın ve istifleme jelini hazırlayın. İstifleme jelini ekleyin, kabarcıkları önlemeye özen gösterin. İlgili sayıda kuyucuk içeren bir tarak yerleştirin ve 5 dakika boyunca polimerize olmasına izin verin. Artık istifleme jeli kullanarak polimerizasyonu izleyin.
- SDS-PAGE'i çalıştırmak için jeli monte edin ve hazneye rezervuar tamponu ekleyin.
- Kuyucuk başına her numunenin 10 μL'sini veya protein merdiveninin 8 μL'sini yükleyin. Numuneler çözme jeline girene kadar 180 V'ta çalıştırın ve ardından voltajı ~ 160 V'a düşürün ve boya cephesi plakanın kenarından ~ 0,5 cm olana kadar çalıştırın.
NOT: Numunelerin dibe ulaşması için gereken süre 1-1,5 saat arasında değişebilir. Voltaj düşürülerek süre uzatılabilir. Voltajı asla sıfıra indirmeyin. Daha yüksek voltajlar jelin "gülümsemesini" artırabilir ve plakaları çatlatabilir. - Jeli Coomassie boyasına (protein boyama için) veya 1x transfer tamponuna (batı lekelenmesi için) aktarın. Coomassie boyama için, gece boyunca lekeleyin ve sonra boyama, görüntü ve kurutma.
- Batı lekesi için, transfer sistemini üreticinin talimatlarına göre hazırlayın.
- Islak transfer için soğuk 1x transfer tamponu ve ıslak öncesi pedler, filtre kağıdı ve nitroselüloz kullanın. Burada kullanılan Bio-rad Protean III sistemi için (bakınız Malzeme Tablosu) filtre kağıdı 10 cm x 7,5 cm boyutlarında kesilebilir. Nitroselülozu 9 cm x 6.75 cm'ye kesin.
NOT: Nitroselüloz oldukça yanıcıdır. Açık alevlerden ve diğer potansiyel tutuşma kaynaklarından kaçının. - Transfer kasetini pedler, filtre kağıdı ve nitroselüloz ile yerleştirin. Hava kabarcıklarını açın. Jeli dikkatlice ekleyin.
- Filtre kağıdını ekleyin ve hava kabarcıklarını sürün. Pedi ekleyin, kaseti kapatın ve tutucuya doğru yönde yerleştirin (nitroselülozun kırmızı terminale baktığından emin olun). Yan tarafa bir karıştırma çubuğu ve bir buz torbası ekleyin ve rezervuarı soğuk 1x transfer tamponu ile doldurun. 90 dakika boyunca 110 V'ta aktarın.
NOT: Transfer sırasında oluşan ısı, transferi olumsuz yönde etkileyebilir. İyi bir aktarım sağlamak için her zaman soğuk 1x aktarım arabelleği kullanın. - Nitroselülozu çıkarın ve ~ 5 dakika boyunca Ponceau çözeltisi ile lekeleyin. Ultra saf su ile durulayın. Protein merdivenini kurşun kalemle işaretleyin ve lekeyi gerektiği gibi kesin. Artık aktarım arabelleğini kullanarak lekeyi temizleyin.
NOT: Ponceau birçok kez yeniden kullanılabilir. - Nitroselülozu 25 mL% 5 BSA'da 4 ° C'de 1x TBST'de, gece boyunca çalkalayarak bloke edin. Daha sonra, bloke edici çözeltiyi atın ve 1x TBST'de% 1 BSA'da birincil antikor (1: 1.000) ekleyin. Gece boyunca 4 °C'de çalkalayın.
NOT: Birincil antikor -20 ° C'de kaydedilebilir ve birkaç kez tekrar kullanılabilir. - Nitroselülozu 3x'i 1x TBST'de her biri 10 dakika boyunca çalkalayarak yıkayın. Yıkamayı atın ve 1x TBST'de% 1 BSA'da 10 mL HRP konjuge sekonder antikor (1: 10.000) ekleyin. Oda sıcaklığında 1 saat çalkalayın. Nitroselülozu 3x'i 1x TBST'de her biri 10 dakika boyunca çalkalayarak yıkayın.
- Nitroselülozu görüntülemeden hemen önce ECL reaktifini hazırlayın. Görüntülemeden hemen önce, TBST'yi boşaltın ve ECL reaktifini nitroselüloza ekleyin. 1 dakika çalkalayın. Jeli görüntüleyin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Tyrode tamponunda SLO'ya karşı promastigot hassasiyetinin M199'a kıyasla artması
L. majör promastigotların SLO duyarlılığı farklı tahlil tamponları arasında karşılaştırıldı. Vahşi tip, spt2- ve spt2-/+SPT2 promastigotları, bir akış sitometresinde analizden önce 30 dakika boyunca serumsuz M199 veya Tyrode tamponunda SLO ile 30dakika boyunca zorlandı. Analiz için uygun parazitler ileri/yan saçılma profilleri ile tan?...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu çalışmada, PFT'lerin moleküler mekanizmalarını ve fonksiyonlarını incelemek için kullanılan yöntemler, insan patojeni Leishmania major'u model bir sistem olarak kullanarak tanımlanmıştır. Tek hücreli canlılığı ölçmek için orta verimli bir akış sitometrisi tabanlı sitotoksisite testi geliştirilmiştir. LC50 değerleri lojistik modelleme kullanılarak doz-yanıt eğrisinden hesaplanabildiğinden, canlılık popülasyon düzeyinde nicelikseldir. Bir ilke kanıtı olarak, ort...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Bu çalışma, Ulusal Sağlık Enstitüleri Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü, PAK ve KZ'ye (co-I) R21AI156225 ve KZ'ye (co-I) R01AI139198 hibe verdi. CH, bu çalışma sırasında sağlanan Öğretim Asistanlığı için Biyolojik Bilimler Bölümü'ne teşekkür etmek ister.
Finansman kuruluşlarının çalışmanın tasarımında hiçbir rolü yoktu; verilerin toplanmasında, analizinde veya yorumlanmasında; yazının yazımında; ne de sonuçların yayınlanması kararında. İçerik yalnızca yazarların sorumluluğundadır ve finansman kuruluşlarının resmi görüşlerini temsil etmek zorunda değildir. Yazarlar, rakip çıkar çatışmaları olmadığını beyan ederler.
Teşekkürler
Yazarlar, Keyel ve Zhang laboratuvarlarının üyelerine makaleyi eleştirel incelemeleri için teşekkür eder. Yazarlar, tesislerin kullanımı için Sanat ve Bilim Koleji Mikroskopisine teşekkür eder.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.2 mL microtiter (Marsh) tubes | Fisher | 02-681-376 | Cytotoxicity assay |
| 1.5 mL microcentrifuge tube | Fisher | 05-408-129 | Toxin dilutions |
| 15 mL centrifuge tube | Avantor VWR (Radnor, PA) | 89039-666 | To hold cells and media |
| 1x Phosphate buffered saline (PBS) | Fisher | BP399 | For cell processing |
| 3% H2O2 | Walmart (Fayetteville, AR) | N/A | For ECL |
| 5x M199 | Cell-gro | 11150067 | Basal growth media for L. major promastigotes |
| Biosafety cabinet | Baker | To culture cells in sterile conditions | |
| Bovine serum albumin (BSA) | Fisher | BP1605-100 | Fraction V acceptable purity |
| CaCl2 | Fisher | BP510-100 | Stock concentration 100 mM |
| Centrifuge | Thermo Fisher | Heraeus Megafuge 40R | To pellet the cells from culture |
| Cy5 Mono-reactive dye pack | Cytiva (Marlborough, MA) | PA25031 | Fluorophore label for toxins |
| Digital dry bath | Benchmark | BSH1002 | To denature protein samples |
| EGTA | Amresco | 0732-100G | Stock concentration 0.5 M |
| Excel | Microsoft (Redmond, VA) | Data analysis software | |
| Flow cytometer (4-laser Attune NxT) | Fisher | Cytometer for data acquisition | |
| FlowJo | BD (Ashland, OR) | Software | |
| Formaldehyde | Fisher | BP531-500 | Fixative for counting cells |
| G418 | Fisher | BP673-1 | Selection agent for cells |
| Hellmanex III | Sigma | Z805939 | Dilute 1:4 for cleaning cytometer |
| Hemacytometer | Fisher | 0267151B | For counting cells |
| Human red blood cells | Zen-bio (Durham, NC) | SER-10MLRBC | To validate toxin activity |
| Ice bucket | |||
| Light microscope | Nikon | Eclipse 55i | To visualize cells |
| Nitrocellulose | Fisher | 88018 | For probing proteins via antibodies |
| Pipettors and tips | Avantor VWR | To dispense reagents | |
| Power supply | Bio-Rad | To run SDS-PAGE and transfers | |
| Propidium iodide | Biotium | 40016 | Stock concentration 2 mg/mL in water |
| Protein ladder | Bio-Rad | 161-0373 | To determine molecular weight of proteins |
| SDS-PAGE Running Apparatus (Mini Protean III) | Bio-Rad | 165-3302 | To separate proteins based on their size |
| Sealing tape | R&D | DY992 | To seal plates with cells |
| Streptolysin O C530A plasmid insert | Cloned into pBAD-gIII vector (Reference: 7) | ||
| Streptolysin O C530A toxin | Lab purified | Specific activity 4.34 x 105 HU/mg | |
| Swinging bucket rotor | Thermo Fisher | 75003607 | To centrifuge cells |
| V-bottom plate | Greiner Bio-one | 651206 | For cytotoxicity assay |
| Vortex | Benchmark | BV1000 | To mix cells |
| Western blot imaging system (Chemi-doc) | Bio-Rad | To visualize proteins by western blot | |
| Western Blot Transfer Apparatus (Mini Protean III) | Bio-Rad | 170-3930 | Transfer proteins to nitrocellulose |
| Whatman Filter paper | GE Healthcare Life Sciences | 3030-700 | Used in transfer of proteins to nitrocellulose |
| Antibody | |||
| Anti-ERK antibody | Cell Signaling Technologies | Cat# 9102S | Rabbit (1:1000 dilution) |
| Anti-lipophosphoglycan (LPG) antibody | CreativeBioLabs | Cat# WIC79.3 | Mouse (1: 1000) |
| Anti-MEK antibody | Cell Signaling Technologies | Cat# 9122L | Rabbit (1:1000) |
| Anti-mouse IgG, HRP conjugate | Jackson Immunoresearch | Cat#715-035-151 | Donkey (1:10000) |
| Anti-phosphoERK antibody | Cell Signaling Technologies | Cat# 9101S | Rabbit (1:1000) |
| Anti-pMEK antibody | Cell Signaling Technologies | Cat# 9121S | Rabbit (1:1000) |
| Anti-rabbit IgG, HRP conjugate | Jackson Immunoresearch | Cat#711-035-152 | Donkey (1:10000) |
| Anti-tubulin antibody | Sigma | Cat# T5168 | Mouse (1: 2000) |
| Leishmania major Genotypes | Reference: 13 | ||
| Episomal addback (spt2-/+SPT2) | Δspt2::HYG/Δspt2:PAC/+pXG-SPT2 | ||
| Serine palmitoyltransferase subunit 2 knockout (spt2-) | Δspt2::HYG/Δspt2::PAC | ||
| Wild type (WT) | LV39 clone 5 (Rho/SU/59/P) |
Referanslar
- Thapa, R., Ray, S., Keyel, P. A. Interaction of macrophages and cholesterol-dependent cytolysins: The impact on immune response and cellular survival. Toxins. 12 (9), 531(2020).
- Limbago, B., Penumalli, V., Weinrick, B., Scott, J. R. Role of streptolysin O in a mouse model of invasive group A streptococcal disease. Infection & Immunity. 68 (11), 6384-6390 (2000).
- Farrand, A. J., et al. The cholesterol-dependent cytolysin membrane-binding interface discriminates lipid environments of cholesterol to support beta-barrel pore insertion. Journal of Biological Chemistry. 290 (29), 17733-17744 (2015).
- Soltani, C. E., Hotze, E. M., Johnson, A. E., Tweten, R. K. Structural elements of the cholesterol-dependent cytolysins that are responsible for their cholesterol-sensitive membrane interactions. Proceedings of the National Academy of Sciences of the United States of America. 104 (51), 20226-20231 (2007).
- Schoenauer, R., et al. Down-regulation of acid sphingomyelinase and neutral sphingomyelinase-2 inversely determines the cellular resistance to plasmalemmal injury by pore-forming toxins. FASEB Journal. 33 (1), 275-285 (2019).
- Ray, S., Roth, R., Keyel, P. A. Membrane repair triggered by cholesterol-dependent cytolysins is activated by mixed lineage kinases and MEK. Science Advances. 8 (11), (2022).
- Babiychuk, E. B., Monastyrskaya, K., Draeger, A. Fluorescent annexin A1 reveals dynamics of ceramide platforms in living cells. Traffic. 9 (10), 1757-1775 (2008).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136(2014).
- Demonbreun, A. R., et al. An actin-dependent annexin complex mediates plasma membrane repair in muscle. Journal of Cell Biology. 213 (6), 705-718 (2016).
- Wolfmeier, H., et al. Ca(2)(+)-dependent repair of pneumolysin pores: A new paradigm for host cellular defense against bacterial pore-forming toxins. Biochimica et Biophysica Acta. 1853 (2), 2045-2054 (2015).
- Bravo, F., Sanchez, M. R. New and re-emerging cutaneous infectious diseases in Latin America and other geographic areas. Dermatologic Clinics. 21 (4), 655-668 (2003).
- Manfredi, M., Iuliano, S. Cutaneous leishmaniasis with long duration and bleeding ulcer. Clinical Microbiology Open Access. 05, 2-6 (2016).
- Zhang, K., et al. Sphingolipids are essential for differentiation but not growth in Leishmania. EMBO Journal. 22 (22), 6016-6026 (2003).
- Zhang, K. Balancing de novo synthesis and salvage of lipids by Leishmania amastigotes. Current Opinions in Microbiology. 63, 98-103 (2021).
- Kaur, P., Goyal, N. Pathogenic role of mitogen activated protein kinases in protozoan parasites. Biochimie. 193, 78-89 (2022).
- Wiese, M. Leishmania MAP kinases--Familiar proteins in an unusual context. International Journal of Parasitology. 37 (10), 1053-1062 (2007).
- Brumlik, M. J., Pandeswara, S., Ludwig, S. M., Murthy, K., Curiel, T. J. Parasite mitogen-activated protein kinases as drug discovery targets to treat human protozoan pathogens. Journal of Signal Transduction. 2011, 971968(2011).
- Wiese, M., Kuhn, D., Grunfelder, C. G. Protein kinase involved in flagellar-length control. Eukaryotic Cell. 2 (4), 769-777 (2003).
- Agron, P. G., Reed, S. L., Engel, J. N. An essential, putative MEK kinase of Leishmania major. Molecular Biochemistry of Parasitology. 142 (1), 121-125 (2005).
- Ray, S., Thapa, R., Keyel, P. A. Multiple parameters beyond lipid binding affinity drive cytotoxicity of cholesterol-dependent cytolysins. Toxins. 11 (1), (2018).
- Beneke, T., et al. A CRISPR Cas9 high-throughput genome editing toolkit for kinetoplastids. Royal Society Open Science. 4 (5), 170095(2017).
- Kapler, G. M., Coburn, C. M., Beverley, S. M. Stable transfection of the human parasite Leishmania major delineates a 30-kilobase region sufficient for extrachromosomal replication and expression. Molecular and Cellular Biology. 10 (3), 1084-1094 (1990).
- Moitra, S., Pawlowic, M. C., Hsu, F. F., Zhang, K. Phosphatidylcholine synthesis through cholinephosphate cytidylyltransferase is dispensable in Leishmania major. Scientific Reports. 9, 7602(2019).
- Keyel, P. A., Heid, M. E., Watkins, S. C., Salter, R. D. Visualization of bacterial toxin induced responses using live cell fluorescence microscopy. Journal of Visualized Experiments. (68), 4227(2012).
- Romero, M., et al. Intrinsic repair protects cells from pore-forming toxins by microvesicle shedding. Cell Death & Differentiation. 24 (5), 798-808 (2017).
- Keyel, P. A., et al. Streptolysin O clearance through sequestration into blebs that bud passively from the plasma membrane. Journal of Cell Science. 124, 2414-2423 (2011).
- Dong, Z., Patel, Y., Saikumar, P., Weinberg, J. M., Venkatachalam, M. A. Development of porous defects in plasma membranes of adenosine triphosphate-depleted Madin-Darby canine kidney cells and its inhibition by glycine. Laboratory Investigations. 78 (6), 657-668 (1998).
- Loomis, W. P., den Hartigh, A. B., Cookson, B. T., Fink, S. L. Diverse small molecules prevent macrophage lysis during pyroptosis. Cell Death & Disease. 10 (4), 326(2019).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır