このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
リーシュマニアメジャーを用いた細孔形成毒素の分子機構と機能の解明
要約
ここに提示されるのは、孔形成毒素によって誘導される結合、細胞毒性、およびシグナル伝達を決定するために リーシュマニアの主要な 前鞭毛虫を使用するプロトコルです。ストレプトリジンOの概念実証が提供されます。他の毒素を使用して、 L.メジャー で利用可能な遺伝子変異体を活用して、毒素耐性の新しいメカニズムを定義することもできます。
要約
細胞はPFTによって引き起こされる膜損傷に抵抗するため、孔形成毒素(PFT)の機能とメカニズムを理解することは困難です。生物物理学的アプローチは細孔形成を理解するのに役立ちますが、膜脂質とタンパク質の完全な補体がない還元主義的アプローチに依存することがよくあります。培養ヒト細胞は代替システムを提供しますが、修復メカニズムの複雑さと冗長性により、特定のメカニズムを特定することは困難です。対照的に、皮膚リーシュマニア症の原因となるヒト原虫病原体である リーシュマニアメジャーは、複雑さと生理学的関連性の間の最適なバランスを提供します。 L. major は遺伝的に扱いやすく、 in vitroで高密度に培養することができ、感染に対する摂動の影響は、確立されたマウスモデルで測定できます。さらに、 L. major は哺乳類の対応するものとは異なる脂質を合成し、膜動態を変化させる可能性があります。膜動態におけるこれらの変化は、最も特徴付けられた毒素ファミリーであるコレステロール依存性サイトライシン(CDC)のPFTで調べることができます。CDCは リーシュマニア 膜のエルゴステロールに結合し、 L.メジャー 前鞭虫を殺すことができ、 L.メジャー がPFT機能の細胞および分子メカニズムを決定するための適切なモデルシステムであることを示しています。この研究では、寄生虫培養、脂質感受性を評価するための遺伝的ツール、膜結合アッセイ、および細胞死アッセイを含む、 L.主要な 前鞭毛虫のPFT機能を試験する方法について説明しています。これらのアッセイにより、進化的に多様な生物の範囲にわたるPFT機能および脂質組織の共通性を理解するための強力なモデルシステムとして L.メジャー を迅速に使用できるようになります。
概要
孔形成毒素(PFT)は細菌毒素の最大のファミリーですが1、それらが細胞を穿孔して破壊するメカニズムはよくわかっていません。最もよく研究されている細孔形成毒素のファミリーは、コレステロール依存性サイトライシン(CDC)のファミリーです。CDCは主に、壊死性筋膜炎の原因物質である化膿レンサ球菌2を含むグラム陽性菌によって合成されます。化膿菌はCDCストレプトリジンO(SLO)を分泌し、宿主細胞の原形質膜のステロールにモノマーとして結合し、オリゴマー化し、膜1に~20-30 nmの細孔を挿入します。このプロセスで脂質が果たす役割は、十分に決定されていないままです。
脂質-CDC相互作用を研究するための1つのアプローチは、化学的に定義されたリポソームの使用である。定義されたリポソームは、毒素結合と細孔形成を維持するために必要な脂質の閾値に関する情報を提供しますが3,4、細胞機能を完全には再現していません。例えば、再構成されたリポソームは、毒素に応答する哺乳動物宿主および脂質修飾の脂質非対称性を欠いている5。リポソームに代わる1つは、哺乳類細胞株を使用することである。これらの細胞株はより生理学的に関連性がありますが、毒素の感知と耐性のメカニズムには大きな冗長性があります2。結果として、CDCに抵抗するために使用される修復経路は十分に決定されていないままです。特に、Ca2+流入は膜修復の主要な活性化因子である1。Ca2+流入の下流には、セラミド依存性修復経路6,7およびMEK依存性修復経路6を含む複数の経路が関与している。これらの経路は、輸送に必要なエンドソームソーティング複合体(ESCRT)8、およびアネキシン6,9,10を含む他のタンパク質エフェクターと相互作用します。哺乳類細胞におけるこれらの経路を解剖することは、データの解釈を混乱させる冗長性のために困難である。
修復経路を解剖するための複雑さと単純さのバランスをとる1つの方法は、リーシュマニア属の原生動物病原体などのより単純な生物を使用することです。リーシュマニア属 人間や他の動物にリーシュマニア症を引き起こします。リーシュマニア症は、種やその他の要因に応じて、皮膚リーシュマニア症(自己限定性皮膚病変)から致命的な内臓リーシュマニア症(肝脾腫)までさまざまです11。皮膚リーシュマニア症の原因物質であるリーシュマニアメジャーは、サンドフライベクターを介してヒトに伝達され、リーシュマニアの機能と感染を理解するために使用されます12。また、リーシュマニア属は12遺伝子性である。それらは、アマスティゴテスと呼ばれる細胞内哺乳類マクロファージ寄生虫として、およびサンドフライ12の自由に泳ぐ鞭毛前鞭毛虫として存在します。L.主要な前鞭毛虫は、M199などの血清添加培地で高密度に培養することができます13。プロマスティゴテスも遺伝的に扱いやすいです。脂質生合成経路を標的とするものを含む多くの遺伝子ノックアウトが存在する13。これらのノックアウトは、Balb/cマウスの感染による感染力および病変発生の成長および差異について評価することができる13。
リーシュマニア培養の比較的容易さと脂質生合成ノックアウトの範囲に加えて、寄生虫は哺乳類よりも単純なゲノムを持っています。リーシュマニアの最も特徴的な種はL.メジャーであり、脂質代謝に欠陥のある突然変異体など、多くの既存の遺伝的ツールがあります14。特に、多くの修復タンパク質は存在しません。L. majorは、アネキシンなどの主要な哺乳類修復タンパク質についてこれまでに同定されたホモログを有していない。これにより、哺乳類システムの複雑さなしに、進化的に保存された修復経路の特性評価が可能になります。しかし、修復経路は今日までリーシュマニアでは特徴付けられていません。同時に、MEK経路6などの修復に関与する主要なシグナル伝達経路は、リーシュマニアsp.15,16に保存されていますが、ホモログを検証する必要があります。マイトジェン活性化プロテインキナーゼ(MAPK)経路はL. mexicanaでよく研究されており、哺乳類細胞の細胞内生存と熱安定性に寄与し、メタサイクロジェネシスを制御します16。リーシュマニア属では、15個のMAPKのうち10個が特徴付けられています17。LmMAPK9およびLmMAPK13は、保存されたリン酸化リップ配列における同一性に基づいて、哺乳類ERK1/2に最も類似していると予測される。リン酸化リップ配列は、哺乳類のERK1/2およびLmMAPK9およびLmMAPK13の両方でTEYです。しかしながら、リーシュマニアMAPKのうち8つはTDYリン酸化モチーフ15を有する。リーシュマニア属では、MEKの少なくとも2つのホモログ、LmxMKK18およびMEKK関連キナーゼ(MRK1)19が同定されています。これは、リーシュマニアで特定された洞察が哺乳類のシステムに変換できることを示唆しています。それらが哺乳類系に変換されない場合、それらはリーシュマニア症を治療するための治療標的を表す。
L. major promastigotesを使用して膜修復および毒素との相互作用を研究するためには、中程度のスループット技術が必要です。高解像度のライブセルイメージングは、標識されたタンパク質や膜をリアルタイムで可視化することができますが、スループットが低く、細胞の生存率を測定しない可能性があります。ミディアムスループット生存率アッセイには、フローサイトメトリーによる色素取り込みの測定、ミトコンドリア活性の測定、または乳酸デヒドロゲナーゼ(LDH)などの細胞タンパク質の放出が含まれます。哺乳動物細胞では、LDHアッセイは細胞死を定量的に測定しない20。さらに、LDH放出やミトコンドリア活性などの集団ベースのアッセイでは、堅牢なシングルセルまたはマルチパラメトリック分析はできません20。対照的に、フローサイトメトリーベースのアッセイは、マルチパラメトリックシングルセル解析を可能にします20。しかし、これらのアッセイは、L.主要な前鞭毛虫の毒素生物学または毒素に対する応答の理解には適用されていません。
この研究では、SLOは、L.メジャーの前鞭毛虫の培養に日常的に使用されているM199培地とより単純なTyradeバッファーの2つの異なるバッファーにおけるL.メジャーのスフィンゴ脂質ヌル変異体の原形質膜摂動を理解するためのツールとして使用されます。ミディアムスループットフローサイトメトリーアッセイが説明され、毒素の用量反応曲線を生成するために使用されます。フローサイトメトリーアッセイからのデータは、LC50値を決定するためにロジスティック曲線にモデル化されます。この情報を使用して、SLOのサブライティック用量を決定し、ウェスタンブロッティングを使用してMAPK抗体を検証できます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
RG2病原体リー シュマニアメジャー および組換えDNAの使用および取り扱いには、すべての適切なガイドラインおよび標準的な微生物学的、安全性、および細胞培養慣行が採用されました。ライブ L.メジャー を使用したすべての実験は、BSL-2認定ラボのバイオセーフティキャビネットで実施されました。この作業は、テキサス工科大学の機関バイオセーフティ委員会によって監督されました。
注:安全性の観点から、生きている L.主要な 前鞭毛虫はリスクグループ2の病原体です。適切な封じ込め、予防措置、および機関バイオセーフティ委員会(IBC)の監視を使用して処理します。有害物質および化学物質は、有害物質の制度的手順に従って取り扱う。組換え毒素を使用する場合、組換えDNAの作業にはIBCの承認と監視が必要になる場合があります。
1. L.主要な 前鞭毛虫の栽培と準備
- 相同組換えまたはCRISPRベースの方法のいずれかを用いて、前述のように L.主要な 遺伝子変異体を入手し、または作製し、検証する13、21。プラスミドに追加された遺伝子で補完されたノックアウトを使用して、ノックアウトの特異性を確保します。
- 野生型 L.メジャー および spt2- プロマスティゴテスを完全M199培地中で27°Cで培養する。エピソームアドバック細胞(spt2-/+SPT2)を完全なM199と10 μg/mL G418で培養します( 表1 および 材料表を参照)。
注: L.主要 細胞を用いた実験を含む実験セットアップ全体は、BSL2認定のバイオセーフティキャビネットで実行する必要があります。 - 前鞭毛虫を完全なM199培地22で、以前に行われたL.主要成長曲線アッセイ23によって決定された対数期(2-8 x 106細胞/ mL)に達するまで培養します。細胞毒性のために各ウェルに1 x 10 5細胞、染色制御のために5 x 105細胞を計画します。ウェスタンブロットでは、ウェルあたり2 x 107細胞を計画します。
注:2つのテクニカルレプリケートで細胞毒性アッセイを実行します。 - 適切な細胞密度を確認するには、アリコート(10〜40 μL)の前鞭毛虫を等量の固定液(1x PBSで3.7%パラホルムアルデヒド)と混合します。10 μLの固定サンプルを血球計算盤の両側にロードします。
注意: ホルムアルデヒドは有毒な化学物質です。有害化学物質の制度的方針に従って取り扱ってください。 - 倍率20倍の顕微鏡を使用して細胞カウントを実行します。血球計算盤の中央にある25個の小さな正方形のすべての細胞を数えます。両側の正方形に対して繰り返し、カウントを平均します。
注:カウント間の変動が>10の場合は、再カウントして平均化します。平均カウントが<10または>100の場合は、希釈と再カウントを変更し、次の式を使用して培養密度を計算します。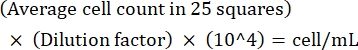 (式1)
(式1)
例えば、25マスに平均250個の リーシュマニア がある場合、培養密度は5 x 106 細胞/mLです。 - 計数後、5 x 106 細胞を15 mLコニカルチューブに移し、1,500 x g で室温で8分間遠心分離して細胞をペレット化します。
- 10 mLピペットを使用して上清を廃棄し、細胞ペレットを短時間ボルテックスします。同じチューブに5 mLの1x PBSを加え、3〜6倍を穏やかに反転させて細胞を洗浄します。1,500 x g で室温で8分間遠心分離し、細胞をペレット化します。
- 10 mLピペットを使用して上清を廃棄し、実験に使用した5 mLの培地(M199または1x Tyrodeバッファーなど)に5 x 10 6細胞ペレットを5 mLピペットで再懸濁して、最終濃度1 x 106細胞/mLにします。
2. 細胞毒性アッセイ
- 実験準備
- 前述のように毒素を精製するか24、またはベンダーから毒素を購入する。使い捨てアリコートに分注し、-80°Cで最長1年間保管します。複数の凍結融解サイクルを避けてください。
- ヒト赤血球を使用して各毒素の溶血活性を測定します( 材料の表を参照)24。
注:溶血活性は、精製、突然変異などによる活性の違いを制御するために使用されます。赤血球の種の選択は、溶血活性を変化させる可能性があります(例えば、インターメディリジンはヒト赤血球を必要とします)。. - 各条件に対して2つの技術的反復、用量反応曲線の7つの希釈、および無毒素対照を計画します。
注:野生型(WT)、spt2-、およびspt2-/+SPT2プロマスティゴートでは、1つのV底96ウェルプレートで2つの処理をテストできます。たとえば、メディアに対する感度を比較することができます(図1)。Vボトムプレートの代わりに、1.2 mLマイクロタイターチューブ(材料の表を参照)を使用できます。サイトメーターでの取得時間のため、一度に複数のプレートを実行することはお勧めしません。 - 必要な試験条件と実験の目的に基づいて、使用するアッセイバッファーを決定します。
注:この例では、2つのアッセイバッファーが比較されます:M199と生存率色素ヨウ化プロピジウム(PI)を添加したTyrodeバッファー。血清中のコレステロールはCDC活性を妨害します24。 - 治療された遺伝子型の状態と数に基づいて、必要な毒素の量を計算します。50%特異的溶解が希釈曲線の途中で発生することを確認します。
注:CDCの場合、2倍の連続希釈は、後のロジスティックモデリングに適した範囲を提供します。spt2- 前鞭毛虫の場合、4,000 HU/mL SLOが推奨される開始希釈液です。不活性毒素が使用される場合、最高用量に相当する質量が代わりに使用されてもよい。 - ウェルあたり200 μLの最終容量を計画し、ピペットエラーを考慮して少量(50-100 μL)を追加します。
注:それぞれが重複して行われる3つの遺伝子型では、連続希釈用の6つのサンプルがあります。 - 次の式を使用して、必要な毒素の総量を決定します。
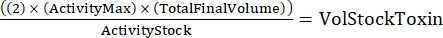 (式 2)
(式 2)
ここで、アクティビティマックスは使用された最高濃度(HU / mL)です。総最終容量は総容量です(6サンプルの場合、200 x 6 + 100 = 1,300 μL)。活性ストックは、毒素ストック(HU / mL)の活性です。VolStockToxinは、必要な毒素ストックの量です。 - 実験に必要なアッセイバッファーを十分に準備します。基礎培地に生存率色素と、Ca2+レベルを制御するために必要なCa2+またはEGTAを補給します。混合する渦。
注:たとえば、10 mL タイロードバッファーごとに、2 mg/mL PIを50 μL、100 mM CaCl 2を200 μL添加し、それぞれ10 μg/mLと2 mMの最終濃度を与えます。 - 生存率色素PIが、Cy5またはAlexaFluor647結合毒素20,25を使用した蛍光結合アッセイなど、使用される他のプローブと競合しないことを確認してください。
- 毒素の希釈を計画して、毒素の2倍の溶液を作ります。アッセイバッファーを1.5 mL遠沈管に加え、氷上で冷却します。アッセイを開始する直前に毒素のみを追加します。
注:この例では、1.3 mLのアッセイバッファーをトップ希釈用に添加し、650 μLを段階希釈用に添加して、2x毒素溶液を調製します。
- 実験
- ステップ1.8で処理したプロマスティゴテス0.5 mLを「染色されていないコントロール」として別のチューブに予約します。
注:このサンプルは、フローサイトメーターのゲーティングを設定するために使用されます。 - 残りの前鞭毛虫に最終濃度10 μg / mLまで2 mg / mL PIを追加します。3秒間渦。
注:処理された前鞭毛虫にPIを添加した後、これらの細胞は2.5時間しか使用できません。 2.5時間後、細胞は死に始め、結果は誤ってなります。 - 1 x 105 (100 μL/ウェル中)の処理済みプロマスティゴテをV底96ウェルプレートまたは1.2 mLマイクロタイターチューブの各ウェルに追加します(図1)。プレートまたはチューブラックを氷の上に置きます viewから約45°の角度で。 リーシュマニア 前鞭毛虫を扱うときは、バイオセーフティキャビネットで作業を行います。
- PIを含むアッセイバッファー100 μLを各無毒素コントロール(最後の行)に追加します。色が濃く見える総容量200 μLのチューブを視覚的に識別して、コントロールが正しく追加されたことを確認します。
- 毒素アリコートを-80°Cから取り除き、氷上で解凍し、必要に応じてプールします。ステップ2.1.5で計算された毒素の量を最高希釈液(ステップ2.1.10で調製)に追加します。次に、毒素を順次希釈します(図1)。混合を確実にするために、少なくとも8倍にピペットを上下させます。
注意: CDCは室温で急速に不活性化するため、氷上で実行してください。 - 最も低い毒素濃度から始めて、100 μLの毒素を正しい行(図1 および 図2)にすばやく追加し、すべての毒素が細胞に追加されるまで続けます。
- プレートをシーリングテープでシールします。37°Cで30分間インキュベートします。インキュベーション期間の後、プレートを包装してフローサイトメーターに輸送します。
- ステップ1.8で処理したプロマスティゴテス0.5 mLを「染色されていないコントロール」として別のチューブに予約します。
- データ・アクイジション
- フローサイトメーター( 材料表を参照)と取得ソフトウェアを、製造元の指示および施設の方針に従ってセットアップします。サイトメーターの事前トレーニングなしにフローサイトメトリー手順を実行しないでください。
注: この例では、4 レーザーの Attune NxT を使用しました。PIはYL-1チャネル(561nmレーザーで励起され、577LPを通過し、600DLPから反射され、585/16バンドパスでフィルタリングされた)で収集されましたが、PIの広いスペクトルは他のチャネルで収集できます。 - 染色されていない L.メジャー プロマスチゴートサンプルを使用して、前方散乱と側方散乱のゲートと、選択した色素に基づく初期蛍光パラメータを設定します。
- ドットプロットで自家蛍光をチェックするために、必要に応じて1つのパラメータを追加します(例:「染色なし」)(図3)。
注:この例では、BL-1チャネル(488 nmレーザーで励起され、495 DLPと503 LPを通過し、555 DLPから反射され、530/30バンドパス で フィルタリング)が使用されました。 - 単一染色コントロールを使用して、生存率色素(この研究ではPI)および蛍光標識された毒素のゲートを設定します。前方散乱とマイクロ詰まりの時間を監視します。
注:PIは、染色されていないコントロールの上のすべての細胞をぼんやりと染色します。死んだ細胞は容易に分離可能であり、集団の間に一過性に透過処理された細胞があります。 - サイトメーター上の各サンプルについて>10,000のゲートイベントを取得します。
注:最も感度の高いものから最も感度の低いものまで読み取ることをお勧めしますが、取得の順序を逆にして、サンプル結果に対する読み取り順序の影響を判断できます。 - データを保存し、必要に応じて分析用にエクスポートします。
- フローサイトメーター( 材料表を参照)と取得ソフトウェアを、製造元の指示および施設の方針に従ってセットアップします。サイトメーターの事前トレーニングなしにフローサイトメトリー手順を実行しないでください。
- データ分析
注: この調査では、ソルバー プラグインを使用した Excel ( 材料表) がデータ分析に使用されました ( 補足ファイル1).- ゲート総数は、必要に応じて前方および側方散乱および時間上のゲーティングによる単一細胞 L.主要な 前鞭毛虫である(図3)。フローサイトメーターに推奨される高さまたは面積を使用してください。
注:ここで使用するフローサイトメーターでは、面積ではなく高さが推奨パラメータです。 - 死細胞を「PIハイ」として識別してゲートします。中間セルを「PIロー」としてゲートします。PI高細胞は死細胞であり、一方PI低細胞は一過性に透過処理される26。
注:PIの高いセルは通常、負のセルから2〜3の対数シフトを示します。 - データを Excel にエクスポートします。サンプル名/IDと%PIハイを取得して、殺害を決定します。
注:蛍光毒素を使用した場合、生きている、一過性に透過した、および陰性の集団の中央値の蛍光強度(MFI)が必要になります。%PI低は、一過性透過処理のために輸出することができます。 - 2つのテクニカル反復間の各条件の平均%PI高値を求めます。
注:蛍光毒素に平均MFIが必要な場合は、これも計算してください。 - 次の式24,25を使用して、%PI高値から%比溶解を計算します。
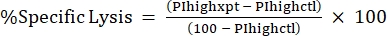 (式3)
(式3)
ここで、PIhighxpt は実験条件の %PI ハイです。PIhighctlは、無毒素コントロールの%PI高値です。 - 用量反応曲線の毒素濃度に対する%特異的溶解をプロットします(図4)。
- ロジスティックモデリングのためにExcelで線量反応曲線を整理します。毒素濃度と平均%特異的溶解を、実験の詳細および/または生の%PI高計算とともに含めます(表2)。
- ソルバー アドインが有効になっていることを確認します。
注: Excel のデスクトップ バージョンでソルバーを有効にするには、[ ファイル > オプション] > [アドイン] に移動し、[ ソルバー ] チェック ボックスをオンにします。エクセルを再起動します。 - さらに 4 つの列に "モデル化済み"、"残差"、"パラメーター"、および "パラメーター値" というラベルを付けます。最初の列が実験パラメータ、毒素濃度、および%特異的溶解に対応していることを確認します(表2)。
- [パラメーター] 列に、L、k、c、SUM、および LC50 のパラメーターを追加します。「パラメータ値」列に100、0.05、1,000の値を入力して、パラメータL、k、およびcを初期化します。
- 「モデル化済み」列で、次の式を使用してロジスティックモデルを作成します。
 (式4)
(式4)
L、k、およびcを、「パラメータ値」列のこれらのパラメータを含むセルに設定します。
xを毒素濃度を含む細胞に設定します。
注: 表 2 のセル G4 の場合、数式は次のようになります: =$J$3/(1+EXP(-$J$4*(D4-$J$5))) - この式を、無毒素コントロールを除くすべての%特異的溶解値に適用します。
- 「残差」列で、次の式を使用して、モデル化された数と実際の比溶解との差の2乗を計算します。
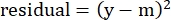 (式5)
(式5)
ここで、yは実験的な%比溶解です。mは、ステップ2.4.10〜2.4.11で計算された「モデル化された」列の対応する値です。 - 「SUM」の横にある「パラメータ値」列で、残差列のすべての値を合計します。
- 「LC50」の横の「パラメータ値」欄に、決定された値からLC50 を算出する式を初期化する。これは、m = 50のときの x の式4を解いています。
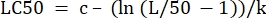 (式6)
(式6)
表 2 の場合、Excel の数式は次のようになります: =J5-(LN(J3/(50)-1))/J4 - [データ]タブからソルバーを開きます。計算された残差の合計を含むセルとなる目標の設定を選択します。[最小] に設定します。
- L、k、および c のパラメーター値の変数セルを変更します。
注: 「制約のない変数を非負にする」をオンのままにしておくと、ソルバーの動作が向上する可能性があります。 - 負のk値の場合、kから-1を因数分解してkを正に変更することにより、式4と式6を変更します。GRG 非線形解析方法を使用します。[ 実行] をクリックします。
- 曲線を確認し、LC50 が式6を使用して自動的に計算されていることを確認します(表2)。%特異的溶解と毒素濃度に対するモデリングの両方をグラフィカルにプロットすることにより、適合度を検証します。
注:また、曲線に対するR2 を計算することによって確認してもよい。
- ゲート総数は、必要に応じて前方および側方散乱および時間上のゲーティングによる単一細胞 L.主要な 前鞭毛虫である(図3)。フローサイトメーターに推奨される高さまたは面積を使用してください。
3. 毒素に挑戦した L.主要な 前鞭毛虫のタンパク質分析
- セクション1で説明されているように L.主要な 前鞭毛を準備します。
- 5 mLピペットを使用して、2 x 107 WT、spt2-、およびspt2-/+SPT2 L.主要な前鞭毛虫を2 mLの目的のアッセイバッファーに再懸濁します(例:.、無血清M199)。毒素を最終サブライト濃度まで添加し、37°Cで30分間インキュベートします。
注:たとえば、 spt2- 前鞭毛虫のSLOのサブリティック用量は500 HU / mLです。 - 他の遺伝子型と無毒素コントロールを含めます。
- 前鞭毛虫を1,500 x g で10分間遠心分離し、細胞をペレット化します。10 mLピペットを使用して上清を廃棄します。細胞ペレットを含む密閉管を、バイオセーフティキャビネットのグリルなどの不規則な表面を横切って3回急速に動かして、細胞ペレットを破壊します。
注:細胞ペレットは肉眼ではほとんど見えません。 - 使用直前に1x SDS-PAGEサンプルバッファーを2-メルカプトエタノールで再構成し、セルペレットに添加する前に95°Cに10分間加熱します。細胞ペレットを熱い1x SDS-PAGEサンプルバッファーに再懸濁し、上下にピペッティングしてよく混合します。再懸濁した細胞ペレットを1xサンプルバッファー中で95°Cで10分間加熱します。
注:サンプルバッファーに可溶化した後、必要に応じてサンプルを-20°Cで長期間保存します。 - 分離ゲルを準備します。過硫酸アンモニウム(APS)とTEMEDを除くすべてのコンポーネントを15分間脱気します。
- ゲルをキャストする直前にAPSとTEMEDを追加します。解像ジェルを水で慎重に覆います。分離ゲルを重合させます(~30-45分)。
- 水をデカントし、スタッキングゲルを準備します。気泡がないように注意しながら、スタッキングジェルを追加します。関連する数のウェルで櫛を挿入し、5分間重合させます。残ったスタッキングゲルを使用して重合を監視します。
- SDS-PAGEを実行するためのゲルを組み立て、チャンバーにリザーバーバッファーを追加します。
- ウェルあたり各サンプル10 μL、またはタンパク質ラダー8 μLをロードします。サンプルが分離ゲルに入るまで180 Vで実行し、次に電圧を~160 Vに下げて、色素の前面がプレートの端から~0.5 cmになるまで実行します。
注意: サンプルが底に到達するのにかかる時間は、1〜1.5時間の間で異なる場合があります。電圧を下げることで時間を長くすることができます。電圧をゼロに下げないでください。電圧が高くなると、ゲルの「笑顔」が増加し、プレートにひびが入る可能性があります。 - ゲルをクマシー染色(タンパク質染色用)または1x転写バッファー(ウェスタンブロッティング用)に転写します。クーマシー染色の場合は、一晩染色してから、脱染色、画像化、乾燥します。
- ウェスタンブロットの場合は、製造元の指示に従ってトランスファーシステムを準備します。
- ウェットトランスファーの場合は、コールド1xトランスファーバッファーとプレウェットパッド、ろ紙、ニトロセルロースを使用します。ここで使用する Bio-rad Protian III システム ( 材料の表を参照) の場合、ろ紙は 10 cm x 7.5 cm にカットできます。ニトロセルロースを9 cm x 6.75 cmにカットします。
注意: ニトロセルロースは非常に可燃性です。裸火やその他の潜在的な発火源を避けてください。 - 転写カセットをパッド、ろ紙、ニトロセルロースで広げます。気泡を広げます。ゲルを慎重に加えます。
- ろ紙を追加し、気泡を広げます。パッドを追加し、カセットを閉じて、正しい向きでホルダーに挿入します(ニトロセルロースが赤い端子を向いていることを確認してください)。攪拌子とアイスパックを側面に追加し、冷たい1xトランスファーバッファーでリザーバーを補充します。110 Vで90分間転送します。
注意: 転送中に発生する熱は、転送に悪影響を与える可能性があります。良好な転送を確実にするために、常にコールド1x転送バッファを使用してください。 - ニトロセルロースを取り除き、ポンソー溶液で~5分間染色します。超純水ですすいでください。タンパク質のはしごに鉛筆で印を付け、必要に応じてブロットをトリミングします。残った転写バッファーを使用してブロットを脱染色します。
注:ポンソーは何度も再利用できます。 - ニトロセルロースを25 mLの5%BSA溶液中の1x TBST溶液中で4°Cで一晩振とうしながらブロックします。次に、ブロッキング溶液を廃棄し、1x TBST中の1%BSA中の一次抗体(1:1,000)を追加します。4°Cで一晩振とうします。
注:一次抗体は-20°Cで保存し、数回再利用できます。 - ニトロセルロースを振とうしながら1x TBSTでそれぞれ10分間3回洗浄します。洗浄液を廃棄し、10 mLのHRP結合二次抗体(1:10,000)を1x TBST中の1%BSA中に加えます。室温で1時間振とうする。ニトロセルロースを振とうしながら1x TBSTでそれぞれ10分間3回洗浄します。
- ニトロセルロースをイメージングする直前にECL試薬を調製します。イメージングの直前に、TBSTをデカントし、ECL試薬をニトロセルロースに加えます。1分間振とうします。ゲルをイメージします。
Access restricted. Please log in or start a trial to view this content.
結果
M199と比較したタイロード緩衝液中のSLOに対する前鞭毛虫感受性の増加
L.主要前鞭毛虫のSLO感受性を異なるアッセイバッファー間で比較した。野生型、spt2-、およびspt2-/+SPT2プロマスティゴテスに、フローサイトメーターで分析する前に、無血清M199または2 mM CaCl2を添加したTyrodeバッファーで30分間SLOに挑戦しました。分析に適した寄?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
本研究では、ヒト病原体 リーシュマニアメジャー をモデル系として、PFTの分子メカニズムと機能を研究する方法について説明しました。単一細胞生存率を測定するためのミディアムスループットフローサイトメトリーベースの細胞毒性アッセイが開発されました。LC50 値はロジスティックモデリングを使用して用量反応曲線から計算できるため、生存率は集団レベルで定量的?...
Access restricted. Please log in or start a trial to view this content.
開示事項
この研究は、国立衛生研究所の国立アレルギー感染症研究所の助成金R21AI156225をPAKとKZ(co-I)に、R01AI139198をKZ(co-I)に付与しました。CHは、この研究の期間中に提供されたティーチングアシスタントのための生物科学科に感謝したいと思います。
資金提供機関は研究のデザインに何の役割も果たさなかった。データの収集、分析、または解釈。原稿の執筆において。また、結果を公開する決定もありません。内容は著者の責任であり、必ずしも資金提供機関の公式見解を表すものではありません。著者らは、競合する利益相反はないと宣言しています。
謝辞
著者らは、原稿の批判的レビューに対してKeyelとZhangの研究室のメンバーに感謝したいと思います。著者らは、施設の使用について教養学部顕微鏡法に感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1.2 mL microtiter (Marsh) tubes | Fisher | 02-681-376 | Cytotoxicity assay |
| 1.5 mL microcentrifuge tube | Fisher | 05-408-129 | Toxin dilutions |
| 15 mL centrifuge tube | Avantor VWR (Radnor, PA) | 89039-666 | To hold cells and media |
| 1x Phosphate buffered saline (PBS) | Fisher | BP399 | For cell processing |
| 3% H2O2 | Walmart (Fayetteville, AR) | N/A | For ECL |
| 5x M199 | Cell-gro | 11150067 | Basal growth media for L. major promastigotes |
| Biosafety cabinet | Baker | To culture cells in sterile conditions | |
| Bovine serum albumin (BSA) | Fisher | BP1605-100 | Fraction V acceptable purity |
| CaCl2 | Fisher | BP510-100 | Stock concentration 100 mM |
| Centrifuge | Thermo Fisher | Heraeus Megafuge 40R | To pellet the cells from culture |
| Cy5 Mono-reactive dye pack | Cytiva (Marlborough, MA) | PA25031 | Fluorophore label for toxins |
| Digital dry bath | Benchmark | BSH1002 | To denature protein samples |
| EGTA | Amresco | 0732-100G | Stock concentration 0.5 M |
| Excel | Microsoft (Redmond, VA) | Data analysis software | |
| Flow cytometer (4-laser Attune NxT) | Fisher | Cytometer for data acquisition | |
| FlowJo | BD (Ashland, OR) | Software | |
| Formaldehyde | Fisher | BP531-500 | Fixative for counting cells |
| G418 | Fisher | BP673-1 | Selection agent for cells |
| Hellmanex III | Sigma | Z805939 | Dilute 1:4 for cleaning cytometer |
| Hemacytometer | Fisher | 0267151B | For counting cells |
| Human red blood cells | Zen-bio (Durham, NC) | SER-10MLRBC | To validate toxin activity |
| Ice bucket | |||
| Light microscope | Nikon | Eclipse 55i | To visualize cells |
| Nitrocellulose | Fisher | 88018 | For probing proteins via antibodies |
| Pipettors and tips | Avantor VWR | To dispense reagents | |
| Power supply | Bio-Rad | To run SDS-PAGE and transfers | |
| Propidium iodide | Biotium | 40016 | Stock concentration 2 mg/mL in water |
| Protein ladder | Bio-Rad | 161-0373 | To determine molecular weight of proteins |
| SDS-PAGE Running Apparatus (Mini Protean III) | Bio-Rad | 165-3302 | To separate proteins based on their size |
| Sealing tape | R&D | DY992 | To seal plates with cells |
| Streptolysin O C530A plasmid insert | Cloned into pBAD-gIII vector (Reference: 7) | ||
| Streptolysin O C530A toxin | Lab purified | Specific activity 4.34 x 105 HU/mg | |
| Swinging bucket rotor | Thermo Fisher | 75003607 | To centrifuge cells |
| V-bottom plate | Greiner Bio-one | 651206 | For cytotoxicity assay |
| Vortex | Benchmark | BV1000 | To mix cells |
| Western blot imaging system (Chemi-doc) | Bio-Rad | To visualize proteins by western blot | |
| Western Blot Transfer Apparatus (Mini Protean III) | Bio-Rad | 170-3930 | Transfer proteins to nitrocellulose |
| Whatman Filter paper | GE Healthcare Life Sciences | 3030-700 | Used in transfer of proteins to nitrocellulose |
| Antibody | |||
| Anti-ERK antibody | Cell Signaling Technologies | Cat# 9102S | Rabbit (1:1000 dilution) |
| Anti-lipophosphoglycan (LPG) antibody | CreativeBioLabs | Cat# WIC79.3 | Mouse (1: 1000) |
| Anti-MEK antibody | Cell Signaling Technologies | Cat# 9122L | Rabbit (1:1000) |
| Anti-mouse IgG, HRP conjugate | Jackson Immunoresearch | Cat#715-035-151 | Donkey (1:10000) |
| Anti-phosphoERK antibody | Cell Signaling Technologies | Cat# 9101S | Rabbit (1:1000) |
| Anti-pMEK antibody | Cell Signaling Technologies | Cat# 9121S | Rabbit (1:1000) |
| Anti-rabbit IgG, HRP conjugate | Jackson Immunoresearch | Cat#711-035-152 | Donkey (1:10000) |
| Anti-tubulin antibody | Sigma | Cat# T5168 | Mouse (1: 2000) |
| Leishmania major Genotypes | Reference: 13 | ||
| Episomal addback (spt2-/+SPT2) | Δspt2::HYG/Δspt2:PAC/+pXG-SPT2 | ||
| Serine palmitoyltransferase subunit 2 knockout (spt2-) | Δspt2::HYG/Δspt2::PAC | ||
| Wild type (WT) | LV39 clone 5 (Rho/SU/59/P) |
参考文献
- Thapa, R., Ray, S., Keyel, P. A. Interaction of macrophages and cholesterol-dependent cytolysins: The impact on immune response and cellular survival. Toxins. 12 (9), 531(2020).
- Limbago, B., Penumalli, V., Weinrick, B., Scott, J. R. Role of streptolysin O in a mouse model of invasive group A streptococcal disease. Infection & Immunity. 68 (11), 6384-6390 (2000).
- Farrand, A. J., et al. The cholesterol-dependent cytolysin membrane-binding interface discriminates lipid environments of cholesterol to support beta-barrel pore insertion. Journal of Biological Chemistry. 290 (29), 17733-17744 (2015).
- Soltani, C. E., Hotze, E. M., Johnson, A. E., Tweten, R. K. Structural elements of the cholesterol-dependent cytolysins that are responsible for their cholesterol-sensitive membrane interactions. Proceedings of the National Academy of Sciences of the United States of America. 104 (51), 20226-20231 (2007).
- Schoenauer, R., et al. Down-regulation of acid sphingomyelinase and neutral sphingomyelinase-2 inversely determines the cellular resistance to plasmalemmal injury by pore-forming toxins. FASEB Journal. 33 (1), 275-285 (2019).
- Ray, S., Roth, R., Keyel, P. A. Membrane repair triggered by cholesterol-dependent cytolysins is activated by mixed lineage kinases and MEK. Science Advances. 8 (11), (2022).
- Babiychuk, E. B., Monastyrskaya, K., Draeger, A. Fluorescent annexin A1 reveals dynamics of ceramide platforms in living cells. Traffic. 9 (10), 1757-1775 (2008).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136(2014).
- Demonbreun, A. R., et al. An actin-dependent annexin complex mediates plasma membrane repair in muscle. Journal of Cell Biology. 213 (6), 705-718 (2016).
- Wolfmeier, H., et al. Ca(2)(+)-dependent repair of pneumolysin pores: A new paradigm for host cellular defense against bacterial pore-forming toxins. Biochimica et Biophysica Acta. 1853 (2), 2045-2054 (2015).
- Bravo, F., Sanchez, M. R. New and re-emerging cutaneous infectious diseases in Latin America and other geographic areas. Dermatologic Clinics. 21 (4), 655-668 (2003).
- Manfredi, M., Iuliano, S. Cutaneous leishmaniasis with long duration and bleeding ulcer. Clinical Microbiology Open Access. 05, 2-6 (2016).
- Zhang, K., et al. Sphingolipids are essential for differentiation but not growth in Leishmania. EMBO Journal. 22 (22), 6016-6026 (2003).
- Zhang, K. Balancing de novo synthesis and salvage of lipids by Leishmania amastigotes. Current Opinions in Microbiology. 63, 98-103 (2021).
- Kaur, P., Goyal, N. Pathogenic role of mitogen activated protein kinases in protozoan parasites. Biochimie. 193, 78-89 (2022).
- Wiese, M. Leishmania MAP kinases--Familiar proteins in an unusual context. International Journal of Parasitology. 37 (10), 1053-1062 (2007).
- Brumlik, M. J., Pandeswara, S., Ludwig, S. M., Murthy, K., Curiel, T. J. Parasite mitogen-activated protein kinases as drug discovery targets to treat human protozoan pathogens. Journal of Signal Transduction. 2011, 971968(2011).
- Wiese, M., Kuhn, D., Grunfelder, C. G. Protein kinase involved in flagellar-length control. Eukaryotic Cell. 2 (4), 769-777 (2003).
- Agron, P. G., Reed, S. L., Engel, J. N. An essential, putative MEK kinase of Leishmania major. Molecular Biochemistry of Parasitology. 142 (1), 121-125 (2005).
- Ray, S., Thapa, R., Keyel, P. A. Multiple parameters beyond lipid binding affinity drive cytotoxicity of cholesterol-dependent cytolysins. Toxins. 11 (1), (2018).
- Beneke, T., et al. A CRISPR Cas9 high-throughput genome editing toolkit for kinetoplastids. Royal Society Open Science. 4 (5), 170095(2017).
- Kapler, G. M., Coburn, C. M., Beverley, S. M. Stable transfection of the human parasite Leishmania major delineates a 30-kilobase region sufficient for extrachromosomal replication and expression. Molecular and Cellular Biology. 10 (3), 1084-1094 (1990).
- Moitra, S., Pawlowic, M. C., Hsu, F. F., Zhang, K. Phosphatidylcholine synthesis through cholinephosphate cytidylyltransferase is dispensable in Leishmania major. Scientific Reports. 9, 7602(2019).
- Keyel, P. A., Heid, M. E., Watkins, S. C., Salter, R. D. Visualization of bacterial toxin induced responses using live cell fluorescence microscopy. Journal of Visualized Experiments. (68), 4227(2012).
- Romero, M., et al. Intrinsic repair protects cells from pore-forming toxins by microvesicle shedding. Cell Death & Differentiation. 24 (5), 798-808 (2017).
- Keyel, P. A., et al. Streptolysin O clearance through sequestration into blebs that bud passively from the plasma membrane. Journal of Cell Science. 124, 2414-2423 (2011).
- Dong, Z., Patel, Y., Saikumar, P., Weinberg, J. M., Venkatachalam, M. A. Development of porous defects in plasma membranes of adenosine triphosphate-depleted Madin-Darby canine kidney cells and its inhibition by glycine. Laboratory Investigations. 78 (6), 657-668 (1998).
- Loomis, W. P., den Hartigh, A. B., Cookson, B. T., Fink, S. L. Diverse small molecules prevent macrophage lysis during pyroptosis. Cell Death & Disease. 10 (4), 326(2019).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved