Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Расшифровка молекулярного механизма и функции порообразующих токсинов с помощью Leishmania major
В этой статье
Резюме
Здесь представлен протокол, использующий основные промастиготы Leishmania для определения связывания, цитотоксичности и передачи сигналов, индуцированных порообразующими токсинами. Приведено доказательство концепции со стрептолизином О. Другие токсины также могут быть использованы для использования генетических мутантов, доступных в L. major , для определения новых механизмов устойчивости к токсинам.
Аннотация
Понимание функции и механизма порообразующих токсинов (PFT) является сложной задачей, потому что клетки сопротивляются повреждению мембраны, вызванному PFT. Хотя биофизические подходы помогают понять формирование пор, они часто полагаются на редукционистские подходы, в которых отсутствует полный набор мембранных липидов и белков. Культивируемые клетки человека обеспечивают альтернативную систему, но их сложность и избыточность в механизмах восстановления затрудняют идентификацию конкретных механизмов. Напротив, простейший патоген человека, ответственный за кожный лейшманиоз, Leishmania major, предлагает оптимальный баланс между сложностью и физиологической значимостью. L. major генетически поддается лечению и может культивироваться до высокой плотности in vitro, и любое влияние возмущений на инфекцию может быть измерено в установленных мышиных моделях. Кроме того, L. major синтезирует липиды, отличные от их коллег млекопитающих, которые могут изменять динамику мембран. Эти изменения в динамике мембран могут быть исследованы с помощью PFT из наиболее характерного семейства токсинов, холестерин-зависимых цитолизинов (CDC). CDC связываются с эргостерином в мембране Leishmania и могут убивать L. major promastigotes, что указывает на то, что L. major является подходящей модельной системой для определения клеточных и молекулярных механизмов функции PFT. В этой работе описываются методы тестирования функции PFT в L. major promastigotes, включая культуру паразитов, генетические инструменты для оценки восприимчивости к липидам, мембрансвязывающие анализы и анализы гибели клеток. Эти анализы позволят быстро использовать L. major в качестве мощной модельной системы для понимания функции PFT в ряде эволюционно разнообразных организмов и общих черт в липидной организации.
Введение
Порообразующие токсины (PFT) являются крупнейшим семейством бактериальных токсинов1, но механизмы, с помощью которых они перфорируют и разрушают клетки, плохо изучены. Наиболее изученным семейством порообразующих токсинов является семейство холестерин-зависимых цитолизинов (CDC). CDC в основном синтезируются грамположительными бактериями, включая возбудителя некротизирующего фасциита Streptococcus pyogenes2. S. pyogenes секретирует стрептолизин CDC O (SLO), который связывается со стеринами в плазматической мембране клеток-хозяев в виде мономеров, олигомеризуется и вставляет ~ 20-30 нм пор в мембрану1. Роль, которую играют липиды в этом процессе, остается слабо определенной.
Одним из подходов к изучению взаимодействия липидов и CDC является использование химически определенных липосом. Хотя определенные липосомы предоставляют информацию о необходимых порогах липидов для поддержания связывания токсинов и образования пор 3,4, они не полностью повторяют клеточные функции. Например, восстановленные липосомы не имеют липидной асимметрии хозяев млекопитающих и липидных модификаций в ответ на токсины5. Одной из альтернатив липосом является использование клеточных линий млекопитающих. Хотя эти клеточные линии более физиологически значимы, существует большая степень избыточности в механизмах восприятия токсинов и резистентности2. Как следствие, пути восстановления, используемые для сопротивления CDC, остаются плохо определенными. Примечательно, что приток Ca2+ является основным активатором восстановлениямембраны 1. После притока Ca2+ задействовано несколько путей, включая керамид-зависимую репарацию 6,7 и MEK-зависимый путь восстановления6. Эти пути взаимодействуют с другими белковыми эффекторами, включая эндосомальный сортировочный комплекс, необходимый для транспортировки (ESCRT)8, и аннексины 6,9,10. Вскрытие этих путей в клетках млекопитающих является сложной задачей из-за избыточности, которая запутывает интерпретацию данных.
Одним из способов сбалансировать сложность с простотой для рассечения путей восстановления является использование более простых организмов, таких как простейшие патогены рода Leishmania. Leishmania sp. вызывает лейшманиоз у людей и других животных. Лейшманиоз варьируется от кожного лейшманиоза (самоограниченные поражения кожи) до фатального висцерального лейшманиоза (гепатоспленомегалия), в зависимости от вида и других факторов11. Leishmania major, возбудитель кожного лейшманиоза, передается людям через вектор песчаной мухи и используется для понимания функции лейшмании и инфекции12. Кроме того, Leishmania sp. являются дигенными12. Они существуют как внутриклеточные макрофаговые паразиты млекопитающих, называемые амастиготами, и как свободно плавающие, жгутиковые промастиготы в песчаной мухе12. L. major promastigotes можно культивировать в сывороточных средах, таких как M199, до высокой плотности13. Промастиготы также генетически поддаются лечению; существует много нокаутов генов, в том числе нацеленных на пути биосинтеза липидов13. Эти нокауты могут быть оценены на предмет роста и различий в инфекционности и развитии поражения через инфекцию мышей Balb/c13.
В дополнение к относительной легкости культуры Лейшмании и диапазону нокаутов биосинтеза липидов, паразит имеет более простой геном, чем млекопитающие. Наиболее характерным видом Leishmania является L. major, который имеет много существующих генетических инструментов, таких как мутанты с дефектным липидным метаболизмом14. Примечательно, что многие репарационные белки отсутствуют. L. major не имеет гомологов, идентифицированных на сегодняшний день для ключевых белков репарации млекопитающих, таких как аннексины. Это позволяет характеризовать эволюционно сохраненные пути восстановления без сложности систем млекопитающих. Тем не менее, пути восстановления не были охарактеризованы в Лейшмании на сегодняшний день. В то же время ключевые сигнальные пути, участвующие в восстановлении, такие как путь MEK6, сохраняются в Leishmania sp.15,16, хотя гомологи должны быть проверены. Путь митоген-активированной протеинкиназы (MAPK) хорошо изучен в L. mexicana, где он способствует внутриклеточной выживаемости и термостабильности в клетках млекопитающих и контролирует метациклогенез16. В Leishmania sp. 10 из 15 MAPK были охарактеризованы17. Прогнозируется, что LmMAPK9 и LmMAPK13 наиболее похожи на ERK1/2 млекопитающих на основе идентичности в сохраненной фосфорилирующей последовательности губ. Фосфорилирующая последовательность губ является TEY как для млекопитающих ERK1/2, так и для LmMAPK9 и LmMAPK13. Тем не менее, восемь из Leishmania MAPK имеют мотив фосфорилирования TDY15. По крайней мере, два гомолога MEK были идентифицированы в Leishmania sp., LmxMKK18 и MEKK-связанной киназе (MRK1)19. Это говорит о том, что идеи, выявленные в Лейшмании, могут быть переведены в системы млекопитающих. Там, где они не переводятся в системы млекопитающих, они представляют собой терапевтические мишени для лечения лейшманиоза.
Для того, чтобы использовать L. major promastigotes для изучения восстановления мембран и взаимодействия с токсинами, необходимы методы средней пропускной способности. Хотя визуализация живых клеток с высоким разрешением позволяет визуализировать меченые белки и мембраны в режиме реального времени, она имеет низкую пропускную способность и может не измерять клеточную выживаемость. Анализы жизнеспособности со средней пропускной способностью включают поглощение красителя, измеренное с помощью проточной цитометрии, измерение митохондриальной активности или высвобождение клеточных белков, таких как лактатдегидрогеназа (ЛДГ). В клетках млекопитающих анализы ЛДГ количественно не измеряют гибель клеток20. Кроме того, популяционные анализы, такие как высвобождение ЛДГ или митохондриальная активность, не позволяют проводить надежный одноклеточный или многопараметрический анализ20. Напротив, анализы на основе проточной цитометрии позволяют проводить многопараметрический одноклеточный анализ20. Однако эти анализы не были применены для понимания биологии токсинов или реакций на токсины в L. major promastigotes.
В этом исследовании SLO используется в качестве инструмента для понимания возмущения плазматической мембраны нулевого мутанта l . major в двух разных буферах - среде M199, обычно используемой для культивирования L. major promastigotes, и более простом буфере Tyrode. Описан и используется среднепроизводительный проточный цитометрический анализ для генерации кривых дозы-ответа токсинов. Данные цитометрического анализа потока моделируются по логистической кривой для определения значений LC50 . С помощью этой информации сублитическая доза SLO может быть определена, так что антитела MAPK могут быть проверены с использованием западного блоттинга.
Access restricted. Please log in or start a trial to view this content.
протокол
Все соответствующие руководящие принципы и стандартные микробиологические, безопасные и клеточные культуры были использованы для использования и обработки патогена RG2 Leishmania major и рекомбинантной ДНК. Все эксперименты с живым L. major проводились в кабинете биобезопасности в лаборатории, сертифицированной BSL-2. Работа контролировалась Институциональным комитетом по биобезопасности Техасского технического университета.
ПРИМЕЧАНИЕ: С точки зрения безопасности, живые L. major promastigotes являются патогенами группы риска 2. Управление с использованием соответствующих мер сдерживания, мер предосторожности и надзора со стороны Институционального комитета по биобезопасности (МКБ). Обращаться с токсичными веществами и химическими веществами в соответствии с институциональными процедурами для токсичных веществ. Если используются рекомбинантные токсины, для работы рекомбинантной ДНК может потребоваться одобрение и надзор IBC.
1. Выращивание и приготовление L. major promastigotes
- Получить или сделать и проверить L. основные генетические мутанты, как описано ранее, используя либо гомологичную рекомбинацию, либо методы на основе CRISPR13,21. Используйте нокауты, дополненные геном, добавленным обратно на плазмиду, чтобы обеспечить специфичность нокаута.
- Культивирует дикие типы L. major и spt2-promastigotes при 27 °C в полной среде M199. Культивируйте эписомальные дополнительные клетки (spt2-/+SPT2) в полном M199 плюс 10 мкг/мл G418 (см. Таблицу 1 и Таблицу материалов).
ПРИМЕЧАНИЕ: Вся экспериментальная установка, включающая эксперименты с L. основными клетками, должна быть выполнена в шкафу биобезопасности, сертифицированном BSL2. - Культивируют промастиготы в полной среде M19922 до тех пор, пока они не достигнут логарифмической фазы (2-8x 10 6 клеток/мл), как определено L. основными анализами кривой роста, выполненными ранее23. Планируйте 1 х 105 клеток для каждой лунки для цитотоксичности, плюс 5 х 105 клеток для контроля окрашивания. Для вестерн-блоттинга планируйте 2 х 107 клеток на лунку.
ПРИМЕЧАНИЕ: Выполните анализ цитотоксичности с двумя техническими репликами. - Чтобы проверить правильную плотность клеток, смешайте аликвоту (10-40 мкл) промастигот с равным объемом фиксатора (3,7% параформальдегида в 1x PBS). Загрузите 10 мкл неподвижного образца на каждую сторону гемацитометра.
ВНИМАНИЕ: Формальдегид является токсичным химическим веществом. Обрабатывать в соответствии с институциональной политикой в отношении опасных химических веществ. - Выполняйте подсчет клеток с помощью микроскопа с 20-кратным увеличением. Считайте все ячейки в 25 маленьких квадратах в центре гемацитометра. Повторите для квадратов с обеих сторон и усредните количество.
ПРИМЕЧАНИЕ: Если разница между подсчетами составляет >10, пересчет и среднее значение. Если среднее число составляет <10 или >100, измените разбавление и пересчет, а затем вычислите плотность культуры, используя следующую формулу: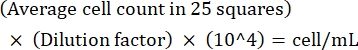 (Экв. 1)
(Экв. 1)
Например, если в 25 квадратах в среднем 250 лейшманий , плотность культуры составляет 5 х 106 клеток/мл. - После подсчета переложите 5 х 106 ячеек в коническую трубку 15 мл и центрифугу при 1 500 х г в течение 8 мин при комнатной температуре в гранулированные ячейки.
- Выбросьте супернатант с помощью пипетки объемом 10 мл и кратковременно вихрьте гранулу клетки. Добавьте 5 мл 1x PBS в ту же трубку и промыть клетки, осторожно инвертируя 3-6x. Центрифуга при 1 500 х г в течение 8 мин при комнатной температуре гранулирует ячейки.
- Выбросьте супернатант с помощью пипетки 10 мл и повторно суспендируйте гранулу 5 x 106 клеток в 5 мл среды (например, M199 или буфер 1x Tyrode), используемую для экспериментов с пипеткой 5 мл, чтобы получить конечную концентрацию 1 x 106 клеток/мл.
2. Анализ цитотоксичности
- Экспериментальная подготовка
- Очистите токсин, как описано ранее24, или приобретите токсин у продавца. Aliquot в одноразовые аликвоты и хранить при температуре −80 °C до 1 года. Избегайте многократных циклов замораживания-оттаивания.
- Определить гемолитическую активность для каждого токсина с помощью эритроцитов человека (см. Таблицу материалов)24.
ПРИМЕЧАНИЕ: Гемолитическая активность используется, потому что она контролирует различия в активности из-за очистки, мутаций и т. Д. Выбор вида эритроцитов может изменить гемолитическую активность (например, интермедилизин требует эритроцитов человека). - Запланируйте две технические реплики для каждого состояния, семь разведений для кривой доза-реакция и контроль без токсинов.
ПРИМЕЧАНИЕ: С промастиготами дикого типа (WT), spt2 и spt2-/+SPT2 можно испытать две обработки в одной пластине с 96 лунками с V-образным дном. Например, можно сравнить чувствительность к медиа (рисунок 1). Вместо пластины с V-образным дном могут использоваться микротитрные трубки объемом 1,2 мл (см. Таблицу материалов). Из-за времени сбора на цитометре не рекомендуется запускать более одной пластины одновременно. - Определите, какой буфер анализа использовать, исходя из необходимых условий тестирования и цели эксперимента.
ПРИМЕЧАНИЕ: В этом примере сравниваются два буфера анализа: M199 и буфер Тирода, дополненный жизнеспособным красителем пропидия йодидом (PI). Холестерин в сыворотке крови будет мешать активности CDC24. - Рассчитайте необходимое количество токсина на основе условий и количества обработанных генотипов. Убедитесь, что 50% специфический лизис происходит на полпути вниз по кривой разбавления.
ПРИМЕЧАНИЕ: Для CDC двухкратное последовательное разбавление даст хороший диапазон для последующего логистического моделирования. Для spt2-промастигот рекомендуется 4000 HU/mL SLO. Там, где используются неактивные токсины, вместо них может использоваться масса, эквивалентная самой высокой дозе. - Запланируйте конечный объем 200 мкл на скважину и добавьте небольшой дополнительный объем (50-100 мкл), чтобы учесть ошибку пипетки.
ПРИМЕЧАНИЕ: С тремя генотипами, каждый из которых выполнен в двух экземплярах, будет шесть образцов для серийного разбавления. - Определите общее количество необходимого токсина, используя следующую формулу:
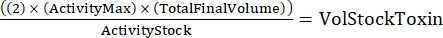 (Экв. 2)
(Экв. 2)
где ActivityMax является самой высокой используемой концентрацией (HU/мл); TotalFinalVolume - общий объем (для шести образцов 200 x 6 + 100 = 1 300 мкл); ActivityStock - активность запаса токсинов (HU/mL); и VolStockToxin - это объем необходимого запаса токсинов. - Подготовьте достаточный буфер анализа, необходимый для эксперимента. Дополните базальную среду красителем жизнеспособности и любым Ca2+ или EGTA, необходимым для контроля уровня Ca2+ . Вихрь для смешивания.
ПРИМЕЧАНИЕ: Например, на каждые 10 мл буфера Тирода добавляют 50 мкл 2 мг/мл PI и 200 мкл 100 мМCaCl2, давая конечные концентрации 10 мкг/мл и 2 мМ, соответственно. - Убедитесь, что жизнеспособность красителя PI не конфликтует с любыми другими используемыми зондами, например, для флуоресцентных связывающих анализов с использованием Cy5 или AlexaFluor647-конъюгированных токсинов20,25.
- Планируйте разбавление токсинов, чтобы сделать 2-кратный раствор токсина. Добавьте буфер анализа в трубки центрифуги объемом 1,5 мл и охладите на льду. Добавляйте токсин только непосредственно перед началом анализа.
ПРИМЕЧАНИЕ: В этом примере 1,3 мл буфера для анализа будет добавлено для верхнего разбавления, и 650 мкл будет добавлено для последовательных разведений для приготовления 2-кратного раствора токсина.
- Эксперимент
- Зарезервируйте 0,5 мл обработанных промастиготов с этапа 1,8 в отдельной пробирке в качестве «Неокрашенного контроля».
ПРИМЕЧАНИЕ: Этот образец будет использоваться для настройки затвора на проточном цитометре. - Добавьте 2 мг/мл PI к конечной концентрации 10 мкг/мл к оставшимся промастиготам. Вихрь на 3 с.
ПРИМЕЧАНИЕ: После добавления PI к обработанным промастиготам эти клетки можно использовать только в течение периода времени 2,5 ч. Через 2,5 ч клетки начинают умирать, и результаты становятся ошибочными. - Добавьте 1 х 105 (в 100 мкл/лунку) обработанных промастиготов к каждой скважине V-образной пластины из 96 скважин или 1,2 мл микротитров (рисунок 1). Поместите пластину или трубчатую стойку на лед под углом примерно 45° от обзора. Выполняйте работу в шкафу биобезопасности при обращении с промастиготами Лейшмании .
- Добавьте 100 мкл буфера анализа с PI к каждому контролю без токсинов (последняя строка). Убедитесь, что элемент управления был правильно добавлен, визуально идентифицируя трубки общим объемом 200 мкл, которые кажутся более темными по цвету.
- Удалите аликвоты токсинов при температуре −80°C, разморозьте на льду и по мере необходимости объединяйте в бассейн. Добавить объем токсина, рассчитанный на этапе 2.1.5, к наибольшему разбавлению (полученному на этапе 2.1.10). Затем последовательно разбавляют токсин (рисунок 1). Пипетка вверх и вниз не менее 8x для обеспечения смешивания.
ПРИМЕЧАНИЕ: Работайте на льду, потому что CDC быстро инактивируются при комнатной температуре. - Начиная с самой низкой концентрации токсина, быстро добавьте 100 мкл токсина в правильный ряд (Рисунок 1 и Рисунок 2) и продолжайте до тех пор, пока весь токсин не будет добавлен в клетки.
- Запечатайте пластину уплотнительной лентой. Инкубировать при 37 °C в течение 30 мин. После инкубационного периода упакуйте и транспортируйте пластину к проточному цитометру.
- Зарезервируйте 0,5 мл обработанных промастиготов с этапа 1,8 в отдельной пробирке в качестве «Неокрашенного контроля».
- Сбор данных
- Настройте проточный цитометр (см. Таблицу материалов) и программное обеспечение для приобретения в соответствии с инструкциями производителя и политикой для каждого объекта. Не выполняйте процедуру проточной цитометрии без предварительной подготовки на цитометре.
ПРИМЕЧАНИЕ: В этом примере использовался 4-лазерный Attune NxT. PI собирался на канале YL-1 (возбуждался лазером 561 нм, пропускался через LP 577, отражался от 600 DLP и фильтровался через полосу пропускания 585/16), хотя широкий спектр PI позволяет собирать данные по другим каналам. - Используя неокрашенный образец L. major promastigote, установите затворы для прямого и бокового рассеяния и исходные флуоресцентные параметры на основе выбранных красителей.
- Включите один дополнительный параметр, если это необходимо для точечных графиков, чтобы проверить автофлуоресценцию (например, «без пятна») (рисунок 3).
ПРИМЕЧАНИЕ: В этом примере использовался канал BL-1 (возбуждаемый лазером 488 нм, проходящий через 495 DLP и 503 LP, отраженный от 555 DLP и отфильтрованный через полосу пропускания 530/30). - Используя одноокрашенные элементы управления, установите затворы для красителя жизнеспособности (PI в этом исследовании) и любых флуоресцентно меченых токсинов. Контролируйте прямое рассеяние и время для микрозасоров.
ПРИМЕЧАНИЕ: PI будет тускло окрашивать все ячейки над незапятнанными элементами управления. Мертвые клетки будут легко отделимыми, с временно проницаемыми клетками между популяциями. - Получите > 10 000 закрытых событий для каждого образца на цитометре.
ПРИМЕЧАНИЕ: Рекомендуется считывать от наиболее чувствительных к наименее чувствительным, но порядок получения может быть изменен на обратный, чтобы определить любое влияние порядка чтения на результаты выборки. - Сохраните данные и экспортируйте их по мере необходимости для анализа.
- Настройте проточный цитометр (см. Таблицу материалов) и программное обеспечение для приобретения в соответствии с инструкциями производителя и политикой для каждого объекта. Не выполняйте процедуру проточной цитометрии без предварительной подготовки на цитометре.
- Анализ данных
ПРИМЕЧАНИЕ: В этом исследовании Excel с подключаемым модулем Solver (см. Таблица материалов) использовался для анализа данных (см. Дополнительный файл 1).- Затвор тотальный, одноклеточный L. major promastigotes путем наведения на передний и боковой разброс и время по мере необходимости (рисунок 3). Используйте высоту или площадь, как рекомендуется для проточного цитометра.
ПРИМЕЧАНИЕ: Для проточного цитометра, используемого здесь, рекомендуемым параметром является высота, а не площадь. - Идентифицируйте и защищайте мертвые клетки как «PI высокий». Затвор промежуточных ячеек как "PI низкий". Высокие клетки PI являются мертвыми клетками, в то время как клетки с низким PI временно проницаемы26.
ПРИМЕЧАНИЕ: Высокие ячейки PI обычно показывают сдвиг 2-3 логарифма от отрицательных клеток. - Экспортируйте данные в Excel. Получите имя/идентификатор образца и %PI high, чтобы определить убийство.
ПРИМЕЧАНИЕ: Если бы использовались флуоресцентные токсины, потребовалась бы средняя интенсивность флуоресцентной активности (МФО) живых, временно проницаемых и отрицательных популяций. %PI low может быть экспортирован для переходной пермеабилизации. - Определите средний %PI высокий для каждого условия между двумя техническими репликами.
ПРИМЕЧАНИЕ: Если средняя МФО необходима для флуоресцентных токсинов, рассчитайте и это. - Вычислите %Специфический лизис из %PI high, используя следующую формулу24,25:
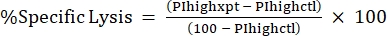 (Экв. 3)
(Экв. 3)
где PIhighxpt — %PI высокий для экспериментального состояния; и PIhighctl является %PI высоким для контроля без токсинов. - График %Специфический лизис против концентрации токсина для кривой доза-реакция (рисунок 4).
- Организуйте кривую «доза-реакция» в Excel для логистического моделирования. Включите концентрацию токсина и средний %Специфический лизис вместе с экспериментальными деталями и/или необработанными расчетами %PI с высоким (таблица 2).
- Убедитесь, что надстройка "Решатель" включена.
ПРИМЕЧАНИЕ: Чтобы включить средство поиска решения в классической версии Excel, перейдите в раздел Параметры > файлов > надстройки и установите флажок Решатель . Перезапустите Excel. - Пометьте еще четыре столбца как «смоделированные», «остатки», «параметры» и «значения параметров». Убедитесь, что первые столбцы соответствуют экспериментальным параметрам, концентрации токсина и %специфическому лизису (таблица 2).
- Добавьте следующие параметры в столбец "параметры": L, k, c, SUM и LC50. Инициализируйте параметры L, k и c, введя следующие значения в столбец "значения параметров": 100, 0.05, 1,000.
- В столбце "Смоделировано" создайте логистическую модель, используя следующую формулу:
 (Экв. 4)
(Экв. 4)
Задайте для L, k и c ячейки, содержащие эти параметры в столбце "значения параметров".
Установите x в клетку, содержащую концентрацию токсина.
ПРИМЕЧАНИЕ: Для таблицы 2, ячейка G4, формула выглядит следующим образом: =$J$3/(1+EXP(-$J$4*(D4-$J$5))) - Примените это уравнение ко всем значениям %Specific Lysis, за исключением контроля без токсинов.
- В столбце «Остатки» рассчитайте квадрат разности между смоделированным числом и фактическим удельным лизисом, используя следующее уравнение:
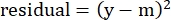 (Экв. 5)
(Экв. 5)
где y — экспериментальный %специфический лизис; и m - соответствующее значение в колонке "смоделированный", рассчитанное на этапах 2.4.10-2.4.11. - В столбце "Значения параметров" рядом с "SUM" суммируйте все значения в столбце остатков.
- В столбце «Значения параметров» рядом с «LC50» инициализируйте уравнение для вычисления LC50 из определенных значений. Это решение Eq 4 для x , когда m = 50.
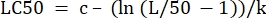 (Экв. 6)
(Экв. 6)
Для таблицы 2 формула Excel выглядит следующим образом: =J5-(LN(J3/(50)-1))/J4 - Откройте средство поиска решения на вкладке Данные. Выберите ячейку Задать цель , содержащую сумму рассчитанных остатков. Установите для него значение Min.
- Измените ячейки переменных для значений параметров L, k и c.
ПРИМЕЧАНИЕ: Решатель может вести себя лучше, если оставить флажок "Сделать неограниченные переменные неотрицательными". - Для отрицательных значений k модифицируйте Eq 4 и Eq 6, умножая −1 от k к изменению k к положительному. Используйте метод нелинейного решения GRG. Нажмите кнопку Решить.
- Проверьте кривую и то, что LC50 автоматически рассчитывается с использованием Eq 6 (таблица 2). Проверьте соответствие, графически построив как %-специфический лизис, так и моделирование концентрации токсина.
ПРИМЕЧАНИЕ: Это также может быть проверено путем вычисления R2 для кривой.
- Затвор тотальный, одноклеточный L. major promastigotes путем наведения на передний и боковой разброс и время по мере необходимости (рисунок 3). Используйте высоту или площадь, как рекомендуется для проточного цитометра.
3. Белковый анализ токсиновых L . основных промастиготов
- Приготовьте L. major promastigotes, как описано в разделе 1.
- Повторное суспендирование 2 x 107 WT, spt2- и spt2-/+SPT2 L. основных промастиготов в 2 мл желаемого буфера анализа с использованием пипетки 5 мл (например, без сыворотки M199). Добавьте токсин к конечной сублитической концентрации и инкубируйте при 37 °C в течение 30 мин.
ПРИМЕЧАНИЕ: Например, сублитическая доза SLO для spt2-промастиготов составляет 500 HU/мл. - Включают другие генотипы и контроль без токсинов.
- Центрифугируйте промастиготы при 1 500 х г в течение 10 мин, чтобы гранулировать клетки. Выбросьте супернатант с помощью пипетки объемом 10 мл. Запустите закрытую трубку, содержащую гранулу ячейки, быстро три раза по неровной поверхности, такой как решетка шкафа биобезопасности, чтобы разбить гранулу ячейки.
ПРИМЕЧАНИЕ: Гранула клетки почти невидима невооруженным глазом. - Перед использованием восстанавливают 1x буфер образца SDS-PAGE с 2-меркаптоэтанолом и нагревают до 95 °C в течение 10 мин перед добавлением в ячейку гранулы. Повторно суспендируйте гранулу ячейки в горячем буфере образцов 1x SDS-PAGE и хорошо перемешайте путем пипетки вверх и вниз. Нагревайте повторно суспендированную ячейку гранулы в 1x буфере образца при 95 °C в течение 10 мин.
ПРИМЕЧАНИЕ: После солюбилизации в буфере образцов храните образцы длительно при температуре −20 °C, если это необходимо. - Приготовьте рассасывающий гель. Дегазировать все компоненты, кроме персульфата аммония (APS) и TEMED в течение 15 мин.
- Добавьте APS и TEMED непосредственно перед отливкой геля. Аккуратно налейте рассасывающий гель водой. Дайте рассасывающемуся гелю полимеризоваться, ~30-45 мин.
- Декантируйте воду и подготовьте гель для укладки. Добавьте укладочный гель, заботясь о том, чтобы избежать пузырьков. Вставляют гребень с соответствующим количеством лунок, и дают полимеризоваться в течение 5 мин. Контролируйте полимеризацию с помощью любого оставшегося геля для укладки.
- Соберите гель для запуска SDS-PAGE и добавьте резервуарный буфер в камеру.
- Нагрузка 10 мкл каждого образца на лунку или 8 мкл белковой лестницы. Работайте при 180 В до тех пор, пока образцы не войдут в разрешающий гель, а затем уменьшите напряжение до ~160 В и работайте до тех пор, пока передняя часть красителя не достигнет ~0,5 см от края пластины.
ПРИМЕЧАНИЕ: Время, необходимое для того, чтобы образцы достигли дна, может варьироваться в пределах 1-1,5 ч. Время может быть удлинено за счет снижения напряжения. Никогда не снижайте напряжение до нуля. Более высокие напряжения могут усилить «улыбку» геля и трещины на пластинах. - Перенесите гель либо в пятно Кумасси (для окрашивания белка), либо в 1-кратный буфер переноса (для вестерн-блоттинга). Для окрашивания Coomassie окрашивайте на ночь, а затем очищайте, снимайте и сушите.
- Для вестерн-блоттинга подготовьте систему переноса в соответствии с инструкциями производителя.
- Для влажной передачи используйте холодный 1-кратный буфер переноса и предварительно влажные прокладки, фильтровальную бумагу и нитроцеллюлозу. Для системы Bio-rad Protean III (см. Таблицу материалов), используемой здесь, фильтровальная бумага может быть разрезана до 10 см х 7,5 см. Нарежьте нитроцеллюлозу до 9 см х 6,75 см.
ПРИМЕЧАНИЕ: Нитроцеллюлоза легко воспламеняется. Избегайте открытого пламени и других потенциальных источников возгорания. - Разложите трансферную кассету с прокладками, фильтровальной бумагой и нитроцеллюлозой. Выкатывайте пузырьки воздуха. Добавьте гель осторожно.
- Добавьте фильтровальную бумагу и распакуйте пузырьки воздуха. Добавьте прокладку, закройте кассету и вставьте в держатель в правильной ориентации (убедитесь, что нитроцеллюлоза обращена к красному терминалу). Добавьте перемешивание и пакет со льдом в сторону, а затем посыпьте резервуар холодным 1-кратным буфером переноса. Передача при 110 В в течение 90 мин.
ПРИМЕЧАНИЕ: Тепло, выделяемое во время передачи, может отрицательно повлиять на передачу. Чтобы обеспечить хорошую передачу, всегда используйте холодный буфер передачи 1x. - Удалите нитроцеллюлозу и окрашивание раствором Понсо в течение ~5 мин. Смойте сверхчистой водой. Отметьте белковую лестницу карандашом и обрежьте пятно по мере необходимости. Удалите пятно с помощью остаточного буфера передачи.
ПРИМЕЧАНИЕ: Ponceau может быть повторно использован много раз. - Блокируют нитроцеллюлозу в 25 мл 5% BSA в 1x TBST при 4 °C, при встряхивании, на ночь. Затем откажитесь от блокирующего раствора и добавьте первичное антитело (1:1000) в 1% BSA в 1x TBST. Встряхните при 4 °C в течение ночи.
ПРИМЕЧАНИЕ: Первичное антитело может быть сохранено при -20 °C и повторно использовано несколько раз. - Промыть нитроцеллюлозу 3x в течение 10 мин каждый в 1x TBST с встряхиванием. Откажитесь от промывки и добавьте 10 мл HRP-конъюгированного вторичного антитела (1:10 000) в 1% BSA в 1x TBST. Встряхивать при комнатной температуре в течение 1 ч. Промыть нитроцеллюлозу 3x в течение 10 мин каждый в 1x TBST с встряхиванием.
- Подготовьте реагент ECL непосредственно перед визуализацией нитроцеллюлозы. Непосредственно перед визуализацией декантируйте TBST и добавьте реагент ECL к нитроцеллюлозе. Встряхните в течение 1 мин. Представьте себе гель.
Access restricted. Please log in or start a trial to view this content.
Результаты
Повышенная чувствительность к промастиготам к SLO в буфере Tyrode по сравнению с M199
Чувствительность SLO L. major promastigotes сравнивали между различными буферами анализа. Промастиготы дикого типа, spt2 и spt2-/+SPT2 были оспорены SLO в бессывороточном буфере M199 или Tyrode, ...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этом исследовании были описаны методы изучения молекулярных механизмов и функций PFT, используя патоген человека Leishmania major в качестве модельной системы. Был разработан среднепроизводительный анализ цитотоксичности на основе проточной цитотоксичности для измерения жизнеспособ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Данная работа была поддержана грантами Национального института аллергии и инфекционных болезней Национальных институтов здравоохранения R21AI156225 ПАК и KZ (co-I) и R01AI139198 KZ (co-I). CH хотел бы поблагодарить Департамент биологических наук за должность ассистента преподавателя, предоставленную во время этого исследования.
Финансирующие учреждения не играли никакой роли в разработке исследования; в сборе, анализе или интерпретации данных; при написании рукописи; ни в решении опубликовать результаты. Содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения финансирующих учреждений. Авторы заявляют, что у них нет конкурирующих конфликтов интересов.
Благодарности
Авторы хотели бы поблагодарить членов лабораторий Кейеля и Чжана за их критический обзор рукописи. Авторы благодарят Колледж искусств и наук микроскопии за использование средств.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.2 mL microtiter (Marsh) tubes | Fisher | 02-681-376 | Cytotoxicity assay |
| 1.5 mL microcentrifuge tube | Fisher | 05-408-129 | Toxin dilutions |
| 15 mL centrifuge tube | Avantor VWR (Radnor, PA) | 89039-666 | To hold cells and media |
| 1x Phosphate buffered saline (PBS) | Fisher | BP399 | For cell processing |
| 3% H2O2 | Walmart (Fayetteville, AR) | N/A | For ECL |
| 5x M199 | Cell-gro | 11150067 | Basal growth media for L. major promastigotes |
| Biosafety cabinet | Baker | To culture cells in sterile conditions | |
| Bovine serum albumin (BSA) | Fisher | BP1605-100 | Fraction V acceptable purity |
| CaCl2 | Fisher | BP510-100 | Stock concentration 100 mM |
| Centrifuge | Thermo Fisher | Heraeus Megafuge 40R | To pellet the cells from culture |
| Cy5 Mono-reactive dye pack | Cytiva (Marlborough, MA) | PA25031 | Fluorophore label for toxins |
| Digital dry bath | Benchmark | BSH1002 | To denature protein samples |
| EGTA | Amresco | 0732-100G | Stock concentration 0.5 M |
| Excel | Microsoft (Redmond, VA) | Data analysis software | |
| Flow cytometer (4-laser Attune NxT) | Fisher | Cytometer for data acquisition | |
| FlowJo | BD (Ashland, OR) | Software | |
| Formaldehyde | Fisher | BP531-500 | Fixative for counting cells |
| G418 | Fisher | BP673-1 | Selection agent for cells |
| Hellmanex III | Sigma | Z805939 | Dilute 1:4 for cleaning cytometer |
| Hemacytometer | Fisher | 0267151B | For counting cells |
| Human red blood cells | Zen-bio (Durham, NC) | SER-10MLRBC | To validate toxin activity |
| Ice bucket | |||
| Light microscope | Nikon | Eclipse 55i | To visualize cells |
| Nitrocellulose | Fisher | 88018 | For probing proteins via antibodies |
| Pipettors and tips | Avantor VWR | To dispense reagents | |
| Power supply | Bio-Rad | To run SDS-PAGE and transfers | |
| Propidium iodide | Biotium | 40016 | Stock concentration 2 mg/mL in water |
| Protein ladder | Bio-Rad | 161-0373 | To determine molecular weight of proteins |
| SDS-PAGE Running Apparatus (Mini Protean III) | Bio-Rad | 165-3302 | To separate proteins based on their size |
| Sealing tape | R&D | DY992 | To seal plates with cells |
| Streptolysin O C530A plasmid insert | Cloned into pBAD-gIII vector (Reference: 7) | ||
| Streptolysin O C530A toxin | Lab purified | Specific activity 4.34 x 105 HU/mg | |
| Swinging bucket rotor | Thermo Fisher | 75003607 | To centrifuge cells |
| V-bottom plate | Greiner Bio-one | 651206 | For cytotoxicity assay |
| Vortex | Benchmark | BV1000 | To mix cells |
| Western blot imaging system (Chemi-doc) | Bio-Rad | To visualize proteins by western blot | |
| Western Blot Transfer Apparatus (Mini Protean III) | Bio-Rad | 170-3930 | Transfer proteins to nitrocellulose |
| Whatman Filter paper | GE Healthcare Life Sciences | 3030-700 | Used in transfer of proteins to nitrocellulose |
| Antibody | |||
| Anti-ERK antibody | Cell Signaling Technologies | Cat# 9102S | Rabbit (1:1000 dilution) |
| Anti-lipophosphoglycan (LPG) antibody | CreativeBioLabs | Cat# WIC79.3 | Mouse (1: 1000) |
| Anti-MEK antibody | Cell Signaling Technologies | Cat# 9122L | Rabbit (1:1000) |
| Anti-mouse IgG, HRP conjugate | Jackson Immunoresearch | Cat#715-035-151 | Donkey (1:10000) |
| Anti-phosphoERK antibody | Cell Signaling Technologies | Cat# 9101S | Rabbit (1:1000) |
| Anti-pMEK antibody | Cell Signaling Technologies | Cat# 9121S | Rabbit (1:1000) |
| Anti-rabbit IgG, HRP conjugate | Jackson Immunoresearch | Cat#711-035-152 | Donkey (1:10000) |
| Anti-tubulin antibody | Sigma | Cat# T5168 | Mouse (1: 2000) |
| Leishmania major Genotypes | Reference: 13 | ||
| Episomal addback (spt2-/+SPT2) | Δspt2::HYG/Δspt2:PAC/+pXG-SPT2 | ||
| Serine palmitoyltransferase subunit 2 knockout (spt2-) | Δspt2::HYG/Δspt2::PAC | ||
| Wild type (WT) | LV39 clone 5 (Rho/SU/59/P) |
Ссылки
- Thapa, R., Ray, S., Keyel, P. A. Interaction of macrophages and cholesterol-dependent cytolysins: The impact on immune response and cellular survival. Toxins. 12 (9), 531(2020).
- Limbago, B., Penumalli, V., Weinrick, B., Scott, J. R. Role of streptolysin O in a mouse model of invasive group A streptococcal disease. Infection & Immunity. 68 (11), 6384-6390 (2000).
- Farrand, A. J., et al. The cholesterol-dependent cytolysin membrane-binding interface discriminates lipid environments of cholesterol to support beta-barrel pore insertion. Journal of Biological Chemistry. 290 (29), 17733-17744 (2015).
- Soltani, C. E., Hotze, E. M., Johnson, A. E., Tweten, R. K. Structural elements of the cholesterol-dependent cytolysins that are responsible for their cholesterol-sensitive membrane interactions. Proceedings of the National Academy of Sciences of the United States of America. 104 (51), 20226-20231 (2007).
- Schoenauer, R., et al. Down-regulation of acid sphingomyelinase and neutral sphingomyelinase-2 inversely determines the cellular resistance to plasmalemmal injury by pore-forming toxins. FASEB Journal. 33 (1), 275-285 (2019).
- Ray, S., Roth, R., Keyel, P. A. Membrane repair triggered by cholesterol-dependent cytolysins is activated by mixed lineage kinases and MEK. Science Advances. 8 (11), (2022).
- Babiychuk, E. B., Monastyrskaya, K., Draeger, A. Fluorescent annexin A1 reveals dynamics of ceramide platforms in living cells. Traffic. 9 (10), 1757-1775 (2008).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136(2014).
- Demonbreun, A. R., et al. An actin-dependent annexin complex mediates plasma membrane repair in muscle. Journal of Cell Biology. 213 (6), 705-718 (2016).
- Wolfmeier, H., et al. Ca(2)(+)-dependent repair of pneumolysin pores: A new paradigm for host cellular defense against bacterial pore-forming toxins. Biochimica et Biophysica Acta. 1853 (2), 2045-2054 (2015).
- Bravo, F., Sanchez, M. R. New and re-emerging cutaneous infectious diseases in Latin America and other geographic areas. Dermatologic Clinics. 21 (4), 655-668 (2003).
- Manfredi, M., Iuliano, S. Cutaneous leishmaniasis with long duration and bleeding ulcer. Clinical Microbiology Open Access. 05, 2-6 (2016).
- Zhang, K., et al. Sphingolipids are essential for differentiation but not growth in Leishmania. EMBO Journal. 22 (22), 6016-6026 (2003).
- Zhang, K. Balancing de novo synthesis and salvage of lipids by Leishmania amastigotes. Current Opinions in Microbiology. 63, 98-103 (2021).
- Kaur, P., Goyal, N. Pathogenic role of mitogen activated protein kinases in protozoan parasites. Biochimie. 193, 78-89 (2022).
- Wiese, M. Leishmania MAP kinases--Familiar proteins in an unusual context. International Journal of Parasitology. 37 (10), 1053-1062 (2007).
- Brumlik, M. J., Pandeswara, S., Ludwig, S. M., Murthy, K., Curiel, T. J. Parasite mitogen-activated protein kinases as drug discovery targets to treat human protozoan pathogens. Journal of Signal Transduction. 2011, 971968(2011).
- Wiese, M., Kuhn, D., Grunfelder, C. G. Protein kinase involved in flagellar-length control. Eukaryotic Cell. 2 (4), 769-777 (2003).
- Agron, P. G., Reed, S. L., Engel, J. N. An essential, putative MEK kinase of Leishmania major. Molecular Biochemistry of Parasitology. 142 (1), 121-125 (2005).
- Ray, S., Thapa, R., Keyel, P. A. Multiple parameters beyond lipid binding affinity drive cytotoxicity of cholesterol-dependent cytolysins. Toxins. 11 (1), (2018).
- Beneke, T., et al. A CRISPR Cas9 high-throughput genome editing toolkit for kinetoplastids. Royal Society Open Science. 4 (5), 170095(2017).
- Kapler, G. M., Coburn, C. M., Beverley, S. M. Stable transfection of the human parasite Leishmania major delineates a 30-kilobase region sufficient for extrachromosomal replication and expression. Molecular and Cellular Biology. 10 (3), 1084-1094 (1990).
- Moitra, S., Pawlowic, M. C., Hsu, F. F., Zhang, K. Phosphatidylcholine synthesis through cholinephosphate cytidylyltransferase is dispensable in Leishmania major. Scientific Reports. 9, 7602(2019).
- Keyel, P. A., Heid, M. E., Watkins, S. C., Salter, R. D. Visualization of bacterial toxin induced responses using live cell fluorescence microscopy. Journal of Visualized Experiments. (68), 4227(2012).
- Romero, M., et al. Intrinsic repair protects cells from pore-forming toxins by microvesicle shedding. Cell Death & Differentiation. 24 (5), 798-808 (2017).
- Keyel, P. A., et al. Streptolysin O clearance through sequestration into blebs that bud passively from the plasma membrane. Journal of Cell Science. 124, 2414-2423 (2011).
- Dong, Z., Patel, Y., Saikumar, P., Weinberg, J. M., Venkatachalam, M. A. Development of porous defects in plasma membranes of adenosine triphosphate-depleted Madin-Darby canine kidney cells and its inhibition by glycine. Laboratory Investigations. 78 (6), 657-668 (1998).
- Loomis, W. P., den Hartigh, A. B., Cookson, B. T., Fink, S. L. Diverse small molecules prevent macrophage lysis during pyroptosis. Cell Death & Disease. 10 (4), 326(2019).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены