É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Decifrando o Mecanismo Molecular e a Função das Toxinas Formadoras de Furos Usando Leishmania Major
Neste Artigo
Resumo
Apresenta-se aqui um protocolo que utiliza promastigotas maiores de Leishmania para determinar a ligação, citotoxicidade e sinalização induzidas por toxinas formadoras de poros. É fornecida uma prova de conceito com estreptolisina O. Outras toxinas também podem ser usadas para alavancar os mutantes genéticos disponíveis em L. major para definir novos mecanismos de resistência a toxinas.
Resumo
Compreender a função e o mecanismo das toxinas formadoras de poros (PFTs) é um desafio porque as células resistem aos danos na membrana causados pelos PFTs. Embora as abordagens biofísicas ajudem a entender a formação de poros, elas geralmente dependem de abordagens reducionistas que não possuem o complemento completo de lipídios e proteínas da membrana. As células humanas cultivadas fornecem um sistema alternativo, mas sua complexidade e redundâncias nos mecanismos de reparo dificultam a identificação de mecanismos específicos. Em contraste, o patógeno protozoário humano responsável pela leishmaniose cutânea, Leishmania major, oferece um equilíbrio ideal entre complexidade e relevância fisiológica. L. major é geneticamente tratável e pode ser cultivada a alta densidade in vitro, e qualquer impacto de perturbações na infecção pode ser medido em modelos murinos estabelecidos. Além disso, L. major sintetiza lipídios distintos de suas contrapartes de mamíferos, o que poderia alterar a dinâmica da membrana. Essas alterações na dinâmica da membrana podem ser investigadas com PFTs da família de toxinas mais bem caracterizadas, as citolisinas dependentes de colesterol (CDCs). Os CDCs se ligam ao ergosterol na membrana de Leishmania e podem matar os promastigotas de L. major, indicando que o L. major é um sistema modelo adequado para determinar os mecanismos celulares e moleculares da função da TFP. Este trabalho descreve métodos para testar a função da TFP em promastigotas de L. major, incluindo cultura de parasitas, ferramentas genéticas para avaliar a suscetibilidade lipídica, ensaios de ligação à membrana e ensaios de morte celular. Esses ensaios permitirão o rápido uso de L. major como um poderoso sistema modelo para entender a função da TFP em uma variedade de organismos evolutivamente diversos e semelhanças na organização lipídica.
Introdução
As toxinas formadoras de perfurações (PFTs) são a maior família de toxinas bacterianas1, mas os mecanismos pelos quais elas perfuram e destroem as células são pouco compreendidos. A família mais bem estudada de toxinas formadoras de poros é a das citolisinas dependentes de colesterol (CDCs). Os CDCs são sintetizados principalmente por bactérias gram-positivas, incluindo o agente causador da fascite necrosante, Streptococcus pyogenes2. S. pyogenes secreta a estreptolisina O (SLO) do CDC, que se liga a esteróis na membrana plasmática das células hospedeiras como monômeros, oligomeriza e insere poros ~20-30 nm na membrana1. O papel que os lipídios desempenham neste processo permanece pouco determinado.
Uma abordagem para estudar as interações lipídio-CDC é o uso de lipossomas quimicamente definidos. Embora os lipossomas definidos forneçam informações sobre os limiares necessários de lipídios para sustentar a ligação de toxinas e a formação de poros3,4, eles não recapitulam totalmente as funções celulares. Por exemplo, os lipossomas reconstituídos carecem de assimetria lipídica dos hospedeiros mamíferos e de modificações lipídicas em resposta às toxinas5. Uma alternativa aos lipossomas é usar linhagens celulares de mamíferos. Embora essas linhagens celulares sejam mais fisiologicamente relevantes, há um grande grau de redundância nos mecanismos de detecção e resistência a toxinas2. Como consequência, as vias de reparo usadas para resistir aos CDCs permanecem mal determinadas. Notavelmente, o influxo de Ca2+ é o principal ativador do reparo da membrana1. A jusante do influxo de Ca2+, várias vias são ativadas, incluindo um reparo dependente de ceramida 6,7 e uma via de reparo dependente de MEK6. Essas vias interagem com outros efetores proteicos, incluindo o complexo de classificação endossômica necessário para o transporte (ESCRT)8 e as anexinas 6,9,10. Dissecar essas vias em células de mamíferos é um desafio devido à redundância, o que confunde a interpretação dos dados.
Uma maneira de equilibrar a complexidade com a simplicidade para dissecar as vias de reparo é o uso de organismos mais simples, como patógenos protozoários do gênero Leishmania. Leishmania sp. causa leishmaniose em humanos e outros animais. A leishmaniose varia desde a leishmaniose cutânea (lesões cutâneas autolimitadas) até a leishmaniose visceral fatal (hepatoesplenomegalia), dependendo da espécie e de outros fatores11. A Leishmania major, agente causador da leishmaniose cutânea, é transmitida ao homem por meio de um vetor flebotomíneo e é utilizada para compreender a função e a infecção da Leishmania 12. Além disso, Leishmania sp. são digênicas12. Eles existem como parasitas de macrófagos de mamíferos intracelulares denominados amastigotas e como promastigotas flagelados de natação livre no flebotomíneo12. Os promastigotas de L. major podem ser cultivados em meios suplementados com soro, como M199, até alta densidade13. Os promastigotas também são geneticamente tratáveis; existem muitos knockouts genéticos, incluindo aqueles que visam as vias de biossíntese lipídica13. Esses knockouts podem ser avaliados quanto ao crescimento e diferenças na infectividade e no desenvolvimento de lesões via infecção de camundongos Balb/c13.
Além da relativa facilidade da cultura de Leishmania e da gama de knockouts de biossíntese lipídica, o parasita tem um genoma mais simples do que os mamíferos. A espécie mais bem caracterizada de Leishmania é L. major, que possui muitas ferramentas genéticas existentes, como mutantes com metabolismo lipídico defeituoso14. Notavelmente, muitas proteínas de reparo estão ausentes. L. major não tem homólogos identificados até o momento para as principais proteínas de reparo de mamíferos, como as anexinas. Isso permite a caracterização de vias de reparo evolutivamente conservadas sem a complexidade dos sistemas de mamíferos. No entanto, as vias de reparo não foram caracterizadas na Leishmania até o momento. Ao mesmo tempo, as principais vias de sinalização envolvidas no reparo, como a via MEK6, são conservadas em Leishmania sp.15,16, embora os homólogos precisem ser validados. A via da proteína quinase ativada por mitógenos (MAPK) é bem estudada em L. mexicana, onde contribui para a sobrevivência intracelular e termoestabilidade em células de mamíferos e controla a metaciclogênese16. Em Leishmania sp., 10 dos 15 MAPKs foram caracterizados17. Prevê-se que LmMAPK9 e LmMAPK13 sejam os mais semelhantes ao ERK1/2 de mamíferos com base na identidade na sequência de lábios de fosforilação conservada. A sequência do lábio de fosforilação é TEY para ERK1/2 de mamíferos e LmMAPK9 e LmMAPK13. No entanto, oito dos MAPKs de Leishmania têm um motivo de fosforilação TDY15. Pelo menos dois homólogos de MEK foram identificados em Leishmania sp., LmxMKK18 e quinase relacionada a MEKK (MRK1)19. Isso sugere que os insights identificados na Leishmania poderiam se traduzir em sistemas de mamíferos. Quando não se traduzem em sistemas de mamíferos, representam alvos terapêuticos para o tratamento da leishmaniose.
Para usar os promastigotas de L. major para estudar o reparo da membrana e as interações com toxinas, são necessárias técnicas de rendimento médio. Embora a imagem de células vivas de alta resolução permita a visualização de proteínas e membranas marcadas em tempo real, é de baixo rendimento e pode não medir a sobrevivência celular. Os ensaios de viabilidade de rendimento médio incluem a captação de corantes medida por citometria de fluxo, a medição da atividade mitocondrial ou a liberação de proteínas celulares como a lactato desidrogenase (LDH). Em células de mamíferos, os ensaios de LDH não medem quantitativamente a morte celular20. Além disso, ensaios de base populacional como liberação de LDH ou atividade mitocondrial não permitem análises robustas de célula única ou multiparamétrica20. Em contraste, os ensaios baseados em citometria de fluxo permitem a análise multiparamétrica de célula única20. No entanto, esses ensaios não foram aplicados para entender a biologia da toxina ou as respostas a toxinas em promastigotas de L. major.
Neste estudo, o SLO é usado como uma ferramenta para entender a perturbação da membrana plasmática do mutante nulo esfingolipídico de L. major em dois tampões diferentes - o meio M199 rotineiramente usado para cultivar promastigotas de L. major e o tampão de Tyrode mais simples . Um ensaio de citometria de fluxo de rendimento médio é descrito e usado para gerar curvas dose-resposta de toxinas. Os dados do ensaio citométrico de fluxo são modelados em uma curva logística para determinar os valores de CL50 . Com essas informações, uma dose sublítica de SLO pode ser determinada para que os anticorpos MAPK possam ser validados usando western blotting.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todas as diretrizes apropriadas e práticas microbiológicas, de segurança e de cultura celular padrão foram empregadas para o uso e manuseio do DNA recombinante do patógeno Leishmania major e recombinante do RG2. Todos os experimentos com L. major vivo foram realizados em um gabinete de biossegurança em um laboratório certificado BSL-2. O trabalho foi supervisionado pelo Comitê de Biossegurança Institucional da Texas Tech University.
NOTA: Do ponto de vista da segurança, os promastigotas vivos de L. major são patógenos do Grupo de Risco 2. Lidar com o uso de contenção, precauções e supervisão apropriadas do Comitê Institucional de Biossegurança (IBC). Manipular substâncias tóxicas e produtos químicos de acordo com os procedimentos institucionais para substâncias tóxicas. Se forem utilizadas toxinas recombinantes, a aprovação e a supervisão do GRG podem ser necessárias para o trabalho de ADN recombinante.
1. Cultivo e preparação de promastigotas de L. major
- Obter, ou fazer e validar, L. principais mutantes genéticos, conforme descrito anteriormente, usando métodos homólogos de recombinação ou baseados em CRISPR13,21. Use nocautes complementados com o gene adicionado de volta em um plasmídeo para garantir a especificidade do nocaute.
- Cultura de promastigotas selvagens do tipo L. major e spt2- a 27 °C em meio M199 completo. Cultivar as células episómicas de addback (spt2-/+SPT2) em M199 completo mais 10 μg/ml G418 (ver Tabela 1 e Tabela de Materiais).
NOTA: Toda a configuração experimental envolvendo experimentos com células L. principais deve ser realizada em um gabinete de biossegurança certificado pela BSL2. - Cultivar os promastigotas em meio M199 completo22 até atingirem a fase logarítmica (2-8 x 106 células/mL), conforme determinado pelos ensaios de curva de crescimento de L. major realizados anteriormente23. Planeje 1 x 10 5 células para cada poço para citotoxicidade, mais 5 x 105 células para controle de coloração. Para Western Blot, planeje 2 x 107 células por poço.
NOTA: Realizar ensaio de citotoxicidade com duas repetições técnicas. - Para verificar a densidade celular adequada, misture uma alíquota (10-40 μL) de promastigotas com um volume igual de fixador (3,7% de paraformaldeído em 1x PBS). Carregar 10 μL da amostra fixa em cada lado do hemacitómetro.
CUIDADO: O formaldeído é um produto químico tóxico. Manusear de acordo com as políticas institucionais para produtos químicos perigosos. - Realize a contagem de células usando um microscópio com ampliação de 20x. Conte todas as células nos 25 pequenos quadrados no centro do hemacitômetro. Repita para os quadrados de ambos os lados e faça a média das contagens.
NOTA: Se a variação entre as contagens for >10, recontagem e média. Se a contagem média for <10 ou >100, altere a diluição e a recontagem e, em seguida, calcule a densidade de cultura usando a seguinte fórmula: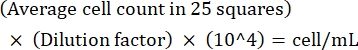 (Eq 1)
(Eq 1)
Por exemplo, se houver em média 250 Leishmania em 25 quadrados, a densidade de cultura é de 5 x 106 células/mL. - Após a contagem, transfira 5 x 106 células para um tubo cônico de 15 mL e centrifugar a 1.500 x g por 8 min à temperatura ambiente para peletizar as células.
- Descarte o sobrenadante usando uma pipeta de 10 mL e faça um breve vórtice da pelota celular. Adicione 5 mL de 1x PBS ao mesmo tubo e lave as células invertendo suavemente 3-6x. Centrifugar a 1.500 x g durante 8 min à temperatura ambiente para peletizar as células.
- Descarte o sobrenadante usando uma pipeta de 10 mL e ressuspenda o pellet de 5 x 10 6 células em 5 mL de meio (por exemplo, M199 ou tampão de Tyrode) usado para os experimentos com uma pipeta de 5 mL para dar uma concentração final de 1 x 106 células/mL.
2. Ensaio de citotoxicidade
- Preparação experimental
- Purifice a toxina como descrito anteriormente24, ou compre a toxina de um fornecedor. Alicote em alíquotas de uso único e armazene −80 °C por até 1 ano. Evite vários ciclos de congelamento-descongelamento.
- Determinar a atividade hemolítica para cada toxina usando glóbulos vermelhos humanos (ver Tabela de Materiais)24.
NOTA: A atividade hemolítica é usada porque controla as diferenças de atividade devido à purificação, mutações, etc. A escolha da espécie de eritrócitos pode alterar a atividade hemolítica (por exemplo, a intermediação requer glóbulos vermelhos humanos). - Planeje duas replicações técnicas para cada condição, sete diluições para a curva dose-resposta e um controle sem toxinas.
NOTA: Com promastigotas do tipo selvagem (WT), spt2 e spt2-/+SPT2, dois tratamentos podem ser testados em uma placa de fundo V de 96 poços. Por exemplo, a sensibilidade à mídia pode ser comparada (Figura 1). Em vez de uma placa de fundo em V, podem ser utilizados tubos de microtitulação de 1,2 ml (ver Tabela de Materiais). Devido aos tempos de aquisição no citômetro, não é recomendado o funcionamento de mais de uma placa ao mesmo tempo. - Determine qual buffer de ensaio usar com base nas condições de teste necessárias e no objetivo do experimento.
NOTA: Neste exemplo, dois buffers de ensaio são comparados: M199 e o buffer de Tyrode suplementado com o iodeto de propídio (PI) do corante de viabilidade. O colesterol no soro interferirá na atividade do CDC24. - Calcule a quantidade de toxina necessária com base nas condições e no número de genótipos tratados. Certifique-se de que 50% de lise específica ocorra na metade da curva de diluição.
NOTA: Para CDCs, uma diluição em série de duas vezes dará um bom alcance para modelagem logística posterior. Para promastigotas spt2- , 4.000 HU/mL SLO é a diluição inicial recomendada. Quando toxinas inativas são usadas, uma massa equivalente à dose mais alta pode ser usada em vez disso. - Planeje um volume final de 200 μL por poço e adicione um pequeno volume extra (50-100 μL) para levar em conta o erro da pipeta.
NOTA: Com três genótipos, cada um feito em duplicata, haverá seis amostras para a diluição seriada. - Determine a quantidade total de toxina necessária usando a seguinte fórmula:
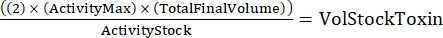 (Eq 2)
(Eq 2)
onde ActivityMax é a maior concentração utilizada (HU/mL); TotalFinalVolume é o volume total (para seis amostras, 200 x 6 + 100 = 1.300 μL); ActivityStock é a atividade do estoque de toxinas (HU/mL); e VolStockToxin é o volume de estoque de toxinas necessário. - Prepare o buffer de ensaio suficiente necessário para o experimento. Complemente o meio basal com um corante de viabilidade e qualquer Ca 2+ ou EGTA necessário para controlar os níveisde Ca2+. Vórtice para misturar.
NOTA: Por exemplo, por cada 10 ml de tampão Tyrode, adicionar 50 μL de 2 mg/ml PI e 200 μL de CaCl 2 de 100 mM, dando concentrações finais de 10 μg/ml e2 mM, respetivamente. - Garantir que o corante de viabilidade PI não entre em conflito com outras sondas utilizadas, como para ensaios de ligação fluorescente usando toxinas conjugadas com Cy5 ou AlexaFluor64720,25.
- Planeje diluições de toxinas para fazer uma solução 2x de toxina. Adicione o tampão de ensaio a tubos de centrífuga de 1,5 mL e esfrie no gelo. Adicione apenas a toxina imediatamente antes de iniciar o ensaio.
NOTA: Neste exemplo, 1,3 mL de tampão de ensaio seria adicionado para a diluição superior, e 650 μL seriam adicionados para diluições seriadas para preparar a solução de toxina 2x.
- Experimentar
- Reserve 0,5 mL de promastigotas processados da etapa 1.8 em um tubo separado como "Controle não corado".
NOTA: Esta amostra será usada para configurar o gating no citômetro de fluxo. - Adicionar 2 mg/mL de IP a uma concentração final de 10 μg/mL aos demais promastigotos. Vórtice por 3 s.
NOTA: Após a adição de IP aos promastigotas processados, essas células só podem ser usadas por um período de tempo de 2,5 h. Após 2,5 h, as células começam a morrer e os resultados se tornam errôneos. - Adicionar 1 x 105 (em 100 μL/poço) de promastigotas processadas a cada poço de uma placa de fundo V de 96 poços ou tubos de microtitulação de 1,2 mL (Figura 1). Coloque a placa ou o suporte do tubo no gelo a um ângulo de aproximadamente 45° da visualização. Realizar o trabalho em um armário de biossegurança ao manusear promastigotas de Leishmania .
- Adicionar 100 μL de tampão de ensaio com PI a cada controlo de não toxinas (última linha). Verifique se o controle foi adicionado corretamente identificando visualmente tubos com um volume total de 200 μL que parecem de cor mais escura.
- Remova as alíquotas da toxina de -80 ° C, descongele no gelo e acumule conforme necessário. Adicionar o volume de toxina calculado na etapa 2.1.5 à diluição mais elevada (preparada na etapa 2.1.10). Em seguida, diluir em série a toxina (Figura 1). Pipeta para cima e para baixo pelo menos 8x para garantir a mistura.
NOTA: Execute no gelo porque os CDCs inativam rapidamente à temperatura ambiente. - A partir da menor concentração de toxina, adicione rapidamente 100 μL de toxina à linha correta (Figura 1 e Figura 2) e continue até que toda a toxina tenha sido adicionada às células.
- Sele a placa com fita adesiva. Incubar a 37 °C durante 30 min. Após o período de incubação, embale e transporte a placa para o citômetro de fluxo.
- Reserve 0,5 mL de promastigotas processados da etapa 1.8 em um tubo separado como "Controle não corado".
- Aquisição de dados
- Configure o citômetro de fluxo (consulte Tabela de Materiais) e o software de aquisição de acordo com as instruções do fabricante e a política por instalação. Não realize o procedimento de citometria de fluxo sem treinamento prévio no citômetro.
NOTA: Neste exemplo, um Attune NxT de 4 laser foi usado. O PI foi coletado no canal YL-1 (excitado por um laser de 561 nm, passado através de um LP 577, refletido a partir de 600 DLP e filtrado através do passe de banda 585/16), embora o amplo espectro do PI permita a coleta em outros canais. - Usando a amostra promastigota de L. major não corada, defina as portas para dispersão frontal e lateral e os parâmetros fluorescentes iniciais com base nos corantes escolhidos.
- Inclua um parâmetro extra, se desejado, para gráficos de pontos para verificar a autofluorescência (por exemplo, "sem mancha") (Figura 3).
NOTA: Neste exemplo, o canal BL-1 (excitado por um laser de 488 nm, passado por 495 DLP e 503 LP, refletido de 555 DLP e filtrado via bandpass 530/30) foi usado. - Usando controles de coloração única, defina as portas para o corante de viabilidade (PI neste estudo) e quaisquer toxinas marcadas fluorescentemente. Monitore a dispersão para a frente versus o tempo para microentupimentos.
NOTA: PI irá manchar fracamente todas as células acima controles não corados. As células mortas serão facilmente separáveis, com células transitoriamente permeabilizadas entre as populações. - Adquira > 10.000 eventos fechados para cada amostra no citômetro.
NOTA: Recomenda-se ler do mais sensível para o menos sensível, mas a ordem de aquisição pode ser invertida para determinar qualquer impacto da ordem de leitura nos resultados da amostra. - Salve os dados e exporte conforme necessário para análise.
- Configure o citômetro de fluxo (consulte Tabela de Materiais) e o software de aquisição de acordo com as instruções do fabricante e a política por instalação. Não realize o procedimento de citometria de fluxo sem treinamento prévio no citômetro.
- Análise de dados
Observação : neste estudo, o Excel com plug-in Solver (consulte Tabela de Materiais) foi utilizado para a análise dos dados (ver Arquivo suplementar 1).- Porta total, L. promastigota de célula única por gating na dispersão para frente e para o lado e tempo conforme necessário (Figura 3). Use altura ou área conforme recomendado para o citômetro de fluxo.
NOTA: Para o citômetro de fluxo usado aqui, a altura é o parâmetro recomendado em vez de área. - Identifique e paguente as células mortas como "PI alto". Células intermediárias de porta como "PI baixo". As células IP altas são células mortas, enquanto as células PI baixas são transitoriamente permeabilizadas26.
NOTA: As células PI altas normalmente mostram um deslocamento de log 2-3 de células negativas. - Exporte os dados para o Excel. Obtenha o nome/ID da amostra e %PI alto para determinar a matança.
NOTA: Se toxinas fluorescentes foram usadas, a intensidade fluorescente mediana (MFI) de populações vivas, transitoriamente permeabilizadas e negativas será necessária. %PI baixo pode ser exportado para permeabilização transitória. - Determine a alta média de %PI para cada condição entre as duas replicações técnicas.
NOTA: Se a IFM média for necessária para toxinas fluorescentes, calcule-a também. - Calcule %Lise específica a partir da alta %PI usando a seguinte fórmula24,25:
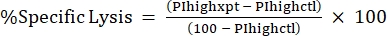 (Eq 3)
(Eq 3)
onde PIhighxpt é o %PI alto para a condição experimental; e PIhighctl é o %PI alto para o controle de não-toxinas. - Gráfico %Lise específica contra a concentração de toxinas para a curva dose-resposta (Figura 4).
- Organize a curva dose-resposta no Excel para modelagem logística. Incluir a concentração de toxinas e a lise %específica média, juntamente com detalhes experimentais e/ou cálculos brutos de %PI altos (Tabela 2).
- Verifique se o suplemento Solver está habilitado.
Observação : para habilitar o Solver na versão de área de trabalho do Excel, vá para Opções de > de arquivo > suplementos e marque a caixa Solver . Reinicie o Excel. - Rotule mais quatro colunas como "modeladas", "residuais", "parâmetros" e "valores de parâmetros". Verifique se as primeiras colunas correspondem aos parâmetros experimentais, à concentração de toxinas e à %Lise específica (Tabela 2).
- Adicione os seguintes parâmetros na coluna "parâmetros": L, k, c, SOMA e LC50. Inicialize os parâmetros L, k e c inserindo os seguintes valores na coluna "valores de parâmetro": 100, 0,05, 1.000.
- Na coluna "modelado", crie o modelo logístico usando a seguinte fórmula:
 (Eq 4)
(Eq 4)
Defina L, k e c para as células que contêm esses parâmetros na coluna "valores de parâmetro".
Defina x para a célula que contém a concentração de toxina.
NOTA: Para a Tabela 2, célula G4, a fórmula é a seguinte: =$J$3/(1+EXP(-$J$4*(D4-$J$5))) - Aplique esta equação a todos os valores de %Lise específica, exceto o controle de não toxinas.
- Na coluna "resíduos", calcule o quadrado da diferença entre o número modelado e a lise específica real usando a seguinte equação:
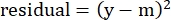 (Eq. 5)
(Eq. 5)
onde y é a lise experimental %Specific Lysis; e m é o valor correspondente na coluna "modelada" calculada nas etapas 2.4.10-2.4.11. - Na coluna "valores de parâmetro" ao lado de "SOMA", some todos os valores na coluna de resíduos.
- Na coluna "valores de parâmetro" ao lado de "LC50", inicialize a equação para calcular a LC50 a partir dos valores determinados. Isso está resolvendo Eq 4 para x quando m = 50.
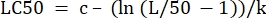 (Eq 6)
(Eq 6)
Para a Tabela 2, a fórmula do Excel é a seguinte: =J5-(LN(J3/(50)-1))/J4 - Abra o Solver na guia Dados. Selecione Definir Objetivo para ser a célula que contém a soma dos resíduos calculados. Defina-o como Min.
- Altere as células variáveis para os valores de parâmetro de L, k e c.
Observação : O solucionador pode se comportar melhor se "Tornar variáveis irrestritas não-negativas" é deixado marcado. - Para valores k negativos, modifique Eq 4 e Eq 6 fatorando −1 de k para alterar k para positivo. Use o método de resolução não linear GRG. Clique em Resolver.
- Verifique a curva e se a CL50 é calculada automaticamente usando a Eq 6 (Tabela 2). Verifique o ajuste plotando graficamente a lise específica e a modelagem em relação à concentração de toxinas.
NOTA: Também pode ser verificado calculando o R2 para a curva.
- Porta total, L. promastigota de célula única por gating na dispersão para frente e para o lado e tempo conforme necessário (Figura 3). Use altura ou área conforme recomendado para o citômetro de fluxo.
3. Análise proteica de promastigotas de L. major desafiados por toxinas
- Preparar promastigotas de L. major conforme descrito na secção 1.
- Ressuspeite 2 x 107 WT, spt2-, e spt2-/+SPT2 L. promastigotas maiores em 2 mL do tampão de ensaio desejado usando uma pipeta de 5 mL (por exemplo, M199 livre de soro). Adicionar toxina a uma concentração sublítica final e incubar a 37 °C durante 30 min.
NOTA: Por exemplo, uma dose sublítica de SLO para promastigotas spt2-é de 500 UH/mL. - Incluir outros genótipos e controles sem toxinas.
- Centrifugar os promastigotas a 1.500 x g por 10 min para peletizar as células. Rejeitar o sobrenadante utilizando uma pipeta de 10 ml. Execute o tubo fechado contendo o pellet de célula rapidamente três vezes através de uma superfície irregular, como a grade do gabinete de biossegurança, para quebrar o pellet de célula.
NOTA: A pelota celular é quase invisível a olho nu. - Reconstituir 1x tampão de amostra SDS-PAGE com 2-mercaptoetanol imediatamente antes do uso e aquecer a 95 °C por 10 min antes da adição ao pellet de célula. Ressuspenda o pellet de célula em buffer de amostra SDS-PAGE quente 1x e misture bem pipetando para cima e para baixo. Aqueça o pellet de célula ressuspenso em 1x tampão de amostra a 95 °C durante 10 min.
NOTA: Após a solubilização em tampão de amostra, armazene as amostras a longo prazo a -20 °C, se necessário. - Prepare o gel de resolução. Desgaseifique todos os componentes, exceto o persulfato de amônio (APS) e o TEMED por 15 min.
- Adicione APS e TEMED imediatamente antes de fundir o gel. Sobreponha cuidadosamente o gel de resolução com água. Deixe o gel de resolução polimerizar, ~ 30-45 min.
- Decante a água e prepare o gel de empilhamento. Adicione o gel de empilhamento, tomando cuidado para evitar bolhas. Insira um pente com o número relevante de poços e deixe polimerizar por 5 min. Monitore a polimerização usando qualquer gel de empilhamento que sobra.
- Monte o gel para executar o SDS-PAGE e adicione o tampão do reservatório à câmara.
- Carregar 10 μL de cada amostra por poço, ou 8 μL da escada de proteínas. Execute a 180 V até que as amostras entrem no gel de resolução e, em seguida, reduza a tensão para ~ 160 V e corra até que a frente do corante esteja a ~ 0,5 cm da borda da placa.
NOTA: O tempo que leva para as amostras chegarem ao fundo pode variar entre 1-1,5 h. O tempo pode ser prolongado reduzindo a tensão. Nunca reduza a tensão a zero. Tensões mais altas podem aumentar o gel "sorrindo" e rachar as placas. - Transfira o gel para a coloração de Coomassie (para coloração de proteínas) ou para o tampão de transferência de 1x (para western blotting). Para coloração de Coomassie, manche durante a noite e, em seguida, destain, imagem e seque.
- Para western blot, prepare o sistema de transferência de acordo com as instruções do fabricante.
- Para uma transferência úmida, use tampão de transferência frio 1x e almofadas pré-úmidas, papel de filtro e nitrocelulose. Para o sistema Bio-rad Protean III (ver Tabela de Materiais) aqui utilizado, o papel de filtro pode ser cortado a 10 cm x 7,5 cm. Corte a nitrocelulose a 9 cm x 6,75 cm.
NOTA: A nitrocelulose é altamente inflamável. Evite chamas abertas e outras fontes potenciais de ignição. - Coloque o de transferência com almofadas, papel de filtro e nitrocelulose. Distribua bolhas de ar. Adicione o gel com cuidado.
- Adicione o papel de filtro e distribua as bolhas de ar. Adicione a almofada, feche o e insira no suporte na orientação correta (certifique-se de que a nitrocelulose esteja voltada para o terminal vermelho). Adicione uma barra de agitação e um bloco de gelo ao lado e cubra o reservatório com um tampão de transferência frio de 1x. Transfira a 110 V por 90 min.
NOTA: O calor gerado durante a transferência pode afetar adversamente a transferência. Para garantir uma boa transferência, use sempre o buffer de transferência frio de 1x. - Remova a nitrocelulose e deixe manchar com a solução de Ponceau por ~5 min. Enxaguar com água ultrapura. Marque a escada de proteína a lápis e corte a mancha conforme necessário. Desine a mancha usando o buffer de transferência restante.
NOTA: Ponceau pode ser reutilizado muitas vezes. - Bloquear a nitrocelulose em 25 mL de BSA a 5% em 1x TBST a 4 °C, com agitação, durante a noite. Em seguida, descarte a solução bloqueadora e adicione o anticorpo primário (1:1.000) em 1% de BSA em 1x TBST. Agitar a 4 °C durante a noite.
NOTA: O anticorpo primário pode ser guardado a -20 °C e reutilizado várias vezes. - Lave a nitrocelulose 3x por 10 min cada em 1x TBST com agitação. Descarte a lavagem e adicione 10 mL de anticorpo secundário conjugado com HRP (1:10.000) em 1% de BSA em 1x TBST. Agitar à temperatura ambiente durante 1 h. Lave a nitrocelulose 3x por 10 min cada em 1x TBST com agitação.
- Prepare o reagente ECL imediatamente antes de criar imagens com a nitrocelulose. Imediatamente antes da imagem, decante o TBST e adicione o reagente ECL à nitrocelulose. Agite por 1 min. Imagem do gel.
Access restricted. Please log in or start a trial to view this content.
Resultados
Aumento da sensibilidade promastigota ao SLO no tampão de Tyrode em comparação com M199
A sensibilidade SLO dos promastigotas de L. major foi comparada entre diferentes tampões de ensaio. Promastigotas do tipo selvagem, spt2 e spt2-/+SPT2 foram desafiados com SLO em M199 livre de soro ou tampão de Tyrode suplementado com CaCl 2 2 mMpor 30 min antes da análise em um citômetro de fluxo. Os parasitas adequados para análise foram células...
Access restricted. Please log in or start a trial to view this content.
Discussão
Neste estudo, foram descritos métodos para estudar os mecanismos moleculares e as funções dos TFPs, utilizando o patógeno humano Leishmania major como sistema modelo. Um ensaio de citotoxicidade baseado em citometria de fluxo de rendimento médio para medir a viabilidade de uma única célula foi desenvolvido. A viabilidade é quantitativa no nível populacional porque os valores de CL50 podem ser calculados a partir da curva dose-resposta usando modelagem logística. Como prova de princípio, um ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Este trabalho foi apoiado pelo Instituto Nacional de Alergia e Doenças Infecciosas dos Institutos Nacionais de Saúde concessão R21AI156225 para PAK e KZ (co-I) e R01AI139198 para KZ (co-I). CH gostaria de agradecer ao Departamento de Ciências Biológicas para a Assistência de Ensino prestado durante o tempo deste estudo.
As agências de fomento não tiveram nenhum papel no desenho do estudo; na coleta, análise ou interpretação de dados; na redação do manuscrito; nem na decisão de publicar os resultados. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais das agências de fomento. Os autores declaram que não têm conflitos de interesse concorrentes.
Agradecimentos
Os autores gostariam de agradecer aos membros dos laboratórios Keyel e Zhang por sua revisão crítica do manuscrito. Os autores agradecem à Faculdade de Artes e Ciências da Microscopia pelo uso das instalações.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.2 mL microtiter (Marsh) tubes | Fisher | 02-681-376 | Cytotoxicity assay |
| 1.5 mL microcentrifuge tube | Fisher | 05-408-129 | Toxin dilutions |
| 15 mL centrifuge tube | Avantor VWR (Radnor, PA) | 89039-666 | To hold cells and media |
| 1x Phosphate buffered saline (PBS) | Fisher | BP399 | For cell processing |
| 3% H2O2 | Walmart (Fayetteville, AR) | N/A | For ECL |
| 5x M199 | Cell-gro | 11150067 | Basal growth media for L. major promastigotes |
| Biosafety cabinet | Baker | To culture cells in sterile conditions | |
| Bovine serum albumin (BSA) | Fisher | BP1605-100 | Fraction V acceptable purity |
| CaCl2 | Fisher | BP510-100 | Stock concentration 100 mM |
| Centrifuge | Thermo Fisher | Heraeus Megafuge 40R | To pellet the cells from culture |
| Cy5 Mono-reactive dye pack | Cytiva (Marlborough, MA) | PA25031 | Fluorophore label for toxins |
| Digital dry bath | Benchmark | BSH1002 | To denature protein samples |
| EGTA | Amresco | 0732-100G | Stock concentration 0.5 M |
| Excel | Microsoft (Redmond, VA) | Data analysis software | |
| Flow cytometer (4-laser Attune NxT) | Fisher | Cytometer for data acquisition | |
| FlowJo | BD (Ashland, OR) | Software | |
| Formaldehyde | Fisher | BP531-500 | Fixative for counting cells |
| G418 | Fisher | BP673-1 | Selection agent for cells |
| Hellmanex III | Sigma | Z805939 | Dilute 1:4 for cleaning cytometer |
| Hemacytometer | Fisher | 0267151B | For counting cells |
| Human red blood cells | Zen-bio (Durham, NC) | SER-10MLRBC | To validate toxin activity |
| Ice bucket | |||
| Light microscope | Nikon | Eclipse 55i | To visualize cells |
| Nitrocellulose | Fisher | 88018 | For probing proteins via antibodies |
| Pipettors and tips | Avantor VWR | To dispense reagents | |
| Power supply | Bio-Rad | To run SDS-PAGE and transfers | |
| Propidium iodide | Biotium | 40016 | Stock concentration 2 mg/mL in water |
| Protein ladder | Bio-Rad | 161-0373 | To determine molecular weight of proteins |
| SDS-PAGE Running Apparatus (Mini Protean III) | Bio-Rad | 165-3302 | To separate proteins based on their size |
| Sealing tape | R&D | DY992 | To seal plates with cells |
| Streptolysin O C530A plasmid insert | Cloned into pBAD-gIII vector (Reference: 7) | ||
| Streptolysin O C530A toxin | Lab purified | Specific activity 4.34 x 105 HU/mg | |
| Swinging bucket rotor | Thermo Fisher | 75003607 | To centrifuge cells |
| V-bottom plate | Greiner Bio-one | 651206 | For cytotoxicity assay |
| Vortex | Benchmark | BV1000 | To mix cells |
| Western blot imaging system (Chemi-doc) | Bio-Rad | To visualize proteins by western blot | |
| Western Blot Transfer Apparatus (Mini Protean III) | Bio-Rad | 170-3930 | Transfer proteins to nitrocellulose |
| Whatman Filter paper | GE Healthcare Life Sciences | 3030-700 | Used in transfer of proteins to nitrocellulose |
| Antibody | |||
| Anti-ERK antibody | Cell Signaling Technologies | Cat# 9102S | Rabbit (1:1000 dilution) |
| Anti-lipophosphoglycan (LPG) antibody | CreativeBioLabs | Cat# WIC79.3 | Mouse (1: 1000) |
| Anti-MEK antibody | Cell Signaling Technologies | Cat# 9122L | Rabbit (1:1000) |
| Anti-mouse IgG, HRP conjugate | Jackson Immunoresearch | Cat#715-035-151 | Donkey (1:10000) |
| Anti-phosphoERK antibody | Cell Signaling Technologies | Cat# 9101S | Rabbit (1:1000) |
| Anti-pMEK antibody | Cell Signaling Technologies | Cat# 9121S | Rabbit (1:1000) |
| Anti-rabbit IgG, HRP conjugate | Jackson Immunoresearch | Cat#711-035-152 | Donkey (1:10000) |
| Anti-tubulin antibody | Sigma | Cat# T5168 | Mouse (1: 2000) |
| Leishmania major Genotypes | Reference: 13 | ||
| Episomal addback (spt2-/+SPT2) | Δspt2::HYG/Δspt2:PAC/+pXG-SPT2 | ||
| Serine palmitoyltransferase subunit 2 knockout (spt2-) | Δspt2::HYG/Δspt2::PAC | ||
| Wild type (WT) | LV39 clone 5 (Rho/SU/59/P) |
Referências
- Thapa, R., Ray, S., Keyel, P. A. Interaction of macrophages and cholesterol-dependent cytolysins: The impact on immune response and cellular survival. Toxins. 12 (9), 531(2020).
- Limbago, B., Penumalli, V., Weinrick, B., Scott, J. R. Role of streptolysin O in a mouse model of invasive group A streptococcal disease. Infection & Immunity. 68 (11), 6384-6390 (2000).
- Farrand, A. J., et al. The cholesterol-dependent cytolysin membrane-binding interface discriminates lipid environments of cholesterol to support beta-barrel pore insertion. Journal of Biological Chemistry. 290 (29), 17733-17744 (2015).
- Soltani, C. E., Hotze, E. M., Johnson, A. E., Tweten, R. K. Structural elements of the cholesterol-dependent cytolysins that are responsible for their cholesterol-sensitive membrane interactions. Proceedings of the National Academy of Sciences of the United States of America. 104 (51), 20226-20231 (2007).
- Schoenauer, R., et al. Down-regulation of acid sphingomyelinase and neutral sphingomyelinase-2 inversely determines the cellular resistance to plasmalemmal injury by pore-forming toxins. FASEB Journal. 33 (1), 275-285 (2019).
- Ray, S., Roth, R., Keyel, P. A. Membrane repair triggered by cholesterol-dependent cytolysins is activated by mixed lineage kinases and MEK. Science Advances. 8 (11), (2022).
- Babiychuk, E. B., Monastyrskaya, K., Draeger, A. Fluorescent annexin A1 reveals dynamics of ceramide platforms in living cells. Traffic. 9 (10), 1757-1775 (2008).
- Jimenez, A. J., et al. ESCRT machinery is required for plasma membrane repair. Science. 343 (6174), 1247136(2014).
- Demonbreun, A. R., et al. An actin-dependent annexin complex mediates plasma membrane repair in muscle. Journal of Cell Biology. 213 (6), 705-718 (2016).
- Wolfmeier, H., et al. Ca(2)(+)-dependent repair of pneumolysin pores: A new paradigm for host cellular defense against bacterial pore-forming toxins. Biochimica et Biophysica Acta. 1853 (2), 2045-2054 (2015).
- Bravo, F., Sanchez, M. R. New and re-emerging cutaneous infectious diseases in Latin America and other geographic areas. Dermatologic Clinics. 21 (4), 655-668 (2003).
- Manfredi, M., Iuliano, S. Cutaneous leishmaniasis with long duration and bleeding ulcer. Clinical Microbiology Open Access. 05, 2-6 (2016).
- Zhang, K., et al. Sphingolipids are essential for differentiation but not growth in Leishmania. EMBO Journal. 22 (22), 6016-6026 (2003).
- Zhang, K. Balancing de novo synthesis and salvage of lipids by Leishmania amastigotes. Current Opinions in Microbiology. 63, 98-103 (2021).
- Kaur, P., Goyal, N. Pathogenic role of mitogen activated protein kinases in protozoan parasites. Biochimie. 193, 78-89 (2022).
- Wiese, M. Leishmania MAP kinases--Familiar proteins in an unusual context. International Journal of Parasitology. 37 (10), 1053-1062 (2007).
- Brumlik, M. J., Pandeswara, S., Ludwig, S. M., Murthy, K., Curiel, T. J. Parasite mitogen-activated protein kinases as drug discovery targets to treat human protozoan pathogens. Journal of Signal Transduction. 2011, 971968(2011).
- Wiese, M., Kuhn, D., Grunfelder, C. G. Protein kinase involved in flagellar-length control. Eukaryotic Cell. 2 (4), 769-777 (2003).
- Agron, P. G., Reed, S. L., Engel, J. N. An essential, putative MEK kinase of Leishmania major. Molecular Biochemistry of Parasitology. 142 (1), 121-125 (2005).
- Ray, S., Thapa, R., Keyel, P. A. Multiple parameters beyond lipid binding affinity drive cytotoxicity of cholesterol-dependent cytolysins. Toxins. 11 (1), (2018).
- Beneke, T., et al. A CRISPR Cas9 high-throughput genome editing toolkit for kinetoplastids. Royal Society Open Science. 4 (5), 170095(2017).
- Kapler, G. M., Coburn, C. M., Beverley, S. M. Stable transfection of the human parasite Leishmania major delineates a 30-kilobase region sufficient for extrachromosomal replication and expression. Molecular and Cellular Biology. 10 (3), 1084-1094 (1990).
- Moitra, S., Pawlowic, M. C., Hsu, F. F., Zhang, K. Phosphatidylcholine synthesis through cholinephosphate cytidylyltransferase is dispensable in Leishmania major. Scientific Reports. 9, 7602(2019).
- Keyel, P. A., Heid, M. E., Watkins, S. C., Salter, R. D. Visualization of bacterial toxin induced responses using live cell fluorescence microscopy. Journal of Visualized Experiments. (68), 4227(2012).
- Romero, M., et al. Intrinsic repair protects cells from pore-forming toxins by microvesicle shedding. Cell Death & Differentiation. 24 (5), 798-808 (2017).
- Keyel, P. A., et al. Streptolysin O clearance through sequestration into blebs that bud passively from the plasma membrane. Journal of Cell Science. 124, 2414-2423 (2011).
- Dong, Z., Patel, Y., Saikumar, P., Weinberg, J. M., Venkatachalam, M. A. Development of porous defects in plasma membranes of adenosine triphosphate-depleted Madin-Darby canine kidney cells and its inhibition by glycine. Laboratory Investigations. 78 (6), 657-668 (1998).
- Loomis, W. P., den Hartigh, A. B., Cookson, B. T., Fink, S. L. Diverse small molecules prevent macrophage lysis during pyroptosis. Cell Death & Disease. 10 (4), 326(2019).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados