Method Article
توليد الخلايا القاتلة الطبيعية من الخلايا الجذعية البشرية المحتملة الموسعة
In This Article
Summary
يوضح البروتوكول الحالي كيفية التمييز بين خلايا CD3− / CD45 + CD56 + ذات السمية الخلوية الخفيفة والخلايا الجذعية البشرية المحتملة الموسعة (hEPSCs) في ظل ظروف الاستزراع ثلاثي الأبعاد و 2D. وهذا يسمح بالتحقق من النمط الظاهري الروتيني دون تدمير البيئة المكروية المعقدة.
Abstract
يسمح تمايز الخلايا القاتلة الطبيعية (NK) عن الخلايا الجذعية البشرية متعددة القدرات بإجراء البحوث على المنتجات الخلوية السريرية وتصنيعها للعلاج المناعي. يوصف هنا بروتوكول من مرحلتين يستخدم وسيطا تجاريا خاليا من المصل وكوكتيلا من السيتوكينات (إنترلوكين [IL] -3 ، IL-7 ، IL-15 ، عامل الخلايا الجذعية [SCF] ، و التيروزين كيناز 3 ليجند الشبيه ب FMS [Ftl3L]) للتمييز بين الخلايا الجذعية البشرية المحتملة الموسعة (hEPSCs) إلى خلايا تمتلك خصائص الخلايا القاتلة الطبيعية في المختبر باستخدام تقنية الاستزراع ثلاثية الأبعاد (3D) و 2 الأبعاد (2D). باتباع هذا البروتوكول ، يتم إنشاء خلايا CD3−CD56 + أو CD45 + CD56 + NK باستمرار. عند الاستزراع مع أهداف الورم لمدة 3 ساعات ، تظهر المنتجات المتمايزة سمية خلوية خفيفة مقارنة بخط الخلايا الدائمة المستقل IL-2 ، خلايا NK92mi. يحافظ البروتوكول على تعقيد البيئة المكروية التمايز عن طريق توليد هياكل 3D ، مما يسهل دراسة العلاقات المكانية بين الخلايا المناعية ومنافذها. وفي الوقت نفسه ، يتيح نظام الثقافة 2D التحقق الظاهري الروتيني من تمايز الخلايا دون الإضرار بمكانة التمايز الدقيقة.
Introduction
بالمقارنة مع الخلايا الجذعية التقليدية متعددة القدرات مثل الخلايا الجذعية الجنينية البشرية (hESCs) والخلايا الجذعية متعددة القدرات المستحثة من الإنسان (hiPSCs) ، فإن الخلايا الجذعية البشرية المحتملة الموسعة (hEPSCs) أقرب إلى حالة القدرة الكاملة ، حيث يمكن أن تتمايز إلى سلالات خارج الجنين وجنينية1. على سبيل المثال ، يمكن تمييز hEPSCs إلى خلايا تشبه الأرومة الغاذية1 وخلايا تشبه كيس الصفار2. لتحقيق الفعالية الفريدة ل hEPSCs ، يتم استزراع بلاستومير فردي في وسط يحتوي على عدة جزيئات صغيرة تمنع التزام النسب بالإشارة1 ، والتي يشار إليها باسم وسيط EPSC (EPSCM). إن استزراع hESCs و hiPSCs في EPSCM يوسع من فعاليتها المقيدة سابقا لتمييزها إلى خلايا الأرومة الغاذية1.
الخلايا الجذعية متعددة القدرات هي أداة بحثية قيمة لتجربة التعديلات الجينية الجديدة. نظرا لقدرات التجديد الذاتي والتمايز للخلايا الجذعية متعددة القدرات ، يمكن لاستنساخ واحد محول لخلية جذعية متعددة القدرات إنتاج منتجات خلوية متمايزة تمتلك نفس التعديل الجيني في نفس الموضع. وضع تشو وكوفمان معيارا لتمايز الخلايا القاتلة الطبيعية عن الخلايا الجذعية التقليدية متعددة القدرات (hESCs و hiPSCs)3. أولا ، قاموا بتحفيز الخلايا الجذعية المكونة للدم (HSCs) من جسم جنيني مشتق من الخلايا الجذعية متعددة القدرات. أدت إضافة عامل الخلايا الجذعية (SCF) ، التيروزين كيناز 3 ليجند الشبيه ب FMS (Ftl3L) ، الإنترلوكين (IL) -7 ، IL-15 ، ومكمل مبكر من IL-3 إلى تحيز HSCs لتتطور إلى خلايا قاتلة طبيعية (NK). بعد ذلك ، قاموا بتوسيع الخلايا القاتلة الطبيعية بخلايا تقديم المستضد الاصطناعي (aAPCs) ، والتي تقدم IL-21 المرتبط بالغشاء ، مع مكملات مستمرة من IL-2. طبق الباحثون هذا النهج على العلاج المناعي من أجل توليد خلايا قاتلة طبيعية مشتقة من iPSC تتمتع بمستقبلات المستضد الخيمري (CAR-iNK)4.
يتم تعريف الخلايا القاتلة الطبيعية البشرية على أنها كريات الدم البيضاء CD3−CD56 + في الدم المحيطي. هم المستجيبون ضد الخلايا المصابة بالفيروس والخلايا السرطانية5. تتعرف بعض المستقبلات المثبطة على الخلايا القاتلة الطبيعية على الجزيئات المعبر عنها في كل مكان في الخلايا الطبيعية. على سبيل المثال ، يتعرف NKG2A / CD94 heterodimer المعبر عنه على خلايا NK على جزيئات MHC من الفئة الأولى5. وفي الوقت نفسه ، تتعرف المستقبلات المنشطة على الخلايا القاتلة الطبيعية على الروابط التي يسببها الإجهاد ، مثل كيفية التعرف على NKG2D للتسلسل A المرتبط ب MPTIDE من الفئة الأولى من MHC المستحث بالتحول A (MICA / MICK)6. تقوم بعض الخلايا المتحولة بتقليل تنظيم "روابطها الذاتية" للهروب من المراقبة المناعية وتنظيم الروابط الشاذة ، مما يحفز الخلايا القاتلة الطبيعية على تنفيذ آلياتها الحلزونية. لفتت القدرات الجوهرية المضادة للورم للخلايا القاتلة الطبيعية الانتباه إلى هذا النوع من الخلايا المناعية.
إن القدرة على الظهور في وقت واحد لكل من السلالات الجنينية وغير الجنينية قد تجعل hEPSCs تلخيصا أكثر إخلاصا لمكانة التطور الجنيني من الخلايا الجذعية التقليدية متعددة القدرات. من التجربة ، من الأسهل الحفاظ على قوة hEPSCs من hiPSCs. في الدراسة الحالية ، تم تطوير بروتوكول (الشكل 1) لتحيز hEPSCs للتطور إلى سلالات مكونة للدم وتمييز الخلايا السلفية لاحقا إلى خلايا قاتلة طبيعية (NK) في المختبر. في البروتوكول ، يتم استخدام الوسائط التجارية لتجنب تناقضات المصل ، تليها إضافة السيتوكينات تدريجيا إلى التمايز المتحيز إلى السلالات اللمفاوية. يحتوي هذا البروتوكول على نظامين للحفاظ على البيئة المكروية ثلاثية الأبعاد المعقدة أثناء اشتقاق خلايا CD3−CD56 + / CD45 + CD56 + التي تشبه الخلايا القاتلة الطبيعية البشرية ظاهريا ووظيفيا.
قد يكون هذا البروتوكول مفيدا في دراسة تفاعل الخلايا المناعية مع منافذ تمايزها وقد يكون لديه القدرة على تنقية المنتجات الخلوية للاستخدامات العلاجية المناعية.
Protocol
الدراسة الحالية تشارك في التجارب المختبرية . لذلك ، لا تنطبق الموافقة على الأخلاقيات. تم الحصول على خطوط الخلايا المحددة المستخدمة في هذه الدراسة من مصادر تجارية (انظر جدول المواد).
1. توليد الهياكل العضوية 3D من hEPSCs
- حافظ على hEPSCs عن طريق زراعتها ب 1 مل من وسط EPSC (لوحة 12 بئر) على خلايا تغذية SNL1.
ملاحظة: لوحظت مستعمرات على شكل قبة (الشكل 2 أ) إذا بقيت قوتها الموسعة. - إجراء التمايز المسبق ل hEPSCs.
- قم بإزالة وسيط hEPSC ، وأضف 1 مل من وسط DFK (DMEM / F12 + وسيط استبدال المصل بنسبة 10٪ ، انظر جدول المواد). احتضان لمدة 2-3 أيام عند 37 درجة مئوية و 5٪ CO2. قم بإجراء تغيير متوسط في اليوم الثاني إذا استمر الحضانة لمدة 3 أيام.
ملاحظة: تحت المجهر ، يتم تسطيح المستعمرات على شكل قبة (الشكل 2 ب).
- قم بإزالة وسيط hEPSC ، وأضف 1 مل من وسط DFK (DMEM / F12 + وسيط استبدال المصل بنسبة 10٪ ، انظر جدول المواد). احتضان لمدة 2-3 أيام عند 37 درجة مئوية و 5٪ CO2. قم بإجراء تغيير متوسط في اليوم الثاني إذا استمر الحضانة لمدة 3 أيام.
- تحقق من تكوين الأجسام الجنينية بواسطة تقنية القطرة المعلقة 7,8.
- قم بإزالة وسط DFK ، واغسله ب 1 مل من PBS مرة واحدة. أضف 500 ميكرولتر من 0.05٪ تربسين ، واحتضان اللوحة عند 37 درجة مئوية و 5٪ CO2 لمدة 3-7 دقائق بناء على المورفولوجيا.
ملاحظة: يجب أن تكون hEPSCs قابلة للفصل عن خلايا التغذية عندما تكون اللوحة مضطربة قليلا. - قم بإزالة التربسين ، وأضف 2 مل من وسط DFK لحصاد الخلايا. قم بتدوير الخلايا لأسفل بمعدل 300 × جم لمدة 3 دقائق في درجة حرارة الغرفة.
- إزالة طافت مع ماصة. أضف 1 مل من وسط DFK و 1 ميكرولتر من Y27632 (انظر جدول المواد) لإعادة تعليق الخلايا عن طريق النقر.
- احسب عدد الخلايا داخل معلق الخلية باستخدام مقياس الدم9. قم بتخفيف تعليق الخلية بوسط DFK و Y27632 (1000x) بحيث يكون هناك 4000 خلية / 25 ميكرولتر من وسط DFK.
- املأ غطاء طبق بتري 10 سم بحوالي 30-40 قطرة من 25 ميكرولتر من معلق الخلية لكل غطاء. صب بعض PBS في الطبق السفلي لمنع تبخر القطرات. اقلب الغطاء برفق وقم بتغطية الطبق. احتضان الطبق عند 37 درجة مئوية و 5٪ CO2 لمدة 3 أيام.
- قم بإزالة وسط DFK ، واغسله ب 1 مل من PBS مرة واحدة. أضف 500 ميكرولتر من 0.05٪ تربسين ، واحتضان اللوحة عند 37 درجة مئوية و 5٪ CO2 لمدة 3-7 دقائق بناء على المورفولوجيا.
2. الأديم المتوسط والنمط الدموي البطاني للجسم الجنيني (EB)
- اجمع EBs داخل القطرة.
- اجمع كل EBs من القطرة إلى أنبوب سعة 15 مل باستخدام ماصة سعة 1 مل وبعض PBS. ضخ القليل من PBS في القطرة ، ثم استنشاق الوسط ، بما في ذلك EBs ، مع ماصة.
ملاحظة: تشير القطرات ذات اللون الأصفر إلى تكوين ونمو أكثر نجاحا من القطرات الوردية. - قم بتدوير EBs المجمعة بمعدل 100 × جم لمدة 1 دقيقة في درجة حرارة الغرفة ، واستخدم ماصة لإزالة المادة الطافية. أضف 1 مل من الوسط A (من مجموعة تمايز الخلايا المتاحة تجاريا ، انظر جدول المواد) لنقل EBs المجمعة إلى لوحة غير ملتصقة من 24 بئرا. قم بتسمية هذا اليوم على أنه اليوم 0 (الشكل 1).
ملاحظة: عادة ، يتم تجميع جميع EBs التي تم جمعها من طبق واحد 10 سم ونقلها إلى بئر واحد من لوحة 24 بئر.
- اجمع كل EBs من القطرة إلى أنبوب سعة 15 مل باستخدام ماصة سعة 1 مل وبعض PBS. ضخ القليل من PBS في القطرة ، ثم استنشاق الوسط ، بما في ذلك EBs ، مع ماصة.
- أداء نمط الأديم المتوسط من EBs.
- احتضان الطبق لمدة 3 أيام عند 37 درجة مئوية مع 5٪ CO2. في اليوم الثاني ، قم بإزالة 500 ميكرولتر من المتوسط A (من المجموعة ، الخطوة 2.1.2) مع تجنب سحب EBs. ثم أضف 500 ميكرولتر من الوسط الطازج A.
- إجراء المواصفات الدموية البطانية للجسم الجنيني.
- قم بإزالة 700 ميكرولتر من الوسط A من البئر ، وأضف 700 ميكرولتر من الوسط B (من المجموعة ، الخطوة 2.1.2). الثقافة لمدة 7 أيام. قم بإجراء نصف تغيير متوسط B في اليوم 5 واليوم 7 واليوم 9.
3. تمايز الخلايا القاتلة الطبيعية
- انقل EBs المنقوشة إلى واجهة هواء سائل.
- قم بإمالة اللوحة قليلا بحيث تتجمع EBs في الأسفل. استخدم ماصة سعة 1 مل لإزالة أكبر قدر ممكن من الوسط B مع تجنب EBs.
- التقط EBs باستخدام ماصة عن طريق استنشاق الوسيط المتبقي. انقلها إلى بئر في لوحة مكونة من 24 بئرا (انظر جدول المواد).
ملاحظة: قم بتقييد الأرقام إلى اثنين إلى ثلاثة EBs لكل محول للحصول على الكثافة المثلى.
- أداء توسيع السلف اللمفاوي.
- أضف 500 ميكرولتر من وسط NK-1 (وسط التمدد اللمفاوي المتاح تجاريا + 14 وحدة دولية / مل IL-3 ، 4500 وحدة دولية / مل IL-15 ، 8800 وحدة دولية / مل IL-7 ، 26 وحدة دولية / مل SCF ، و 12 وحدة دولية / مل ftl3L ، انظر جدول المواد) إلى الجزء السفلي من البئر. الثقافة لمدة 14 يوما ، وإجراء تغيير متوسط كل يوم.
- حصاد ونقل الخلايا في الأيام 7-10 إلى لوحة المغلفة.
- لطلاء اللوحة ، قم بتخفيف مادة الطلاء (مادة طلاء تمايز اللمفاويات المتاحة تجاريا ، 100x ، انظر جدول المواد) في PBS. أضف 1 مل من محلول الطلاء المخفف إلى كل بئر من صفيحة مكونة من 12 بئرا ، واحتضان اللوحة عند 4 درجات مئوية طوال الليل. تغطية فتح لوحة مع فيلم التفاف.
- أضف 200 ميكرولتر من PBS إلى البئر ، وببطء ماصة لأعلى ولأسفل حوالي خمس إلى ست مرات لحصاد الخلايا المنبعثة من المواد العضوية. تجنب ماصة المواد العضوية.
ملاحظة: يتم إطلاق الخلايا المستديرة من الكائنات العضوية بشكل مستمر (الشكل 2 د). - انقل معلق الخلية المحصودة إلى أنبوب سعة 2 مل ، وقم بتدوير الخلايا لأسفل بمعدل 500 × جم لمدة 5 دقائق في درجة حرارة الغرفة. قم بإزالة المادة الطافية باستخدام ماصة ، وأضف 1 مل من وسط NK-1 (الخطوة 3.2.1) لإعادة تعليق الخلايا عن طريق سحب العينات.
- قم بإزالة كل محلول الطلاء من البئر ، واغسل كل بئر من لوحة 12 بئرا مع 1 مل من PBS مرتين.
- قسم الخلايا المحصودة بنسبة 1: 2. انقل معلق الخلية إلى لوحة مطلية ب 12 بئرا (الخطوة 3.3.1). أضف 1 مل من وسط NK-1 بحيث يحتوي كل بئر على 1.5 مل من الوسط.
- لإجراء تغيير متوسط ، اترك الخلايا تجلس لمدة 1-2 دقيقة للسماح للخلايا بالغرق في القاع. يستنشق بعناية 750 ميكرولتر من المتوسطة. قم بتدوير المادة الطافية المجمعة عند 500 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- تخلص من معظم المادة الطافية ، وأعد تعليقها في 750 ميكرولتر من وسط NK-1 مع ماصة من خمس إلى ست مرات. أضف الخلايا المعاد تعليقها في الوسط الطازج إلى البئر الأصلي.
ملاحظة: يشار إلى هذا النظام المتوازي باسم نظام 2D في الشكل 1. اتبع جدول التغيير المتوسط لبئر الكائنات العضوية التي نشأت منها الخلايا.
- قم بإجراء نضوج الخلايا القاتلة الطبيعية باتباع الخطوات أدناه.
- قم بإزالة الوسيط القديم للنظام ثلاثي الأبعاد ، وأضف 500 ميكرولتر من NK-2 (وسيط تمايز الخلايا القاتلة الطبيعية المتاح تجاريا + 4500 وحدة دولية / مل IL-15 ، و 8800 وحدة دولية / مل IL-7 ، و 26 وحدة دولية / مل SCF ، و 12 وحدة دولية / مل ftl3L ، انظر جدول المواد) في الجزء السفلي من transwell. احتضان عند 37 درجة مئوية و 5٪ CO2 لمدة 14 يوما.
ملاحظة: تأكد من أن الوسيط يلامس الجزء السفلي من البئر. - قم بإجراء تغيير متوسط كامل على الخلايا في نظام 2D. اجمع كل 1.5 مل من الخلايا من بئر واحد ، وقم بطردها بالطرد المركزي عند 500 × جم لمدة 5 دقائق في درجة حرارة الغرفة. قم بإزالة معظم المادة الطافية باستخدام ماصة ، وأعد تعليق الحبيبات ب 1.5 مل من وسط NK-2 (الخطوة 3.4.1).
- قم بإجراء تغيير متوسط كل يوم بديل. قم بإمالة لوحة نظام 3D قليلا ، وقم بإزالة كل الوسائط القديمة خارج transwell. أضف 500 ميكرولتر من وسط NK-2 خارج البئر.
- لإجراء تغيير نصف متوسط على بئر واحد من لوحة 12 بئر لنظام 2D ، اترك الخلايا تجلس لمدة 1-2 دقيقة للسماح للخلايا بالغرق في القاع. استنشاق بعناية 750 ميكرولتر من الوسط.
- قم بتدوير المادة الطافية المجمعة بمعدل 500 × جم لمدة 5 دقائق في درجة حرارة الغرفة لمنع فقدان الخلايا. تخلص من معظم المادة الطافية ، وأعد تعليقها في 750 ميكرولتر من وسط NK-2 عن طريق السحب من خمس إلى ست مرات. أضف الخلايا المعاد تعليقها في وسط جديد إلى البئر الأصلي.
- قم بإزالة الوسيط القديم للنظام ثلاثي الأبعاد ، وأضف 500 ميكرولتر من NK-2 (وسيط تمايز الخلايا القاتلة الطبيعية المتاح تجاريا + 4500 وحدة دولية / مل IL-15 ، و 8800 وحدة دولية / مل IL-7 ، و 26 وحدة دولية / مل SCF ، و 12 وحدة دولية / مل ftl3L ، انظر جدول المواد) في الجزء السفلي من transwell. احتضان عند 37 درجة مئوية و 5٪ CO2 لمدة 14 يوما.
4. حصاد الخلايا الناضجة
- حصاد الخلايا المستزرعة في نظام 2D.
- احصد الخلايا عن طريق سحب الأموال لأعلى ولأسفل خلال الأيام 38-45. يغسل مع 1 مل من PBS مرتين. جهاز طرد مركزي لتعليق الخلية عند 500 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- قم بإزالة المادة الطافية باستخدام ماصة ، وأعد تعليقها في المخزن المؤقت الذي تختاره (على سبيل المثال ، PBS + 2٪ FBS لقياس التدفق الخلوي ، انظر جدول المواد).
- حصاد الخلايا المضمنة في العضوي.
- اجمع الوسط من خارج البئر إلى أنبوب سعة 15 مل خلال الأيام 38-45. اغسل العضو العضوي مرتين بإضافة 200 ميكرولتر من PBS داخل البئر وسحب لأعلى ولأسفل خمس إلى ست مرات. انقل التعليق إلى أنبوب 15 مل.
- أضف 500 ميكرولتر من PBS إلى بئر من لوحة 12 بئر. انقل العضو العضوي من البئر إلى ذلك البئر من الصفيحة المكونة من 12 بئرا بالملقط.
- قطع organoid 20 مرة باستخدام زوج من المقص والملقط. اغسل الخلايا المتبقية على الملقط والمقص في البئر باستخدام PBS. اجمع أكبر قدر ممكن من برنامج تلفزيوني ، وانقله إلى أنبوب 15 مل المستخدم في الخطوة 4.2.1 دون استنشاق البنية العضوية.
- أضف 500 ميكرولتر من كاشف التفكك (انظر جدول المواد) إلى البئر لهضم العضو العضوي إنزيميا. احتضن بمحلول انفصال خلية تجاري (انظر جدول المواد) لمدة 7-10 دقائق عند 37 درجة مئوية و 5٪ CO2. قم بإخماد التفاعل بإضافة 1 مل من PBS مع 2٪ FBS ، واجمع المحلول في أنبوب آخر سعة 15 مل. اغسل البئر ب 1 مل من PBS مع 2٪ FBS مرتين.
ملاحظة: تحديد طول الحضانة على أساس المورفولوجيا. حاول تحقيق النقطة التي تبدأ عندها الخلايا المفردة في إطلاقها من غشاء بنية 3D. - أضف 1 مل من PBS مع 2٪ FBS ، وماصة لأعلى ولأسفل 8-10 مرات. جمع كل الحلول ، بما في ذلك الهياكل العضوية. انقلها إلى أنبوب سعة 15 مل المستخدم في الخطوة 4.2.3 باستخدام مصفاة خلوية.
- جهاز طرد مركزي لكل من الأنابيب عند 500 × جم لمدة 5 دقائق في درجة حرارة الغرفة. تجاهل الطاف مع ماصة. أعد تعليق حبيبات الخلية باستخدام المخزن المؤقت الذي تختاره (الخطوة 4.1.2).
النتائج
تم افتراض أن منتجات التمايز الحالية في المختبر (IVD) ستمتلك علامات سطحية مماثلة وقدرات مضادة للورم لخلايا NK البشرية.
تم الوصول إلى العلامة المميزة لخلايا NK البشرية لاختبار ما إذا كانت منتجات التمايز من نظام ثقافة 3D قد أسفرت عن خلايا تشبه ظاهريا خلايا NK البشرية. حوالي 15٪ من الخلايا المنفصلة عن نظام الاستزراع ثلاثي الأبعاد من دفعتين مستحثتين في نقاط زمنية مختلفة (ن = 2) كانت CD3−CD56+ (الشكل 3A). تم استبدال CD3 ب CD45 (علامة عموم الكريات البيض) في لوحة الاختبار بسبب عدم وجود CD3 وصعوبة تحفيز الخلايا التائية في المختبر. ما يقرب من 16 ٪ من الخلايا المنفصلة عن بنية ثلاثية الأبعاد كانت CD45 + CD56 + (الشكل 3B ، ن = 1) ، وهو ما يتماشى مع النسب المئوية لخلايا CD3−CD56 + التي شوهدت في التجارب السابقة. تراوحت النسب المئوية لخلايا CD3−CD56+ في الخلايا التي تم حصادها من نظام الاستزراع ثنائي الأبعاد من 30٪ إلى 6٪ ، من التحريضات الأكثر نجاحا (الشكل 3C ، n = 3) إلى التحريضات الأقل نجاحا (الشكل 3D ، n = 2). تم التحقق من صحة الوظائف والأنماط الظاهرية للخلايا التي تم حصادها من نظام الثقافة 2D. خلال اليوم 18 من ثقافة نظام 2D ، عبر حوالي 12٪ من الخلايا عن كل من CD56 خارج الرحم و CD107a بعد 2 ساعة من 50 نانوغرام / مل IL-18 ، 455 وحدة دولية / مل IL-2 ، و 20 نانوغرام / مل مضاد CD244 تحفيز الأجسام المضادة (الشكل 4C ، ن = 1). حوالي 28٪ من الخلايا المحصودة كانت CD94 + CD159a + (الشكل 4B ، n = 1). يشير التعبير خارج الرحم ل CD107a ، وهو بطانة بروتينية على غشاء الحبيبات ، إلى التحلل10 ، في حين أن CD94 / NKG2A (CD159a) غير متجانس هو علامة تعريف أخرى للخلايا القاتلة الطبيعية. يوفر هذا مثالا على التحقق من النمط الظاهري والوظيفي لمنتجات IVD.
تم اختبار وظائف منتجات IVD من خلال سميتها الخلوية ضد خلايا الدم الحمراء البشرية - خلايا K562. يكشف التنميط الشامل لليجند على خلايا K562 عن معقد الكيمياء النسيجية الرئيسي I (MHC-I) وتعبير NKG2D ligand القوي نسبيا (مثل ULBP-1 و ULBP-2/5/6 و ULBP-3)11 ؛ وبالتالي ، فإن خلايا K562 عرضة للنشاط الليتيك للخلايا القاتلة الطبيعية12. تم تجهيز كل من منتجات نقطة النهاية IVD وخلايا NK92mi ب 50 نانوغرام / مل IL-18 و 455 وحدة دولية / مل IL-2 و 20 نانوغرام / مل من الأجسام المضادة ل CD244 بين عشية وضحاها. تم استزراع خلايا GFP + K562 إما مع الخلايا المحصودة من خلايا IVD أو NK92mi بنسب مختلفة من المستجيب إلى الهدف (E: T) في وجود 50 نانوغرام / مل (لم يتم توفير وحدة دولية) IL-18 و 455 وحدة دولية / مل IL-2 و 20 نانوغرام / مل من الأجسام المضادة المضادة ل CD244 في نفس الحجم من وسط H5100 لمدة 3 ساعات. كانت قراءة نشاط قتل الخلايا القاتلة الطبيعية هي التعبير عن علامة الخلية الميتة على مجموعات GFP + الفرعية. تم تحويل خلايا K562 باستخدام ناقل تحكم متاح تجاريا (انظر جدول المواد) للتعبير عن GFP بشكل أساسي ، وكانت كفاءة النقل حوالي 80٪ (الشكل التكميلي 1A). كانت النسب المئوية لإشارة GFP المضافة متناسبة مع عدد خلايا GFP + K562 المضافة ، مما يشير إلى تعبير GFP محدد من خلايا K562 المحولة (الشكل التكميلي 1B).
تم حساب النسب المئوية للخلايا المستهدفة المحتضرة الموضحة في الشكل 5 بالصيغةالتالية 13:
النسبة المئوية للخلايا الميتة = (FITC + DAPI +٪ من الزراعة المشتركة [على سبيل المثال ، الشكل 5 أ]) - (FITC + DAPI +٪ من خلايا K562 المحولة)
من بين جميع نسب E: T الثلاثة التي تم تقييمها (0.1: 1 ، 0.33: 1 ، 1: 1) ، كانت النسب المئوية لخلايا GFP + المحتضرة مرتبطة بشكل إيجابي بنسب E: T عند استزراعها مع منتجات IVD (الشكل 5B ، hEPSC-NK) أو خلايا NK92mi (الشكل 5B ، NK92mi) ، مما يشير إلى القتل المحدد لأهداف الورم. ومع ذلك ، كانت السمية الخلوية لمنتجات IVD متواضعة نسبيا ضمن الإطار الزمني المختبر (الشكل 5C).
أخيرا ، تمت مقارنة توليد الخلايا السلفية اللمفاوية بين ثقافات 3D و 2D. وقد وجد أن حالة المزرعة ثلاثية الأبعاد ولدت خلايا سلفية (55000 خلية) أكثر من حالة الثقافة ثنائية الأبعاد (36000 خلية) (الشكل التكميلي 2). هذا يشير إلى أن سياق بنية الأنسجة والمكونات الخلوية في ثقافة 3D دعم توليد الخلايا السلفية اللمفاوية.
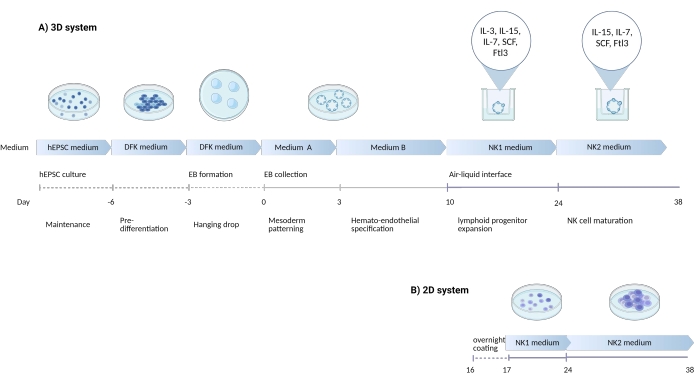
الشكل 1: رسم تخطيطي يوضح استراتيجية التمايز لتمييز الخلايا القاتلة الطبيعية عن hEPSCs . (أ) هنا ، يتم عرض الجدول الزمني لأنظمة الثقافة 3D ، مع تفصيل ظروف الثقافة والكلمات الرئيسية الموجزة من كل خطوة. يتم الحفاظ على واجهة الهواء السائل لنظام 3D أثناء تحريض الخلية NK. (ب) هنا ، يظهر الجدول الزمني لأنظمة الثقافة 2D. يتم زرع الخلايا المنبعثة التي يتم حصادها من الأيام 7-10 من الهياكل في نظام 3D على لوحة مغلفة بدون واجهة الهواء والسائل. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
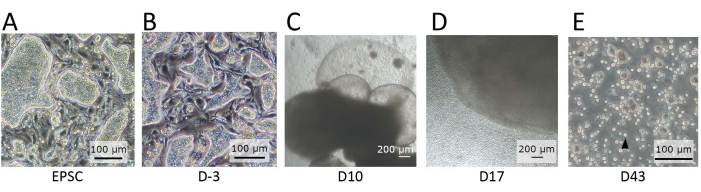
الشكل 2: مورفولوجيا الخلايا التي لوحظت في مراحل متميزة من التمايز. (أ) مورفولوجيا hEPSCs عند الاحتفاظ بها في EPSCM. تشكل hEPSCs مستعمرات على شكل قبة. (ب) مورفولوجيا hEPSCs بعد التمايز المسبق. يتم تسطيح المستعمرات على شكل قبة. يتم حصاد hEPSCs وتشكيل EBs بتقنية الإسقاط المعلق. يتم جمع EBs واستزراعها في الوسط A ثم المتوسط B. (C) مورفولوجيا EB في اليوم 10. خلال هذه الفترة ، يبدأ EB في التوسع والنفخ ، وتشكيل هياكل غشائية. د: مورفولوجيا EB المطلق للخلايا. بعد البذر على البئر ، ينمو EB ويطلق باستمرار خلايا مستديرة إلى المناطق المحيطة. يتم جمع بعض الخلايا التي تم إطلاقها وزراعتها على صفيحة مكونة من 12 بئرا مطلية بمواد طلاء تمايز اللمفاوي. مجموعات الخلايا غير متجانسة شكليا وتميل إلى التجمع معا. ه: مورفولوجيا الخلايا المرصودة عند نقطة نهاية IVD. لوحظت خلايا تعليق دائرية صغيرة (سهم أسود). قضبان المقياس: (أ ، ب ، ه) = 100 ميكرومتر ؛ (C,D) = 100 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
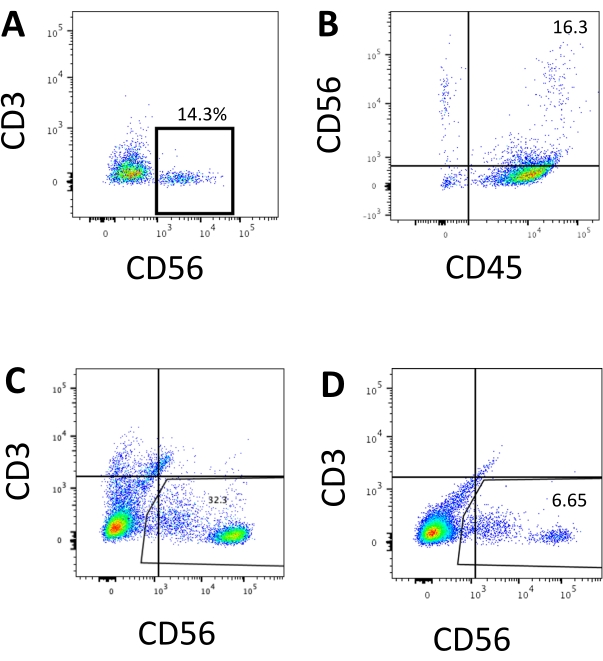
الشكل 3: مخططات تمثيلية لنظام مراقبة الأصول الميدانية للمنتجات المشتقة من نظام تحليل المخاطر الهيدرولوجية (FACS) عند نقطة النهاية. يتم تحضين الخلايا بأجسام مضادة مترافقة بالمنظار الفلوري على الجليد لمدة 30 دقيقة. يتم تلطيخ العينات ب DAPI قبل تحميلها في منفذ حقن عينة FACS. تستخدم الخلايا غير الملوثة لإنشاء البوابة السلبية. (أ) مخطط FACS التمثيلي على تعبير CD3 و CD56 في الخلايا المنفصلة عن نظام الثقافة ثلاثية الأبعاد من دفعتين (n = 2). (ب) مخطط FACS التمثيلي على تعبير CD45 و CD56 في الخلايا المنفصلة عن الثقافة ثلاثية الأبعاد (n = 1). (ج) مخطط FACS التمثيلي على تعبير CD3 و CD56 في الخلايا التي تم حصادها من الصفيحة المطلية من تحريض ناجح (n = 3). (د) مخطط FACS التمثيلي على تعبير CD3 و CD56 من اللوحة المطلية عندما يكون الحث دون المستوى الأمثل (n = 2). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
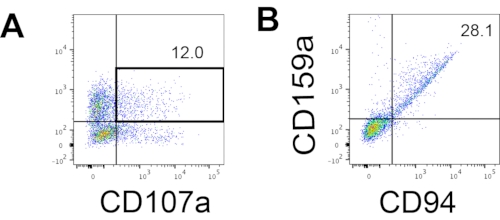
الشكل 4: مخطط FACS التمثيلي للمنتجات المشتقة من hEPSC خلال ثقافة اليوم 18 (ن = 1). (أ) مخطط FACS على تعبير CD56 و CD107a بعد 2 ساعة من التحفيز باستخدام الأجسام المضادة IL2 و IL-18 و CD244. (ب) مخطط FACS على تعبير CD159a و CD94. يتم تلطيخ العينات ب DAPI قبل تحميلها في منفذ حقن عينة FACS. تستخدم الخلايا غير الملوثة لإنشاء البوابة السلبية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
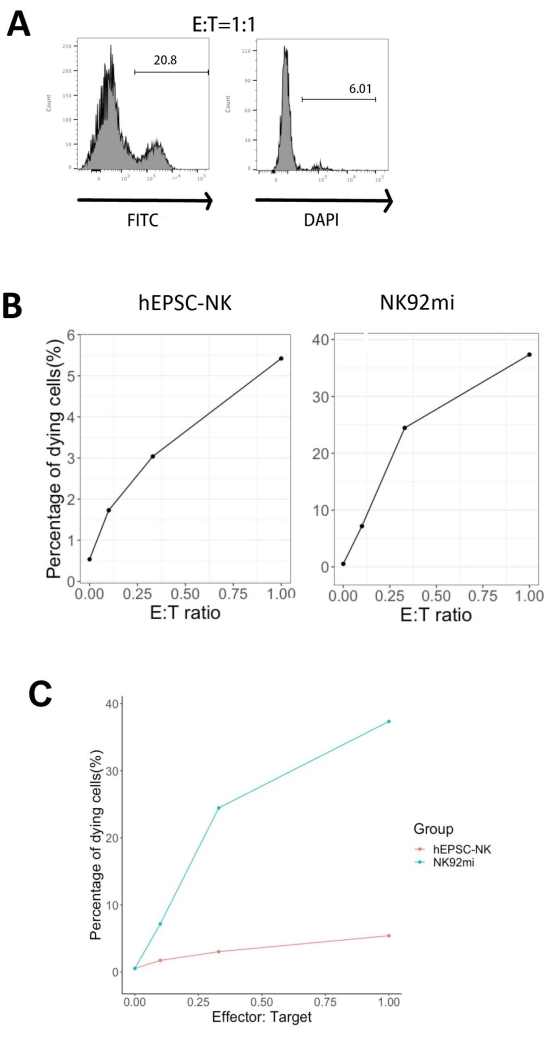
الشكل 5: مخطط النسب المئوية للخلايا الميتة مقابل نسب E: T المختلفة من الزراعة المشتركة لخلايا GFP + K562 مع منتج نقطة نهاية IVD أو خلايا NK92mi (n = 1). تم تقييم تعبير خلايا FETC + DAPI + باستخدام محلل خلوي ، وتم إجراء تحليل البيانات باستخدام برنامج متوافق. (أ) مخطط تمثيلي لنظام FACS يوضح بوابة مجموعات فرعية من FITC + DAPI + من الاستزراع المشترك لمنتجات IVD وخلايا K562 بنسبة E: T تبلغ 1. (ب) قطع فردية من تجربة الاستزراع المشترك مع منتجات GFP + IVD (يسار) أو خلايا NK92mi (يمين) لمدة 3 ساعات. كلاهما يعكس علاقة تناسبية إيجابية بين النسبة المئوية للخلايا الميتة ونسبة E: T. (ج) مخطط يوضح منحنيات القتل لمنتجات IVD وخلايا NK92mi على نفس المقياس. أظهرت منتجات IVD سمية خلوية خفيفة مقارنة بخلايا NK92mi. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل التكميلي 1: الفحص الوظيفي للخلايا القاتلة الطبيعية من hEPSCs. (أ) الرسم البياني FACS لخلايا K562 المحولة. عبرت خلايا FETC + K562 عن GFP. (B) الرسوم البيانية FACS من الاستزراع المشترك لخلايا GFP + K562 ومنتجات IVD لنقطة النهاية بثلاث نسب E: T (n = 1). تتوافق النسب المئوية لخلايا FETC + في الزراعة المشتركة مع عدد خلايا K562 المحولة المضافة. تم إنشاء البوابات بخلايا K562 غير المحولة. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 2: تمايز السلف اللمفاوي في ثقافة 2D مقابل 3D. تم استخدام البروتوكول الحالي القائم على العضوية لحث السلف اللمفاوي من الخلايا الجذعية البشرية المحتملة الموسعة. تم وضع شرطين: (1) تم الاحتفاظ بالسلف اللمفاوي في مزرعة داخل الكائنات العضوية (3D) ، و (2) تم عزل السلف اللمفاوي والاحتفاظ به في طبق الاستزراع (2D). بعد أسبوعين من الثقافة الإضافية ، تم تحديد أرقام الخلايا لمقارنة ثقافة 2D مقابل 3D. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
هناك بعض الخطوات المحورية لضمان التمايز الناجح لخلايا CD45 + CD56 + من hEPSCs. التمايز المسبق (الخطوة 1.2) أمر بالغ الأهمية لأن وسيط EPSC يحتوي على مثبطات التزام النسب1. بعد التمايز المسبق ، يتم تسطيح مستعمرات hEPSCs على شكل قبة (الشكل 2 ب). لا غنى عن إضافة Y27632 ، مثبط Rho-kinase (ROCKi) ، أثناء تكوين EBs من hEPSCs (الخطوة 1.3) لبقاء hEPSCs بعد التفكك. اعتبار آخر مهم هو عدد EBs المزروعة في كل بئر. نظرا لأنه نظام صغير الحجم ، فإن اثنين إلى ثلاثة EBs لكل transwell هي الكثافة المثلى لمنع الاستهلاك المفرط للوسائط. يتم الحفاظ على واجهة الهواء والسائل خلال كامل مسار تمايز الخلايا القاتلة الطبيعية لنظام 3D ، والذي يعتقد أنه يحافظ على قطبية الخلايا اللحمية ويدعم توسع السلف المكونة للدم المشتقة من AGM14,15.
كما ذكرنا من قبل ، فإن كثافة EBs على transwell هي عامل حاسم للتمايز الناجح. العلامة الرئيسية لهذا هو لون الوسط 1 يوم بعد زرع EBs على transwell. إذا تحول اللون إلى اللون الأصفر بسرعة ، فهذا يشير إما إلى التلوث أو الاكتظاظ. لحل المشكلة ، يجب استخدام ماصة 1 مل لالتقاط EBs إضافية يدويا ونقلها إلى بئر آخر.
أحد القيود الرئيسية لهذا البروتوكول هو نقاء خلايا CD3− / CD45 + CD56 + في منتجات IVD ، والتي يعتقد أنها مسؤولة جزئيا عن السمية الخلوية السفلية مقارنة بخلايا NK92mi النقية. تم استخدام نظام ثقافة 3D للحث على السلف المكونة للدم عن طريق توليد EB الذي يشبه الطبقات الجرثومية الجنينية الثلاث. تحاكي هذه الاستراتيجية تطور خلايا الدم في البيئة المكروية لنخاع العظم ، وبالتالي إزالة الحاجة إلى الخلايا اللحمية لدعم التمايز3. بدون خطوة فرز لتنقية السلف المكونة للدم ، من المتوقع أن تنخفض نقاء منتجات IVD. تعمل الإستراتيجية للاحتفاظ بمكانة التمايز المعقدة مع زيادة نقاء منتج نقطة النهاية على تطوير طريقة توسيع لمنتجات CD3−CD56+ IVD التي تم فرزها. على سبيل المثال ، يمكن زراعة منتجات CD3−CD56 + IVD التي تم فرزها على خلايا تقديم المستضد الاصطناعي (aAPCs) ، مثل خلايا K562 المشععة المهندسة باستخدام IL-21 المرتبط بالغشاء. مع توفير IL-2 في الثقافة ، يمكن لهذه الطريقة تحقيق زيادة بمقدار 1000 ضعف في أرقام الخلايا القاتلة الطبيعية3.
ومن القيود الأخرى محدودية الوصول إلى الخلايا البشرية القاتلة الطبيعية كمرجع إيجابي. NK92mi هو المرجع الإيجابي المستخدم في مقايسة الثقافة المشتركة ، لكنه ليس دقيقا بدرجة كافية. تم تصميم خلايا NK92mi من خلايا NK92 ، وهو خط خلية دائم يعبر عن الأنماط الظاهرية للخلايا القاتلة الطبيعيةالمنشطة 16 ، لإنتاج IL-2 بشكل مستقل لتلبية متطلبات الثقافة. تظهر خلايا NK92 نشاطا قاتلا متفوقا ضد خلايا K562 في المختبر مقارنة بالخلايا القاتلة الطبيعية الأوليةالبشرية 17. يمكن تحقيق مقارنة أكثر عدلا لقدرة منتجات IVD على قتل الورم من خلال فحص السمية الخلوية لخلايا الدم القاتلة الطبيعية المحيطية بالتوازي ، ولكن لسوء الحظ ، لا يوجد وصول إلى بنوك الدم.
يهدف بروتوكول الاستزراع ثنائي النظام هذا إلى إنشاء خلايا CD3− / CD45 + CD56 + من hEPSCs. يمكن إجراء تقييم علامات السطح والسمية الخلوية باستخدام FACS بشكل روتيني على خلايا من أنظمة 2D دون تعطيل مكانة التمايز. على الرغم من الاختلافات في النسب المئوية لخلايا CD3−CD56 + ، يمكن للأنظمة ثلاثية الأبعاد و 2D اشتقاق خلايا CD3−CD56 + مع اختلافات مماثلة في تعبير CD56 (الشكل 3) ، ويعكس نظام 2D وجود أسلاف لمفاوية من حالة الثقافة ثلاثية الأبعاد.
تكمن أهمية استخدام نظام ثقافة 3D في أنه يسمح باستخدام مقايسات التنميط عالية الدقة ، مثل النسخ المكاني أو قياس الطيف الكتلي للتصوير ، للبحث في العلاقات المكانية وتفاعلات الخلية الخلوية داخل مكانة التمايز المعقدة.
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح.
Acknowledgements
نود أن نشكر الدكتور هاندي كاو ، وسانشينغ غاو ، وديفيد شيانغ ، وييمينغ تشاو ، وريتيكا جوغاني ، وأوين تشان ، وستيفاني تشيونغ ، وسيلين تشان على مساعدتهم الفنية ومناقشاتهم المفيدة. تم دعم هذا العمل من قبل صندوق تكنولوجيا المنصة. تم إنشاء الشكل 1 باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 30 w/v% Albumin Solution, from Bovine Serum(BSA), Fatty Acid Free | Wako Chemicals | 017-22231 | For resuspending cytokines. |
| ACCUMAX | STEMCELL Technologies | 07921 | |
| Anti-human-CD159a-PE | BD | 375104 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD3-APC antibodies | BD | 555355 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 2% FBS) |
| Anti-human-CD45-APC antibodies | BD | 555485 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 3% FBS) |
| Anti-human-CD56-PE antibodies | BD | 555516 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 4% FBS) |
| Anti-human-CD56-PEcy7 antibodies | BD | 335826 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD94-APC | BD | 559876 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Bemis Parafilm M Laboratory Wrapping Film | Thermo Scientific | 11772644 | |
| Cd244 Monoclonal Antibody (eBioC1.7 (C1.7)), Functional Grade, eBioscience | Thermo Scientific | 16-5838-85 | |
| Costar 6.5 mm Transwell, 0.4 µm Pore Polyester Membrane Inserts | STEMCELL Technologies | 3470 | |
| Dapi Solution, 1 mg/mL | BD | 564907 | It is resuspended with ddH2O so the concentration is 10 µM/mL. Add 1 µL of the aliquot in 300 µL of FACS buffer (PBS + 2% FBS) |
| DMEM | CPOS-Bioreagent core | 11965092 | |
| DMEM/F12 | Thermo Scientific | 11320033 | |
| FcX, human | Biolengend | 422302 | |
| Fetal Bovine Serum(FBS) qualified E.U.-approved South America | CPOS-Bioreagent core | 10270106 | |
| FlowJo v10.8.0 | BD | ||
| Gibco PBS (10x) pH 7.4 | CPOS-Bioreagent core | 70011044 | 10x concentrated PBS is manufactured as follows: without calcium, magnesium or phenol red |
| K562 cells | ATCC | CCL-243 | |
| Knockout Serum Replacement | Thermo Scientific | 10828-028 | |
| MyeloCult H5100 medium | STEMCELL Technologies | 5150 | |
| NK92mi cells | ATCC | CRL-2408 | Lot: 70045208. Once thawed, they are cultured in MyeloCult H5100 medium, and maintained the density between 2 x 105 to 1 x 106 cell/mL. |
| Nunc Cell-Culture Treated Multidishes 12 well plate | Thermo Scientific | 150628 | flat bottom |
| Nunc Cell-Culture Treated Multidishes 24 well plate | Thermo Scientific | 142475 | |
| Nunc EasYDish Dishes | Thermo Scientific | 150460 | |
| pLenti-GFP Lentiviral Control Vector | CELL BIOLABS | LTV-400 | It is packaged as the manufactuer suggested (https://www.cellbiolabs.com/sites/default/files/LTV-400-gfp- lentiviral-plasmid.pdf). 40 μL of 50x lentivirus is added with 1 μL 10 mg/mL polybrene per 1 mL of cell suspension. Complete medium change is performed 24 h after the addition of lentivirus. Cells are incubated undisputedly for 3 days at 37 °C, 5% CO2. |
| Polybrene | EMD Millipore | TR-1003-G | |
| Recombinant Human Flt-3 Ligand/FLT3L Protein | R&D Systems | 308-FK-005 | It is resuspend with PBS + 0.2% BSA. Thr working concentration is 10 ng/mL or 12 IU/mL. |
| Recombinant Human IL-15 Protein | R&D Systems | 247-ILB-005 | It is resuspended with PBS + 0.2% BSA. The working concentration is 10 ng/mL or 4500 IU/mL. |
| Recombinant Human IL-18/IL-1F4 Protein | R&D Systems | 9124-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL. The IU is not provided by the company. |
| Recombinant Human IL-2 Protein | R&D Systems | 202-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL or 455 IU/mL. |
| Recombinant Human IL-3 Protein, 50ug | PeproTech | 200-03 | It is resuspended with PBS + 0.2% BSA. The working concentration is 5 ng/mL or 14 IU/mL. |
| Recombinant Human IL-7 Protein | R&D Systems | 207-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 8800 IU/mL. |
| Recombinant Human SCF Protein | R&D Systems | 255-SC-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 26 IU/mL. |
| STEMdiff Hematopoietic Kit | STEMCELL Technologies | 5310 | Medium A: 45 mL STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement A ; Medium B: 75 STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement B |
| StemSpan lymphoid differentiation coating material | STEMCELL Technologies | 9950 | It is resuspended in PBS (100x) |
| StemSpan NK cell differentiation medium | STEMCELL Technologies | 9960 | It is prepared by adding 500 µL StemSpan NK Cell Differentiation Supplement (100x) into 49.5 mL of SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan lymphoid expansion medium | STEMCELL Technologies | 9960 | It is prepared by adding 5 mL StemSpan Lymphoid Progenitor Expansion Supplement (10x) into 45 mL of StemSpan SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan NK Cell Generation Kit | STEMCELL Technologies | 9960 | Thaw the medium and materials in room temperature and the medium is stored in 4 °C once thawed. |
| The BD LSRFortessa cell analyzer | BD | ||
| Trypsin-EDTA (0.05%), phenol red | Thermo Scientific | 25300054 | |
| Y-27632 dihydrochloride | Tocris | 1254 | working concentration: 10 µM |
References
- Gao, X., et al. Establishment of porcine and human expanded potential stem cells. Nature Cell Biology. 21 (6), 687-699 (2019).
- Mackinlay, K. M. L., et al. An in vitro stem cell model of human epiblast and yolk sac interaction. eLife. 10, 63930 (2021).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical-scale natural killer cells from human pluripotent stem cells. Methods in Molecular Biology. 2048, 107-119 (2019).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity. Cell Stem Cell. 23 (2), 181-192 (2018).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Dhar, P., Wu, J. D. NKG2D and its ligands in cancer. Current Opinion in Immunology. 51, 55-61 (2018).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Rungarunlert, S., Techakumphu, M., Pirity, M. K., Dinnyes, A. Embryoid body formation from embryonic and induced pluripotent stem cells: Benefits of bioreactors. World Journal of Stem Cells. 1, 11-21 (2009).
- Counting cells using a hemocytometer. abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. Journal of Immunological Methods. 294, 15-22 (2004).
- Tremblay-McLean, A., Coenraads, S., Kiani, Z., Dupuy, F. P., Bernard, N. F. Expression of ligands for activating natural killer cell receptors on cell lines commonly used to assess natural killer cell function. BMC Immunology. 20, 8 (2019).
- Inoue, T., Swain, A., Nakanishi, Y., Sugiyama, D. Multicolor analysis of cell surface marker of human leukemia cell lines using flow cytometry. Anticancer Research. 34 (8), 4539 (2014).
- Mhatre, S. Rapid flow cytometry based cytotoxicity assay for evaluation of NK cell function. Indian Journal of Experimental Biology. 52 (10), 983-988 (2014).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Motazedian, A., et al. Multipotent RAG1+ progenitors emerge directly from haemogenic endothelium in human pluripotent stem cell-derived haematopoietic organoids. Nature Cell Biology. 22 (1), 60-73 (2020).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Yan, Y., et al. Antileukemia activity of a natural killer cell line against human leukemias. Clinical Cancer Research. 4 (11), 2859-2868 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved