Method Article
Generación de células asesinas naturales a partir de células madre humanas de potencial expandido
En este artículo
Resumen
El presente protocolo muestra cómo diferenciar las células CD3−/CD45+CD56+ con citotoxicidad leve de las células madre humanas de potencial expandido (hEPSC) en condiciones de cultivo 3D y 2D. Esto permite la validación fenotípica rutinaria sin la destrucción del microambiente complejo.
Resumen
La diferenciación de las células asesinas naturales (NK) de las células madre pluripotentes humanas permite la investigación y la fabricación de productos celulares de grado clínico para inmunoterapia. Aquí se describe un protocolo de dos fases que utiliza un medio comercial libre de suero y un cóctel de citoquinas (interleucina [IL]-3, IL-7, IL-15, factor de células madre [SCF] y ligando tirosina quinasa 3 similar a FMS [Ftl3L]) para diferenciar células madre humanas de potencial expandido (hEPSC) en células que poseen propiedades de células NK in vitro con tecnología de cultivo tridimensional (3D) y 2-dimensional (2D). Siguiendo este protocolo, las células NK CD3−CD56+ o CD45+CD56+ se generan constantemente. Cuando se cocultivan con dianas tumorales durante 3 h, los productos diferenciados muestran citotoxicidad leve en comparación con una línea celular permanente independiente de IL-2, las células NK92mi. El protocolo preserva la complejidad del microambiente de diferenciación mediante la generación de estructuras 3D, facilitando así el estudio de las relaciones espaciales entre las células inmunes y sus nichos. Mientras tanto, el sistema de cultivo 2D permite la validación fenotípica rutinaria de la diferenciación celular sin dañar el delicado nicho de diferenciación.
Introducción
En comparación con las células madre pluripotentes convencionales como las células madre embrionarias humanas (hESCs) y las células madre pluripotentes inducidas humanas (hiPSCs), las células madre humanas de potencial expandido (hEPSC) están más cerca del estado de totipotencia, ya que pueden diferenciarse en linajes extraembrionarios y embrionarios1. Por ejemplo, las hEPSC se pueden diferenciar en trofoblastos1 y células similares a sacos vitelinos2. Para lograr la potencia única de las hEPSC, se cultiva un blastómero individual en un medio que contiene varias moléculas pequeñas que inhiben la señalización de compromiso de linaje1, que se conoce como medio EPSC (EPSCM). El cultivo de hESCs e hiPSCs en el EPSCM expande su potencia previamente restringida para diferenciarlos en células trofoblastas1.
Las células madre pluripotentes son una valiosa herramienta de investigación para experimentar con nuevas modificaciones genéticas. Debido a las capacidades de autorrenovación y diferenciación de las células madre pluripotentes, un clon transformado de una célula madre pluripotente puede producir productos celulares diferenciados que poseen la misma modificación genética en el mismo locus. Zhu y Kaufman establecieron el estándar para la diferenciación de células NK a partir de células madre pluripotentes convencionales (hESCs e hiPSCs)3. Primero, indujeron células madre hematopoyéticas (HSC) de un cuerpo embrioide derivado de células madre pluripotentes. La adición de factor de células madre (SCF), ligando 3 tirosina quinasa 3 similar a FMS (Ftl3L), interleucina (IL)-7, IL-15 y un suplemento temprano de IL-3 sesgó las HSC para convertirse en células asesinas naturales (NK). Posteriormente, expandieron las células NK con células presentadoras de antígeno artificiales (aAPC), que presentan IL-21 unida a la membrana, con la suplementación continua de IL-2. Los investigadores han aplicado este enfoque a la inmunoterapia para generar células asesinas naturales derivadas de iPSC dotadas del receptor de antígeno quimérico (CAR-iNK)4.
Las células NK humanas se definen como leucocitos CD3-CD56+ en la sangre periférica. Son efectores contra las células infectadas por virus y las células tumorales5. Algunos receptores inhibitorios en las células NK reconocen moléculas expresadas ubicuamente en células normales. Como ejemplo, el heterodímero NKG2A/CD94 expresado en células NK reconoce moléculas MHC clase I5. Mientras tanto, los receptores activadores en las células NK reconocen ligandos inducidos por el estrés, como NKG2D reconoce la secuencia A RELACIONADA CON POLIPÉPTIDOS MHC CLASE I inducida por transformación (mica / micb)6. Algunas células transformadas regulan negativamente sus "autoligandos" para escapar de la vigilancia inmune y regulan al alza los ligandos aberrantes, lo que hace que las células NK ejecuten su maquinaria lítica. Las capacidades antitumorales intrínsecas de las células NK han llamado la atención sobre este tipo de células inmunes.
La capacidad de dar lugar simultáneamente a linajes embrionarios y extraembrionarios puede hacer que las hEPSC sean una recapitulación más fiel del nicho de desarrollo embrionario que las células madre pluripotentes convencionales. Por experiencia, es más fácil mantener la potencia de las hEPSC que de las hiPSC. En el presente estudio, se desarrolló un protocolo (Figura 1) para sesgar las hEPSC para convertirse en linajes hematopoyéticos y luego diferenciar las células progenitoras en células asesinas naturales (NK) in vitro. En el protocolo, se emplean medios comerciales para evitar inconsistencias séricas, seguidas de la adición gradual de citoquinas para sesgar la diferenciación en linajes linfoides. Este protocolo tiene dos sistemas para preservar el complejo microambiente 3D mientras se derivan células CD3-CD56 + / CD45 + CD56 + que fenotípica y funcionalmente se parecen a las células NK humanas.
Este protocolo puede ser útil para estudiar la interacción de las células inmunes con sus nichos de diferenciación y puede tener el potencial de purificar productos celulares para usos inmunoterapéuticos.
Protocolo
El presente estudio involucró experimentos in vitro ; por lo tanto, la aprobación ética no es aplicable. Las líneas celulares establecidas utilizadas en este estudio se obtuvieron de fuentes comerciales (ver la Tabla de Materiales).
1. Generación de estructuras organoides 3D a partir de hEPSCs
- Mantener las hEPSC cultivándolas con 1 ml de medio EPSC (placa de 12 pocillos) en células alimentadoras SNL1.
NOTA: Se observan colonias en forma de cúpula (Figura 2A) si su potencia expandida permanece. - Realizar la prediferenciación de los hEPSC.
- Retire el medio hEPSC y agregue 1 ml de medio DFK (DMEM/F12 + 10% de medio de reemplazo sérico, consulte la Tabla de materiales). Incubar durante 2-3 días a 37 °C y 5% deCO2. Realizar un cambio medio el segundo día si continúa la incubación durante 3 días.
NOTA: Bajo el microscopio, las colonias en forma de cúpula se aplanan (Figura 2B).
- Retire el medio hEPSC y agregue 1 ml de medio DFK (DMEM/F12 + 10% de medio de reemplazo sérico, consulte la Tabla de materiales). Incubar durante 2-3 días a 37 °C y 5% deCO2. Realizar un cambio medio el segundo día si continúa la incubación durante 3 días.
- Comprobar la formación de cuerpos embrioides mediante la técnica de gota colgante 7,8.
- Retire el medio DFK y lávese con 1 ml de PBS una vez. Añadir 500 μL de tripsina al 0,05%, e incubar la placa a 37 °C y 5% deCO2 durante 3-7 min en función de la morfología.
NOTA: Las hEPSC deben poder separarse de las celdas de alimentación cuando la placa está ligeramente alterada. - Retire la tripsina y agregue 2 ml de medio DFK para cosechar las células. Haga girar las celdas a 300 x g durante 3 minutos a temperatura ambiente.
- Retire el sobrenadante con una pipeta. Agregue 1 ml de medio DFK y 1 μL de Y27632 (consulte la Tabla de materiales) para resuspender las células mediante el movimiento.
- Contar el número de células dentro de la suspensión celular con un hemocitómetro9. Diluir la suspensión celular con medio DFK e Y27632 (1,000x) para que haya 4,000 células/25 μL de medio DFK.
- Llene la tapa de una placa de Petri de 10 cm con alrededor de 30-40 gotas de 25 μL de suspensión celular por tapa. Vierta un poco de PBS en el plato inferior para evitar la evaporación de las gotas. Invierta suavemente la tapa y cubra el plato. Incubar el plato a 37 °C y 5% deCO2 durante 3 días.
- Retire el medio DFK y lávese con 1 ml de PBS una vez. Añadir 500 μL de tripsina al 0,05%, e incubar la placa a 37 °C y 5% deCO2 durante 3-7 min en función de la morfología.
2. Mesodermo y patrón hemato-endotelial del cuerpo embrioide (EB)
- Recolecte EB dentro de la gota.
- Recoja todos los EB de la gota en un tubo de 15 ml usando una pipeta de 1 ml y un poco de PBS. Bombee un poco de PBS en la gota y luego aspire el medio, incluidos los EB, con la pipeta.
NOTA: Las gotitas que son más amarillas indican una formación y crecimiento más exitosos que las gotas rosadas. - Girar los EB recolectados a 100 x g durante 1 minuto a temperatura ambiente y usar una pipeta para eliminar el sobrenadante. Agregue 1 ml de medio A (de un kit de diferenciación celular disponible comercialmente, consulte la Tabla de materiales) para transferir los EB recolectados a una placa de 24 pocillos no adherente. Etiquete este día como Día 0 (Figura 1).
NOTA: Por lo general, todos los EB recolectados de un plato de 10 cm se agrupan y se transfieren a un pocillo de una placa de 24 pocillos.
- Recoja todos los EB de la gota en un tubo de 15 ml usando una pipeta de 1 ml y un poco de PBS. Bombee un poco de PBS en la gota y luego aspire el medio, incluidos los EB, con la pipeta.
- Realizar patrones de mesodermo de los EB.
- Incubar la placa durante 3 días a 37 °C con 5% deCO2. El día 2, retire 500 μL de medio A (del kit, paso 2.1.2) evitando pipetear los EB. A continuación, añadir 500 μL de medio fresco A.
- Realizar la especificación hemato-endotelial del cuerpo embrioide.
- Retire 700 μL del medio A del pocillo y agregue 700 μL del medio B (del kit, paso 2.1.2). Cultura durante 7 días. Realice un medio cambio de medio B el día 5, el día 7 y el día 9.
3. Diferenciación de células NK
- Transfiera los EB modelados a una interfaz aire-líquido.
- Incline ligeramente la placa para que los EB se agreguen en la parte inferior. Use una pipeta de 1 ml para eliminar la mayor cantidad posible de medio B evitando los EB.
- Recoger los EB con una pipeta aspirando el medio restante. Transfiéralos a un pozo transbordador en una placa de 24 pocillos (consulte la Tabla de materiales).
NOTA: Restrinja los números a dos o tres EB por transwell para una densidad óptima.
- Realizar la expansión del progenitor linfoide.
- Agregue 500 μL de medio NK-1 (medio de expansión linfoide disponible comercialmente + 14 UI/ml IL-3, 4,500 UI/ml IL-15, 8,800 UI/ml IL-7, 26 UI/ml SCF y 12 UI/ml ftl3L, consulte la Tabla de materiales) al compartimiento inferior del transwell. Cultivar durante 14 días, y realizar un cambio medio cada dos días.
- Cosechar y transferir las células en los días 7-10 a una placa recubierta.
- Para recubrir la placa, diluya el material de recubrimiento (material de recubrimiento de diferenciación linfoide disponible comercialmente, 100x, consulte la Tabla de materiales) en PBS. Añadir 1 ml de solución de recubrimiento diluida a cada pocillo de una placa de 12 pocillos e incubar la placa a 4 °C durante la noche. Cubra la abertura de la placa con una película de envoltura.
- Agregue 200 μL de PBS en el transpozo, y pipetear lentamente hacia arriba y hacia abajo alrededor de cinco a seis veces para cosechar las células liberadas de los organoides. Evite pipetear los organoides.
NOTA: Las células redondas se liberan de los organoides continuamente (Figura 2D). - Transfiera la suspensión celular cosechada a un tubo de 2 ml y gire las células a 500 x g durante 5 minutos a temperatura ambiente. Extraer el sobrenadante con una pipeta y añadir 1 ml de medio NK-1 (paso 3.2.1) para resuspender las células mediante pipeteo.
- Retire toda la solución de recubrimiento del pozo y lave cada pocillo de una placa de 12 pocillos con 1 ml de PBS dos veces.
- Divida las células cosechadas en una proporción de 1:2. Transfiera la suspensión celular a una placa recubierta de 12 pocillos (paso 3.3.1). Agregue 1 mL de medio NK-1 para que cada pocillo tenga 1.5 mL de medio.
- Para realizar un cambio medio, deje que las células reposen durante 1-2 minutos para permitir que las células se hundan hasta el fondo. Aspirar cuidadosamente 750 μL de medio. Girar el sobrenadante recogido a 500 x g durante 5 min a temperatura ambiente.
- Desechar la mayor parte del sobrenadante y resuspender en 750 μL de medio NK-1 con pipeteo de cinco a seis veces. Agregue las células resuspendidas en el medio fresco en el pocillo original.
NOTA: Este sistema paralelo se denomina sistema 2D en la figura 1. Siga el horario de cambio del medio del pozo de los organoides de los que se originaron las células.
- Realice la maduración de las células NK siguiendo los pasos a continuación.
- Retire el medio antiguo del sistema 3D y agregue 500 μL de NK-2 (medio de diferenciación de células NK disponible comercialmente + 4,500 UI / ml IL-15, 8,800 UI / ml IL-7, 26 UI / ml SCF y 12 UI / ml ftl3L, consulte la Tabla de materiales) en el compartimiento inferior del transwell. Incubar a 37 °C y 5% deCO2 durante 14 días.
NOTA: Asegúrese de que el medio está tocando la parte inferior del transwell. - Realice un cambio completo del medio en las celdas del sistema 2D. Recoja los 1,5 ml de células de un pocillo y centrifugarlo a 500 x g durante 5 minutos a temperatura ambiente. Retirar la mayor parte del sobrenadante con una pipeta y volver a suspender el pellet con 1,5 ml de medio NK-2 (paso 3.4.1).
- Realice un cambio medio cada día alterno. Incline ligeramente la placa del sistema 3D y retire todo el medio antiguo fuera del transwell. Añadir 500 μL de medio NK-2 fuera del transwell.
- Para realizar un cambio medio medio en un pocillo de una placa de 12 pocillos para el sistema 2D, deje que las celdas reposen durante 1-2 minutos para permitir que las células se hundan hasta el fondo. Aspirar cuidadosamente 750 μL del medio.
- Gire el sobrenadante recolectado a 500 x g durante 5 minutos a temperatura ambiente para evitar la pérdida celular. Desechar la mayor parte del sobrenadante y resuspender en 750 μL de medio NK-2 pipeteando de cinco a seis veces. Agregue las células resuspendidas en medio fresco en el pocillo original.
- Retire el medio antiguo del sistema 3D y agregue 500 μL de NK-2 (medio de diferenciación de células NK disponible comercialmente + 4,500 UI / ml IL-15, 8,800 UI / ml IL-7, 26 UI / ml SCF y 12 UI / ml ftl3L, consulte la Tabla de materiales) en el compartimiento inferior del transwell. Incubar a 37 °C y 5% deCO2 durante 14 días.
4. Recolección de células maduras
- Cosechar las células cultivadas en el sistema 2D.
- Cosechar las células pipeteando hacia arriba y hacia abajo durante los días 38-45. Lavar con 1 ml de PBS dos veces. Centrifugar la suspensión celular a 500 x g durante 5 min a temperatura ambiente.
- Retire el sobrenadante con una pipeta y vuelva a suspenderlo en el tampón de su elección (es decir, PBS + FBS al 2% para citometría de flujo, consulte la Tabla de materiales).
- Cosecha las células incrustadas en el organoide.
- Recoja el medio del exterior del transpozo en un tubo de 15 ml durante los días 38-45. Lave el organoide dos veces agregando 200 μL de PBS dentro del pozo y pipeteando hacia arriba y hacia abajo de cinco a seis veces. Transfiera la suspensión al tubo de 15 ml.
- Agregue 500 μL de PBS en un pocillo de una placa de 12 pocillos. Transfiera el organoide del pozo transaccional al pozo de la placa de 12 pocillos con fórceps.
- Corta el organoide 20 veces usando un par de tijeras y fórceps. Enjuague las células restantes de los fórceps y las tijeras en el pozo con PBS. Recoger la mayor cantidad posible de PBS y transferirla al tubo de 15 ml utilizado en el paso 4.2.1 sin aspirar la estructura organoide.
- Agregue 500 μL del reactivo de disociación (consulte la Tabla de materiales) en el pozo para digerir el organoide enzimáticamente. Incubar con una solución comercial de desprendimiento celular (ver la Tabla de materiales) durante 7-10 min a 37 °C y 5% deCO2. Apague la reacción agregando 1 ml de PBS con FBS al 2% y recoja la solución en otro tubo de 15 ml. Lave el pozo con 1 ml de PBS con 2% de FBS dos veces.
NOTA: Determine la duración de la incubación en función de la morfología. Trate de lograr el punto en el que las células individuales comiencen a liberarse de la membrana de la estructura 3D. - Agregue 1 ml de PBS con 2% de FBS y pipetear hacia arriba y hacia abajo 8-10 veces. Recoge todas las soluciones, incluidas las estructuras organoides. Transfiéralos al tubo de 15 ml utilizado en el paso 4.2.3 con un filtro celular.
- Centrifugar ambos tubos a 500 x g durante 5 min a temperatura ambiente. Deseche el sobrenadante con una pipeta. Resuspender el pellet celular con el tampón de elección (paso 4.1.2).
Resultados
Se planteó la hipótesis de que los productos actuales de diferenciación in vitro (IVD) poseerían marcadores de superficie y capacidades antitumorales similares a las células NK humanas.
Se accedió al marcador definitorio de las células NK humanas para probar si los productos de diferenciación del sistema de cultivo 3D producían células que fenotípicamente se parecían a las células NK humanas. Alrededor del 15% de las células disociadas del sistema de cultivo 3D de dos lotes inducidos en diferentes puntos de tiempo (n = 2) eran CD3−CD56+ (Figura 3A). El CD3 fue reemplazado por CD45 (un marcador panleucocitario) en el panel de prueba debido a la ausencia de CD3 y la dificultad para inducir células T in vitro. Aproximadamente el 16% de las células disociadas de la estructura 3D eran CD45+CD56+ (Figura 3B, n = 1), lo que está en línea con los porcentajes de células CD3−CD56+ observados en ensayos anteriores. Los porcentajes de células CD3−CD56+ en las células recolectadas del sistema de cultivo 2D variaron de 30% a 6%, desde inducciones más exitosas (Figura 3C, n = 3) hasta inducciones menos exitosas (Figura 3D, n = 2). Se validó la funcionalidad y los fenotipos de las células recolectadas del sistema de cultivo 2D. Durante el cultivo del día 18 del sistema 2D, aproximadamente el 12% de las células expresaron CD56 y CD107a ectópicas después de 2 h de estimulación de anticuerpos anti-CD244 de 50 ng/ml IL-18, 455 UI/ml de IL-2 y 20 ng/ml de anticuerpos anti-CD244 (Figura 4C, n = 1). Alrededor del 28% de las células recolectadas eran CD94+CD159a+ (Figura 4B, n = 1). La expresión ectópica de CD107a, un revestimiento proteico en la membrana de los gránulos, indica desgranulación10, mientras que el heterodímero CD94/NKG2A(CD159a) es otro marcador definitorio de las células NK. Esto proporciona un ejemplo de la validación fenotípica y de funcionalidad de los productos IVD.
La funcionalidad de los productos IVD se probó por su citotoxicidad contra las células de eritroleucemia humana-células K562. El perfil completo del ligando en las células K562 revela su complejo histoquímico mayor regulado a la baja I (MHC-I) y la expresión comparativamente fuerte del ligando NKG2D (como ULBP-1, ULBP-2/5/6 y ULBP-3)11; así, las células K562 son susceptibles a la actividad lítica de las células NK12. Tanto los productos de punto final IVD como las células NK92mi se prepararon con 50 ng / ml IL-18, 455 UI / ml IL-2 y 20 ng / ml anticuerpos anti-CD244 durante la noche. Las células GFP+ K562 se cocultivaron con células recolectadas de células IVD o NK92mi en diferentes proporciones efector-objetivo (E:T) en presencia de 50 ng/mL (UI no proporcionada) IL-18, 455 UI/mL IL-2 y 20 ng/mL anticuerpos anti-CD244 en el mismo volumen de medio H5100 durante 3 h. La lectura de la actividad de destrucción de células NK fue la expresión del marcador de células muertas en subconjuntos GFP +. Las células K562 se transducieron con un vector de control disponible comercialmente (ver la Tabla de materiales) para expresar GFP constitutivamente, y la eficiencia de la transducción fue de aproximadamente 80% (Figura suplementaria 1A). Los porcentajes de señal GFP añadida fueron proporcionales al número de células GFP+ K562 añadidas, lo que sugiere una expresión específica de GFP a partir de las células K562 transducidas (Figura suplementaria 1B).
Los porcentajes de células diana moribundas que se muestran en la Figura 5 se calcularon con la siguiente fórmula13:
Porcentaje de células moribundas = (FITC + DAPI + % de cocultivo [por ejemplo, Figura 5A]) - (FITC + DAPI + % de células K562 transducidas)
De las tres proporciones E:T evaluadas (0,1:1, 0,33:1, 1:1), los porcentajes de células GFP+ moribundas se correlacionaron positivamente con las proporciones E:T cuando se cocultivaron con productos IVD (Figura 5B, hEPSC-NK) o células NK92mi (Figura 5B, NK92mi), lo que indica la destrucción específica de los objetivos tumorales. Sin embargo, la citotoxicidad de los productos IVD fue comparativamente modesta dentro del plazo probado (Figura 5C).
Finalmente, se comparó la generación de células progenitoras linfoides entre los cultivos 3D y 2D. Se encontró que la condición de cultivo 3D generó más células progenitoras (55,000 células) que la condición de cultivo 2D (36,000 células) (Figura complementaria 2). Esto sugiere que el contexto de la arquitectura del tejido y los componentes celulares en el cultivo 3D apoyaron la generación de células progenitoras linfoides.
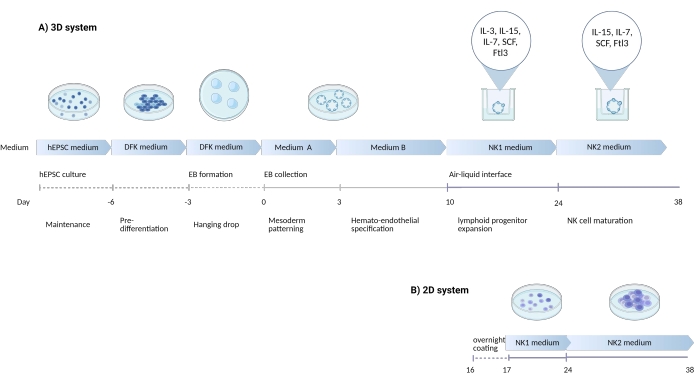
Figura 1: Diagrama esquemático que muestra la estrategia de diferenciación para diferenciar las células NK de las hEPSC . (A) Aquí, se muestra la línea de tiempo de los sistemas de cultivo 3D, detallando las condiciones de cultivo y las breves palabras clave de cada paso. La interfaz aire-líquido del sistema 3D se mantiene durante la inducción de células NK. (B) Aquí, se muestra la línea de tiempo de los sistemas de cultivo 2D. Las células liberadas cosechadas de los días 7-10 de las estructuras en el sistema 3D se siembran en una placa recubierta sin la interfaz aire-líquido. Haga clic aquí para ver una versión más grande de esta figura.
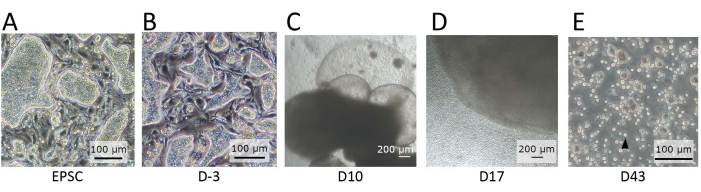
Figura 2: Morfología de las células observadas en distintas etapas de diferenciación. (A) La morfología de las hEPSC cuando se mantienen en EPSCM. Las hEPSC forman colonias en forma de cúpula. (B) La morfología de las hEPSC después de la prediferenciación. Las colonias en forma de cúpula son aplanadas. Los hEPSC se cosechan y forman EB con la técnica de gota colgante. Los EB se recolectan y cultivan en el medio A y luego en el medio B. (C) La morfología de un EB en el día 10. Durante este período, el EB comienza a expandirse e inflarse, formando estructuras membranosas. (D) La morfología de una EB liberadora de células. Después de sembrar en el pozo de transmisión, el EB crece y libera constantemente células redondas a los alrededores. Algunas de las células liberadas se recolectan y cultivan en una placa de 12 pocillos recubierta con materiales de recubrimiento de diferenciación linfoide. Las poblaciones celulares son morfológicamente heterogéneas y tienden a agregarse. (E) La morfología de las células observadas en el punto final del IVD. Se observan pequeñas celdas de suspensión circulares (flecha negra). Barras de escala: (A,B,E) = 100 μm; (C,D) = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
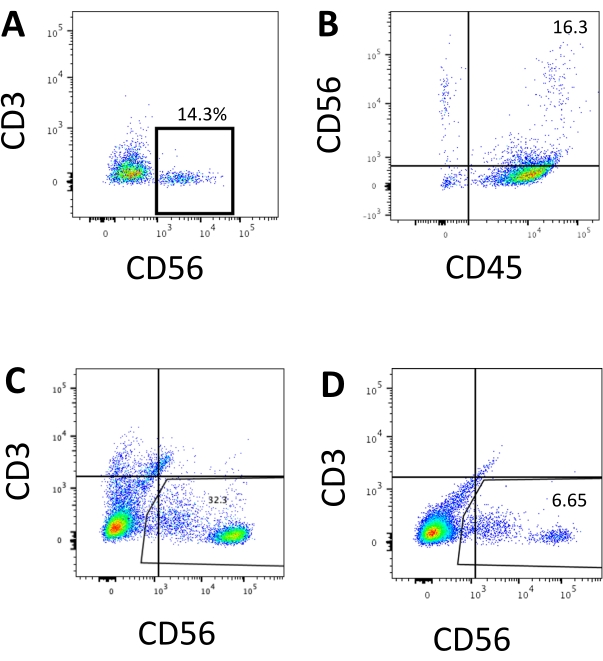
Figura 3: Gráficos representativos del sistema de control de los bienes sobre el terreno de los productos derivados del hEPSC en el punto final. Las células se incuban con anticuerpos conjugados con fluoroscopio en hielo durante 30 minutos. Las muestras se tiñen con DAPI antes de cargarlas en el puerto de inyección de muestras FACS. Las células no teñidas se utilizan para establecer la activación negativa. (A) Gráfico representativo de FACS en la expresión de CD3 y CD56 en células disociadas del sistema de cultivo 3D de dos lotes (n = 2). (B) Gráfico representativo de FACS en la expresión de CD45 y CD56 en células disociadas del cultivo 3D (n = 1). (C) Gráfico representativo de FACS sobre la expresión de CD3 y CD56 en células recolectadas de la placa recubierta de una inducción exitosa (n = 3). (D) Gráfico representativo del FACS en la expresión de CD3 y CD56 de la placa recubierta cuando la inducción es subóptima (n = 2). Haga clic aquí para ver una versión más grande de esta figura.
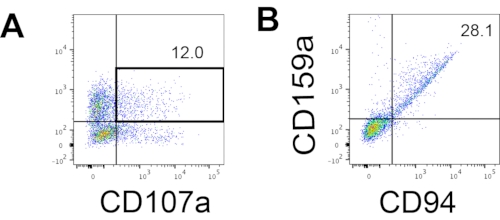
Figura 4: Gráfico representativo del FACS en productos derivados de hEPSC durante el cultivo del día 18 (n = 1). (A) Gráfico FACS en la expresión de CD56 y CD107a después de 2 h de estimulación con IL2, IL-18 y anticuerpos anti-CD244. (B) Diagrama FACS en CD159a y expresión CD94. Las muestras se tiñen con DAPI antes de cargarse en el puerto de inyección de muestras FACS. Las células no teñidas se utilizan para establecer la activación negativa. Haga clic aquí para ver una versión más grande de esta figura.
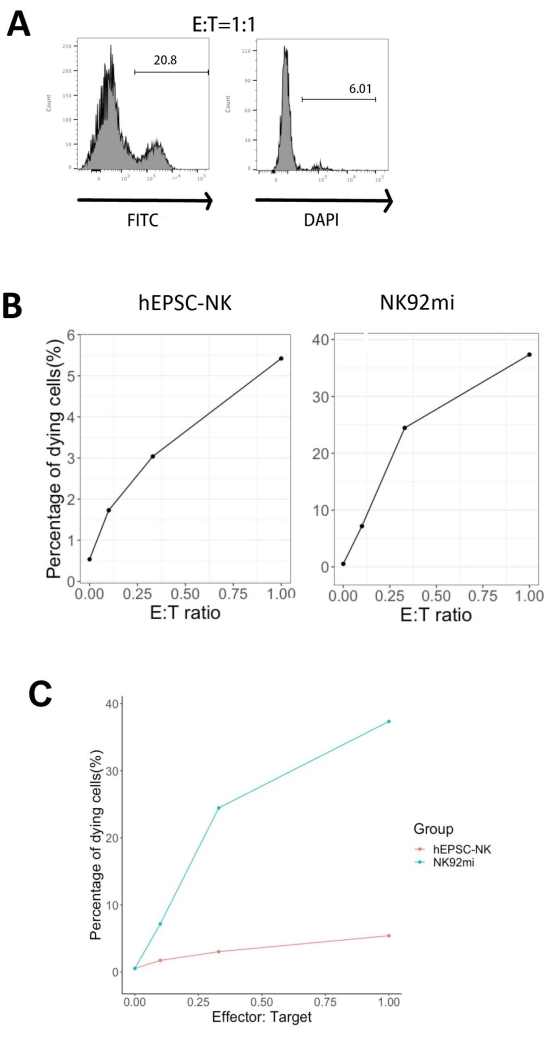
Figura 5: Gráfico de los porcentajes de células moribundas contra diferentes relaciones E:T del cocultivo de células GFP+ K562 con el producto de punto final IVD o células NK92mi (n = 1). La expresión de las células FITC+ DAPI+ se evaluó con un analizador celular y el análisis de datos se realizó con un software compatible. (A) Un gráfico representativo de FACS que muestre la compuerta de los subconjuntos FITC + DAPI + del cocultivo de productos IVD y células K562 con una relación E:T de 1. (B) Parcelas individuales del experimento de cocultivo con productos GFP+ IVD (izquierda) o células NK92mi (derecha) durante 3 h. Ambos reflejan una relación proporcional positiva entre el porcentaje de células moribundas y la relación E:T. (C) Un gráfico que muestra las curvas de muerte de los productos IVD y las células NK92mi en la misma escala. Los productos IVD mostraron citotoxicidad leve en comparación con las células NK92mi. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Ensayo funcional de células NK de hEPSC. (A) Histograma FACS de células K562 transducidas. Las células FITC+ K562 expresaron GFP. (B) histogramas FACS del cocultivo de células GFP+ K562 y los productos IVD de punto final a tres relaciones E:T (n = 1). Los porcentajes de células FITC+ en el cocultivo correspondieron al número de células K562 transducidas añadidas. Los gatings se establecieron con células K562 no transducidas. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Diferenciación de progenitores linfoides en cultivo 2D versus 3D. El presente protocolo basado en organoides se utilizó para inducir progenitores linfoides a partir de células madre humanas de potencial expandido. Se establecieron dos condiciones: (1) los progenitores linfoides se mantuvieron en cultivo dentro de los organoides (3D), y (2) los progenitores linfoides se aislaron y se mantuvieron en la placa de cultivo (2D). Después de 2 semanas de cultivo adicional, se determinó el número de células para comparar el cultivo 2D versus 3D. Haga clic aquí para descargar este archivo.
Discusión
Hay algunos pasos fundamentales para garantizar la diferenciación exitosa de las células CD45 + CD56 + de las hEPSC. La prediferenciación (paso 1.2) es crucial ya que el medio EPSC contiene inhibidores del compromiso de linaje1. Después de la prediferenciación, las colonias en forma de cúpula de hEPSC se aplanan (Figura 2B). La adición de Y27632, un inhibidor de la Rho-quinasa (ROCKi), durante la formación de EBs a partir de hEPSCs (paso 1.3) es indispensable para la supervivencia de las hEPSCs después de la disociación. Otra consideración importante es el número de EB plantados en cada transwell. Dado que es un sistema de pequeña escala, dos o tres EB por transwell es la densidad óptima para evitar el consumo excesivo de los medios. La interfaz aire-líquido se mantiene durante todo el curso de la diferenciación de células NK para el sistema 3D, que se cree que mantiene la polaridad de las células estromales y apoya la expansión de los progenitores hematopoyéticos derivados de AGM14,15.
Como se mencionó anteriormente, la densidad de EB en el transwell es un factor determinante para una diferenciación exitosa. El signo clave para esto es el color del medio 1 día después de la implantación de EB en el transwell. Si el color se vuelve amarillo rápidamente, esto indica contaminación o hacinamiento. Para resolver el problema, se debe usar una pipeta de 1 ml para recoger manualmente los EB adicionales y transferirlos a otro transwell.
Una limitación importante de este protocolo es la pureza de las células CD3−/CD45+ CD56+ en los productos IVD, que se cree que son parcialmente responsables de la citotoxicidad inferior en comparación con las células NK92mi puras. Se empleó un sistema de cultivo 3D para inducir progenitores hematopoyéticos a través de la generación de un EB que se asemeja a las tres capas germinales embrionarias. Esta estrategia imita el desarrollo de las células sanguíneas en el microambiente de la médula ósea, eliminando así la necesidad de células estromales para apoyar la diferenciación3. Sin un paso de clasificación para purificar los progenitores hematopoyéticos, se prevé que se reduzca la pureza de los productos IVD. Una estrategia para retener el nicho de diferenciación complejo mientras se aumenta la pureza del producto de punto final es desarrollar un método de expansión para los productos clasificados CD3−CD56+ IVD. Por ejemplo, los productos clasificados CD3−CD56+ IVD se pueden cultivar en células presentadoras de antígeno artificiales (aAPC), como las células K562 irradicadas diseñadas con IL-21 unida a la membrana. Con el suministro de IL-2 en el cultivo, este método puede lograr un aumento de 1.000 veces en el número de células NK3.
Otra limitación es el acceso limitado a las células NK humanas de buena fe como referencia positiva. NK92mi es la referencia positiva empleada en el ensayo de cocultivo, pero no es lo suficientemente precisa. Las células NK92mi están diseñadas a partir de células NK92, una línea celular permanente que expresa fenotipos16 de células NK activadas, para producir IL-2 de forma autónoma para cumplir con los requisitos de cultivo. Las células NK92 demuestran una actividad de destrucción superior contra las células K562 in vitro que las células NK primarias humanas17. Se podría lograr una comparación más justa de la capacidad de matar tumores de los productos IVD analizando la citotoxicidad de las células NK de sangre periférica en paralelo, pero desafortunadamente, falta acceso a los bancos de sangre.
Este protocolo de cultivo de dos sistemas tiene como objetivo generar células CD3−/CD45+CD56+ a partir de hEPSC. La evaluación de los marcadores de superficie y la citotoxicidad con FACS se puede realizar rutinariamente en células de sistemas 2D sin interrumpir el nicho de diferenciación. A pesar de las diferencias en los porcentajes de células CD3−CD56+, los sistemas 3D y 2D pueden derivar células CD3−CD56+ con variaciones similares en la expresión de CD56 (Figura 3), y el sistema 2D refleja la existencia de progenitores linfoides de la condición de cultivo 3D.
La importancia de utilizar el sistema de cultivo 3D es que permite el uso de ensayos de perfiles de alta resolución, como la transcriptómica espacial o la espectrometría de masas de imágenes, para investigar las relaciones espaciales y las interacciones célula-célula dentro del nicho de diferenciación compleja.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Nos gustaría agradecer al Dr. Handi Cao, Sanxing GAO, David Xiang, Yiming Chao, Ritika Jogani, Owen Chan, Stephanie Cheung y Celine Chan por su asistencia técnica y útiles discusiones. Este trabajo fue apoyado por el Fondo de Tecnología de la Plataforma. La figura 1 se ha creado con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 30 w/v% Albumin Solution, from Bovine Serum(BSA), Fatty Acid Free | Wako Chemicals | 017-22231 | For resuspending cytokines. |
| ACCUMAX | STEMCELL Technologies | 07921 | |
| Anti-human-CD159a-PE | BD | 375104 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD3-APC antibodies | BD | 555355 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 2% FBS) |
| Anti-human-CD45-APC antibodies | BD | 555485 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 3% FBS) |
| Anti-human-CD56-PE antibodies | BD | 555516 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 4% FBS) |
| Anti-human-CD56-PEcy7 antibodies | BD | 335826 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD94-APC | BD | 559876 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Bemis Parafilm M Laboratory Wrapping Film | Thermo Scientific | 11772644 | |
| Cd244 Monoclonal Antibody (eBioC1.7 (C1.7)), Functional Grade, eBioscience | Thermo Scientific | 16-5838-85 | |
| Costar 6.5 mm Transwell, 0.4 µm Pore Polyester Membrane Inserts | STEMCELL Technologies | 3470 | |
| Dapi Solution, 1 mg/mL | BD | 564907 | It is resuspended with ddH2O so the concentration is 10 µM/mL. Add 1 µL of the aliquot in 300 µL of FACS buffer (PBS + 2% FBS) |
| DMEM | CPOS-Bioreagent core | 11965092 | |
| DMEM/F12 | Thermo Scientific | 11320033 | |
| FcX, human | Biolengend | 422302 | |
| Fetal Bovine Serum(FBS) qualified E.U.-approved South America | CPOS-Bioreagent core | 10270106 | |
| FlowJo v10.8.0 | BD | ||
| Gibco PBS (10x) pH 7.4 | CPOS-Bioreagent core | 70011044 | 10x concentrated PBS is manufactured as follows: without calcium, magnesium or phenol red |
| K562 cells | ATCC | CCL-243 | |
| Knockout Serum Replacement | Thermo Scientific | 10828-028 | |
| MyeloCult H5100 medium | STEMCELL Technologies | 5150 | |
| NK92mi cells | ATCC | CRL-2408 | Lot: 70045208. Once thawed, they are cultured in MyeloCult H5100 medium, and maintained the density between 2 x 105 to 1 x 106 cell/mL. |
| Nunc Cell-Culture Treated Multidishes 12 well plate | Thermo Scientific | 150628 | flat bottom |
| Nunc Cell-Culture Treated Multidishes 24 well plate | Thermo Scientific | 142475 | |
| Nunc EasYDish Dishes | Thermo Scientific | 150460 | |
| pLenti-GFP Lentiviral Control Vector | CELL BIOLABS | LTV-400 | It is packaged as the manufactuer suggested (https://www.cellbiolabs.com/sites/default/files/LTV-400-gfp- lentiviral-plasmid.pdf). 40 μL of 50x lentivirus is added with 1 μL 10 mg/mL polybrene per 1 mL of cell suspension. Complete medium change is performed 24 h after the addition of lentivirus. Cells are incubated undisputedly for 3 days at 37 °C, 5% CO2. |
| Polybrene | EMD Millipore | TR-1003-G | |
| Recombinant Human Flt-3 Ligand/FLT3L Protein | R&D Systems | 308-FK-005 | It is resuspend with PBS + 0.2% BSA. Thr working concentration is 10 ng/mL or 12 IU/mL. |
| Recombinant Human IL-15 Protein | R&D Systems | 247-ILB-005 | It is resuspended with PBS + 0.2% BSA. The working concentration is 10 ng/mL or 4500 IU/mL. |
| Recombinant Human IL-18/IL-1F4 Protein | R&D Systems | 9124-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL. The IU is not provided by the company. |
| Recombinant Human IL-2 Protein | R&D Systems | 202-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL or 455 IU/mL. |
| Recombinant Human IL-3 Protein, 50ug | PeproTech | 200-03 | It is resuspended with PBS + 0.2% BSA. The working concentration is 5 ng/mL or 14 IU/mL. |
| Recombinant Human IL-7 Protein | R&D Systems | 207-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 8800 IU/mL. |
| Recombinant Human SCF Protein | R&D Systems | 255-SC-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 26 IU/mL. |
| STEMdiff Hematopoietic Kit | STEMCELL Technologies | 5310 | Medium A: 45 mL STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement A ; Medium B: 75 STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement B |
| StemSpan lymphoid differentiation coating material | STEMCELL Technologies | 9950 | It is resuspended in PBS (100x) |
| StemSpan NK cell differentiation medium | STEMCELL Technologies | 9960 | It is prepared by adding 500 µL StemSpan NK Cell Differentiation Supplement (100x) into 49.5 mL of SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan lymphoid expansion medium | STEMCELL Technologies | 9960 | It is prepared by adding 5 mL StemSpan Lymphoid Progenitor Expansion Supplement (10x) into 45 mL of StemSpan SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan NK Cell Generation Kit | STEMCELL Technologies | 9960 | Thaw the medium and materials in room temperature and the medium is stored in 4 °C once thawed. |
| The BD LSRFortessa cell analyzer | BD | ||
| Trypsin-EDTA (0.05%), phenol red | Thermo Scientific | 25300054 | |
| Y-27632 dihydrochloride | Tocris | 1254 | working concentration: 10 µM |
Referencias
- Gao, X., et al. Establishment of porcine and human expanded potential stem cells. Nature Cell Biology. 21 (6), 687-699 (2019).
- Mackinlay, K. M. L., et al. An in vitro stem cell model of human epiblast and yolk sac interaction. eLife. 10, 63930 (2021).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical-scale natural killer cells from human pluripotent stem cells. Methods in Molecular Biology. 2048, 107-119 (2019).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity. Cell Stem Cell. 23 (2), 181-192 (2018).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Dhar, P., Wu, J. D. NKG2D and its ligands in cancer. Current Opinion in Immunology. 51, 55-61 (2018).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Rungarunlert, S., Techakumphu, M., Pirity, M. K., Dinnyes, A. Embryoid body formation from embryonic and induced pluripotent stem cells: Benefits of bioreactors. World Journal of Stem Cells. 1, 11-21 (2009).
- Counting cells using a hemocytometer. abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. Journal of Immunological Methods. 294, 15-22 (2004).
- Tremblay-McLean, A., Coenraads, S., Kiani, Z., Dupuy, F. P., Bernard, N. F. Expression of ligands for activating natural killer cell receptors on cell lines commonly used to assess natural killer cell function. BMC Immunology. 20, 8 (2019).
- Inoue, T., Swain, A., Nakanishi, Y., Sugiyama, D. Multicolor analysis of cell surface marker of human leukemia cell lines using flow cytometry. Anticancer Research. 34 (8), 4539 (2014).
- Mhatre, S. Rapid flow cytometry based cytotoxicity assay for evaluation of NK cell function. Indian Journal of Experimental Biology. 52 (10), 983-988 (2014).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Motazedian, A., et al. Multipotent RAG1+ progenitors emerge directly from haemogenic endothelium in human pluripotent stem cell-derived haematopoietic organoids. Nature Cell Biology. 22 (1), 60-73 (2020).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Yan, Y., et al. Antileukemia activity of a natural killer cell line against human leukemias. Clinical Cancer Research. 4 (11), 2859-2868 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados