Method Article
יצירת תאי הרג טבעיים מתאי גזע פוטנציאליים מורחבים אנושיים
In This Article
Summary
הפרוטוקול הנוכחי מראה כיצד להבדיל בין תאי CD3−/CD45+CD56+ עם ציטוטוקסיות קלה מתאי גזע פוטנציאליים מורחבים אנושיים (hEPSCs) בתנאי תרבית תלת-ממדית ודו-ממדית. זה מאפשר אימות פנוטיפי שגרתי ללא הרס של microenvironment מורכב.
Abstract
התמיינות תאי הרג טבעי (NK) מתאי גזע פלוריפוטנטיים אנושיים מאפשרת מחקר וייצור של מוצרים תאיים ברמה קלינית לאימונותרפיה. מתואר כאן פרוטוקול דו-פאזי המשתמש בתווך מסחרי ללא סרום ובקוקטייל של ציטוקינים (אינטרלוקין [IL]-3, IL-7, IL-15, גורם תאי גזע [SCF], וליגנד טירוזין קינאז 3 דמוי FMS [Ftl3L]) כדי להתמיין תאי גזע פוטנציאליים מורחבים אנושיים (hEPSCs) לתאים בעלי תכונות תאי NK במבחנה באמצעות טכנולוגיית תרבית תלת-ממדית (תלת-ממדית) ודו-ממדית (דו-ממדית). בעקבות פרוטוקול זה, CD3−CD56+ או CD45+CD56+ תאי NK נוצרים באופן עקבי. כאשר הם מתורבתים יחד עם מטרות הגידול במשך 3 שעות, המוצרים המובחנים מציגים ציטוטוקסיות קלה בהשוואה לקו תאים קבועים בלתי תלויים IL-2, תאי NK92mi. הפרוטוקול משמר את מורכבות המיקרו-סביבה המתמיינת על ידי יצירת מבנים תלת-ממדיים, ובכך מקל על חקר היחסים המרחביים בין תאי מערכת החיסון לנישות שלהם. בינתיים, מערכת התרבית הדו-ממדית מאפשרת תיקוף פנוטיפי שגרתי של התמיינות תאים מבלי לפגוע בנישת ההתמיינות העדינה.
Introduction
בהשוואה לתאי גזע פלוריפוטנטיים קונבנציונליים כמו תאי גזע עובריים אנושיים (hESCs) ותאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSCs), תאי גזע פוטנציאליים מורחבים אנושיים (hEPSCs) קרובים יותר למצב של טוטיפוטנציה, מכיוון שהם יכולים להתמיין הן לשושלות חוץ-עובריות והן לשושלות עובריות1. לדוגמה, hEPSCs יכול להיות ממוין לטרופובלסטים1 ולתאים דמויי שק חלמון2. כדי להשיג את העוצמה הייחודית של hEPSCs, בלסטומר בודד מתורבת בתווך המכיל מספר מולקולות קטנות המעכבות את איתות מחויבות השושלת1, המכונה מדיום EPSC (EPSCM). תרבית תאי גזע עובריים עובריים (תאי גזע עובריים) ו-hiPSCs ב-EPSCM מרחיבה את עוצמתם המוגבלת בעבר כדי להתמיין לתאי טרופובלסט1.
תאי גזע פלוריפוטנטיים הם כלי מחקר רב ערך לניסויים בשינויים גנטיים חדשניים. בשל יכולות ההתחדשות העצמית וההתמיינות של תאי גזע פלוריפוטנטים, שיבוט אחד שעבר טרנספורמציה של תא גזע פלוריפוטנטי יכול לייצר מוצרים תאיים ממוינים בעלי אותו שינוי גנטי באותו לוקוס. ז'ו וקאופמן קבעו את התקן להתמיינות תאי NK מתאי גזע פלוריפוטנטיים קונבנציונליים (hESCs ו-hiPSCs)3. ראשית, הם גרמו לתאי גזע המטופויטיים (HSCs) מגוף עוברי שמקורו בתאי גזע פלוריפוטנטים. התוספת של גורם תאי גזע (SCF), ליגנד טירוזין קינאז 3 דמוי FMS (Ftl3L), אינטרלוקין (IL)-7, IL-15 ותוספת מוקדמת של IL-3 הטיתה את HSCs להתפתח לתאי הרג טבעי (NK). לאחר מכן, הם הרחיבו את תאי ה- NK עם תאים מציגי אנטיגן מלאכותיים (aAPCs), המציגים IL-21 הקשור לקרום, עם תוספת מתמשכת של IL-2. חוקרים יישמו גישה זו באימונותרפיה כדי לייצר תאי הרג טבעיים שמקורם ב-iPSC וניחנו בקולטן האנטיגן הכימרי (CAR-iNK)4.
תאי NK אנושיים מוגדרים כלויקוציטים CD3-CD56+ בדם ההיקפי. הם משפיעים נגד תאים נגועים בנגיף ותאי גידול5. חלק מהקולטנים המעכבים בתאי NK מזהים מולקולות המתבטאות בכל מקום בתאים נורמליים. לדוגמה, הטרודימר NKG2A/CD94 המתבטא בתאי NK מזהה מולקולות MHC Class I5. בינתיים, הקולטנים המפעילים על תאי NK מזהים ליגנדות המושרות על ידי לחץ, כמו האופן שבו NKG2D מזהה רצף A (MICA/MICB) הקשור לפוליפפטיד מסוג MHC המושרה על ידי טרנספורמציה6. חלק מהתאים שעברו טרנספורמציה מווסתים את "הליגנדות העצמיות" שלהם כדי לחמוק ממעקב חיסוני ומווסתים ליגנדות חריגות, מה שמפעיל את תאי ה-NK להפעיל את המנגנון הליטי שלהם. היכולות האנטי-סרטניות המהותיות של תאי NK הפנו את תשומת הלב לסוג תא חיסוני זה.
היכולת להצמיח בו זמנית שושלות עובריות וחוץ-עובריות עשויה להפוך את hEPSCs לשחזור נאמן יותר של נישת ההתפתחות העוברית מאשר תאי גזע פלוריפוטנטיים קונבנציונליים. מניסיון, קל יותר לשמור על העוצמה של hEPSCs מאשר hiPSCs. במחקר הנוכחי פותח פרוטוקול (איור 1) להטיית hEPSCs להתפתח לשושלות המטופויטיות ומאוחר יותר להתמיין תאי אב לתאי הרג טבעי (NK) במבחנה. בפרוטוקול, נעשה שימוש במדיה מסחרית כדי למנוע חוסר עקביות בסרום, ולאחר מכן הוספה הדרגתית של ציטוקינים להתמיינות הטיה לשושלות לימפה. פרוטוקול זה כולל שתי מערכות לשימור המיקרו-סביבה התלת-ממדית המורכבת תוך הפקת תאי CD3-CD56+/CD45+CD56+ הדומים פנוטיפית ותפקודית לתאי NK אנושיים.
פרוטוקול זה עשוי להיות שימושי בחקר האינטראקציה של תאי מערכת החיסון עם נישות ההתמיינות שלהם, וייתכן שיש לו פוטנציאל לטהר מוצרים תאיים לשימושים אימונותרפיים.
Protocol
המחקר הנוכחי עסק בניסויי מבחנה ; לפיכך, אישור אתיקה אינו ישים. קווי התאים המבוססים ששימשו במחקר זה התקבלו ממקורות מסחריים (ראו טבלת חומרים).
1. יצירת מבנים אורגנואידים תלת ממדיים מ- hEPSCs
- שמור על hEPSCs על ידי תרבית אותם עם 1 מ"ל של מדיום EPSC (צלחת 12 בארות) על תאי מזין SNL1.
הערה: מושבות בצורת כיפה נצפות (איור 2A) אם העוצמה המורחבת שלהן נשארת. - בצע הבחנה מראש של hEPSCs.
- הסר את מדיום hEPSC והוסף 1 מ"ל של מדיום DFK (DMEM/F12 + 10% מדיום החלפת סרום, עיין בטבלת החומרים). יש לדגור במשך 2-3 ימים בטמפרטורה של 37°C ו-5% CO2. בצע שינוי בינוני ביום השני אם ממשיכים את הדגירה במשך 3 ימים.
הערה: מתחת למיקרוסקופ, המושבות בצורת כיפה משוטחות (איור 2B).
- הסר את מדיום hEPSC והוסף 1 מ"ל של מדיום DFK (DMEM/F12 + 10% מדיום החלפת סרום, עיין בטבלת החומרים). יש לדגור במשך 2-3 ימים בטמפרטורה של 37°C ו-5% CO2. בצע שינוי בינוני ביום השני אם ממשיכים את הדגירה במשך 3 ימים.
- בדוק את היווצרות גופי העובר על ידי טכניקת הטיפה התלויה 7,8.
- הסר את מדיום DFK, ושטוף עם 1 מ"ל של PBS פעם אחת. הוסף 500 μL של 0.05% טריפסין, ודגר על הצלחת ב 37 ° C ו 5% CO2 במשך 3-7 דקות בהתבסס על המורפולוגיה.
הערה: יש לנתק את תאי ה-hEPSC מתאי ההזנה כאשר הצלחת מופרעת מעט. - הסר את הטריפסין, והוסף 2 מ"ל של מדיום DFK כדי לקצור את התאים. סובבו את התאים במהירות של 300 x גרם במשך 3 דקות בטמפרטורת החדר.
- מוציאים את הסופרנאטנט עם פיפטה. הוסף 1 מ"ל של מדיום DFK ו- 1 μL של Y27632 (ראה טבלת חומרים) כדי להשהות מחדש את התאים על ידי הבהוב.
- ספור את מספר התאים בתוך תרחיף התא עם המוציטומטר9. דללו את תרחיף התא עם מדיום DFK ו-Y27632 (1,000x) כך שיהיו 4,000 תאים/25 μL של תווך DFK.
- מלאו את הפקק של צלחת פטרי בקוטר 10 ס"מ בכ-30-40 טיפות של 25 מיקרוליטר תרחיף תאים לכל מכסה. יוצקים מעט PBS לצלחת התחתונה כדי למנוע אידוי של הטיפות. הופכים בעדינות את הפקק ומכסים את המנה. לדגור את המנה ב 37 ° C ו 5% CO2 במשך 3 ימים.
- הסר את מדיום DFK, ושטוף עם 1 מ"ל של PBS פעם אחת. הוסף 500 μL של 0.05% טריפסין, ודגר על הצלחת ב 37 ° C ו 5% CO2 במשך 3-7 דקות בהתבסס על המורפולוגיה.
2. דפוס מזודרם והמטו-אנדותל של הגוף העוברי (EB)
- אספו EBs בתוך הטיפה.
- לאסוף את כל EBs מן הטיפה לתוך צינור 15 מ"ל באמצעות פיפטה 1 מ"ל וכמה PBS. לשאוב קצת PBS לתוך הטיפה, ולאחר מכן לשאוף החוצה את המדיום, כולל EBs, עם פיפטה.
הערה: טיפות צהובות יותר מצביעות על היווצרות וצמיחה מוצלחות יותר מאשר טיפות ורודות. - סובבו את ה-EBs שנאספו במהירות של 100 x גרם למשך דקה אחת בטמפרטורת החדר, והשתמשו בפיפטה כדי להסיר את הסופרנטנט. הוסף 1 מ"ל של מדיום A (מתוך ערכת התמיינות תאים זמינה מסחרית, ראה טבלת החומרים) כדי להעביר את EBs שנאספו לצלחת 24 בארות שאינה דבקה. תייגו יום זה כיום 0 (איור 1).
הערה: בדרך כלל, כל ה- EBs שנאספו מצלחת אחת של 10 ס"מ מקובצים ומועברים לבאר אחת של צלחת בת 24 בארות.
- לאסוף את כל EBs מן הטיפה לתוך צינור 15 מ"ל באמצעות פיפטה 1 מ"ל וכמה PBS. לשאוב קצת PBS לתוך הטיפה, ולאחר מכן לשאוף החוצה את המדיום, כולל EBs, עם פיפטה.
- בצע דפוס מזודרם של EBs.
- לדגור על הצלחת במשך 3 ימים ב 37 ° C עם 5% CO2. ביום השני, יש להסיר 500 μL של מדיום A (מהערכה, שלב 2.1.2) תוך הימנעות מפיפטציה של ה-EBs. לאחר מכן, להוסיף 500 μL של בינוני טרי A.
- בצע מפרט המטו-אנדותל של הגוף העוברי.
- מוציאים 700 μL של בינוני A מהבאר, ומוסיפים 700 μL של בינוני B (מהערכה, שלב 2.1.2). תרבות במשך 7 ימים. בצע חצי שינוי של בינוני B ביום 5, יום 7 ויום 9.
3. התמיינות תאי NK
- העבר את ה- EBs המעוצבים לממשק אוויר-נוזל.
- הטו מעט את הצלחת כך שה-EBs יצטברו בתחתית. השתמש פיפטה 1 מ"ל כדי להסיר כמה שיותר מדיום B תוך הימנעות EBs.
- הרימו את ה-EBs עם פיפטה על ידי שאיפת המדיום הנותר. מעבירים אותם לטרנסוול בצלחת בת 24 בארות (ראו טבלת חומרים).
הערה: הגבל את המספרים לשניים עד שלושה EBs לכל טרנסוול לקבלת צפיפות מיטבית.
- בצע הרחבת אב לימפה.
- הוסף 500 μL של מדיום NK-1 (בינוני הרחבת לימפה זמין מסחרית + 14 IU/mL IL-3, 4,500 IU/mL IL-15, 8,800 IU/mL IL-7, 26 IU/mL SCF ו- 12 IU/mL ftl3L, ראה טבלת חומרים) לתא התחתון של הטרנסוול. תרבות במשך 14 יום, ולבצע שינוי בינוני כל יומיים.
- קוצרים ומעבירים את התאים בימים 7-10 לצלחת מצופה.
- כדי לצפות את הצלחת, דללו את חומר הציפוי (חומר ציפוי התמיינות לימפואידית זמין מסחרית, 100x, ראה טבלת חומרים) ב- PBS. מוסיפים 1 מ"ל של תמיסת ציפוי מדוללת לכל באר של צלחת 12 בארות, ודגרים על הצלחת ב 4 מעלות צלזיוס למשך הלילה. מכסים את פתח הצלחת בסרט עטיפה.
- הוסיפו 200 μL של PBS לתוך הטרנסוול, ולאט לאט פיפטה מעלה ומטה בערך חמש עד שש פעמים כדי לקצור את התאים ששוחררו מהאורגנואידים. הימנע pipetting אורגנואידים.
הערה: תאים עגולים משתחררים מהאורגנואידים ברציפות (איור 2D). - מעבירים את תרחיף התאים שנקטף לצינור של 2 מ"ל, ומסובבים את התאים במהירות של 500 x גרם למשך 5 דקות בטמפרטורת החדר. הסר את supernatant עם פיפטה, ולהוסיף 1 מ"ל של מדיום NK-1 (שלב 3.2.1) כדי להשעות מחדש את התאים על ידי pipetting.
- מוציאים את כל תמיסת הציפוי מהבאר, ושוטפים כל באר של צלחת 12 בארות עם 1 מ"ל של PBS פעמיים.
- פצלו את התאים שנקטפו ביחס של 1:2. העבר את מתלה התא לצלחת מצופה בת 12 בארות (שלב 3.3.1). הוסף 1 מ"ל של מדיום NK-1 כך שלכל באר יש 1.5 מ"ל של בינוני.
- כדי לבצע שינוי בינוני, תנו לתאים לשבת 1-2 דקות כדי לאפשר לתאים לשקוע לתחתית. בזהירות לשאוף החוצה 750 μL של בינוני. סובבו את הסופרנאטנט שנאסף במהירות של 500 x גרם במשך 5 דקות בטמפרטורת החדר.
- יש להשליך את רוב הסופרנטנט, ולהשהות מחדש ב-750 מיקרוליטר של מדיום NK-1 עם פיפטינג חמש עד שש פעמים. מוסיפים את התאים המרחפים בתווך הטרי לתוך הבאר המקורית.
הערה: מערכת מקבילית זו מכונה המערכת הדו-ממדית באיור 1. עקוב אחר לוח הזמנים של השינוי הבינוני של באר האורגנואידים שמהם נוצרו התאים.
- בצע הבשלה של תאי NK לפי השלבים הבאים.
- הסר את המדיום הישן של מערכת התלת-ממד, והוסף 500 μL של NK-2 (בינוני התמיינות תאי NK זמין מסחרית + 4,500 IU/mL IL-15, 8,800 IU/mL IL-7, 26 IU/mL SCF ו-12 IU/mL ftl3L, ראה טבלת חומרים) לתא התחתון של הטרנסוול. יש לדגור בטמפרטורה של 37°C ו-5%CO2 למשך 14 יום.
הערה: ודא שהמדיום נוגע בתחתית הטרנסוול. - בצע שינוי בינוני מלא על התאים במערכת הדו-ממדית. לאסוף את כל 1.5 מ"ל של תאים מבאר אחת, ולצנזר אותו ב 500 x גרם במשך 5 דקות בטמפרטורת החדר. מוציאים את רוב הסופרנאטנט עם פיפטה, ומשעיפים מחדש את הגלולה עם 1.5 מ"ל של מדיום NK-2 (שלב 3.4.1).
- בצע שינוי בינוני בכל יום לסירוגין. הטה מעט את הצלחת של מערכת התלת-ממד, והסר את כל המדיום הישן מחוץ לטרנסוול. הוסף 500 μL של מדיום NK-2 מחוץ לטרנסוול.
- כדי לבצע שינוי חצי בינוני על באר אחת של צלחת 12 בארות עבור המערכת הדו-ממדית, תנו לתאים לשבת 1-2 דקות כדי לאפשר לתאים לשקוע לתחתית. בזהירות לשאוף החוצה 750 μL של המדיום.
- סובב את הסופרנאטנט שנאסף ב 500 x גרם במשך 5 דקות בטמפרטורת החדר כדי למנוע אובדן תאים. יש להשליך את רוב הסופרנטנט, ולהשהות מחדש ב-750 מיקרוליטר של תווך NK-2 על ידי פיפטינג חמש עד שש פעמים. מוסיפים את התאים המרחפים בתווך טרי לבאר המקורית.
- הסר את המדיום הישן של מערכת התלת-ממד, והוסף 500 μL של NK-2 (בינוני התמיינות תאי NK זמין מסחרית + 4,500 IU/mL IL-15, 8,800 IU/mL IL-7, 26 IU/mL SCF ו-12 IU/mL ftl3L, ראה טבלת חומרים) לתא התחתון של הטרנסוול. יש לדגור בטמפרטורה של 37°C ו-5%CO2 למשך 14 יום.
4. קצירת תאים בוגרים
- קצרו את התאים שגודלו בתרבית במערכת הדו-ממדית.
- קצרו את התאים על ידי צנרת למעלה ולמטה במהלך ימים 38-45. לשטוף עם 1 מ"ל של PBS פעמיים. צנטריפוגה את מתלה התא ב 500 x גרם במשך 5 דקות בטמפרטורת החדר.
- הסר את הסופרנאטנט עם פיפטה, והשהה אותו מחדש במאגר לפי בחירתו (כלומר, PBS + 2% FBS עבור ציטומטריית זרימה, ראה טבלת חומרים).
- קצרו את התאים המוטבעים באורגנואיד.
- אספו את התווך מחוץ לטרנסוול לתוך צינור של 15 מ"ל במהלך ימים 38-45. שטפו את האורגנואיד פעמיים על ידי הוספת 200 מיקרוליטר של PBS בתוך הטרנסוול ופיפטציה למעלה ולמטה חמש עד שש פעמים. העבר את המתלה לצינור 15 מ"ל.
- הוסף 500 μL של PBS לתוך באר של צלחת 12 בארות. מעבירים את האורגנואיד מהטרנסוול לבאר זו של צלחת 12 הקידוחים בעזרת מלקחיים.
- חותכים את האורגנואיד 20 פעמים באמצעות זוג מספריים ומלקחיים. שטפו את התאים הנותרים על המלקחיים והמספריים לתוך הבאר עם PBS. אסוף PBS רב ככל האפשר, והעבר אותו לצינור 15 מ"ל המשמש בשלב 4.2.1 מבלי לשאוף את מבנה האורגנואידים.
- הוסף 500 μL של מגיב הדיסוציאציה (ראה טבלת החומרים) לתוך הטרנסוול כדי לעכל את האורגנואיד באופן אנזימטי. יש לדגור עם תמיסת ניתוק תאים מסחרית (ראו טבלת חומרים) למשך 7-10 דקות בטמפרטורה של 37°C ו-5% CO2. להרוות את התגובה על ידי הוספת 1 מ"ל של PBS עם 2% FBS, ולאסוף את הפתרון עוד 15 מ"ל צינור. לשטוף את הבאר עם 1 מ"ל של PBS עם 2% FBS פעמיים.
הערה: קבע את אורך הדגירה בהתבסס על המורפולוגיה. נסו להשיג את הנקודה שבה תאים בודדים מתחילים להשתחרר מהקרום של המבנה התלת-ממדי. - הוסף 1 מ"ל של PBS עם 2% FBS, פיפטה למעלה ולמטה 8-10 פעמים. לאסוף את כל התמיסות, כולל מבנים אורגנואידים. העבר אותם לצינור 15 מ"ל המשמש בשלב 4.2.3 עם מסננת תאים.
- צנטריפוגה את שני הצינורות ב 500 x גרם במשך 5 דקות בטמפרטורת החדר. השליכו את הסופרנאטנט עם פיפטה. השהה מחדש את גלולת התא עם המאגר הנבחר (שלב 4.1.2).
תוצאות
ההשערה הייתה כי תוצרי התמיינות החוץ גופית (IVD) הנוכחיים יהיו בעלי סמנים על פני השטח ויכולות אנטי-סרטניות דומות לתאי NK אנושיים.
הסמן המגדיר של תאי NK אנושיים היה נגיש כדי לבדוק אם תוצרי ההתמיינות ממערכת התרבית התלת-ממדית הניבו תאים הדומים פנוטיפית לתאי NK אנושיים. כ-15% מהתאים שנותקו ממערכת התרבית התלת-ממדית משתי אצוות שהושרו בנקודות זמן שונות (n = 2) היו CD3-CD56+ (איור 3A). CD3 הוחלף ב- CD45 (סמן פאן-לויקוציטים) בפאנל הבדיקה בשל היעדר CD3 והקושי לגרום לתאי T במבחנה. כ-16% מהתאים שנותקו מהמבנה התלת-ממדי היו CD45+CD56+ (איור 3B, n = 1), אשר עולה בקנה אחד עם אחוז תאי CD3-CD56+ שנצפו בניסויים קודמים. האחוזים של תאי CD3-CD56+ בתאים שנקצרו ממערכת התרבית הדו-ממדית נעו בין 30% ל-6%, החל מהשראות מוצלחות יותר (איור 3C, n = 3) ועד להשראות פחות מוצלחות (איור 3D, n = 2). הפונקציונליות והפנוטיפים של התאים שנקצרו ממערכת התרבית הדו-ממדית אומתו. במהלך תרבית יום 18 מהמערכת הדו-ממדית, כ-12% מהתאים ביטאו גם CD56 חוץ רחמי וגם CD107a לאחר שעתיים של 50 ננוגרם/מ"ל IL-18, 455 IU/mL IL-2 ו-20 ננוגרם/מ"ל נגד גירוי נוגדנים CD244 (איור 4C, n = 1). כ-28% מהתאים שנקטפו היו CD94+CD159a+ (איור 4B, n = 1). הביטוי החוץ רחמי של CD107a, רירית חלבון על קרום הגרגירים, מציין degranulation10, בעוד שהטרודימר CD94/NKG2A (CD159a) הוא סמן מגדיר נוסף של תאי NK. זה מספק דוגמה לאימות פנוטיפי ופונקציונלי של מוצרי IVD.
הפונקציונליות של מוצרי IVD נבדקה על ידי ציטוטוקסיות שלהם נגד תאי אריתרולוקמיה אנושיים-K562 תאים. פרופיל ליגנד מקיף על תאי K562 חושף את קומפלקס ההיסטוכימיה העיקרי שלהם I (MHC-I) ואת ביטוי ליגנד NKG2D חזק יחסית (כגון ULBP-1, ULBP-2/5/6 ו-ULBP-3)11; לפיכך, תאי K562 רגישים לפעילות הליטית של תאי NK12. שני מוצרי נקודות הקצה IVD ותאי NK92mi הוכשרו בנוגדנים IL-18 של 50 ננוגרם/מ"ל, 455 IU/mL IL-2 ו-20 ננוגרם/מ"ל נגד CD244 במהלך הלילה. תאי GFP+ K562 גודלו בתרבית משותפת עם תאים שנקטפו מתאי IVD או NK92mi ביחסי השפעה למטרה שונים (E:T) בנוכחות 50 ננוגרם/מ"ל (IU לא סופק) IL-18, 455 IU/mL IL-2 ו-20 ננוגרם/מ"ל נוגדנים נגד CD244 באותו נפח של תווך H5100 למשך 3 שעות. הקריאה של פעילות הרג תאי NK הייתה הביטוי של סמן התא המת בתת-קבוצות GFP+. תאי K562 הותמרו באמצעות וקטור בקרה זמין מסחרית (ראו טבלת חומרים) כדי לבטא GFP באופן קונסטיטוטיבי, ויעילות ההתמרה הייתה כ-80% (איור משלים 1A). האחוזים של אות GFP שנוסף היו פרופורציונליים למספר תאי GFP+ K562 שנוספו, מה שמרמז על ביטוי GFP ספציפי מתאי K562 המומרים (איור משלים 1B).
אחוזי תאי המטרה הגוועים המוצגים באיור 5 חושבו באמצעות הנוסחההבאה 13:
אחוז התאים הגוססים = (FITC + DAPI + % מהתרבות המשותפת [לדוגמה, איור 5A]) - (FITC + DAPI + % מתאי K562 המותמרים)
מכל שלושת יחסי ה-E:T שהוערכו (0.1:1, 0.33:1, 1:1), האחוזים של תאי GFP+ גוססים היו בקורלציה חיובית עם יחסי E:T כאשר תורבתו יחד עם תוצרי IVD (איור 5B, hEPSC-NK) או תאי NK92mi (איור 5B, NK92mi), מה שמצביע על הרג ספציפי של מטרות סרטניות. עם זאת, ציטוטוקסיות של מוצרי IVD הייתה צנועה יחסית במסגרת הזמן שנבדקה (איור 5C).
לבסוף, דור תאי האב הלימפואידי הושווה בין התרביות התלת-ממדיות והדו-ממדיות. נמצא שתנאי התרבית התלת-ממדית יצרו יותר תאי אב (55,000 תאים) מאשר תנאי התרבית הדו-ממדית (36,000 תאים) (איור משלים 2). זה מצביע על כך שההקשר של ארכיטקטורת רקמות ורכיבים תאיים בתרבית התלת-ממדית תמך ביצירת תאי אב לימפואידים.
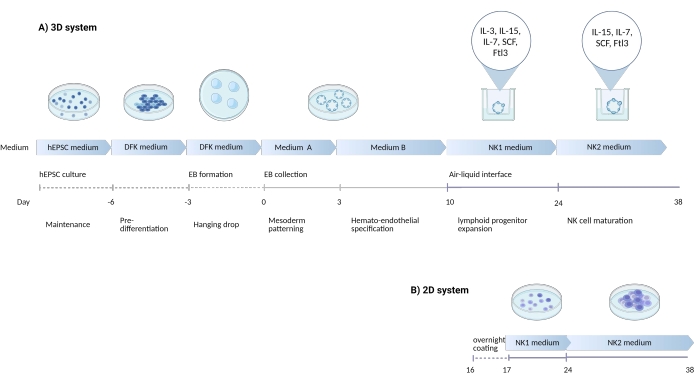
איור 1: דיאגרמה סכמטית שמראה את אסטרטגיית ההתמיינות להבדיל בין תאי NK לתאי hEPSC . (A) כאן מוצג ציר הזמן של מערכות התרביות התלת-ממדיות, המפרט את תנאי התרבית ומילות מפתח קצרות מכל שלב. ממשק האוויר-נוזל של המערכת התלת-ממדית נשמר במהלך השראת תא NK. (B) כאן, ציר הזמן של מערכות התרבות הדו-ממדית מוצג. התאים המשתחררים שנקטפו בימים 7-10 ממבנים במערכת התלת-ממדית נזרעים על צלחת מצופה ללא ממשק אוויר-נוזל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
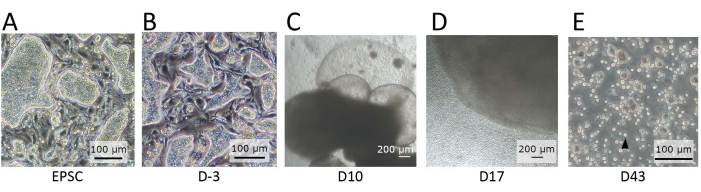
איור 2: מורפולוגיה של התאים שנצפתה בשלבים שונים של התמיינות. (A) המורפולוגיה של hEPSCs כאשר היא נשמרת ב-EPSCM. ה-hEPSCs יוצרים מושבות בצורת כיפה. (B) המורפולוגיה של hEPSCs לאחר קדם-דיפרנציאציה. המושבות בצורת כיפה שטוחות. ה-hEPSCs נקצרים ויוצרים EBs בטכניקת הטיפה התלויה. ה- EBs נאספים ומתורבתים במדיום A ולאחר מכן בינוני B. (C) המורפולוגיה של EB ביום 10. במהלך תקופה זו, EB מתחיל להתרחב ולהתנפח, יצירת מבנים קרומיים. (D) המורפולוגיה של EB משחרר תאים. לאחר הזריעה על הטרנסוול, EB גדל ומשחרר כל הזמן תאים עגולים לסביבה. חלק מהתאים המשתחררים נאספים ומתורבתים על צלחת בת 12 בארות המצופה בחומרי ציפוי התמיינות לימפואידים. אוכלוסיות התאים הטרוגניות מורפולוגית ונוטות להצטבר יחד. (E) המורפולוגיה של התאים שנצפתה בנקודת הקצה של ה-IVD. תאי השעיה קטנים ועגולים (חץ שחור) נצפים. פסי קנה מידה: (A,B,E) = 100 מיקרומטר; (C,D) = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
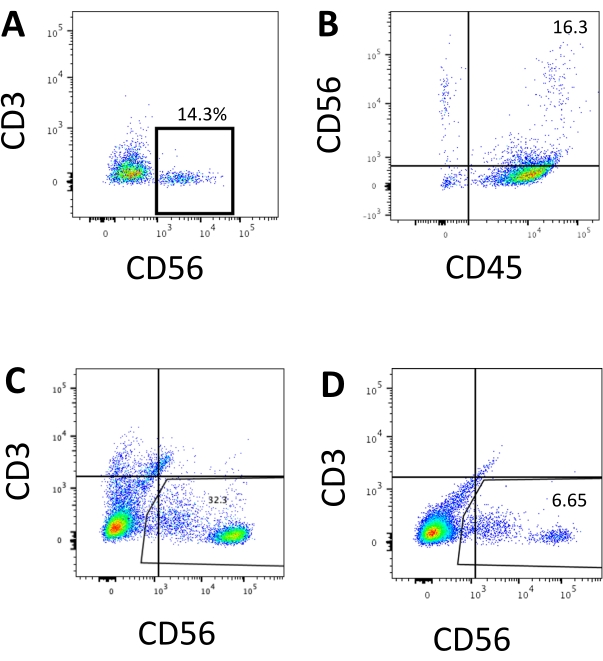
איור 3: חלקות FACS מייצגות של מוצרים שמקורם ב-hEPSC בנקודת הקצה. התאים מודגרים עם נוגדנים מצומדים פלואורוסקופ על קרח במשך 30 דקות. הדגימות מוכתמות ב-DAPI לפני שהן נטענות ליציאת הזרקת הדגימה של FACS. תאים לא מוכתמים משמשים כדי לבסס את הגידור השלילי. (A) תרשים FACS מייצג על ביטוי CD3 ו-CD56 בתאים מנותקים ממערכת התרביות התלת-ממדית משתי אצוות (n = 2). (B) תרשים FACS מייצג על ביטוי CD45 ו-CD56 בתאים מנותקים מהתרבית התלת-ממדית (n = 1). (C) תרשים FACS מייצג על ביטוי CD3 ו-CD56 בתאים שנקטפו מהצלחת המצופה מאינדוקציה מוצלחת (n = 3). (D) התוויית FACS מייצגת על ביטוי CD3 ו- CD56 מהלוח המצופה כאשר האינדוקציה תת-אופטימלית (n = 2). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
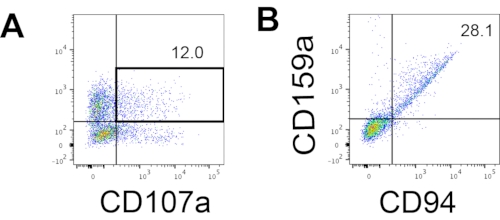
איור 4: תרשים FACS מייצג על מוצרים שמקורם ב-hEPSC במהלך תרבית היום ה-18 (n = 1). (A) התוויית FACS על ביטוי CD56 ו-CD107a לאחר שעתיים של גירוי עם נוגדנים IL2, IL-18 ונוגדנים נגד CD244. (B) התוויית FACS בביטוי CD159a ו-CD94. הדגימות מוכתמות ב-DAPI לפני שהן נטענות ליציאת הזרקת הדגימה של FACS. תאים לא מוכתמים משמשים כדי לבסס את הגידור השלילי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
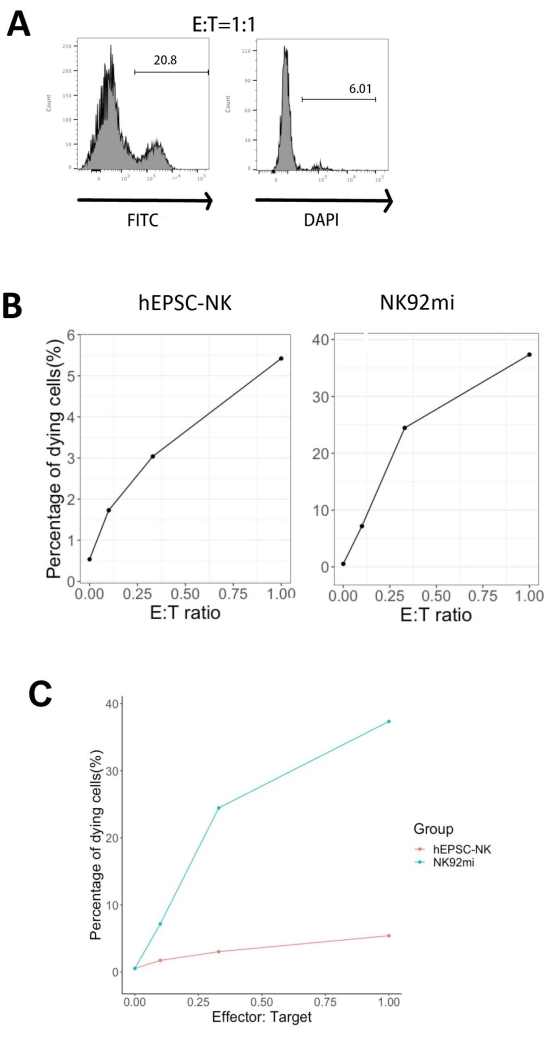
איור 5: תרשים האחוזים של תאים גוססים כנגד יחסי E:T שונים מהתרבות המשותפת של תאי GFP+ K562 עם מכפלת נקודת הקצה IVD או תאי NK92mi (n = 1). הביטוי של תאי FITC+ DAPI+ הוערך באמצעות מנתח תאים, וניתוח הנתונים בוצע באמצעות תוכנה תואמת. (A) תרשים FACS מייצג המציג את ה- gating של FITC + DAPI + תת-קבוצות מהתרבות המשותפת של מוצרי IVD ותאי K562 עם יחס E:T של 1. (B) חלקות בודדות מניסוי החקלאות המשותפת עם תוצרי GFP+ IVD (משמאל) או תאי NK92mi (מימין) במשך 3 שעות. שניהם משקפים יחס יחסי חיובי בין אחוז התאים הגוססים לבין יחס E:T. (C) תרשים המראה את עקומות ההרג של תוצרי IVD ותאי NK92mi באותו קנה מידה. תוצרי IVD הציגו ציטוטוקסיות קלה בהשוואה לתאי NK92mi. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: בדיקה פונקציונלית של תאי NK מתאי hEPSC. (A) היסטוגרמה FACS של תאי K562 מותמרים. תאי FITC+ K562 ביטאו GFP. (B) היסטוגרמות FACS מהתרבות המשותפת של תאי GFP+ K562 ומוצרי IVD של נקודת הקצה בשלושה יחסי E:T (n = 1). האחוזים של תאי FITC+ בקוקולטורה תאמו למספר תאי K562 המומרים שנוספו. הגאטינגים הוקמו עם תאי K562 לא מותמרים. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: התמיינות אבות לימפואידית בתרבית דו-ממדית לעומת תלת-ממדית. הפרוטוקול הנוכחי המבוסס על אורגנואידים שימש להשראת אבות לימפה מתאי גזע פוטנציאליים מורחבים אנושיים. נקבעו שני תנאים: (1) אבות לימפה נשמרו בתרבית בתוך האורגנואידים (3D), ו-(2) אבות לימפה בודדו והוחזקו על צלחת התרבית (2D). לאחר שבועיים של תרבית נוספת, נקבע כי מספרי התאים ישוו את התרבית הדו-ממדית לעומת התלת-ממדית. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
ישנם מספר שלבים מרכזיים כדי להבטיח את ההבחנה המוצלחת של תאי CD45+CD56+ מתאי hEPSC. ההבחנה המוקדמת (שלב 1.2) היא קריטית מכיוון שמדיום EPSC מכיל מעכבי מחויבות לשושלת1. לאחר התמיינות מוקדמת, המושבות בצורת כיפה של hEPSCs משוטחות (איור 2B). התוספת של Y27632, מעכב רו-קינאז (ROCKi), במהלך היווצרות EBs מ-hEPSCs (שלב 1.3) היא הכרחית להישרדותם של hEPSCs לאחר דיסוציאציה. שיקול חשוב נוסף הוא מספר ה- EBs שנשתלו על כל טרנסוול. מכיוון שמדובר במערכת בקנה מידה קטן, שניים עד שלושה EBs לכל טרנסוול היא הצפיפות האופטימלית למניעת צריכת יתר של התקשורת. ממשק אוויר-נוזל נשמר במהלך כל מהלך התמיינות תאי NK עבור המערכת התלת-ממדית, אשר מאמינים כי היא שומרת על הקוטביות של תאי הסטרומה ותומכת בהרחבת האבות ההמטופויטיים שמקורם ב-AGM14,15.
כפי שהוזכר קודם, צפיפות EBs על transwell הוא גורם מכריע עבור בידול מוצלח. סימן המפתח לכך הוא צבע המדיום 1 יום לאחר השתלת EBs על transwell. אם הצבע הופך צהוב במהירות, זה מצביע על זיהום או צפיפות. כדי לפתור את הבעיה, פיפטה 1 מ"ל יש להשתמש כדי להרים באופן ידני EBs נוספים ולהעביר אותם לתוך transwell אחר.
מגבלה עיקרית של פרוטוקול זה היא טוהר תאי CD3−/CD45+ CD56+ במוצרי IVD, אשר מאמינים כי הם אחראים חלקית לציטוטוקסיות הנחותה בהשוואה לתאי NK92mi טהורים. מערכת תרבית תלת-ממדית שימשה להשראת אבות המטופויטיים באמצעות יצירת EB הדומה לשלוש שכבות הנבט העוברי. אסטרטגיה זו מחקה את התפתחות תאי הדם במיקרו-סביבה של מח העצם, ובכך מבטלת את הצורך בתאי סטרומה לתמיכה בהתמיינות3. ללא שלב מיון לטיהור האבות ההמטופויטיים, טוהר מוצרי IVD צפוי להיות מופחת. אסטרטגיה לשמירה על נישת הבידול המורכבת תוך הגדלת טוהר מוצר נקודת הקצה היא פיתוח שיטת הרחבה למוצרי CD3-CD56+ IVD ממוינים. לדוגמה, מוצרי CD3-CD56+ IVD ממוינים יכולים להיות בתרבית על תאים מציגי אנטיגן מלאכותיים (aAPCs), כגון תאי K562 מחוסנים שהונדסו עם IL-21 הקשור לקרום. עם אספקת IL-2 בתרבית, שיטה זו יכולה להשיג גידול של פי 1,000 במספר תאי NK3.
מגבלה נוספת היא הגישה המוגבלת לתאי NK אנושיים בתום לב כהתייחסות חיובית. NK92mi הוא הייחוס החיובי שנעשה בו שימוש במבחן הקוקולטור, אך הוא אינו מדויק מספיק. תאי NK92mi מהונדסים מתאי NK92, קו תאים קבוע המבטא פנוטיפים מופעלים של תאי NK16, כדי לייצר IL-2 באופן אוטונומי כדי לעמוד בדרישות התרבית. תאי NK92 מפגינים פעילות הרג טובה יותר נגד תאי K562 במבחנה מאשר תאי NK ראשוניים אנושיים17. השוואה הוגנת יותר של יכולת הריגת הגידול של מוצרי IVD יכולה להיות מושגת על ידי קביעת ציטוטוקסיות של תאי NK היקפיים בדם במקביל, אך למרבה הצער, גישה לבנקי דם חסרה.
פרוטוקול תרבית דו-מערכתי זה נועד ליצור תאי CD3−/CD45+CD56+ מתאי hEPSC. הערכה של סמני פני השטח וציטוטוקסיות עם FACS יכולה להתבצע באופן שגרתי על תאים ממערכות דו-ממדיות מבלי לשבש את נישת ההתמיינות. למרות ההבדלים באחוזים של תאי CD3-CD56+, מערכות תלת-ממד ודו-ממד יכולות להפיק תאי CD3-CD56+ עם וריאציות דומות בביטוי CD56 (איור 3), והמערכת הדו-ממדית משקפת את קיומם של אבות לימפה ממצב התרבית התלת-ממדית.
משמעות השימוש במערכת התרביות התלת-ממדית היא בכך שהיא מאפשרת שימוש במבחני פרופיל ברזולוציה גבוהה, כגון תעתיק מרחבי או ספקטרומטריית מסות הדמיה, כדי לחקור את היחסים המרחביים ואת האינטראקציות בין תאים בתוך נישת ההתמיינות המורכבת.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
ברצוננו להודות לד"ר הנדי קאו, Sanxing GAO, דיוויד שיאנג, יימינג צ'או, ריטיקה ג'וגאני, אוון צ'אן, סטפני צ'אונג וסלין צ'אן על עזרתם הטכנית ועל הדיונים המועילים. עבודה זו נתמכה על ידי הקרן לטכנולוגיית פלטפורמה. איור 1 נוצר באמצעות BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 30 w/v% Albumin Solution, from Bovine Serum(BSA), Fatty Acid Free | Wako Chemicals | 017-22231 | For resuspending cytokines. |
| ACCUMAX | STEMCELL Technologies | 07921 | |
| Anti-human-CD159a-PE | BD | 375104 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD3-APC antibodies | BD | 555355 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 2% FBS) |
| Anti-human-CD45-APC antibodies | BD | 555485 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 3% FBS) |
| Anti-human-CD56-PE antibodies | BD | 555516 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 4% FBS) |
| Anti-human-CD56-PEcy7 antibodies | BD | 335826 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD94-APC | BD | 559876 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Bemis Parafilm M Laboratory Wrapping Film | Thermo Scientific | 11772644 | |
| Cd244 Monoclonal Antibody (eBioC1.7 (C1.7)), Functional Grade, eBioscience | Thermo Scientific | 16-5838-85 | |
| Costar 6.5 mm Transwell, 0.4 µm Pore Polyester Membrane Inserts | STEMCELL Technologies | 3470 | |
| Dapi Solution, 1 mg/mL | BD | 564907 | It is resuspended with ddH2O so the concentration is 10 µM/mL. Add 1 µL of the aliquot in 300 µL of FACS buffer (PBS + 2% FBS) |
| DMEM | CPOS-Bioreagent core | 11965092 | |
| DMEM/F12 | Thermo Scientific | 11320033 | |
| FcX, human | Biolengend | 422302 | |
| Fetal Bovine Serum(FBS) qualified E.U.-approved South America | CPOS-Bioreagent core | 10270106 | |
| FlowJo v10.8.0 | BD | ||
| Gibco PBS (10x) pH 7.4 | CPOS-Bioreagent core | 70011044 | 10x concentrated PBS is manufactured as follows: without calcium, magnesium or phenol red |
| K562 cells | ATCC | CCL-243 | |
| Knockout Serum Replacement | Thermo Scientific | 10828-028 | |
| MyeloCult H5100 medium | STEMCELL Technologies | 5150 | |
| NK92mi cells | ATCC | CRL-2408 | Lot: 70045208. Once thawed, they are cultured in MyeloCult H5100 medium, and maintained the density between 2 x 105 to 1 x 106 cell/mL. |
| Nunc Cell-Culture Treated Multidishes 12 well plate | Thermo Scientific | 150628 | flat bottom |
| Nunc Cell-Culture Treated Multidishes 24 well plate | Thermo Scientific | 142475 | |
| Nunc EasYDish Dishes | Thermo Scientific | 150460 | |
| pLenti-GFP Lentiviral Control Vector | CELL BIOLABS | LTV-400 | It is packaged as the manufactuer suggested (https://www.cellbiolabs.com/sites/default/files/LTV-400-gfp- lentiviral-plasmid.pdf). 40 μL of 50x lentivirus is added with 1 μL 10 mg/mL polybrene per 1 mL of cell suspension. Complete medium change is performed 24 h after the addition of lentivirus. Cells are incubated undisputedly for 3 days at 37 °C, 5% CO2. |
| Polybrene | EMD Millipore | TR-1003-G | |
| Recombinant Human Flt-3 Ligand/FLT3L Protein | R&D Systems | 308-FK-005 | It is resuspend with PBS + 0.2% BSA. Thr working concentration is 10 ng/mL or 12 IU/mL. |
| Recombinant Human IL-15 Protein | R&D Systems | 247-ILB-005 | It is resuspended with PBS + 0.2% BSA. The working concentration is 10 ng/mL or 4500 IU/mL. |
| Recombinant Human IL-18/IL-1F4 Protein | R&D Systems | 9124-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL. The IU is not provided by the company. |
| Recombinant Human IL-2 Protein | R&D Systems | 202-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL or 455 IU/mL. |
| Recombinant Human IL-3 Protein, 50ug | PeproTech | 200-03 | It is resuspended with PBS + 0.2% BSA. The working concentration is 5 ng/mL or 14 IU/mL. |
| Recombinant Human IL-7 Protein | R&D Systems | 207-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 8800 IU/mL. |
| Recombinant Human SCF Protein | R&D Systems | 255-SC-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 26 IU/mL. |
| STEMdiff Hematopoietic Kit | STEMCELL Technologies | 5310 | Medium A: 45 mL STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement A ; Medium B: 75 STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement B |
| StemSpan lymphoid differentiation coating material | STEMCELL Technologies | 9950 | It is resuspended in PBS (100x) |
| StemSpan NK cell differentiation medium | STEMCELL Technologies | 9960 | It is prepared by adding 500 µL StemSpan NK Cell Differentiation Supplement (100x) into 49.5 mL of SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan lymphoid expansion medium | STEMCELL Technologies | 9960 | It is prepared by adding 5 mL StemSpan Lymphoid Progenitor Expansion Supplement (10x) into 45 mL of StemSpan SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan NK Cell Generation Kit | STEMCELL Technologies | 9960 | Thaw the medium and materials in room temperature and the medium is stored in 4 °C once thawed. |
| The BD LSRFortessa cell analyzer | BD | ||
| Trypsin-EDTA (0.05%), phenol red | Thermo Scientific | 25300054 | |
| Y-27632 dihydrochloride | Tocris | 1254 | working concentration: 10 µM |
References
- Gao, X., et al. Establishment of porcine and human expanded potential stem cells. Nature Cell Biology. 21 (6), 687-699 (2019).
- Mackinlay, K. M. L., et al. An in vitro stem cell model of human epiblast and yolk sac interaction. eLife. 10, 63930 (2021).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical-scale natural killer cells from human pluripotent stem cells. Methods in Molecular Biology. 2048, 107-119 (2019).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity. Cell Stem Cell. 23 (2), 181-192 (2018).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Dhar, P., Wu, J. D. NKG2D and its ligands in cancer. Current Opinion in Immunology. 51, 55-61 (2018).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Rungarunlert, S., Techakumphu, M., Pirity, M. K., Dinnyes, A. Embryoid body formation from embryonic and induced pluripotent stem cells: Benefits of bioreactors. World Journal of Stem Cells. 1, 11-21 (2009).
- Counting cells using a hemocytometer. abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. Journal of Immunological Methods. 294, 15-22 (2004).
- Tremblay-McLean, A., Coenraads, S., Kiani, Z., Dupuy, F. P., Bernard, N. F. Expression of ligands for activating natural killer cell receptors on cell lines commonly used to assess natural killer cell function. BMC Immunology. 20, 8 (2019).
- Inoue, T., Swain, A., Nakanishi, Y., Sugiyama, D. Multicolor analysis of cell surface marker of human leukemia cell lines using flow cytometry. Anticancer Research. 34 (8), 4539 (2014).
- Mhatre, S. Rapid flow cytometry based cytotoxicity assay for evaluation of NK cell function. Indian Journal of Experimental Biology. 52 (10), 983-988 (2014).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Motazedian, A., et al. Multipotent RAG1+ progenitors emerge directly from haemogenic endothelium in human pluripotent stem cell-derived haematopoietic organoids. Nature Cell Biology. 22 (1), 60-73 (2020).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Yan, Y., et al. Antileukemia activity of a natural killer cell line against human leukemias. Clinical Cancer Research. 4 (11), 2859-2868 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved