Method Article
ヒト増殖電位幹細胞からのナチュラルキラー細胞の作製
要約
本プロトコルは、3Dおよび2D培養条件の両方で、軽度の細胞毒性を有するCD3−/CD45+CD56+細胞をヒト拡大電位幹細胞(hEPSC)から分化させる方法を示しています。これにより、複雑な微小環境を破壊することなく、日常的な表現型検証が可能になります。
要約
ナチュラルキラー(NK)細胞をヒト多能性幹細胞から分化させることで、免疫療法のための臨床グレードの細胞製品の研究と製造が可能になります。ここでは、無血清の市販培地とサイトカインのカクテル(インターロイキン[IL]-3、IL-7、IL-15、幹細胞因子[SCF]、およびFMS様チロシンキナーゼ3リガンド[Ftl3L])を使用して、ヒト拡大電位幹細胞(hEPSC)を3次元(3D)および2次元(2D)の両方の培養技術を使用して in vitro でNK細胞特性を有する細胞に分化させる2相プロトコルについて説明します。このプロトコルに従って、CD3−CD56+またはCD45+CD56+ NK細胞が一貫して生成されます。腫瘍標的と3時間共培養した場合、分化産物はIL-2非依存性永久細胞株であるNK92mi細胞と比較して軽度の細胞毒性を示します。このプロトコルは、3D構造の生成によって分化微小環境の複雑さを維持し、免疫細胞とそのニッチとの間の空間的関係の研究を容易にします。一方、2D培養システムは、繊細な分化ニッチを損なうことなく、細胞分化のルーチン表現型検証を可能にします。
概要
ヒト胚性幹細胞(hESC)やヒト人工多能性幹細胞(hiPSC)などの従来の多能性幹細胞と比較して、ヒト拡張電位幹細胞(hEPSC)は、胚外系統と胚系統の両方に分化できるため、全能性の状態に近いです1。例えば、hEPSCは、栄養膜1 および卵黄嚢様細胞2に分化することができる。hEPSCのユニークな効力を達成するために、個々の割球は、EPSC培地(EPSCM)と呼ばれる系統コミットメントシグナル伝達を阻害するいくつかの小分子を含む培地で培養されます1。EPSCMでhESCおよびhiPS細胞を培養すると、以前は制限されていた効力が拡大し、栄養芽細胞に分化します1。
多能性幹細胞は、新しい遺伝子組み換えを実験するための貴重な研究ツールです。多能性幹細胞の自己複製能力と分化能力により、多能性幹細胞の1つの形質転換クローンは、同じ遺伝子座で同じ遺伝子改変を有する分化細胞産物を産生することができる。ZhuとKaufmanは、従来の多能性幹細胞(hESCおよびhiPSC)3からのNK細胞分化の標準を確立しました。まず、多能性幹細胞由来の胚様体から造血幹細胞(HSC)を誘導しました。幹細胞因子(SCF)、FMS様チロシンキナーゼ3リガンド(Ftl3L)、インターロイキン(IL)-7、IL-15、およびIL-3の早期サプリメントの添加により、HSCはナチュラルキラー(NK)細胞に発達するようにバイアスがかかりました。続いて、膜結合型IL-21を提示する人工抗原提示細胞(aAPC)を用いてNK細胞を増殖させ、IL-2を継続的に補充した。研究者らは、キメラ抗原受容体(CAR-iNK)4を備えたiPS細胞由来のナチュラルキラー細胞を作製するために、このアプローチを免疫療法に適用しました。
ヒトNK細胞は、末梢血中のCD3−CD56+白血球として定義されます。それらは、ウイルス感染細胞および腫瘍細胞に対するエフェクターである5。NK細胞上のいくつかの阻害受容体は、正常細胞に遍在的に発現する分子を認識します。一例として、NK細胞上に発現するNKG2A/CD94ヘテロ二量体は、MHCクラスI分子5を認識する。一方、NK細胞上の活性化受容体は、NKG2Dが形質転換誘導MHCクラスIポリペプチド関連配列A(MICA/MICB)を認識する方法と同様に、ストレス誘導性リガンドを認識します6。一部の形質転換細胞は、免疫監視から逃れるために「自己リガンド」をダウンレギュレートし、異常なリガンドをアップレギュレートし、NK細胞が溶解機構を実行するきっかけとなります。NK細胞の固有の抗腫瘍能力は、この免疫細胞タイプに注目を集めています。
胚系と胚外系譜の両方を同時に生じさせる能力は、hEPSCを従来の多能性幹細胞よりも胚発生ニッチのより忠実な要約にする可能性があります。経験から、hEPSCの効力を維持するのはhiPS細胞よりも簡単です。本研究では、hEPSCをバイアスして造血系統に発達させ、後に前駆細胞をin vitroでナチュラルキラー(NK)細胞に分化させるためのプロトコルが開発されました(図1)。このプロトコルでは、血清の不一致を回避するために市販の培地が使用され、続いてサイトカインを段階的に添加してリンパ系系統への分化をバイアスします。このプロトコルには、表現型的および機能的にヒトNK細胞に類似したCD3−CD56+/CD45+CD56+細胞を導出しながら、複雑な3D微小環境を保存するための2つのシステムがあります。
このプロトコルは、免疫細胞とその分化ニッチとの相互作用を研究するのに有用であり、免疫療法用途のために細胞産物を精製する可能性がある。
プロトコル
本研究は インビトロ 実験を含む。したがって、倫理承認は適用されません。この研究で使用された確立された細胞株は、市販の供給源から入手した( 材料の表を参照)。
1. hEPSCからの3次元オルガノイド構造の生成
- hEPSCをSNLフィーダー細胞1上で1 mLのEPSC培地(12ウェルプレート)で培養することにより、hEPSCを維持します。
注:ドーム型のコロニーは、その拡張された効力が残っている場合に観察されます(図2A)。 - hEPSCの事前分化を行います。
- hEPSC培地を取り出し、1 mLのDFK培地(DMEM/F12 + 10%血清置換培地、 材料表を参照)を加えます。37°Cおよび5%CO2で2〜3日間インキュベートする。3日間インキュベーションを続ける場合は、2日目に培地交換を行います。
注:顕微鏡下では、ドーム型のコロニーは平らになっています(図2B)。
- hEPSC培地を取り出し、1 mLのDFK培地(DMEM/F12 + 10%血清置換培地、 材料表を参照)を加えます。37°Cおよび5%CO2で2〜3日間インキュベートする。3日間インキュベーションを続ける場合は、2日目に培地交換を行います。
- ハンギングドロップ法7,8による胚体の形成を確認する。
- DFK培地を取り出し、1mLのPBSで1回洗浄する。500 μLの0.05%トリプシンを加え、形態に基づいてプレートを37°Cおよび5%CO2 で3〜7分間インキュベートします。
注意: プレートがわずかに乱れたときに、hEPSCをフィーダーセルから取り外すことができる必要があります。 - トリプシンを除去し、2 mLのDFK培地を加えて細胞を回収します。細胞を300 x g で室温で3分間スピンダウンします。
- ピペットで上清を取り除きます。1 mLのDFK培地と1 μLのY27632( 材料表を参照)を加え、フリックして細胞を再懸濁します。
- 血球計算盤9で細胞懸濁液内の細胞数をカウントする。細胞懸濁液をDFK培地とY27632(1,000倍)で希釈し、4,000細胞/25 μLのDFK培地が存在するようにします。
- 10 cmのペトリ皿のキャップに、キャップあたり約30〜40滴の25 μLの細胞懸濁液を入れます。液滴の蒸発を防ぐために、下の皿にPBSを注ぎます。キャップをそっとひっくり返し、皿を覆います。皿を37°C、5%CO2 で3日間インキュベートします。
- DFK培地を取り出し、1mLのPBSで1回洗浄する。500 μLの0.05%トリプシンを加え、形態に基づいてプレートを37°Cおよび5%CO2 で3〜7分間インキュベートします。
2. 胚様体(EB)の中胚葉・血液内皮パターニング
- 液滴内のEBを収集します。
- 1 mLピペットとPBSを使用して、液滴からすべてのEBを15 mLチューブに回収します。少量のPBSを液滴に送り込み、EBを含む培地をピペットで吸引します。
注:黄色が多い液滴は、ピンク色の液滴よりも形成と成長が成功したことを示します。 - 採取したEBを100 x g で室温で1分間スピンダウンし、ピペットを使用して上清を除去します。1 mLの培地A(市販の細胞分化キットから、 材料の表を参照)を加えて、回収したEBを非接着性の24ウェルプレートに移します。この日を Day 0 とラベル付けします (図 1)。
注:通常、1つの10 cmディッシュから収集されたすべてのEBはグループ化され、24ウェルプレートの1つのウェルに移されます。
- 1 mLピペットとPBSを使用して、液滴からすべてのEBを15 mLチューブに回収します。少量のPBSを液滴に送り込み、EBを含む培地をピペットで吸引します。
- EBの中胚葉パターニングを行います。
- プレートを5%CO2で37°Cで3日間インキュベートします。2日目に、EBのピペッティングを避けながら、500 μLの培地A(キットからステップ2.1.2)を除去します。次に、500 μLの新しい培地Aを追加します。
- 胚様体の血液内皮指定を行う。
- ウェルから700 μLの培地Aを取り除き、700 μLの培地Bを加えます(キットのステップ2.1.2)。7日間の文化。5日目、7日目、および9日目に培地Bのハーフチェンジを実行します。
3. NK細胞分化
- パターン化されたEBを気液界面に移します。
- EBが底に凝集するようにプレートを少し傾けます。1 mL ピペットを使用して、EB を避けながらできるだけ多くの培地 B を除去します。
- 残りの培地を吸引することにより、ピペットでEBをピックアップします。それらを24ウェルプレートのトランスウェルに移します( 材料表を参照)。
注:最適な密度を得るには、トランスウェルあたり2〜3EBに制限してください。
- リンパ系前駆細胞の拡張を行います。
- 500 μLのNK-1培地(市販のリンパ球拡張培地+ 14 IU/mL IL-3、4,500 IU/mL IL-15、8,800 IU/mL IL-7、26 IU/mL SCF、および12 IU/mL ftl3L、 材料表を参照)をトランスウェルの下部コンパートメントに追加します。14日間培養し、1日おきに培地交換を行う。
- 7〜10日目に細胞を収穫し、コーティングされたプレートに移します。
- プレートをコーティングするには、コーティング材料(市販のリンパ系分化コーティング材料、100倍、 材料表を参照)をPBSで希釈します。12ウェルプレートの各ウェルに1 mLの希釈コーティング溶液を加え、プレートを4°Cで一晩インキュベートします。プレートの開口部をラッピングフィルムで覆います。
- 200 μLのPBSをトランスウェルに加え、約5〜6回ゆっくりとピペットで上下させて、オルガノイドから放出された細胞を回収します。オルガノイドのピペッティングは避けてください。
注:丸い細胞はオルガノイドから連続的に放出されます(図2D)。 - 回収した細胞懸濁液を2 mLチューブに移し、細胞を500 x g で室温で5分間スピンダウンします。ピペットで上清を除去し、1 mLのNK-1培地を加え(ステップ3.2.1)、ピペッティングにより細胞を再懸濁します。
- ウェルからすべてのコーティング溶液を取り出し、12ウェルプレートの各ウェルを1 mLのPBSで2回洗浄します。
- 採取した細胞を1:2の比率で分割します。細胞懸濁液をコーティングされた12ウェルプレートに移します(ステップ3.3.1)。各ウェルに1.5 mLの培地が含まれるように、1 mLのNK-1培地を追加します。
- 培地交換を行うには、細胞を1〜2分間放置して、細胞が底に沈むようにします。750 μLの培地を注意深く吸引します。採取した上清を500 x g で室温で5分間スピンダウンします。
- 上清の大部分を捨て、750 μLのNK-1培地に5〜6回ピペッティングで再懸濁します。新鮮な培地に再懸濁した細胞を元のウェルに加えます。
メモ: この並列システムは、 図 1 では 2D システムと呼ばれています。細胞が由来するオルガノイドのウェルの培地交換スケジュールに従ってください。
- 以下の手順でNK細胞の成熟を行います。
- 3Dシステムの古い培地を取り出し、500 μLのNK-2(市販のNK細胞分化培地+ 4,500 IU/mL IL-15、8,800 IU/mL IL-7、26 IU/mL SCF、および12 IU/mL ftl3L、 材料表を参照)をトランスウェルの下部コンパートメントに追加します。37°C、5%CO2 で14日間インキュベートします。
注意: 培地がトランスウェルの底部に触れていることを確認してください。 - 2Dシステムのセルに対して完全な培地交換を実行します。1 つのウェルから 1.5 mL の細胞をすべて回収し、室温で 500 x g で 5 分間遠心分離します。ピペットで上清の大部分を除去し、ペレットを1.5 mLのNK-2培地で再懸濁します(ステップ3.4.1)。
- 隔日で中程度の交換を実行します。3Dシステムのプレートを少し傾け、トランスウェルの外側にある古い培地をすべて取り除きます。500 μLのNK-2培地をトランスウェルの外側に追加します。
- 2Dシステム用の12ウェルプレートの1ウェルでハーフメディウム交換を行うには、細胞を1〜2分間放置して、細胞が底に沈むようにします。750 μLの培地を注意深く吸引します。
- 回収した上清を500 x g で室温で5分間スピンダウンし、細胞の損失を防ぎます。上清の大部分を捨て、5〜6回ピペッティングして750 μLのNK-2培地に再懸濁します。新鮮な培地に再懸濁した細胞を元のウェルに加えます。
- 3Dシステムの古い培地を取り出し、500 μLのNK-2(市販のNK細胞分化培地+ 4,500 IU/mL IL-15、8,800 IU/mL IL-7、26 IU/mL SCF、および12 IU/mL ftl3L、 材料表を参照)をトランスウェルの下部コンパートメントに追加します。37°C、5%CO2 で14日間インキュベートします。
4. 成熟細胞の採取
- 2Dシステムで培養した細胞を回収します。
- 38〜45日目に上下にピペッティングして細胞を収穫します。1 mLのPBSで2回洗浄します。細胞懸濁液を500 x g で室温で5分間遠心分離します。
- ピペットで上清を除去し、選択したバッファーに再懸濁します(フローサイトメトリーの場合はPBS + 2%FBS、 材料の表を参照)。
- オルガノイドに埋め込まれた細胞を収穫します。
- 38〜45日目に、トランスウェルの外側から培地を15 mLチューブに回収します。トランスウェル内に200 μLのPBSを加え、5〜6回上下にピペッティングして、オルガノイドを2回洗浄します。懸濁液を15 mLチューブに移します。
- 500 μLのPBSを12ウェルプレートのウェルに加えます。オルガノイドをトランスウェルから鉗子で12ウェルプレートのウェルに移します。
- ハサミと鉗子を使用してオルガノイドを20回カットします。鉗子とはさみの残りの細胞をPBSでウェルに洗い流します。できるだけ多くのPBSを採取し、オルガノイド構造を吸引せずにステップ4.2.1で使用した15 mLチューブに移します。
- 500 μLの解離試薬( 材料表を参照)をトランスウェルに加え、オルガノイドを酵素的に消化します。市販の細胞剥離溶液( 材料の表を参照)で37°Cおよび5%CO2で7〜10分間インキュベートします。1 mLのPBSと2%FBSを加えて反応を停止し、別の15 mLチューブに溶液を収集します。2%FBSを含む1 mLのPBSでウェルを2回洗浄します。
注:形態に基づいてインキュベーションの長さを決定します。単一細胞が3D構造の膜から放出され始めるポイントを達成するようにしてください。 - 2%FBSを含む1 mLのPBSを追加し、ピペットで8〜10回上下させます。オルガノイド構造を含むすべての溶液を収集します。ステップ4.2.3で使用した15 mLチューブにセルストレーナーで移します。
- 両方のチューブを500 x g で室温で5分間遠心分離します。上清をピペットで捨てる。細胞ペレットを選択したバッファーで再懸濁します(ステップ4.1.2)。
結果
現在の in vitro 分化(IVD)産物は、ヒトNK細胞と同様の表面マーカーと抗腫瘍能力を持っているという仮説が立てられました。
ヒトNK細胞の定義マーカーにアクセスして、3D培養システムからの分化産物が表現型的にヒトNK細胞に類似した細胞を生成するかどうかをテストしました。異なる時点(n = 2)で誘導された2つのバッチから3D培養系から解離した細胞の約15%はCD3−CD56+(図3A)でした。CD3は、CD3が存在せず、 in vitroでT細胞を誘導することが困難であったため、テストパネルでCD45(汎白血球マーカー)に置き換えられました。3D構造から解離した細胞の約16%はCD45+CD56+(図3B、n = 1)であり、これは以前の試験で見られたCD3-CD56+細胞の割合と一致しています。2D培養システムから回収した細胞中のCD3−CD56+細胞の割合は、誘導の成功率が高い(図3C、n = 3)から誘導が成功していない(図3D、n = 2)まで、30%から6%の範囲でした。2D培養システムから採取した細胞の機能と表現型を検証しました。2Dシステムからの18日目の培養では、50 ng/mL IL-18、455 IU/mL IL-2、および20 ng/mL抗CD244抗体刺激を2時間行った後、約12%の細胞が異所性CD56とCD107aの両方を発現しました(図4C、n = 1)。採取した細胞の約28%はCD94+CD159a+であった(図4B、n=1)。顆粒膜上のタンパク質ライニングであるCD107aの異所性発現は脱顆粒を示し10、CD94/NKG2A(CD159a)ヘテロ二量体はNK細胞の別の決定マーカーです。これは、IVD製品の表現型と機能検証の例を提供します。
IVD製品の機能性は、ヒト赤白血病細胞-K562細胞に対する細胞毒性によって試験されました。K562細胞の包括的なリガンドプロファイリングにより、下方制御された主要な組織化学複合体I(MHC-I)と比較的強いNKG2Dリガンド発現(ULBP-1、ULBP-2/5/6、ULBP-3など)が明らかになりました11。したがって、K562細胞はNK細胞12の溶解活性の影響を受けやすい。IVDエンドポイント製品とNK92mi細胞の両方を、50 ng/mLのIL-18、455 IU/mLのIL-2、および20 ng/mLの抗CD244抗体で一晩プライミングしました。GFP+ K562細胞を、IVD細胞またはNK92mi細胞から回収した細胞と、異なるエフェクター対標的比(E:T)で、50 ng/mL(IUは提供されていません)IL-18、455 IU/mL IL-2、および20 ng/mL抗CD244抗体を同容量のH5100培地中で3時間共培養しました。NK細胞殺傷活性の読み出しは、GFP+サブセット上の死細胞マーカーの発現であった。K562細胞を市販のコントロールベクター( 材料表参照)で形質導入してGFPを構成的に発現させ、形質導入の効率は約80%でした(補足図1A)。付加されたGFPシグナルの割合は、添加されたGFP+ K562細胞の数に比例し、形質導入されたK562細胞からの特異的GFP発現を示唆しています(補足図1B)。
図5に示す死にかけている標的細胞の割合を、以下の式13で計算した:
死にかけている細胞の割合=(FITC+DAPI+共培養の割合[例えば、 図5A])-(FITC + DAPI+形質導入されたK562細胞の%)
評価した3つのE:T比(0.1:1、0.33:1、1:1)のうち、IVD産物(図5B、hEPSC-NK)またはNK92mi細胞(図5B、NK92mi)と共培養した場合の、死にかけているGFP+細胞の割合はE:T比と正の相関があり、腫瘍標的の特異的な殺傷を示しています。しかし、IVD産物の細胞毒性は、試験期間内では比較的控えめでした(図5C)。
最後に、リンパ系前駆細胞生成を3D培養と2D培養の間で比較した。その結果、3D培養条件では、2D培養条件(36,000細胞)よりも多くの前駆細胞(55,000細胞)が生成されることがわかりました(補足図2)。これは、3D培養における組織構造と細胞成分の文脈がリンパ系前駆細胞の生成を支持したことを示唆しています。
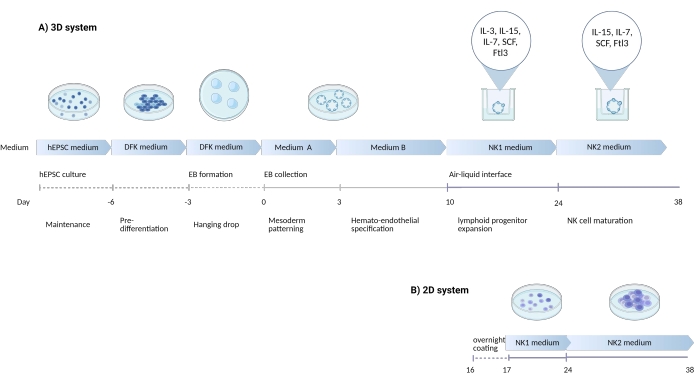
図1:NK細胞をhEPSCから分化させるための分化戦略を示す模式図。 (A)ここでは、3D培養システムのタイムラインを示し、各ステップの培養条件と簡単なキーワードを詳述しています。3Dシステムの気液界面は、NK細胞誘導中も維持されます。(B)ここでは、2D培養システムのタイムラインを示しています。3Dシステムの構造から7日目から10日目に回収された放出細胞は、気液界面のないコーティングプレートに播種されます。この図の拡大版を表示するには、ここをクリックしてください。
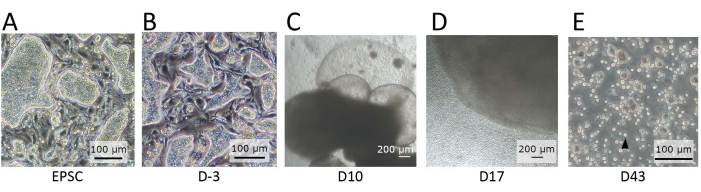
図2:分化の異なる段階で観察された細胞の形態。 (A)EPSCMで維持された場合のhEPSCの形態。hEPSCはドーム型のコロニーを形成します。(B)分化前のhEPSCの形態。ドーム型のコロニーは平らになっています。hEPSCは採取され、ハンギングドロップ技術でEBを形成します。EBを回収し、培地A、次に培地Bで培養する。 (C)10日目のEBの形態。この期間中、EBは膨張および膨張し始め、膜構造を形成します。(D)細胞放出性EBの形態。トランスウェルに播種した後、EBは成長し、常に丸い細胞を周囲に放出します。放出された細胞の一部を回収し、リンパ系分化コーティング材料でコーティングした12ウェルプレート上で培養します。細胞集団は形態学的に不均一であり、一緒に凝集する傾向があります。(E)IVDの終点で観察された細胞の形態。小さな円形の懸濁細胞(黒い矢印)が観察されます。スケールバー:(A、B、E)= 100μm;(C,D) = 100 μm. この図の拡大版を表示するには、ここをクリックしてください。
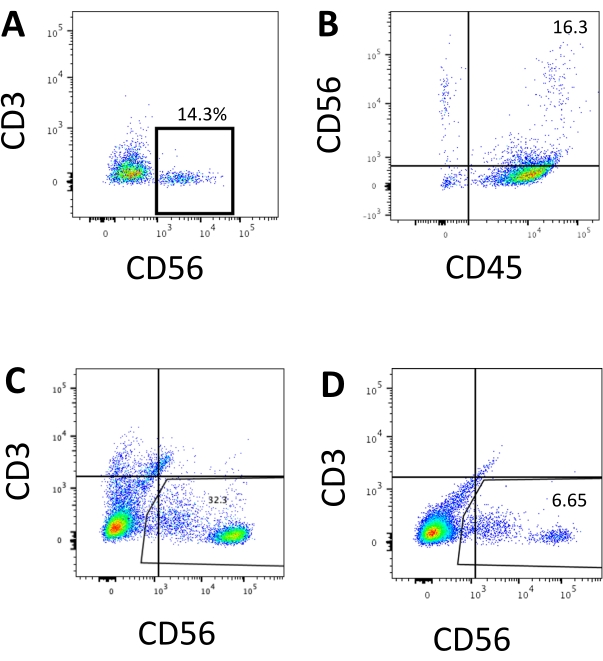
図3:エンドポイントにおけるhEPSC由来産物の代表的なFACSプロット。 細胞を透視鏡結合抗体とともに氷上で30分間インキュベートします。サンプルは、FACSサンプル注入ポートにロードされる前にDAPIで染色されます。染色されていない細胞は、ネガティブゲーティングを確立するために使用されます。(A)2つのバッチから3D培養系から解離した細胞におけるCD3およびCD56発現に関する代表的なFACSプロット(n=2)。(B)3D培養物から解離した細胞におけるCD45およびCD56発現に関する代表的なFACSプロット(n=1)。(C)誘導の成功からコーティングプレートから採取した細胞におけるCD3およびCD56発現に関する代表的なFACSプロット(n=3)。(D)誘導が最適でない(n=2)ときのコーティングプレートからのCD3およびCD56発現に関する代表的なFACSプロット。 この図の拡大版を表示するには、ここをクリックしてください。
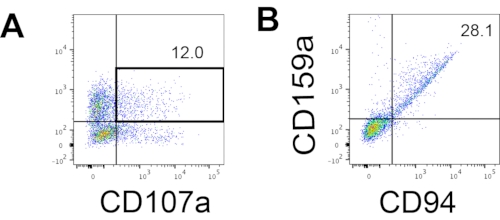
図4:18日目の培養中のhEPSC由来産物に関する代表的なFACSプロット(n=1)。 (A)IL2、IL-18、および抗CD244抗体による刺激の2時間後のCD56およびCD107a発現に関するFACSプロット。(B)CD159aおよびCD94発現に関するFACSプロット。サンプルは、FACSサンプル注入ポートにロードされる前にDAPIで染色されます。染色されていない細胞は、ネガティブゲーティングを確立するために使用されます。 この図の拡大版を表示するには、ここをクリックしてください。
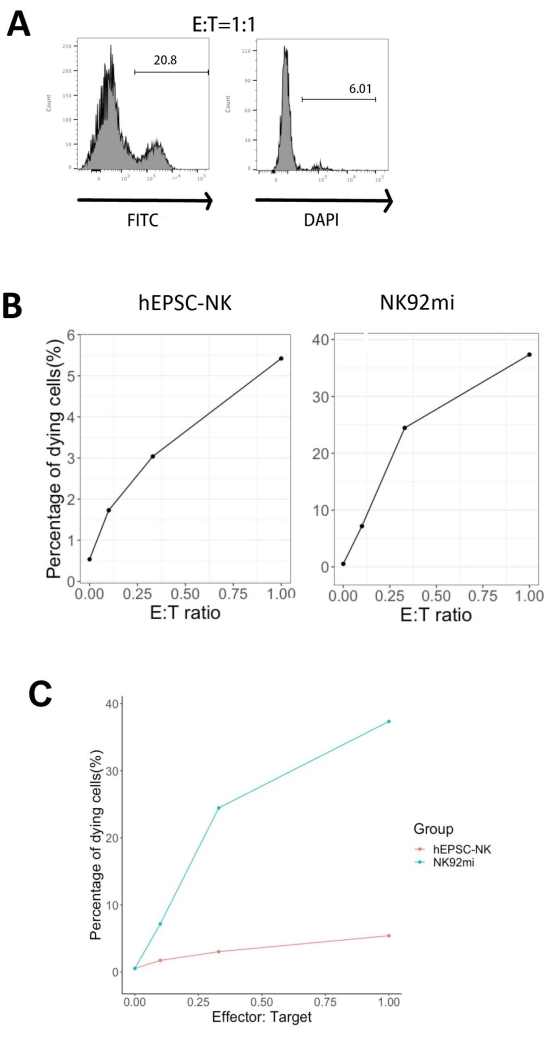
図5:GFP+ K562細胞とIVDエンドポイント産物またはNK92mi細胞(n = 1)との共培養からの異なるE:T比に対する死にかけている細胞の割合のプロット。 FITC+ DAPI+細胞の発現を細胞分析装置で評価し、互換性のあるソフトウェアでデータ解析を行った。(A)E:T比1のIVD産物とK562細胞の共培養からのFITC+DAPI+サブセットのゲーティングを示す代表的なFACSプロット。(B)GFP+ IVD産物(左)またはNK92mi細胞(右)との3時間の共培養実験からの個々のプロット。どちらも、死にかけている細胞の割合とE:T比の間の正の比例関係を反映しています。(C)IVD産物とNK92mi細胞の殺傷曲線を同じスケールで示すプロット。IVD製品は、NK92mi細胞と比較して軽度の細胞毒性を示しました。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:hEPSCからのNK細胞の機能アッセイ。 (a)形質導入されたK562細胞のFACSヒストグラム。FITC+ K562細胞はGFPを発現した。(B)GFP+ K562細胞とエンドポイントIVD産物の3つのE:T比での共培養からのFACSヒストグラム(n = 1)。共存培養におけるFITC+細胞の割合は、添加された形質導入K562細胞の数に対応していた。ゲーティングは、形質導入されていないK562細胞で確立されました。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:2D培養と3D培養におけるリンパ系前駆細胞の分化。 本オルガノイドベースのプロトコールは、ヒト拡大電位幹細胞からリンパ系前駆細胞を誘導するために使用された。(1)オルガノイド内でリンパ系前駆細胞を培養中に保持する(3D)、(2)リンパ系前駆細胞を単離して培養皿上に保持する(2D)という2つの条件を設定しました。2週間の追加培養後、細胞数を2D培養と3D培養と比較するために決定した。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
CD45+CD56+細胞をhEPSCから分化させるためには、いくつかの極めて重要なステップがあります。EPSC培地には系統コミットメント1の阻害剤が含まれているため、分化前(ステップ1.2)は非常に重要です。分化前後、hEPSCのドーム型コロニーは平坦化されます(図2B)。hEPSCからのEBの形成(ステップ1.3)中のRhoキナーゼ阻害剤(ROCKi)であるY27632の添加は、解離後のhEPSCの生存に不可欠です。もう一つの重要な考慮事項は、各トランスウェルに植えられるEBの数です。小規模システムであるため、トランスウェルあたり2〜3EBが培地の過剰消費を防ぐための最適な密度です。気液界面は、3DシステムのNK細胞分化の全過程を通して維持され、間質細胞の極性を維持し、AGM由来の造血前駆細胞の増殖をサポートすると考えられている14,15。
前述のように、トランスウェル上のEBの密度は、分化を成功させるための決定要因です。これのキーサインは、トランスウェルへのEBの移植の1日後の培地の色です。色がすぐに黄色に変わる場合、これは汚染または過密のいずれかを示しています。この問題を解決するには、1 mLピペットを使用して追加のEBを手動でピックアップし、別のトランスウェルに移す必要があります。
このプロトコルの主な制限は、IVD製品中のCD3−/CD45+ CD56+細胞の純度であり、これは純粋なNK92mi細胞と比較して劣った細胞毒性の原因の一部であると考えられています。3D培養システムを採用し、3つの胚胚葉に似たEBの生成 を介して 造血前駆細胞を誘導しました。この戦略は、骨髄微小環境における血球の発達を模倣し、したがって、分化をサポートするための間質細胞の必要性を排除する3。造血前駆細胞を精製するための選別工程がなければ、IVD産物の純度が低下することが予想される。エンドポイント製品の純度を高めながら複雑な分化ニッチを維持する戦略は、選別されたCD3−CD56+ IVD産物の拡張法を開発することです。例えば、選別されたCD3−CD56+ IVD産物は、膜結合IL-21で操作された照射K562細胞などの人工抗原提示細胞(aAPC)上で培養することができる。培養液にIL-2を供給することで、NK細胞数を1,000倍に増やすことができます3。
別の制限は、正の参照としての善意のヒトNK細胞へのアクセスが制限されていることです。NK92miは、共存アッセイで使用されるポジティブリファレンスですが、十分に正確ではありません。NK92mi細胞は、活性化されたNK細胞表現型16を発現する永久細胞株であるNK92細胞から操作され、培養要件を満たすようにIL-2を自律的に産生します。NK92細胞は、ヒト初代NK細胞よりも インビトロで K562細胞に対して優れた殺傷活性を示す17。末梢血NK細胞の細胞毒性を並行してアッセイすることで、IVD産物の腫瘍殺傷能力のより公正な比較を達成できますが、残念ながら、血液バンクへのアクセスは不足しています。
この2系統培養プロトコルは、hEPSCからCD3−/CD45+CD56+細胞を生成することを目的としています。FACSによる表面マーカーと細胞毒性の評価は、分化ニッチを破壊することなく、2Dシステムの細胞に対して日常的に実行できます。CD3−CD56+細胞の割合の違いにもかかわらず、3Dおよび2DシステムはCD56発現の類似した変動を有するCD3−CD56+細胞を導出することができ(図3)、2Dシステムは3D培養条件からのリンパ系前駆細胞の存在を反映しています。
3D培養システムを利用する意義は、空間トランスクリプトミクスやイメージング質量分析などの高分解能プロファイリングアッセイを使用して、複雑な分化ニッチ内の空間的関係と細胞間相互作用を研究できることです。
開示事項
著者は利益相反を宣言しません。
謝辞
ハンディ・カオ博士、サンシン・ガオ、デビッド・シャン、イーミン・チャオ、リティカ・ジョガニ、オーウェン・チャン、ステファニー・チャン、セリーヌ・チャンの技術支援と有益な議論に感謝します。この作業は、プラットフォーム技術基金によって支援されました。 図 1 は BioRender.com で作成されています。
資料
| Name | Company | Catalog Number | Comments |
| 30 w/v% Albumin Solution, from Bovine Serum(BSA), Fatty Acid Free | Wako Chemicals | 017-22231 | For resuspending cytokines. |
| ACCUMAX | STEMCELL Technologies | 07921 | |
| Anti-human-CD159a-PE | BD | 375104 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD3-APC antibodies | BD | 555355 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 2% FBS) |
| Anti-human-CD45-APC antibodies | BD | 555485 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 3% FBS) |
| Anti-human-CD56-PE antibodies | BD | 555516 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 4% FBS) |
| Anti-human-CD56-PEcy7 antibodies | BD | 335826 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD94-APC | BD | 559876 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Bemis Parafilm M Laboratory Wrapping Film | Thermo Scientific | 11772644 | |
| Cd244 Monoclonal Antibody (eBioC1.7 (C1.7)), Functional Grade, eBioscience | Thermo Scientific | 16-5838-85 | |
| Costar 6.5 mm Transwell, 0.4 µm Pore Polyester Membrane Inserts | STEMCELL Technologies | 3470 | |
| Dapi Solution, 1 mg/mL | BD | 564907 | It is resuspended with ddH2O so the concentration is 10 µM/mL. Add 1 µL of the aliquot in 300 µL of FACS buffer (PBS + 2% FBS) |
| DMEM | CPOS-Bioreagent core | 11965092 | |
| DMEM/F12 | Thermo Scientific | 11320033 | |
| FcX, human | Biolengend | 422302 | |
| Fetal Bovine Serum(FBS) qualified E.U.-approved South America | CPOS-Bioreagent core | 10270106 | |
| FlowJo v10.8.0 | BD | ||
| Gibco PBS (10x) pH 7.4 | CPOS-Bioreagent core | 70011044 | 10x concentrated PBS is manufactured as follows: without calcium, magnesium or phenol red |
| K562 cells | ATCC | CCL-243 | |
| Knockout Serum Replacement | Thermo Scientific | 10828-028 | |
| MyeloCult H5100 medium | STEMCELL Technologies | 5150 | |
| NK92mi cells | ATCC | CRL-2408 | Lot: 70045208. Once thawed, they are cultured in MyeloCult H5100 medium, and maintained the density between 2 x 105 to 1 x 106 cell/mL. |
| Nunc Cell-Culture Treated Multidishes 12 well plate | Thermo Scientific | 150628 | flat bottom |
| Nunc Cell-Culture Treated Multidishes 24 well plate | Thermo Scientific | 142475 | |
| Nunc EasYDish Dishes | Thermo Scientific | 150460 | |
| pLenti-GFP Lentiviral Control Vector | CELL BIOLABS | LTV-400 | It is packaged as the manufactuer suggested (https://www.cellbiolabs.com/sites/default/files/LTV-400-gfp- lentiviral-plasmid.pdf). 40 μL of 50x lentivirus is added with 1 μL 10 mg/mL polybrene per 1 mL of cell suspension. Complete medium change is performed 24 h after the addition of lentivirus. Cells are incubated undisputedly for 3 days at 37 °C, 5% CO2. |
| Polybrene | EMD Millipore | TR-1003-G | |
| Recombinant Human Flt-3 Ligand/FLT3L Protein | R&D Systems | 308-FK-005 | It is resuspend with PBS + 0.2% BSA. Thr working concentration is 10 ng/mL or 12 IU/mL. |
| Recombinant Human IL-15 Protein | R&D Systems | 247-ILB-005 | It is resuspended with PBS + 0.2% BSA. The working concentration is 10 ng/mL or 4500 IU/mL. |
| Recombinant Human IL-18/IL-1F4 Protein | R&D Systems | 9124-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL. The IU is not provided by the company. |
| Recombinant Human IL-2 Protein | R&D Systems | 202-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL or 455 IU/mL. |
| Recombinant Human IL-3 Protein, 50ug | PeproTech | 200-03 | It is resuspended with PBS + 0.2% BSA. The working concentration is 5 ng/mL or 14 IU/mL. |
| Recombinant Human IL-7 Protein | R&D Systems | 207-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 8800 IU/mL. |
| Recombinant Human SCF Protein | R&D Systems | 255-SC-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 26 IU/mL. |
| STEMdiff Hematopoietic Kit | STEMCELL Technologies | 5310 | Medium A: 45 mL STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement A ; Medium B: 75 STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement B |
| StemSpan lymphoid differentiation coating material | STEMCELL Technologies | 9950 | It is resuspended in PBS (100x) |
| StemSpan NK cell differentiation medium | STEMCELL Technologies | 9960 | It is prepared by adding 500 µL StemSpan NK Cell Differentiation Supplement (100x) into 49.5 mL of SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan lymphoid expansion medium | STEMCELL Technologies | 9960 | It is prepared by adding 5 mL StemSpan Lymphoid Progenitor Expansion Supplement (10x) into 45 mL of StemSpan SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan NK Cell Generation Kit | STEMCELL Technologies | 9960 | Thaw the medium and materials in room temperature and the medium is stored in 4 °C once thawed. |
| The BD LSRFortessa cell analyzer | BD | ||
| Trypsin-EDTA (0.05%), phenol red | Thermo Scientific | 25300054 | |
| Y-27632 dihydrochloride | Tocris | 1254 | working concentration: 10 µM |
参考文献
- Gao, X., et al. Establishment of porcine and human expanded potential stem cells. Nature Cell Biology. 21 (6), 687-699 (2019).
- Mackinlay, K. M. L., et al. An in vitro stem cell model of human epiblast and yolk sac interaction. eLife. 10, 63930(2021).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical-scale natural killer cells from human pluripotent stem cells. Methods in Molecular Biology. 2048, 107-119 (2019).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity. Cell Stem Cell. 23 (2), 181-192 (2018).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Dhar, P., Wu, J. D. NKG2D and its ligands in cancer. Current Opinion in Immunology. 51, 55-61 (2018).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Rungarunlert, S., Techakumphu, M., Pirity, M. K., Dinnyes, A. Embryoid body formation from embryonic and induced pluripotent stem cells: Benefits of bioreactors. World Journal of Stem Cells. 1, 11-21 (2009).
- Counting cells using a hemocytometer. abcam. , Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. Journal of Immunological Methods. 294, 15-22 (2004).
- Tremblay-McLean, A., Coenraads, S., Kiani, Z., Dupuy, F. P., Bernard, N. F. Expression of ligands for activating natural killer cell receptors on cell lines commonly used to assess natural killer cell function. BMC Immunology. 20, 8(2019).
- Inoue, T., Swain, A., Nakanishi, Y., Sugiyama, D. Multicolor analysis of cell surface marker of human leukemia cell lines using flow cytometry. Anticancer Research. 34 (8), 4539(2014).
- Mhatre, S. Rapid flow cytometry based cytotoxicity assay for evaluation of NK cell function. Indian Journal of Experimental Biology. 52 (10), 983-988 (2014).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Motazedian, A., et al. Multipotent RAG1+ progenitors emerge directly from haemogenic endothelium in human pluripotent stem cell-derived haematopoietic organoids. Nature Cell Biology. 22 (1), 60-73 (2020).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Yan, Y., et al. Antileukemia activity of a natural killer cell line against human leukemias. Clinical Cancer Research. 4 (11), 2859-2868 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved