Method Article
Генерация естественных клеток-киллеров из стволовых клеток с расширенным потенциалом человека
В этой статье
Резюме
Настоящий протокол показывает, как дифференцировать CD3−/CD45+CD56+ клетки с умеренной цитотоксичностью от стволовых клеток человека с расширенным потенциалом (hEPSC) как в условиях 3D, так и в условиях 2D-культуры. Это позволяет проводить рутинную фенотипическую валидацию без разрушения сложной микросреды.
Аннотация
Дифференцировка естественных киллерных (NK) клеток от плюрипотентных стволовых клеток человека позволяет проводить исследования и производить клеточные продукты клинического класса для иммунотерапии. Здесь описан двухфазный протокол, который использует бессывороточную коммерческую среду и коктейль из цитокинов (интерлейкин [IL]-3, IL-7, IL-15, фактор стволовых клеток [SCF] и FMS-подобную тирозинкиназу 3 лиганда [Ftl3L]) для дифференцировки стволовых клеток с расширенным потенциалом человека (hEPSC) в клетки, обладающие свойствами NK-клеток in vitro с помощью как 3-мерной (3D), так и 2-мерной (2D) технологии культивирования. Следуя этому протоколу, последовательно генерируются CD3−CD56+ или CD45+CD56+ NK-клетки. При кокуляции с опухолевыми мишенями в течение 3 ч дифференцированные продукты демонстрируют умеренную цитотоксичность по сравнению с IL-2-независимой постоянной клеточной линией, клетками NK92mi. Протокол сохраняет сложность микроокружения дифференцировки путем генерации 3D-структур, тем самым облегчая изучение пространственных отношений между иммунными клетками и их нишами. Между тем, система 2D-культур позволяет рутинную фенотипическую валидацию дифференцировки клеток без ущерба для деликатной ниши дифференцировки.
Введение
По сравнению с обычными плюрипотентными стволовыми клетками, такими как эмбриональные стволовые клетки человека (hESCs) и индуцированные человеком плюрипотентные стволовые клетки (hiPSCs), стволовые клетки человека с расширенным потенциалом (hEPSC) ближе к состоянию тотипотентности, поскольку они могут дифференцироваться как во внеэмбриональные, так и в эмбриональные линии1. Например, гЭПСК могут быть дифференцированы на трофобласты1 и желтокообразные клетки2. Для достижения уникальной эффективности гЭПСК отдельный бластомер культивируют в среде, содержащей несколько малых молекул, которые ингибируют передачу сигналов1, которая называется средой EPSC (EPSCM). Культивирование hESCs и hiPSCs в EPSCM расширяет их ранее ограниченную потенцию, чтобы дифференцировать их в клетки трофобласта1.
Плюрипотентные стволовые клетки являются ценным исследовательским инструментом для экспериментов с новыми генетическими модификациями. Благодаря самообновлению и дифференцировке плюрипотентных стволовых клеток один трансформированный клон плюрипотентной стволовой клетки может производить дифференцированные клеточные продукты, которые обладают той же генетической модификацией в том же локусе. Чжу и Кауфман установили стандарт дифференцировки NK-клеток от обычных плюрипотентных стволовых клеток (hESCs и hiPSCs)3. Во-первых, они индуцировали гемопоэтические стволовые клетки (ГСК) из эмбрионального тела, полученного из плюрипотентных стволовых клеток. Добавление фактора стволовых клеток (SCF), FMS-подобного тирозинкиназы 3 лиганда (Ftl3L), интерлейкина (IL)-7, IL-15 и ранней добавки IL-3 смещало ГСК для развития в естественные киллерные (NK) клетки. Впоследствии они расширили NK-клетки искусственными антигенпрезентирующими клетками (aAPCs), которые представляют мембранно-связанный IL-21, с непрерывным добавлением IL-2. Исследователи применили этот подход к иммунотерапии, чтобы генерировать естественные клетки-киллеры, полученные из iPSC, наделенные рецептором химерного антигена (CAR-iNK)4.
Человеческие NK-клетки определяются как CD3−CD56+ лейкоциты в периферической крови. Они являются эффекторами против инфицированных вирусом клеток и опухолевых клеток5. Некоторые тормозные рецепторы на NK-клетках распознают молекулы, экспрессируемые повсеместно в нормальных клетках. Например, гетеродимер NKG2A/CD94, экспрессируемый на NK-клетках, распознает молекулы MHC класса I5. Между тем, активирующие рецепторы на NK-клетках распознают лиганды, индуцированные стрессом, подобно тому, как NKG2D распознает индуцированную трансформацией MHC класса I полипептидную последовательность A (MICA /MICB)6. Некоторые трансформированные клетки понижают свои «самолиганды», чтобы избежать иммунного надзора и повысить аберрантные лиганды, что заставляет NK-клетки выполнять свой литический механизм. Внутренние противоопухолевые способности NK-клеток привлекли внимание к этому типу иммунных клеток.
Способность одновременно давать начало как эмбриональным, так и внеэмбриональным линиям может сделать hEPSC более точным повторением ниши эмбрионального развития, чем обычные плюрипотентные стволовые клетки. По опыту, поддерживать эффективность гЭПСК легче, чем хайПСК. В настоящем исследовании был разработан протокол (рисунок 1) для смещения hEPSC для развития в кроветворные линии, а затем дифференцировки клеток-предшественников в естественные киллерные (NK) клетки in vitro. В протоколе используются коммерческие носители, чтобы избежать сывороточных несоответствий, с последующим поэтапным добавлением цитокинов для дифференцировки смещения в лимфоидные линии. Этот протокол имеет две системы для сохранения сложной 3D-микросреды при получении CD3−CD56+/CD45+CD56+ клеток, которые фенотипически и функционально напоминают человеческие NK-клетки.
Этот протокол может быть полезен при изучении взаимодействия иммунных клеток с их нишами дифференцировки и может иметь потенциал для очистки клеточных продуктов для иммунотерапевтического использования.
протокол
Настоящее исследование включало эксперименты с vitro ; поэтому утверждение этики не применяется. Установленные клеточные линии, использованные в этом исследовании, были получены из коммерческих источников (см. Таблицу материалов).
1. Генерация 3D органоидных структур из hEPSC
- Поддерживайте hEPSC путем культивирования их с 1 мл среды EPSC (12-луночная пластина) на питающих ячейкахSNL 1.
ПРИМЕЧАНИЕ: Куполообразные колонии наблюдаются (рисунок 2А), если их расширенная потенция сохраняется. - Выполните предварительную дифференциацию hEPSC.
- Удалите среду hEPSC и добавьте 1 мл среды DFK (DMEM/F12 + 10% сывороточной замещающей среды, см. Таблицу материалов). Инкубировать в течение 2-3 дней при 37 °C и 5% CO2. Выполняют среднюю смену на второй день, если продолжать инкубацию в течение 3 дней.
ПРИМЕЧАНИЕ: Под микроскопом куполообразные колонии сплющиваются (рисунок 2B).
- Удалите среду hEPSC и добавьте 1 мл среды DFK (DMEM/F12 + 10% сывороточной замещающей среды, см. Таблицу материалов). Инкубировать в течение 2-3 дней при 37 °C и 5% CO2. Выполняют среднюю смену на второй день, если продолжать инкубацию в течение 3 дней.
- Проверьте формирование эмбриональных тел методом висячих капель 7,8.
- Удалите DFK-среду и вымойте 1 мл PBS один раз. Добавьте 500 мкл 0,05% трипсина и инкубируйте пластину при 37 °C и 5% CO2 в течение 3-7 мин в зависимости от морфологии.
ПРИМЕЧАНИЕ: ГЭПСК должны иметь возможность отсоединяться от фидерных ячеек, когда пластина слегка нарушена. - Удалите трипсин и добавьте 2 мл среды DFK для сбора клеток. Раскрутите ячейки при 300 х г в течение 3 мин при комнатной температуре.
- Удалите супернатант пипеткой. Добавьте 1 мл среды DFK и 1 мкл Y27632 (см. Таблицу материалов) для повторного суспендирования ячеек.
- Подсчитайте количество клеток внутри клеточной суспензии с помощью гемоцитометра9. Разбавьте клеточную суспензию средой DFK и Y27632 (1000x) таким образом, чтобы было 4000 клеток /25 мкл среды DFK.
- Наполните крышку чашки Петри размером 10 см примерно 30-40 каплями 25 мкл клеточной суспензии на колпачок. Налейте немного PBS в нижнюю посуду, чтобы предотвратить испарение капель. Аккуратно переверните колпачок и накройте блюдо. Инкубировать блюдо при 37 °C и 5% CO2 в течение 3 дней.
- Удалите DFK-среду и вымойте 1 мл PBS один раз. Добавьте 500 мкл 0,05% трипсина и инкубируйте пластину при 37 °C и 5% CO2 в течение 3-7 мин в зависимости от морфологии.
2. Мезодерма и гематоэндотелиальный рисунок эмбриоидного тела (ЭБ)
- Соберите ЭБ внутри капли.
- Соберите все ЭБ из капли в пробирку объемом 15 мл, используя пипетку объемом 1 мл и немного PBS. Закачивайте немного PBS в каплю, а затем аспирируйте среду, включая EB, пипеткой.
ПРИМЕЧАНИЕ: Капли, которые более желтые, указывают на более успешное образование и рост, чем розовые капли. - Открутите собранные ЭБ при 100 х г в течение 1 мин при комнатной температуре и используйте пипетку для удаления супернатанта. Добавьте 1 мл среды А (из коммерчески доступного набора дифференцировки клеток, см. Таблицу материалов) для переноса собранных ЭБ на неадгезивную 24-луночную пластину. Обозначьте этот день как День 0 (Рисунок 1).
ПРИМЕЧАНИЕ: Обычно все ЭБ, собранные с одной тарелки размером 10 см, группируются и переносятся в одну лунку из 24-луночной тарелки.
- Соберите все ЭБ из капли в пробирку объемом 15 мл, используя пипетку объемом 1 мл и немного PBS. Закачивайте немного PBS в каплю, а затем аспирируйте среду, включая EB, пипеткой.
- Выполните мезодермное моделирование ЭБ.
- Инкубировать пластину в течение 3 дней при 37 °C с 5% CO2. На 2-й день удалите 500 мкл среды А (из комплекта, шаг 2.1.2), избегая при этом пипетирования ЭБ. Затем добавляют 500 мкл свежей среды А.
- Выполняют гемато-эндотелиальную спецификацию эмбрионального тела.
- Удалите 700 мкл среды А из скважины и добавьте 700 мкл среды В (из комплекта, этап 2.1.2). Культура на 7 дней. Выполните половинную смену среднего B на 5-й день, 7-й день и 9-й день.
3. Дифференцировка NK-клеток
- Перенесите узорчатые ЭБ на интерфейс воздух-жидкость.
- Слегка наклоните пластину, чтобы ЭБ накапливались на дне. Используйте пипетку 1 мл, чтобы удалить как можно больше среднего B, избегая ПРИ этом EB.
- Подберите ЭБ пипеткой, аспирируя оставшуюся среду. Переложите их на трансвелл в 24-луночную плиту (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Ограничьте числа двумя-тремя ЭБ на трансвелл для оптимальной плотности.
- Выполняют лимфоидное расширение предшественника.
- Добавьте 500 мкл среды NK-1 (коммерчески доступная лимфоидная расширительная среда + 14 МЕ/мл IL-3, 4 500 МЕ/мл IL-15, 8 800 МЕ/мл IL-7, 26 МЕ/мл SCF и 12 МЕ/мл ftl3L, см. Таблицу материалов) в нижний отсек трансвелла. Культивируйте в течение 14 дней, и выполняйте среднюю смену через день.
- Соберите и перенесите клетки на 7-10 день на пластину с покрытием.
- Чтобы покрыть пластину, разбавьте материал покрытия (коммерчески доступный материал лимфоидного дифференцировочного покрытия, 100x, см. Таблицу материалов) в PBS. Добавьте 1 мл раствора разбавленного покрытия в каждую лунку 12-луночной пластины и инкубируйте пластину при 4 °C в течение ночи. Накройте отверстие тарелки упаковочной пленкой.
- Добавьте 200 мкл PBS в трансвелл и медленно пипетку вверх и вниз примерно пять-шесть раз, чтобы собрать клетки, высвобождаемые из органоидов. Избегайте пипетирования органоидов.
ПРИМЕЧАНИЕ: Круглые клетки высвобождаются из органоидов непрерывно (рисунок 2D). - Переложите собранную клеточную суспензию в трубку объемом 2 мл и раскрутите клетки при 500 х г в течение 5 мин при комнатной температуре. Удалите супернатант пипеткой и добавьте 1 мл среды NK-1 (шаг 3.2.1) для повторного суспендирования клеток путем пипетирования.
- Удалите весь раствор покрытия из скважины и дважды промойте каждую лунку 12-луночной пластины 1 мл PBS.
- Разделите собранные клетки в соотношении 1:2. Перенесите клеточную суспензию на 12-луночную пластину с покрытием (этап 3.3.1). Добавьте 1 мл среды NK-1 так, чтобы каждая скважина имела 1,5 мл среды.
- Чтобы выполнить изменение среды, дайте клеткам посидеть в течение 1-2 минут, чтобы ячейки опустились на дно. Осторожно аспирировать 750 мкл среды. Открутите собранный супернатант при 500 х г в течение 5 мин при комнатной температуре.
- Отбросьте большую часть супернатанта и повторно суспендируйте в 750 мкл среды NK-1 с пипеткой пять-шесть раз. Добавьте клетки, повторно суспендированные в свежей среде, в исходный колодец.
ПРИМЕЧАНИЕ: Эта параллельная система называется 2D-системой на рисунке 1. Следуйте графику изменения среды колодца органоидов, из которых произошли клетки.
- Выполните созревание NK-клеток, выполнив следующие действия.
- Удалите старую среду 3D-системы и добавьте 500 мкл NK-2 (коммерчески доступная среда дифференцировки NK-клеток + 4 500 МЕ/мл IL-15, 8 800 МЕ/мл IL-7, 26 МЕ/мл SCF и 12 МЕ/мл ftl3L, см. Таблицу материалов) в нижний отсек трансвеллера. Инкубировать при 37 °C и 5% CO2 в течение 14 дней.
ПРИМЕЧАНИЕ: Убедитесь, что среда касается нижней части трансвелла. - Выполните полное изменение среды на ячейках в 2D-системе. Соберите все 1,5 мл клеток из одной лунки и центрифугируйте ее при 500 х г в течение 5 мин при комнатной температуре. Удалите большую часть супернатанта пипеткой и повторно суспендируйте гранулу с 1,5 мл среды NK-2 (шаг 3.4.1).
- Выполняйте среднее изменение каждый последующий день. Слегка наклоните пластину 3D-системы, и удалите всю старую среду за пределы трансвелла. Добавьте 500 мкл среды NK-2 вне трансвелла.
- Чтобы выполнить половину изменения среды на одной лунке 12-луночной пластины для 2D-системы, дайте ячейкам посидеть в течение 1-2 минут, чтобы ячейки опустились на дно. Осторожно аспирируйте 750 мкл среды.
- Вращайте собранный супернатант при 500 х г в течение 5 мин при комнатной температуре, чтобы предотвратить потерю клеток. Отбросьте большую часть супернатанта и повторно суспендируйте в 750 мкл среды NK-2 путем пипетки пять-шесть раз. Добавьте клетки, повторно суспендированные в свежей среде, в исходный колодец.
- Удалите старую среду 3D-системы и добавьте 500 мкл NK-2 (коммерчески доступная среда дифференцировки NK-клеток + 4 500 МЕ/мл IL-15, 8 800 МЕ/мл IL-7, 26 МЕ/мл SCF и 12 МЕ/мл ftl3L, см. Таблицу материалов) в нижний отсек трансвеллера. Инкубировать при 37 °C и 5% CO2 в течение 14 дней.
4. Сбор зрелых клеток
- Соберите клетки, культивируемые в 2D-системе.
- Собирайте клетки путем пипетки вверх и вниз в течение дней 38-45. Дважды промыть 1 мл PBS. Центрифугируют клеточную суспензию при 500 х г в течение 5 мин при комнатной температуре.
- Удалите супернатант пипеткой и повторно суспендируйте его в буфере выбора (т.е. PBS + 2% FBS для проточной цитометрии, см. Таблицу материалов).
- Извлеките клетки, встроенные в органоид.
- Соберите среду снаружи трансвелла в трубку объемом 15 мл в течение 38-45 дней. Промыть органоид дважды, добавив 200 мкл PBS внутрь трансвелла и пипеткой вверх и вниз пять-шесть раз. Переложите суспензию в трубку объемом 15 мл.
- Добавьте 500 мкл PBS в колодец из 12-луночной пластины. Перенесите органоид из трансвеллера в колодец из 12-луночной пластины с щипцами.
- Разрежьте органоид 20 раз с помощью ножниц и щипцов. Смойте оставшиеся клетки на щипцах и ножницах в колодец с PBS. Соберите как можно больше PBS и перенесите его в трубку объемом 15 мл, используемую на этапе 4.2.1, без аспирации органоидной структуры.
- Добавьте 500 мкл диссоциационного реагента (см. Таблицу материалов) в трансвелл для ферментативного переваривания органоида. Инкубировать с коммерческим раствором клеточного отделения (см. Таблицу материалов) в течение 7-10 мин при 37 °C и 5% CO2. Гасят реакцию, добавляя 1 мл PBS с 2% FBS, и собирают раствор в еще одну пробирку объемом 15 мл. Промыть лунку 1 мл PBS с 2% FBS дважды.
ПРИМЕЧАНИЕ: Определите длину инкубации на основе морфологии. Постарайтесь достичь точки, в которой одиночные клетки начинают высвобождаться из мембраны 3D-структуры. - Добавьте 1 мл PBS с 2% FBS, и пипетку вверх и вниз 8-10 раз. Соберите все растворы, включая органоидные структуры. Перенесите их в пробирку объемом 15 мл, используемую на этапе 4.2.3, с помощью клеточного ситечка.
- Центрифугировать обе трубки по 500 х г в течение 5 мин при комнатной температуре. Выбросьте супернатант с помощью пипетки. Повторное суспендирование клеточной гранулы с буфером выбора (этап 4.1.2).
Результаты
Было выдвинуто предположение, что существующие продукты дифференцировки in vitro (IVD) будут обладать аналогичными поверхностными маркерами и противоопухолевыми способностями с NK-клетками человека.
К определяющему маркеру человеческих NK-клеток обращались, чтобы проверить, дают ли продукты дифференцировки из системы 3D-культур клеток клетки, которые фенотипически напоминают человеческие NK-клетки. Около 15% клеток, диссоциированных из системы 3D-культур из двух партий, индуцированных в разные моменты времени (n = 2), были CD3−CD56+ (рисунок 3A). CD3 был заменен CD45 (панлейкоцитарный маркер) на тестовой панели из-за отсутствия CD3 и трудности индуцирования Т-клеток in vitro. Приблизительно 16% клеток, диссоциированных от 3D-структуры, были CD45 + CD56 + (рисунок 3B, n = 1), что соответствует проценту клеток CD3−CD56+, наблюдаемым в более ранних испытаниях. Процентное содержание клеток CD3−CD56+ в клетках, собранных из системы 2D-культур, варьировалось от 30% до 6%, от более успешных индукций (рисунок 3C, n = 3) до менее успешных индукций (рисунок 3D, n = 2). Функциональность и фенотипы клеток, собранных из системы 2D-культур, были проверены. Во время культуры 18-го дня из 2D-системы около 12% клеток экспрессировали как эктопический CD56, так и CD107a через 2 ч стимуляции антителами 50 нг/мл IL-18, 455 МЕ/мл IL-2 и 20 нг/мл анти-CD244 антител (Рисунок 4C, n = 1). Около 28% собранных клеток были CD94+CD159a+ (рисунок 4B, n = 1). Эктопическая экспрессия CD107a, белковой подкладки на мембране гранул, указывает на дегрануляцию10, в то время как гетеродимер CD94/NKG2A(CD159a) является еще одним определяющим маркером NK-клеток. Это дает пример фенотипической и функциональной проверки продуктов IVD.
Функциональность продуктов IVD была проверена их цитотоксичностью против клеток эритролейкемии человека - клеток K562. Комплексное профилирование лигандов на клетках K562 выявляет их низкорегулируемый основной гистохимический комплекс I (MHC-I) и сравнительно сильную экспрессию лигандов NKG2D (таких как ULBP-1, ULBP-2/5/6 и ULBP-3)11; таким образом, клетки K562 восприимчивы к литической активности NK-клеток12. Как конечные продукты IVD, так и клетки NK92mi были праймированы 50 нг / мл IL-18, 455 МЕ / мл IL-2 и 20 нг / мл анти-CD244 антител в течение ночи. Клетки GFP+ K562 кокулировали либо с собранными клетками из клеток IVD, либо с NK92mi в различных соотношениях эффектор-мишень (E:T) в присутствии 50 нг/мл (МЕ не предусмотрена) IL-18, 455 МЕ/мл IL-2 и 20 нг/мл анти-CD244 антител в том же объеме среды H5100 в течение 3 ч. Считывание активности уничтожения NK-клеток было экспрессией маркера мертвых клеток на подмножествах GFP+. Клетки K562 трансдуцировали коммерчески доступным контрольным вектором (см. Таблицу материалов) для конститутивной экспрессии GFP, и эффективность трансдукции составляла около 80% (дополнительный рисунок 1A). Процентное содержание добавленного сигнала GFP было пропорционально количеству добавленных клеток GFP+ K562, что свидетельствует о специфической экспрессии GFP из трансдуцированных клеток K562 (дополнительный рисунок 1B).
Процентное содержание умирающих клеток-мишеней, показанное на рисунке 5 , было рассчитано по следующей формуле13:
Процент умирающих клеток = (FITC + DAPI + % кокультуры [например, рисунок 5A]) - (FITC + DAPI + % трансдуцированных клеток K562)
Из всех трех оцененных соотношений E:T (0,1:1, 0,33:1, 1:1) процентное содержание умирающих клеток GFP+ положительно коррелировало с соотношениями E:T при кокультурации с продуктами IVD (рисунок 5B, hEPSC-NK) или клетками NK92mi (рисунок 5B, NK92mi), что указывает на специфическое убийство опухолевых мишеней. Тем не менее, цитотоксичность продуктов IVD была сравнительно скромной в течение тестируемого периода времени (рисунок 5C).
Наконец, генерацию лимфоидных клеток-предшественников сравнивали между 3D и 2D культурами. Было обнаружено, что условие 3D-культуры генерирует больше клеток-предшественников (55 000 клеток), чем условие 2D-культуры (36 000 клеток) (дополнительный рисунок 2). Это говорит о том, что контекст тканевой архитектуры и клеточных компонентов в 3D-культуре поддерживал генерацию лимфоидных клеток-предшественников.
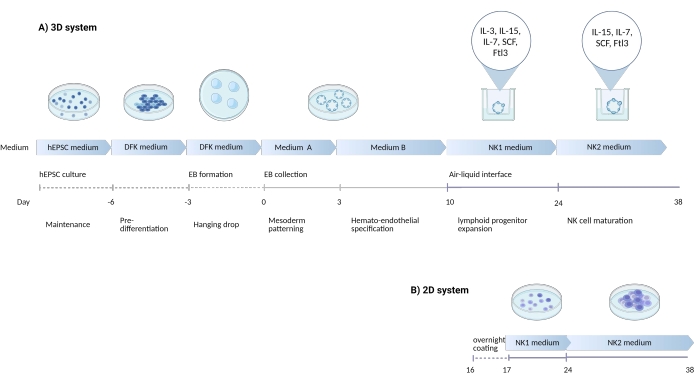
Рисунок 1: Принципиальная диаграмма, показывающая стратегию дифференцировки NK-клеток от hEPSC. (A) Здесь показана временная шкала систем 3D-культур, с подробным описанием условий культивирования и краткими ключевыми словами из каждого шага. Воздушно-жидкостная граница раздела 3D-системы поддерживается во время индукции NK-ячейки. (B) Здесь показана временная шкала систем 2D-культуры. Освобожденные клетки, собранные в дни 7-10 из структур в 3D-системе, высеваются на пластину с покрытием без интерфейса воздух-жидкость. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
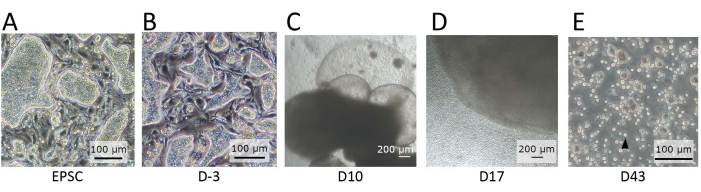
Рисунок 2: Морфология клеток, наблюдаемая на различных стадиях дифференцировки. (A) Морфология hEPSC при поддержании в EPSCM. HEPSC образуют куполообразные колонии. (B) Морфология hEPSC после предварительной дифференцировки. Куполообразные колонии сплющены. HEPSC собираются и образуют ЭБ с помощью техники подвешивания капли. ЭБ собирают и культивируют в среде А, а затем в среде В. (С) Морфология ЭБ на 10-й день. В этот период ЭБ начинает расширяться и раздуваться, образуя мембранные структуры. (D) Морфология ЭБ, высвобождающего клетки. После посева на трансвелле ЭБ растет и постоянно выпускает круглые клетки в окружающую среду. Некоторые из высвобождаемых клеток собирают и культивируют на 12-луночной пластине, покрытой материалами покрытия лимфоидной дифференцировки. Клеточные популяции морфологически неоднородны и имеют тенденцию объединяться вместе. (E) Морфология клеток, наблюдаемая в конечной точке IVD. Наблюдаются небольшие, круглые клетки подвески (черная стрелка). Шкала стержней: (A,B,E) = 100 мкм; (C,D) = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
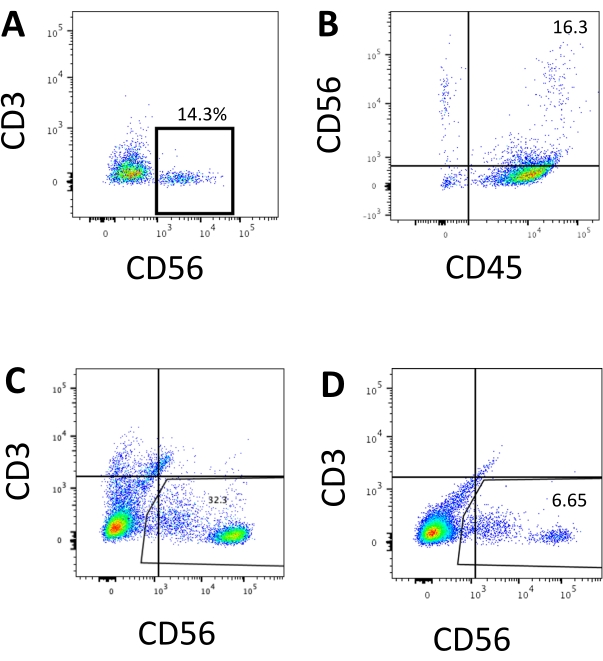
Рисунок 3: Репрезентативные графики FACS продуктов, полученных из hEPSC, в конечной точке. Клетки инкубируются с флюороскопически-конъюгированными антителами на льду в течение 30 мин. Образцы окрашиваются DAPI перед загрузкой в инжекционный порт образца FACS. Неокрашенные клетки используются для установления отрицательного гатинга. (A) Репрезентативный график FACS на экспрессии CD3 и CD56 в клетках, диссоциированных от системы 3D-культивирования из двух партий (n = 2). (B) Репрезентативный график FACS на экспрессии CD45 и CD56 в клетках, диссоциированных от 3D-культуры (n = 1). (C) Репрезентативный график FACS на экспрессии CD3 и CD56 в клетках, собранных из пластины с покрытием в результате успешной индукции (n = 3). (D) Репрезентативный график FACS на экспрессии CD3 и CD56 с пластины с покрытием, когда индукция является неоптимальной (n = 2). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
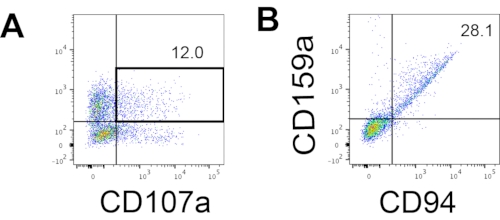
Рисунок 4: Репрезентативный график FACS на продуктах, полученных из hEPSC, во время культуры 18-го дня (n = 1). (A) График FACS на экспрессии CD56 и CD107a после 2 ч стимуляции антителами IL2, IL-18 и анти-CD244. (B) График FACS на выражениях CD159a и CD94. Образцы окрашиваются вDAPI перед загрузкой в инжекционный порт образца FACS. Неокрашенные клетки используются для установления отрицательного гатинга. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
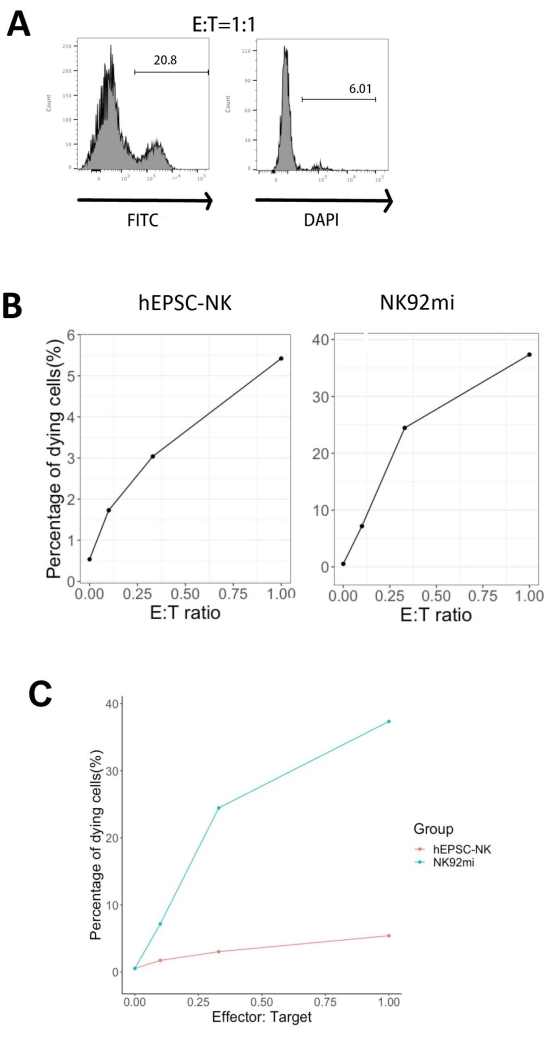
Рисунок 5: График процентов умирающих клеток по отношению к различным соотношениям E:T из кокультуры клеток GFP+ K562 с продуктом конечной точки IVD или клетками NK92mi (n = 1). Экспрессию клеток FITC+ DAPI+ оценивали с помощью клеточного анализатора, а анализ данных выполняли с помощью совместимого программного обеспечения. (A) Репрезентативный график FACS, показывающий забор подмножеств FITC + DAPI + из кокультуры продуктов IVD и клеток K562 с соотношением E:T 1. (B) Отдельные участки из эксперимента по кокультуре с продуктами GFP+ IVD (слева) или клетками NK92mi (справа) в течение 3 ч. Оба отражают положительную пропорциональную зависимость между процентом умирающих клеток и соотношением E:T. (C) График, показывающий кривые уничтожения продуктов IVD и клеток NK92mi в той же шкале. Продукты IVD демонстрировали умеренную цитотоксичность по сравнению с клетками NK92mi. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Функциональный анализ NK-клеток из гЭПСК. (A) FACS гистограмма трансдуцированных клеток K562. Клетки FITC+ K562 экспрессировали GFP. (B) Гистограммы FACS из кокультуры клеток GFP+ K562 и продуктов IVD конечной точки при трех соотношениях E:T (n = 1). Процентное содержание клеток FITC+ в кокультуре соответствовало количеству добавленных трансдуцированных клеток K562. Решетки были установлены с нетрансдуцированными клетками K562. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Дифференциация лимфоидных предшественников в 2D и 3D культуре. Настоящий протокол на основе органоидов использовался для индуцирования лимфоидных предшественников из стволовых клеток с расширенным потенциалом человека. Были созданы два условия: (1) лимфоидные предшественники хранились в культуре внутри органоидов (3D), и (2) лимфоидные предшественники были выделены и сохранены на чашке для культивирования (2D). После 2 недель дополнительной культуры было определено количество клеток для сравнения 2D и 3D культуры. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Существует несколько ключевых шагов для обеспечения успешной дифференцировки клеток CD45 + CD56 + из hEPSC. Предварительная дифференциация (этап 1.2) имеет решающее значение, поскольку среда EPSC содержит ингибиторы приверженности линии1. После предварительной дифференциации куполообразные колонии hEPSC сплющиваются (рисунок 2B). Добавление Y27632, ингибитора рокиназы (ROCKi), во время образования ЭБ из hEPSC (стадия 1.3) незаменимо для выживания hEPSC после диссоциации. Другим важным соображением является количество ЭБ, посаженных на каждую трансвеллу. Поскольку это мелкомасштабная система, две-три ЭБ на трансвелл является оптимальной плотностью для предотвращения чрезмерного потребления среды. Воздушно-жидкостная граница раздела поддерживается в течение всего процесса дифференцировки NK-клеток для 3D-системы, которая, как полагают, поддерживает полярность стромальных клеток и поддерживает расширение гемопоэтических предшественников14,15, полученных из AGM.
Как упоминалось ранее, плотность ЭБ на трансвелле является определяющим фактором для успешной дифференциации. Ключевым признаком для этого является цвет среды через 1 день после имплантации ЭБ на трансвелле. Если цвет быстро желтеет, это указывает либо на загрязнение, либо на переполненность. Чтобы решить проблему, следует использовать пипетку объемом 1 мл, чтобы вручную подобрать лишние ЭБ и перенести их в другой трансвелл.
Основным ограничением этого протокола является чистота клеток CD3−/CD45+ CD56+ в продуктах IVD, которые, как полагают, частично ответственны за более низкую цитотоксичность по сравнению с чистыми клетками NK92mi. Система 3D-культур была использована для индуцирования кроветворных предшественников через генерацию ЭБ, который напоминает три эмбриональных зародышевых слоя. Эта стратегия имитирует развитие клеток крови в микроокружении костного мозга, тем самым устраняя необходимость в стромальных клетках для поддержки дифференцировки3. Без этапа сортировки для очистки кроветворных прародителей чистота продуктов IVD, как ожидается, будет снижена. Стратегия сохранения ниши комплексной дифференциации при одновременном повышении чистоты конечного продукта заключается в разработке метода расширения для отсортированных продуктов CD3−CD56+ IVD. Например, отсортированные продукты CD3−CD56+ IVD можно культивировать на искусственных антигенпрезентирующих клетках (aAPCs), таких как иррадиированные клетки K562, спроектированные с мембранно-связанным IL-21. При поступлении IL-2 в культуру этот метод может достичь 1000-кратного увеличения числа NK-клеток3.
Другим ограничением является ограниченный доступ к добросовестным человеческим NK-клеткам в качестве положительного ориентира. NK92mi является положительной ссылкой, используемой в анализе кокультуры, но она недостаточно точна. Клетки NK92mi спроектированы из клеток NK92, постоянной клеточной линии, которая экспрессирует активированные фенотипы NK-клеток16, для автономного производства IL-2 для удовлетворения требований культуры. Клетки NK92 демонстрируют превосходную убивающую активность против клеток K562 in vitro , чем первичные NK-клетки человека17. Более справедливое сравнение опухолеулавливающей способности продуктов IVD может быть достигнуто путем параллельного анализа цитотоксичности NK-клеток периферической крови, но, к сожалению, доступ к банкам крови отсутствует.
Этот двухсистемный протокол культивирования направлен на генерацию CD3−/CD45+CD56+ клеток из hEPSC. Оценка поверхностных маркеров и цитотоксичности с помощью FACS может обычно выполняться на клетках из 2D-систем без нарушения ниши дифференцировки. Несмотря на различия в процентном соотношении клеток CD3−CD56+, 3D- и 2D-системы могут получать CD3−CD56+ клетки с аналогичными вариациями экспрессии CD56 (рисунок 3), а 2D-система отражает существование лимфоидных предшественников из состояния 3D-культуры.
Важность использования системы 3D-культур заключается в том, что она позволяет использовать профилирующие анализы с высоким разрешением, такие как пространственная транскриптомика или масс-спектрометрия изображений, для исследования пространственных отношений и взаимодействий клетки и клеток в нише сложной дифференцировки.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы хотели бы поблагодарить д-ра Ханди Цао, Сансин ГАО, Дэвида Сян, Имин Чао, Ритику Джогани, Оуэна Чана, Стефани Чунг и Селин Чан за их техническую помощь и полезные обсуждения. Эта работа была поддержана Фондом технологий платформы. Рисунок 1 был создан с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 30 w/v% Albumin Solution, from Bovine Serum(BSA), Fatty Acid Free | Wako Chemicals | 017-22231 | For resuspending cytokines. |
| ACCUMAX | STEMCELL Technologies | 07921 | |
| Anti-human-CD159a-PE | BD | 375104 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD3-APC antibodies | BD | 555355 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 2% FBS) |
| Anti-human-CD45-APC antibodies | BD | 555485 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 3% FBS) |
| Anti-human-CD56-PE antibodies | BD | 555516 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 4% FBS) |
| Anti-human-CD56-PEcy7 antibodies | BD | 335826 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD94-APC | BD | 559876 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Bemis Parafilm M Laboratory Wrapping Film | Thermo Scientific | 11772644 | |
| Cd244 Monoclonal Antibody (eBioC1.7 (C1.7)), Functional Grade, eBioscience | Thermo Scientific | 16-5838-85 | |
| Costar 6.5 mm Transwell, 0.4 µm Pore Polyester Membrane Inserts | STEMCELL Technologies | 3470 | |
| Dapi Solution, 1 mg/mL | BD | 564907 | It is resuspended with ddH2O so the concentration is 10 µM/mL. Add 1 µL of the aliquot in 300 µL of FACS buffer (PBS + 2% FBS) |
| DMEM | CPOS-Bioreagent core | 11965092 | |
| DMEM/F12 | Thermo Scientific | 11320033 | |
| FcX, human | Biolengend | 422302 | |
| Fetal Bovine Serum(FBS) qualified E.U.-approved South America | CPOS-Bioreagent core | 10270106 | |
| FlowJo v10.8.0 | BD | ||
| Gibco PBS (10x) pH 7.4 | CPOS-Bioreagent core | 70011044 | 10x concentrated PBS is manufactured as follows: without calcium, magnesium or phenol red |
| K562 cells | ATCC | CCL-243 | |
| Knockout Serum Replacement | Thermo Scientific | 10828-028 | |
| MyeloCult H5100 medium | STEMCELL Technologies | 5150 | |
| NK92mi cells | ATCC | CRL-2408 | Lot: 70045208. Once thawed, they are cultured in MyeloCult H5100 medium, and maintained the density between 2 x 105 to 1 x 106 cell/mL. |
| Nunc Cell-Culture Treated Multidishes 12 well plate | Thermo Scientific | 150628 | flat bottom |
| Nunc Cell-Culture Treated Multidishes 24 well plate | Thermo Scientific | 142475 | |
| Nunc EasYDish Dishes | Thermo Scientific | 150460 | |
| pLenti-GFP Lentiviral Control Vector | CELL BIOLABS | LTV-400 | It is packaged as the manufactuer suggested (https://www.cellbiolabs.com/sites/default/files/LTV-400-gfp- lentiviral-plasmid.pdf). 40 μL of 50x lentivirus is added with 1 μL 10 mg/mL polybrene per 1 mL of cell suspension. Complete medium change is performed 24 h after the addition of lentivirus. Cells are incubated undisputedly for 3 days at 37 °C, 5% CO2. |
| Polybrene | EMD Millipore | TR-1003-G | |
| Recombinant Human Flt-3 Ligand/FLT3L Protein | R&D Systems | 308-FK-005 | It is resuspend with PBS + 0.2% BSA. Thr working concentration is 10 ng/mL or 12 IU/mL. |
| Recombinant Human IL-15 Protein | R&D Systems | 247-ILB-005 | It is resuspended with PBS + 0.2% BSA. The working concentration is 10 ng/mL or 4500 IU/mL. |
| Recombinant Human IL-18/IL-1F4 Protein | R&D Systems | 9124-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL. The IU is not provided by the company. |
| Recombinant Human IL-2 Protein | R&D Systems | 202-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL or 455 IU/mL. |
| Recombinant Human IL-3 Protein, 50ug | PeproTech | 200-03 | It is resuspended with PBS + 0.2% BSA. The working concentration is 5 ng/mL or 14 IU/mL. |
| Recombinant Human IL-7 Protein | R&D Systems | 207-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 8800 IU/mL. |
| Recombinant Human SCF Protein | R&D Systems | 255-SC-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 26 IU/mL. |
| STEMdiff Hematopoietic Kit | STEMCELL Technologies | 5310 | Medium A: 45 mL STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement A ; Medium B: 75 STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement B |
| StemSpan lymphoid differentiation coating material | STEMCELL Technologies | 9950 | It is resuspended in PBS (100x) |
| StemSpan NK cell differentiation medium | STEMCELL Technologies | 9960 | It is prepared by adding 500 µL StemSpan NK Cell Differentiation Supplement (100x) into 49.5 mL of SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan lymphoid expansion medium | STEMCELL Technologies | 9960 | It is prepared by adding 5 mL StemSpan Lymphoid Progenitor Expansion Supplement (10x) into 45 mL of StemSpan SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan NK Cell Generation Kit | STEMCELL Technologies | 9960 | Thaw the medium and materials in room temperature and the medium is stored in 4 °C once thawed. |
| The BD LSRFortessa cell analyzer | BD | ||
| Trypsin-EDTA (0.05%), phenol red | Thermo Scientific | 25300054 | |
| Y-27632 dihydrochloride | Tocris | 1254 | working concentration: 10 µM |
Ссылки
- Gao, X., et al. Establishment of porcine and human expanded potential stem cells. Nature Cell Biology. 21 (6), 687-699 (2019).
- Mackinlay, K. M. L., et al. An in vitro stem cell model of human epiblast and yolk sac interaction. eLife. 10, 63930 (2021).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical-scale natural killer cells from human pluripotent stem cells. Methods in Molecular Biology. 2048, 107-119 (2019).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity. Cell Stem Cell. 23 (2), 181-192 (2018).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Dhar, P., Wu, J. D. NKG2D and its ligands in cancer. Current Opinion in Immunology. 51, 55-61 (2018).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Rungarunlert, S., Techakumphu, M., Pirity, M. K., Dinnyes, A. Embryoid body formation from embryonic and induced pluripotent stem cells: Benefits of bioreactors. World Journal of Stem Cells. 1, 11-21 (2009).
- Counting cells using a hemocytometer. abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. Journal of Immunological Methods. 294, 15-22 (2004).
- Tremblay-McLean, A., Coenraads, S., Kiani, Z., Dupuy, F. P., Bernard, N. F. Expression of ligands for activating natural killer cell receptors on cell lines commonly used to assess natural killer cell function. BMC Immunology. 20, 8 (2019).
- Inoue, T., Swain, A., Nakanishi, Y., Sugiyama, D. Multicolor analysis of cell surface marker of human leukemia cell lines using flow cytometry. Anticancer Research. 34 (8), 4539 (2014).
- Mhatre, S. Rapid flow cytometry based cytotoxicity assay for evaluation of NK cell function. Indian Journal of Experimental Biology. 52 (10), 983-988 (2014).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Motazedian, A., et al. Multipotent RAG1+ progenitors emerge directly from haemogenic endothelium in human pluripotent stem cell-derived haematopoietic organoids. Nature Cell Biology. 22 (1), 60-73 (2020).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Yan, Y., et al. Antileukemia activity of a natural killer cell line against human leukemias. Clinical Cancer Research. 4 (11), 2859-2868 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены