Method Article
인간 확장 잠재적 줄기 세포로부터 자연 살해 세포 생성
요약
본 프로토콜은 3D 및 2D 배양 조건 모두에서 인간 확장 전위 줄기 세포 (hEPSC)로부터 경미한 세포 독성을 갖는 CD3- / CD45 + CD56 + 세포를 구별하는 방법을 보여줍니다. 이를 통해 복잡한 미세 환경을 파괴하지 않고 일상적인 표현형 검증이 가능합니다.
초록
인간 만능 줄기 세포에서 자연 살해 (NK) 세포의 분화는 면역 요법을위한 임상 등급 세포 제품에 대한 연구 및 제조를 가능하게합니다. 여기에서는 무혈청 상용 배지와 사이토카인(인터루킨[IL]-3, IL-7, IL-15, 줄기세포 인자[SCF] 및 FMS 유사 티로신 키나제 3 리간드[Ftl3L])의 칵테일을 사용하여 인간 확장 전위 줄기세포(hEPSC)를 3차원(3D) 및 2차원(2D) 배양 기술을 통해 시험관 내에서 NK 세포 특성을 가진 세포로 분화시키는 2상 프로토콜입니다. 이 프로토콜에 따라 CD3-CD56+ 또는 CD45+CD56+ NK 세포가 지속적으로 생성됩니다. 종양 표적과 3 시간 동안 공동 배양 할 때, 분화 된 생성물은 IL-2 비 의존적 영구 세포주 인 NK92mi 세포와 비교하여 경미한 세포 독성을 나타낸다. 이 프로토콜은 3D 구조의 생성을 통해 분화 미세 환경의 복잡성을 보존하여 면역 세포와 틈새 사이의 공간적 관계에 대한 연구를 용이하게합니다. 한편, 2D 배양 시스템은 섬세한 분화 틈새를 손상시키지 않으면서 세포 분화의 일상적인 표현형 검증을 가능하게 합니다.
서문
인간 배아 줄기 세포 (hESC) 및 인간 유도 만능 줄기 세포 (hiPSC)와 같은 기존의 만능 줄기 세포와 비교할 때, 인간 확장 전위 줄기 세포 (hEPSC)는 배아 외 및 배아 계통으로 분화 할 수 있기 때문에 전능성 상태에 더 가깝습니다1. 예를 들어, hEPSC는 영양막세포 1 및 난황낭 유사 세포2로 분화 될 수 있습니다. hEPSC의 고유 한 효능을 달성하기 위해 개별 분열구는 EPSC 배지 (EPSCM)라고하는 계통 약속 신호 전달1을 억제하는 여러 개의 소분자를 포함하는 배지에서 배양됩니다. EPSCM에서 hESC 및 hiPSC를 배양하면 이전에 제한된 효능을 확장하여 영양막 세포로 분화합니다1.
만능 줄기 세포는 새로운 유전자 변형을 실험하기위한 귀중한 연구 도구입니다. 만능 줄기 세포의 자가 재생 및 분화 능력으로 인해 만능 줄기 세포의 형질전환된 클론 하나는 동일한 유전자좌에서 동일한 유전자 변형을 갖는 분화된 세포 산물을 생산할 수 있습니다. Zhu와 Kaufman은 기존의 만능 줄기 세포 (hESC 및 hiPSC)에서 NK 세포 분화를위한 표준을 수립했습니다 3. 첫째, 그들은 만능 줄기 세포에서 유래 한 배아체에서 조혈 줄기 세포 (HSC)를 유도했습니다. 줄기 세포 인자 (SCF), FMS 유사 티로신 키나아제 3 리간드 (Ftl3L), 인터루킨 (IL) -7, IL-15 및 IL-3의 초기 보충제를 추가하면 HSC가 자연 살해 (NK) 세포로 발전했습니다. 그 후, 그들은 IL-2의 지속적인 보충으로 막 결합 IL-21을 나타내는 인공 항원 제시 세포 (aAPCs)로 NK 세포를 확장했습니다. 연구자들은 키메라 항원 수용체(CAR-iNK)가 부여된 iPSC 유래 자연 살해 세포를 생성하기 위해 이 접근법을 면역 요법에 적용했습니다.4.
인간 NK 세포는 말초 혈액에서 CD3-CD56+ 백혈구로 정의됩니다. 그들은 바이러스에 감염된 세포와 종양 세포에 대한 효과제입니다5. NK 세포의 일부 억제 수용체는 정상 세포에서 유비쿼터스로 발현되는 분자를 인식합니다. 예를 들어, NK 세포 상에서 발현된 NKG2A/CD94 이종이량체는 MHC 클래스 I 분자5를 인식한다. 한편, NK 세포의 활성화 수용체는 NKG2D가 형질전환 유도 MHC 클래스 I 폴리펩티드 관련 서열 A(MICA/MICB)6를 인식하는 것과 같이 스트레스 유발 리간드를 인식합니다. 일부 형질전환 세포는 면역 감시를 피하기 위해 "자가 리간드"를 하향조절하고 비정상적인 리간드를 상향 조절하여 NK 세포가 용균 기계를 실행하도록 합니다. NK 세포의 내재적 항 종양 능력은이 면역 세포 유형에 주목을 불러 일으켰습니다.
배아 및 배아 외 혈통을 동시에 발생시키는 능력은 hEPSC를 기존의 다 능성 줄기 세포보다 배아 발달 틈새의 더 충실한 요약으로 만들 수 있습니다. 경험상 hiPSC보다 hEPSC의 효능을 유지하는 것이 더 쉽습니다. 본 연구에서는 hEPSC를 편향시켜 조혈 계통으로 발전하고 나중에 전구 세포를 시험관 내에서 자연 살해 (NK) 세포로 분화시키는 프로토콜이 개발되었습니다 (그림 1). 프로토콜에서는 혈청 불일치를 피하기 위해 상업용 매체를 사용하고 사이토카인을 단계적으로 추가하여 림프 계통으로 편향 분화합니다. 이 프로토콜에는 인간 NK 세포와 표현형 및 기능적으로 유사한 CD3-CD56+/CD45+CD56+ 세포를 유도하면서 복잡한 3D 미세 환경을 보존하는 두 가지 시스템이 있습니다.
이 프로토콜은 면역 세포와 분화 틈새의 상호 작용을 연구하는 데 유용할 수 있으며 면역 치료 용도로 세포 제품을 정제할 가능성이 있을 수 있습니다.
프로토콜
본 연구는 시험관내 실험에 관여; 따라서 윤리 승인은 적용되지 않습니다. 이 연구에 사용 된 확립 된 세포주는 상업적 출처에서 얻은 것입니다 (재료 표 참조).
1. hEPSC로부터 3D 오가노이드 구조 생성
- hEPSC를 SNL 영양세포1에서 EPSC 배지(12웰 플레이트) 1mL로 배양하여 유지합니다.
참고: 돔 모양의 콜로니는 확장된 효능이 남아 있는 경우 관찰됩니다(그림 2A). - hEPSC의 사전 분화를 수행합니다.
- hEPSC 배지를 제거하고 1mL의 DFK 배지(DMEM/F12 + 10% 혈청 대체 배지, 재료 표 참조)를 추가합니다. 37°C 및 5%CO2에서 2-3일 동안 배양한다. 3일 동안 배양을 계속하는 경우 2일째에 배지 변경을 수행한다.
참고: 현미경으로 보면 돔 모양의 콜로니가 평평해집니다(그림 2B).
- hEPSC 배지를 제거하고 1mL의 DFK 배지(DMEM/F12 + 10% 혈청 대체 배지, 재료 표 참조)를 추가합니다. 37°C 및 5%CO2에서 2-3일 동안 배양한다. 3일 동안 배양을 계속하는 경우 2일째에 배지 변경을 수행한다.
- 교수형 드롭 기술 7,8에 의한 배아체의 형성을 확인하십시오.
- DFK 배지를 제거하고 1mL의 PBS로 1회 세척합니다. 500 μL의 0.05% 트립신을 첨가하고, 플레이트를 37°C 및 5%CO2 에서 형태에 기초하여 3-7분 동안 인큐베이션한다.
알림: hEPSC는 플레이트가 약간 방해받을 때 피더 셀에서 분리될 수 있어야 합니다. - 트립신을 제거하고 2mL의 DFK 배지를 추가하여 세포를 수확합니다. 실온에서 3분 동안 300 x g 에서 셀을 회전시킵니다.
- 피펫으로 상청액을 제거하십시오. 1mL의 DFK 배지와 1μL의 Y27632( 재료 표 참조)를 추가하여 플릭으로 세포를 재현탁시킵니다.
- 혈구계9로 세포 현탁액 내의 세포 수를 세십시오. 세포 현탁액을 DFK 배지 및 Y27632(1,000x)로 희석하여 4,000개의 세포/25μL의 DFK 배지가 되도록 합니다.
- 10cm 페트리 접시의 캡을 캡당 25μL의 세포 현탁액 약 30-40방울로 채웁니다. 물방울의 증발을 방지하기 위해 PBS를 아래쪽 접시에 붓습니다. 뚜껑을 부드럽게 뒤집고 접시를 덮으십시오. 접시를 3일 동안 37°C 및 5%CO2 에서 인큐베이션한다.
- DFK 배지를 제거하고 1mL의 PBS로 1회 세척합니다. 500 μL의 0.05% 트립신을 첨가하고, 플레이트를 37°C 및 5%CO2 에서 형태에 기초하여 3-7분 동안 인큐베이션한다.
2. 배아체의 중배엽 및 혈구-내피 패턴(EB)
- 물방울 내에서 EB를 수집합니다.
- 1mL 피펫과 일부 PBS를 사용하여 액적의 모든 EB를 15mL 튜브로 수집합니다. 액적에 약간의 PBS를 펌핑한 다음 피펫으로 EB를 포함한 배지를 흡인합니다.
알림: 더 노란색인 물방울은 분홍색 물방울보다 더 성공적인 형성과 성장을 나타냅니다. - 수집된 EB를 실온에서 1분 동안 100 x g 로 스핀다운하고 피펫을 사용하여 상청액을 제거합니다. 1mL의 배지 A(시판되는 세포 분화 키트, 재료 표 참조)를 추가하여 수집된 EB를 비부착성 24웰 플레이트로 옮깁니다. 이 날짜를 Day 0으로 지정합니다(그림 1).
알림: 일반적으로 하나의 10cm 접시에서 수집 된 모든 EB는 그룹화되어 24 웰 플레이트의 한 웰로 옮겨집니다.
- 1mL 피펫과 일부 PBS를 사용하여 액적의 모든 EB를 15mL 튜브로 수집합니다. 액적에 약간의 PBS를 펌핑한 다음 피펫으로 EB를 포함한 배지를 흡인합니다.
- EB의 중배엽 패터닝을 수행합니다.
- 플레이트를 37°C에서 5%CO2로 3일 동안 인큐베이션한다. 2일째에 EB의 피펫팅을 피하면서 500μL의 배지 A(키트에서 단계 2.1.2)를 제거합니다. 그런 다음 500μL의 새로운 배지 A를 추가합니다.
- 배아체의 혈내피 사양을 수행한다.
- 웰에서 700μL의 배지 A를 제거하고 700μL의 배지 B를 추가합니다(키트에서 단계 2.1.2). 7 일 동안 문화. 5일, 7일, 9일에 배지 B의 절반 변경을 수행합니다.
3. NK세포 분화
- 패턴화된 EB를 공기-액체 인터페이스로 전송합니다.
- EB가 바닥에 응집되도록 플레이트를 약간 기울입니다. 1mL 피펫을 사용하여 EB를 피하면서 가능한 한 많은 배지 B를 제거합니다.
- 나머지 배지를 흡인하여 피펫으로 EB를 집어 올립니다. 24 웰 플레이트의 트랜스 웰로 옮깁니다 ( 재료 표 참조).
참고: 최적의 밀도를 위해 트랜스웰당 2-3개의 EB로 수를 제한합니다.
- 림프 전구 확장을 수행하십시오.
- 500 μL의 NK-1 배지 (시판되는 림프 확장 배지 + 14 IU / mL IL-3, 4,500 IU / mL IL-15, 8,800 IU / mL IL-7, 26 IU / mL SCF 및 12 IU / mL ftl3L, 재료 표 참조)를 트랜스 웰의 하단 구획에 추가합니다. 14일 동안 배양하고, 격일로 배지 변경을 수행한다.
- 세포를 수확하고 7-10일에 코팅된 플레이트로 옮깁니다.
- 플레이트를 코팅하려면 코팅 물질(시판되는 림프 분화 코팅 물질, 100x, 재료 표 참조)을 PBS로 희석합니다. 12-웰 플레이트의 각 웰에 희석된 코팅 용액 1mL를 추가하고, 플레이트를 4°C에서 밤새 배양한다. 포장 필름으로 판의 입구를 덮으십시오.
- 200μL의 PBS를 트랜스웰에 넣고 오가노이드에서 방출된 세포를 수확하기 위해 약 5-6회 위아래로 천천히 피펫팅합니다. 오가노이드를 피펫팅하지 마십시오.
참고: 둥근 세포는 유기체에서 지속적으로 방출됩니다(그림 2D). - 수확된 세포 현탁액을 2mL 튜브로 옮기고 실온에서 5분 동안 500 x g 에서 세포를 스핀다운합니다. 피펫으로 상청액을 제거하고 1mL의 NK-1 배지(단계 3.2.1)를 추가하여 피펫팅으로 세포를 재현탁합니다.
- 웰로부터 모든 코팅 용액을 제거하고, 12-웰 플레이트의 각 웰을 1 mL의 PBS로 2회 세척한다.
- 수확한 세포를 1:2 비율로 나눕니다. 세포 현탁액을 코팅된 12-웰 플레이트 상으로 옮긴다(단계 3.3.1). 각 웰에 1.5mL의 배지가 있도록 NK-1 배지 1mL를 추가합니다.
- 배지 변경을 수행하려면 세포가 바닥으로 가라앉을 수 있도록 세포를 1-2분 동안 그대로 두십시오. 750μL의 배지를 조심스럽게 흡인합니다. 수집된 상청액을 실온에서 5분 동안 500 x g 로 스핀다운합니다.
- 대부분의 상청액을 버리고 750 μL의 NK-1 배지에 5-6회 피펫팅하여 재현탁합니다. 새로운 배지에 재현탁된 세포를 원래 웰에 추가합니다.
노트: 이 병렬 시스템을 그림 1에서 2D 시스템이라고 합니다. 세포가 유래한 오가노이드 웰의 배지 변화 일정을 따르십시오.
- 아래 단계에 따라 NK 세포 성숙을 수행합니다.
- 3D 시스템의 기존 배지를 제거하고 500μL의 NK-2(시판되는 NK 세포 분화 배지 + 4,500IU/mL IL-15, 8,800IU/mL IL-7, 26IU/mL SCF 및 12IU/mL ftl3L, 재료 표 참조)를 트랜스웰의 하단 구획에 추가합니다. 37°C 및 5%CO2 에서 14일 동안 인큐베이션한다.
알림: 유체가 트랜스웰의 바닥에 닿아 있는지 확인하십시오. - 2D 시스템의 셀에 대해 전체 배지 변경을 수행합니다. 한 웰에서 1.5mL의 세포를 모두 수집하고 실온에서 5분 동안 500 x g 로 원심분리합니다. 피펫으로 대부분의 상청액을 제거하고 1.5mL의 NK-2 배지로 펠릿을 재현탁합니다(단계 3.4.1).
- 격일로 중간 변경을 수행하십시오. 3D 시스템의 플레이트를 약간 기울이고 트랜스웰 외부의 모든 오래된 매체를 제거합니다. 트랜스웰 외부에 500μL의 NK-2 배지를 추가합니다.
- 2D 시스템용 12웰 플레이트의 한 웰에서 절반 배지 변경을 수행하려면 셀을 1-2분 동안 그대로 두어 셀이 바닥으로 가라앉도록 합니다. 750μL의 배지를 조심스럽게 흡인합니다.
- 세포 손실을 방지하기 위해 수집된 상청액을 실온에서 5분 동안 500 x g 으로 스핀다운합니다. 대부분의 상청액을 버리고 5-6회 피펫팅하여 750 μL의 NK-2 배지에 재현탁합니다. 새로운 배지에 재현탁된 세포를 원래 웰에 추가합니다.
- 3D 시스템의 기존 배지를 제거하고 500μL의 NK-2(시판되는 NK 세포 분화 배지 + 4,500IU/mL IL-15, 8,800IU/mL IL-7, 26IU/mL SCF 및 12IU/mL ftl3L, 재료 표 참조)를 트랜스웰의 하단 구획에 추가합니다. 37°C 및 5%CO2 에서 14일 동안 인큐베이션한다.
4. 성숙한 세포 수확
- 2D 시스템에서 배양된 세포를 수확합니다.
- 38-45일 동안 위아래로 피펫팅하여 세포를 수확합니다. 1mL의 PBS로 두 번 세척하십시오. 세포 현탁액을 실온에서 5분 동안 500 x g 로 원심분리합니다.
- 피펫으로 상청액을 제거하고 선택한 완충액에 재현탁합니다(즉, 유세포분석을 위한 PBS + 2% FBS, 재료 표 참조).
- 유기체에 내장 된 세포를 수확하십시오.
- 38-45일 동안 트랜스웰 외부에서 배지를 15mL 튜브로 수집합니다. 트랜스웰 내부에 200μL의 PBS를 추가하고 위아래로 5-6회 피펫팅하여 오가노이드를 두 번 세척합니다. 현탁액을 15mL 튜브로 옮깁니다.
- 500μL의 PBS를 12웰 플레이트의 웰에 추가합니다. 오가노이드를 트랜스웰에서 집게로 12웰 플레이트의 웰로 옮깁니다.
- 가위와 집게를 사용하여 유기체를 20 번 자릅니다. 집게와 가위의 나머지 세포를 PBS로 우물에 플러시하십시오. 가능한 한 많은 PBS를 수집하고 오가노이드 구조를 흡인하지 않고 4.2.1단계에서 사용된 15mL 튜브로 옮깁니다.
- 500μL의 해리 시약( 재료 표 참조)을 트랜스웰에 추가하여 오가노이드를 효소적으로 분해합니다. 상업용 세포 분리 용액 ( 재료 표 참조)과 함께 37 ° C 및 5 %CO2에서 7-10 분 동안 배양합니다. 1mL의 PBS와 2% FBS를 첨가하여 반응을 켄칭하고, 다른 15mL 튜브에 용액을 모은다. 2% FBS가 있는 PBS 1mL로 웰을 두 번 세척합니다.
참고: 형태에 따라 배양 기간을 결정하십시오. 단일 세포가 3D 구조의 막에서 방출되기 시작하는 지점을 달성하십시오. - 2% FBS와 함께 PBS 1mL를 추가하고 위아래로 8-10회 피펫팅합니다. 유기체 구조를 포함한 모든 용액을 수집하십시오. 세포 여과기를 사용하여 4.2.3단계에서 사용한 15mL 튜브로 옮깁니다.
- 실온에서 5분 동안 두 튜브를 500 x g 로 원심분리합니다. 피펫으로 상청액을 버립니다. 선택한 버퍼로 세포 펠릿을 재현탁합니다(단계 4.1.2).
결과
본원 의 시험관내 분화(IVD) 제품은 인간 NK 세포와 유사한 표면 마커 및 항종양 능력을 가질 것이라는 가설이 세워졌다.
인간 NK 세포의 정의 마커에 액세스하여 3D 배양 시스템의 분화 산물이 표현형으로 인간 NK 세포와 유사한 세포를 생성하는지 여부를 테스트했습니다. 상이한 시점 (n = 2)에서 유도 된 2 개의 배치로부터 3D 배양 시스템으로부터 해리 된 세포의 약 15 %는 CD3-CD56 +였다 (도 3A). CD3는 CD3의 부재 및 시험관내 T 세포 유도의 어려움으로 인해 시험 패널에서 CD45 (범 백혈구 마커)로 대체되었다. 3D 구조에서 해리 된 세포의 약 16 %는 CD45 + CD56 + (그림 3B, n = 1)였으며, 이는 이전 시험에서 볼 수있는 CD3-CD56 + 세포의 비율과 일치합니다. 2D 배양 시스템에서 수확 된 세포에서 CD3-CD56 + 세포의 비율은 더 성공적인 유도 (그림 3C, n = 3)에서 덜 성공적인 유도 (그림 3D, n = 2)에 이르기까지 30 %에서 6 % 사이였습니다. 2D 배양 시스템에서 수확한 세포의 기능과 표현형을 검증했습니다. 2D 시스템에서 18일차 배양 동안, 세포의 약 12%가 50ng/mL IL-18, 455IU/mL IL-2 및 20ng/mL 항-CD244 항체 자극의 2시간 후에 이소성 CD56 및 CD107a를 모두 발현했습니다(그림 4C, n=1). 수확된 세포의 약 28%는 CD94+CD159a+였다(도 4B, n=1). 과립막의 단백질 라이닝인 CD107a의 이소성 발현은 탈과립10을 나타내는 반면, CD94/NKG2A(CD159a) 이종이량체는 NK 세포를 정의하는 또 다른 마커입니다. 이것은 IVD 제품의 표현형 및 기능 검증의 예를 제공합니다.
IVD 제품의 기능성은 인간 적혈구 세포-K562 세포에 대한 세포 독성에 의해 시험되었습니다. K562 세포에 대한 포괄적인 리간드 프로파일링은 하향조절된 주요 조직화학 복합체 I(MHC-I) 및 비교적 강력한 NKG2D 리간드 발현(예: ULBP-1, ULBP-2/5/6 및 ULBP-3)11; 따라서, K562 세포는 NK 세포12의 용균 활성에 민감하다. IVD 종점 제품과 NK92mi 세포 모두 하룻밤 사이에 50ng/mL IL-18, 455IU/mL IL-2 및 20ng/mL 항-CD244 항체로 프라이밍되었습니다. GFP+ K562 세포는 동일한 부피의 H5100 배지에서 50ng/mL(IU 미제공) IL-18, 455IU/mL IL-2 및 20ng/mL 항-CD244 항체의 존재 하에 상이한 이펙터 대 표적 비율(E:T)로 IVD 또는 NK92mi 세포에서 수확한 세포와 3시간 동안 공동 배양되었습니다. NK 세포 사멸 활성의 판독은 GFP+ 서브세트에서 죽은 세포 마커의 발현이었습니다. K562 세포를 GFP를 구성적으로 발현하기 위해 시판되는 대조 벡터( 재료 표 참조)로 형질도입하였고, 형질도입 효율은 약 80%였다(보충 그림 1A). 추가된 GFP 신호의 백분율은 추가된 GFP+ K562 세포의 수에 비례하여 형질도입된 K562 세포에서 특정 GFP 발현을 시사합니다(보충 그림 1B).
도 5에 나타낸 죽어가는 표적 세포의 백분율은 하기 식13으로 계산하였다:
죽어가는 세포의 백분율 = (FITC + DAPI + 공동 배양의 % [예를 들어, 도 5A]) - (FITC + DAPI + 형질도입된 K562 세포의 %)
평가된 세 가지 E:T 비율(0.1:1, 0.33:1, 1:1) 중 죽어가는 GFP+ 세포의 비율은 IVD 제품(그림 5B, hEPSC-NK) 또는 NK92mi 세포(그림 5B, NK92mi)와 함께 배양했을 때 E:T 비율과 양의 상관관계가 있었으며, 이는 종양 표적의 특이적 사멸을 나타냅니다. 그러나 IVD 제품의 세포 독성은 테스트 기간 내에 비교적 완만했습니다 (그림 5C).
마지막으로, 림프성 전구 세포 생성을 3D 및 2D 배양물 간에 비교하였다. 3D 배양 조건은 2D 배양 조건(36,000개 세포)보다 더 많은 전구 세포(55,000개 세포)를 생성하는 것으로 나타났습니다(보충 그림 2). 이는 3D 배양에서 조직 구조 및 세포 구성 요소의 맥락이 림프 전구 세포의 생성을 지원했음을 시사합니다.
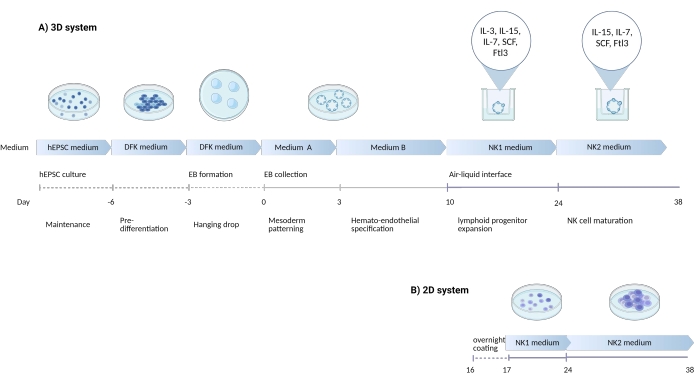
그림 1: hEPSC로부터 NK 세포를 분화시키기 위한 분화 전략을 보여주는 개략도 . (A) 여기에서는 3D 배양 시스템의 타임라인을 보여주며, 배양 조건과 각 단계의 간략한 키워드를 자세히 설명합니다. 3D 시스템의 공기-액체 인터페이스는 NK 세포 유도 중에 유지됩니다. (b) 여기서, 2D 배양 시스템의 타임라인이 도시된다. 3D 시스템의 구조물에서 7-10일째에 수확한 방출된 세포는 공기-액체 계면이 없는 코팅된 플레이트에 시딩됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
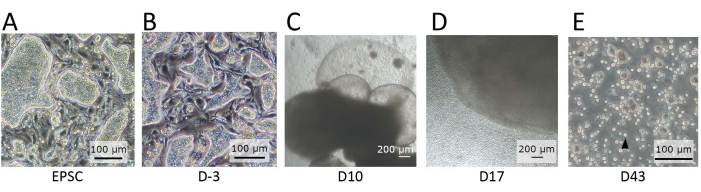
그림 2: 뚜렷한 분화 단계에서 관찰된 세포의 형태. (A) EPSCM에서 유지 될 때 hEPSC의 형태. hEPSC는 돔형 콜로니를 형성합니다. (B) 사전 분화 후 hEPSC의 형태. 돔형 식민지는 평평합니다. hEPSC는 수확되어 행잉 드롭 기술로 EB를 형성합니다. EB는 배지 A에서 수집 및 배양 된 다음 배지 B에서 배양됩니다. (C) 10 일째에 EB의 형태. 이 기간 동안 EB는 팽창하고 팽창하기 시작하여 막 구조를 형성합니다. (D) 세포 방출 EB의 형태. 트랜스웰에 씨를 뿌린 후 EB는 자라서 둥근 세포를 주변으로 지속적으로 방출합니다. 방출된 세포 중 일부는 수집되어 림프 분화 코팅 물질로 코팅된 12-웰 플레이트에서 배양됩니다. 세포 집단은 형태학적으로 이질적이며 함께 응집되는 경향이 있습니다. (E) IVD의 종말점에서 관찰된 세포의 형태. 작은 원형 현탁 세포 (검은 색 화살표)가 관찰됩니다. 스케일 바 : (A, B, E) = 100 μm; (C, D) = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
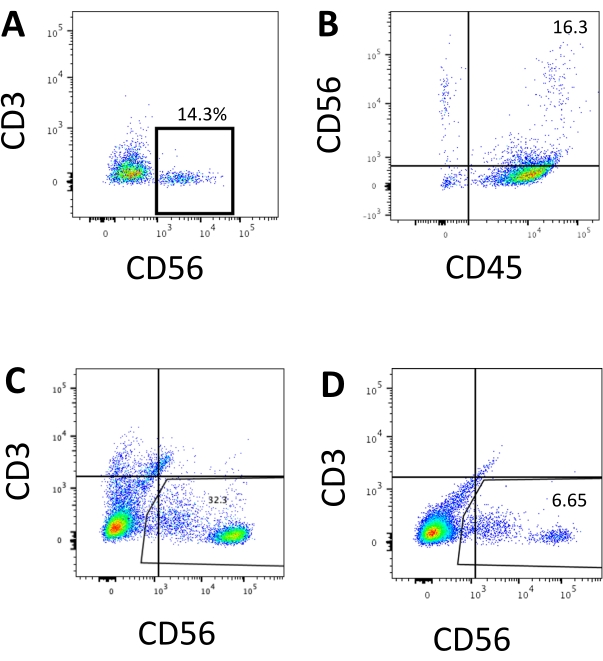
그림 3: 엔드포인트에서 hEPSC 파생 제품의 대표적인 FACS 플롯. 세포를 형광 투시경 접합 항체와 함께 얼음 위에서 30분 동안 인큐베이션합니다. 샘플은 FACS 샘플 주입 포트에 로드되기 전에 DAPI로 염색됩니다. 염색되지 않은 세포는 음성 게이팅을 설정하는 데 사용됩니다. (A) 2개의 배치로부터 3D 배양 시스템으로부터 해리된 세포에서의 CD3 및 CD56 발현에 대한 대표적인 FACS 플롯(n=2). (B) 3D 배양물로부터 해리된 세포에서의 CD45 및 CD56 발현에 대한 대표적인 FACS 플롯 (n=1). (c) 성공적인 유도로부터 코팅된 플레이트로부터 수확된 세포에서의 CD3 및 CD56 발현에 대한 대표적인 FACS 플롯 (n=3). (D) 유도가 차선책일 때 코팅된 플레이트로부터의 CD3 및 CD56 발현에 대한 대표적인 FACS 플롯(n=2). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
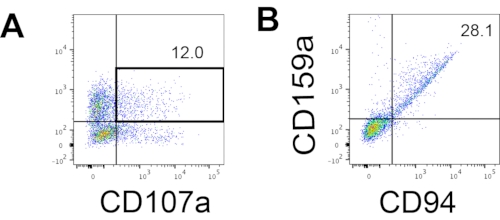
그림 4: 18일차 배양 중 hEPSC 유래 제품에 대한 대표적인 FACS 플롯(n=1). (A) IL2, IL-18 및 항-CD244 항체로 2시간 자극한 후 CD56 및 CD107a 발현에 대한 FACS 플롯. (B) CD159a 및 CD94 발현에 대한 FACS 플롯. 샘플은 FACS 샘플 주입 포트에 로드되기 전에 DAPI로 염색됩니다. 염색되지 않은 세포는 음성 게이팅을 설정하는 데 사용됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
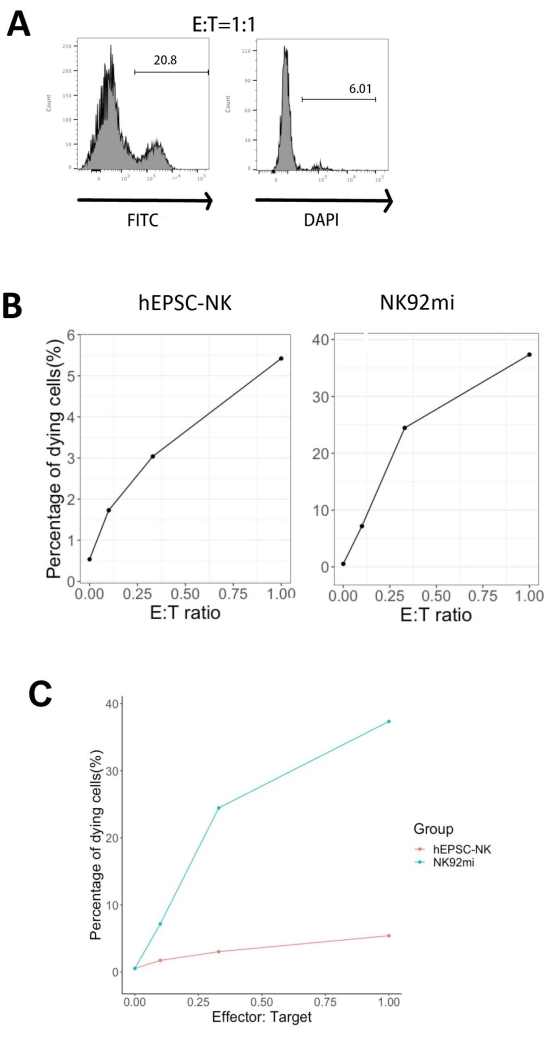
그림 5: IVD 종말점 제품 또는 NK92mi 세포(n = 1)와 GFP+ K562 세포의 공동 배양에서 얻은 다양한 E:T 비율에 대한 죽어가는 세포의 백분율 플롯. FITC+ DAPI+ 세포의 발현은 세포 분석기로 평가하고, 데이터 분석은 호환 가능한 소프트웨어로 수행하였다. (A) E:T 비율이 1인 IVD 제품 및 K562 세포의 공동 배양에서 FITC+DAPI+ 서브세트의 게이팅을 보여주는 대표적인 FACS 플롯. (B) GFP+ IVD 제품(왼쪽) 또는 NK92mi 세포(오른쪽)를 사용한 3시간 동안의 공동 배양 실험의 개별 플롯. 둘 다 죽어가는 세포의 비율과 E:T 비율 사이의 양의 비례 관계를 반영합니다. (C) IVD 제품과 NK92mi 세포의 사멸 곡선을 동일한 척도로 보여주는 플롯. IVD 제품은 NK92mi 세포에 비해 약한 세포 독성을 나타냈다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: hEPSC에서 NK 세포의 기능 분석. (a) 형질도입된 K562 세포의 FACS 히스토그램. FITC+ K562 세포는 GFP를 발현했습니다. (B) GFP+ K562 세포와 3가지 E:T 비율(n = 1)의 종말점 IVD 제품의 공동 배양에서 얻은 FACS 히스토그램. 공동 배양에서 FITC+ 세포의 백분율은 추가된 형질도입된 K562 세포의 수와 일치했습니다. 게이팅은 형질도입되지 않은 K562 세포로 확립되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 2D 대 3D 배양에서 림프 전구 세포 분화. 본 오가노이드-기반 프로토콜은 인간 확장 잠재적 줄기 세포로부터 림프성 전구세포를 유도하기 위해 사용되었다. 두 가지 조건이 설정되었습니다 : (1) 림프 전구 세포를 유기체 내 배양 (3D)에 보관하고, (2) 림프 전구 세포를 분리하여 배양 접시에 보관했습니다 (2D). 2주간의 추가 배양 후, 세포 수를 측정하여 2D 대 3D 배양을 비교하였다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
hEPSC에서 CD45+CD56+ 세포의 성공적인 분화를 보장하기 위한 몇 가지 중요한 단계가 있습니다. 사전 분화 (단계 1.2)는 EPSC 배지가 계통 약속1의 억제제를 포함하기 때문에 중요합니다. 사전 분화 후, hEPSC의 돔 모양의 콜로니는 평평 해집니다 (그림 2B). hEPSC로부터 EB를 형성하는 동안 Rho- 키나제 억제제 (ROCKi) 인 Y27632 (단계 1.3)의 첨가는 해리 후 hEPSC의 생존에 필수적입니다. 또 다른 중요한 고려 사항은 각 트랜스웰에 심어진 EB의 수입니다. 소규모 시스템이기 때문에 트랜스웰당 2-3개의 EB가 미디어의 과소비를 방지하는 최적의 밀도입니다. 공기-액체 계면은 3D 시스템에 대한 NK 세포 분화의 전체 과정 동안 유지되며, 이는 기질 세포의 극성을 유지하고 AGM 유래 조혈 전구체14,15의 확장을 지원하는 것으로 여겨집니다.
앞서 언급했듯이 트랜스웰의 EB 밀도는 성공적인 차별화를 위한 결정 요소입니다. 이것의 핵심 신호는 트랜스 웰에 EB를 이식 한 지 1 일 후에 배지의 색입니다. 색상이 빠르게 노란색으로 변하면 오염 또는 과밀을 나타냅니다. 이 문제를 해결하려면 1mL 피펫을 사용하여 추가 EB를 수동으로 픽업하여 다른 트랜스웰로 옮겨야 합니다.
이 프로토콜의 주요 한계는 IVD 제품에서 CD3-/CD45+ CD56+ 세포의 순도이며, 이는 순수한 NK92mi 세포에 비해 열등한 세포독성에 부분적으로 책임이 있는 것으로 여겨집니다. 3D 배양 시스템은 3개의 배아 배아 층과 유사한 EB의 생성을 통해 조혈 전구 세포를 유도하는 데 사용되었습니다. 이 전략은 골수 미세 환경에서 혈액 세포의 발달을 모방하여 분화를 지원하기 위해 기질 세포의 필요성을 제거합니다3. 조혈 전구 세포를 정제하기 위한 분류 단계가 없으면 IVD 제품의 순도가 감소할 것으로 예상됩니다. 종말점 제품의 순도를 높이면서 복잡한 차별화 틈새 시장을 유지하는 전략은 분류된 CD3-CD56+ IVD 제품에 대한 확장 방법을 개발하는 것입니다. 예를 들어, 분류된 CD3-CD56+ IVD 제품은 막 결합 IL-21로 조작된 방사선 조사된 K562 세포와 같은 인공 항원 제시 세포(aAPC)에서 배양할 수 있습니다. 배양 물에서 IL-2를 공급하면이 방법은 NK 세포 수3을 1,000 배 증가시킬 수 있습니다.
또 다른 한계는 양성 참조로서 선의의 인간 NK 세포에 대한 제한된 접근이다. NK92mi는 공동 배양 분석에 사용되는 긍정적 인 기준이지만 충분히 정확하지는 않습니다. NK92mi 세포는 활성화 된 NK 세포 표현형16을 발현하는 영구 세포주 인 NK92 세포에서 조작되어 배양 요구 사항을 충족하기 위해 IL-2를 자율적으로 생성합니다. NK92 세포는 인간 1차 NK 세포(17)보다 시험관내에서 K562 세포에 대해 우수한 사멸 활성을 나타낸다. 말초 혈액 NK 세포의 세포 독성을 병행하여 IVD 제품의 종양 살상 능력을 보다 공정하게 비교할 수 있지만 불행히도 혈액 은행에 대한 접근이 부족합니다.
이 두 시스템 배양 프로토콜은 hEPSC에서 CD3-/CD45+CD56+ 세포를 생성하는 것을 목표로 합니다. FACS를 사용한 표면 마커 및 세포 독성 평가는 분화 틈새를 방해하지 않고 2D 시스템의 세포에서 일상적으로 수행 할 수 있습니다. CD3-CD56+ 세포의 백분율 차이에도 불구하고, 3D 및 2D 시스템은 CD56 발현에서 유사한 변이를 갖는 CD3-CD56+ 세포를 유도할 수 있으며(그림 3), 2D 시스템은 3D 배양 조건으로부터 림프성 전구세포의 존재를 반영한다.
3D 배양 시스템 활용의 중요성은 공간 전사체학 또는 이미징 질량분석법과 같은 고해상도 프로파일링 분석을 사용하여 복잡한 분화 틈새 내에서 공간적 관계 및 세포-세포 상호 작용을 연구할 수 있다는 것입니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
Handi Cao 박사, Sanxing GAO, David Xiang, Yiming Chao, Ritika Jogani, Owen Chan, Stephanie Cheung 및 Celine Chan의 기술 지원과 유용한 토론에 감사드립니다. 이 작업은 플랫폼 기술 기금의 지원을 받았습니다. 그림 1 은 BioRender.com 로 작성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 30 w/v% Albumin Solution, from Bovine Serum(BSA), Fatty Acid Free | Wako Chemicals | 017-22231 | For resuspending cytokines. |
| ACCUMAX | STEMCELL Technologies | 07921 | |
| Anti-human-CD159a-PE | BD | 375104 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD3-APC antibodies | BD | 555355 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 2% FBS) |
| Anti-human-CD45-APC antibodies | BD | 555485 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 3% FBS) |
| Anti-human-CD56-PE antibodies | BD | 555516 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 4% FBS) |
| Anti-human-CD56-PEcy7 antibodies | BD | 335826 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD94-APC | BD | 559876 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Bemis Parafilm M Laboratory Wrapping Film | Thermo Scientific | 11772644 | |
| Cd244 Monoclonal Antibody (eBioC1.7 (C1.7)), Functional Grade, eBioscience | Thermo Scientific | 16-5838-85 | |
| Costar 6.5 mm Transwell, 0.4 µm Pore Polyester Membrane Inserts | STEMCELL Technologies | 3470 | |
| Dapi Solution, 1 mg/mL | BD | 564907 | It is resuspended with ddH2O so the concentration is 10 µM/mL. Add 1 µL of the aliquot in 300 µL of FACS buffer (PBS + 2% FBS) |
| DMEM | CPOS-Bioreagent core | 11965092 | |
| DMEM/F12 | Thermo Scientific | 11320033 | |
| FcX, human | Biolengend | 422302 | |
| Fetal Bovine Serum(FBS) qualified E.U.-approved South America | CPOS-Bioreagent core | 10270106 | |
| FlowJo v10.8.0 | BD | ||
| Gibco PBS (10x) pH 7.4 | CPOS-Bioreagent core | 70011044 | 10x concentrated PBS is manufactured as follows: without calcium, magnesium or phenol red |
| K562 cells | ATCC | CCL-243 | |
| Knockout Serum Replacement | Thermo Scientific | 10828-028 | |
| MyeloCult H5100 medium | STEMCELL Technologies | 5150 | |
| NK92mi cells | ATCC | CRL-2408 | Lot: 70045208. Once thawed, they are cultured in MyeloCult H5100 medium, and maintained the density between 2 x 105 to 1 x 106 cell/mL. |
| Nunc Cell-Culture Treated Multidishes 12 well plate | Thermo Scientific | 150628 | flat bottom |
| Nunc Cell-Culture Treated Multidishes 24 well plate | Thermo Scientific | 142475 | |
| Nunc EasYDish Dishes | Thermo Scientific | 150460 | |
| pLenti-GFP Lentiviral Control Vector | CELL BIOLABS | LTV-400 | It is packaged as the manufactuer suggested (https://www.cellbiolabs.com/sites/default/files/LTV-400-gfp- lentiviral-plasmid.pdf). 40 μL of 50x lentivirus is added with 1 μL 10 mg/mL polybrene per 1 mL of cell suspension. Complete medium change is performed 24 h after the addition of lentivirus. Cells are incubated undisputedly for 3 days at 37 °C, 5% CO2. |
| Polybrene | EMD Millipore | TR-1003-G | |
| Recombinant Human Flt-3 Ligand/FLT3L Protein | R&D Systems | 308-FK-005 | It is resuspend with PBS + 0.2% BSA. Thr working concentration is 10 ng/mL or 12 IU/mL. |
| Recombinant Human IL-15 Protein | R&D Systems | 247-ILB-005 | It is resuspended with PBS + 0.2% BSA. The working concentration is 10 ng/mL or 4500 IU/mL. |
| Recombinant Human IL-18/IL-1F4 Protein | R&D Systems | 9124-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL. The IU is not provided by the company. |
| Recombinant Human IL-2 Protein | R&D Systems | 202-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL or 455 IU/mL. |
| Recombinant Human IL-3 Protein, 50ug | PeproTech | 200-03 | It is resuspended with PBS + 0.2% BSA. The working concentration is 5 ng/mL or 14 IU/mL. |
| Recombinant Human IL-7 Protein | R&D Systems | 207-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 8800 IU/mL. |
| Recombinant Human SCF Protein | R&D Systems | 255-SC-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 26 IU/mL. |
| STEMdiff Hematopoietic Kit | STEMCELL Technologies | 5310 | Medium A: 45 mL STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement A ; Medium B: 75 STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement B |
| StemSpan lymphoid differentiation coating material | STEMCELL Technologies | 9950 | It is resuspended in PBS (100x) |
| StemSpan NK cell differentiation medium | STEMCELL Technologies | 9960 | It is prepared by adding 500 µL StemSpan NK Cell Differentiation Supplement (100x) into 49.5 mL of SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan lymphoid expansion medium | STEMCELL Technologies | 9960 | It is prepared by adding 5 mL StemSpan Lymphoid Progenitor Expansion Supplement (10x) into 45 mL of StemSpan SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan NK Cell Generation Kit | STEMCELL Technologies | 9960 | Thaw the medium and materials in room temperature and the medium is stored in 4 °C once thawed. |
| The BD LSRFortessa cell analyzer | BD | ||
| Trypsin-EDTA (0.05%), phenol red | Thermo Scientific | 25300054 | |
| Y-27632 dihydrochloride | Tocris | 1254 | working concentration: 10 µM |
참고문헌
- Gao, X., et al. Establishment of porcine and human expanded potential stem cells. Nature Cell Biology. 21 (6), 687-699 (2019).
- Mackinlay, K. M. L., et al. An in vitro stem cell model of human epiblast and yolk sac interaction. eLife. 10, 63930(2021).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical-scale natural killer cells from human pluripotent stem cells. Methods in Molecular Biology. 2048, 107-119 (2019).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity. Cell Stem Cell. 23 (2), 181-192 (2018).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Dhar, P., Wu, J. D. NKG2D and its ligands in cancer. Current Opinion in Immunology. 51, 55-61 (2018).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Rungarunlert, S., Techakumphu, M., Pirity, M. K., Dinnyes, A. Embryoid body formation from embryonic and induced pluripotent stem cells: Benefits of bioreactors. World Journal of Stem Cells. 1, 11-21 (2009).
- Counting cells using a hemocytometer. abcam. , Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. Journal of Immunological Methods. 294, 15-22 (2004).
- Tremblay-McLean, A., Coenraads, S., Kiani, Z., Dupuy, F. P., Bernard, N. F. Expression of ligands for activating natural killer cell receptors on cell lines commonly used to assess natural killer cell function. BMC Immunology. 20, 8(2019).
- Inoue, T., Swain, A., Nakanishi, Y., Sugiyama, D. Multicolor analysis of cell surface marker of human leukemia cell lines using flow cytometry. Anticancer Research. 34 (8), 4539(2014).
- Mhatre, S. Rapid flow cytometry based cytotoxicity assay for evaluation of NK cell function. Indian Journal of Experimental Biology. 52 (10), 983-988 (2014).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Motazedian, A., et al. Multipotent RAG1+ progenitors emerge directly from haemogenic endothelium in human pluripotent stem cell-derived haematopoietic organoids. Nature Cell Biology. 22 (1), 60-73 (2020).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Yan, Y., et al. Antileukemia activity of a natural killer cell line against human leukemias. Clinical Cancer Research. 4 (11), 2859-2868 (1998).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유