Method Article
Production de cellules tueuses naturelles à partir de cellules souches humaines à potentiel élargi
Dans cet article
Résumé
Le présent protocole montre comment différencier les cellules CD3−/CD45+CD56+ présentant une cytotoxicité légère des cellules souches à potentiel élargi humain (CSEPH) dans des conditions de culture 3D et 2D. Cela permet une validation phénotypique de routine sans la destruction du microenvironnement complexe.
Résumé
La différenciation des cellules tueuses naturelles (NK) des cellules souches pluripotentes humaines permet la recherche et la fabrication de produits cellulaires de qualité clinique pour l’immunothérapie. Décrit ici est un protocole en deux phases qui utilise un milieu commercial sans sérum et un cocktail de cytokines (interleukine [IL]-3, IL-7, IL-15, facteur de cellules souches [SCF] et ligand tyrosine kinase 3 de type FMS [Ftl3L]) pour différencier les cellules souches à potentiel étendu humain (hEPSC) en cellules qui possèdent des propriétés de cellules NK in vitro avec une technologie de culture à la fois en 3 dimensions (3D) et en 2 dimensions (2D). En suivant ce protocole, les cellules NK CD3-CD56+ ou CD45+CD56+ sont générées de manière constante. Lorsqu’ils sont cocultivés avec des cibles tumorales pendant 3 heures, les produits différenciés présentent une légère cytotoxicité par rapport à une lignée cellulaire permanente indépendante de l’IL-2, les cellules NK92mi. Le protocole préserve la complexité du microenvironnement de différenciation par la génération de structures 3D, facilitant ainsi l’étude des relations spatiales entre les cellules immunitaires et leurs niches. Pendant ce temps, le système de culture 2D permet la validation phénotypique de routine de la différenciation cellulaire sans nuire à la niche de différenciation délicate.
Introduction
Par rapport aux cellules souches pluripotentes conventionnelles comme les cellules souches embryonnaires humaines (CSEh) et les cellules souches pluripotentes induites par l’homme (CSPhi), les cellules souches à potentiel étendu humain (CSEPh) sont plus proches de l’état de totipotence, car elles peuvent se différencier en lignées extra-embryonnaires et embryonnaires1. Par exemple, les CSPh peuvent être différenciées en trophoblastes1 et en cellules semblables à un sac vitellin2. Pour atteindre la puissance unique des hEPSC, un blastomère individuel est cultivé dans un milieu contenant plusieurs petites molécules qui inhibent la signalisationd’engagement de lignée 1, appelée milieu EPSC (EPSCM). La culture des CSEh et des CSPh dans l’EPSCM augmente leur puissance précédemment restreinte pour les différencier en cellules trophoblastiques1.
Les cellules souches pluripotentes sont un outil de recherche précieux pour expérimenter de nouvelles modifications génétiques. En raison des capacités d’auto-renouvellement et de différenciation des cellules souches pluripotentes, un clone transformé d’une cellule souche pluripotente peut produire des produits cellulaires différenciés qui possèdent la même modification génétique au même locus. Zhu et Kaufman ont établi la norme pour la différenciation des cellules NK à partir de cellules souches pluripotentes conventionnelles (CSEh et CSPh)3. Tout d’abord, ils ont induit des cellules souches hématopoïétiques (CSH) à partir d’un corps embryoïde dérivé de cellules souches pluripotentes. L’ajout du facteur des cellules souches (SCF), du ligand de la tyrosine kinase 3 de type FMS (Ftl3L), de l’interleukine (IL)-7, de l’IL-15 et d’un supplément précoce d’IL-3 a biaisé les CSH pour qu’elles se développent en cellules tueuses naturelles (NK). Par la suite, ils ont étendu les cellules NK avec des cellules présentatrices d’antigènes artificiels (aAPC), qui présentent une IL-21 liée à la membrane, avec la supplémentation continue d’IL-2. Les chercheurs ont appliqué cette approche à l’immunothérapie afin de générer des cellules tueuses naturelles dérivées de l’iPSC dotées du récepteur antigénique chimérique (CAR-iNK)4.
Les cellules NK humaines sont définies comme des leucocytes CD3−CD56+ dans le sang périphérique. Ce sont des effecteurs contre les cellules infectées par le virus et les cellules tumorales5. Certains récepteurs inhibiteurs sur les cellules NK reconnaissent les molécules exprimées de manière ubiquitaire dans les cellules normales. A titre d’exemple, l’hétérodimère NKG2A/CD94 exprimé sur les cellules NK reconnaît les molécules de classe I du CMH5. Pendant ce temps, les récepteurs activateurs sur les cellules NK reconnaissent les ligands induits par le stress, comme NKG2D reconnaît la séquence A LIÉE AU POLYPEPTIDE DE CLASSE I DU CMH INDUITE PAR TRANSFORMATION (MICA / MICB)6. Certaines cellules transformées régulent à la baisse leurs « auto-ligands » pour échapper à la surveillance immunitaire et réguler positivement les ligands aberrants, ce qui déclenche les cellules NK pour exécuter leur machinerie lytique. Les capacités antitumorales intrinsèques des cellules NK ont attiré l’attention sur ce type de cellules immunitaires.
La capacité de donner naissance simultanément à des lignées embryonnaires et extra-embryonnaires peut faire des CSPh une récapitulation plus fidèle de la niche de développement embryonnaire que les cellules souches pluripotentes conventionnelles. Par expérience, il est plus facile de maintenir la puissance des CSPh que des CSPh. Dans la présente étude, un protocole a été développé (Figure 1) pour biaiser les CSPh afin qu’elles se développent en lignées hématopoïétiques et différencient plus tard les cellules progénitrices en cellules tueuses naturelles (NK) in vitro. Dans le protocole, des milieux commerciaux sont utilisés pour éviter les incohérences sériques, suivies de l’ajout progressif de cytokines pour la différenciation des biais en lignées lymphoïdes. Ce protocole dispose de deux systèmes pour préserver le microenvironnement 3D complexe tout en dérivant des cellules CD3−CD56+/CD45+CD56+ qui ressemblent phénotypiquement et fonctionnellement aux cellules NK humaines.
Ce protocole peut être utile pour étudier l’interaction des cellules immunitaires avec leurs niches de différenciation et peut avoir le potentiel de purifier les produits cellulaires à des fins immunothérapeutiques.
Protocole
La présente étude comportait des expériences in vitro ; Par conséquent, l’approbation éthique n’est pas applicable. Les lignées cellulaires établies utilisées dans cette étude ont été obtenues de sources commerciales (voir le tableau des matériaux).
1. Génération de structures organoïdes 3D à partir de CSEP
- Maintenir les CSEP en les cultivant avec 1 mL de milieu EPSC (plaque à 12 puits) sur des cellules SNL1.
REMARQUE : Des colonies en forme de dôme sont observées (figure 2A) si leur puissance accrue demeure. - Effectuer la pré-différenciation des hEPSC.
- Retirer le milieu hEPSC et ajouter 1 mL de milieu DFK (DMEM/F12 + milieu de remplacement du sérum à 10 %, voir le tableau des matières). Incuber pendant 2-3 jours à 37 °C et 5% CO2. Effectuez un changement moyen le deuxième jour si vous poursuivez l’incubation pendant 3 jours.
REMARQUE : Au microscope, les colonies en forme de dôme sont aplaties (Figure 2B).
- Retirer le milieu hEPSC et ajouter 1 mL de milieu DFK (DMEM/F12 + milieu de remplacement du sérum à 10 %, voir le tableau des matières). Incuber pendant 2-3 jours à 37 °C et 5% CO2. Effectuez un changement moyen le deuxième jour si vous poursuivez l’incubation pendant 3 jours.
- Vérifier la formation des corps embryoïdes par la technique de la goutte suspendue 7,8.
- Retirer le milieu DFK et laver une fois avec 1 ml de PBS. Ajouter 500 μL de trypsine à 0,05% et incuber la plaque à 37 °C et 5% de CO2 pendant 3-7 min en fonction de la morphologie.
NOTE: Les CSPh doivent pouvoir être détachés des cellules d’alimentation lorsque la plaque est légèrement perturbée. - Retirer la trypsine et ajouter 2 ml de milieu DFK pour récolter les cellules. Faites tourner les cellules à 300 x g pendant 3 min à température ambiante.
- Retirer le surnageant à l’aide d’une pipette. Ajouter 1 mL de milieu DFK et 1 μL de Y27632 (voir le tableau des matières) pour remettre les cellules en suspension en les effleurant.
- Comptez le nombre de cellules dans la suspension cellulaire avec un hémocytomètre9. Diluer la suspension cellulaire avec un milieu DFK et Y27632 (1 000x) de sorte qu’il y ait 4 000 cellules/25 μL de milieu DFK.
- Remplissez le capuchon d’une boîte de Petri de 10 cm avec environ 30-40 gouttes de 25 μL de suspension cellulaire par bouchon. Versez un peu de PBS dans le plat inférieur pour empêcher l’évaporation des gouttelettes. Retourner doucement le capuchon et couvrir le plat. Incuber le plat à 37 °C et 5% de CO2 pendant 3 jours.
- Retirer le milieu DFK et laver une fois avec 1 ml de PBS. Ajouter 500 μL de trypsine à 0,05% et incuber la plaque à 37 °C et 5% de CO2 pendant 3-7 min en fonction de la morphologie.
2. Mésoderme et structure hémato-endothéliale du corps embryoïde (EB)
- Recueillir les EB dans la gouttelette.
- Recueillir tous les EB de la gouttelette dans un tube de 15 mL à l’aide d’une pipette de 1 mL et d’un peu de PBS. Pompez un peu de PBS dans la gouttelette, puis aspirez le milieu, y compris les EB, avec la pipette.
REMARQUE: Les gouttelettes qui sont plus jaunes indiquent une formation et une croissance plus réussies que les gouttelettes roses. - Faites tourner les EB collectés à 100 x g pendant 1 min à température ambiante et utilisez une pipette pour retirer le surnageant. Ajouter 1 mL de milieu A (à partir d’une trousse de différenciation cellulaire disponible dans le commerce, voir le tableau des matériaux) pour transférer les EB collectés sur une plaque non adhérente à 24 puits. Étiquetez ce jour comme Jour 0 (Figure 1).
NOTE: Habituellement, tous les EB collectés à partir d’une boîte de 10 cm sont regroupés et transférés dans un puits d’une assiette de 24 puits.
- Recueillir tous les EB de la gouttelette dans un tube de 15 mL à l’aide d’une pipette de 1 mL et d’un peu de PBS. Pompez un peu de PBS dans la gouttelette, puis aspirez le milieu, y compris les EB, avec la pipette.
- Effectuer la structuration mésodermique des EB.
- Incuber la plaque pendant 3 jours à 37 °C avec 5% de CO2. Le jour 2, retirer 500 μL du milieu A (de la trousse, étape 2.1.2) tout en évitant de pipeter les EB. Ensuite, ajoutez 500 μL de milieu frais A.
- Effectuer la spécification hémato-endothéliale du corps embryoïde.
- Retirer 700 μL de milieu A du puits et ajouter 700 μL de milieu B (de la trousse, étape 2.1.2). Culture pendant 7 jours. Effectuez un demi-changement de milieu B le jour 5, le jour 7 et le jour 9.
3. Différenciation des cellules NK
- Transférer les EB à motifs sur une interface air-liquide.
- Inclinez légèrement la plaque pour que les EB s’agrègent sur le fond. Utilisez une pipette de 1 mL pour enlever autant de milieu B que possible tout en évitant les EB.
- Ramasser les EB avec une pipette en aspirant le milieu restant. Transférez-les dans un transwell dans une plaque de 24 puits (voir le tableau des matériaux).
REMARQUE: Limitez les nombres à deux ou trois EB par transwell pour une densité optimale.
- Effectuer une expansion des progéniteurs lymphoïdes.
- Ajouter 500 μL de milieu NK-1 (milieu d’expansion lymphoïde disponible dans le commerce + 14 UI/mL d’IL-3, 4 500 UI/mL d’IL-15, 8 800 UI/mL d’IL-7, 26 UI/mL d’AGC et 12 UI/mL de pi3L, voir le tableau des matériaux) au compartiment inférieur du transpuits. Culture pendant 14 jours, et effectuer un changement de milieu tous les deux jours.
- Récoltez et transférez les cellules les jours 7 à 10 dans une assiette enduite.
- Pour recouvrir la plaque, diluer le matériau de revêtement (matériau de revêtement de différenciation lymphoïde disponible dans le commerce, 100x, voir le tableau des matériaux) dans du PBS. Ajouter 1 mL de solution de revêtement diluée à chaque puits d’une plaque de 12 puits et incuber la plaque à 4 °C pendant une nuit. Couvrir l’ouverture de la plaque avec un film d’emballage.
- Ajouter 200 μL de PBS dans le transpuits, et pipeter lentement de haut en bas environ cinq à six fois pour récolter les cellules libérées par les organoïdes. Évitez de pipeter les organoïdes.
NOTE: Des cellules rondes sont libérées des organoïdes en continu (Figure 2D). - Transférer la suspension cellulaire récoltée dans un tube de 2 mL et faire tourner les cellules à 500 x g pendant 5 minutes à température ambiante. Retirer le surnageant à l’aide d’une pipette et ajouter 1 mL de milieu NK-1 (étape 3.2.1) pour remettre les cellules en suspension par pipetage.
- Retirez toute la solution de revêtement du puits et lavez deux fois chaque puits d’une plaque de 12 puits avec 1 mL de PBS.
- Divisez les cellules récoltées dans un rapport de 1:2. Transférer la suspension cellulaire sur une plaque revêtue de 12 puits (étape 3.3.1). Ajouter 1 mL de milieu NK-1 de sorte que chaque puits contienne 1,5 mL de milieu.
- Pour effectuer un changement de milieu, laissez les cellules reposer pendant 1-2 minutes pour permettre aux cellules de couler au fond. Aspirer soigneusement 750 μL de milieu. Faire tourner le surnageant recueilli à 500 x g pendant 5 min à température ambiante.
- Jeter la majeure partie du surnageant et remettre en suspension dans 750 μL de milieu NK-1 avec pipetage cinq à six fois. Ajouter les cellules remises en suspension dans le milieu frais dans le puits d’origine.
REMARQUE : Ce système parallèle est appelé système 2D à la figure 1. Suivez le calendrier de changement de milieu du puits des organoïdes d’où proviennent les cellules.
- Effectuez la maturation des cellules NK en suivant les étapes ci-dessous.
- Retirer l’ancien milieu du système 3D et ajouter 500 μL de NK-2 (milieu de différenciation des cellules NK disponible dans le commerce + 4 500 UI/mL d’IL-15, 8 800 UI/mL d’IL-7, 26 UI/mL d’ICC et 12 UI/mL pi3L, voir le tableau des matériaux) dans le compartiment inférieur du transpuits. Incuber à 37 °C et 5% de CO2 pendant 14 jours.
NOTE: Assurez-vous que le milieu touche le fond du transwell. - Effectuez un changement complet de milieu sur les cellules du système 2D. Prélever les 1,5 mL de cellules d’un puits et les centrifuger à 500 x g pendant 5 minutes à température ambiante. Retirer la plus grande partie du surnageant à l’aide d’une pipette et remettre la pastille en suspension avec 1,5 mL de milieu NK-2 (étape 3.4.1).
- Effectuez un changement moyen tous les deux jours. Inclinez légèrement la plaque du système 3D et retirez tout l’ancien support à l’extérieur du transwell. Ajouter 500 μL de milieu NK-2 à l’extérieur du transpuits.
- Pour effectuer un changement de demi-milieu sur un puits d’une plaque de 12 puits pour le système 2D, laissez les cellules reposer pendant 1-2 minutes pour permettre aux cellules de couler au fond. Aspirer soigneusement 750 μL du milieu.
- Faites tourner le surnageant collecté à 500 x g pendant 5 minutes à température ambiante pour éviter la perte de cellules. Jeter la majeure partie du surnageant et remettre en suspension dans 750 μL de milieu NK-2 en pipetant cinq à six fois. Ajouter les cellules remises en suspension dans un milieu frais dans le puits d’origine.
- Retirer l’ancien milieu du système 3D et ajouter 500 μL de NK-2 (milieu de différenciation des cellules NK disponible dans le commerce + 4 500 UI/mL d’IL-15, 8 800 UI/mL d’IL-7, 26 UI/mL d’ICC et 12 UI/mL pi3L, voir le tableau des matériaux) dans le compartiment inférieur du transpuits. Incuber à 37 °C et 5% de CO2 pendant 14 jours.
4. Récolte de cellules matures
- Récoltez les cellules cultivées dans le système 2D.
- Récoltez les cellules en pipetant de haut en bas pendant les jours 38 à 45. Laver deux fois avec 1 ml de PBS. Centrifuger la suspension cellulaire à 500 x g pendant 5 min à température ambiante.
- Retirez le surnageant à l’aide d’une pipette et remettez-le en suspension dans le tampon de votre choix (c.-à-d. PBS + FBS à 2 % pour la cytométrie en flux, voir le tableau des matières).
- Récolter les cellules incorporées dans l’organoïde.
- Recueillir le milieu de l’extérieur du transpuits dans un tube de 15 ml pendant les jours 38 à 45. Lavez l’organoïde deux fois en ajoutant 200 μL de PBS à l’intérieur du transpuits et en pipetant de haut en bas cinq à six fois. Transférer la suspension dans le tube de 15 mL.
- Ajouter 500 μL de PBS dans un puits d’une plaque de 12 puits. Transférer l’organoïde du transpuits vers le puits de la plaque à 12 puits à l’aide d’une pince.
- Couper l’organoïde 20 fois à l’aide d’une paire de ciseaux et d’une pince. Rincez les cellules restantes sur la pince et les ciseaux dans le puits avec du PBS. Recueillir autant de PBS que possible et le transférer dans le tube de 15 mL utilisé à l’étape 4.2.1 sans aspirer la structure organoïde.
- Ajouter 500 μL du réactif de dissociation (voir le tableau des matériaux) dans le transwell pour digérer l’organoïde par voie enzymatique. Incuber avec une solution commerciale de détachement cellulaire (voir le tableau des matériaux) pendant 7-10 min à 37 °C et 5% de CO2. Éteignez la réaction en ajoutant 1 mL de PBS avec 2% de FBS et recueillez la solution dans un autre tube de 15 mL. Lavez le puits avec 1 mL de PBS avec 2% FBS deux fois.
NOTE: Déterminez la durée de l’incubation en fonction de la morphologie. Essayez d’atteindre le point auquel les cellules individuelles commencent à être libérées de la membrane de la structure 3D. - Ajouter 1 mL de PBS avec 2% FBS, et pipeter 8-10 fois. Collectez toutes les solutions, y compris les structures organoïdes. Transvasez-les dans le tube de 15 mL utilisé à l’étape 4.2.3 à l’aide d’une crépine cellulaire.
- Centrifuger les deux tubes à 500 x g pendant 5 min à température ambiante. Jeter le surnageant à l’aide d’une pipette. Remettez en suspension la pastille de cellule avec le tampon de votre choix (étape 4.1.2).
Résultats
On a émis l’hypothèse que les produits actuels de différenciation in vitro (DIV) posséderaient des marqueurs de surface et des capacités antitumorales similaires à ceux des cellules NK humaines.
Le marqueur définissant les cellules NK humaines a été consulté pour tester si les produits de différenciation du système de culture 3D produisaient des cellules qui ressemblaient phénotypiquement à des cellules NK humaines. Environ 15 % des cellules dissociées du système de culture 3D de deux lots induits à des moments différents (n = 2) étaient CD3−CD56+ (Figure 3A). CD3 a été remplacé par CD45 (un marqueur panleucocytaire) dans le panel de test en raison de l’absence de CD3 et de la difficulté à induire des lymphocytes T in vitro. Environ 16 % des cellules dissociées de la structure 3D étaient CD45+CD56+ (Figure 3B, n = 1), ce qui correspond aux pourcentages de cellules CD3−CD56+ observés dans les essais antérieurs. Les pourcentages de cellules CD3-CD56+ dans les cellules prélevées à partir du système de culture 2D variaient de 30 % à 6 %, allant d’inductions plus réussies (Figure 3C, n = 3) à des inductions moins réussies (Figure 3D, n = 2). La fonctionnalité et les phénotypes des cellules récoltées à partir du système de culture 2D ont été validés. Au cours de la culture du jour 18 à partir du système 2D, environ 12% des cellules ont exprimé à la fois CD56 et CD107a ectopiques après 2 h de stimulation anti-CD244 de 50 ng / mL, 455 UI / mL d’IL-2 et 20 ng / mL d’anticorps anti-CD244 (Figure 4C, n = 1). Environ 28 % des cellules récoltées étaient CD94+CD159a+ (figure 4B, n = 1). L’expression ectopique de CD107a, une protéine de doublure sur la membrane des granulés, indique une dégranulation10, tandis que l’hétérodimère CD94/NKG2A(CD159a) est un autre marqueur déterminant des cellules NK. Ceci fournit un exemple de la validation phénotypique et fonctionnelle des produits DIV.
La fonctionnalité des produits DIV a été testée par leur cytotoxicité contre les cellules érythroleucémiques humaines-cellules K562. Le profilage complet des ligands sur les cellules K562 révèle leur complexe histochimique majeur I (MHC-I) régulé à la baisse et leur expression relativement forte du ligand NKG2D (tels que ULBP-1, ULBP-2/5/6 et ULBP-3)11 ; ainsi, les cellules K562 sont sensibles à l’activité lytique des cellules NK12. Les deux produits d’évaluation DIV et les cellules NK92mi ont été amorcés avec 50 ng / mL IL-18, 455 UI / mL IL-2 et 20 ng / mL d’anticorps anti-CD244 pendant la nuit. Les cellules GFP+ K562 ont été cocultivées avec des cellules récoltées à partir de cellules IVD ou NK92mi à différents rapports effecteur/cible (E:T) en présence d’anticorps IL-18 de 50 ng/mL (UI non fournie), d’anticorps IL-2 de 455 UI/mL et d’anticorps anti-CD244 de 20 ng/mL dans le même volume de milieu H5100 pendant 3 h. La lecture de l’activité de destruction des cellules NK était l’expression du marqueur des cellules mortes sur les sous-ensembles GFP+. Les cellules K562 ont été transduites avec un vecteur de contrôle disponible dans le commerce (voir le tableau des matériaux) pour exprimer la GFP de manière constitutive, et l’efficacité de la transduction était d’environ 80% (figure supplémentaire 1A). Les pourcentages de signaux GFP ajoutés étaient proportionnels au nombre de cellules GFP+ K562 ajoutées, suggérant une expression spécifique de GFP à partir des cellules K562 transduites (Figure supplémentaire 1B).
Les pourcentages de cellules cibles mourantes illustrées à la figure 5 ont été calculés à l’aide de la formule13 suivante :
Pourcentage de cellules mourantes = (FITC + DAPI + % de coculture [par exemple, Figure 5A]) - (FITC + DAPI + % de cellules K562 transduites)
Parmi les trois rapports E:T évalués (0,1:1, 0,33:1, 1:1), les pourcentages de cellules GFP+ mourantes étaient positivement corrélés avec les ratios E:T lorsqu’elles étaient cocultivées avec des produits DIV (Figure 5B, hEPSC-NK) ou des cellules NK92mi (Figure 5B, NK92mi), indiquant la destruction spécifique des cibles tumorales. Cependant, la cytotoxicité des produits DIV était comparativement modeste au cours de la période testée (figure 5C).
Enfin, la génération de cellules progénitrices lymphoïdes a été comparée entre les cultures 3D et 2D. Il a été constaté que la condition de culture 3D générait plus de cellules progénitrices (55 000 cellules) que la condition de culture 2D (36 000 cellules) (Figure supplémentaire 2). Cela suggère que le contexte de l’architecture tissulaire et des composants cellulaires dans la culture 3D a soutenu la génération de cellules progénitrices lymphoïdes.
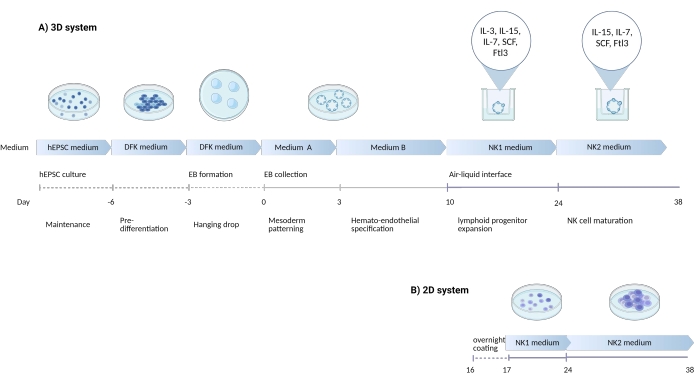
Figure 1: Diagramme schématique montrant la stratégie de différenciation pour différencier les cellules NK des hEPSC . (A) Ici, la chronologie des systèmes de culture 3D est montrée, détaillant les conditions de culture et de brefs mots-clés de chaque étape. L’interface air-liquide du système 3D est maintenue pendant l’induction de la cellule NK. (B) Ici, la chronologie des systèmes de culture 2D est montrée. Les cellules libérées récoltées des jours 7 à 10 à partir de structures du système 3D sont ensemencées sur une plaque revêtue sans interface air-liquide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
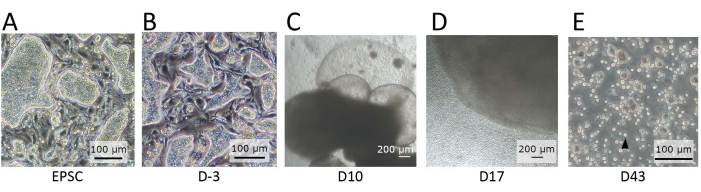
Figure 2 : Morphologie des cellules observées à différents stades de différenciation. (A) La morphologie des CSPh lorsqu’elle est maintenue dans l’EPSCM. Les hEPSC forment des colonies en forme de dôme. (B) La morphologie des CSPh après prédifférenciation. Les colonies en forme de dôme sont aplaties. Les CSPh sont récoltés et forment des EB avec la technique de la goutte suspendue. Les EB sont collectés et cultivés dans le milieu A puis dans le milieu B. (C) La morphologie d’un EB au jour 10. Pendant cette période, l’EB commence à se dilater et à se gonfler, formant des structures membraneuses. (D) La morphologie d’un EB libérant des cellules. Après l’ensemencement sur le transpuits, l’EB se développe et libère constamment des cellules rondes dans l’environnement. Certaines des cellules libérées sont collectées et cultivées sur une plaque de 12 puits recouverte de matériaux de revêtement de différenciation lymphoïde. Les populations cellulaires sont morphologiquement hétérogènes et ont tendance à s’agréger. (E) La morphologie des cellules observées à l’extrémité du DIV. De petites cellules de suspension circulaires (flèche noire) sont observées. Barres d’échelle: (A,B,E) = 100 μm; (C,D) = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
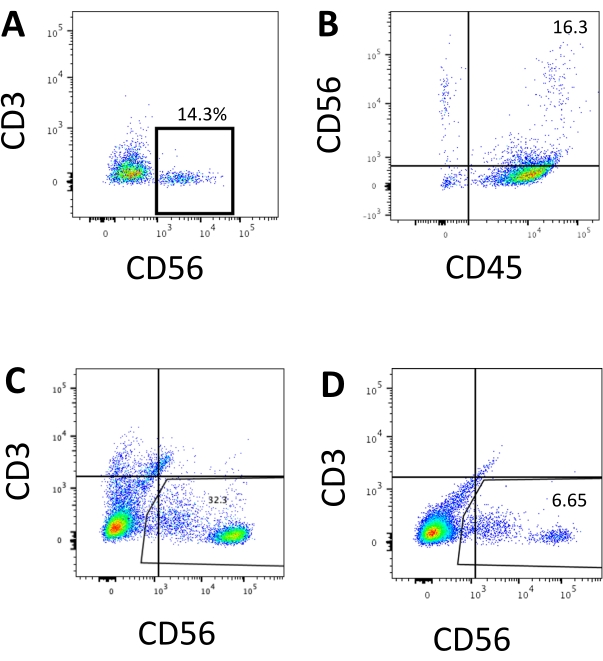
Figure 3 : Tracés FACS représentatifs des produits dérivés de l’hEPSC au point final. Les cellules sont incubées avec des anticorps conjugués au fluoroscope sur de la glace pendant 30 minutes. Les échantillons sont colorés avec du DAPI avant d’être chargés dans le port d’injection de l’échantillon FACS. Des cellules non colorées sont utilisées pour établir le point de contrôle négatif. (A) Tracé FACS représentatif sur l’expression de CD3 et CD56 dans des cellules dissociées du système de culture 3D de deux lots (n = 2). (B) Tracé FACS représentatif sur l’expression de CD45 et CD56 dans des cellules dissociées de la culture 3D (n = 1). (C) Tracé FACS représentatif sur l’expression de CD3 et CD56 dans des cellules prélevées sur la plaque revêtue lors d’une induction réussie (n = 3). (D) Tracé FACS représentatif sur l’expression de CD3 et CD56 à partir de la plaque revêtue lorsque l’induction est sous-optimale (n = 2). Veuillez cliquer ici pour voir une version agrandie de cette figure.
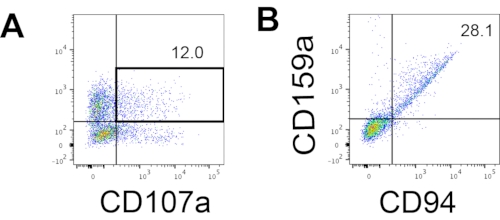
Figure 4 : Graphique FACS représentatif sur les produits dérivés de l’hEPSC pendant la culture du jour 18 (n = 1). (A) Tracé FACS sur l’expression de CD56 et CD107a après 2 h de stimulation avec des anticorps IL2, IL-18 et anti-CD244. (B) Tracé FACS sur l’expression CD159a et CD94. Les échantillons sont colorés avec du DAPI avant d’être chargés dans l’orifice d’injection de l’échantillon FACS. Des cellules non colorées sont utilisées pour établir le point de contrôle négatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
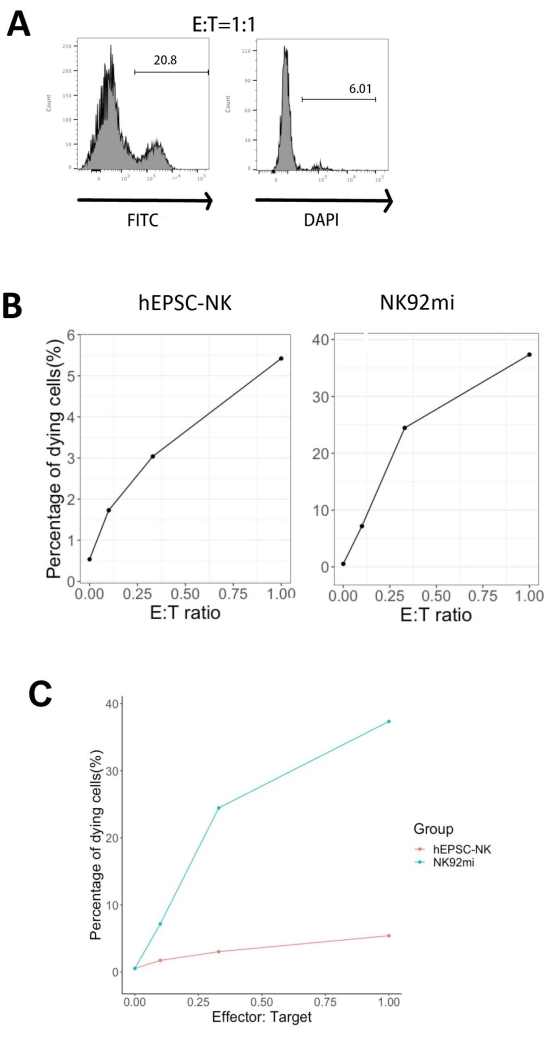
Figure 5 : Graphique des pourcentages de cellules mourantes par rapport à différents rapports E:T de la coculture de cellules GFP+ K562 avec le produit final DIV ou des cellules NK92mi (n = 1). L’expression des cellules FITC+ DAPI+ a été évaluée à l’aide d’un analyseur de cellules, et l’analyse des données a été effectuée avec un logiciel compatible. (A) Un graphique FACS représentatif montrant le contrôle des sous-ensembles FITC + DAPI + à partir de la coculture de produits DIV et de cellules K562 avec un rapport E:T de 1. (B) Parcelles individuelles de l’expérience de coculture avec des produits DIV GFP+ (à gauche) ou des cellules NK92mi (à droite) pendant 3 h. Les deux reflètent une relation proportionnelle positive entre le pourcentage de cellules mourantes et le rapport E:T. (C) Un graphique montrant les courbes de destruction des produits DIV et des cellules NK92mi à la même échelle. Les produits DIV présentaient une légère cytotoxicité par rapport aux cellules NK92mi. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Essai fonctionnel des cellules NK provenant de CSEP. (A) Histogramme FACS des cellules K562 transduites. Les cellules FITC+ K562 exprimaient la GFP. (B) Histogrammes FACS à partir de la coculture de cellules GFP+ K562 et des produits DIV à trois rapports E:T (n = 1). Les pourcentages de cellules FITC+ dans la coculture correspondaient au nombre de cellules K562 transduites ajoutées. Les gatings ont été établis avec des cellules K562 non transduites. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Différenciation des progéniteurs lymphoïdes en culture 2D versus 3D. Le protocole actuel basé sur les organoïdes a été utilisé pour induire des progéniteurs lymphoïdes à partir de cellules souches humaines à potentiel élargi. Deux conditions ont été mises en place : (1) les progéniteurs lymphoïdes ont été maintenus en culture dans les organoïdes (3D), et (2) les progéniteurs lymphoïdes ont été isolés et conservés dans la boîte de culture (2D). Après 2 semaines de culture supplémentaire, le nombre de cellules a été déterminé pour comparer la culture 2D et 3D. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Il y a quelques étapes cruciales pour assurer la différenciation réussie des cellules CD45+CD56+ des hEPSC. La pré-différenciation (étape 1.2) est cruciale puisque le milieu EPSC contient des inhibiteurs de l’engagementde lignée 1. Après pré-différenciation, les colonies de CSPh en forme de dôme sont aplaties (Figure 2B). L’ajout de Y27632, un inhibiteur de la rho-kinase (ROCKi), lors de la formation des EB à partir des CSPh (étape 1.3) est indispensable à la survie des CSPh après dissociation. Une autre considération importante est le nombre de EB plantés sur chaque transwell. Comme il s’agit d’un système à petite échelle, deux à trois EB par transwell est la densité optimale pour éviter la surconsommation du média. L’interface air-liquide est maintenue pendant toute la différenciation des cellules NK pour le système 3D, qui est censé maintenir la polarité des cellules stromales et soutenir l’expansion des progéniteurs hématopoïétiques dérivés de l’AGM14,15.
Comme mentionné précédemment, la densité des EB sur le transwell est un facteur déterminant pour une différenciation réussie. Le signe clé pour cela est la couleur du milieu 1 jour après l’implantation des EB sur le transwell. Si la couleur jaunit rapidement, cela indique une contamination ou une surpopulation. Pour résoudre le problème, une pipette de 1 mL doit être utilisée pour ramasser manuellement les EB supplémentaires et les transférer dans un autre transwell.
Une limitation majeure de ce protocole est la pureté des cellules CD3−/CD45+ CD56+ dans les produits DIV, qui serait partiellement responsable de la cytotoxicité inférieure par rapport aux cellules NK92mi pures. Un système de culture 3D a été utilisé pour induire des progéniteurs hématopoïétiques via la génération d’un EB qui ressemble aux trois couches germinales embryonnaires. Cette stratégie imite le développement des cellules sanguines dans le microenvironnement de la moelle osseuse, éliminant ainsi le besoin de cellules stromales pour soutenir la différenciation3. Sans une étape de tri pour purifier les progéniteurs hématopoïétiques, la pureté des produits DIV devrait être réduite. Une stratégie visant à conserver le créneau de différenciation complexe tout en augmentant la pureté du produit final consiste à développer une méthode d’expansion pour les produits DIV CD3-CD56+ triés. Par exemple, les produits DIV CD3−CD56+ triés peuvent être cultivés sur des cellules présentatrices d’antigènes artificiels (APCa), telles que des cellules K562 irradiquées conçues avec de l’IL-21 liée à la membrane. Avec l’apport d’IL-2 dans la culture, cette méthode permet de multiplier par 1 000 le nombre de cellules NK3.
Une autre limite est l’accès limité aux cellules NK humaines de bonne foi comme référence positive. NK92mi est la référence positive utilisée dans le test de coculture, mais elle n’est pas assez précise. Les cellules NK92mi sont conçues à partir de cellules NK92, une lignée cellulaire permanente qui exprime les phénotypes de cellules NK activées16, pour produire de manière autonome de l’IL-2 afin de répondre aux exigences de culture. Les cellules NK92 démontrent une activité de destruction supérieure contre les cellules K562 in vitro que les cellules NK primaires humaines17. Une comparaison plus juste de la capacité de destruction tumorale des produits DIV pourrait être obtenue en analysant la cytotoxicité des cellules NK du sang périphérique en parallèle, mais malheureusement, l’accès aux banques de sang fait défaut.
Ce protocole de culture à deux systèmes vise à générer des cellules CD3−/CD45+CD56+ à partir de hEPSC. L’évaluation des marqueurs de surface et de la cytotoxicité avec FACS peut être effectuée en routine sur des cellules de systèmes 2D sans perturber la niche de différenciation. Malgré les différences dans les pourcentages de cellules CD3-CD56+, les systèmes 3D et 2D peuvent dériver des cellules CD3-CD56+ avec des variations similaires dans l’expression de CD56 (Figure 3), et le système 2D reflète l’existence de progéniteurs lymphoïdes de la condition de culture 3D.
L’importance de l’utilisation du système de culture 3D est qu’il permet l’utilisation de tests de profilage à haute résolution, tels que la transcriptomique spatiale ou la spectrométrie de masse d’imagerie, pour étudier les relations spatiales et les interactions cellule-cellule dans le créneau de différenciation complexe.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous tenons à remercier le Dr Handi Cao, Sanxing GAO, David Xiang, Yiming Chao, Ritika Jogani, Owen Chan, Stephanie Cheung et Céline Chan pour leur assistance technique et leurs discussions utiles. Ce travail a été soutenu par le Platform Technology Fund. La figure 1 a été créée avec BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 30 w/v% Albumin Solution, from Bovine Serum(BSA), Fatty Acid Free | Wako Chemicals | 017-22231 | For resuspending cytokines. |
| ACCUMAX | STEMCELL Technologies | 07921 | |
| Anti-human-CD159a-PE | BD | 375104 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD3-APC antibodies | BD | 555355 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 2% FBS) |
| Anti-human-CD45-APC antibodies | BD | 555485 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 3% FBS) |
| Anti-human-CD56-PE antibodies | BD | 555516 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 4% FBS) |
| Anti-human-CD56-PEcy7 antibodies | BD | 335826 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD94-APC | BD | 559876 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Bemis Parafilm M Laboratory Wrapping Film | Thermo Scientific | 11772644 | |
| Cd244 Monoclonal Antibody (eBioC1.7 (C1.7)), Functional Grade, eBioscience | Thermo Scientific | 16-5838-85 | |
| Costar 6.5 mm Transwell, 0.4 µm Pore Polyester Membrane Inserts | STEMCELL Technologies | 3470 | |
| Dapi Solution, 1 mg/mL | BD | 564907 | It is resuspended with ddH2O so the concentration is 10 µM/mL. Add 1 µL of the aliquot in 300 µL of FACS buffer (PBS + 2% FBS) |
| DMEM | CPOS-Bioreagent core | 11965092 | |
| DMEM/F12 | Thermo Scientific | 11320033 | |
| FcX, human | Biolengend | 422302 | |
| Fetal Bovine Serum(FBS) qualified E.U.-approved South America | CPOS-Bioreagent core | 10270106 | |
| FlowJo v10.8.0 | BD | ||
| Gibco PBS (10x) pH 7.4 | CPOS-Bioreagent core | 70011044 | 10x concentrated PBS is manufactured as follows: without calcium, magnesium or phenol red |
| K562 cells | ATCC | CCL-243 | |
| Knockout Serum Replacement | Thermo Scientific | 10828-028 | |
| MyeloCult H5100 medium | STEMCELL Technologies | 5150 | |
| NK92mi cells | ATCC | CRL-2408 | Lot: 70045208. Once thawed, they are cultured in MyeloCult H5100 medium, and maintained the density between 2 x 105 to 1 x 106 cell/mL. |
| Nunc Cell-Culture Treated Multidishes 12 well plate | Thermo Scientific | 150628 | flat bottom |
| Nunc Cell-Culture Treated Multidishes 24 well plate | Thermo Scientific | 142475 | |
| Nunc EasYDish Dishes | Thermo Scientific | 150460 | |
| pLenti-GFP Lentiviral Control Vector | CELL BIOLABS | LTV-400 | It is packaged as the manufactuer suggested (https://www.cellbiolabs.com/sites/default/files/LTV-400-gfp- lentiviral-plasmid.pdf). 40 μL of 50x lentivirus is added with 1 μL 10 mg/mL polybrene per 1 mL of cell suspension. Complete medium change is performed 24 h after the addition of lentivirus. Cells are incubated undisputedly for 3 days at 37 °C, 5% CO2. |
| Polybrene | EMD Millipore | TR-1003-G | |
| Recombinant Human Flt-3 Ligand/FLT3L Protein | R&D Systems | 308-FK-005 | It is resuspend with PBS + 0.2% BSA. Thr working concentration is 10 ng/mL or 12 IU/mL. |
| Recombinant Human IL-15 Protein | R&D Systems | 247-ILB-005 | It is resuspended with PBS + 0.2% BSA. The working concentration is 10 ng/mL or 4500 IU/mL. |
| Recombinant Human IL-18/IL-1F4 Protein | R&D Systems | 9124-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL. The IU is not provided by the company. |
| Recombinant Human IL-2 Protein | R&D Systems | 202-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL or 455 IU/mL. |
| Recombinant Human IL-3 Protein, 50ug | PeproTech | 200-03 | It is resuspended with PBS + 0.2% BSA. The working concentration is 5 ng/mL or 14 IU/mL. |
| Recombinant Human IL-7 Protein | R&D Systems | 207-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 8800 IU/mL. |
| Recombinant Human SCF Protein | R&D Systems | 255-SC-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 26 IU/mL. |
| STEMdiff Hematopoietic Kit | STEMCELL Technologies | 5310 | Medium A: 45 mL STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement A ; Medium B: 75 STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement B |
| StemSpan lymphoid differentiation coating material | STEMCELL Technologies | 9950 | It is resuspended in PBS (100x) |
| StemSpan NK cell differentiation medium | STEMCELL Technologies | 9960 | It is prepared by adding 500 µL StemSpan NK Cell Differentiation Supplement (100x) into 49.5 mL of SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan lymphoid expansion medium | STEMCELL Technologies | 9960 | It is prepared by adding 5 mL StemSpan Lymphoid Progenitor Expansion Supplement (10x) into 45 mL of StemSpan SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan NK Cell Generation Kit | STEMCELL Technologies | 9960 | Thaw the medium and materials in room temperature and the medium is stored in 4 °C once thawed. |
| The BD LSRFortessa cell analyzer | BD | ||
| Trypsin-EDTA (0.05%), phenol red | Thermo Scientific | 25300054 | |
| Y-27632 dihydrochloride | Tocris | 1254 | working concentration: 10 µM |
Références
- Gao, X., et al. Establishment of porcine and human expanded potential stem cells. Nature Cell Biology. 21 (6), 687-699 (2019).
- Mackinlay, K. M. L., et al. An in vitro stem cell model of human epiblast and yolk sac interaction. eLife. 10, 63930 (2021).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical-scale natural killer cells from human pluripotent stem cells. Methods in Molecular Biology. 2048, 107-119 (2019).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity. Cell Stem Cell. 23 (2), 181-192 (2018).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Dhar, P., Wu, J. D. NKG2D and its ligands in cancer. Current Opinion in Immunology. 51, 55-61 (2018).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Rungarunlert, S., Techakumphu, M., Pirity, M. K., Dinnyes, A. Embryoid body formation from embryonic and induced pluripotent stem cells: Benefits of bioreactors. World Journal of Stem Cells. 1, 11-21 (2009).
- Counting cells using a hemocytometer. abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. Journal of Immunological Methods. 294, 15-22 (2004).
- Tremblay-McLean, A., Coenraads, S., Kiani, Z., Dupuy, F. P., Bernard, N. F. Expression of ligands for activating natural killer cell receptors on cell lines commonly used to assess natural killer cell function. BMC Immunology. 20, 8 (2019).
- Inoue, T., Swain, A., Nakanishi, Y., Sugiyama, D. Multicolor analysis of cell surface marker of human leukemia cell lines using flow cytometry. Anticancer Research. 34 (8), 4539 (2014).
- Mhatre, S. Rapid flow cytometry based cytotoxicity assay for evaluation of NK cell function. Indian Journal of Experimental Biology. 52 (10), 983-988 (2014).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Motazedian, A., et al. Multipotent RAG1+ progenitors emerge directly from haemogenic endothelium in human pluripotent stem cell-derived haematopoietic organoids. Nature Cell Biology. 22 (1), 60-73 (2020).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Yan, Y., et al. Antileukemia activity of a natural killer cell line against human leukemias. Clinical Cancer Research. 4 (11), 2859-2868 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon