Method Article
Generierung natürlicher Killerzellen aus humanen Stammzellen mit erweitertem Potenzial
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll zeigt, wie CD3−/CD45+CD56+-Zellen mit leichter Zytotoxizität von humanen Stammzellen mit expandiertem Potenzial (hEPSCs) sowohl unter 3D- als auch unter 2D-Kulturbedingungen unterschieden werden können. Dies ermöglicht eine routinemäßige phänotypische Validierung, ohne die komplexe Mikroumgebung zu zerstören.
Zusammenfassung
Die Differenzierung von natürlichen Killerzellen (NK-Zellen) von humanen pluripotenten Stammzellen ermöglicht die Erforschung und Herstellung von klinischen Zellprodukten für die Immuntherapie. Hier wird ein Zwei-Phasen-Protokoll beschrieben, das ein serumfreies kommerzielles Medium und einen Cocktail aus Zytokinen (Interleukin [IL]-3, IL-7, IL-15, Stammzellfaktor [SCF] und FMS-ähnlicher Tyrosinkinase-3-Ligand [Ftl3L]) verwendet, um humane Stammzellen mit erweitertem Potenzial (hEPSCs) in Zellen zu differenzieren, die NK-Zelleigenschaften in vitro sowohl mit 3-dimensionaler (3D) als auch mit 2-dimensionaler (2D) Kulturtechnologie besitzen. Nach diesem Protokoll werden konsistent CD3−CD56+ oder CD45+CD56+ NK-Zellen erzeugt. Bei Kokultivierung mit Tumortargets für 3 h zeigen die differenzierten Produkte eine leichte Zytotoxizität im Vergleich zu einer IL-2-unabhängigen permanenten Zelllinie, den NK92mi-Zellen. Das Protokoll bewahrt die Komplexität der Differenzierungsmikroumgebung durch die Generierung von 3D-Strukturen und erleichtert so die Untersuchung der räumlichen Beziehungen zwischen Immunzellen und ihren Nischen. In der Zwischenzeit ermöglicht das 2D-Kultursystem die routinemäßige phänotypische Validierung der Zelldifferenzierung, ohne die empfindliche Differenzierungsnische zu beeinträchtigen.
Einleitung
Im Vergleich zu herkömmlichen pluripotenten Stammzellen wie humanen embryonalen Stammzellen (hES-Zellen) und humanen induzierten pluripotenten Stammzellen (hiPS-Zellen) sind humane Stammzellen mit erweitertem Potenzial (hEPSCs) näher am Zustand der Totipotenz, da sie sich sowohl in extraembryonale als auch in embryonale Linien differenzieren können1. Zum Beispiel können hEPSCs in Trophoblasten1 und Dottersack-ähnliche Zellen2 unterschieden werden. Um die einzigartige Wirksamkeit von hEPSCs zu erreichen, wird ein einzelnes Blastomer in einem Medium kultiviert, das mehrere kleine Moleküle enthält, die die Lineage-Commitment-Signalübertragung1 hemmen, die als EPSC-Medium (EPSCM) bezeichnet wird. Die Kultivierung von hES-Zellen und hiPS-Zellen im EPSCM erweitert ihre zuvor eingeschränkte Potenz, um sie zu Trophoblastenzellen zu differenzieren1.
Pluripotente Stammzellen sind ein wertvolles Forschungswerkzeug, um mit neuartigen genetischen Veränderungen zu experimentieren. Aufgrund der Selbsterneuerungs- und Differenzierungsfähigkeiten pluripotenter Stammzellen kann ein transformierter Klon einer pluripotenten Stammzelle differenzierte Zellprodukte produzieren, die die gleiche genetische Veränderung am selben Locus besitzen. Zhu und Kaufman etablierten den Standard für die Differenzierung von NK-Zellen aus konventionellen pluripotenten Stammzellen (hES-Zellen und hiPS-Zellen)3. Zunächst induzierten sie hämatopoetische Stammzellen (HSZ) aus einem embryoiden Körper, der aus pluripotenten Stammzellen gewonnen wurde. Die Zugabe von Stammzellfaktor (SCF), FMS-ähnlichem Tyrosinkinase-3-Liganden (Ftl3L), Interleukin (IL)-7, IL-15 und einer frühen Ergänzung von IL-3 verzerrte die HSCs dazu, sich zu natürlichen Killerzellen (NK) zu entwickeln. Anschließend expandierten sie die NK-Zellen mit künstlichen Antigen-präsentierenden Zellen (aAPCs), die membrangebundenes IL-21 präsentieren, mit der kontinuierlichen Supplementierung von IL-2. Forscher haben diesen Ansatz auf die Immuntherapie angewendet, um iPSC-abgeleitete natürliche Killerzellen zu erzeugen, die mit dem chimären Antigenrezeptor (CAR-iNK) ausgestattet sind4.
Humane NK-Zellen sind definiert als CD3−CD56+-Leukozyten im peripheren Blut. Sie sind Effektoren gegen virusinfizierte Zellen und Tumorzellen5. Einige inhibitorische Rezeptoren auf NK-Zellen erkennen Moleküle, die ubiquitär in normalen Zellen exprimiert werden. Zum Beispiel erkennt das NKG2A/CD94-Heterodimer, das auf NK-Zellen exprimiert wird, MHC-Klasse-I-Moleküle5. In der Zwischenzeit erkennen die aktivierenden Rezeptoren auf NK-Zellen stressinduzierte Liganden, wie NKG2D transformationsinduzierte MHC-Klasse-I-Polypeptid-bezogene Sequenz A (MICA/MICB)6 erkennt. Einige transformierte Zellen regulieren ihre "Selbstliganden" herunter, um der Immunüberwachung zu entgehen und aberrante Liganden hochzuregulieren, was die NK-Zellen dazu veranlasst, ihre lytische Maschinerie auszuführen. Die intrinsischen Anti-Tumor-Fähigkeiten von NK-Zellen haben die Aufmerksamkeit auf diesen Immunzelltyp gelenkt.
Die Fähigkeit, gleichzeitig sowohl embryonale als auch extraembryonale Abstammungslinien hervorzubringen, kann dazu führen, dass hEPSCs die Nische der Embryonalentwicklung genauer rekapitulieren als herkömmliche pluripotente Stammzellen. Erfahrungsgemäß ist es einfacher, die Wirksamkeit von hEPSC als von hiPS-Zellen aufrechtzuerhalten. In der vorliegenden Studie wurde ein Protokoll entwickelt (Abbildung 1), um hEPSCs so zu beeinflussen, dass sie sich zu hämatopoetischen Linien entwickeln und später Vorläuferzellen in vitro zu natürlichen Killerzellen (NK-Zellen) differenzieren. Im Protokoll werden kommerzielle Medien verwendet, um Seruminkonsistenzen zu vermeiden, gefolgt von der schrittweisen Zugabe von Zytokinen, um die Differenzierung in lymphatische Linien zu verzerren. Dieses Protokoll verfügt über zwei Systeme, um die komplexe 3D-Mikroumgebung zu erhalten und gleichzeitig CD3-CD56+/CD45+CD56+-Zellen abzuleiten, die phänotypisch und funktionell menschlichen NK-Zellen ähneln.
Dieses Protokoll kann nützlich sein, um die Interaktion von Immunzellen mit ihren Differenzierungsnischen zu untersuchen und könnte das Potenzial haben, zelluläre Produkte für immuntherapeutische Zwecke zu reinigen.
Protokoll
Die vorliegende Studie umfasste In-vitro-Experimente ; Daher ist die ethische Genehmigung nicht anwendbar. Die etablierten Zelllinien, die in dieser Studie verwendet wurden, stammen aus kommerziellen Quellen (siehe Materialtabelle).
1. Generierung von 3D-Organoidstrukturen aus hEPSCs
- Aufrechterhaltung von hEPSCs, indem sie mit 1 ml EPSC-Medium (12-Well-Platte) auf SNL-Feeder-Zellen1 kultiviert werden.
HINWEIS: Kuppelförmige Kolonien werden beobachtet (Abbildung 2A), wenn ihre erweiterte Potenz erhalten bleibt. - Führen Sie eine Vordifferenzierung der hEPSCs durch.
- Entfernen Sie das hEPSC-Medium und fügen Sie 1 ml DFK-Medium hinzu (DMEM/F12 + 10% Serumersatzmedium, siehe Materialtabelle). 2-3 Tage bei 37 °C und 5%CO2 inkubieren. Führen Sie am zweiten Tag einen Mediumswechsel durch, wenn Sie die Inkubation 3 Tage lang fortsetzen.
HINWEIS: Unter dem Mikroskop sind die kuppelförmigen Kolonien abgeflacht (Abbildung 2B).
- Entfernen Sie das hEPSC-Medium und fügen Sie 1 ml DFK-Medium hinzu (DMEM/F12 + 10% Serumersatzmedium, siehe Materialtabelle). 2-3 Tage bei 37 °C und 5%CO2 inkubieren. Führen Sie am zweiten Tag einen Mediumswechsel durch, wenn Sie die Inkubation 3 Tage lang fortsetzen.
- Kontrollieren Sie die Bildung von embryonalen Körpern mit der hängenden Tropfentechnik 7,8.
- Entfernen Sie das DFK-Medium und waschen Sie es einmal mit 1 ml PBS. Fügen Sie 500 μL 0,05% Trypsin hinzu und inkubieren Sie die Platte bei 37 °C und 5%CO2 für 3-7 min, basierend auf der Morphologie.
HINWEIS: Die hEPSCs müssen sich von den Zuführzellen lösen lassen, wenn die Platte leicht gestört ist. - Entfernen Sie das Trypsin und fügen Sie 2 ml DFK-Medium hinzu, um die Zellen zu ernten. Die Zellen bei 300 x g für 3 min bei Raumtemperatur schleudern.
- Entfernen Sie den Überstand mit einer Pipette. Fügen Sie 1 ml DFK-Medium und 1 μL Y27632 hinzu (siehe Materialtabelle), um die Zellen durch Schnippen zu resuspendieren.
- Zählen Sie die Anzahl der Zellen in der Zellsuspension mit einem Hämozytometer9. Verdünnen Sie die Zellsuspension mit DFK-Medium und Y27632 (1.000x), so dass 4.000 Zellen/25 μL DFK-Medium vorhanden sind.
- Füllen Sie die Kappe einer 10 cm großen Petrischale mit ca. 30-40 Tropfen 25 μL Zellsuspension pro Kappe. Gießen Sie etwas PBS in die untere Schale, um die Verdunstung der Tröpfchen zu verhindern. Drehen Sie die Kappe vorsichtig um und decken Sie die Schüssel ab. Die Schale bei 37 °C und 5%CO2 3 Tage inkubieren.
- Entfernen Sie das DFK-Medium und waschen Sie es einmal mit 1 ml PBS. Fügen Sie 500 μL 0,05% Trypsin hinzu und inkubieren Sie die Platte bei 37 °C und 5%CO2 für 3-7 min, basierend auf der Morphologie.
2. Mesoderm und hämato-endotheliale Musterung des embryoiden Körpers (EB)
- Sammeln Sie EBs im Tröpfchen.
- Sammeln Sie alle EBs aus dem Tröpfchen in ein 15-ml-Röhrchen mit einer 1-ml-Pipette und etwas PBS. Pumpen Sie ein wenig PBS in das Tröpfchen und saugen Sie dann das Medium, einschließlich der EBs, mit der Pipette ab.
HINWEIS: Tröpfchen, die eher gelb sind, weisen auf eine erfolgreichere Bildung und ein erfolgreicheres Wachstum hin als rosa Tröpfchen. - Die gesammelten EBs werden bei 100 x g für 1 Minute bei Raumtemperatur nach unten geschleudert und der Überstand mit einer Pipette entfernt. Fügen Sie 1 ml Medium A (aus einem kommerziell erhältlichen Zelldifferenzierungskit, siehe Materialtabelle) hinzu, um die gesammelten EBs auf eine nicht haftende 24-Well-Platte zu übertragen. Bezeichnen Sie diesen Tag als Tag 0 (Abbildung 1).
HINWEIS: Normalerweise werden alle EBs, die aus einer 10-cm-Schüssel gesammelt werden, gruppiert und in eine Vertiefung einer 24-Well-Platte überführt.
- Sammeln Sie alle EBs aus dem Tröpfchen in ein 15-ml-Röhrchen mit einer 1-ml-Pipette und etwas PBS. Pumpen Sie ein wenig PBS in das Tröpfchen und saugen Sie dann das Medium, einschließlich der EBs, mit der Pipette ab.
- Führen Sie eine Mesoderm-Musterung der EBs durch.
- Die Platte 3 Tage bei 37 °C mit 5%CO2 inkubieren. An Tag 2 werden 500 μl des Mediums A (aus dem Kit, Schritt 2.1.2) entnommen und dabei das Pipettieren der EBs vermieden. Dann fügen Sie 500 μL frisches Medium A hinzu.
- Hämato-endotheliale Spezifizierung des embryoiden Körpers.
- Entfernen Sie 700 μl Medium A aus der Vertiefung und fügen Sie 700 μl Medium B hinzu (aus dem Kit, Schritt 2.1.2). Kultur für 7 Tage. Führen Sie an Tag 5, Tag 7 und Tag 9 einen halben Wechsel des Mediums B durch.
3. NK-Zell-Differenzierung
- Übertragen Sie die strukturierten EBs auf eine Luft-Flüssigkeits-Grenzfläche.
- Kippen Sie die Platte leicht, so dass die EBs auf der Unterseite aggregieren. Verwenden Sie eine 1-ml-Pipette, um so viel Medium B wie möglich zu entfernen und dabei die EBs zu vermeiden.
- Nehmen Sie die EBs mit einer Pipette auf, indem Sie das restliche Medium absaugen. Übertragen Sie sie in eine Transwell in einer 24-Well-Platte (siehe Materialtabelle).
HINWEIS: Beschränken Sie die Anzahl auf zwei bis drei EBs pro Transwell, um eine optimale Dichte zu erzielen.
- Führen Sie eine lymphatische Vorläuferexpansion durch.
- 500 μL NK-1-Medium (handelsübliches lymphatisches Expansionsmedium + 14 I.E./ml IL-3, 4.500 I.E./ml IL-15, 8.800 I.E./ml IL-7, 26 I.E./ml SCF und 12 I.E./ml ftl3L, siehe Materialtabelle) in das untere Kompartiment des Transwells geben. Kultur für 14 Tage, und führen Sie jeden zweiten Tag einen Medienwechsel durch.
- Ernten Sie die Zellen und übertragen Sie sie an den Tagen 7-10 auf eine beschichtete Platte.
- Um die Platte zu beschichten, verdünnen Sie das Beschichtungsmaterial (kommerziell erhältliches lymphatisches Differenzierungsbeschichtungsmaterial, 100x, siehe Materialtabelle) in PBS. Geben Sie 1 ml verdünnte Beschichtungslösung in jede Vertiefung einer 12-Well-Platte und inkubieren Sie die Platte über Nacht bei 4 °C. Decken Sie die Öffnung der Platte mit Umwickelfolie ab.
- Geben Sie 200 μL PBS in den Transwell und pipettieren Sie langsam etwa fünf bis sechs Mal auf und ab, um die von den Organoiden freigesetzten Zellen zu ernten. Vermeiden Sie es, die Organoide zu pipettieren.
HINWEIS: Runde Zellen werden kontinuierlich aus den Organoiden freigesetzt (Abbildung 2D). - Die geerntete Zellsuspension in ein 2-ml-Röhrchen überführen und die Zellen bei 500 x g für 5 min bei Raumtemperatur schleudern. Entfernen Sie den Überstand mit einer Pipette und fügen Sie 1 ml NK-1-Medium hinzu (Schritt 3.2.1), um die Zellen durch Pipettieren zu resuspendieren.
- Entfernen Sie die gesamte Beschichtungslösung aus der Vertiefung und waschen Sie jede Vertiefung einer 12-Well-Platte zweimal mit 1 ml PBS.
- Teilen Sie die geernteten Zellen im Verhältnis 1:2 auf. Die Zellsuspension wird auf eine beschichtete 12-Well-Platte übertragen (Schritt 3.3.1). Fügen Sie 1 ml NK-1-Medium hinzu, so dass jede Vertiefung 1,5 mL Medium enthält.
- Um einen Mediumwechsel durchzuführen, lassen Sie die Zellen 1-2 Minuten sitzen, damit die Zellen auf den Boden sinken können. 750 μL Medium vorsichtig absaugen. Der gesammelte Überstand wird bei 500 x g für 5 min bei Raumtemperatur geschleudert.
- Der größte Teil des Überstands wird verworfen und in 750 μl NK-1-Medium unter fünf- bis sechsmaligem Pipettieren resuspendiert. Geben Sie die im frischen Medium resuspendierten Zellen in die ursprüngliche Vertiefung.
HINWEIS: Dieses parallele System wird in Abbildung 1 als 2D-System bezeichnet. Befolgen Sie den Mediumwechselplan der Vertiefung der Organoide, aus denen die Zellen stammen.
- Führen Sie die NK-Zellreifung durch, indem Sie die folgenden Schritte ausführen.
- Entfernen Sie das alte Medium des 3D-Systems und fügen Sie 500 μL NK-2 (kommerziell erhältliches NK-Zelldifferenzierungsmedium + 4.500 IE/ml IL-15, 8.800 IE/ml IL-7, 26 IE/ml SCF und 12 IE/ml ftl3L, siehe Materialtabelle) in das untere Fach des Transwells ein. Bei 37 °C und 5 %CO2 14 Tage inkubieren.
HINWEIS: Stellen Sie sicher, dass das Medium den Boden des Transwells berührt. - Führen Sie einen vollständigen Medienwechsel an den Zellen im 2D-System durch. Sammeln Sie alle 1,5 ml Zellen aus einer Vertiefung und zentrifugieren Sie sie bei 500 x g für 5 min bei Raumtemperatur. Der größte Teil des Überstands wird mit einer Pipette entfernt und das Pellet mit 1,5 ml NK-2-Medium resuspendiert (Schritt 3.4.1).
- Führen Sie jeden zweiten Tag einen Medienwechsel durch. Kippen Sie die Platte des 3D-Systems leicht und entfernen Sie das gesamte alte Medium außerhalb des Transwells. Fügen Sie 500 μL NK-2-Medium außerhalb des Transwells hinzu.
- Um einen halben Mediumwechsel an einer Vertiefung einer 12-Well-Platte für das 2D-System durchzuführen, lassen Sie die Zellen 1-2 Minuten lang sitzen, damit die Zellen auf den Boden sinken können. 750 μL des Mediums vorsichtig absaugen.
- Schleudern Sie den gesammelten Überstand bei 500 x g für 5 min bei Raumtemperatur, um Zellverlust zu vermeiden. Verwerfen Sie den größten Teil des Überstands und resuspendieren Sie in 750 μL NK-2-Medium durch fünf- bis sechsmaliges Pipettieren. Die in frischem Medium resuspendierten Zellen in die ursprüngliche Vertiefung geben.
- Entfernen Sie das alte Medium des 3D-Systems und fügen Sie 500 μL NK-2 (kommerziell erhältliches NK-Zelldifferenzierungsmedium + 4.500 IE/ml IL-15, 8.800 IE/ml IL-7, 26 IE/ml SCF und 12 IE/ml ftl3L, siehe Materialtabelle) in das untere Fach des Transwells ein. Bei 37 °C und 5 %CO2 14 Tage inkubieren.
4. Ernte reifer Zellen
- Ernten Sie die im 2D-System kultivierten Zellen.
- Ernten Sie die Zellen, indem Sie an den Tagen 38-45 auf und ab pipettieren. Zweimal mit 1 ml PBS waschen. Die Zellsuspension wird bei 500 x g 5 min bei Raumtemperatur zentrifugiert.
- Entfernen Sie den Überstand mit einer Pipette und resuspendieren Sie ihn im Puffer Ihrer Wahl (d. h. PBS + 2% FBS für die Durchflusszytometrie, siehe Materialtabelle).
- Ernten Sie die Zellen, die in das Organoid eingebettet sind.
- Sammeln Sie das Medium von außerhalb des Transwells in einem 15-ml-Röhrchen an den Tagen 38-45. Waschen Sie das Organoid zweimal, indem Sie 200 μL PBS in den Transwell geben und fünf- bis sechsmal auf und ab pipettieren. Überführen Sie die Suspension in das 15-ml-Röhrchen.
- Geben Sie 500 μL PBS in eine Vertiefung einer 12-Well-Platte. Übertragen Sie das Organoid mit einer Pinzette aus dem Transwell in die Vertiefung der 12-Well-Platte.
- Schneiden Sie das Organoid 20 Mal mit einer Schere und einer Pinzette. Spülen Sie die restlichen Zellen auf der Pinzette und Schere mit PBS in die Vertiefung. Sammeln Sie so viel PBS wie möglich und übertragen Sie es in das in Schritt 4.2.1 verwendete 15-ml-Röhrchen, ohne die Organoidstruktur abzusaugen.
- Geben Sie 500 μL des Dissoziationsreagenzes (siehe Materialtabelle) in das Transwell, um das Organoid enzymatisch zu verdauen. Inkubieren Sie mit einer handelsüblichen Zellablösungslösung (siehe Materialtabelle) für 7-10 min bei 37 °C und 5%CO2. Die Reaktion wird durch Zugabe von 1 ml PBS mit 2% FBS abgeschreckt und die Lösung in einem weiteren 15-ml-Röhrchen gesammelt. Waschen Sie den Brunnen zweimal mit 1 ml PBS mit 2% FBS.
HINWEIS: Bestimmen Sie die Länge der Inkubation anhand der Morphologie. Versuchen Sie, den Punkt zu erreichen, an dem einzelne Zellen aus der Membran der 3D-Struktur freigesetzt werden. - Fügen Sie 1 ml PBS mit 2% FBS hinzu und pipettieren Sie 8-10 Mal auf und ab. Sammeln Sie alle Lösungen, einschließlich der organoiden Strukturen. Übertragen Sie sie mit einem Zellsieb in das in Schritt 4.2.3 verwendete 15-ml-Röhrchen.
- Beide Röhrchen werden bei 500 x g für 5 min bei Raumtemperatur zentrifugiert. Entsorgen Sie den Überstand mit einer Pipette. Resuspendieren Sie das Zellpellet mit dem Puffer Ihrer Wahl (Schritt 4.1.2).
Ergebnisse
Es wurde die Hypothese aufgestellt, dass die vorhandenen In-vitro-Differenzierungsprodukte (IVD) ähnliche Oberflächenmarker und Anti-Tumor-Fähigkeiten wie menschliche NK-Zellen besitzen würden.
Der definierende Marker menschlicher NK-Zellen wurde abgerufen, um zu testen, ob die Differenzierungsprodukte aus dem 3D-Kultursystem Zellen ergaben, die phänotypisch menschlichen NK-Zellen ähnelten. Etwa 15% der Zellen, die aus zwei Chargen, die zu unterschiedlichen Zeitpunkten (n = 2) induziert wurden, aus dem 3D-Kultursystem dissoziierten, waren CD3−CD56+ (Abbildung 3A). CD3 wurde im Testpanel aufgrund des Fehlens von CD3 und der Schwierigkeit, T-Zellen in vitro zu induzieren, durch CD45 (einen Pan-Leukozyten-Marker) ersetzt. Etwa 16% der Zellen, die von der 3D-Struktur dissoziiert wurden, waren CD45+CD56+ (Abbildung 3B, n = 1), was mit den Prozentsätzen von CD3−CD56+-Zellen übereinstimmt, die in früheren Studien beobachtet wurden. Der Anteil der CD3−CD56+-Zellen in den Zellen, die aus dem 2D-Kultursystem entnommen wurden, reichte von 30% bis 6%, von erfolgreicheren Induktionen (Abbildung 3C, n = 3) bis zu weniger erfolgreichen Induktionen (Abbildung 3D, n = 2). Die Funktionalität und Phänotypen der aus dem 2D-Kultursystem gewonnenen Zellen wurden validiert. Während der Tag-18-Kultur aus dem 2D-System exprimierten etwa 12% der Zellen sowohl ektopisches CD56 als auch CD107a nach 2 h 50 ng/ml IL-18, 455 I.E./ml IL-2 und 20 ng/ml Anti-CD244-Antikörperstimulation (Abbildung 4C, n = 1). Etwa 28% der geernteten Zellen waren CD94+CD159a+ (Abbildung 4B, n = 1). Die ektopische Expression von CD107a, einer Proteinauskleidung auf der Membran von Granula, zeigt eine Degranulation10 an, während das CD94/NKG2A(CD159a)-Heterodimer ein weiterer definierender Marker für NK-Zellen ist. Dies ist ein Beispiel für die phänotypische und funktionale Validierung von IVD-Produkten.
Die Funktionalität der IVD-Produkte wurde durch ihre Zytotoxizität gegen humane Erythroleukämie-Zellen-K562-Zellen getestet. Umfassende Ligandenprofile auf K562-Zellen zeigen ihre herunterregulierte Haupthistochemie-Komplex I (MHC-I) und vergleichsweise starke NKG2D-Ligandenexpression (wie ULBP-1, ULBP-2/5/6 und ULBP-3)11; Somit sind K562-Zellen anfällig für die lytische Aktivität von NK-Zellen12. Sowohl IVD-Endpunktprodukte als auch NK92mi-Zellen wurden über Nacht mit 50 ng/ml IL-18-, 455 I.E./ml IL-2- und 20 ng/ml-Anti-CD244-Antikörpern präpariert. Die GFP+ K562-Zellen wurden entweder mit geernteten Zellen aus IVD- oder NK92mi-Zellen bei unterschiedlichen Effektor-zu-Ziel-Verhältnissen (E:T) in Gegenwart von 50 ng/ml (IE nicht angegeben) IL-18-, 455 IE/ml IL-2- und 20 ng/ml-Anti-CD244-Antikörpern im gleichen Volumen des H5100-Mediums für 3 h kokultiviert. Das Auslesen der NK-Zelltötungsaktivität war die Expression des toten Zellmarkers auf GFP+-Untergruppen. Die K562-Zellen wurden mit einem kommerziell erhältlichen Kontrollvektor (siehe Materialtabelle) transduziert, um GFP konstitutiv zu exprimieren, und die Effizienz der Transduktion betrug etwa 80% (ergänzende Abbildung 1A). Die Prozentsätze des hinzugefügten GFP-Signals waren proportional zur Anzahl der hinzugefügten GFP+ K562-Zellen, was auf eine spezifische GFP-Expression der transduzierten K562-Zellen hindeutet (ergänzende Abbildung 1B).
Die in Abbildung 5 dargestellten Prozentsätze der absterbenden Zielzellen wurden mit der folgenden Formel13 berechnet:
Prozentsatz der sterbenden Zellen = (FITC + DAPI + % der Kokultur [z. B . Abbildung 5A]) - (FITC + DAPI + % der transduzierten K562-Zellen)
Von allen drei untersuchten E:T-Verhältnissen (0,1:1, 0,33:1, 1:1) korrelierten die Prozentsätze der sterbenden GFP+-Zellen positiv mit den E:T-Verhältnissen, wenn sie mit IVD-Produkten (Abbildung 5B, hEPSC-NK) oder NK92mi-Zellen (Abbildung 5B, NK92mi) kokultiviert wurden, was auf die spezifische Abtötung von Tumorzielen hinweist. Die Zytotoxizität der IVD-Produkte war jedoch innerhalb des getesteten Zeitraums vergleichsweise gering (Abbildung 5C).
Abschließend wurde die lymphatische Vorläuferzellgeneration zwischen den 3D- und 2D-Kulturen verglichen. Es zeigte sich, dass die 3D-Kulturbedingung mehr Vorläuferzellen (55.000 Zellen) erzeugte als die 2D-Kulturbedingung (36.000 Zellen) (ergänzende Abbildung 2). Dies deutet darauf hin, dass der Kontext der Gewebearchitektur und der zellulären Komponenten in der 3D-Kultur die Erzeugung von lymphatischen Vorläuferzellen unterstützte.
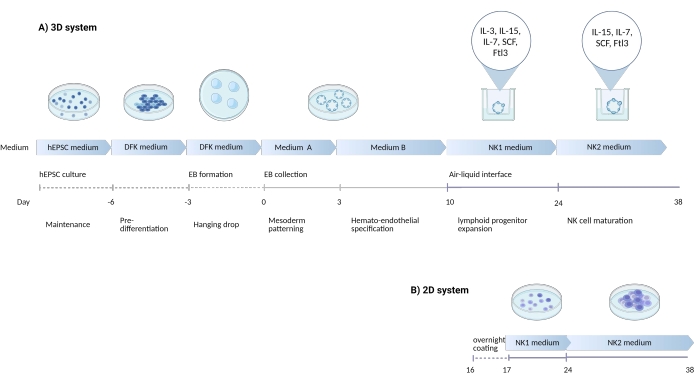
Abbildung 1: Schematische Darstellung der Differenzierungsstrategie zur Differenzierung von NK-Zellen von hEPSCs . (A) Hier wird die Zeitleiste der 3D-Kultursysteme gezeigt, die die Kulturbedingungen und kurze Schlüsselwörter aus jedem Schritt detailliert beschreibt. Die Luft-Flüssigkeits-Grenzfläche des 3D-Systems wird während der NK-Zellinduktion aufrechterhalten. (B) Hier ist die Zeitachse der 2D-Kultursysteme dargestellt. Die freigesetzten Zellen, die an den Tagen 7-10 aus Strukturen im 3D-System geerntet werden, werden auf einer beschichteten Platte ohne Luft-Flüssigkeits-Grenzfläche ausgesät. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
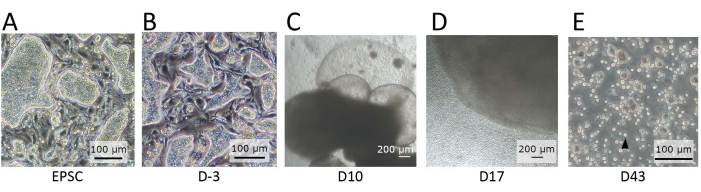
Abbildung 2: Morphologie der Zellen, die in verschiedenen Stadien der Differenzierung beobachtet wurden. (A) Die Morphologie von hEPSCs, wenn sie in EPSCM beibehalten werden. Die hEPSCs bilden kuppelförmige Kolonien. (B) Die Morphologie von hEPSC nach der Vordifferenzierung. Die kuppelförmigen Kolonien sind abgeflacht. Die hEPSCs werden geerntet und bilden EBs mit der Hanging-Drop-Technik. Die EBs werden gesammelt und in Medium A und dann in Medium B kultiviert. (C) Die Morphologie eines EB am Tag 10. Während dieser Zeit beginnt sich das EB auszudehnen und aufzublähen und membranöse Strukturen zu bilden. (D) Die Morphologie eines zellfreisetzenden EB. Nach der Aussaat auf dem Transwell wächst der EB und gibt ständig runde Zellen an die Umgebung ab. Einige der freigesetzten Zellen werden gesammelt und auf einer 12-Well-Platte kultiviert, die mit lymphatischen Differenzierungsbeschichtungsmaterialien beschichtet ist. Die Zellpopulationen sind morphologisch heterogen und neigen dazu, sich zu aggregieren. (E) Die Morphologie der Zellen, die am Endpunkt der IVD beobachtet wurden. Es werden kleine, kreisförmige Suspensionszellen (schwarzer Pfeil) beobachtet. Maßstabsbalken: (A,B,E) = 100 μm; (C,D) = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
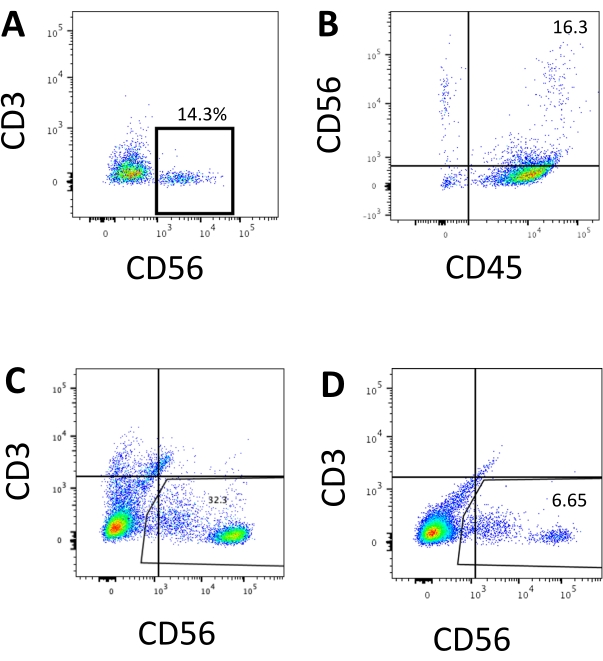
Abbildung 3: Repräsentative FACS-Diagramme von hEPSC-abgeleiteten Produkten am Endpunkt. Die Zellen werden mit fluoroskop-konjugierten Antikörpern für 30 Minuten auf Eis inkubiert. Die Proben werden mit DAPI gefärbt, bevor sie in den FACS-Probeninjektionsport geladen werden. Ungefärbte Zellen werden verwendet, um das negative Gating zu etablieren. (A) Repräsentatives FACS-Diagramm zur CD3- und CD56-Expression in Zellen, die aus zwei Chargen (n = 2) vom 3D-Kultursystem dissoziiert wurden. (B) Repräsentatives FACS-Diagramm zur CD45- und CD56-Expression in Zellen, die von der 3D-Kultur dissoziiert wurden (n = 1). (C) Repräsentatives FACS-Diagramm zur CD3- und CD56-Expression in Zellen, die aus der beschichteten Platte aus einer erfolgreichen Induktion gewonnen wurden (n = 3). (D) Repräsentatives FACS-Diagramm der CD3- und CD56-Expression der beschichteten Platte bei suboptimaler Induktion (n = 2). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
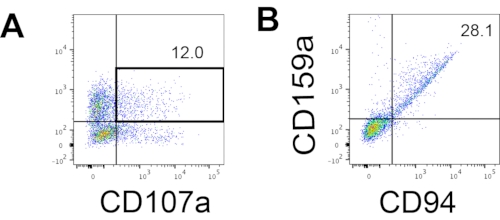
Abbildung 4: Repräsentatives FACS-Diagramm auf hEPSC-abgeleiteten Produkten während der Tag-18-Kultur (n = 1). (A) FACS-Diagramm zur CD56- und CD107a-Expression nach 2 Stunden Stimulation mit IL2-, IL-18- und Anti-CD244-Antikörpern. (B) FACS-Diagramm auf CD159a- und CD94-Expression. Die Proben werden mit DAPI gefärbt, bevor sie in den FACS-Probeninjektionsanschluss geladen werden. Ungefärbte Zellen werden verwendet, um das negative Gating zu etablieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
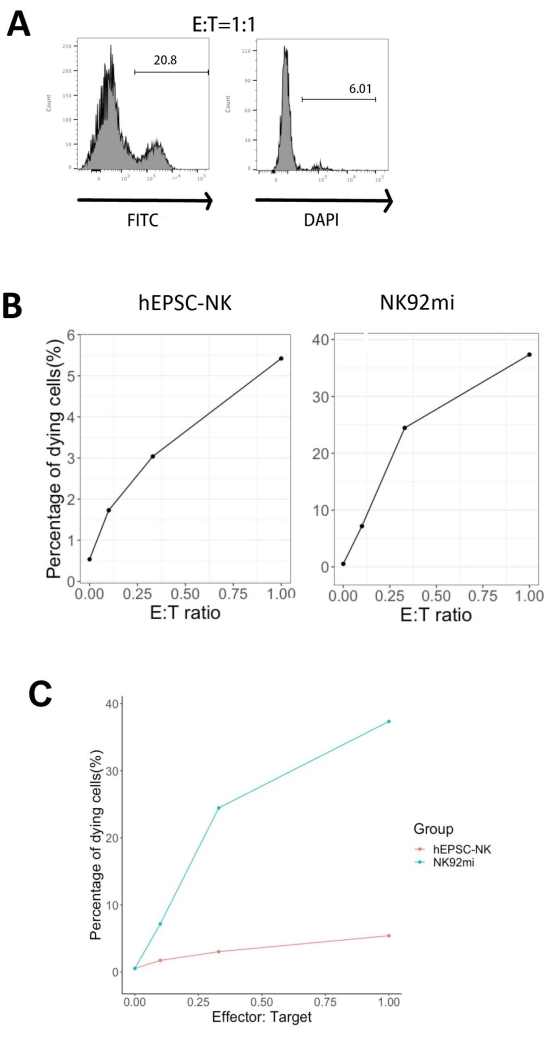
Abbildung 5: Diagramm der Prozentsätze der sterbenden Zellen im Vergleich zu verschiedenen E:T-Verhältnissen aus der Kokultur von GFP+ K562-Zellen entweder mit dem IVD-Endpunktprodukt oder mit NK92mi-Zellen (n = 1). Die Expression von FITC+ DAPI+ Zellen wurde mit einem Zellanalysator bewertet und die Datenanalyse mit kompatibler Software durchgeführt. (A) Ein repräsentatives FACS-Diagramm, das das Gating von FITC + DAPI + Untergruppen aus der Kokultur von IVD-Produkten und K562-Zellen mit einem E:T-Verhältnis von 1 zeigt. (B) Einzelne Parzellen aus dem Cokultur-Experiment mit GFP+ IVD-Produkten (links) oder NK92mi-Zellen (rechts) für 3 h. Beide spiegeln eine positive proportionale Beziehung zwischen dem Prozentsatz der sterbenden Zellen und dem E:T-Verhältnis wider. (C) Ein Diagramm, das die Abtötungskurven von IVD-Produkten und NK92mi-Zellen auf der gleichen Skala zeigt. Die IVD-Produkte zeigten im Vergleich zu den NK92mi-Zellen eine leichte Zytotoxizität. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Funktioneller Assay von NK-Zellen aus hEPSCs. (A) FACS-Histogramm transduzierter K562-Zellen. Die FITC+ K562-Zellen exprimierten GFP. (B) FACS-Histogramme aus der Kokultur von GFP+ K562-Zellen und den Endpunkt-IVD-Produkten bei drei E:T-Verhältnissen (n = 1). Die Prozentsätze der FITC+-Zellen in der Kokultur entsprachen der Anzahl der hinzugefügten transduzierten K562-Zellen. Die Gatings wurden mit untransduzierten K562-Zellen etabliert. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Lymphoide Vorläuferdifferenzierung in 2D- versus 3D-Kultur. Das vorliegende Organoid-basierte Protokoll wurde verwendet, um lymphatische Vorläuferzellen aus humanen Stammzellen mit erweitertem Potenzial zu induzieren. Es wurden zwei Bedingungen festgelegt: (1) lymphatische Vorläuferzellen wurden in Kultur innerhalb der Organoide gehalten (3D) und (2) lymphatische Vorläuferzellen wurden isoliert und auf der Kulturschale (2D) gehalten. Nach 2 Wochen zusätzlicher Kultur wurden die Zellzahlen bestimmt, um die 2D- mit der 3D-Kultur zu vergleichen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Es gibt einige entscheidende Schritte, um die erfolgreiche Differenzierung von CD45+CD56+-Zellen von hEPSCs sicherzustellen. Die Vordifferenzierung (Schritt 1.2) ist entscheidend, da das EPSC-Medium Inhibitoren der Abstammungsbindung1 enthält. Nach der Vordifferenzierung werden die kuppelförmigen Kolonien von hEPSCs abgeflacht (Abbildung 2B). Die Zugabe von Y27632, einem Rho-Kinase-Inhibitor (ROCKi), während der Bildung von EBs aus hEPSCs (Schritt 1.3) ist für das Überleben der hEPSCs nach Dissoziation unerlässlich. Eine weitere wichtige Überlegung ist die Anzahl der EBs, die auf jedem Transwell gepflanzt werden. Da es sich um ein kleines System handelt, sind zwei bis drei EBs pro Transwell die optimale Dichte, um einen übermäßigen Verbrauch der Medien zu vermeiden. Die Luft-Flüssigkeits-Grenzfläche wird während des gesamten Verlaufs der NK-Zelldifferenzierung für das 3D-System aufrechterhalten, von dem angenommen wird, dass es die Polarität der Stromazellen beibehält und die Expansion der AGM-abgeleiteten hämatopoetischen Vorläuferzellen unterstützt14,15.
Wie bereits erwähnt, ist die Dichte der EBs auf dem Transwell ein entscheidender Faktor für eine erfolgreiche Differenzierung. Das Schlüsselzeichen dafür ist die Farbe des Mediums 1 Tag nach der Implantation von EBs auf dem Transwell. Wenn die Farbe schnell gelb wird, deutet dies entweder auf eine Kontamination oder eine Überfüllung hin. Um das Problem zu lösen, sollte eine 1-ml-Pipette verwendet werden, um zusätzliche EBs manuell aufzunehmen und in einen anderen Transwell zu überführen.
Eine wesentliche Einschränkung dieses Protokolls ist die Reinheit der CD3−/CD45+ CD56+ Zellen in den IVD-Produkten, von der angenommen wird, dass sie teilweise für die geringere Zytotoxizität im Vergleich zu reinen NK92mi-Zellen verantwortlich ist. Ein 3D-Kultursystem wurde verwendet, um hämatopoetische Vorläuferzellen durch die Erzeugung eines EB zu induzieren, das den drei embryonalen Keimblättern ähnelt. Diese Strategie ahmt die Entwicklung von Blutzellen in der Mikroumgebung des Knochenmarks nach, wodurch die Notwendigkeit von Stromazellen zur Unterstützung der Differenzierung beseitigtwird 3. Ohne einen Sortierschritt zur Reinigung der hämatopoetischen Vorläuferzellen wird erwartet, dass die Reinheit der IVD-Produkte verringert wird. Eine Strategie, um die komplexe Differenzierungsnische beizubehalten und gleichzeitig die Reinheit des Endpunktprodukts zu erhöhen, ist die Entwicklung einer Expansionsmethode für die sortierten CD3−CD56+ IVD-Produkte. Zum Beispiel können die sortierten CD3−CD56+ IVD-Produkte auf künstlichen Antigen-präsentierenden Zellen (aAPCs) kultiviert werden, wie z.B. irradizierte K562-Zellen, die mit membrangebundenem IL-21 hergestellt wurden. Mit der Zufuhr von IL-2 in der Kultur kann mit dieser Methode eine 1.000-fache Erhöhung der NK-Zellzahlerreicht werden 3.
Eine weitere Einschränkung ist der eingeschränkte Zugang zu echten menschlichen NK-Zellen als positive Referenz. NK92mi ist die positive Referenz, die im Cokultur-Assay verwendet wird, aber es ist nicht genau genug. NK92mi-Zellen werden aus NK92-Zellen hergestellt, einer permanenten Zelllinie, die aktivierte NK-Zell-Phänotypen16 exprimiert, um IL-2 autonom zu produzieren, um die Kulturanforderungen zu erfüllen. NK92-Zellen zeigen in vitro eine überlegene Abtötungsaktivität gegenüber K562-Zellen als menschliche primäre NK-Zellen17. Ein fairerer Vergleich der tumorabtötenden Fähigkeit von IVD-Produkten könnte erreicht werden, indem die Zytotoxizität peripherer Blut-NK-Zellen parallel untersucht wird, aber leider fehlt der Zugang zu Blutbanken.
Dieses Zwei-System-Kulturprotokoll zielt darauf ab, CD3−/CD45+CD56+-Zellen aus hEPSCs zu erzeugen. Die Bewertung der Oberflächenmarker und der Zytotoxizität mit FACS kann routinemäßig an Zellen aus 2D-Systemen durchgeführt werden, ohne die Differenzierungsnische zu stören. Trotz der Unterschiede in den Prozentsätzen der CD3−CD56+-Zellen können die 3D- und 2D-Systeme CD3−CD56+-Zellen mit ähnlichen Variationen in der CD56-Expression ableiten (Abbildung 3), und das 2D-System spiegelt die Existenz von lymphatischen Vorläuferzellen aus dem 3D-Kulturzustand wider.
Die Bedeutung des 3D-Kultursystems besteht darin, dass es die Verwendung von hochauflösenden Profiling-Assays wie räumlicher Transkriptomik oder bildgebender Massenspektrometrie ermöglicht, um die räumlichen Beziehungen und Zell-Zell-Interaktionen innerhalb der komplexen Differenzierungsnische zu untersuchen.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Wir danken Dr. Handi Cao, Sanxing GAO, David Xiang, Yiming Chao, Ritika Jogani, Owen Chan, Stephanie Cheung und Celine Chan für ihre technische Unterstützung und ihre nützlichen Diskussionen. Diese Arbeit wurde durch den Platform Technology Fund unterstützt. Abbildung 1 wurde mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 30 w/v% Albumin Solution, from Bovine Serum(BSA), Fatty Acid Free | Wako Chemicals | 017-22231 | For resuspending cytokines. |
| ACCUMAX | STEMCELL Technologies | 07921 | |
| Anti-human-CD159a-PE | BD | 375104 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD3-APC antibodies | BD | 555355 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 2% FBS) |
| Anti-human-CD45-APC antibodies | BD | 555485 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 3% FBS) |
| Anti-human-CD56-PE antibodies | BD | 555516 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 4% FBS) |
| Anti-human-CD56-PEcy7 antibodies | BD | 335826 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD94-APC | BD | 559876 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Bemis Parafilm M Laboratory Wrapping Film | Thermo Scientific | 11772644 | |
| Cd244 Monoclonal Antibody (eBioC1.7 (C1.7)), Functional Grade, eBioscience | Thermo Scientific | 16-5838-85 | |
| Costar 6.5 mm Transwell, 0.4 µm Pore Polyester Membrane Inserts | STEMCELL Technologies | 3470 | |
| Dapi Solution, 1 mg/mL | BD | 564907 | It is resuspended with ddH2O so the concentration is 10 µM/mL. Add 1 µL of the aliquot in 300 µL of FACS buffer (PBS + 2% FBS) |
| DMEM | CPOS-Bioreagent core | 11965092 | |
| DMEM/F12 | Thermo Scientific | 11320033 | |
| FcX, human | Biolengend | 422302 | |
| Fetal Bovine Serum(FBS) qualified E.U.-approved South America | CPOS-Bioreagent core | 10270106 | |
| FlowJo v10.8.0 | BD | ||
| Gibco PBS (10x) pH 7.4 | CPOS-Bioreagent core | 70011044 | 10x concentrated PBS is manufactured as follows: without calcium, magnesium or phenol red |
| K562 cells | ATCC | CCL-243 | |
| Knockout Serum Replacement | Thermo Scientific | 10828-028 | |
| MyeloCult H5100 medium | STEMCELL Technologies | 5150 | |
| NK92mi cells | ATCC | CRL-2408 | Lot: 70045208. Once thawed, they are cultured in MyeloCult H5100 medium, and maintained the density between 2 x 105 to 1 x 106 cell/mL. |
| Nunc Cell-Culture Treated Multidishes 12 well plate | Thermo Scientific | 150628 | flat bottom |
| Nunc Cell-Culture Treated Multidishes 24 well plate | Thermo Scientific | 142475 | |
| Nunc EasYDish Dishes | Thermo Scientific | 150460 | |
| pLenti-GFP Lentiviral Control Vector | CELL BIOLABS | LTV-400 | It is packaged as the manufactuer suggested (https://www.cellbiolabs.com/sites/default/files/LTV-400-gfp- lentiviral-plasmid.pdf). 40 μL of 50x lentivirus is added with 1 μL 10 mg/mL polybrene per 1 mL of cell suspension. Complete medium change is performed 24 h after the addition of lentivirus. Cells are incubated undisputedly for 3 days at 37 °C, 5% CO2. |
| Polybrene | EMD Millipore | TR-1003-G | |
| Recombinant Human Flt-3 Ligand/FLT3L Protein | R&D Systems | 308-FK-005 | It is resuspend with PBS + 0.2% BSA. Thr working concentration is 10 ng/mL or 12 IU/mL. |
| Recombinant Human IL-15 Protein | R&D Systems | 247-ILB-005 | It is resuspended with PBS + 0.2% BSA. The working concentration is 10 ng/mL or 4500 IU/mL. |
| Recombinant Human IL-18/IL-1F4 Protein | R&D Systems | 9124-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL. The IU is not provided by the company. |
| Recombinant Human IL-2 Protein | R&D Systems | 202-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL or 455 IU/mL. |
| Recombinant Human IL-3 Protein, 50ug | PeproTech | 200-03 | It is resuspended with PBS + 0.2% BSA. The working concentration is 5 ng/mL or 14 IU/mL. |
| Recombinant Human IL-7 Protein | R&D Systems | 207-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 8800 IU/mL. |
| Recombinant Human SCF Protein | R&D Systems | 255-SC-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 26 IU/mL. |
| STEMdiff Hematopoietic Kit | STEMCELL Technologies | 5310 | Medium A: 45 mL STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement A ; Medium B: 75 STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement B |
| StemSpan lymphoid differentiation coating material | STEMCELL Technologies | 9950 | It is resuspended in PBS (100x) |
| StemSpan NK cell differentiation medium | STEMCELL Technologies | 9960 | It is prepared by adding 500 µL StemSpan NK Cell Differentiation Supplement (100x) into 49.5 mL of SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan lymphoid expansion medium | STEMCELL Technologies | 9960 | It is prepared by adding 5 mL StemSpan Lymphoid Progenitor Expansion Supplement (10x) into 45 mL of StemSpan SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan NK Cell Generation Kit | STEMCELL Technologies | 9960 | Thaw the medium and materials in room temperature and the medium is stored in 4 °C once thawed. |
| The BD LSRFortessa cell analyzer | BD | ||
| Trypsin-EDTA (0.05%), phenol red | Thermo Scientific | 25300054 | |
| Y-27632 dihydrochloride | Tocris | 1254 | working concentration: 10 µM |
Referenzen
- Gao, X., et al. Establishment of porcine and human expanded potential stem cells. Nature Cell Biology. 21 (6), 687-699 (2019).
- Mackinlay, K. M. L., et al. An in vitro stem cell model of human epiblast and yolk sac interaction. eLife. 10, 63930 (2021).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical-scale natural killer cells from human pluripotent stem cells. Methods in Molecular Biology. 2048, 107-119 (2019).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity. Cell Stem Cell. 23 (2), 181-192 (2018).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Dhar, P., Wu, J. D. NKG2D and its ligands in cancer. Current Opinion in Immunology. 51, 55-61 (2018).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Rungarunlert, S., Techakumphu, M., Pirity, M. K., Dinnyes, A. Embryoid body formation from embryonic and induced pluripotent stem cells: Benefits of bioreactors. World Journal of Stem Cells. 1, 11-21 (2009).
- Counting cells using a hemocytometer. abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. Journal of Immunological Methods. 294, 15-22 (2004).
- Tremblay-McLean, A., Coenraads, S., Kiani, Z., Dupuy, F. P., Bernard, N. F. Expression of ligands for activating natural killer cell receptors on cell lines commonly used to assess natural killer cell function. BMC Immunology. 20, 8 (2019).
- Inoue, T., Swain, A., Nakanishi, Y., Sugiyama, D. Multicolor analysis of cell surface marker of human leukemia cell lines using flow cytometry. Anticancer Research. 34 (8), 4539 (2014).
- Mhatre, S. Rapid flow cytometry based cytotoxicity assay for evaluation of NK cell function. Indian Journal of Experimental Biology. 52 (10), 983-988 (2014).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Motazedian, A., et al. Multipotent RAG1+ progenitors emerge directly from haemogenic endothelium in human pluripotent stem cell-derived haematopoietic organoids. Nature Cell Biology. 22 (1), 60-73 (2020).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Yan, Y., et al. Antileukemia activity of a natural killer cell line against human leukemias. Clinical Cancer Research. 4 (11), 2859-2868 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten