Method Article
从人类扩增的潜在干细胞中产生自然杀伤细胞
摘要
本协议显示了如何在3D和2D培养条件下区分具有轻度细胞毒性的CD3 - / CD45 + CD56 +细胞与人扩增潜在干细胞(hEPSC)。这允许在不破坏复杂微环境的情况下进行常规表型验证。
摘要
自然杀伤(NK)细胞与人类多能干细胞的分化允许研究和制造用于免疫治疗的临床级细胞产品。这里描述的是一种两相方案,它使用无血清商业培养基和细胞因子(白细胞介素 [IL]-3、IL-7、IL-15、干细胞因子 [SCF] 和 FMS 样酪氨酸激酶 3 配体 [Ftl3L])将人扩增电位干细胞 (hEPSC) 分化为具有 NK 细胞特性的细胞通过三维 (3D) 和二维 (2D) 培养技术在 体外 。按照该方案,CD3 - CD56 +或CD45 + CD56 + NK细胞持续产生。当与肿瘤靶标共培养3小时时,与IL-2非依赖性永久性细胞系NK92mi细胞相比,分化的产物显示出轻度细胞毒性。该协议通过生成3D结构保留了分化微环境的复杂性,从而促进了免疫细胞与其生态位之间空间关系的研究。同时,2D培养系统可以在不损害精细分化生态位的情况下对细胞分化进行常规表型验证。
引言
与人类胚胎干细胞(hESCs)和人类诱导多能干细胞(hiPSCs)等传统多能干细胞相比,人类扩增潜能干细胞(hEPSC)更接近全能性状态,因为它们可以分化为胚胎外和胚胎谱系1。例如,hEPSC可以分化为滋养层1 和卵黄囊样细胞2。为了实现hEPSC的独特效力,在含有几种抑制谱系承诺信号1的小分子的培养基中培养单个卵裂球,该培养基称为EPSC培养基(EPSCM)。在EPSCM中培养hESC和hiPSC可以扩大其先前受限的效力,以将它们分化为滋养层细胞1。
多能干细胞是试验新型基因改造的宝贵研究工具。由于多能干细胞的自我更新和分化能力,多能干细胞的一个转化克隆可以产生在同一位点具有相同基因修饰的分化细胞产物。Zhu和Kaufman建立了NK细胞与传统多能干细胞(hESC和hiPSCs)分化的标准3。首先,他们从源自多能干细胞的胚状体诱导造血干细胞(HSC)。干细胞因子(SCF),FMS样酪氨酸激酶3配体(Ftl3L),白细胞介素(IL)-7,IL-15和IL-3的早期补充剂的添加使HSC偏向发展为自然杀伤(NK)细胞。随后,他们用人工抗原呈递细胞(aAPC)扩增NK细胞,这些细胞呈递膜结合IL-21,并不断补充IL-2。研究人员已将这种方法应用于免疫疗法,以产生赋予嵌合抗原受体(CAR-iNK)的iPSC衍生的自然杀伤细胞4。
人NK细胞被定义为外周血中的CD3−CD56+白细胞。它们是对抗病毒感染细胞和肿瘤细胞的效应器5。NK细胞上的一些抑制受体识别正常细胞中普遍表达的分子。例如,在NK细胞上表达的NKG2A / CD94异二聚体识别MHC I类分子5。同时,NK细胞上的激活受体识别应激诱导的配体,就像NKG2D识别转化诱导的MHC I类多肽相关序列A(云母/MIB)6一样。一些转化细胞下调其"自配体"以逃避免疫监视并上调异常配体,从而触发NK细胞执行其裂解机制。NK细胞的内在抗肿瘤能力引起了人们对这种免疫细胞类型的关注。
同时产生胚胎和胚胎外谱系的能力可能使hEPSCs比传统的多能干细胞更忠实地概括胚胎发育生态位。根据经验,维持hEPSCs的效力比hiPSC更容易。在本研究中,开发了一种方案(图1)以偏向hEPSCs发育为造血谱系,然后在 体外将 祖细胞分化为自然杀伤(NK)细胞。在该方案中,使用商业培养基以避免血清不一致,然后逐步添加细胞因子以偏向分化为淋巴系。该协议有两个系统来保存复杂的3D微环境,同时衍生出表型和功能类似于人类NK细胞的CD3 - CD56 + / CD45 + CD56 +细胞。
该协议可能有助于研究免疫细胞与其分化生态位的相互作用,并且可能具有纯化细胞产物用于免疫治疗用途的潜力。
研究方案
本研究涉及 体外 实验;因此,道德批准不适用。本研究中使用的已建立细胞系是从商业来源获得的(见 材料表)。
1. 从hEPSC生成3D类器官结构
- 通过在 SNL饲养层细胞上用 1 mL EPSC 培养基(12 孔板)培养 hEPSC 来维持 hEPSC 1。
注意:如果它们的扩展效力仍然存在,则观察到圆顶形菌落(图2A)。 - 对hEPSC进行预分化。
- 取出hEPSC培养基,加入1mL DFK培养基(DMEM / F12 + 10%血清替代培养基,参见 材料表)。在37°C和5%CO2下孵育2-3天。如果继续孵育3天,则在第二天进行培养基更换。
注意:在显微镜下,圆顶形菌落变平(图2B)。
- 取出hEPSC培养基,加入1mL DFK培养基(DMEM / F12 + 10%血清替代培养基,参见 材料表)。在37°C和5%CO2下孵育2-3天。如果继续孵育3天,则在第二天进行培养基更换。
- 通过悬挂滴技术7,8检查胚体的形成。
- 取出DFK培养基,用1 mL PBS洗涤一次。加入500μL的0.05%胰蛋白酶,并根据形态将板在37°C和5%CO2 下孵育3-7分钟。
注意:当板受到轻微干扰时,hEPSC必须能够与饲养层细胞分离。 - 取出胰蛋白酶,加入 2 mL DFK 培养基以收获细胞。在室温下以300× g 旋转细胞3分钟。
- 用移液管除去上清液。加入 1 mL DFK 培养基和 1 μL Y27632(参见 材料表),通过轻弹重悬细胞。
- 用血细胞计数器9计算细胞悬液内的细胞数。用DFK培养基和Y27632(1,000x)稀释细胞悬液,使其有4,000个细胞/ 25μLDFK培养基。
- 用每盖约 30-40 滴 25 μL 细胞悬液填充 10 cm 培养皿的盖子。将一些PBS倒入下部培养皿中,以防止液滴蒸发。轻轻倒置盖子,盖上盘子。将培养皿在37°C和5%CO2 下孵育3天。
- 取出DFK培养基,用1 mL PBS洗涤一次。加入500μL的0.05%胰蛋白酶,并根据形态将板在37°C和5%CO2 下孵育3-7分钟。
2. 胚体的中胚层和血内皮模式(EB)
- 收集液滴内的EB。
- 使用 1 mL 移液器和一些 PBS 将液滴中的所有 EB 收集到 15 mL 管中。将少量PBS泵入液滴中,然后用移液管吸出培养基,包括EB。
注意:更黄色的液滴表示比粉红色液滴更成功的形成和生长。 - 在室温下以100× g 旋转收集的EB1分钟,并使用移液管除去上清液。加入 1 mL 培养基 A(来自市售细胞分化试剂盒,参见 材料表),将收集的 EB 转移到非贴壁 24 孔板中。将这一天标记为第 0 天(图 1)。
注意:通常,从一个10厘米培养皿收集的所有EB被分组并转移到24孔板的一个孔中。
- 使用 1 mL 移液器和一些 PBS 将液滴中的所有 EB 收集到 15 mL 管中。将少量PBS泵入液滴中,然后用移液管吸出培养基,包括EB。
- 对EB进行中胚层图案化。
- 将板在37°C下用5%CO2孵育3天。在第 2 天,取出 500 μL 培养基 A(从试剂盒中取出,步骤 2.1.2),同时避免移液 EB。然后,加入 500 μL 新鲜培养基 A。
- 对拟胚体进行血内皮检查。
- 从孔中取出 700 μL 培养基 A,然后加入 700 μL 培养基 B(从试剂盒中,步骤 2.1.2)。培养7天。在第 5 天、第 7 天和第 9 天进行培养基 B 的一半变化。
3. NK细胞分化
- 将图案化的EB转移到气液界面上。
- 稍微倾斜板,使EB聚集在底部。使用 1 mL 移液器尽可能多地去除培养基 B,同时避免 EB。
- 用移液器吸出剩余的培养基来拾取EB。将它们转移到24孔板中的Transwell中(参见 材料表)。
注意:将每个透孔的数量限制为两到三个EB,以获得最佳密度。
- 进行淋巴祖细胞扩增。
- 向Transwell的下隔室中加入500 μL NK-1培养基(市售淋巴扩张培养基+ 14 IU/mL IL-3、4,500 IU/mL IL-15、8,800 IU/mL IL-7、26 IU/mL SCF和12 IU/mL ftl3L,参见 材料表)。培养14天,每隔一天进行一次培养基更换。
- 收获并在第7-10天将细胞转移到包衣板上。
- 要涂覆板,请在PBS中稀释包衣材料(市售淋巴分化包衣材料,100x,参见 材料表)。向12孔板的每个孔中加入1mL稀释的涂层溶液,并将板在4°C孵育过夜。用包装膜盖住盘子的开口。
- 将 200 μL PBS 加入到Transwell中,缓慢上下移液约五到六次,以收获从类器官释放的细胞。避免移液类器官。
注意:圆形细胞从类器官中连续释放(图2D)。 - 将收获的细胞悬液转移到 2 mL 管中,并在室温下以 500 x g 离心细胞 5 分钟。用移液管除去上清液,加入1mL NK-1培养基(步骤3.2.1)通过移液重悬细胞。
- 从孔中取出所有涂层溶液,并用1mL PBS洗涤12孔板的每个孔两次。
- 以 1:2 的比例拆分收获的细胞。将细胞悬液转移到包被的12孔板上(步骤3.3.1)。加入 1 mL NK-1 培养基,使每个孔含有 1.5 mL 培养基。
- 要进行培养基更换,让细胞静置1-2分钟,让细胞沉到底部。小心吸出 750 μL 培养基。在室温下以500× g 旋转收集的上清液5分钟。
- 弃去大部分上清液,并移液五至六次重悬于 750 μL NK-1 培养基中。将重悬于新鲜培养基中的细胞加入原始孔中。
注意:此并行系统在 图 1 中称为 2D 系统。遵循细胞来源的类器官孔的培养基更换时间表。
- 按照以下步骤进行NK细胞成熟。
- 取出 3D 系统的旧培养基,并将 500 μL NK-2(市售 NK 细胞分化培养基 + 4,500 IU/mL IL-15、8,800 IU/mL IL-7、26 IU/mL SCF 和 12 IU/mL ftl3L,参见 材料表)加入到跨孔的下隔室中。在37°C和5%CO2 下孵育14天。
注意:确保培养基接触交叉孔的底部。 - 对2D系统中的细胞进行完全培养基更换。从一个孔中收集所有 1.5 mL 细胞,并在室温下以 500 x g 离心 5 分钟。用移液管除去大部分上清液,并用1.5mL NK-2培养基重悬沉淀(步骤3.4.1)。
- 每隔一天进行一次中等更改。稍微倾斜3D系统的板,并取出Transwell外的所有旧介质。在透孔外加入 500 μL NK-2 培养基。
- 为了在2D系统的12孔板的一个孔上进行半培养基更换,让细胞静置1-2分钟,以使细胞沉入底部。小心地吸出 750 μL 培养基。
- 在室温下以500× g 旋转收集的上清液5分钟以防止细胞损失。弃去大部分上清液,并通过移液五到六次重悬于 750 μL NK-2 培养基中。将重悬于新鲜培养基中的细胞加入原始孔中。
- 取出 3D 系统的旧培养基,并将 500 μL NK-2(市售 NK 细胞分化培养基 + 4,500 IU/mL IL-15、8,800 IU/mL IL-7、26 IU/mL SCF 和 12 IU/mL ftl3L,参见 材料表)加入到跨孔的下隔室中。在37°C和5%CO2 下孵育14天。
4. 收获成熟细胞
- 收获在2D系统中培养的细胞。
- 在第38-45天通过上下移液收获细胞。用 1 mL PBS 洗涤两次。在室温下以500× g 离心细胞悬液5分钟。
- 用移液管除去上清液,并将其重悬于所选缓冲液中(即,用于流式细胞术的PBS + 2%FBS,参见 材料表)。
- 收获嵌入类器官中的细胞。
- 在第 38-45 天将培养基从透孔外部收集到 15 mL 管中。通过在Trans孔内加入200 μLPBS并上下移液五到六次来洗涤类器官两次。将悬浮液转移到 15 mL 管中。
- 将 500 μL PBS 加入 12 孔板的孔中。用镊子将类器官从Transwell转移到12孔板的该孔中。
- 用一把剪刀和镊子将类器官切割20次。用PBS将镊子和剪刀上的剩余细胞冲洗到孔中。收集尽可能多的PBS,并将其转移到步骤4.2.1中使用的15mL管中,而不吸出类器官结构。
- 将 500 μL 解离试剂(参见 材料表)加入透孔中,以酶促消化类器官。用商业细胞分离溶液(参见 材料表)在37°C和5%CO2下孵育7-10分钟。通过加入 1 mL PBS 和 2% FBS 来淬灭反应,并将溶液收集在另一个 15 mL 管中。用 1 mL 含有 2% FBS 的 PBS 清洗孔两次。
注意:根据形态确定孵育的长度。尝试达到单个细胞开始从3D结构的膜释放的点。 - 加入 1 mL 含 2% FBS 的 PBS,上下移液 8-10 次。收集所有溶液,包括类器官结构。将它们转移到带有细胞过滤器的步骤 4.2.3 中使用的 15 mL 管中。
- 在室温下以500× g 离心两个管5分钟。用移液管弃去上清液。用所选缓冲液重悬细胞沉淀(步骤4.1.2)。
结果
据推测,目前的 体外 分化(IVD)产物将具有与人类NK细胞相似的表面标志物和抗肿瘤能力。
访问人NK细胞的定义标记以测试来自3D培养系统的分化产物是否产生表型类似于人NK细胞的细胞。在不同时间点(n = 2)诱导的两批从3D培养系统中解离的细胞中约有15%是CD3−CD56+(图3A)。由于缺乏CD3和体 外诱导T细胞的困难,CD3在测试组中被CD45(泛白细胞标志物)取代。从3D结构中解离的细胞中约有16%是CD45 + CD56+(图3B,n = 1),这与早期试验中看到的CD3 - CD56 +细胞的百分比一致。从2D培养系统收获的细胞中CD3−CD56 +细胞的百分比范围为30%至6%,从更成功的诱导(图3C,n = 3)到不太成功的诱导(图3D,n = 2)。验证了从2D培养系统收获的细胞的功能和表型。在 2D 系统的第 18 天培养期间,约 12% 的细胞在 50 ng/mL IL-18、455 IU/mL IL-2 和 20 ng/mL 抗 CD244 抗体刺激 2 小时后同时表达异位 CD56 和 CD107a(图 4C,n = 1)。大约28%的收获细胞是CD94 + CD159a +(图4B,n = 1)。颗粒膜上的蛋白质衬里CD107a的异位表达表明脱颗粒10,而CD94 / NKG2A(CD159a)异二聚体是NK细胞的另一个定义标志物。这为IVD产品的表型和功能验证提供了一个示例。
IVD产品的功能通过其对人红白血病细胞-K562细胞的细胞毒性进行测试。K562细胞上的综合配体分析揭示了其下调的主要组织化学复合物I(MHC-I)和相对较强的NKG2D配体表达(如ULBP-1,ULBP-2 / 5 / 6和ULBP-3)11;因此,K562细胞对NK细胞12的裂解活性敏感。IVD终点产物和NK92mi细胞均在过夜之间用50 ng/mL IL-18、455 IU/mL IL-2和20 ng/mL抗CD244抗体引发。GFP+ K562细胞与IVD或NK92mi细胞收获的细胞在相同体积的H5100培养基中存在50 ng/mL(未提供IU)IL-18、455 IU/mL IL-2和20 ng/mL抗CD244抗体的情况下,以不同的效应子与靶标比(E:T)共培养3小时。NK细胞杀伤活性的读数是死细胞标志物在GFP+亚群上的表达。用市售对照载体(见 材料表)转导K562细胞以组成型表达GFP,转导效率约为80%(补充图1A)。GFP信号添加的百分比与添加的GFP + K562细胞的数量成正比,表明转导的K562细胞的特异性GFP表达(补充图1B)。
图5所示的死亡靶细胞的百分比使用以下公式13计算:
死亡细胞的百分比=(FITC + DAPI +共培养的百分比[例如, 图5A])-(FITC + DAPI +转导的K562细胞的百分比)
在评估的所有三种E:T比率(0.1:1,0.33:1,1:1)中,当与IVD产物共培养时,死亡的GFP +细胞的百分比与E:T比率呈正相关(图5B,hEPSC-NK)或NK92mi细胞(图5B,NK92mi),表明肿瘤靶标的特异性杀伤。然而,IVD产物的细胞毒性在测试时间范围内相对较小(图5C)。
最后,比较3D和2D培养物之间的淋巴祖细胞生成。结果发现,3D培养条件比2D培养条件(36,000个细胞)产生更多的祖细胞(55,000个细胞)(补充图2)。这表明3D培养中组织结构和细胞成分的背景支持淋巴祖细胞的产生。
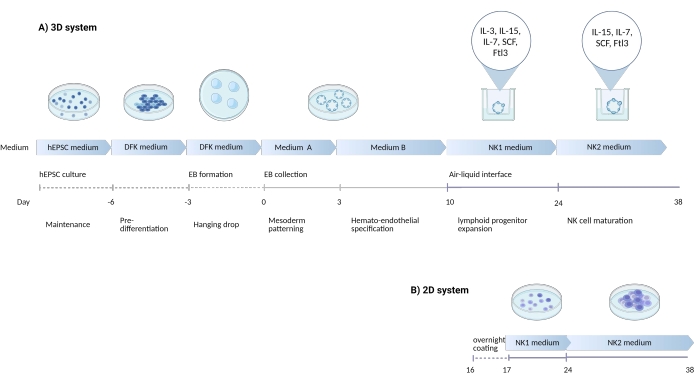
图1:示意图显示了从hEPSC中区分NK细胞的分化策略 。 (A)这里显示了3D培养系统的时间表,详细说明了每个步骤的培养条件和简要关键字。在NK细胞诱导过程中,3D系统的气液界面得以保持。(B)这里显示了2D培养系统的时间表。从第7-10天从3D系统中的结构中收获的释放细胞接种在没有气液界面的涂层板上。 请点击此处查看此图的大图。
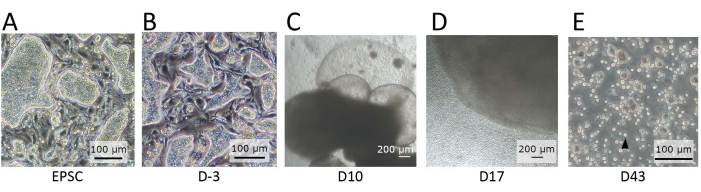
图2:在不同分化阶段观察到的细胞形态 。 (A)在EPSCM中维持hEPSCs时的形态。hEPSCs形成圆顶形菌落。(B)预分化后hEPSCs的形态。圆顶形的菌落是扁平的。收获hEPSCs并用悬挂滴技术形成EB。收集EBs并在培养基A中培养,然后在培养基B中培养。 (C)第10天EB的形态。在此期间,EB开始膨胀和膨胀,形成膜结构。(D)细胞释放EB的形态。在Transwell上播种后,EB生长并不断向周围释放圆形细胞。收集一些释放的细胞并在涂有淋巴分化包衣材料的12孔板上培养。细胞群在形态上是异质的,并且倾向于聚集在一起。(E)在IVD终点观察到的细胞形态。观察到小的圆形悬浮细胞(黑色箭头)。比例尺:(A,B,E)= 100微米;(C,D) = 100 μm。 请点击此处查看此图的大图。
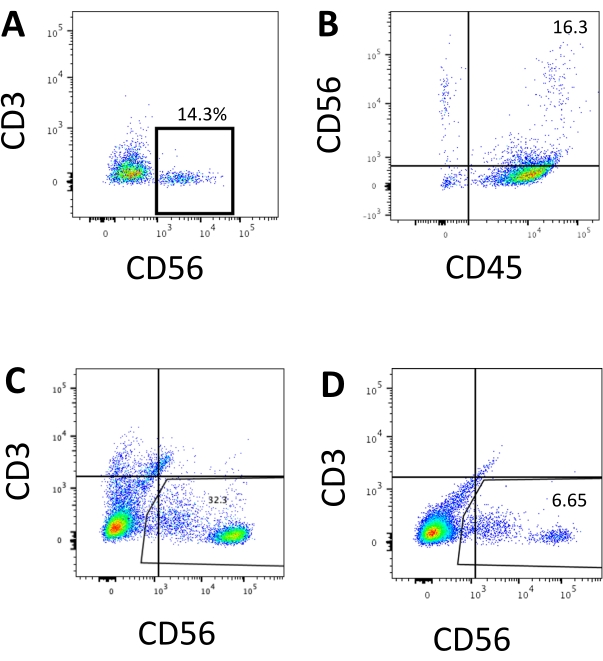
图3:终点hEPSC衍生产品的代表性FACS图。将细胞与荧光镜偶联抗体在冰上孵育30分钟。样品在加载到FACS样品进样口之前用DAPI染色。未染色的细胞用于建立阴性门控。(A)从两批3D培养系统解离的细胞中CD3和CD56表达的代表性FACS图(n = 2)。(B)从3D培养物中解离的细胞中CD45和CD56表达的代表性FACS图(n = 1)。(C)从成功诱导(n = 3)从包被板收获的细胞中CD3和CD56表达的代表性FACS图。(D)诱导欠佳时包被板CD3和CD56表达的代表性FACS图(n = 2)。请点击此处查看此图的大图。
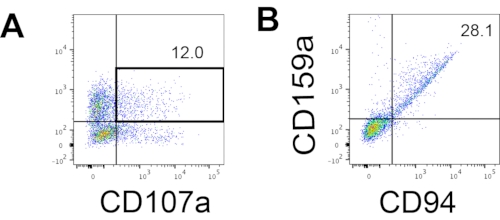
图 4:第 18 天培养期间 hEPSC 衍生产物的代表性 FACS 图(n = 1)。 (A)用IL2,IL-18和抗CD244抗体刺激2小时后CD56和CD107a表达上的FACS图。(B)CD159a和CD94表达上的FACS图。样品在加载到FACS样品进样口之前用DAPI染色。未染色的细胞用于建立阴性门控。请点击此处查看此图的大图。
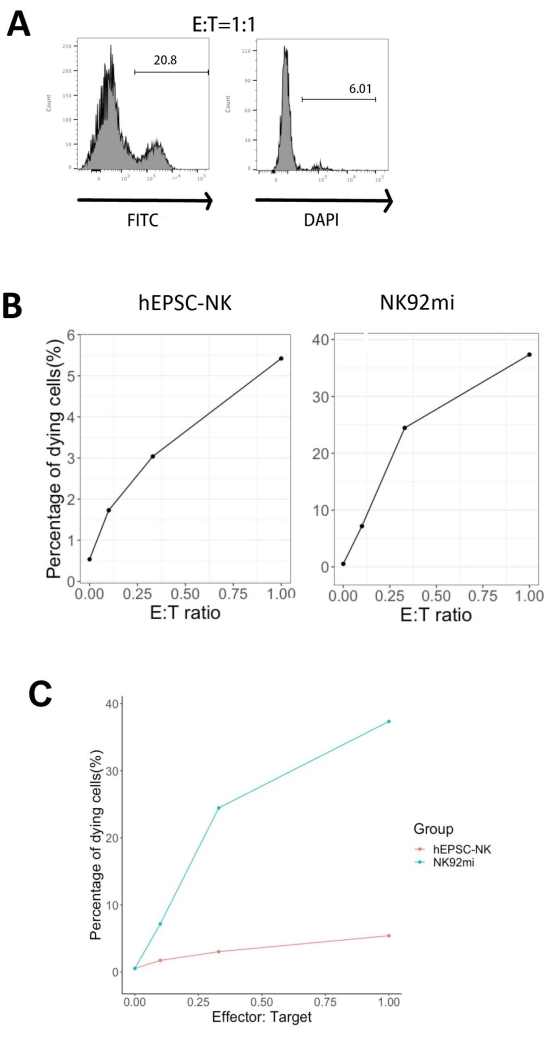
图 5:死亡细胞与 GFP+ K562 细胞与 IVD 终点产物或 NK92mi 细胞共培养的不同 E:T 比率的百分比图(n = 1)。 用细胞分析仪评估FITC+ DAPI+细胞的表达,并使用兼容软件进行数据分析。(A)代表性的FACS图,显示了来自IVD产物和K562细胞共培养的FITC + DAPI +亚群的门控,E:T比值为1。(B)来自GFP + IVD产物(左)或NK92mi细胞(右)共培养实验3小时的个体图。两者都反映了死亡细胞的百分比与E:T比率之间的正比例关系。(C)显示IVD产物和NK92mi细胞在相同尺度上的杀伤曲线的图。与NK92mi细胞相比,IVD产物显示出轻微的细胞毒性。请点击此处查看此图的大图。
补充图1:来自hEPSC的NK细胞的功能测定。 (A)转导的K562细胞的FACS直方图。FITC+ K562细胞表达GFP。(B)来自GFP + K562细胞共培养的FACS直方图和三个E:T比率(n = 1)的终点IVD产物。共培养物中FITC+细胞的百分比对应于添加的转导K562细胞的数量。用未转导的K562细胞建立门控。 请点击此处下载此文件。
补充图2:2D与3D培养中的淋巴祖细胞分化。 目前基于类器官的方案用于从人类扩增的潜在干细胞中诱导淋巴祖细胞。设置两个条件:(1)淋巴祖细胞保存在类器官内的培养物中(3D),以及(2)淋巴祖细胞被分离并保存在培养皿上(2D)。额外培养2周后,确定细胞数量以比较2D与3D培养。 请点击此处下载此文件。
讨论
有几个关键步骤可以确保CD45 + CD56 +细胞从hEPSC中成功分化。预分化(步骤1.2)至关重要,因为EPSC培养基含有谱系承诺1的抑制剂。预分化后,hEPSC的圆顶形菌落变平(图2B)。在hEPSC形成EBs的过程中(步骤1.3)添加Y27632,一种Rho激酶抑制剂(ROCKi),对于hEPSC解离后的存活是必不可少的。另一个重要的考虑因素是每个跨孔上种植的EB数量。由于它是一个小规模的系统,每个跨孔两到三个EB是防止介质过度消耗的最佳密度。在3D系统的NK细胞分化的整个过程中保持气液界面,据信可以保持基质细胞的极性并支持AGM衍生造血祖细胞的扩增14,15。
如前所述,Transwell上EB的密度是成功分化的决定性因素。其关键标志是在Transwell上植入EB后1天培养基的颜色。如果颜色迅速变黄,则表明污染或过度拥挤。为了解决这个问题,应使用1 mL移液器手动拾取额外的EB并将其转移到另一个Transwell中。
该协议的一个主要限制是IVD产物中CD3 - / CD45 + CD56 +细胞的纯度,与纯NK92mi细胞相比,这被认为是较差的细胞毒性的部分原因。采用3D培养系统通过产生类似于三个胚胎胚层的 EB来 诱导造血祖细胞。该策略模拟骨髓微环境中血细胞的发育,从而消除了对基质细胞支持分化的需要3。如果没有纯化造血祖细胞的分选步骤,IVD产品的纯度预计将降低。保留复杂分化生态位同时提高终点产物纯度的策略是开发一种用于分选CD3−CD56 + IVD产物的扩增方法。例如,分选的CD3−CD56 + IVD产物可以在人工抗原呈递细胞(aAPC)上培养,例如用膜结合IL-21改造的辐照K562细胞。随着培养物中IL-2的供应,该方法可以使NK细胞数量增加1,000倍3。
另一个限制是作为阳性参考的真正的人NK细胞的获取有限。NK92mi是共培养测定中使用的阳性参考,但它不够准确。NK92mi细胞由NK92细胞(一种表达活化的NK细胞表型16的永久性细胞系)改造而成,可自主产生IL-2以满足培养要求。NK92细胞在 体外 对K562细胞表现出比人原代NK细胞更好的杀伤活性17。通过平行测定外周血NK细胞的细胞毒性,可以实现IVD产物肿瘤杀伤能力的更公平比较,但不幸的是,缺乏血库的途径。
这种双系统培养方案旨在从hEPSC产生CD3− / CD45 + CD56 +细胞。FACS对表面标志物和细胞毒性的评估可以在不破坏分化生态位的情况下常规进行。尽管CD3-CD56 +细胞的百分比存在差异,但3D和2D系统可以衍生出CD3-CD56 +细胞,CD56表达变化相似(图3),并且2D系统反映了3D培养条件下淋巴祖细胞的存在。
利用3D培养系统的意义在于,它允许使用高分辨率分析分析,例如空间转录组学或成像质谱法,来研究复杂分化生态位内的空间关系和细胞间相互作用。
披露声明
作者声明不存在利益冲突。
致谢
我们要感谢曹汉迪博士、高三星、向大卫、赵一鸣、丽蒂卡·乔加尼、欧文·陈、斯蒂芬妮·张和陈席琳的技术援助和有益的讨论。这项工作得到了平台技术基金的支持。 图 1 是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 30 w/v% Albumin Solution, from Bovine Serum(BSA), Fatty Acid Free | Wako Chemicals | 017-22231 | For resuspending cytokines. |
| ACCUMAX | STEMCELL Technologies | 07921 | |
| Anti-human-CD159a-PE | BD | 375104 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD3-APC antibodies | BD | 555355 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 2% FBS) |
| Anti-human-CD45-APC antibodies | BD | 555485 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 3% FBS) |
| Anti-human-CD56-PE antibodies | BD | 555516 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 4% FBS) |
| Anti-human-CD56-PEcy7 antibodies | BD | 335826 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Anti-human-CD94-APC | BD | 559876 | During antibody staining, 0.5 µL of antibodies is added into the staining buffer (PBS + 5% FBS) |
| Bemis Parafilm M Laboratory Wrapping Film | Thermo Scientific | 11772644 | |
| Cd244 Monoclonal Antibody (eBioC1.7 (C1.7)), Functional Grade, eBioscience | Thermo Scientific | 16-5838-85 | |
| Costar 6.5 mm Transwell, 0.4 µm Pore Polyester Membrane Inserts | STEMCELL Technologies | 3470 | |
| Dapi Solution, 1 mg/mL | BD | 564907 | It is resuspended with ddH2O so the concentration is 10 µM/mL. Add 1 µL of the aliquot in 300 µL of FACS buffer (PBS + 2% FBS) |
| DMEM | CPOS-Bioreagent core | 11965092 | |
| DMEM/F12 | Thermo Scientific | 11320033 | |
| FcX, human | Biolengend | 422302 | |
| Fetal Bovine Serum(FBS) qualified E.U.-approved South America | CPOS-Bioreagent core | 10270106 | |
| FlowJo v10.8.0 | BD | ||
| Gibco PBS (10x) pH 7.4 | CPOS-Bioreagent core | 70011044 | 10x concentrated PBS is manufactured as follows: without calcium, magnesium or phenol red |
| K562 cells | ATCC | CCL-243 | |
| Knockout Serum Replacement | Thermo Scientific | 10828-028 | |
| MyeloCult H5100 medium | STEMCELL Technologies | 5150 | |
| NK92mi cells | ATCC | CRL-2408 | Lot: 70045208. Once thawed, they are cultured in MyeloCult H5100 medium, and maintained the density between 2 x 105 to 1 x 106 cell/mL. |
| Nunc Cell-Culture Treated Multidishes 12 well plate | Thermo Scientific | 150628 | flat bottom |
| Nunc Cell-Culture Treated Multidishes 24 well plate | Thermo Scientific | 142475 | |
| Nunc EasYDish Dishes | Thermo Scientific | 150460 | |
| pLenti-GFP Lentiviral Control Vector | CELL BIOLABS | LTV-400 | It is packaged as the manufactuer suggested (https://www.cellbiolabs.com/sites/default/files/LTV-400-gfp- lentiviral-plasmid.pdf). 40 μL of 50x lentivirus is added with 1 μL 10 mg/mL polybrene per 1 mL of cell suspension. Complete medium change is performed 24 h after the addition of lentivirus. Cells are incubated undisputedly for 3 days at 37 °C, 5% CO2. |
| Polybrene | EMD Millipore | TR-1003-G | |
| Recombinant Human Flt-3 Ligand/FLT3L Protein | R&D Systems | 308-FK-005 | It is resuspend with PBS + 0.2% BSA. Thr working concentration is 10 ng/mL or 12 IU/mL. |
| Recombinant Human IL-15 Protein | R&D Systems | 247-ILB-005 | It is resuspended with PBS + 0.2% BSA. The working concentration is 10 ng/mL or 4500 IU/mL. |
| Recombinant Human IL-18/IL-1F4 Protein | R&D Systems | 9124-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL. The IU is not provided by the company. |
| Recombinant Human IL-2 Protein | R&D Systems | 202-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 50 ng/mL or 455 IU/mL. |
| Recombinant Human IL-3 Protein, 50ug | PeproTech | 200-03 | It is resuspended with PBS + 0.2% BSA. The working concentration is 5 ng/mL or 14 IU/mL. |
| Recombinant Human IL-7 Protein | R&D Systems | 207-IL-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 8800 IU/mL. |
| Recombinant Human SCF Protein | R&D Systems | 255-SC-010 | It is resuspended with PBS + 0.2% BSA. The working concentration is 20 ng/mL or 26 IU/mL. |
| STEMdiff Hematopoietic Kit | STEMCELL Technologies | 5310 | Medium A: 45 mL STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement A ; Medium B: 75 STEMdiff Hematopoietic Basal Medium + STEMdiff Hematopoietic Supplement B |
| StemSpan lymphoid differentiation coating material | STEMCELL Technologies | 9950 | It is resuspended in PBS (100x) |
| StemSpan NK cell differentiation medium | STEMCELL Technologies | 9960 | It is prepared by adding 500 µL StemSpan NK Cell Differentiation Supplement (100x) into 49.5 mL of SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan lymphoid expansion medium | STEMCELL Technologies | 9960 | It is prepared by adding 5 mL StemSpan Lymphoid Progenitor Expansion Supplement (10x) into 45 mL of StemSpan SFEM II. Both are provided in StemSpan NK Cell Generation Kit. |
| StemSpan NK Cell Generation Kit | STEMCELL Technologies | 9960 | Thaw the medium and materials in room temperature and the medium is stored in 4 °C once thawed. |
| The BD LSRFortessa cell analyzer | BD | ||
| Trypsin-EDTA (0.05%), phenol red | Thermo Scientific | 25300054 | |
| Y-27632 dihydrochloride | Tocris | 1254 | working concentration: 10 µM |
参考文献
- Gao, X., et al. Establishment of porcine and human expanded potential stem cells. Nature Cell Biology. 21 (6), 687-699 (2019).
- Mackinlay, K. M. L., et al. An in vitro stem cell model of human epiblast and yolk sac interaction. eLife. 10, 63930 (2021).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical-scale natural killer cells from human pluripotent stem cells. Methods in Molecular Biology. 2048, 107-119 (2019).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance anti-tumor activity. Cell Stem Cell. 23 (2), 181-192 (2018).
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nature Immunology. 9 (5), 503-510 (2008).
- Dhar, P., Wu, J. D. NKG2D and its ligands in cancer. Current Opinion in Immunology. 51, 55-61 (2018).
- Dang, S. M., Kyba, M., Perlingeiro, R., Daley, G. Q., Zandstra, P. W. Efficiency of embryoid body formation and hematopoietic development from embryonic stem cells in different culture systems. Biotechnology and Bioengineering. 78 (4), 442-453 (2002).
- Rungarunlert, S., Techakumphu, M., Pirity, M. K., Dinnyes, A. Embryoid body formation from embryonic and induced pluripotent stem cells: Benefits of bioreactors. World Journal of Stem Cells. 1, 11-21 (2009).
- Counting cells using a hemocytometer. abcam Available from: https://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2022)
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. Journal of Immunological Methods. 294, 15-22 (2004).
- Tremblay-McLean, A., Coenraads, S., Kiani, Z., Dupuy, F. P., Bernard, N. F. Expression of ligands for activating natural killer cell receptors on cell lines commonly used to assess natural killer cell function. BMC Immunology. 20, 8 (2019).
- Inoue, T., Swain, A., Nakanishi, Y., Sugiyama, D. Multicolor analysis of cell surface marker of human leukemia cell lines using flow cytometry. Anticancer Research. 34 (8), 4539 (2014).
- Mhatre, S. Rapid flow cytometry based cytotoxicity assay for evaluation of NK cell function. Indian Journal of Experimental Biology. 52 (10), 983-988 (2014).
- Medvinsky, A., Dzierzak, E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell. 86 (6), 897-906 (1996).
- Motazedian, A., et al. Multipotent RAG1+ progenitors emerge directly from haemogenic endothelium in human pluripotent stem cell-derived haematopoietic organoids. Nature Cell Biology. 22 (1), 60-73 (2020).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell line (NK-92) with phenotypical and functional characteristics of activated natural killer cells. Leukemia. 8 (4), 652-658 (1994).
- Yan, Y., et al. Antileukemia activity of a natural killer cell line against human leukemias. Clinical Cancer Research. 4 (11), 2859-2868 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。