A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحضير سهل وتنشيط ضوئي للتجمعات النانوية ذات صبغة الدواء
In This Article
Summary
يصف هذا البروتوكول تصنيع وتوصيف التجميع النانوي للصبغة البدائية المستجيبة للضوء. تم وصف منهجية إطلاق الدواء من الجسيمات النانوية عن طريق التفكيك الناجم عن الضوء ، بما في ذلك إعداد تشعيع الضوء ، بشكل صريح. أظهرت الأدوية التي تم إطلاقها من الجسيمات النانوية بعد تشعيع الضوء تأثيرات ممتازة مضادة للانتشار على خلايا ورم القولون والمستقيم البشرية.
Abstract
التجميع الذاتي هو طريقة بسيطة لكنها موثوقة لبناء أنظمة توصيل الأدوية النانوية. تمكن الأدوية الأولية القابلة للتنشيط الضوئي من إطلاق الأدوية التي يمكن التحكم فيها من الناقلات النانوية في المواقع المستهدفة المعدلة بواسطة الإشعاع الضوئي. في هذا البروتوكول ، يتم تقديم طريقة سهلة لتصنيع الجسيمات النانوية القابلة للتنشيط الضوئي عن طريق التجميع الذاتي الجزيئي. يتم وصف إجراءات تخليق الأدوية الأولية ، وتصنيع الجسيمات النانوية ، والتوصيف الفيزيائي للتجميع النانوي ، وإظهار الانقسام الضوئي ، والتحقق من السمية الخلوية في المختبر بالتفصيل. تم تصنيع دواء أولي من البورون - ديبيروميثين - كلورامبوسيل (BC) القابل للثقب الضوئي لأول مرة. BC وصبغة الأشعة تحت الحمراء القريبة ، IR-783 ، بنسبة محسنة ، يمكن أن تتجمع ذاتيا في جسيمات نانوية (IR783 / BC NPs). كان متوسط حجم الجسيمات النانوية المركبة 87.22 نانومتر وشحنة سطحية تبلغ -29.8 مللي فولت. تفككت الجسيمات النانوية عند تشعيع الضوء ، والتي يمكن ملاحظتها بواسطة المجهر الإلكتروني للإرسال. تم الانتهاء من الانقسام الضوئي ل BC في غضون 10 دقائق ، مع كفاءة استرداد 22٪ للكلورامبوسيل. أظهرت الجسيمات النانوية سمية خلوية محسنة تحت تشعيع الضوء عند 530 نانومتر مقارنة بالجسيمات النانوية غير المشععة والأدوية الأولية BC الخالية من الإشعاع. يوفر هذا البروتوكول مرجعا لبناء وتقييم أنظمة توصيل الأدوية المستجيبة للضوء.
Introduction
العلاج الكيميائي هو علاج شائع للسرطان يستخدم عوامل سامة للخلايا لقتل الخلايا السرطانية وبالتالي يمنع نمو الورم1. ومع ذلك ، قد يعاني المرضى من آثار جانبية مثل السمية القلبية والسمية الكبدية بسبب الامتصاص غير المستهدف لأدوية العلاج الكيميائي2،3،4. لذلك ، فإن توصيل الدواء الموضعي من خلال التحكم الزماني المكاني لإطلاق / تنشيط الدواء في الأورام أمر ضروري لتقليل التعرض للأدوية في الأنسجة الطبيعية.
الأدوية الأولية هي أدوية معدلة كيميائيا تظهر سمية منخفضة في الأنسجة الطبيعية مع الاحتفاظ بعملها في الآفات المريضة عند التنشيط 5,6. يمكن أن تستجيب الأدوية الأولية لمجموعة متنوعة من المحفزات ، مثل الرقم الهيدروجيني7,8 ، والإنزيمات9,10 ، والموجات فوق الصوتية 11,12 ، والحرارة 13 ، والضوء14,15,1 6 ، وتطلق عقاقيرها الأم على وجه التحديد في الآفات. ومع ذلك ، فإن العديد من الأدوية الأولية تظهر عيوبا متأصلة ، مثل ضعف الذوبان ، ومعدل الامتصاص غير الصحيح ، والتدمير الأيضي المبكر ، مما قد يحد من نموها17. في هذا السياق ، يوفر تكوين التجميعات النانوية للأدوية الأولية مزايا مثل انخفاض الآثار الجانبية ، وإطلاق الدواء في الموقع ، والاحتفاظ بشكل أفضل ، والجمع بين العلاج والتصوير ، مما يشير إلى إمكانات تطبيق كبيرة لهذه التجميعات النانوية. تم تطوير العديد من التجميعات النانوية للأدوية الأولية لعلاج الأمراض ، بما في ذلك المجالات النانوية للدوكسوروبيسين ، والمذيلات الأولية للكركمين ، والألياف النانوية للدواء الكامبتوثيسين18.
في هذا البروتوكول ، نقدم طريقة بسيطة لإعداد التجميعات النانوية للصبغة الأولية التي تظهر نسبة عالية من الأدوية الأولية ، وقابلية جيدة لتشتت المياه ، والاستقرار على المدى الطويل ، والقدرة على الاستجابة الحساسة. IR783 عبارة عن صبغة قريبة من الأشعة تحت الحمراء قابلة للذوبان في الماء يمكن أن تكون بمثابة مثبت للتجمعات النانوية19. المكون الآخر للتجميع النانوي هو البورون-ديبيروميثين-كلورامبوسيل (BODIPY-Cb ، BC) ، وهو دواء أولي تم تصميمه لسببين رئيسيين. نظرا لأن الكلورامبوسيل (Cb) يعرض سمية جهازية في الجسم الحي ، فإن شكل الدواء الأولي يمكن أن يقلل من سميته20. يمكن شق الدواء الأولي BC ضوئيا باستخدام إشعاع ضوئي 530 نانومتر موجه إلى آفات المرض ، مما يتيح الإطلاق المحلي ل Cb. من ناحية أخرى ، فإن Cb عرضة للتحلل المائي في البيئات المائية ، ويمكن حمايته عن طريق تحويله إلى شكل دواءأولي 21. وبالتالي ، كان من المتوقع أن يشكل التجميع المشترك للدواء الأولي BC وصبغة IR-783 نظاما نانويا مستقرا وفعالا لتوصيل الدواء (الشكل 1 أ). تعمل هذه المجموعة النانوية للصبغة الأولية على تحسين تشتت واستقرار جزيئات الأدوية الأولية ، مما يشير إلى إمكانية تطبيقها في توصيل الدواء الذي يمكن التحكم فيه بالضوء. يتيح الانقسام الضوئي للدواء الأولي BC تفكيك الجسيمات النانوية وإطلاق Cb المتحكم فيه بالضوء في الآفات (الشكل التكميلي 1).
Protocol
1. تخليق دواء البورون-ديبيروميثين-كلورامبوسيل (BC) (الشكل 2)22
- تخليق BODIPY-OAc
- قم بوزن 1.903 g من 2,4-dimethyl pyrrole وقم بإذابته في 20 mL من ثنائي كلورو الميثان اللامائي (DCM) في دورق مستدير القاع تحت جو نيتروجين. وزن 1.638 g من كلوريد الأسيتوكسي أسيتيل وإضافته قطرة قطرة في المحلول. استمر في التقليب لمدة 10 دقائق في درجة حرارة الغرفة ثم ارتجع المحلول لمدة 1 ساعة عند 40 درجة مئوية.
- تبريد الخليط إلى درجة حرارة الغرفة. يزن 5.170 جم من N ، N-diisopropylethylamine (DIPEA) ويضاف قطرة قطرة إلى الخليط تحت التحريك. بعد 30 دقيقة ، قم بوزن 5.677 جم من ثلاثي فلوريد البورون ثنائي إيثيل إيثرات (BF3 · OEt2) ، أضفه بالتنقيط إلى المحلول ، واستمر في التقليب لمدة 30 دقيقة إضافية.
- أضف 10 جم من هلام السيليكا (200-400 شبكة) إلى الخليط وأزل المذيب عن طريق التبخر الدوار عند 45 درجة مئوية. أوقف التبخر عندما يعود هلام السيليكا إلى مسحوق جاف.
- أضف فريت في الجزء السفلي من خرطوشة (انظر جدول المواد). املأ هلام السيليكا (من الخطوة 1.1.3) في الخرطوشة ثم أضف فريت آخر إلى الخرطوشة أعلى الجل المملوء.
- ثبت الخرطوشة في الياقة المتصلة بنظام كروماتوغرافيا الفلاش (انظر جدول المواد) وقم بتدويرها لقفلها. قم بتركيب الخرطوشة أعلى الصمام السداسي في نظام كروماتوغرافيا الفلاش وقم بتثبيت عمود فلاش (انظر جدول المواد) أسفل الصمام.
- ابدأ تشغيل أداة الكروماتوغرافيا واضبط 515 نانومتر و 365 نانومتر كأطوال موجية للكشف. قم بإجراء الشطف باستخدام 4/3 (v / v) hexane / DCM. اجمع الكسور المخففة عند ظهور إشارة 515 نانومتر.
- قم بإزالة المذيب من الكسور المجمعة عن طريق التبخر الدوار عند 40 درجة مئوية حتى لا يتم جمع المزيد من المذيب في دورق جمع المذيب. ضع المنتج الصلب في غرفة تجفيف بالتفريغ طوال الليل لإزالة بقية المذيب.
- تخليق BODIPY-OH
- تزن 1.120 جم من BODIPY-OAc (يتم تصنيعها في الخطوة 1.1) وتذوب في 70 مل من رباعي هيدروفوران (THF) في درجة حرارة الغرفة ، مغطاة بالكامل بورق. أضف 70 مل من محلول مائي LiOH 0.1 M بالتنقيط في محلول BODIPY-OAc.
- حرك الخليط لمدة 30 دقيقة وأزل المذيب عند 40 درجة مئوية عن طريق التبخر الدوار حتى لا يتم جمع المزيد من المذيب في دورق جمع المذيبات. ضع البقايا في غرفة تجفيف بالتفريغ طوال الليل لإزالة الماء.
- قم بإذابة البقايا الجافة في 30 مل من DCM وأضف 10 جم من هلام السيليكا إلى المحلول. قم بإزالة المذيب عن طريق التبخر الدوار عند 40 درجة مئوية. أوقف التبخر عندما يعود هلام السيليكا إلى مسحوق جاف.
- قم بتنقية المنتج BODIPY-OH بواسطة كروماتوغرافيا العمود ، باتباع الخطوات من 1.1.4 إلى 1.1.6 ، مع DCM وحده باعتباره المخفف.
- قارن الكسور التي تم جمعها في نقاط زمنية مختلفة مع محلول THF من BODIPY-OAc على كروماتوغرافيا الطبقة الرقيقة (TLC) وحدد المنتج23.
- بقعة 3-4 ميكرولتر من الجزء المستخلص ومحلول BODIPY-OAc بشكل منفصل على حافة واحدة من لوحة TLC على نفس الارتفاع. ضع لوحة TLC في غرفة زجاجية تحتوي على 1 مل من DCM ، مع غمر الحافة المرقطة في مذيب DCM ولكن مع خروج النقطتين من المذيب.
- أخرج لوحة TLC عندما يصل مذيب DCM إلى أكثر من نصف ارتفاع اللوحة. حدد الكسر المرتفع مع بقعة TLC على ارتفاع مختلف عن بقعة BODIPY-OAc.
- قم بإزالة المذيب عن طريق التبخر الدوار عند 40 درجة مئوية (الخطوة 1.1.7) للحصول على المنتج BODIPY-OH.
- تخليق BODIPY-(Me) 2-OH
- وزن 313 ملغ من BODIPY-OH وتذويبه في 35 مل من ثنائي إيثيل الأثير اللامائي في الظلام تحت جو النيتروجين. أضف 3.75 مل من يوديد ميثيل المغنيسيوم (3 أمتار في ثنائي إيثيل الأثير) بالتنقيط في المحلول واستمر في التقليب لمدة 3 ساعات في درجة حرارة الغرفة.
- إخماد التفاعل بإضافة 3.5 mL من الماء بالتنقيط.
- استخراج الخليط مع DCM والماء.
- انقل الخليط إلى قمع فصل سعة 125 مل. أضف 20 مل من DCM إلى الخليط.
- أغلق غطاء القمع الفاصل. قم بإمالة القمع بزاوية 45 درجة تقريبا وهز القمع قليلا. افتح الغطاء لتفريغ الهواء. كرر هذه الخطوة 3 مرات ، واتركها لمدة 3 دقائق.
- افتح الصمام السفلي واجمع المرحلة العضوية السفلية في دورق.
- أضف 30 مل من DCM إلى المرحلة المائية. كرر الاستخراج (الخطوتان 1.3.3.2 و 1.3.3.3) 3 مرات مع 30 مل من DCM في كل مرة.
- أضف 10 جم من Na2SO4 الصلبة إلى المرحلة العضوية المجمعة لتجفيف المرحلة العضوية طوال الليل.
- قم بتوصيل قارورة ترشيح بمضخة تفريغ بأنبوب مطاطي. ضع قطعة من ورق الترشيح على قمع Büchner وأدخل القمع في الجزء العلوي من القارورة. بلل ورق الترشيح ب 1 مل من DCM ، وانقل الخليط إلى القمع ، وقم بتشغيل مضخة التفريغ. جمع الحل العضوي في قارورة.
- أضف 10 غرام من هلام السيليكا إلى المحلول العضوي. قم بإزالة المذيب العضوي عن طريق التبخر الدوار عند 40 درجة مئوية حتى يعود هلام السيليكا إلى المسحوق الجاف. قم بتنقية المنتج BODIPY-(Me) 2-OH بواسطة كروماتوغرافيا العمود (الخطوات 1.1.4 إلى 1.1.6) باستخدام الهكسان / DCM = 1/1 (v / v) كمخفف.
- حدد الكسور المستخلصة التي تحتوي على المنتج باستخدام تحليل TLC كما هو موضح في الخطوة 1.2.5 (بقعة TLC على ارتفاع مختلف عن BODIPY-OH). قم بإزالة المذيب عن طريق التبخر الدوار عند 40 درجة مئوية للحصول على المنتج كما هو موضح في الخطوة 1.1.7.
- تخليق BODIPY-(Me) 2-I 2-OH
- وزن 41 ملغ من BODIPY-(Me)2-OH وتذويبه في 2.5 مل من THF اللامائي في الظلام تحت جو النيتروجين. تزن 74 ملغ من N-iodosuccinimide وتذوب في 1 مل من THF اللامائي.
- أضف محلول N-iodosuccinimide بالتنقيط إلى محلول BODIPY-(Me)2-OH. بعد التقليب لمدة 3.5 ساعات في درجة حرارة الغرفة ، قم بإزالة المذيب عن طريق التبخر الدوار عند 40 درجة مئوية حتى لا يتم جمع المزيد من المذيب في دورق تجميع المذيبات على المبخر الدوار.
- قم بإذابة البقايا في 10 مل من DCM واغسلها 3 مرات ب 30 مل من الماء في كل مرة ، كما هو موضح في الخطوة 1.3.3. جفف المرحلة العضوية باستخدام Na2SO 4 (الخطوتان 1.3.4 و 1.3.5). قم بإزالة المذيب عن طريق التبخر الدوار عند 40 درجة مئوية (الخطوة 1.1.7) للحصول على المنتج BODIPY-(Me) 2-I 2-OH.
- تخليق BODIPY-Cb
- تزن 85 ملغ من الكلورامبوسيل وتذوب في 2 مل من DCM اللامائي في الظلام تحت جو النيتروجين. تزن 69 ملغ من N ، N'-dicyclohexylcarbodiimide وتذوب في 1 مل من DCM اللامائي. أضفه بالتنقيط إلى محلول الكلورامبوسيل مع التحريك لمدة 10 دقائق.
- حل 1.7 ملغ من 4-ثنائي ميثيل أمينوبيريدين في 0.5 مل من DCM اللامائية. أضف هذا المحلول إلى الخليط واستمر في التقليب لمدة 10 دقائق في درجة حرارة الغرفة. ثم أضف 73 مجم من BODIPY-(Me)2-I 2-OH المذاب في 2 مل من DCM اللامائي واستمر في التحريك لمدة ساعتين.
- أضف 10 جم من هلام السيليكا إلى الخليط وأزل المذيب عن طريق التبخر الدوار عند 40 درجة مئوية. أوقف التبخر عندما يعود هلام السيليكا إلى مسحوق جاف. تنقية المنتج BODIPY-Cb بواسطة كروماتوغرافيا العمود (الخطوات 1.1.4 إلى 1.1.6 ، 540 نانومتر وطول موجة إشارة 365 نانومتر) مع الهكسان / DCM = 7/3 (v / v) كمخفف.
- حدد الكسور المستخلصة التي تحتوي على منتج مختلف عن BODIPY-(Me) 2-I 2-OH باستخدام تحليل TLC (الخطوة 1.2.5). قم بإزالة المذيب عن طريق التبخر الدوار عند 40 درجة مئوية (الخطوة 1.1.7) للحصول على المنتج BODIPY-Cb.
2. تحضير IR783 / BC NPs بطريقة هطول الأمطار الوميضية
- قم بوزن 10 مجم من الدواء الأولي BC (BODIPY-Cb) وقم بإذابته في 1 مل من DMSO في أنبوب دقيق سعة 1.5 مل للحصول على محلول مخزون 10 مجم / مل. قم بتغطية محلول BC بورق.
- تحضير 300 ميكرولتر من 0.4 مجم / مل IR-783 في ماء منزوع الأيونات المصفى في أنبوب دقيق سعة 1.5 مل. ضع هذا الأنبوب الدقيق على خلاط دوامة عند 1500 دورة في الدقيقة.
- أضف 20 ميكرولتر من محلول BC في DMSO إلى محلول IR-783 على مدى 10 ثوان بمعدل ثابت باستخدام ماصة 20 ميكرولتر. يجب أن تلمس نهاية طرف الماصة الجدار الداخلي للأنبوب الدقيق (الشكل 1 ب).
- احتفظ بالأنبوب الدقيق على خلاط الدوامة لمدة 30 ثانية إضافية للحصول على محلول IR783 / BC NP. ثم ضع محلول الجسيمات النانوية على رف مغطى بالكامل بورق الألمنيوم.
- قم بطرد مركزي محلول IR783 / BC NP الناتج لمدة 10 دقائق عند 2000 × جم و 4 درجات مئوية لإزالة الركام. جمع طاف ، وترك ~ 20 ميكرولتر في الأنبوب لتجنب إزعاج بيليه. تخلص من الحبيبات.
- قم بطرد المادة الطافية مرتين لمدة 30 دقيقة عند 30000 × جم و 4 درجات مئوية وجمع الجسيمات النانوية المترسبة من كل من أجهزة الطرد المركزي. إعادة تعليق الجسيمات النانوية في 300 ميكرولتر من 1x PBS.
ملاحظة: عندما يتم تشتيت الدواء الأولي BC الكارهة للماء في DMSO في الماء مع الدوامة ، يتم إذابة DMSO بالماء ، وتميل جزيئات الأدوية الأولية إلى تكوين مجموعات نانوية للحفاظ على استقرارها في ظل حالة التشبع الفائق المحلي24. - تحديد محتوى IR-783 و BC بواسطة كروماتوغرافيا سائلة عالية الأداء (HPLC) ، باستخدام طريقة الشطف الموضحة في الجدول 1.
ملاحظة: يتم تحضير عينة HPLC عن طريق خلط كميات متساوية من محلول الجسيمات النانوية والأسيتونيتريل. حجم الحقن 20 ميكرولتر. الطول الموجي للكشف عن الكلورامبوسيل و BC prodrug هو 260 نانومتر ، والطول الموجي للكشف عن IR783 هو 783 نانومتر. عمود HPLC عبارة عن عمود تحليلي C18 مقاس 4.6 مم (قطر داخلي) × 100 مم (طول) ، بحجم جسيم 2.7 ميكرومتر وحجم مسام 120 Å. - احسب كفاءة تغليف الأدوية الأولية (EE٪) وسعة التحميل (LC٪) وفقا للمعادلات التالية:

| الوقت (دقيقة) | الأسيتونيتريل (٪) | الماء (٪) |
| 0 | 20 | 80 |
| 5 | 20 | 80 |
| 30 | 95 | 5 |
| 35 | 95 | 5 |
الجدول 1: طريقة HPLC للتحليل النوعي والكمي للدواء الأولي BC وانقسامه الضوئي. مستنسخة بإذن25. حقوق الطبع والنشر 2022 ، وايلي.
3. توصيف IR783 / BC NPs
- قم بقياس متوسط حجم IR783 / BC NPs باستخدام أداة تشتت الضوء الديناميكي (DLS) (انظر جدول المواد). أضف 200 ميكرولتر من محلول IR783 / BC NP في كوفيت وأدخل الكوفيت في الحامل للقياس. اضبط نوع القياس على أنه "الحجم" ودرجة حرارة القياس على 25 درجة مئوية. قم بإجراء ثلاثة قياسات لمدة 20 ثانية لكل قياس.
- قم بقياس الشحنة السطحية ل IR783 / BC NPs باستخدام أداة DLS باستخدام كوفيت اختبار زيتا المحتمل.
- قم بتخفيف 25 ميكرولتر من محلول IR783 / BC NP مع 725 ميكرولتر من الماء منزوع الأيونات في أنبوب دقيق سعة 1.5 مل وأضف المحلول إلى كوفيت اختبار جهد زيتا. ضع الكوفيت في أخدود العينة. قم بتغطية أخدود العينة.
- اضبط نوع القياس على أنه "جهد زيتا" ودرجة حرارة القياس على 25 درجة مئوية. قم بإجراء 10 قياسات.
- تحضير العينات للتصوير المجهري الإلكتروني (TEM). أضف 10 ميكرولتر من محلول IR783 / BC NP على قطعة من فيلم الكربون الهولي على شبكة نحاسية (300 شبكة) وقم بإزالة 7 ميكرولتر. اترك 3 ميكرولتر من المحلول على الفيلم طوال الليل للتبخر التلقائي.
ملاحظة: إضافة 10 ميكرولتر من محلول NP متبوعا بإزالة 7 ميكرولتر يسمح للقطرة بتغطية مساحة أوسع على الفيلم.
4. التنشيط الضوئي ل IR783 / BC NPs
- قم بإعداد مصباح LED (530 نانومتر ؛ انظر جدول المواد) بحامل حديدي بحيث يواجه الضوء أرضية التشغيل مباشرة. ضع مقياس ضوئي للصمام الثنائي الضوئي الكروي المدمج (انظر جدول المواد) مباشرة تحت مصباح LED.
ملاحظة: لمنع تأثير الضوء البيئي ، يتم إجراء جميع تجارب تشعيع الضوء في غرفة مظلمة. - قم بتشغيل مصباح LED وافتح غطاء مقياس الضوء. سجل الإشعاع واضبط معلمات المصباح باستخدام البرنامج المرتبط (انظر جدول المواد). اضبط تيار الإدخال (مللي أمبير) لضبط الإشعاع على 50 ميجاوات / سم2.
ملاحظة: يتأثر الإشعاع أيضا بالمسافة بين مصباح LED ومقياس الضوء. في الإعداد المستخدم هنا (الشكل 3 أ ، ب) ، يتم تثبيت المسافة عند 5 سم. - قم بتخفيف محلول IR783 / BC NP بالماء منزوع الأيونات إلى 50 ميكرومتر بناء على تركيز BC. أضف 200 ميكرولتر من محلول IR783 / BC NP إلى أنبوب دقيق سعة 1.5 مل. ضع الأنبوب على كتلة رغوية بحجم أخدود مناسب للأنبوب الدقيق وبنفس ارتفاع مقياس الضوء في الخطوة 4.1 (الشكل 3C ، D).
- افتح غطاء الأنبوب. قم بتشغيل مصباح LED وقم بإشعاع محلول الجسيمات النانوية لمدة 1 و 2 و 3 و 5 و 7 و 10 دقائق.
- تحديد استهلاك BC وإطلاق Cb بواسطة HPLC بعد تشعيع الضوء. احسب النسبة المئوية لإصدار BC و Cb المتبقي باستخدام المعادلات التالية:

5. اختبار السمية الخلوية ل IR783 / BC NPs مع وبدون تشعيع الضوء
- زراعة خلايا HCT116 (خط خلايا ورم القولون والمستقيم البشري) في وسط RPMI 1640 يحتوي على 10٪ مصل بقري جنيني و 1٪ بنسلين-ستربتومايسين (وسط كامل) في جو CO2 بنسبة 5٪ عند 37 درجة مئوية (~ 2 × 106 خلايا لكل طبق في طبق زراعة خلايا 90 مم). قم بزراعة الخلايا بشكل روتيني كل 2-3 أيام.
ملاحظة: HCT116 هو خط خلايا القولون البشري. بالمقارنة مع الخلايا السرطانية الأخرى مثل خلايا HeLa و MCF7 و A549 ، تعبر خلايا HCT-116 عن مستوى أعلى من الكافيولين -125 ، والذي يمكن استهدافه بواسطة IR783 وتعزيز الامتصاص الخلوي ل IR783 / BC NPs. - قم بطلاء خلايا HCT116 في 96 لوحة بئر بوسط كامل RPMI 1640 بكثافة 104 خلايا لكل بئر.
- نضح الوسط من طبق الثقافة عندما يتجاوز التقاء الخلية 50٪. اغسل الخلايا باستخدام 1x PBS وقم بإزالة PBS. أضف 1 مل من محلول التربسين 0.25٪ واحتضانه عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪.
- بعد 3 دقائق ، أضف 2 مل من الوسط الكامل لإخماد هضم التربسين. أعد تعليق الخلايا ، وانقل تعليق الخلية إلى أنبوب طرد مركزي سعة 15 مل ، وأجهزة طرد مركزي عند 300 × جم لمدة 3 دقائق. تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 1 مل من الوسط الكامل.
- تمييع 10 ميكرولتر من تعليق الخلية إلى 200 ميكرولتر مع وسط كامل. ضع 10 ميكرولتر على مقياس الدم وقم بتغطيته بغطاء.
- مراقبة مقياس الدم تحت المجهر (العدسة: 10x ؛ العدسة الموضوعية: 4x). عد وسجل أرقام الخلايا في مربعات الزاوية الأربعة والمركز. احسب تركيز الخلية باستخدام الصيغة:
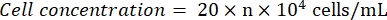
حيث n = متوسط أرقام الخلايا للمربعات الخمسة. - تمييع تعليق الخلية إلى 1 × 105 خلايا / مل. أضف 100 ميكرولتر من معلق الخلية لكل بئر في صفيحة 96 بئرا لبذر الخلايا. أضف 100 ميكرولتر من PBS لكل بئر في الآبار غير المصنفة.
- عالج الخلايا ب (1) 0.1-150 ميكرومتر خالية من BC ، (2) 0.1-150 ميكرومتر IR783 / BC NPs (بناء على تركيز BC) ، (3) 0.1-150 ميكرومتر خالية من BC مع تشعيع الضوء ، أو (4) 0.1-150 ميكرومتر IR783 / BC NPs (بناء على تركيز BC) مع تشعيع الضوء. احتضان الخلايا عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪ لمدة 6 ساعات.
ملاحظة: يتم تخفيف حلول BC و IR783 / BC NP المجانية من حلول المخزون الخاصة بكل منها بوسط كامل. - بعد 6 ساعات من الحضانة ، استبدل الوسط المحتوي على الأدوية الأولية / الجسيمات النانوية بوسط كامل جديد. احتضان المجموعتين غير المشعة 1 و 2 في الظلام لمدة 24 ساعة. بالنسبة للمجموعتين 3 و 4 ، قم بإشعاع الخلايا بمصباح LED 530 نانومتر (50 ميجاوات / سم2) لمدة 5 دقائق ، واحتضانها لمدة 24 ساعة.
ملاحظة: يتم وضع ألواح الخلايا على كتلة رغوية لضمان نفس ارتفاع مقياس الضوء في الخطوة 4.1. - تحديد صلاحية الخلية باستخدام مقايسة بروميد 3- (4،5-ثنائي ميثيل ثيازول-2-يل) -2،5-ثنائي فينيل تيترازوليوم بروميد (MTT).
- بعد معالجة BC أو الجسيمات النانوية ، أضف 10 ميكرولتر من MTT (10 مجم / مل في PBS) إلى كل بئر واحتضان الألواح عند 37 درجة مئوية لمدة 3 ساعات. ثم قم بإزالة الوسيط وإضافة 100 ميكرولتر من DMSO إلى كل بئر. اقرأ الامتصاص باستخدام قارئ الصفائح الدقيقة عند 490 نانومتر و 570 نانومتر و 630 نانومتر.
- احسب صلاحية الخلية باستخدام المعادلة التالية:

ملاحظة: يتم إجراء أربع تجارب مستقلة (ن = 4) لكل مجموعة للتحليل. يمكن استبدال OD490 ب OD570-OD 630 في حساب صلاحية الخلية.
النتائج
تم تصنيع IR783 / BC NPs بنجاح في هذه الدراسة باستخدام طريقة الترسيب السريع. تم تقديم NPs IR783 / BC المركبة كمحلول أرجواني ، بينما كان المحلول المائي ل IR783 أزرق (الشكل 4A). كما هو موضح في الشكل 4B ، أظهرت IR783 / BC NPs متوسط حجم يبلغ حوالي 87.22 نانومتر مع مؤشر تعدد التشتت (PDI) يبلغ 0.0...
Discussion
يحدد هذا البروتوكول طريقة ترسيب فلاش سهلة لتصنيع الجسيمات النانوية ذات الصبغة الأولية ، والتي توفر نهجا بسيطا ومريحا لتشكيل الجسيمات النانوية. هناك العديد من الخطوات الحاسمة في هذه الطريقة. أولا ، بالنسبة لجميع خطوات التوليف والتصنيع والتوصيف ، يجب تغطية الحاويات مثل الأنابيب الدقيقة ب?...
Disclosures
أودع طلب بناء على معاهدة التعاون بشأن البراءات يحمل الرقم .PCT/CN2021/081262.
Acknowledgements
نحن نعترف بالمساعدة المقدمة من المرفق الأساسي لكلية الطب بجامعة هونغ كونغ لي كا شينغ. نشكر البروفيسور تشي مينغ تشي في جامعة هونغ كونغ على توفير خط خلايا HCT116 البشري. تم دعم هذا العمل من قبل مركز مينغ واي لاو للطب التعويضي برنامج العضو المنتسب ومجلس المنح البحثية في هونغ كونغ (مخطط الحياة المهنية المبكرة ، رقم 27115220).
Materials
| Name | Company | Catalog Number | Comments |
| 1260 Infinity II HPLC | Agilent Technologies | ||
| 2,4-Dimethyl pyrrole | J&K Scientific | 315305 | |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT) | Gibco | M6494 | |
| 4-Dimethylaminopyridine (4-DMAP) | J&K Scientific | 212279 | |
| 90 mm Petri Dish Clear Treated Sterile | SPL | 11090 | |
| 96-well Tissue Culture Plate Clear Treated Sterile | SPL | 30096 | |
| Acetoxyacetyl chloride | J&K Scientific | 192001 | |
| Boron trifluoride diethyl etherate | J&K Scientific | 921076 | |
| Büchner funnel | AS ONE | 3-6466-01 | |
| Chlorambucil | J&K Scientific | 321407-1G | |
| CM100 Transmission Electron Microscope | Philips | ||
| CombiFlash RF chromatography system | Teledyne ISCO | ||
| Dichloromethane | DUKSAN Pure Chemicals | JT9315-88 | |
| Dimethyl sulfoxide | DUKSAN Pure Chemicals | 2762 | |
| Disposable cuvette | Malvern Panalytical | DTS1070 | Zeta potential measurement |
| Disposable cuvette | Malvern Panalytical | ZEN0040 | |
| Empty Disposable Sample Load Cartridges | Teledyne ISCO | 693873225 | can hold up to 65 g |
| Fetal bovine serum | Gibco | 10270106 | |
| Filtering flask | AS ONE | 3-7089-03 | |
| Hexane | DUKSAN Pure Chemicals | 4198 | |
| Holey carbon film on copper grid | Beijing Zhongjingkeyi Technology Co.,Ltd | BZ10023a | |
| HPLC column (InfinityLab Poroshell 120) | Agilent Technologies | 695975-902T | |
| Integrating sphere photodiode power sensor | Thorlabs | S142C | |
| IR783 | Tokyo Chemical Industry (TCI) Co., Ltd | I1031 | |
| LED | Mightex | LCS-0530-15-11 | |
| LED Driver Control Panel V3.2.0 (Software) | Mightex | ||
| Lithium Hydroxide Anhydrous | TCI | L0225 | |
| Methylmagnesium iodide, 3M solution in diethyl ether | Aladdin | M140783 | |
| N,N-Diisopropyl ethyl amine (DIPEA) | J&K Scientific | 203402 | |
| N,N'-Dicyclohexylcarbodiimide (DCC) | J&K Scientific | 275928 | |
| penicillin–streptomycin | Gibco | 15140122 | |
| Phosphate-buffered saline (10×) | Sigma-Aldrich | P5493 | |
| Power and energy meter | Thorlabs | PM100 USB | |
| Rotavapor | BUCHI Rotavapor R300 | ||
| RMPI 1640 | Gibco | 21870076 | |
| Separatory funnel (125 mL) | Synthware | F474125L | |
| Silver Silica Gel Disposable Flash Columns, 40 g | Teledyne ISCO | 692203340 | |
| Sodium sulfate, anhydrous | Alfa Aesar | A19890 | |
| SpectraMax M4 | Molecular Devices LLC | ||
| Tetrahydrofuran (THF), anhydrous | J&K Scientific | 943616 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200056 | |
| Vortex | DLAB Scientific Co., Ltd | MX-S | |
| Zetasizer Nano ZS90 | Malvern Instrument |
References
- Chabner, B. A., Roberts, T. G. Chemotherapy and the war on cancer. Nature Reviews Cancer. 5 (1), 65-72 (2005).
- Monsuez, J. -. J., Charniot, J. -. C., Vignat, N., Artigou, J. -. Y. Cardiac side-effects of cancer chemotherapy. International Journal of Cardiology. 144 (1), 3-15 (2010).
- Floyd, J., Mirza, I., Sachs, B., Perry, M. C. Hepatotoxicity of chemotherapy. Seminars in Oncology. 33 (1), 50-67 (2006).
- Bar-Joseph, H., Stemmer, S. M., Tsarfaty, I., Shalgi, R., Ben-Aharon, I. Chemotherapy-induced vascular toxicity-real-time in vivo imaging of vessel impairment. Journal of Visualized Experiments. (95), e51650 (2015).
- Denny, W. A. Prodrug strategies in cancer therapy. European Journal of Medicinal Chemistry. 36 (7-8), 577-595 (2001).
- Kastrati, I., Delgado-Rivera, L., Georgieva, G., Thatcher, G. R. J., Frasor, J. Synthesis and characterization of an aspirin-fumarate prodrug that inhibits NFκB activity and breast cancer stem cells. Journal of Visualized Experiments. (119), e54798 (2017).
- Mao, J., et al. A simple dual-pH responsive prodrug-based polymeric micelles for drug delivery. ACS Applied Materials & Interfaces. 8 (27), 17109-17117 (2016).
- Li, S. -. Y., et al. A pH-responsive prodrug for real-time drug release monitoring and targeted cancer therapy. Chemical Communications. 50 (80), 11852-11855 (2014).
- Andresen, T. L., Thompson, D. H., Kaasgaard, T. Enzyme-triggered nanomedicine: Drug release strategies in cancer therapy (Invited Review). Molecular Membrane Biology. 27 (7), 353-363 (2010).
- Xu, G., McLeod, H. L. Strategies for enzyme/prodrug cancer therapy. Clinical Cancer Research. 7 (11), 3314-3324 (2001).
- Luo, W., et al. Dual-targeted and pH-sensitive doxorubicin prodrug-microbubble complex with ultrasound for tumor treatment. Theranostics. 7 (2), 452 (2017).
- Gao, J., et al. Ultrasound triggered phase-change nanodroplets for doxorubicin prodrug delivery and ultrasound diagnosis: An in vitro study. Colloids and Surfaces B: Biointerfaces. 174, 416-425 (2019).
- Brade, A. M., Szmitko, P., Ngo, D., Liu, F. -. F., Klamut, H. J. Heat-directed suicide gene therapy for breast cancer. Cancer Gene Therapy. 10 (4), 294-301 (2003).
- Long, K., et al. One-photon red light-triggered disassembly of small-molecule nanoparticles for drug delivery. Journal of Nanobiotechnology. 19 (1), 357 (2021).
- Liu, Y., Long, K., Kang, W., Wang, T., Wang, W. Optochemical control of immune checkpoint blockade via light-triggered PD-L1 dimerization. Advanced NanoBiomed Research. 2 (6), 2200017 (2022).
- Wang, T., et al. Optochemical control of mTOR signaling and mTOR-dependent autophagy. ACS Pharmacology & Translational Science. 5 (3), 149-155 (2022).
- Abet, V., Filace, F., Recio, J., Alvarez-Builla, J., Burgos, C. Prodrug approach: An overview of recent cases. European Journal of Medicinal Chemistry. 127, 810-827 (2017).
- Li, G., et al. Small-molecule prodrug nanoassemblies: an emerging nanoplatform for anticancer drug delivery. Small. 17 (52), 2101460 (2021).
- Shamay, Y., et al. Quantitative self-assembly prediction yields targeted nanomedicines. Nature Materials. 17 (4), 361-368 (2018).
- Sinoway, P. A., Callen, J. P. Chlorambucil. Arthritis & Rheumatism. 36 (3), 319-324 (1993).
- Owen, W. R., Stewart, P. J. Kinetics and mechanism of chlorambucil hydrolysis. Journal of Pharmaceutical Sciences. 68 (8), 992-996 (1979).
- Lv, W., et al. Upconversion-like photolysis of BODIPY-based prodrugs via a one-photon process. Journal of the American Chemical Society. 141 (44), 17482-17486 (2019).
- Silver, J. Let us teach proper thin layer chromatography technique. Journal of Chemical Education. 97 (12), 4217-4219 (2020).
- Saad, W. S., Prud'homme, R. K. Principles of nanoparticle formation by flash nanoprecipitation. Nano Today. 11 (2), 212-227 (2016).
- Long, K., et al. Photoresponsive prodrug-dye nanoassembly for in-situ monitorable cancer therapy. Bioengineering & Translational Medicine. 7 (3), 10311 (2022).
- Zhong, T., et al. A self-assembling nanomedicine of conjugated linoleic acid-paclitaxel conjugate (CLA-PTX) with higher drug loading and carrier-free characteristic. Scientific Reports. 6 (1), 36614 (2016).
- Long, K., et al. Green light-triggered intraocular drug release for intravenous chemotherapy of retinoblastoma. Advanced Science. 8 (20), 2101754 (2021).
- Lv, W., Wang, W. One-photon upconversion-like photolysis: a new strategy to achieve long-wavelength light-excitable photolysis. Synlett. 31 (12), 1129-1134 (2020).
- Rwei, A. Y., Wang, W., Kohane, D. S. Photoresponsive nanoparticles for drug delivery. Nano Today. 10 (4), 451-467 (2015).
- Grzelczak, M., Vermant, J., Furst, E. M., Liz-Marzán, L. M. Directed self-assembly of nanoparticles. ACS Nano. 4 (7), 3591-3605 (2010).
- Gnanasammandhan, M. K., Idris, N. M., Bansal, A., Huang, K., Zhang, Y. Near-IR photoactivation using mesoporous silica-coated NaYF4:Yb,Er/Tm upconversion nanoparticles. Nature Protocols. 11 (4), 688-713 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved