A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנת Facile ופוטואקטיבציה של ננו-מכלולים של Prodrug-Dye
In This Article
Summary
פרוטוקול זה מתאר את הייצור והאפיון של ננו-הרכבה של פרו-תרופות-צבע. המתודולוגיה לשחרור תרופות מהננו-חלקיקים על ידי פירוק המופעל על ידי אור, כולל מערך קרינת האור, מתוארת במפורש. התרופות ששוחררו מהננו-חלקיקים בעקבות הקרנת אור הפגינו השפעות מצוינות נגד התפשטות על תאי גידול במעי הגס האנושי.
Abstract
הרכבה עצמית היא שיטה פשוטה אך אמינה לבניית מערכות אספקת תרופות בקנה מידה ננומטרי. פרו-תרופות פוטואקטיבטיביות מאפשרות שחרור תרופות נשלט מננו-נשאים באתרי מטרה המווסתים על ידי קרינת אור. בפרוטוקול זה, מוצגת שיטה קלה לייצור ננו-חלקיקים פרו-תרופות-צבע הניתנים להפעלה באמצעות הרכבה עצמית מולקולרית. ההליכים לסינתזה של פרו-תרופות, ייצור ננו-חלקיקים, אפיון פיזיקלי של ננו-הרכבה, הדגמת פוטו-מחשוף ואימות ציטוטוקסיות חוץ גופית מתוארים בפירוט. תרופה הניתנת לצילום בורון-דיפירומתין-כלורמבוציל (BC) סונתזה לראשונה. BC וצבע אינפרא אדום קרוב, IR-783, ביחס אופטימלי, יכולים להרכיב את עצמם לננו-חלקיקים (IR783/BC NPs). הננו-חלקיקים המסונתזים היו בגודל ממוצע של 87.22 ננומטר ומטען פני השטח של -29.8 mV. הננו-חלקיקים התפרקו על ידי קרינת אור, אשר ניתן היה לצפות על ידי שידור מיקרוסקופיה אלקטרונית. הפוטוקלישוף של BC הושלם תוך 10 דקות, עם יעילות התאוששות של 22% עבור כלורמבוציל. הננו-חלקיקים הציגו ציטוטוקסיות משופרת תחת קרינת אור ב-530 ננומטר בהשוואה לננו-חלקיקים שלא הוקרנו ולפרו-תרופה BC חופשית שהוקרנה. פרוטוקול זה מספק התייחסות לבנייה והערכה של מערכות אספקת תרופות פוטורספונסיביות.
Introduction
כימותרפיה היא טיפול נפוץ בסרטן המשתמש בחומרים ציטוטוקסיים כדי להרוג תאים סרטניים ובכך מעכב את צמיחת הגידול1. עם זאת, חולים עלולים לסבול מתופעות לוואי כגון רעילות לב ו hepatotoxicity עקב ספיגה מחוץ למטרה של תרופות כימותרפיות 2,3,4. לכן, אספקת תרופות מקומית באמצעות בקרה מרחבית-זמנית של שחרור/הפעלת תרופות בגידולים חיונית כדי למזער את החשיפה לתרופות ברקמות נורמליות.
Prodrugs הן תרופות מהונדסות-כימית המציגות רעילות מופחתת ברקמות נורמליות תוך שמירה על פעולתן בנגעים חולים עם הפעלתן 5,6. פרו-תרופות יכולות להגיב למגוון גירויים, כגון pH7,8, אנזימים9,10, אולטרסאונד 11,12, חום 13 ואור14,15,1 6, ולשחרר את תרופות האב שלהם במיוחד בנגעים. אף על פי כן, פרו-תרופות רבות מציגות חסרונות מובנים, כגון מסיסות ירודה, קצב ספיגה שגוי והרס מטבולי מוקדם, מה שעלול להגביל את התפתחותן17. בהקשר זה, היווצרות ננו-מכלולים פרו-תרופתיים מציעה יתרונות כמו הפחתת תופעות לוואי, שחרור תרופות באתר, שימור טוב יותר והשילוב של טיפול והדמיה, מה שמצביע על פוטנציאל יישום גדול עבור ננו-מכלולים אלה. ננו-מכלולים פרו-תרופתיים רבים פותחו לטיפול במחלות, כולל ננו-ספירות פרו-תרופות דוקסורוביצין, מיצלות פרו-תרופות כורכומין וננו-סיבים פרו-תרופתי קמפטוטצין18.
בפרוטוקול זה, אנו מציגים שיטה פשוטה להכנת ננו-מכלולים של צבע פרו-תרופתי המציגים תכולת פרו-תרופות גבוהה, פיזור מים טוב, יציבות לטווח ארוך ויכולת תגובה רגישה. IR783 הוא צבע מסיס במים קרוב לאינפרא אדום שיכול לשמש כמייצב של ננו-מכלולים19. המרכיב השני של הננו-הרכבה הוא בורון-דיפירומתן-כלורמבוציל (BODIPY-Cb, BC), פרו-תרופה שתוכננה משתי סיבות עיקריות. מכיוון שכלורמבוציל (Cb) מציג רעילות מערכתית in vivo, צורת הפרו-תרופה יכולה להפחית את רעילותו20. התרופה BC ניתנת לפוטוקליב באמצעות הקרנת אור של 530 ננומטר המכוונת לנגעי המחלה, מה שמאפשר שחרור מקומי של Cb. מצד שני, Cb נוטה להידרוליזה בסביבות מימיות, וניתן להגן עליו על ידי הפיכתו לטופס פרו-תרופתי21. לפיכך, ההרכבה המשותפת של פרו-תרופה BC וצבע IR-783 הייתה צפויה ליצור ננו-מערכת אספקת תרופות יציבה ויעילה (איור 1A). ננו-הרכבה זו של פרו-תרופות משפרת את הפיזור והיציבות של מולקולות הפרו-תרופה, מה שמרמז על הפוטנציאל שלה ליישום באספקת תרופות נשלטת אור. הפוטוקליף של התרופה BC מאפשר פירוק של ננו-חלקיקים ושחרור מבוקר אור של Cb בנגעים (איור משלים 1).
Protocol
1. סינתזה של בורון-דיפירומתן-כלורמבוציל (BC) פרו-תרופה (איור 2)22
- סינתזה של BODIPY-OAc
- שוקלים 1.903 גרם של פירול 2,4-דימתיל וממיסים אותו ב-20 מ"ל של דיכלורומתאן נטול מים (DCM) בבקבוק בעל תחתית עגולה תחת אטמוספירת חנקן. שוקלים 1.638 גרם של אצטוקסי אצטיל כלוריד ומוסיפים אותו טיפה לתוך התמיסה. המשיכו לערבב במשך 10 דקות בטמפרטורת החדר ולאחר מכן רפלוקס את התמיסה למשך שעה אחת בטמפרטורה של 40°C.
- מצננים את התערובת לטמפרטורת החדר. שקלו 5.170 גרם של N,N-diisopropylethylamine (DIPEA) והוסיפו אותו טיפה לתערובת תחת ערבוב. לאחר 30 דקות, לשקול 5.677 גרם של בורון trifluoride diethyl etherate (BF3· OEt 2), להוסיף אותו טיפה לתוך התמיסה, ולהמשיך לערבב במשך 30 דקות נוספות.
- מוסיפים 10 גרם ג'ל סיליקה (200-400 רשת) לתערובת ומסירים את הממס על ידי אידוי סיבובי ב-45°C. עצור את האידוי כאשר ג'ל הסיליקה חוזר לאבקה יבשה.
- הוסף פריט לחלק התחתון של מחסנית (ראה טבלת חומרים). מלא את ג'ל הסיליקה (משלב 1.1.3) לתוך המחסנית ולאחר מכן הוסף פריט נוסף למחסנית בחלק העליון של הג'ל המלא.
- קבע את המחסנית לצווארון המחובר למערכת הכרומטוגרפיה של הפלאש (ראה טבלת חומרים) וסובב אותה כדי לנעול אותה. התקן את המחסנית על גבי השסתום בעל ששת הכיוונים במערכת הכרומטוגרפיה של הבזק והתקן עמודת הבזק (ראה טבלת חומרים) מתחת לשסתום.
- הפעל את מכשיר הכרומטוגרפיה והגדר 515 ננומטר ו- 365 ננומטר כאורכי גל הגילוי. בצע elution עם 4/3 (v/v) הקסאן/DCM. אסוף את השברים השופעים כאשר האות 515 ננומטר מופיע.
- הסר את הממס מהשברים שנאספו על ידי אידוי סיבובי ב 40 ° C עד שלא נאסף יותר ממס בבקבוק איסוף הממס. הניחו את המוצר המוצק בתא ייבוש בוואקום למשך הלילה כדי להסיר את שאר הממס.
- סינתזה של BODIPY-OH
- שוקלים 1.120 גרם של BODIPY-OAc (מסונתז בשלב 1.1) וממיסים אותו ב 70 מ"ל של tetrahydrofuran (THF) בטמפרטורת החדר, מכוסה לחלוטין בנייר כסף. הוסף 70 מ"ל של תמיסה מימית 0.1 M LiOH טיפתית לתמיסת BODIPY-OAc.
- ערבבו את התערובת במשך 30 דקות והוציאו את הממס בטמפרטורה של 40°C על ידי אידוי סיבובי עד שלא ייאסף עוד ממס בבקבוק איסוף הממסים. הניחו את השאריות בתא ייבוש בוואקום למשך הלילה כדי להסיר מים.
- להמיס את השאריות היבשות ב 30 מ"ל של DCM ולהוסיף 10 גרם של ג'ל סיליקה לתוך הפתרון. הסר את הממס על ידי אידוי סיבובי ב 40 ° C. עצור את האידוי כאשר ג'ל הסיליקה חוזר לאבקה יבשה.
- לטהר את המוצר BODIPY-OH על ידי כרומטוגרפיה עמודה, בצע שלבים 1.1.4 עד 1.1.6, עם DCM בלבד כמו eluent.
- השווה שברים שנאספו בנקודות זמן שונות עם תמיסת THF של BODIPY-OAc על כרומטוגרפיה של שכבה דקה (TLC) וזהה את המוצר23.
- נקודה 3-4 μL של החלק המדולל ותמיסת BODIPY-OAc בנפרד על קצה אחד של לוח TLC באותו גובה. מניחים את צלחת TLC בתא זכוכית המכיל 1 מ"ל DCM, ושוקעים את הקצה המנומר בממס DCM אך עם שני הכתמים מחוץ לממס.
- הוציאו את צלחת TLC כאשר ממס DCM מגיע ליותר ממחצית גובה הצלחת. בחר את השבר המדולל עם נקודת TLC בגובה שונה מהנקודה BODIPY-OAc.
- הסר את הממס על ידי אידוי סיבובי ב 40 ° C (שלב 1.1.7) כדי לקבל את המוצר BODIPY-OH.
- סינתזה של BODIPY-(Me)2-OH
- שוקלים 313 מ"ג של BODIPY-OH וממיסים אותו ב 35 מ"ל של אתר דיאתיל נטול מים בחושך תחת אטמוספירת חנקן. הוסיפו 3.75 מ"ל של מתיל מגנזיום יודיד (3 M באתר דיאתיל) טיפתית לתמיסה והמשיכו לערבב במשך 3 שעות בטמפרטורת החדר.
- להרוות את התגובה על ידי הוספת 3.5 מ"ל של מים טיפתית.
- חלצו את התערובת עם DCM ומים.
- מעבירים את התערובת למשפך הפרדה בנפח 125 מ"ל. מוסיפים 20 מ"ל DCM לתערובת.
- סגור את מכסה המשפך המפריד. הטו את המשפך בזווית של כ-45° ונערו מעט את המשפך. פתח את המכסה כדי לרוקן. חזור על שלב זה 3 פעמים, ואפשר לעמוד במשך 3 דקות.
- פתח את השסתום התחתון ואסף את השלב האורגני התחתון בכד.
- הוסף 30 מ"ל של DCM לשלב המימי. חזור על החילוץ (שלבים 1.3.3.2 ו- 1.3.3.3) 3 פעמים עם 30 מ"ל DCM בכל פעם.
- הוסיפו 10 גרם של Na2SO4 מוצק לשלב האורגני שנאסף כדי לייבש את השלב האורגני למשך הלילה.
- חברו בקבוק סינון למשאבת ואקום בעזרת צינור גומי. הניחו פיסת נייר סינון על משפך ביכנר והכניסו את המשפך לחלק העליון של הצלוחית. הרטיבו את נייר הסינון עם 1 מ"ל DCM, העבירו את התערובת למשפך והפעילו את משאבת הוואקום. לאסוף את הפתרון האורגני בצלוחית.
- הוסף 10 גרם של ג'ל סיליקה לתוך פתרון אורגני. הסר את הממס האורגני על ידי אידוי סיבובי ב 40 ° C עד שג'ל הסיליקה חוזר לאבקה יבשה. לטהר את המוצר BODIPY-(Me)2-OH על ידי כרומטוגרפיה עמודה (שלבים 1.1.4 עד 1.1.6) עם hexane/DCM = 1/1 (v/v) כמו eluent.
- בחר את השברים המלוטשים המכילים את המוצר באמצעות ניתוח TLC כמתואר בשלב 1.2.5 (נקודת TLC בגובה שונה מ- BODIPY-OH). הסר את הממס על ידי אידוי סיבובי ב 40 ° C כדי לקבל את המוצר כמתואר בשלב 1.1.7.
- סינתזה של BODIPY-(Me)2-I 2-OH
- שוקלים 41 מ"ג של BODIPY-(Me)2-OH וממיסים אותו ב-2.5 מ"ל THF נטול מים בחושך תחת אטמוספירת חנקן. שוקלים 74 מ"ג של N-iodosuccinimide וממיסים אותו ב 1 מ"ל של THF נטול מים.
- הוסף את תמיסת N-iodosuccinimide טיפה לתמיסת BODIPY-(Me)2-OH. לאחר ערבוב של 3.5 שעות בטמפרטורת החדר, יש להסיר את הממס על ידי אידוי סיבובי ב-40°C עד שלא ייאסף עוד ממס בבקבוק איסוף הממסים על המאייד הסיבובי.
- יש להמיס את השאריות ב-10 מ"ל DCM ולשטוף אותן 3 פעמים עם 30 מ"ל מים בכל פעם, כמתואר בשלב 1.3.3. יבשו את השלב האורגני עם Na2SO 4 (שלבים 1.3.4 ו-1.3.5). הסר את הממס על ידי אידוי סיבובי ב 40 ° C (שלב 1.1.7) כדי לקבל את המוצר BODIPY-(Me)2-I2-OH.
- סינתזה של BODIPY-Cb
- שוקלים 85 מ"ג כלורמבוציל וממיסים אותו ב-2 מ"ל DCM נטול מים בחושך תחת אטמוספירת חנקן. שוקלים 69 מ"ג של N,N'-dicyclohexylcarbodiimide וממיסים אותו ב 1 מ"ל של DCM נטול מים. מוסיפים אותו טיפה לתמיסת כלורמבוציל תוך ערבוב במשך 10 דקות.
- להמיס 1.7 מ"ג של 4-dimethylaminopyridine ב 0.5 מ"ל של DCM נטול מים. מוסיפים תמיסה זו לתערובת וממשיכים לערבב במשך 10 דקות בטמפרטורת החדר. לאחר מכן להוסיף 73 מ"ג של BODIPY-(Me)2-I 2-OH מומס ב 2 מ"ל של DCM נטול מים ולהמשיך לערבב במשך2 שעות.
- הוסף 10 גרם של ג'ל סיליקה לתוך התערובת והסר את הממס על ידי אידוי סיבובי ב 40 ° C. עצור את האידוי כאשר ג'ל הסיליקה חוזר לאבקה יבשה. לטהר את המוצר BODIPY-Cb על ידי כרומטוגרפיית עמודה (שלבים 1.1.4 עד 1.1.6, 540 ננומטר ואורך גל אות 365 ננומטר) עם הקסאן/DCM = 7/3 (v/v) כמו eluent.
- בחר את השברים המלוטשים המכילים את המוצר שונה מ- BODIPY-(Me)2-I 2-OH באמצעות ניתוח TLC (שלב 1.2.5). הסר את הממס על ידי אידוי סיבובי ב 40 ° C (שלב 1.1.7) כדי לקבל את המוצר BODIPY-Cb.
2. הכנת NPs IR783/BC בשיטת משקעים פלאש
- שקלו 10 מ"ג של התרופה BC (BODIPY-Cb) והמיסו אותה ב-1 מ"ל של DMSO במיקרו-צינורית של 1.5 מ"ל כדי לקבל תמיסת מלאי של 10 מ"ג/מ"ל. מכסים את תמיסת BC בנייר כסף.
- הכן 300 μL של 0.4 מ"ג/מ"ל IR-783 במים מסוננים נטולי יונים, במיקרו-צינור של 1.5 מ"ל. הניחו את המיקרו-צינור הזה על מערבל מערבולות במהירות של 1,500 סל"ד.
- הוסף 20 μL של תמיסת BC ב- DMSO לתמיסת IR-783 מעל 10 שניות בקצב קבוע באמצעות פיפטה של 20 μL. קצה הפיפטה אמור לגעת בדופן הפנימית של המיקרו-צינורית (איור 1B).
- שמור את המיקרו-צינור על מערבל המערבולת למשך 30 שניות נוספות כדי לקבל את תמיסת IR783/BC NP. לאחר מכן, הניחו את תמיסת הננו-חלקיקים על מדף מכוסה במלואו בנייר כסף.
- צנטריפוגה את תמיסת IR783/BC NP המתקבלת למשך 10 דקות ב- 2,000 x גרם ו- 4 ° C כדי להסיר אגרגטים. לאסוף את supernatant, משאיר ~ 20 μL בצינור כדי למנוע הפרעה הכדור. השליכו את הכדור.
- צנטריפוגו את הסופרנאטנט פעמיים למשך 30 דקות בטמפרטורה של 30,000 x גרם ו-4°C ואספו את משקע הננו-חלקיקים משתי הצנטריפוגות. השהה מחדש את הננו-חלקיקים ב-300 μL של 1x PBS.
הערה: כאשר הפרו-תרופה ההידרופובית BC ב-DMSO מפוזרת במים עם מערבולת, ה-DMSO מומס על ידי מים, ומולקולות הפרו-תרופה נוטות ליצור מכלולים ננומטריים כדי לשמור על יציבותן במצב רוויית העל המקומית24. - כמת את התוכן של IR-783 ו- BC באמצעות כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC), באמצעות שיטת elution המוצגת בטבלה 1.
הערה: דגימת HPLC מוכנה על ידי ערבוב נפחים שווים של תמיסת ננו-חלקיקים ואצטוניטריל. נפח ההזרקה הוא 20 μL. אורך גל הגילוי עבור כלורמבוציל ופרו-תרופה BC הוא 260 ננומטר, ואורך גל הגילוי עבור IR783 הוא 783 ננומטר. עמודת HPLC היא עמודת C18 אנליטית בגודל 4.6 מ"מ (קוטר פנימי) x 100 מ"מ (אורך), עם גודל חלקיקים של 2.7 מיקרומטר וגודל נקבוביות של 120 Å. - חשב את יעילות האנקפסולציה של התרופה (EE%) ואת קיבולת ההעמסה (LC%) בהתאם למשוואות הבאות:

| זמן (דקות) | אצטוניטריל (%) | מים (%) |
| 0 | 20 | 80 |
| 5 | 20 | 80 |
| 30 | 95 | 5 |
| 35 | 95 | 5 |
טבלה 1: שיטת HPLC לניתוח איכותני וכמותי של BC prodrug והפוטוקליף שלה. הועתק באישור25. זכויות יוצרים 2022, ווילי.
3. אפיון NPs IR783/BC
- מדוד את הגודל הממוצע של NPs IR783/BC באמצעות מכשיר פיזור אור דינמי (DLS) (ראה טבלת חומרים). הוסף 200 μL של תמיסת NP IR783/BC בקובט והכנס את הקובט במחזיק למדידה. הגדר את סוג המדידה כ'גודל' ואת טמפרטורת המדידה כ- 25°C. בצע שלוש מדידות עם משך של 20 שניות לכל מדידה.
- מדוד את מטען פני השטח של NPs IR783/BC באמצעות מכשיר DLS באמצעות קוביית בדיקה בעלת פוטנציאל zeta.
- לדלל 25 μL של תמיסת IR783/BC NP עם 725 μL של מים deionized במיקרו-צינור 1.5 מ"ל ולהוסיף את התמיסה לתוך cuvette בדיקה פוטנציאל zeta. מניחים את הקובט בחריץ הדגימה. מכסים את חריץ הדגימה.
- הגדר את סוג המדידה כ'פוטנציאל זטה' ואת טמפרטורת המדידה כ- 25 ° C. בצע 10 מדידות.
- הכינו את הדגימות להדמיית מיקרוסקופ אלקטרונים תמסורת (TEM). הוסף 10 μL של תמיסת IR783/BC NP על חתיכת סרט פחמן חורי על רשת נחושת (300 רשת) והסר 7 μL. השאר 3 μL של תמיסה על הסרט למשך הלילה לאידוי אוטומטי.
הערה: הוספת 10 μL של תמיסת NP ואחריה הסרה של 7 μL מאפשרת לטיפה לכסות שטח רחב יותר על הסרט.
4. פוטואקטיבציה של NPs IR783/BC
- התקינו מנורת לד (530 ננומטר; ראו טבלת חומרים) עם מעמד ברזל, כך שהאור יפנה ישירות לרצפת ההפעלה. מקם פוטודיודה כדורית משולבת (ראה טבלת חומרים) ישירות מתחת למנורת ה-LED.
הערה: כדי למנוע את השפעת האור הסביבתי, כל ניסויי הקרנת האור נערכים בחדר חושך. - הפעל את מנורת ה- LED ופתח את מכסה הפוטומטר. הקלט את הקרינה והגדר את פרמטרי המנורה באמצעות התוכנה המשויכת (ראה טבלת חומרים). התאם את זרם הכניסה (mA) כדי להגדיר את הקרינה כ- 50 mW/cm2.
הערה: הקרינה מושפעת גם מהמרחק בין מנורת הלד לפוטומטר. במערך המשמש כאן (איור 3A,B), המרחק קבוע על 5 ס"מ. - יש לדלל את תמיסת IR783/BC NP במים שעברו דה-יוניזציה ל-50 מיקרומטר בהתבסס על ריכוז BC. הוסף 200 μL של תמיסת IR783/BC NP למיקרו-צינור של 1.5 מ"ל. הניחו את הצינור על גוש קצף עם חריץ בגודל המתאים למיקרו-צינורית ובאותו גובה כמו הפוטומטר בשלב 4.1 (איור 3C,D).
- פתח את מכסה הצינור. הפעל את מנורת ה-LED והקרין את תמיסת הננו-חלקיקים למשך 1, 2, 3, 5, 7 ו-10 דקות.
- כימות צריכת BC ושחרור Cb על ידי HPLC לאחר הקרנת אור. חשב את אחוז שחרור BC ו- Cb הנותרים באמצעות המשוואות הבאות:

5. בדיקת ציטוטוקסיות של NPs IR783/BC עם וללא הקרנת אור
- תרבית תאי HCT116 (קו תאי גידול מעי גס אנושי) בתווך RPMI 1640 המכיל 10% נסיוב בקר עוברי ו-1% פניצילין-סטרפטומיצין (תווך מלא) באטמוספירה של 5% CO2 ב-37°C (~2 x 106 תאים לצלחת בצלחת תרבית תאים של 90 מ"מ). באופן שגרתי תת-תרבית של התאים כל 2-3 ימים.
הערה: HCT116 הוא קו תאי מעי גס אנושי. בהשוואה לתאים סרטניים אחרים כגון HeLa, MCF7 ותאי A549, תאי HCT-116 מבטאים רמה גבוהה יותר של caveolin-125, אשר יכול להיות ממוקד על ידי IR783 ולשפר את ספיגת התאים של IR783/BC NPs. - לוחית את תאי HCT116 בלוחות 96 בארות עם RPMI 1640 תווך שלם בצפיפות של 104 תאים לכל באר.
- שאפו את המדיום מצלחת התרבית כאשר מפגש התאים עולה על 50%. שטפו את התאים עם PBS 1x והסירו את PBS. הוסף 1 מ"ל של תמיסת טריפסין 0.25% ודגר ב 37 ° C באינקובטור 5% CO2 .
- לאחר 3 דקות, להוסיף 2 מ"ל של בינוני מלא כדי להרוות עיכול טריפסין. להשהות מחדש את התאים, להעביר את תרחיף התא לתוך צינור צנטריפוגה 15 מ"ל, וצנטריפוגה ב 300 x גרם במשך 3 דקות. השליכו את הסופרנאטנט והשעו מחדש את גלולת התא ב-1 מ"ל של תווך שלם.
- לדלל 10 μL של השעיית התא ל 200 μL עם מדיום מלא. מניחים 10 μL על המוציטומטר ומכסים אותו עם כיסוי.
- התבוננו בהמוציטומטר תחת מיקרוסקופ (עינית: 10x; עדשה אובייקטיבית: 4x). ספור ורשום את מספרי התאים בארבעת ריבועי הפינה ובמרכז. חשב את ריכוז התא באמצעות הנוסחה:
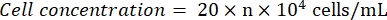
כאשר n = הממוצע של מספרי התאים של חמשת הריבועים. - לדלל את תרחיף התא ל 1 x 105 תאים/מ"ל. הוסף 100 μL של תרחיף התא לכל באר בצלחת 96 באר כדי לזרוע את התאים. הוסף 100 μL של PBS לכל באר בארות unseeded.
- טפל בתאים עם (1) 0.1-150 מיקרומטר ללא BC, (2) 0.1-150 מיקרומטר IR783/BC NPs (מבוסס על ריכוז BC), (3) 0.1-150 מיקרומטר חופשי BC עם קרינת אור, או (4) 0.1-150 מיקרומטר IR783/BC NPs (מבוסס על ריכוז BC) עם קרינת אור. לדגור את התאים ב 37 ° C ב 5% CO2 אינקובטור במשך 6 שעות.
הערה: פתרונות BC ו- IR783/BC NP החינמיים מדוללים מפתרונות המלאי שלהם בהתאמה עם מדיום מלא. - לאחר 6 שעות של דגירה, החלף את המדיום המכיל פרו-תרופה/ננו-חלקיקים בתווך שלם טרי. יש לדגור על קבוצות 1 ו-2 ללא הקרנה בחושך למשך 24 שעות. עבור קבוצות 3 ו -4, להקרין את התאים עם מנורת LED 530 ננומטר (50 mW / cm2) במשך 5 דקות, ולדגור במשך 24 שעות.
הערה: לוחות תאים ממוקמים על בלוק קצף כדי להבטיח גובה זהה לפוטומטר בשלב 4.1. - קבע את כדאיות התא עם 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT) assay.
- לאחר טיפול BC או ננו-חלקיקים, הוסף 10 μL של MTT (10 מ"ג / מ"ל ב- PBS) לכל באר ודגר על הלוחות ב -37 ° C במשך 3 שעות. לאחר מכן, להסיר את המדיום ולהוסיף 100 μL של DMSO לכל באר. קרא את הספיגה עם קורא microplate ב- 490 ננומטר, 570 ננומטר ו- 630 ננומטר.
- חשב את כדאיות התא באמצעות המשוואה הבאה:

הערה: ארבעה ניסויים עצמאיים (n = 4) מכל קבוצה נערכים לניתוח. OD490 יכול להיות מוחלף על ידי OD570-OD 630 בחישוב כדאיות התא.
תוצאות
NPs IR783/BC יוצרו בהצלחה במחקר זה באמצעות שיטת משקעים בזק. NPs IR783/BC המסונתזים הוצגו כתמיסה סגולה, בעוד שהתמיסה המימית של IR783 הייתה כחולה (איור 4A). כפי שניתן לראות באיור 4B, NPs IR783/BC הציגו גודל ממוצע של כ-87.22 ננומטר עם מדד פיזור פולי-פיזור (PDI) של 0.089, מה שמדגים התפלגות גוד...
Discussion
פרוטוקול זה מתאר שיטת משקעים הבזק קלה לייצור ננו-חלקיקים בצבע פרו-תרופות, המציעה גישה פשוטה ונוחה ליצירת ננו-חלקיקים. ישנם מספר שלבים קריטיים בשיטה זו. ראשית, עבור כל שלבי הסינתזה, הייצור והאפיון, מיכלים כמו מיקרו-צינורות צריכים להיות מכוסים בנייר כסף כדי למנוע פיצול מיותר של התרופה BC על יד...
Disclosures
בקשת PCT הוגשה במספר .PCT/CN2021/081262.
Acknowledgements
אנו מכירים בסיוע מאוניברסיטת הונג קונג Li Ka Shing Faculty of Medicine Faculty Core Facility. אנו מודים לפרופסור צ'י-מינג צ'ה מאוניברסיטת הונג קונג על אספקת קו התאים האנושי HCT116. עבודה זו נתמכה על ידי מרכז מינג וואי לאו לרפואה מתקנת תוכנית חברים עמיתים ומועצת מענקי המחקר של הונג קונג (תוכנית קריירה מוקדמת, מס '27115220).
Materials
| Name | Company | Catalog Number | Comments |
| 1260 Infinity II HPLC | Agilent Technologies | ||
| 2,4-Dimethyl pyrrole | J&K Scientific | 315305 | |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT) | Gibco | M6494 | |
| 4-Dimethylaminopyridine (4-DMAP) | J&K Scientific | 212279 | |
| 90 mm Petri Dish Clear Treated Sterile | SPL | 11090 | |
| 96-well Tissue Culture Plate Clear Treated Sterile | SPL | 30096 | |
| Acetoxyacetyl chloride | J&K Scientific | 192001 | |
| Boron trifluoride diethyl etherate | J&K Scientific | 921076 | |
| Büchner funnel | AS ONE | 3-6466-01 | |
| Chlorambucil | J&K Scientific | 321407-1G | |
| CM100 Transmission Electron Microscope | Philips | ||
| CombiFlash RF chromatography system | Teledyne ISCO | ||
| Dichloromethane | DUKSAN Pure Chemicals | JT9315-88 | |
| Dimethyl sulfoxide | DUKSAN Pure Chemicals | 2762 | |
| Disposable cuvette | Malvern Panalytical | DTS1070 | Zeta potential measurement |
| Disposable cuvette | Malvern Panalytical | ZEN0040 | |
| Empty Disposable Sample Load Cartridges | Teledyne ISCO | 693873225 | can hold up to 65 g |
| Fetal bovine serum | Gibco | 10270106 | |
| Filtering flask | AS ONE | 3-7089-03 | |
| Hexane | DUKSAN Pure Chemicals | 4198 | |
| Holey carbon film on copper grid | Beijing Zhongjingkeyi Technology Co.,Ltd | BZ10023a | |
| HPLC column (InfinityLab Poroshell 120) | Agilent Technologies | 695975-902T | |
| Integrating sphere photodiode power sensor | Thorlabs | S142C | |
| IR783 | Tokyo Chemical Industry (TCI) Co., Ltd | I1031 | |
| LED | Mightex | LCS-0530-15-11 | |
| LED Driver Control Panel V3.2.0 (Software) | Mightex | ||
| Lithium Hydroxide Anhydrous | TCI | L0225 | |
| Methylmagnesium iodide, 3M solution in diethyl ether | Aladdin | M140783 | |
| N,N-Diisopropyl ethyl amine (DIPEA) | J&K Scientific | 203402 | |
| N,N'-Dicyclohexylcarbodiimide (DCC) | J&K Scientific | 275928 | |
| penicillin–streptomycin | Gibco | 15140122 | |
| Phosphate-buffered saline (10×) | Sigma-Aldrich | P5493 | |
| Power and energy meter | Thorlabs | PM100 USB | |
| Rotavapor | BUCHI Rotavapor R300 | ||
| RMPI 1640 | Gibco | 21870076 | |
| Separatory funnel (125 mL) | Synthware | F474125L | |
| Silver Silica Gel Disposable Flash Columns, 40 g | Teledyne ISCO | 692203340 | |
| Sodium sulfate, anhydrous | Alfa Aesar | A19890 | |
| SpectraMax M4 | Molecular Devices LLC | ||
| Tetrahydrofuran (THF), anhydrous | J&K Scientific | 943616 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200056 | |
| Vortex | DLAB Scientific Co., Ltd | MX-S | |
| Zetasizer Nano ZS90 | Malvern Instrument |
References
- Chabner, B. A., Roberts, T. G. Chemotherapy and the war on cancer. Nature Reviews Cancer. 5 (1), 65-72 (2005).
- Monsuez, J. -. J., Charniot, J. -. C., Vignat, N., Artigou, J. -. Y. Cardiac side-effects of cancer chemotherapy. International Journal of Cardiology. 144 (1), 3-15 (2010).
- Floyd, J., Mirza, I., Sachs, B., Perry, M. C. Hepatotoxicity of chemotherapy. Seminars in Oncology. 33 (1), 50-67 (2006).
- Bar-Joseph, H., Stemmer, S. M., Tsarfaty, I., Shalgi, R., Ben-Aharon, I. Chemotherapy-induced vascular toxicity-real-time in vivo imaging of vessel impairment. Journal of Visualized Experiments. (95), e51650 (2015).
- Denny, W. A. Prodrug strategies in cancer therapy. European Journal of Medicinal Chemistry. 36 (7-8), 577-595 (2001).
- Kastrati, I., Delgado-Rivera, L., Georgieva, G., Thatcher, G. R. J., Frasor, J. Synthesis and characterization of an aspirin-fumarate prodrug that inhibits NFκB activity and breast cancer stem cells. Journal of Visualized Experiments. (119), e54798 (2017).
- Mao, J., et al. A simple dual-pH responsive prodrug-based polymeric micelles for drug delivery. ACS Applied Materials & Interfaces. 8 (27), 17109-17117 (2016).
- Li, S. -. Y., et al. A pH-responsive prodrug for real-time drug release monitoring and targeted cancer therapy. Chemical Communications. 50 (80), 11852-11855 (2014).
- Andresen, T. L., Thompson, D. H., Kaasgaard, T. Enzyme-triggered nanomedicine: Drug release strategies in cancer therapy (Invited Review). Molecular Membrane Biology. 27 (7), 353-363 (2010).
- Xu, G., McLeod, H. L. Strategies for enzyme/prodrug cancer therapy. Clinical Cancer Research. 7 (11), 3314-3324 (2001).
- Luo, W., et al. Dual-targeted and pH-sensitive doxorubicin prodrug-microbubble complex with ultrasound for tumor treatment. Theranostics. 7 (2), 452 (2017).
- Gao, J., et al. Ultrasound triggered phase-change nanodroplets for doxorubicin prodrug delivery and ultrasound diagnosis: An in vitro study. Colloids and Surfaces B: Biointerfaces. 174, 416-425 (2019).
- Brade, A. M., Szmitko, P., Ngo, D., Liu, F. -. F., Klamut, H. J. Heat-directed suicide gene therapy for breast cancer. Cancer Gene Therapy. 10 (4), 294-301 (2003).
- Long, K., et al. One-photon red light-triggered disassembly of small-molecule nanoparticles for drug delivery. Journal of Nanobiotechnology. 19 (1), 357 (2021).
- Liu, Y., Long, K., Kang, W., Wang, T., Wang, W. Optochemical control of immune checkpoint blockade via light-triggered PD-L1 dimerization. Advanced NanoBiomed Research. 2 (6), 2200017 (2022).
- Wang, T., et al. Optochemical control of mTOR signaling and mTOR-dependent autophagy. ACS Pharmacology & Translational Science. 5 (3), 149-155 (2022).
- Abet, V., Filace, F., Recio, J., Alvarez-Builla, J., Burgos, C. Prodrug approach: An overview of recent cases. European Journal of Medicinal Chemistry. 127, 810-827 (2017).
- Li, G., et al. Small-molecule prodrug nanoassemblies: an emerging nanoplatform for anticancer drug delivery. Small. 17 (52), 2101460 (2021).
- Shamay, Y., et al. Quantitative self-assembly prediction yields targeted nanomedicines. Nature Materials. 17 (4), 361-368 (2018).
- Sinoway, P. A., Callen, J. P. Chlorambucil. Arthritis & Rheumatism. 36 (3), 319-324 (1993).
- Owen, W. R., Stewart, P. J. Kinetics and mechanism of chlorambucil hydrolysis. Journal of Pharmaceutical Sciences. 68 (8), 992-996 (1979).
- Lv, W., et al. Upconversion-like photolysis of BODIPY-based prodrugs via a one-photon process. Journal of the American Chemical Society. 141 (44), 17482-17486 (2019).
- Silver, J. Let us teach proper thin layer chromatography technique. Journal of Chemical Education. 97 (12), 4217-4219 (2020).
- Saad, W. S., Prud'homme, R. K. Principles of nanoparticle formation by flash nanoprecipitation. Nano Today. 11 (2), 212-227 (2016).
- Long, K., et al. Photoresponsive prodrug-dye nanoassembly for in-situ monitorable cancer therapy. Bioengineering & Translational Medicine. 7 (3), 10311 (2022).
- Zhong, T., et al. A self-assembling nanomedicine of conjugated linoleic acid-paclitaxel conjugate (CLA-PTX) with higher drug loading and carrier-free characteristic. Scientific Reports. 6 (1), 36614 (2016).
- Long, K., et al. Green light-triggered intraocular drug release for intravenous chemotherapy of retinoblastoma. Advanced Science. 8 (20), 2101754 (2021).
- Lv, W., Wang, W. One-photon upconversion-like photolysis: a new strategy to achieve long-wavelength light-excitable photolysis. Synlett. 31 (12), 1129-1134 (2020).
- Rwei, A. Y., Wang, W., Kohane, D. S. Photoresponsive nanoparticles for drug delivery. Nano Today. 10 (4), 451-467 (2015).
- Grzelczak, M., Vermant, J., Furst, E. M., Liz-Marzán, L. M. Directed self-assembly of nanoparticles. ACS Nano. 4 (7), 3591-3605 (2010).
- Gnanasammandhan, M. K., Idris, N. M., Bansal, A., Huang, K., Zhang, Y. Near-IR photoactivation using mesoporous silica-coated NaYF4:Yb,Er/Tm upconversion nanoparticles. Nature Protocols. 11 (4), 688-713 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved