È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Facile preparazione e fotoattivazione di nanoassemblaggi di prodrug-dye
In questo articolo
Riepilogo
Questo protocollo descrive la fabbricazione e la caratterizzazione di un nanoassemblaggio profarmaco-colorante fotoreattivo. La metodologia per il rilascio di farmaci dalle nanoparticelle mediante smontaggio innescato dalla luce, compresa la configurazione dell'irradiazione luminosa, è esplicitamente descritta. I farmaci rilasciati dalle nanoparticelle dopo irradiazione luminosa hanno mostrato eccellenti effetti anti-proliferazione sulle cellule tumorali del colon-retto umano.
Abstract
L'autoassemblaggio è un metodo semplice ma affidabile per costruire sistemi di somministrazione di farmaci su scala nanometrica. I profarmaci fotoattivabili consentono il rilascio controllabile di farmaci da nanocarrier in siti bersaglio modulati dall'irradiazione luminosa. In questo protocollo, viene presentato un metodo semplice per fabbricare nanoparticelle fotoattivabili di coloranti profarmaco tramite auto-assemblaggio molecolare. Le procedure per la sintesi di profarmaci, la fabbricazione di nanoparticelle, la caratterizzazione fisica del nanoassemblaggio, la dimostrazione della fotoscissione e la verifica della citotossicità in vitro sono descritte in dettaglio. Un profarmaco boro-dipirrometene-clorambucile (BC) fotoscisivo è stato sintetizzato per la prima volta. BC e un colorante nel vicino infrarosso, IR-783, con un rapporto ottimizzato, potrebbero auto-assemblarsi in nanoparticelle (IR783 / BC NPs). Le nanoparticelle sintetizzate avevano una dimensione media di 87,22 nm e una carica superficiale di -29,8 mV. Le nanoparticelle si sono smontate dopo irradiazione luminosa, che potrebbe essere osservata mediante microscopia elettronica a trasmissione. La fotoscissione di BC è stata completata entro 10 minuti, con un'efficienza di recupero del 22% per il clorambucile. Le nanoparticelle hanno mostrato una maggiore citotossicità sotto irradiazione luminosa a 530 nm rispetto alle nanoparticelle non irradiate e al profarmaco BC libero irradiato. Questo protocollo fornisce un riferimento per la costruzione e la valutazione di sistemi di somministrazione di farmaci fotoresponsivi.
Introduzione
La chemioterapia è un trattamento comune del cancro che impiega agenti citotossici per uccidere le cellule tumorali e quindi inibisce la crescita del tumore1. Tuttavia, i pazienti possono soffrire di effetti collaterali come cardiotossicità ed epatotossicità a causa dell'assorbimento fuori bersaglio dei farmaci chemioterapici 2,3,4. Pertanto, la somministrazione localizzata del farmaco attraverso il controllo spaziotemporale del rilascio/attivazione del farmaco nei tumori è essenziale per ridurre al minimo l'esposizione al farmaco nei tessuti normali.
I profarmaci sono farmaci modificati chimicamente che presentano una ridotta tossicità nei tessuti normali pur mantenendo la loro azione nelle lesioni malate all'attivazione 5,6. I profarmaci possono rispondere a una varietà di stimoli, come pH7,8, enzimi 9,10, ultrasuoni 11,12, calore 13 e luce14,15,1 6, e rilasciare i loro farmaci genitori specificamente nelle lesioni. Tuttavia, molti profarmaci presentano inconvenienti intrinseci, come scarsa solubilità, tasso di assorbimento errato e distruzione metabolica precoce, che possono limitare il loro sviluppo17. In questo contesto, la formazione di nanoassemblaggi di profarmaci offre vantaggi come la diminuzione degli effetti collaterali, il rilascio di farmaci in situ, una migliore ritenzione e la combinazione di trattamento e imaging, indicando un grande potenziale applicativo per questi nanoassemblaggi. Molti nanoassemblaggi di profarmaci sono stati sviluppati per il trattamento delle malattie, tra cui nanosfere di profarmaco di doxorubicina, micelle di profarmaco di curcumina e nanofibre di profarmaco di camptotecina18.
In questo protocollo, presentiamo un metodo semplice per la preparazione di nanoassemblaggi profarmaco-colorante che mostrano un alto contenuto di profarmaco, una buona dispersibilità dell'acqua, stabilità a lungo termine e capacità di risposta sensibile. IR783 è un colorante nel vicino infrarosso solubile in acqua che può servire come stabilizzatore dei nanoassemblaggi19. L'altro componente del nanoassemblaggio è boro-dipirrometene-clorambucile (BODIPY-Cb, BC), un profarmaco che è stato progettato per due motivi principali. Poiché il clorambucile (Cb) mostra tossicità sistemica in vivo, la forma profarmaco può diminuire la sua tossicità20. Il profarmaco BC può essere fotoscisso utilizzando l'irradiazione luminosa a 530 nm diretta alle lesioni della malattia, consentendo il rilascio locale di Cb. D'altra parte, Cb è incline all'idrolisi in ambienti acquosi e può essere protetto trasformandolo in una forma di profarmaco21. Pertanto, ci si aspettava che il co-assemblaggio del profarmaco BC e del colorante IR-783 formasse un nanosistema di somministrazione del farmaco stabile ed efficace (Figura 1A). Questo nanoassemblaggio profarmaco-colorante migliora la dispersibilità e la stabilità delle molecole di profarmaco, suggerendo il suo potenziale per l'applicazione nella somministrazione di farmaci controllabili dalla luce. La fotoscissione del profarmaco BC consente lo smontaggio delle nanoparticelle e il rilascio controllato dalla luce di Cb nelle lesioni (Figura supplementare 1).
Protocollo
1. Sintesi del profarmaco boro-dipirrometene-clorambucile (BC) (Figura 2)22
- Sintesi di BODIPY-OAc
- Pesare 1,903 g di 2,4-dimetil pirrolo e scioglierlo in 20 mL di diclorometano anidro (DCM) in un matraccio a fondo tondo in atmosfera di azoto. Pesare 1,638 g di acetossi acetil cloruro e aggiungerlo goccia a goccia nella soluzione. Continuare ad agitare per 10 minuti a temperatura ambiente e quindi ridistribuire la soluzione per 1 h a 40 °C.
- Raffreddare la miscela a temperatura ambiente. Pesare 5,170 g di N,N-diisopropiletilammina (DIPEA) e aggiungerlo a goccia nella miscela agitando. Dopo 30 minuti, pesare 5,677 g di trifluoruro di boro dietil etere (BF3· OEt2), aggiungerlo goccia a goccia nella soluzione e continuare a mescolare per altri 30 minuti.
- Aggiungere 10 g di gel di silice (200-400 maglie) nella miscela e rimuovere il solvente mediante evaporazione rotativa a 45 °C. Arrestare l'evaporazione quando il gel di silice ritorna in polvere secca.
- Aggiungere una fritta sul fondo di una cartuccia (vedere Tabella dei materiali). Riempire il gel di silice (dal punto 1.1.3) nella cartuccia e quindi aggiungere un'altra fritta nella cartuccia sulla parte superiore del gel riempito.
- Fissare la cartuccia nel collare collegato al sistema di cromatografia flash (vedere Tabella dei materiali) e ruotarla per bloccarla. Installare la cartuccia sulla parte superiore della valvola a sei vie nel sistema di cromatografia flash e installare una colonna flash (vedere Tabella dei materiali) sotto la valvola.
- Avviare lo strumento cromatografico e impostare 515 nm e 365 nm come lunghezze d'onda di rilevamento. Eseguire l'eluizione con 4/3 (v/v) esano/DCM. Raccogliere le frazioni di eluente quando appare il segnale a 515 nm.
- Rimuovere il solvente dalle frazioni raccolte mediante evaporazione rotativa a 40 °C fino a quando non viene raccolto più solvente nel pallone di raccolta del solvente. Mettere il prodotto solido in una camera di essiccazione sottovuoto durante la notte per rimuovere il resto del solvente.
- Sintesi di BODIPY-OH
- Pesare 1,120 g di BODIPY-OAc (sintetizzato al punto 1.1) e scioglierlo in 70 mL di tetraidrofurano (THF) a temperatura ambiente, completamente coperto con un foglio. Aggiungere 70 mL di soluzione acquosa 0,1 M LiOH goccia a goccia nella soluzione BODIPY-OAc.
- Mescolare la miscela per 30 minuti e rimuovere il solvente a 40 °C mediante evaporazione rotativa fino a quando non viene raccolto altro solvente nel matraccio di raccolta del solvente. Porre il residuo in una camera di essiccazione sottovuoto durante la notte per rimuovere l'acqua.
- Sciogliere il residuo secco in 30 ml di DCM e aggiungere 10 g di gel di silice nella soluzione. Rimuovere il solvente mediante evaporazione rotativa a 40 °C. Arrestare l'evaporazione quando il gel di silice ritorna in polvere secca.
- Purificare il prodotto BODIPY-OH mediante cromatografia su colonna, seguendo i passaggi da 1.1.4 a 1.1.6, con DCM da solo come eluente.
- Confrontare le frazioni raccolte in diversi punti temporali di eluizione con una soluzione THF di BODIPY-OAc su cromatografia su strato sottile (TLC) e identificare il prodotto23.
- Spot 3-4 μL della frazione eluita e della soluzione BODIPY-OAc separatamente su un bordo di una piastra TLC alla stessa altezza. Posizionare la piastra TLC in una camera di vetro contenente 1 mL di DCM, immergendo il bordo macchiato nel solvente DCM ma con i due punti fuori dal solvente.
- Estrarre la piastra TLC quando il solvente DCM raggiunge oltre la metà dell'altezza della piastra. Selezionare la frazione eluita con uno spot TLC ad un'altezza diversa dallo spot BODIPY-OAc.
- Rimuovere il solvente mediante evaporazione rotativa a 40 °C (punto 1.1.7) per ottenere il prodotto BODIPY-OH.
- Sintesi di BODIPY-(Me)2-OH
- Pesare 313 mg di BODIPY-OH e scioglierlo in 35 ml di etere etilico anidro al buio in atmosfera di azoto. Aggiungere 3,75 mL di ioduro di metilmagnesio (3 M in etere etilico) goccia per goccia nella soluzione e continuare a mescolare per 3 ore a temperatura ambiente.
- Estinguere la reazione aggiungendo 3,5 ml di acqua a goccia.
- Estrarre la miscela con DCM e acqua.
- Trasferire la miscela in un imbuto separatore da 125 ml. Aggiungere 20 ml di DCM nella miscela.
- Chiudere il tappo dell'imbuto separatore. Inclinare l'imbuto di circa 45° e scuotere leggermente l'imbuto. Aprire il tappo per sgonfiare. Ripeti questo passaggio 3 volte e lascia riposare per 3 minuti.
- Aprire la valvola inferiore e raccogliere la fase organica inferiore in un becher.
- Aggiungere 30 ml di DCM alla fase acquosa. Ripetere l'estrazione (punti 1.3.3.2 e 1.3.3.3) 3 volte con 30 ml di DCM ogni volta.
- Aggiungere 10 g di Na2SO 4 solido nella fase organica raccolta per asciugare la fase organica durante la notte.
- Collegare un pallone filtrante a una pompa per vuoto con un tubo di gomma. Posare un pezzo di carta da filtro sull'imbuto Büchner e inserire l'imbuto nella parte superiore del pallone. Bagnare la carta da filtro con 1 mL di DCM, trasferire la miscela nell'imbuto e accendere la pompa per vuoto. Raccogliere la soluzione organica nel pallone.
- Aggiungere 10 g di gel di silice nella soluzione organica. Rimuovere il solvente organico mediante evaporazione rotativa a 40 °C fino a quando il gel di silice ritorna in polvere secca. Purificare il prodotto BODIPY-(Me)2-OH mediante cromatografia su colonna (punti da 1.1.4 a 1.1.6) con esano/DCM = 1/1 (v/v) come eluente.
- Selezionare le frazioni eluite contenenti il prodotto utilizzando l'analisi TLC come descritto al punto 1.2.5 (spot TLC ad un'altezza diversa da BODIPY-OH). Rimuovere il solvente mediante evaporazione rotativa a 40 °C per ottenere il prodotto come descritto al punto 1.1.7.
- Sintesi di BODIPY-(Me)2-I 2-OH
- Pesare 41 mg di BODIPY-(Me)2-OH e scioglierlo in 2,5 mL di THF anidro al buio in atmosfera di azoto. Pesare 74 mg di N-iodosuccinimide e scioglierlo in 1 mL di THF anidro.
- Aggiungere la soluzione di N-iodosuccinimide goccia a goccia nella soluzione BODIPY-(Me)2-OH. Dopo aver agitato per 3,5 ore a temperatura ambiente, rimuovere il solvente mediante evaporazione rotativa a 40 °C fino a quando non si raccoglie altro solvente nel matraccio di raccolta del solvente sull'evaporatore rotante.
- Sciogliere il residuo in 10 ml di DCM e lavarlo 3 volte con 30 ml di acqua ogni volta, come descritto al punto 1.3.3. Asciugare la fase organica con Na2SO 4 (fasi 1.3.4 e 1.3.5). Rimuovere il solvente mediante evaporazione rotativa a 40 °C (fase 1.1.7) per ottenere il prodotto BODIPY-(Me)2-I 2-OH.
- Sintesi di BODIPY-Cb
- Pesare 85 mg di clorambucile e scioglierlo in 2 ml di DCM anidro al buio sotto un'atmosfera di azoto. Pesare 69 mg di N,N'-dicicloesilcarbodiimmide e scioglierlo in 1 mL di DCM anidro. Aggiungere goccia a goccia nella soluzione di clorambucile agitando per 10 minuti.
- Sciogliere 1,7 mg di 4-dimetilamminopiridina in 0,5 ml di DCM anidro. Aggiungere questa soluzione nella miscela e continuare a mescolare per 10 minuti a temperatura ambiente. Quindi aggiungere 73 mg di BODIPY-(Me)2-I 2-OH sciolto in 2 ml di DCM anidro e continuare a mescolare per 2 ore.
- Aggiungere 10 g di gel di silice nella miscela e rimuovere il solvente mediante evaporazione rotativa a 40 °C. Arrestare l'evaporazione quando il gel di silice ritorna in polvere secca. Purificare il prodotto BODIPY-Cb mediante cromatografia su colonna (passi da 1.1.4 a 1.1.6, lunghezza d'onda del segnale 540 nm e 365 nm) con esano/DCM = 7/3 (v/v) come eluente.
- Selezionare le frazioni eluite contenenti il prodotto diverse da BODIPY-(Me)2-I 2-OH utilizzando l'analisi TLC (fase 1.2.5). Rimuovere il solvente mediante evaporazione rotativa a 40 °C (punto 1.1.7) per ottenere il prodotto BODIPY-Cb.
2. Preparazione delle NP IR783/BC con il metodo della precipitazione flash
- Pesare 10 mg del profarmaco BC (BODIPY-Cb) e scioglierlo in 1 mL di DMSO in un microtubo da 1,5 mL per ottenere una soluzione madre da 10 mg/ml. Coprire la soluzione BC con un foglio.
- Preparare 300 μL di 0,4 mg/mL IR-783 in acqua deionizzata filtrata in un microtubo da 1,5 ml. Posizionare questo microtubo su un miscelatore a vortice a 1.500 giri / min.
- Aggiungere 20 μL della soluzione BC in DMSO alla soluzione IR-783 oltre 10 s a velocità costante utilizzando una pipetta da 20 μL. L'estremità della punta della pipetta deve toccare la parete interna del microtubo (Figura 1B).
- Tenere il microtubo sul miscelatore a vortice per altri 30 s per ottenere la soluzione NP IR783/BC. Quindi, posizionare la soluzione di nanoparticelle su un rack completamente coperto con un foglio.
- Centrifugare la soluzione IR783/BC NP risultante per 10 minuti a 2.000 x g e 4 °C per rimuovere gli aggregati. Raccogliere il surnatante, lasciando ~ 20 μL nel tubo per evitare di disturbare il pellet. Scartare il pellet.
- Centrifugare il surnatante due volte per 30 minuti a 30.000 x g e 4 °C e raccogliere il precipitato di nanoparticelle da entrambe le centrifugazioni. Risospendere le nanoparticelle in 300 μL di 1x PBS.
NOTA: Quando il profarmaco BC idrofobico nel DMSO viene disperso in acqua con vortice, il DMSO viene sciolto dall'acqua e le molecole del profarmaco tendono a formare assemblaggi su scala nanometrica per mantenersi stabili nella situazione di supersaturazione locale24. - Quantificare il contenuto di IR-783 e BC mediante cromatografia liquida ad alta prestazione (HPLC), utilizzando il metodo di eluizione mostrato nella Tabella 1.
NOTA: Il campione HPLC viene preparato miscelando volumi uguali di soluzione di nanoparticelle e acetonitrile. Il volume di iniezione è di 20 μL. La lunghezza d'onda di rilevamento per clorambucil e profarmaco BC è 260 nm e la lunghezza d'onda di rilevamento per IR783 è 783 nm. La colonna HPLC è una colonna analitica C18 di 4,6 mm (diametro interno) x 100 mm (lunghezza), con una dimensione delle particelle di 2,7 μm e una dimensione dei pori di 120 Å. - Calcolare l'efficienza di incapsulamento del profarmaco (EE%) e la capacità di carico (LC%) secondo le seguenti equazioni:

| Tempo (min) | Acetonitrile (%) | Acqua (%) |
| 0 | 20 | 80 |
| 5 | 20 | 80 |
| 30 | 95 | 5 |
| 35 | 95 | 5 |
Tabella 1: Metodo HPLC per l'analisi qualitativa e quantitativa del profarmaco BC e della sua fotoscissione. Riprodotto con autorizzazione25. Diritto d'autore 2022, Wiley.
3. Caratterizzazione delle NP IR783/BC
- Misurare la dimensione media delle NP IR783/BC con uno strumento di diffusione dinamica della luce (DLS) (vedere la tabella dei materiali). Aggiungere 200 μL di soluzione IR783/BC NP in una cuvetta e inserire la cuvetta nel supporto per la misurazione. Impostare il tipo di misurazione come "dimensione" e la temperatura di misurazione su 25 °C. Eseguire tre misurazioni con una durata di 20 s per ogni misurazione.
- Misurare la carica superficiale delle NP IR783/BC con lo strumento DLS utilizzando una cuvetta di prova del potenziale zeta.
- Diluire 25 μL di soluzione NP IR783/BC con 725 μL di acqua deionizzata in un microtubo da 1,5 mL e aggiungere la soluzione in una cuvetta di prova con potenziale zeta. Posizionare la cuvetta nella scanalatura del campione. Tappare la scanalatura del campione.
- Impostare il tipo di misurazione come "potenziale zeta" e la temperatura di misurazione su 25 °C. Eseguire 10 misurazioni.
- Preparare i campioni per l'imaging al microscopio elettronico a trasmissione (TEM). Aggiungere 10 μL di soluzione NP IR783/BC su un pezzo di pellicola di carbonio holey su una griglia di rame (300 mesh) e rimuovere 7 μL. Lasciare 3 μL di soluzione sul film per una notte per l'autoevaporazione.
NOTA: L'aggiunta di 10 μL della soluzione NP seguita dalla rimozione di 7 μL consente alla goccia di coprire un'area più ampia sul film.
4. Fotoattivazione delle NP IR783/BC
- Installare una lampada a LED (530 nm; vedere Tabella dei materiali) con un supporto in ferro in modo che la luce sia rivolta direttamente verso il piano operatorio. Posizionare un fotometro a fotodiodo a sfera integrata (vedere Tabella dei materiali) direttamente sotto la lampada a LED.
NOTA: Per prevenire l'influenza della luce ambientale, tutti gli esperimenti di irradiazione luminosa sono condotti in camera oscura. - Accendere la lampada a LED e aprire il cappuccio del fotometro. Registrare l'irraggiamento e impostare i parametri della lampada utilizzando il software associato (vedere Tabella dei materiali). Regolare la corrente di ingresso (mA) per impostare l'irraggiamento come 50 mW/cm2.
NOTA: L'irradianza è influenzata anche dalla distanza tra la lampada LED e il fotometro. Nella configurazione utilizzata qui (Figura 3A,B), la distanza è fissata a 5 cm. - Diluire la soluzione di NP IR783/BC con acqua deionizzata a 50 μM in base alla concentrazione di BC. Aggiungere 200 μL della soluzione NP IR783/BC in un microtubo da 1,5 ml. Posizionare il tubo su un blocco di schiuma con una scanalatura del microtubo e la stessa altezza del fotometro al punto 4.1 (Figura 3C,D).
- Aprire il tappo del tubo. Accendere la lampada a LED e irradiare la soluzione di nanoparticelle per 1, 2, 3, 5, 7 e 10 minuti.
- Quantificare il consumo di BC e il rilascio di Cb da parte dell'HPLC dopo irradiazione luminosa. Calcolare la percentuale di rilascio rimanente di BC e Cb utilizzando le seguenti equazioni:

5. Prova della citotossicità delle NP IR783/BC con e senza irradiazione luminosa
- Coltura di cellule HCT116 (linea cellulare tumorale del colon-retto umano) in terreno RPMI 1640 contenente il 10% di siero bovino fetale e l'1% di penicillina-streptomicina (terreno completo) in atmosfera al 5% di CO2 a 37 °C (~2 x 106 cellule per piatto in un piatto di coltura cellulare da 90 mm). Sottocoltura di routine le cellule ogni 2-3 giorni.
NOTA: HCT116 è una linea cellulare del colon umano. Rispetto ad altre cellule tumorali come le cellule HeLa, MCF7 e A549, le cellule HCT-116 esprimono un livello più elevato di caveolina-125, che può essere bersaglio di IR783 e migliorare l'assorbimento cellulare delle NP IR783 / BC. - Placcare le celle HCT116 in piastre da 96 pozzetti con mezzo completo RPMI 1640 ad una densità di 104 celle per pozzetto.
- Aspirare il terreno dal piatto di coltura quando la confluenza cellulare supera il 50%. Lavare le celle con 1x PBS e rimuovere il PBS. Aggiungere 1 mL di soluzione di tripsina allo 0,25% e incubare a 37 °C in un incubatore al 5% di CO2 .
- Dopo 3 minuti, aggiungere 2 ml di terreno completo per estinguere la digestione della tripsina. Risospendere le celle, trasferire la sospensione cellulare in una provetta da centrifugazione da 15 ml e centrifugare a 300 x g per 3 minuti. Eliminare il surnatante e risospendere il pellet cellulare in 1 mL di terreno completo.
- Diluire 10 μL della sospensione cellulare a 200 μL con mezzo completo. Posizionare 10 μL su un emocitometro e coprirlo con un coprifoglio.
- Osservare l'emocitometro al microscopio (oculare: 10x; obiettivo: 4x). Contare e registrare i numeri di cella nei quattro quadrati angolari e al centro. Calcola la concentrazione cellulare usando la formula:
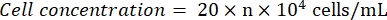
Dove n = la media dei numeri di cella dei cinque quadrati. - Diluire la sospensione cellulare a 1 x 105 cellule/ml. Aggiungere 100 μL della sospensione cellulare per pozzetto in una piastra da 96 pozzetti per seminare le cellule. Aggiungere 100 μL di PBS per pozzetto nei pozzetti non seminati.
- Trattare le cellule con (1) 0,1-150 μM di BC libero, (2) 0,1-150 μM IR783/BC NPs (in base alla concentrazione di BC), (3) 0,1-150 μM di BC libero con irradiazione luminosa, o (4) 0,1-150 μM IR783/BC NPs (in base alla concentrazione di BC) con irradiazione luminosa. Incubare le cellule a 37 °C in un incubatore al 5% di CO2 per 6 ore.
NOTA: Le soluzioni BC libere e IR783/BC NP sono diluite dalle rispettive soluzioni stock con mezzo completo. - Dopo 6 ore di incubazione, sostituire il mezzo contenente profarmaco/nanoparticelle con un terreno completo fresco. Incubare i gruppi 1 e 2 non irradianti al buio per 24 ore. Per i gruppi 3 e 4, irradiare le celle con una lampada LED da 530 nm (50 mW/cm2) per 5 minuti e incubare per 24 ore.
NOTA: le piastre delle celle sono posizionate su un blocco di schiuma per garantire la stessa altezza del fotometro al punto 4.1. - Determinare la vitalità cellulare con il saggio 3-(4,5-dimetiltiazol-2-il)-2,5-difenile tetrazolio bromuro (MTT).
- Dopo il trattamento con BC o nanoparticelle, aggiungere 10 μL di MTT (10 mg/ml in PBS) a ciascun pozzetto e incubare le piastre a 37 °C per 3 ore. Quindi, rimuovere il mezzo e aggiungere 100 μL di DMSO a ciascun pozzetto. Leggere l'assorbanza con un lettore di micropiastre a 490 nm, 570 nm e 630 nm.
- Calcola la vitalità cellulare usando la seguente equazione:

NOTA: Quattro esperimenti indipendenti (n = 4) di ciascun gruppo sono condotti per l'analisi. OD490 può essere sostituito da OD570-OD 630 nel calcolo della vitalità cellulare.
Risultati
Le NP IR783/BC sono state fabbricate con successo in questo studio utilizzando un metodo di precipitazione flash. Le NP IR783/BC sintetizzate si presentavano come una soluzione viola, mentre la soluzione acquosa di IR783 era blu (Figura 4A). Come mostrato nella Figura 4B, le NP IR783/BC hanno mostrato una dimensione media di circa 87,22 nm con un indice di polidispersità (PDI) di 0,089, dimostrando una distribuzione dimensionale ristretta. La carica superficial...
Discussione
Questo protocollo delinea un facile metodo di precipitazione flash per la fabbricazione di nanoparticelle di colorante profarmaco, che offre un approccio semplice e conveniente per la formazione di nanoparticelle. Ci sono diversi passaggi critici in questo metodo. In primo luogo, per tutte le fasi di sintesi, fabbricazione e caratterizzazione, i contenitori come i microtubi dovrebbero essere coperti con un foglio per evitare inutili fotoscissioni del profarmaco BC da parte della luce ambientale. Inoltre, nella fase di pr...
Divulgazioni
Una domanda PCT è stata depositata con il n.PCT / CN2021 / 081262.
Riconoscimenti
Riconosciamo l'assistenza della Facoltà di Medicina dell'Università di Hong Kong Li Ka Shing Faculty Core Facility. Ringraziamo il professor Chi-Ming Che dell'Università di Hong Kong per aver fornito la linea cellulare umana HCT116. Questo lavoro è stato sostenuto dal Ming Wai Lau Centre for Reparative Medicine Associate Member Program e dal Research Grants Council di Hong Kong (Early Career Scheme, No. 27115220).
Materiali
| Name | Company | Catalog Number | Comments |
| 1260 Infinity II HPLC | Agilent Technologies | ||
| 2,4-Dimethyl pyrrole | J&K Scientific | 315305 | |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT) | Gibco | M6494 | |
| 4-Dimethylaminopyridine (4-DMAP) | J&K Scientific | 212279 | |
| 90 mm Petri Dish Clear Treated Sterile | SPL | 11090 | |
| 96-well Tissue Culture Plate Clear Treated Sterile | SPL | 30096 | |
| Acetoxyacetyl chloride | J&K Scientific | 192001 | |
| Boron trifluoride diethyl etherate | J&K Scientific | 921076 | |
| Büchner funnel | AS ONE | 3-6466-01 | |
| Chlorambucil | J&K Scientific | 321407-1G | |
| CM100 Transmission Electron Microscope | Philips | ||
| CombiFlash RF chromatography system | Teledyne ISCO | ||
| Dichloromethane | DUKSAN Pure Chemicals | JT9315-88 | |
| Dimethyl sulfoxide | DUKSAN Pure Chemicals | 2762 | |
| Disposable cuvette | Malvern Panalytical | DTS1070 | Zeta potential measurement |
| Disposable cuvette | Malvern Panalytical | ZEN0040 | |
| Empty Disposable Sample Load Cartridges | Teledyne ISCO | 693873225 | can hold up to 65 g |
| Fetal bovine serum | Gibco | 10270106 | |
| Filtering flask | AS ONE | 3-7089-03 | |
| Hexane | DUKSAN Pure Chemicals | 4198 | |
| Holey carbon film on copper grid | Beijing Zhongjingkeyi Technology Co.,Ltd | BZ10023a | |
| HPLC column (InfinityLab Poroshell 120) | Agilent Technologies | 695975-902T | |
| Integrating sphere photodiode power sensor | Thorlabs | S142C | |
| IR783 | Tokyo Chemical Industry (TCI) Co., Ltd | I1031 | |
| LED | Mightex | LCS-0530-15-11 | |
| LED Driver Control Panel V3.2.0 (Software) | Mightex | ||
| Lithium Hydroxide Anhydrous | TCI | L0225 | |
| Methylmagnesium iodide, 3M solution in diethyl ether | Aladdin | M140783 | |
| N,N-Diisopropyl ethyl amine (DIPEA) | J&K Scientific | 203402 | |
| N,N'-Dicyclohexylcarbodiimide (DCC) | J&K Scientific | 275928 | |
| penicillin–streptomycin | Gibco | 15140122 | |
| Phosphate-buffered saline (10×) | Sigma-Aldrich | P5493 | |
| Power and energy meter | Thorlabs | PM100 USB | |
| Rotavapor | BUCHI Rotavapor R300 | ||
| RMPI 1640 | Gibco | 21870076 | |
| Separatory funnel (125 mL) | Synthware | F474125L | |
| Silver Silica Gel Disposable Flash Columns, 40 g | Teledyne ISCO | 692203340 | |
| Sodium sulfate, anhydrous | Alfa Aesar | A19890 | |
| SpectraMax M4 | Molecular Devices LLC | ||
| Tetrahydrofuran (THF), anhydrous | J&K Scientific | 943616 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200056 | |
| Vortex | DLAB Scientific Co., Ltd | MX-S | |
| Zetasizer Nano ZS90 | Malvern Instrument |
Riferimenti
- Chabner, B. A., Roberts, T. G. Chemotherapy and the war on cancer. Nature Reviews Cancer. 5 (1), 65-72 (2005).
- Monsuez, J. -. J., Charniot, J. -. C., Vignat, N., Artigou, J. -. Y. Cardiac side-effects of cancer chemotherapy. International Journal of Cardiology. 144 (1), 3-15 (2010).
- Floyd, J., Mirza, I., Sachs, B., Perry, M. C. Hepatotoxicity of chemotherapy. Seminars in Oncology. 33 (1), 50-67 (2006).
- Bar-Joseph, H., Stemmer, S. M., Tsarfaty, I., Shalgi, R., Ben-Aharon, I. Chemotherapy-induced vascular toxicity-real-time in vivo imaging of vessel impairment. Journal of Visualized Experiments. (95), e51650 (2015).
- Denny, W. A. Prodrug strategies in cancer therapy. European Journal of Medicinal Chemistry. 36 (7-8), 577-595 (2001).
- Kastrati, I., Delgado-Rivera, L., Georgieva, G., Thatcher, G. R. J., Frasor, J. Synthesis and characterization of an aspirin-fumarate prodrug that inhibits NFκB activity and breast cancer stem cells. Journal of Visualized Experiments. (119), e54798 (2017).
- Mao, J., et al. A simple dual-pH responsive prodrug-based polymeric micelles for drug delivery. ACS Applied Materials & Interfaces. 8 (27), 17109-17117 (2016).
- Li, S. -. Y., et al. A pH-responsive prodrug for real-time drug release monitoring and targeted cancer therapy. Chemical Communications. 50 (80), 11852-11855 (2014).
- Andresen, T. L., Thompson, D. H., Kaasgaard, T. Enzyme-triggered nanomedicine: Drug release strategies in cancer therapy (Invited Review). Molecular Membrane Biology. 27 (7), 353-363 (2010).
- Xu, G., McLeod, H. L. Strategies for enzyme/prodrug cancer therapy. Clinical Cancer Research. 7 (11), 3314-3324 (2001).
- Luo, W., et al. Dual-targeted and pH-sensitive doxorubicin prodrug-microbubble complex with ultrasound for tumor treatment. Theranostics. 7 (2), 452 (2017).
- Gao, J., et al. Ultrasound triggered phase-change nanodroplets for doxorubicin prodrug delivery and ultrasound diagnosis: An in vitro study. Colloids and Surfaces B: Biointerfaces. 174, 416-425 (2019).
- Brade, A. M., Szmitko, P., Ngo, D., Liu, F. -. F., Klamut, H. J. Heat-directed suicide gene therapy for breast cancer. Cancer Gene Therapy. 10 (4), 294-301 (2003).
- Long, K., et al. One-photon red light-triggered disassembly of small-molecule nanoparticles for drug delivery. Journal of Nanobiotechnology. 19 (1), 357 (2021).
- Liu, Y., Long, K., Kang, W., Wang, T., Wang, W. Optochemical control of immune checkpoint blockade via light-triggered PD-L1 dimerization. Advanced NanoBiomed Research. 2 (6), 2200017 (2022).
- Wang, T., et al. Optochemical control of mTOR signaling and mTOR-dependent autophagy. ACS Pharmacology & Translational Science. 5 (3), 149-155 (2022).
- Abet, V., Filace, F., Recio, J., Alvarez-Builla, J., Burgos, C. Prodrug approach: An overview of recent cases. European Journal of Medicinal Chemistry. 127, 810-827 (2017).
- Li, G., et al. Small-molecule prodrug nanoassemblies: an emerging nanoplatform for anticancer drug delivery. Small. 17 (52), 2101460 (2021).
- Shamay, Y., et al. Quantitative self-assembly prediction yields targeted nanomedicines. Nature Materials. 17 (4), 361-368 (2018).
- Sinoway, P. A., Callen, J. P. Chlorambucil. Arthritis & Rheumatism. 36 (3), 319-324 (1993).
- Owen, W. R., Stewart, P. J. Kinetics and mechanism of chlorambucil hydrolysis. Journal of Pharmaceutical Sciences. 68 (8), 992-996 (1979).
- Lv, W., et al. Upconversion-like photolysis of BODIPY-based prodrugs via a one-photon process. Journal of the American Chemical Society. 141 (44), 17482-17486 (2019).
- Silver, J. Let us teach proper thin layer chromatography technique. Journal of Chemical Education. 97 (12), 4217-4219 (2020).
- Saad, W. S., Prud'homme, R. K. Principles of nanoparticle formation by flash nanoprecipitation. Nano Today. 11 (2), 212-227 (2016).
- Long, K., et al. Photoresponsive prodrug-dye nanoassembly for in-situ monitorable cancer therapy. Bioengineering & Translational Medicine. 7 (3), 10311 (2022).
- Zhong, T., et al. A self-assembling nanomedicine of conjugated linoleic acid-paclitaxel conjugate (CLA-PTX) with higher drug loading and carrier-free characteristic. Scientific Reports. 6 (1), 36614 (2016).
- Long, K., et al. Green light-triggered intraocular drug release for intravenous chemotherapy of retinoblastoma. Advanced Science. 8 (20), 2101754 (2021).
- Lv, W., Wang, W. One-photon upconversion-like photolysis: a new strategy to achieve long-wavelength light-excitable photolysis. Synlett. 31 (12), 1129-1134 (2020).
- Rwei, A. Y., Wang, W., Kohane, D. S. Photoresponsive nanoparticles for drug delivery. Nano Today. 10 (4), 451-467 (2015).
- Grzelczak, M., Vermant, J., Furst, E. M., Liz-Marzán, L. M. Directed self-assembly of nanoparticles. ACS Nano. 4 (7), 3591-3605 (2010).
- Gnanasammandhan, M. K., Idris, N. M., Bansal, A., Huang, K., Zhang, Y. Near-IR photoactivation using mesoporous silica-coated NaYF4:Yb,Er/Tm upconversion nanoparticles. Nature Protocols. 11 (4), 688-713 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon