É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fácil preparação e fotoativação de nanomontagens de pró-fármaco-corante
Neste Artigo
Resumo
Este protocolo descreve a fabricação e caracterização de um nanoconjunto fotorresponsivo de corante pró-fármaco. A metodologia para liberação de fármacos a partir das nanopartículas por desmontagem desencadeada por luz, incluindo a configuração da irradiação luminosa, é explicitamente descrita. Os fármacos liberados das nanopartículas após irradiação luminosa exibiram excelentes efeitos antiproliferativos em células tumorais colorretais humanas.
Resumo
A automontagem é um método simples, mas confiável, para a construção de sistemas de liberação de fármacos em nanoescala. Os pró-fármacos fotoativáveis permitem a liberação controlável de fármacos a partir de nanocarreadores em locais-alvo modulados pela irradiação luminosa. Neste protocolo, um método fácil para a fabricação de nanopartículas fotoativáveis de pró-fármaco corante via automontagem molecular é apresentado. Os procedimentos para síntese de pró-fármacos, fabricação de nanopartículas, caracterização física da nanomontagem, demonstração de fotoclivagem e verificação de citotoxicidade in vitro são descritos em detalhes. Um pró-fármaco fotoclimovível boro-dipirrometeno-clorambucil (BC) foi sintetizado pela primeira vez. BC e um corante de infravermelho próximo, IR-783, em uma proporção otimizada, poderiam se auto-montar em nanopartículas (IR783/BC NPs). As nanopartículas sintetizadas apresentaram tamanho médio de 87,22 nm e carga superficial de -29,8 mV. As nanopartículas se desmontaram após irradiação luminosa, o que pôde ser observado por microscopia eletrônica de transmissão. A fotoclivagem da CB foi concluída em 10 min, com eficiência de recuperação de 22% para clorambucil. As nanopartículas apresentaram maior citotoxicidade sob irradiação luminosa a 530 nm em comparação com as nanopartículas não irradiadas e o pró-fármaco BC livre irradiado. Este protocolo fornece uma referência para a construção e avaliação de sistemas de liberação fotorresponsiva de fármacos.
Introdução
A quimioterapia é um tratamento comum do câncer que emprega agentes citotóxicos para matar as células cancerosas e, assim, inibe o crescimento tumoral1. Entretanto, os pacientes podem sofrer efeitos colaterais como cardiotoxicidade e hepatotoxicidade devido à absorção fora do alvo dos quimioterápicos 2,3,4. Portanto, a liberação localizada de fármacos por meio do controle espaço-temporal da liberação/ativação de fármacos em tumores é essencial para minimizar a exposição a fármacos em tecidos normais.
Os pró-fármacos são drogas quimicamente modificadas que apresentam toxicidade reduzida em tecidos normais, mantendo sua ação em lesões doentes após ativação 5,6. Os pró-fármacos podem ser responsivos a uma variedade de estímulos, como pH7,8, enzimas9,10, ultrassom 11,12, calor 13 e luz14,15,1 6, e liberar seus fármacos precursores especificamente nas lesões. No entanto, muitos pró-fármacos apresentam desvantagens inerentes, como baixa solubilidade, taxa de absorção incorreta e destruição metabólica precoce, o que pode limitar seu desenvolvimento17. Nesse contexto, a formação de nanomontagens de pró-fármacos oferece vantagens como diminuição de efeitos colaterais, liberação in situ de fármacos, melhor retenção e combinação de tratamento e imagem, indicando grande potencial de aplicação desses nanoconjuntos. Muitos nanoconjuntos de pró-fármacos foram desenvolvidos para o tratamento de doenças, incluindo nanoesferas de pró-fármacos de doxorrubicina, micelas de pró-fármacos para curcumina e nanofibras de pró-fármacos para camptotecina18.
Neste protocolo, apresentamos um método simples para a preparação de nanomontagens de corantes pró-fármacos que exibem alto conteúdo de pró-fármaco, boa dispersibilidade em água, estabilidade a longo prazo e capacidade de resposta sensível. O IR783 é um corante solúvel em água no infravermelho próximo que pode servir como estabilizador das nanomontagens19. O outro componente da nanomontagem é o boro-dipirrometeno-clorambucil (BODIPY-Cb, BC), um pró-fármaco que foi projetado por duas razões principais. Como o clorambucil (Cb) apresenta toxicidade sistêmica in vivo, a forma pró-fármaco pode diminuir sua toxicidade20. O pró-fármaco BC pode ser fotoclivado com irradiação luminosa de 530 nm direcionada às lesões da doença, possibilitando a liberação local de Cb. Por outro lado, o Cb é propenso à hidrólise em ambientes aquosos, podendo ser protegido transformando-se em pró-fármaco21. Assim, esperava-se que a co-montagem do pró-fármaco BC e do corante IR-783 formasse um nanossistema de liberação estável e eficaz de fármacos (Figura 1A). Esta nanomontagem de pró-fármaco-corante melhora a dispersibilidade e estabilidade das moléculas de pró-fármaco, sugerindo seu potencial para aplicação na liberação de fármacos controláveis por luz. A fotoclivagem do pró-fármaco BC possibilita a desmontagem das nanopartículas e a liberação de Cb nas lesões controlada pela luz (Figura 1 suplementar).
Protocolo
1. Síntese do pró-fármaco boro-dipirrometeno-clorambucil (BC) (Figura 2)22
- Síntese de BODIPY-OAc
- Pesar 1,903 g de 2,4-dimetilpirrol e dissolvê-lo em 20 ml de diclorometano anidro (DCM) num balão de fundo redondo sob atmosfera de azoto. Pesar 1,638 g de cloreto de acetila acetóxi e adicioná-lo gota a gota na solução. Continuar a mexer durante 10 minutos à temperatura ambiente e, em seguida, refluir a solução durante 1 h a 40 °C.
- Arrefecer a mistura até à temperatura ambiente. Pesar 5,170 g de N,N-diisopropiletilamina (DIPEA) e adicioná-lo gota a gota na mistura sob agitação. Após 30 min, pesar 5,677 g de trifluoreto de boro dietiléter (BF3· OEt2), adicione-o gota na solução e continue mexendo por mais 30 min.
- Adicionar 10 g de sílica gel (200-400 mesh) à mistura e remover o solvente por evaporação rotativa a 45 °C. Pare a evaporação quando o gel de sílica retornar ao pó seco.
- Adicione uma frita na parte inferior de um cartucho (consulte a Tabela de Materiais). Encha o gel de sílica (do passo 1.1.3) no cartucho e, em seguida, adicione outra frita no cartucho na parte superior do gel cheio.
- Fixe o cartucho no colar conectado com o sistema de cromatografia flash (consulte Tabela de Materiais) e vire-o para travá-lo. Instale o cartucho na parte superior da válvula de seis vias no sistema de cromatografia flash e instale uma coluna de flash (consulte Tabela de Materiais) sob a válvula.
- Inicie o instrumento de cromatografia e defina 515 nm e 365 nm como comprimentos de onda de detecção. Realizar eluição com 4/3 (v/v) hexano/DCM. Colete as frações eluentes quando o sinal de 515 nm aparecer.
- Remover o solvente das fracções recolhidas por evaporação rotativa a 40 °C até que não seja recolhido mais solvente no balão de recolha de solvente. Coloque o produto sólido em uma câmara de secagem a vácuo durante a noite para remover o restante do solvente.
- Síntese de BODIPY-OH
- Pesar 1,120 g de BODIPY-OAc (sintetizado no passo 1.1) e dissolvê-lo em 70 ml de tetraidrofurano (THF) à temperatura ambiente, totalmente coberto com papel alumínio. Adicionar 70 mL de solução aquosa de LiOH 0,1 M gota a gota na solução de BODIPY-OAc.
- Agitar a mistura durante 30 min e remover o solvente a 40 °C por evaporação rotativa até que não seja recolhido mais solvente no balão de recolha de solventes. Coloque o resíduo em uma câmara de secagem a vácuo durante a noite para remover a água.
- Dissolva o resíduo seco em 30 mL de CMD e adicione 10 g de sílica gel na solução. Retire o solvente por evaporação rotativa a 40 °C. Pare a evaporação quando o gel de sílica retornar ao pó seco.
- Purificar o produto BODIPY-OH por cromatografia em coluna, seguindo os passos 1.1.4 a 1.1.6, tendo como eluente apenas DCM.
- Comparar frações coletadas em diferentes momentos de eluição com uma solução de THF de BODIPY-OAc em cromatografia em camada delgada (CCD) e identificar o produto23.
- Spot 3-4 μL da fração eluída e a solução de BODIPY-OAc separadamente em uma borda de uma placa de CCD na mesma altura. Coloque a placa de CCD em uma câmara de vidro contendo 1 mL de CMD, submergindo a borda manchada no solvente de MDC, mas com os dois pontos fora do solvente.
- Retire a placa TLC quando o solvente DCM atingir mais da metade da altura da placa. Selecione a fração eluída com um ponto TLC a uma altura diferente do ponto BODIPY-OAc.
- Remover o solvente por evaporação rotativa a 40 °C (passo 1.1.7) para obter o produto BODIPY-OH.
- Síntese de BODIPY-(Me)2-OH
- Pesar 313 mg de BODIPY-OH e dissolvê-lo em 35 mL de éter dietílico anidro no escuro sob atmosfera de nitrogênio. Adicionar 3,75 ml de iodeto de metilmagnésio (3 M em éter dietílico) gota a gota na solução e continuar a mexer durante 3 h à temperatura ambiente.
- Atenuar a reação adicionando 3,5 mL de água gotas.
- Extraia a mistura com DCM e água.
- Transfira a mistura para um funil separador de 125 mL. Adicionar 20 mL de CMD à mistura.
- Feche a tampa do funil separador. Incline o funil em torno de 45° e agite levemente o funil. Abra a tampa para desinflar. Repita este passo 3 vezes e deixe repousar durante 3 minutos.
- Abra a válvula inferior e colete a fase orgânica inferior em um béquer.
- Adicionar 30 mL de CMD à fase aquosa. Repetir a extracção (passos 1.3.3.2 e 1.3.3.3) 3 vezes com 30 ml de CMD de cada vez.
- Adicionar 10 g de Na2SO4 sólido na fase orgânica coletada para secar a fase orgânica durante a noite.
- Ligue um frasco filtrante a uma bomba de vácuo com um tubo de borracha. Coloque um pedaço de papel filtro no funil de Büchner e insira o funil na parte superior do frasco. Molhe o papel de filtro com 1 mL de DCM, transfira a mistura para o funil e ligue a bomba de vácuo. Recolher a solução orgânica no balão.
- Adicione 10 g de sílica gel à solução orgânica. Remover o solvente orgânico por evaporação rotativa a 40 °C até que o gel de sílica volte ao pó seco. Purificar o produto BODIPY-(Me)2-OH por cromatografia em coluna (passos 1.1.4 a 1.1.6) com hexano/DCM = 1/1 (v/v) como eluente.
- Seleccionar as fracções eluídas que contêm o produto utilizando a análise de CCD descrita no passo 1.2.5 (ponto de CCD a uma altura diferente da BODIPY-OH). Remover o solvente por evaporação rotativa a 40 °C para obter o produto conforme descrito no passo 1.1.7.
- Síntese de BODIPY-(Me)2-I 2-OH
- Pesar 41 mg de BODIPY-(Me)2-OH e dissolvê-lo em 2,5 mL de THF anidro no escuro sob atmosfera de nitrogênio. Pesar 74 mg de N-iodosuccinimida e dissolvê-lo em 1 ml de THF anidro.
- Adicionar a solução de N-iodosuccinimida gota a gota na solução de BODIPY-(Me)2-OH. Depois de agitar durante 3,5 h à temperatura ambiente, remover o solvente por evaporação rotativa a 40 °C até que não seja recolhido mais solvente no balão de recolha de solvente no evaporador rotativo.
- Dissolver o resíduo em 10 mL de CMD e lavá-lo 3 vezes com 30 mL de água de cada vez, conforme descrito na etapa 1.3.3. Secar a fase orgânica com Na2SO 4 (passos 1.3.4 e 1.3.5). Remover o solvente por evaporação rotativa a 40 °C (passo 1.1.7) para obter o produto BODIPY-(Me)2-I 2-OH.
- Síntese de BODIPY-Cb
- Pesar 85 mg de clorambucil e dissolvê-lo em 2 ml de CMD anidro no escuro sob atmosfera de azoto. Pesar 69 mg de N,N'-diciclohexilcarbodiimida e dissolvê-lo em 1 ml de CMD anidra. Adicione gota a gota na solução de clorambucil com agitação por 10 min.
- Dissolver 1,7 mg de 4-dimetilaminopiridina em 0,5 mL de CMD anidra. Adicione esta solução à mistura e continue a mexer durante 10 minutos à temperatura ambiente. Em seguida, adicione 73 mg de BODIPY-(Me)2-I 2-OH dissolvido em 2 mL de DCM anidro e continue mexendo por2 h.
- Adicionar 10 g de sílica gel à mistura e remover o solvente por evaporação rotativa a 40 °C. Pare a evaporação quando o gel de sílica retornar ao pó seco. Purificar o produto BODIPY-Cb por cromatografia em coluna (passos 1.1.4 a 1.1.6, comprimento de onda de sinal de 540 nm e 365 nm) com hexano/DCM = 7/3 (v/v) como eluente.
- Selecionar as frações eluídas contendo o produto diferente de BODIPY-(Me)2-I 2-OH usando a análise de CCD (etapa 1.2.5). Remover o solvente por evaporação rotativa a 40 °C (passo 1.1.7) para obter o produto BODIPY-Cb.
2. Preparação de NPs IR783/BC pelo método de precipitação instantânea
- Pesar 10 mg do pró-fármaco BC (BODIPY-Cb) e dissolvê-lo em 1 mL de DMSO em um microtubo de 1,5 mL para obter uma solução-estoque de 10 mg/mL. Cubra a solução BC com papel alumínio.
- Preparar 300 μL de 0,4 mg/mL IR-783 em água deionizada filtrada em um microtubo de 1,5 mL. Coloque este microtubo em um misturador de vórtices a 1.500 rpm.
- Adicionar 20 μL da solução BC em DMSO à solução IR-783 durante 10 s a uma taxa constante utilizando uma pipeta de 20 μL. A extremidade da ponta da pipeta deve tocar a parede interna do microtubo (Figura 1B).
- Mantenha o microtubo no misturador de vórtice por mais 30 s para obter a solução IR783/BC NP. Em seguida, coloque a solução de nanopartículas em um rack totalmente coberto com papel alumínio.
- Centrifugar a solução IR783/BC NP resultante por 10 min a 2.000 x g e 4 °C para remover agregados. Recolher o sobrenadante, deixando ~20 μL no tubo para evitar perturbar o pellet. Descarte o pellet.
- Centrifugar o sobrenadante duas vezes por 30 min a 30.000 x g e 4 °C e coletar o precipitado de nanopartículas de ambas as centrifugações. Ressuspender as nanopartículas em 300 μL de 1x PBS.
NOTA: Quando o pró-fármaco BC hidrofóbico em DMSO é disperso em água com vórtice, o DMSO é dissolvido por água, e as moléculas de pró-fármaco tendem a formar conjuntos nanométricos para se manterem estáveis sob a situação de supersaturação local24. - Quantificar o conteúdo de IR-783 e BC por cromatografia líquida de alta eficiência (HPLC), usando o método de eluição mostrado na Tabela 1.
NOTA: A amostra de HPLC é preparada misturando volumes iguais de solução de nanopartículas e acetonitrila. O volume de injeção é de 20 μL. O comprimento de onda de detecção para clorambucil e pró-fármaco BC é de 260 nm, e o comprimento de onda de detecção para IR783 é de 783 nm. A coluna HPLC é uma coluna analítica C18 de 4,6 mm (diâmetro interno) x 100 mm (comprimento), com tamanho de partícula de 2,7 μm e tamanho de poro de 120 Å. - Calcular a eficiência de encapsulação de pró-fármacos (EE%) e a capacidade de carga (CL%) de acordo com as seguintes equações:

| Tempo (min) | Acetonitrila (%) | Água (%) |
| 0 | 20 | 80 |
| 5 | 20 | 80 |
| 30 | 95 | 5 |
| 35 | 95 | 5 |
Tabela 1: Método por HPLC para análise qualitativa e quantitativa do pró-fármaco BC e sua fotoclivagem. Reproduzido com permissão25. Direitos autorais 2022, Wiley.
3. Caracterização dos NPs IR783/BC
- Meça o tamanho médio dos NPs IR783/BC com um instrumento de espalhamento dinâmico de luz (DLS) (consulte a Tabela de Materiais). Adicionar 200 μL de solução IR783/BC NP numa cubeta e introduzir a cubeta no suporte para medição. Defina o tipo de medição como 'tamanho' e a temperatura de medição como 25 °C. Realizar três medições com duração de 20 s para cada medida.
- Meça a carga superficial dos NPs IR783/BC com o instrumento DLS usando uma cubeta de teste de potencial zeta.
- Diluir 25 μL de solução de IR783/BC NP com 725 μL de água deionizada num microtubo de 1,5 ml e adicionar a solução a uma cubeta de teste de potencial zeta. Coloque a cubeta no sulco da amostra. Tampar o sulco da amostra.
- Defina o tipo de medição como «potencial zeta» e a temperatura de medição como 25 °C. Realize 10 medições.
- Preparar as amostras para imagens de microscopia eletrônica de transmissão (MET). Adicionar 10 μL de solução de NP IR783/BC em um pedaço de filme de carbono holey em uma grade de cobre (300 mesh) e remover 7 μL. Deixe 3 μL de solução no filme durante a noite para autoevaporação.
NOTA: A adição de 10 μL da solução NP seguida da remoção de 7 μL permite que a gotícula cubra uma área mais ampla no filme.
4. Fotoativação de NPs IR783/BC
- Configure uma lâmpada LED (530 nm; ver Tabela de Materiais) com um suporte de ferro para que a luz esteja diretamente voltada para o piso de operação. Coloque um fotômetro de fotodiodo de esfera integradora (consulte Tabela de Materiais) diretamente sob a lâmpada LED.
NOTA: Para evitar a influência da luz ambiente, todos os experimentos de irradiação de luz são realizados em uma câmara escura. - Ligue a lâmpada LED e abra a tampa do fotômetro. Registre a irradiância e defina os parâmetros da lâmpada usando o software associado (consulte a Tabela de Materiais). Ajuste a corrente de entrada (mA) para ajustar a irradiância como 50 mW/cm2.
NOTA: A irradiância também é afetada pela distância entre a lâmpada LED e o fotômetro. No arranjo aqui utilizado (Figura 3A,B), a distância é fixada em 5 cm. - Diluir a solução IR783/BC NP com água deionizada para 50 μM com base na concentração de BC. Adicionar 200 μL da solução IR783/BC NP num microtubo de 1,5 ml. Colocar o tubo sobre um bloco de espuma com um sulco de encaixe do tamanho do microtubo e a mesma altura do fotômetro no passo 4.1 (Figura 3C,D).
- Abra a tampa do tubo. Ligue a lâmpada LED e irradie a solução de nanopartículas por 1, 2, 3, 5, 7 e 10 min.
- Quantificar o consumo de BC e a liberação de Cb por HPLC após irradiação luminosa. Calcule a porcentagem de liberação BC e Cb restantes usando as seguintes equações:

5. Teste de citotoxicidade de NPs IR783/BC com e sem irradiação luminosa
- Cultura de células HCT116 (linhagem de células tumorais colorretais humanas) em meio RPMI 1640 contendo 10% de soro fetal bovino e 1% de Penicilina-Estreptomicina (meio completo) em atmosfera de 5% de CO2 a 37 °C (~2 x 106 células por prato em uma placa de cultura celular de 90 mm). Subcultura rotineiramente as células a cada 2-3 dias.
NOTA: HCT116 é uma linhagem celular de cólon humano. Em comparação com outras células cancerosas, como HeLa, MCF7 e A549, as células HCT-116 expressam um nível mais alto de caveolina-125, que pode ser alvo de IR783 e aumentar a captação celular de NPs IR783/BC. - Plaquear as células HCT116 em placas de 96 poços com meio completo RPMI 1640 a uma densidade de 10a 4 células por poço.
- Aspirar o meio da placa de cultura quando a confluência celular exceder 50%. Lave as células com 1x PBS e remova o PBS. Adicionar 1 mL de solução de tripsina a 0,25% e incubar a 37 °C em incubadora de CO2 a 5%.
- Após 3 min, adicionar 2 mL de meio completo para extinguir a digestão de tripsina. Ressuspender as células, transferir a suspensão celular para um tubo de centrifugação de 15 mL e centrifugar a 300 x g por 3 min. Descarte o sobrenadante e ressuspenda o pellet celular em 1 mL de meio completo.
- Diluir 10 μL da suspensão celular para 200 μL com meio completo. Coloque 10 μL em um hemocitômetro e cubra com uma lamínula.
- Observar o hemocitômetro ao microscópio (ocular: 10x; objetiva: 4x). Conte e registre os números de célula nos quatro quadrados de canto e no centro. Calcule a concentração celular usando a fórmula:
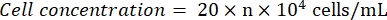
Onde n = a média dos números de células dos cinco quadrados. - Diluir a suspensão celular para 1 x 105 células/mL. Adicionar 100 μL da suspensão celular por poço em uma placa de 96 poços para semear as células. Adicionar 100 μL de PBS por poço nos poços não semeados.
- Tratar as células com (1) 0,1-150 μM de BC livre, (2) 0,1-150 μM de NPs IR783/BC (com base na concentração de BC), (3) 0,1-150 μM de BC livre com irradiação de luz, ou (4) 0,1-150 μM de NPs IR783/BC (com base na concentração de BC) com irradiação de luz. Incubar as células a 37 °C numa estufa de CO2 a 5% durante 6 horas.
NOTA: As soluções livres BC e IR783/BC NP são diluídas a partir de suas respectivas soluções de estoque com meio completo. - Após 6 h de incubação, substituir o meio contendo pró-fármaco/nanopartículas por meio fresco completo. Incubar os Grupos 1 e 2 sem irradiação no escuro por 24 h. Para os Grupos 3 e 4, irradiar as células com lâmpada LED de 530 nm (50 mW/cm2) por 5 min e incubar por 24 h.
NOTA: As placas celulares são colocadas sobre um bloco de espuma para garantir a mesma altura que o fotômetro na etapa 4.1. - Determinar a viabilidade celular com o ensaio de brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difenil tetrazólio (MTT).
- Após o tratamento BC ou nanopartículas, adicionar 10 μL de MTT (10 mg/mL em PBS) a cada poço e incubar as placas a 37 °C por 3 h. Em seguida, retire o meio e adicione 100 μL de DMSO a cada poço. Leia a absorbância com um leitor de microplacas a 490 nm, 570 nm e 630 nm.
- Calcule a viabilidade celular usando a seguinte equação:

NOTA: Quatro experimentos independentes (n = 4) de cada grupo são conduzidos para análise. OD490 pode ser substituído por OD570-OD 630 no cálculo da viabilidade celular.
Resultados
NPs IR783/BC foram fabricados com sucesso neste estudo usando um método de precipitação flash. As NPs IR783/BC sintetizadas apresentaram-se como solução roxa, enquanto a solução aquosa de IR783 foi azul (Figura 4A). Como mostrado na Figura 4B, os NPs IR783/BC exibiram um tamanho médio de aproximadamente 87,22 nm com um índice de polidispersidade (PDI) de 0,089, demonstrando uma distribuição de tamanho estreita. A carga superficial das IR783/NPs foi de...
Discussão
Este protocolo descreve um método fácil de precipitação por flash para a fabricação de nanopartículas de corante pró-fármaco, que oferece uma abordagem simples e conveniente para a formação de nanopartículas. Há várias etapas críticas nesse método. Em primeiro lugar, para todas as etapas de síntese, fabricação e caracterização, recipientes como microtubos devem ser cobertos com papel alumínio para evitar fotoclivagem desnecessária do pró-fármaco BC pela luz ambiental. Além disso, na etapa de pre...
Divulgações
Foi protocolado o pedido de PCT nº .PCT/CN2021/081262.
Agradecimentos
Agradecemos a assistência da Faculdade de Medicina Li Ka Shing da Universidade de Hong Kong. Agradecemos ao Professor Chi-Ming Che da Universidade de Hong Kong por fornecer a linhagem celular HCT116 humana. Este trabalho foi apoiado pelo Ming Wai Lau Centre for Reparative Medicine Associate Member Program e pelo Research Grants Council of Hong Kong (Early Career Scheme, No. 27115220).
Materiais
| Name | Company | Catalog Number | Comments |
| 1260 Infinity II HPLC | Agilent Technologies | ||
| 2,4-Dimethyl pyrrole | J&K Scientific | 315305 | |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT) | Gibco | M6494 | |
| 4-Dimethylaminopyridine (4-DMAP) | J&K Scientific | 212279 | |
| 90 mm Petri Dish Clear Treated Sterile | SPL | 11090 | |
| 96-well Tissue Culture Plate Clear Treated Sterile | SPL | 30096 | |
| Acetoxyacetyl chloride | J&K Scientific | 192001 | |
| Boron trifluoride diethyl etherate | J&K Scientific | 921076 | |
| Büchner funnel | AS ONE | 3-6466-01 | |
| Chlorambucil | J&K Scientific | 321407-1G | |
| CM100 Transmission Electron Microscope | Philips | ||
| CombiFlash RF chromatography system | Teledyne ISCO | ||
| Dichloromethane | DUKSAN Pure Chemicals | JT9315-88 | |
| Dimethyl sulfoxide | DUKSAN Pure Chemicals | 2762 | |
| Disposable cuvette | Malvern Panalytical | DTS1070 | Zeta potential measurement |
| Disposable cuvette | Malvern Panalytical | ZEN0040 | |
| Empty Disposable Sample Load Cartridges | Teledyne ISCO | 693873225 | can hold up to 65 g |
| Fetal bovine serum | Gibco | 10270106 | |
| Filtering flask | AS ONE | 3-7089-03 | |
| Hexane | DUKSAN Pure Chemicals | 4198 | |
| Holey carbon film on copper grid | Beijing Zhongjingkeyi Technology Co.,Ltd | BZ10023a | |
| HPLC column (InfinityLab Poroshell 120) | Agilent Technologies | 695975-902T | |
| Integrating sphere photodiode power sensor | Thorlabs | S142C | |
| IR783 | Tokyo Chemical Industry (TCI) Co., Ltd | I1031 | |
| LED | Mightex | LCS-0530-15-11 | |
| LED Driver Control Panel V3.2.0 (Software) | Mightex | ||
| Lithium Hydroxide Anhydrous | TCI | L0225 | |
| Methylmagnesium iodide, 3M solution in diethyl ether | Aladdin | M140783 | |
| N,N-Diisopropyl ethyl amine (DIPEA) | J&K Scientific | 203402 | |
| N,N'-Dicyclohexylcarbodiimide (DCC) | J&K Scientific | 275928 | |
| penicillin–streptomycin | Gibco | 15140122 | |
| Phosphate-buffered saline (10×) | Sigma-Aldrich | P5493 | |
| Power and energy meter | Thorlabs | PM100 USB | |
| Rotavapor | BUCHI Rotavapor R300 | ||
| RMPI 1640 | Gibco | 21870076 | |
| Separatory funnel (125 mL) | Synthware | F474125L | |
| Silver Silica Gel Disposable Flash Columns, 40 g | Teledyne ISCO | 692203340 | |
| Sodium sulfate, anhydrous | Alfa Aesar | A19890 | |
| SpectraMax M4 | Molecular Devices LLC | ||
| Tetrahydrofuran (THF), anhydrous | J&K Scientific | 943616 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200056 | |
| Vortex | DLAB Scientific Co., Ltd | MX-S | |
| Zetasizer Nano ZS90 | Malvern Instrument |
Referências
- Chabner, B. A., Roberts, T. G. Chemotherapy and the war on cancer. Nature Reviews Cancer. 5 (1), 65-72 (2005).
- Monsuez, J. -. J., Charniot, J. -. C., Vignat, N., Artigou, J. -. Y. Cardiac side-effects of cancer chemotherapy. International Journal of Cardiology. 144 (1), 3-15 (2010).
- Floyd, J., Mirza, I., Sachs, B., Perry, M. C. Hepatotoxicity of chemotherapy. Seminars in Oncology. 33 (1), 50-67 (2006).
- Bar-Joseph, H., Stemmer, S. M., Tsarfaty, I., Shalgi, R., Ben-Aharon, I. Chemotherapy-induced vascular toxicity-real-time in vivo imaging of vessel impairment. Journal of Visualized Experiments. (95), e51650 (2015).
- Denny, W. A. Prodrug strategies in cancer therapy. European Journal of Medicinal Chemistry. 36 (7-8), 577-595 (2001).
- Kastrati, I., Delgado-Rivera, L., Georgieva, G., Thatcher, G. R. J., Frasor, J. Synthesis and characterization of an aspirin-fumarate prodrug that inhibits NFκB activity and breast cancer stem cells. Journal of Visualized Experiments. (119), e54798 (2017).
- Mao, J., et al. A simple dual-pH responsive prodrug-based polymeric micelles for drug delivery. ACS Applied Materials & Interfaces. 8 (27), 17109-17117 (2016).
- Li, S. -. Y., et al. A pH-responsive prodrug for real-time drug release monitoring and targeted cancer therapy. Chemical Communications. 50 (80), 11852-11855 (2014).
- Andresen, T. L., Thompson, D. H., Kaasgaard, T. Enzyme-triggered nanomedicine: Drug release strategies in cancer therapy (Invited Review). Molecular Membrane Biology. 27 (7), 353-363 (2010).
- Xu, G., McLeod, H. L. Strategies for enzyme/prodrug cancer therapy. Clinical Cancer Research. 7 (11), 3314-3324 (2001).
- Luo, W., et al. Dual-targeted and pH-sensitive doxorubicin prodrug-microbubble complex with ultrasound for tumor treatment. Theranostics. 7 (2), 452 (2017).
- Gao, J., et al. Ultrasound triggered phase-change nanodroplets for doxorubicin prodrug delivery and ultrasound diagnosis: An in vitro study. Colloids and Surfaces B: Biointerfaces. 174, 416-425 (2019).
- Brade, A. M., Szmitko, P., Ngo, D., Liu, F. -. F., Klamut, H. J. Heat-directed suicide gene therapy for breast cancer. Cancer Gene Therapy. 10 (4), 294-301 (2003).
- Long, K., et al. One-photon red light-triggered disassembly of small-molecule nanoparticles for drug delivery. Journal of Nanobiotechnology. 19 (1), 357 (2021).
- Liu, Y., Long, K., Kang, W., Wang, T., Wang, W. Optochemical control of immune checkpoint blockade via light-triggered PD-L1 dimerization. Advanced NanoBiomed Research. 2 (6), 2200017 (2022).
- Wang, T., et al. Optochemical control of mTOR signaling and mTOR-dependent autophagy. ACS Pharmacology & Translational Science. 5 (3), 149-155 (2022).
- Abet, V., Filace, F., Recio, J., Alvarez-Builla, J., Burgos, C. Prodrug approach: An overview of recent cases. European Journal of Medicinal Chemistry. 127, 810-827 (2017).
- Li, G., et al. Small-molecule prodrug nanoassemblies: an emerging nanoplatform for anticancer drug delivery. Small. 17 (52), 2101460 (2021).
- Shamay, Y., et al. Quantitative self-assembly prediction yields targeted nanomedicines. Nature Materials. 17 (4), 361-368 (2018).
- Sinoway, P. A., Callen, J. P. Chlorambucil. Arthritis & Rheumatism. 36 (3), 319-324 (1993).
- Owen, W. R., Stewart, P. J. Kinetics and mechanism of chlorambucil hydrolysis. Journal of Pharmaceutical Sciences. 68 (8), 992-996 (1979).
- Lv, W., et al. Upconversion-like photolysis of BODIPY-based prodrugs via a one-photon process. Journal of the American Chemical Society. 141 (44), 17482-17486 (2019).
- Silver, J. Let us teach proper thin layer chromatography technique. Journal of Chemical Education. 97 (12), 4217-4219 (2020).
- Saad, W. S., Prud'homme, R. K. Principles of nanoparticle formation by flash nanoprecipitation. Nano Today. 11 (2), 212-227 (2016).
- Long, K., et al. Photoresponsive prodrug-dye nanoassembly for in-situ monitorable cancer therapy. Bioengineering & Translational Medicine. 7 (3), 10311 (2022).
- Zhong, T., et al. A self-assembling nanomedicine of conjugated linoleic acid-paclitaxel conjugate (CLA-PTX) with higher drug loading and carrier-free characteristic. Scientific Reports. 6 (1), 36614 (2016).
- Long, K., et al. Green light-triggered intraocular drug release for intravenous chemotherapy of retinoblastoma. Advanced Science. 8 (20), 2101754 (2021).
- Lv, W., Wang, W. One-photon upconversion-like photolysis: a new strategy to achieve long-wavelength light-excitable photolysis. Synlett. 31 (12), 1129-1134 (2020).
- Rwei, A. Y., Wang, W., Kohane, D. S. Photoresponsive nanoparticles for drug delivery. Nano Today. 10 (4), 451-467 (2015).
- Grzelczak, M., Vermant, J., Furst, E. M., Liz-Marzán, L. M. Directed self-assembly of nanoparticles. ACS Nano. 4 (7), 3591-3605 (2010).
- Gnanasammandhan, M. K., Idris, N. M., Bansal, A., Huang, K., Zhang, Y. Near-IR photoactivation using mesoporous silica-coated NaYF4:Yb,Er/Tm upconversion nanoparticles. Nature Protocols. 11 (4), 688-713 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados