このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
プロドラッグ色素ナノアセンブリの容易な調製と光活性化
要約
このプロトコルは、光応答性プロドラッグ色素ナノアセンブリの作製および特性評価を記載する。光照射セットアップを含む、光トリガー分解によるナノ粒子からの薬物放出の方法論が明示的に説明されています。光照射後にナノ粒子から放出された薬物は、ヒト結腸直腸腫瘍細胞に対して優れた抗増殖効果を示した。
要約
自己組織化は、ナノスケールのドラッグデリバリーシステムを構築するためのシンプルでありながら信頼性の高い方法です。光活性化可能なプロドラッグは、光照射によって調節された標的部位におけるナノキャリアからの制御可能な薬物放出を可能にする。このプロトコルでは、分子の自己組織 化を介して 光活性化可能なプロドラッグ色素ナノ粒子を作製するための簡単な方法が提示されています。プロドラッグ合成、ナノ粒子作製、ナノアセンブリの物理的特性評価、光切断の実証、および in vitro 細胞毒性検証の手順が詳細に説明されています。光分解可能なホウ素-ジピロメテン-クロラムブシル(BC)プロドラッグが最初に合成されました。BCと近赤外色素IR-783は、最適化された比率で自己組織化してナノ粒子(IR783/BC NP)になることができました。合成されたナノ粒子の平均サイズは87.22nm、表面電荷は-29.8mVであった。ナノ粒子は光照射時に分解し、透過型電子顕微鏡で観察することができました。BCの光切断は10分以内に完了し、クロラムブシルの回収効率は22%でした。ナノ粒子は、非照射ナノ粒子および照射された遊離BCプロドラッグと比較して、530nmで光照射下で増強された細胞毒性を示した。このプロトコルは、光応答性薬物送達システムの構築と評価のためのリファレンスを提供します。
概要
化学療法は、細胞傷害性物質を使用して癌細胞を殺し、腫瘍の成長を阻害する一般的な癌治療です1。しかしながら、患者は、化学療法薬のオフターゲット吸収のために心毒性および肝毒性などの副作用に苦しむ可能性がある2、3、4。したがって、腫瘍における薬物放出/活性化の時空間制御による局所的な薬物送達は、正常組織における薬物曝露を最小限に抑えるために不可欠です。
プロドラッグは化学修飾された薬物であり、活性化時に罹患病変における作用を保持しながら、正常組織における毒性の低下を示す5,6。プロドラッグは、pH7,8、酵素9,10、超音波11,12、熱13、光14,15,1 6などのさまざまな刺激に反応し、病変に特異的に親薬物を放出します。それにもかかわらず、多くのプロドラッグは、溶解性の悪さ、誤った吸収速度、早期代謝破壊などの固有の欠点を示し、その開発を制限する可能性があります17。これに関連して、プロドラッグナノアセンブリの形成は、副作用の減少、in situ薬物放出、より良い保持、および治療とイメージングの組み合わせなどの利点を提供し、これらのナノアセンブリの大きな応用の可能性を示しています。ドキソルビシンプロドラッグナノスフェア、クルクミンプロドラッグミセル、およびカンプトテシンプロドラッグナノファイバーを含む多くのプロドラッグナノアセンブリが疾患治療のために開発されている18。
このプロトコルでは、高いプロドラッグ含量、良好な水分散性、長期安定性、および高感度応答能力を示すプロドラッグ色素ナノアセンブリの調製のための簡単な方法を提示します。IR783は、ナノアセンブリ19の安定化剤として働くことができる水溶性近赤外色素である。ナノアセンブリの他の成分は、2つの主な理由で設計されたプロドラッグであるホウ素-ジピロメテン-クロラムブシル(BODIPY-Cb、BC)です。クロラムブシル(Cb)は インビボで全身毒性を示すので、プロドラッグ形態はその毒性を低下させることができる20。BCプロドラッグは、疾患病変に向けられた530nmの光照射を使用して光切断することができ、Cbの局所放出を可能にします。一方、Cbは水性環境下で加水分解を起こしやすく、プロドラッグ形態21に変換することによって保護することができる。したがって、BCプロドラッグとIR-783色素との共集合は、安定かつ効果的な薬物送達ナノ系を形成することが期待された(図1A)。このプロドラッグ色素ナノアセンブリは、プロドラッグ分子の分散性と安定性を改善し、光制御可能な薬物送達への応用の可能性を示唆しています。BCプロドラッグの光切断により、ナノ粒子の分解と病変におけるCbの光制御放出が可能になります(補足図1)。
プロトコル
1. ホウ素-ジピロメテン-クロラムブシル(BC)プロドラッグの合成(図2)22
- ボディックOAcの合成
- 1.903 gの2,4-ジメチルピロールを量り、窒素雰囲気下で丸底フラスコ内の20 mLの無水ジクロロメタン(DCM)に溶解します。1.638 gのアセトキシアセチルクロリドを量り、溶液に滴下します。室温で10分間攪拌し続けた後、溶液を40°Cで1時間還流します。
- 混合物を室温に冷却する。5.170 gの N,N-ジイソプロピルエチルアミン(DIPEA)を量り、攪拌下の混合物に滴下します。30分後、5.677gの三フッ化ホウ素ジエチルエーテラート(BF3·OEt2)、それを溶液に滴下し、さらに30分間攪拌し続ける。
- 混合物にシリカゲル10g(200〜400メッシュ)を加え、45°Cでロータリーエバポレーションにより溶媒を除去する。 シリカゲルが乾燥粉末に戻ったら蒸発を停止します。
- カートリッジの底にフリットを追加します( 材料表を参照)。シリカゲル(ステップ1.1.3から)をカートリッジに充填し、次に充填されたゲルの上部にあるカートリッジに別のフリットを追加します。
- カートリッジをフラッシュクロマトグラフィーシステムに接続されているカラーに固定し( 材料の表を参照)、回してロックします。フラッシュクロマトグラフィーシステムの6方向バルブの上にカートリッジを取り付け、バルブの下にフラッシュカラム( 材料表を参照)を取り付けます。
- クロマトグラフィー装置を起動し、検出波長として515 nmと365 nmを設定します。4/3(v/v)ヘキサン/DCMで溶出を行います。515 nmのシグナルが表示されたら溶離液画分を収集します。
- 溶媒捕集フラスコに溶媒が回収されなくなるまで、40°Cでのロータリーエバポレーションにより、回収画分から溶媒を除去します。固体生成物を真空乾燥チャンバーに一晩置き、残りの溶媒を除去します。
- ボディピーOHの合成
- 1.120 gのBODIPY-OAc(ステップ1.1で合成)を量り、室温で70 mLのテトラヒドロフラン(THF)に溶解し、ホイルで完全に覆います。70 mLの0.1 M LiOH水溶液をBODIPY-OAc溶液に滴下します。
- 混合物を30分間攪拌し、溶媒回収フラスコに溶媒が回収されなくなるまでロータリーエバポレーションにより40°Cで溶媒を除去します。残渣を真空乾燥室に一晩入れて水分を除去します。
- 乾燥残留物を30 mLのDCMに溶解し、10 gのシリカゲルを溶液に加えます。40°Cでロータリーエバポレーションにより溶媒を除去する。 シリカゲルが乾燥粉末に戻ったら蒸発を停止します。
- 生成物のBODIPY-OHをカラムクロマトグラフィーで精製し、DCMのみを溶離液として、ステップ1.1.4から1.1.6に従います。
- 異なる溶出時点で収集された画分を、薄層クロマトグラフィー(TLC)上のBODIPY-OAcのTHF溶液と比較し、生成物を同定する23。
- 溶出画分とBODIPY-OAc溶液の3〜4 μLを、同じ高さのTLCプレートの一方の端に別々にスポットします。TLCプレートを1 mLのDCMを含むガラスチャンバーに入れ、スポットエッジをDCM溶媒に浸しますが、2つのスポットを溶媒から外します。
- DCM溶媒がプレートの高さの半分以上に達したら、TLCプレートを取り出します。BODIPY-OAcスポットとは異なる高さのTLCスポットを持つ溶出画分を選択します。
- 40°Cでロータリーエバポレーションにより溶媒を除去し(工程1.1.7)、生成物BODIPY-OHを得た。
- ボディピー-(Me)2-OHの合成
- 313 mgのBODIPY-OHを秤量し、窒素雰囲気下で暗所で35 mLの無水ジエチルエーテルに溶解します。3.75 mLのヨウ化メチルマグネシウム(3 Mジエチルエーテル溶液)を溶液に滴下し、室温で3時間攪拌します。
- 3.5 mLの水を滴下して反応を停止します。
- 混合物をDCMと水で抽出します。
- 混合物を125 mLの分液漏斗に移します。20 mLのDCMを混合物に加えます。
- 分液漏斗のキャップを閉じます。漏斗を約45°傾け、漏斗を少し振る。キャップを開けて収縮させます。この手順を3回繰り返し、3分間放置します。
- 下部バルブを開き、ビーカーで下部有機相を収集します。
- 30 mLのDCMを水相に加えます。抽出(ステップ1.3.3.2および1.3.3.3)を毎回30mLのDCMで3回繰り返します。
- 回収した有機相に固体Na2SO4 10 gを加え、有機相を一晩乾燥させます。
- ろ過フラスコをゴムチューブ付きの真空ポンプにリンクします。ビューヒナー漏斗の上にろ紙を置き、漏斗をフラスコの上部に挿入します。ろ紙を1mLのDCMで濡らし、混合物を漏斗に移し、真空ポンプをオンにします。フラスコに有機溶液を集める。
- 有機溶液にシリカゲル10 gを加えます。シリカゲルが乾燥粉末に戻るまで40°Cでロータリーエバポレーションにより有機溶媒を除去する。生成物のBODIPY-(Me)2-OHをカラムクロマトグラフィー(ステップ1.1.4〜1.1.6)で精製し、溶離液としてヘキサン/DCM = 1/1(v/v)を使用します。
- ステップ1.2.5(BODIPY-OHとは異なる高さのTLCスポット)で説明されているように、TLC分析を使用して製品を含む溶出画分を選択します。40°Cでのロータリーエバポレーションにより溶媒を除去し、ステップ1.1.7に記載の生成物を得た。
- ボディピー-(Me)2-I-2-OHの合成
- 41 mgのボディピー-(Me)2-OHを計量し、窒素雰囲気下で暗所で2.5 mLの無水THFに溶解します。74 mgの N-ヨードスクシンイミドを量り、1 mLの無水THFに溶解します。
- N-ヨードスクシンイミド溶液をBODIPY-(Me)2-OH溶液に滴下します。室温で3.5時間撹拌した後、ロータリーエバポレーターの溶媒回収フラスコに溶媒が回収されなくなるまで、40°Cでロータリーエバポレーションにより溶媒を除去した。
- 残留物を10 mLのDCMに溶解し、手順1.3.3の説明に従って、毎回30 mLの水で3回洗浄します。有機相をNa2SO 4で乾燥させる(ステップ1.3.4および1.3.5)。 40°Cでロータリーエバポレーションにより溶媒を除去し(工程1.1.7)、生成物BODIPY-(Me)2-I2-OHを得た。
- ボディピー-Cbの合成
- クロラムブシル85 mgを量り、窒素雰囲気下で暗所で2 mLの無水DCMに溶解します。 69 mgのN,N'-ジシクロヘキシルカルボジイミドを量り、1 mLの無水DCMに溶解します。クロラムブシル溶液に10分間攪拌しながら滴下します。
- 1.7 mgの4-ジメチルアミノピリジンを0.5 mLの無水DCMに溶解します。この溶液を混合物に加え、室温で10分間攪拌し続ける。次に、2 mLの無水DCMに溶解した73 mgのボディピー-(Me)2-I 2-OHを加え、2時間攪拌します。
- 混合物にシリカゲル10gを加え、40°Cでロータリーエバポレーションにより溶媒を除去する。 シリカゲルが乾燥粉末に戻ったら蒸発を停止します。生成物のBODIPY-Cbをカラムクロマトグラフィー(ステップ1.1.4〜1.1.6、540 nmおよび365 nm)で精製し、溶離液としてヘキサン/DCM = 7/3(v/v)を使用します。
- TLC分析を使用して、BODIPY-(Me)2-I 2-OHとは異なる生成物を含む溶出画分を選択します(ステップ1.2.5)。40°Cでロータリーエバポレーションにより溶媒を除去し(ステップ1.1.7)、生成物BODIPY-Cbを得た。
2. フラッシュ沈殿法によるIR783/BC NPの作製
- BCプロドラッグ(BODIPY-Cb)10 mgを計量し、1.5 mLマイクロチューブ中の1 mLのDMSOに溶解して、10 mg/mLのストック溶液を得ます。BC溶液をホイルで覆います。
- 1.5 mLマイクロチューブ内のろ過脱イオン水中で0.4 mg/mL IR-783を300 μL調製します。このマイクロチューブを1,500rpmのボルテックスミキサーに置きます。
- 20 μLのピペットを使用して、DMSO中のBC溶液20 μLをIR-783溶液に10秒間にわたって一定の速度で添加します。ピペットチップの端がマイクロチューブの内壁に接触する必要があります(図1B)。
- マイクロチューブをさらに30秒間ボルテックスミキサーに保持して、IR783 / BC NP溶液を取得します。次に、ナノ粒子溶液をホイルで完全に覆われたラックに置きます。
- 得られたIR783/BC NP溶液を2,000 x g および4°Cで10分間遠心分離して、凝集体を除去します。上清を収集し、ペレットを乱さないようにチューブ内に~20 μLを残します。ペレットを廃棄します。
- 上清を30,000 x g および4°Cで30分間2回遠心分離し、両方の遠心分離からナノ粒子沈殿物を回収します。ナノ粒子を300 μLの1x PBSに再懸濁します。
注:DMSO中の疎水性BCプロドラッグがボルテックスで水に分散すると、DMSOは水に溶解し、プロドラッグ分子はナノスケールの集合体を形成して局所過飽和状況下で安定に保つ傾向があります24。 - IR-783およびBCの含有量を高速液体クロマトグラフィー(HPLC)により定量し、 表1に示す溶出法を用いた。
注:HPLCサンプルは、等量のナノ粒子溶液とアセトニトリルを混合することによって調製されます。注入量は20μLです。クロラムブシルおよびBCプロドラッグの検出波長は260nm、IR783の検出波長は783nmです。HPLC カラムは、粒子径 2.7 μm、細孔径 120 Å の 4.6 mm x 100 mm (長さ) C18 カラムの分析用カラムです。 - プロドラッグの封入効率(EE%)と負荷容量(LC%)を次の式に従って計算します。

| 時間 (分) | アセトニトリル(%) | 水(%) |
| 0 | 20 | 80 |
| 5 | 20 | 80 |
| 30 | 95 | 5 |
| 35 | 95 | 5 |
表1:BCプロドラッグおよびその光切断の定性的および定量的分析のためのHPLC法。許可を得て複製 25.著作権2022、ワイリー。
3. IR783/BC NPの特性評価
- 動的光散乱(DLS)装置を使用して IR783/BC NP の平均サイズを測定します( 材料表を参照)。200 μLのIR783/BC NP溶液をキュベットに入れ、測定のためにキュベットをホルダーに挿入します。測定タイプを「サイズ」、測定温度を25°Cに設定します。 各測定で20秒の持続時間で3つの測定を実行します。
- ゼータ電位テストキュベットを使用して、DLS機器でIR783/BC NPの表面電荷を測定します。
- 25 μLのIR783/BC NP溶液を725 μLの脱イオン水で1.5 mLマイクロチューブで希釈し、その溶液をゼータ電位テストキュベットに加えます。キュベットをサンプル溝に入れます。サンプル溝にキャップをします。
- 測定タイプを「ゼータ電位」、測定温度を25°Cに設定します。 10回の測定を実行します。
- 透過型電子顕微鏡(TEM)イメージング用のサンプルを準備します。銅グリッド(300メッシュ)上の穴の開いたカーボン膜上に10 μLのIR783/BC NP溶液を加え、7 μLを除去します。 自動蒸発のために、フィルム上に3 μLの溶液を一晩放置します。
注:10 μLのNP溶液を追加してから7 μLを除去すると、液滴がフィルム上のより広い領域を覆うことができます。
4. IR783/BC NPの光活性化
- LEDランプ(530 nm; 材料表を参照)を鉄製のスタンドでセットアップして、ライトが操作フロアに直接向くようにします。積分球フォトダイオード光度計( 材料の表を参照)をLEDランプの真下に置きます。
注:環境光の影響を防ぐため、すべての光照射実験は暗室で行われます。 - LEDランプをオンにして、光度計のキャップを開きます。放射照度を記録し、関連するソフトウェアを使用してランプパラメータを設定します( 材料表を参照)。入力電流(mA)を調整して、放射照度を50mW / cm2に設定します。
注意: 放射照度は、LEDランプと光度計の間の距離にも影響されます。ここで使用したセットアップ(図3A、B)では、距離は5cmに固定されています。 - IR783/BC NP 溶液を脱イオン水で BC 濃度に基づいて 50 μM に希釈します。200 μL の IR783/BC NP 溶液を 1.5 mL マイクロチューブに加えます。マイクロチューブの溝フィッティングサイズとステップ4.1の光度計と同じ高さのフォームブロックにチューブを置きます(図3C、D)。
- チューブのキャップを開けます。LEDランプを点灯し、ナノ粒子溶液を1、2、3、5、7、10分間照射します。
- 光照射後のBC消費量とCb放出量をHPLCで定量化します。次の式を使用して、残りのBCおよびCb放出の割合を計算します。

5. IR783/BC NPの光照射の有無による細胞毒性試験
- HCT116細胞(ヒト結腸直腸腫瘍細胞株)を、10%ウシ胎児血清および1%ペニシリン-ストレプトマイシン(完全培地)を含むRPMI 1640培地中で、37°Cの5%CO2雰囲気中で培養する(90mm細胞培養皿に1皿あたり~2 x 106 細胞)。2〜3日ごとに細胞を定期的に継代培養します。
注:HCT116はヒト結腸細胞株です。HeLa、MCF7、A549細胞などの他の癌細胞と比較して、HCT-116細胞はより高いレベルのカベオリン-125を発現し、IR783の標的となり、IR783/BC NPの細胞取り込みを増強することができる。 - HCT116細胞をRPMI 1640完全培地を含む96ウェルプレートに、ウェルあたり104 細胞の密度でプレートします。
- 細胞コンフルエントが50%を超えたら培養皿から培地を吸引する。1x PBSで細胞を洗浄し、PBSを取り外します。1 mLの0.25%トリプシン溶液を加え、5%CO2 インキュベーター内で37°Cでインキュベートします。
- 3分後、2 mLの完全培地を加えてトリプシン消化を消します。細胞を再懸濁し、細胞懸濁液を15 mLの遠心分離チューブに移し、300 x g で3分間遠心分離します。上清を捨て、細胞ペレットを1 mLの完全培地に再懸濁します。
- 細胞懸濁液10 μLを完全培地で200 μLに希釈します。血球計算盤に10μLを置き、カバーガラスで蓋をします。
- 血球計算盤を顕微鏡で観察します(接眼レンズ:10倍、対物レンズ:4倍)。四隅の正方形と中央のセル番号を数えて記録します。次の式を使用して細胞濃度を計算します。
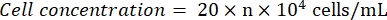
ここで、n = 5 つの正方形のセル数の平均。 - 細胞懸濁液を1 x 105 細胞/mLに希釈します。ウェルあたり100 μLの細胞懸濁液を96ウェルプレートに加え、細胞を播種します。播種されていないウェルにウェルあたり100 μLのPBSを追加します。
- 細胞を(1)0.1〜150μMの遊離BC、(2)0.1〜150μM IR783 / BC NP(BC濃度に基づく)、(3)光照射による0.1〜150μMの遊離BC、または(4)0.1〜150μM IR783 / BC NP(BC濃度に基づく)で光照射で処理します。細胞を5%CO2 インキュベーター内で37°Cで6時間インキュベートします。
注:遊離のBCおよびIR783/BC NP溶液は、それぞれのストック溶液から完全な培地で希釈されます。 - 6時間のインキュベーション後、プロドラッグ/ナノ粒子含有培地を新鮮な完全培地と交換します。非照射グループ1と2を暗所で24時間インキュベートします。グループ3および4では、細胞に530 nmのLEDランプ(50 mW/cm2)を5分間照射し、24時間インキュベートします。
注意: セルプレートは、手順4.1の光度計と同じ高さを確保するためにフォームブロックに配置されます。 - 3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド(MTT)アッセイで細胞生存率を決定します。
- BCまたはナノ粒子処理後、10 μLのMTT(10 mg/mL PBS溶液)を各ウェルに加え、プレートを37°Cで3時間インキュベートします。次に、培地を取り出し、各ウェルに100 μLのDMSOを加えます。マイクロプレートリーダーで490 nm、570 nm、および630 nmの吸光度を読み取ります。
- 次の式を使用して細胞生存率を計算します。

注:分析のために、各グループの4つの独立した実験(n = 4)が実施されます。OD490 は、細胞生存率の計算においてOD570-OD 630 に置き換えることができる。
結果
IR783/BC NPは、フラッシュ沈殿法を用いて本研究で作製することに成功した。合成されたIR783/BC NPは紫色の溶液として提示され、IR783の水溶液は青色でした(図4A)。 図4Bに示すように、IR783/BC NPの平均サイズは約87.22nm、多分散指数(PDI)は0.089であり、狭いサイズ分布を示しています。IR783/NPの表面電荷は約-29.8mV(図4C)であり、これはI...
ディスカッション
このプロトコルは、ナノ粒子形成のための簡単で便利なアプローチを提供するプロドラッグ色素ナノ粒子の作製のための簡単なフラッシュ沈殿法を概説します。この方法にはいくつかの重要なステップがあります。まず、合成、製造、および特性評価のすべてのステップで、マイクロチューブのような容器をホイルで覆い、環境光によるBCプロドラッグの不必要な光切断を回避する必要があ?...
開示事項
PCT出願はNo.PCT/CN2021/081262に提出されています。
謝辞
香港大学李嘉誠医学部中核施設からの支援に感謝します。ヒトHCT116細胞株を提供してくれた香港大学のChi-Ming Che教授に感謝します。この研究は、ミンワイラウ修復医療センターアソシエイトメンバープログラムと香港研究助成評議会(早期キャリアスキーム、第27115220号)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1260 Infinity II HPLC | Agilent Technologies | ||
| 2,4-Dimethyl pyrrole | J&K Scientific | 315305 | |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT) | Gibco | M6494 | |
| 4-Dimethylaminopyridine (4-DMAP) | J&K Scientific | 212279 | |
| 90 mm Petri Dish Clear Treated Sterile | SPL | 11090 | |
| 96-well Tissue Culture Plate Clear Treated Sterile | SPL | 30096 | |
| Acetoxyacetyl chloride | J&K Scientific | 192001 | |
| Boron trifluoride diethyl etherate | J&K Scientific | 921076 | |
| Büchner funnel | AS ONE | 3-6466-01 | |
| Chlorambucil | J&K Scientific | 321407-1G | |
| CM100 Transmission Electron Microscope | Philips | ||
| CombiFlash RF chromatography system | Teledyne ISCO | ||
| Dichloromethane | DUKSAN Pure Chemicals | JT9315-88 | |
| Dimethyl sulfoxide | DUKSAN Pure Chemicals | 2762 | |
| Disposable cuvette | Malvern Panalytical | DTS1070 | Zeta potential measurement |
| Disposable cuvette | Malvern Panalytical | ZEN0040 | |
| Empty Disposable Sample Load Cartridges | Teledyne ISCO | 693873225 | can hold up to 65 g |
| Fetal bovine serum | Gibco | 10270106 | |
| Filtering flask | AS ONE | 3-7089-03 | |
| Hexane | DUKSAN Pure Chemicals | 4198 | |
| Holey carbon film on copper grid | Beijing Zhongjingkeyi Technology Co.,Ltd | BZ10023a | |
| HPLC column (InfinityLab Poroshell 120) | Agilent Technologies | 695975-902T | |
| Integrating sphere photodiode power sensor | Thorlabs | S142C | |
| IR783 | Tokyo Chemical Industry (TCI) Co., Ltd | I1031 | |
| LED | Mightex | LCS-0530-15-11 | |
| LED Driver Control Panel V3.2.0 (Software) | Mightex | ||
| Lithium Hydroxide Anhydrous | TCI | L0225 | |
| Methylmagnesium iodide, 3M solution in diethyl ether | Aladdin | M140783 | |
| N,N-Diisopropyl ethyl amine (DIPEA) | J&K Scientific | 203402 | |
| N,N'-Dicyclohexylcarbodiimide (DCC) | J&K Scientific | 275928 | |
| penicillin–streptomycin | Gibco | 15140122 | |
| Phosphate-buffered saline (10×) | Sigma-Aldrich | P5493 | |
| Power and energy meter | Thorlabs | PM100 USB | |
| Rotavapor | BUCHI Rotavapor R300 | ||
| RMPI 1640 | Gibco | 21870076 | |
| Separatory funnel (125 mL) | Synthware | F474125L | |
| Silver Silica Gel Disposable Flash Columns, 40 g | Teledyne ISCO | 692203340 | |
| Sodium sulfate, anhydrous | Alfa Aesar | A19890 | |
| SpectraMax M4 | Molecular Devices LLC | ||
| Tetrahydrofuran (THF), anhydrous | J&K Scientific | 943616 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200056 | |
| Vortex | DLAB Scientific Co., Ltd | MX-S | |
| Zetasizer Nano ZS90 | Malvern Instrument |
参考文献
- Chabner, B. A., Roberts, T. G. Chemotherapy and the war on cancer. Nature Reviews Cancer. 5 (1), 65-72 (2005).
- Monsuez, J. -. J., Charniot, J. -. C., Vignat, N., Artigou, J. -. Y. Cardiac side-effects of cancer chemotherapy. International Journal of Cardiology. 144 (1), 3-15 (2010).
- Floyd, J., Mirza, I., Sachs, B., Perry, M. C. Hepatotoxicity of chemotherapy. Seminars in Oncology. 33 (1), 50-67 (2006).
- Bar-Joseph, H., Stemmer, S. M., Tsarfaty, I., Shalgi, R., Ben-Aharon, I. Chemotherapy-induced vascular toxicity-real-time in vivo imaging of vessel impairment. Journal of Visualized Experiments. (95), e51650 (2015).
- Denny, W. A. Prodrug strategies in cancer therapy. European Journal of Medicinal Chemistry. 36 (7-8), 577-595 (2001).
- Kastrati, I., Delgado-Rivera, L., Georgieva, G., Thatcher, G. R. J., Frasor, J. Synthesis and characterization of an aspirin-fumarate prodrug that inhibits NFκB activity and breast cancer stem cells. Journal of Visualized Experiments. (119), e54798 (2017).
- Mao, J., et al. A simple dual-pH responsive prodrug-based polymeric micelles for drug delivery. ACS Applied Materials & Interfaces. 8 (27), 17109-17117 (2016).
- Li, S. -. Y., et al. A pH-responsive prodrug for real-time drug release monitoring and targeted cancer therapy. Chemical Communications. 50 (80), 11852-11855 (2014).
- Andresen, T. L., Thompson, D. H., Kaasgaard, T. Enzyme-triggered nanomedicine: Drug release strategies in cancer therapy (Invited Review). Molecular Membrane Biology. 27 (7), 353-363 (2010).
- Xu, G., McLeod, H. L. Strategies for enzyme/prodrug cancer therapy. Clinical Cancer Research. 7 (11), 3314-3324 (2001).
- Luo, W., et al. Dual-targeted and pH-sensitive doxorubicin prodrug-microbubble complex with ultrasound for tumor treatment. Theranostics. 7 (2), 452 (2017).
- Gao, J., et al. Ultrasound triggered phase-change nanodroplets for doxorubicin prodrug delivery and ultrasound diagnosis: An in vitro study. Colloids and Surfaces B: Biointerfaces. 174, 416-425 (2019).
- Brade, A. M., Szmitko, P., Ngo, D., Liu, F. -. F., Klamut, H. J. Heat-directed suicide gene therapy for breast cancer. Cancer Gene Therapy. 10 (4), 294-301 (2003).
- Long, K., et al. One-photon red light-triggered disassembly of small-molecule nanoparticles for drug delivery. Journal of Nanobiotechnology. 19 (1), 357 (2021).
- Liu, Y., Long, K., Kang, W., Wang, T., Wang, W. Optochemical control of immune checkpoint blockade via light-triggered PD-L1 dimerization. Advanced NanoBiomed Research. 2 (6), 2200017 (2022).
- Wang, T., et al. Optochemical control of mTOR signaling and mTOR-dependent autophagy. ACS Pharmacology & Translational Science. 5 (3), 149-155 (2022).
- Abet, V., Filace, F., Recio, J., Alvarez-Builla, J., Burgos, C. Prodrug approach: An overview of recent cases. European Journal of Medicinal Chemistry. 127, 810-827 (2017).
- Li, G., et al. Small-molecule prodrug nanoassemblies: an emerging nanoplatform for anticancer drug delivery. Small. 17 (52), 2101460 (2021).
- Shamay, Y., et al. Quantitative self-assembly prediction yields targeted nanomedicines. Nature Materials. 17 (4), 361-368 (2018).
- Sinoway, P. A., Callen, J. P. Chlorambucil. Arthritis & Rheumatism. 36 (3), 319-324 (1993).
- Owen, W. R., Stewart, P. J. Kinetics and mechanism of chlorambucil hydrolysis. Journal of Pharmaceutical Sciences. 68 (8), 992-996 (1979).
- Lv, W., et al. Upconversion-like photolysis of BODIPY-based prodrugs via a one-photon process. Journal of the American Chemical Society. 141 (44), 17482-17486 (2019).
- Silver, J. Let us teach proper thin layer chromatography technique. Journal of Chemical Education. 97 (12), 4217-4219 (2020).
- Saad, W. S., Prud'homme, R. K. Principles of nanoparticle formation by flash nanoprecipitation. Nano Today. 11 (2), 212-227 (2016).
- Long, K., et al. Photoresponsive prodrug-dye nanoassembly for in-situ monitorable cancer therapy. Bioengineering & Translational Medicine. 7 (3), 10311 (2022).
- Zhong, T., et al. A self-assembling nanomedicine of conjugated linoleic acid-paclitaxel conjugate (CLA-PTX) with higher drug loading and carrier-free characteristic. Scientific Reports. 6 (1), 36614 (2016).
- Long, K., et al. Green light-triggered intraocular drug release for intravenous chemotherapy of retinoblastoma. Advanced Science. 8 (20), 2101754 (2021).
- Lv, W., Wang, W. One-photon upconversion-like photolysis: a new strategy to achieve long-wavelength light-excitable photolysis. Synlett. 31 (12), 1129-1134 (2020).
- Rwei, A. Y., Wang, W., Kohane, D. S. Photoresponsive nanoparticles for drug delivery. Nano Today. 10 (4), 451-467 (2015).
- Grzelczak, M., Vermant, J., Furst, E. M., Liz-Marzán, L. M. Directed self-assembly of nanoparticles. ACS Nano. 4 (7), 3591-3605 (2010).
- Gnanasammandhan, M. K., Idris, N. M., Bansal, A., Huang, K., Zhang, Y. Near-IR photoactivation using mesoporous silica-coated NaYF4:Yb,Er/Tm upconversion nanoparticles. Nature Protocols. 11 (4), 688-713 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved