JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Prodrug-Dye Nanoassemblies의 용이한 준비 및 광활성화
요약
이 프로토콜은 광반응성 전구약물-염료 나노어셈블리의 제조 및 특성화를 설명합니다. 광 조사 설정을 포함하여 광 트리거 분해에 의한 나노 입자로부터의 약물 방출 방법론이 명시 적으로 설명된다. 광 조사 후 나노 입자로부터 방출 된 약물은 인간 대장 종양 세포에 우수한 항 증식 효과를 나타냈다.
초록
자가 조립은 나노 규모의 약물 전달 시스템을 구축하기 위한 간단하면서도 신뢰할 수 있는 방법입니다. 광활성성 전구약물은 광 조사에 의해 조절된 표적 부위에서 나노운반체로부터 제어 가능한 약물 방출을 가능하게 합니다. 이 프로토콜에서, 분자 자기 조립을 통해 광 활성화 가능한 전구 약물-염료 나노 입자를 제조하는 용이한 방법이 제시된다. 전구약물 합성, 나노 입자 제조, 나노 어셈블리의 물리적 특성화, 광 절단 시연 및 시험관 내 세포 독성 검증에 대한 절차가 자세히 설명되어 있습니다. 광절단 가능한 붕소-디피로메텐-클로람부실(BC) 전구약물을 먼저 합성했습니다. BC와 근적외선 염료 인 IR-783은 최적화 된 비율로 나노 입자 (IR783 / BC NP)로 자체 조립 될 수 있습니다. 합성된 나노입자는 평균 크기가 87.22nm이고 표면 전하가 -29.8mV였습니다. 나노 입자는 광 조사시 분해되어 투과 전자 현미경으로 관찰 할 수 있습니다. BC의 광절단은 10분 이내에 완료되었으며 클로람부실의 경우 22%의 회수 효율이 있었습니다. 나노입자는 조사되지 않은 나노입자 및 조사된 유리 BC 전구약물과 비교하여 530 nm에서 광 조사 하에서 향상된 세포독성을 나타내었다. 이 프로토콜은 광반응성 약물 전달 시스템의 구축 및 평가를 위한 참조를 제공합니다.
서문
화학요법은 세포독성제를 사용하여 암세포를 죽이고 종양 성장을 억제하는 일반적인 암 치료법이다1. 그러나, 환자는 화학요법 약물 2,3,4의 표적 이탈 흡수로 인한 심장 독성 및 간독성과 같은 부작용을 겪을 수 있다. 따라서 종양에서 약물 방출/활성화의 시공간적 제어를 통한 국소 약물 전달은 정상 조직에서 약물 노출을 최소화하는 데 필수적입니다.
전구약물은 정상 조직에서는 독성이 감소하는 동시에 활성화 시 병든 병변에서는 작용을 유지하는 화학적으로 변형된 약물이다 5,6. 전구약물은 pH7,8, 효소 9,10, 초음파 11,12, 열 13 및 빛14,15,1 6과 같은 다양한 자극에 반응할 수 있으며 병변에서 특이적으로 모 약물을 방출합니다. 그럼에도 불구하고, 많은 전구약물은 용해도 저하, 흡수율 부정확, 조기 대사 파괴와 같은 고유한 단점을 나타내어 발달을 제한할 수 있다17. 이러한 맥락에서, 전구 약물 나노 어셈블리의 형성은 부작용 감소, 현장 약물 방출, 더 나은 보유 및 치료 및 이미징의 조합과 같은 이점을 제공하여 이러한 나노 어셈블리에 대한 큰 응용 가능성을 나타냅니다. 독소루비신 전구약물 나노스피어, 커큐민 전구약물 미셀, 캄프토테신 전구약물 나노섬유 등 많은 전구약물 나노어셈블리가 질병 치료를 위해 개발되었다18.
이 프로토콜에서 우리는 높은 프로드러그 함량, 우수한 수분산성, 장기 안정성 및 민감한 반응 능력을 나타내는 프로드러그-염료 나노어셈블리를 제조하기 위한 간단한 방법을 제시합니다. IR783은 나노어셈블리(19)의 안정제 역할을 할 수 있는 수용성 근적외선 염료이다. 나노 어셈블리의 다른 구성 요소는 붕소-디피로메텐-클로람부실(BODIPY-Cb, BC)로, 두 가지 주요 이유로 설계된 전구약물입니다. 클로람부실(chlorambucil, Cb)은 생체 내에서 전신 독성을 나타내므로, 전구약물 형태는 독성을 감소시킬 수 있다20. BC 전구약물은 질병 병변을 겨냥한 530nm 광 조사를 사용하여 광분해되어 Cb의 국소 방출을 가능하게 합니다. 한편, Cb는 수성 환경에서 가수분해되기 쉽고, 이를 전구약물 형태21로 변형시킴으로써 보호될 수 있다. 따라서, BC 전구약물과 IR-783 염료의 공동조립은 안정적이고 효과적인 약물 전달 나노시스템을 형성할 것으로 예상되었다(도 1A). 이 전구약물-염료 나노어셈블리는 전구약물 분자의 분산성과 안정성을 향상시켜 광 제어 가능한 약물 전달에 적용할 수 있는 가능성을 시사합니다. BC 전구약물의 광절단은 나노입자의 분해 및 병변에서 Cb의 광 제어 방출을 가능하게 합니다(보충 그림 1).
프로토콜
1. 붕소-디피로메텐-클로람부실(BC) 전구약물의 합성(그림 2)22
- BODIPY-OAc의 합성
- 2,4-디메틸 피롤 1.903g을 칭량하여 질소 분위기 하의 둥근 바닥 플라스크에 무수 디클로로메탄(DCM) 20mL에 용해시킨다. 아세톡시 아세틸 클로라이드 1.638g의 무게를 달아 용액에 적가한다. 실온에서 10분 동안 계속 교반한 다음 용액을 40°C에서 1시간 동안 환류합니다.
- 혼합물을 실온으로 식힌다. N,N-디이소프로필에틸아민(DIPEA) 5.170g의 무게를 달아 교반하면서 혼합물에 적가합니다. 30분 후, 삼불화붕소 디에틸 에테레이트(BF3· O2), 용액에 한 방울 떨어뜨리고 추가로 30분 동안 계속 저어줍니다.
- 상기 혼합물에 10 g의 실리카겔 (200-400 메쉬)을 첨가하고, 45°C에서 회전 증발에 의해 용매를 제거한다. 실리카겔이 건조 분말로 돌아오면 증발을 중지합니다.
- 카트리지 바닥에 프릿을 추가합니다( 재료 표 참조). 실리카겔(1.1.3단계부터)을 카트리지에 채운 다음 채워진 젤 상단의 카트리지에 다른 프릿을 추가합니다.
- 플래시 크로마토그래피 시스템( 재료 표 참조)과 연결된 칼라에 카트리지를 고정하고 돌려서 잠급니다. 플래시 크로마토그래피 시스템의 6방향 밸브 위에 카트리지를 설치하고 밸브 아래에 플래시 컬럼( 재료 표 참조)을 설치합니다.
- 크로마토그래피 기기를 시작하고 검출 파장으로 515nm 및 365nm를 설정합니다. 4/3 (v/v) 헥산/DCM으로 용리를 수행합니다. 515nm 신호가 나타나면 용리액 분획을 수집합니다.
- 용매 수집 플라스크에서 더 이상 용매가 수집되지 않을 때까지 40°C에서 회전 증발에 의해 수집된 분획으로부터 용매를 제거한다. 고체 생성물을 진공 건조 챔버에 밤새 넣어 나머지 용매를 제거합니다.
- BODIPY-OH의 합성
- BODIPY-OAc (1.1 단계에서 합성) 1.120g의 무게를 측정하고 실온에서 70mL의 테트라 히드로 푸란 (THF)에 용해시키고 호일로 완전히 덮습니다. 0.1M LiOH 수용액 70mL를 BODIPY-OAc 용액에 적가합니다.
- 혼합물을 30분 동안 교반하고, 용매 수집 플라스크에 더 이상 용매가 수집되지 않을 때까지 회전 증발에 의해 40°C에서 용매를 제거한다. 잔류물을 진공 건조실에 밤새 넣어 물을 제거합니다.
- 건조 잔류물을 DCM 30mL에 용해시키고 실리카겔 10g을 용액에 첨가한다. 40°C에서 회전 증발에 의해 용매를 제거한다. 실리카겔이 건조 분말로 돌아오면 증발을 중지합니다.
- 1.1.4 내지 1.1.6 단계에 따라 컬럼 크로마토그래피로 생성물 BODIPY-OH를 정제하고, DCM 단독을 용리액으로 사용합니다.
- 상이한 용출 시점에서 수집된 분획을 박층 크로마토그래피(TLC) 상에서 BODIPY-OAc의 THF 용액과 비교하고 생성물23을 확인한다.
- 용출된 분획 3-4μL와 BODIPY-OAc 용액을 동일한 높이의 TLC 플레이트의 한쪽 가장자리에 별도로 스팟합니다. TLC 플레이트를 1mL의 DCM이 들어 있는 유리 챔버에 넣고 점박이 가장자리를 DCM 용매에 담그되 두 개의 반점은 용매에서 빼냅니다.
- DCM 용매가 플레이트 높이의 절반 이상에 도달하면 TLC 플레이트를 꺼냅니다. BODIPY-OAc 스폿과 다른 높이에 TLC 스폿이 있는 용리된 분획을 선택합니다.
- 40°C에서 회전 증발에 의해 용매를 제거하여(단계 1.1.7) 생성물 BODIPY-OH를 얻었다.
- BODIPY-(Me)2-OH의 합성
- BODIPY-OH 313mg을 달아 질소 분위기 하의 암실에서 무수 디에틸 에테르 35mL에 녹인다. 3.75mL의 요오드화 메틸 마그네슘(디에틸 에테르 중 3M)을 용액에 적가하고 실온에서 3시간 동안 계속 교반합니다.
- 물 3.5mL를 한 방울 떨어뜨려 반응을 종료합니다.
- DCM과 물로 혼합물을 추출합니다.
- 혼합물을 125mL 분액 깔때기로 옮깁니다. 혼합물에 20mL의 DCM을 첨가한다.
- 분리 깔때기의 캡을 닫습니다. 깔때기를 약 45° 기울이고 깔때기를 약간 흔듭니다. 캡을 열어 공기를 빼십시오. 이 단계를 3회 반복하고 3분 동안 그대로 두십시오.
- 하단 밸브를 열고 비커에 하부 유기상을 수집합니다.
- 30 mL의 DCM을 수성상에 첨가한다. 추출(단계 1.3.3.2 및 1.3.3.3)을 매번 30mL의 DCM으로 3회 반복합니다.
- 수집 된 유기상에 10g의 고체 Na2SO4 를 첨가하여 유기 상을 밤새 건조시켰다.
- 여과 플라스크를 고무 튜브가 있는 진공 펌프에 연결합니다. Büchner 깔때기에 여과지를 놓고 깔때기를 플라스크 상단에 삽입합니다. DCM 1mL로 여과지를 적시고 혼합물을 깔때기로 옮기고 진공 펌프를 켭니다. 플라스크에 유기 용액을 수집합니다.
- 유기 용액에 실리카겔 10g을 첨가한다. 실리카겔이 건조 분말로 돌아올 때까지 40°C에서 회전 증발에 의해 유기 용매를 제거한다. 헥산/DCM = 1/1 (v/v)를 용리액으로 사용하여 컬럼 크로마토그래피(단계 1.1.4 - 1.1.6)로 생성물 BODIPY-(Me)2-OH를 정제합니다.
- 단계 1.2.5 (BODIPY-OH와 상이한 높이의 TLC 스팟)에 기재된 바와 같이 TLC 분석을 사용하여 생성물을 함유하는 용출된 분획을 선택한다. 40°C에서 회전 증발에 의해 용매를 제거하여 단계 1.1.7에 기재된 바와 같은 생성물을 수득한다.
- BODIPY-(Me)2-I 2-OH의 합성
- BODIPY-(Me)2-OH 41mg을 칭량하여 질소 분위기 하의 암실에서 무수 THF 2.5mL에 녹인다. N-iodosuccinimide 74mg의 무게를 달아 무수 THF 1mL에 녹입니다.
- N-요오도숙신이미드 용액을 BODIPY-(Me)2-OH 용액에 적가합니다. 실온에서 3.5 h 동안 교반한 후, 회전 증발기 상의 용매 수집 플라스크에 더 이상 용매가 수집되지 않을 때까지 40°C에서 회전 증발에 의해 용매를 제거한다.
- 잔류물을 DCM 10mL에 용해시키고 단계 1.3.3에 설명된 대로 매번 30mL의 물로 3회 세척합니다. 유기상을Na2SO4로 건조시킨다(단계 1.3.4 및 1.3.5). 40°C에서 회전 증발에 의해 용매를 제거하여(단계 1.1.7) 생성물 BODIPY-(Me)2-I 2-OH를 얻었다.
- BODIPY-Cb의 합성
- 85mg의 클로람부실을 칭량하여 질소 분위기 하의 어두운 곳에서 무수 DCM 2mL에 용해시킵니다. 69mg의 N,N'-디시클로헥실카르보디이미드를 칭량하여 무수 DCM 1mL에 녹입니다. 10분 동안 교반하면서 chlorambucil 용액에 적가합니다.
- 4-디메틸아미노피리딘 1.7mg을 무수 DCM 0.5mL에 녹인다. 이 용액을 혼합물에 넣고 실온에서 10 분 동안 계속 저어줍니다. 그런 다음 무수 DCM 2mL에 용해된 BODIPY-(Me)2-I 2-OH 73mg을 넣고 2시간 동안 계속 교반합니다.
- 상기 혼합물에 실리카겔 10 g을 첨가하고, 40°C에서 회전 증발에 의해 용매를 제거한다. 실리카겔이 건조 분말로 돌아오면 증발을 중지합니다. 헥산/DCM = 7/3(v/v)를 용리액으로 사용하여 컬럼 크로마토그래피(단계 1.1.4 - 1.1.6, 540nm 및 365nm 신호 파장)로 제품 BODIPY-Cb를 정제합니다.
- TLC 분석을 사용하여 BODIPY-(Me)2-I 2-OH와 다른 생성물을 포함하는 용출된 분획을 선택합니다(단계 1.2.5). 40°C에서 회전 증발에 의해 용매를 제거하고(단계 1.1.7) 생성물 BODIPY-Cb를 얻었다.
2. 플래시 침전법에 의한 IR783/BC NP의 제조
- BC 프로드러그(BODIPY-Cb) 10mg을 칭량하고 1.5mL 마이크로튜브에 있는 DMSO 1mL에 용해시켜 10mg/mL 원액을 얻습니다. BC 용액을 호일로 덮으십시오.
- 300 μL의 0.4 mg/mL IR-783을 1.5 mL 마이크로튜브에 여과된 탈이온수로 준비합니다. 이 마이크로튜브를 1,500rpm의 소용돌이 믹서에 놓습니다.
- 20 μL 피펫을 사용하여 일정한 속도로 10초에 걸쳐 IR-783 용액에 DMSO의 BC 용액 20 μL를 추가합니다. 피펫 팁의 끝은 마이크로튜브의 내벽에 닿아야 합니다(그림 1B).
- IR30/BC NP 용액을 얻기 위해 추가로 783초 동안 소용돌이 믹서에 마이크로튜브를 유지합니다. 그런 다음 호일로 완전히 덮인 랙에 나노 입자 용액을 놓습니다.
- 생성된 IR783/BC NP 용액을 2,000 x g 및 4°C에서 10분 동안 원심분리하여 응집체를 제거하였다. 펠릿을 방해하지 않도록 튜브에 ~20μL를 남기고 상층액을 수집합니다. 펠릿을 버리십시오.
- 상층액을 30,000 x g 및 4°C에서 30분 동안 2회 원심분리하고, 양쪽 원심분리로부터 나노입자 침전물을 수집하였다. 나노입자를 300μL의 1x PBS에 재현탁합니다.
참고: DMSO 내의 소수성 BC 전구약물이 와동과 함께 물에 분산될 때, DMSO는 물에 의해 용해되고, 전구약물 분자는 국소 과포화 상황 하에서 안정하게 유지하기 위해 나노스케일 어셈블리를 형성하는 경향이 있다24. - 표 1에 나타낸 용출법을 이용하여 고성능 액체 크로마토그래피(HPLC)로 IR-783 및 BC의 함량을 정량화한다.
참고: HPLC 샘플은 동일한 부피의 나노입자 용액과 아세토니트릴을 혼합하여 준비합니다. 주입 부피는 20μL입니다. chlorambucil 및 BC 전구약물의 검출 파장은 260nm이고 IR783의 검출 파장은 783nm입니다. HPLC 컬럼은 입자 크기가 2.7μm이고 공극 크기가 120Å인 분석용 4.6mm(내경) x 100mm(길이) C18 컬럼입니다. - 다음 방정식에 따라 전구약물 캡슐화 효율(EE%)과 로딩 용량(LC%)을 계산합니다.

| 시간(분) | 아세토니트릴(%) | 수분 (%) |
| 0 | 20 | 80 |
| 5 | 20 | 80 |
| 30 | 95 | 5 |
| 35 | 95 | 5 |
표 1: BC 전구약물 및 이의 광절단의 정성 및 정량 분석을 위한 HPLC 방법. 허락을 받아 복제25. 저작권 2022, 와일리.
3. IR783/BC NP의 특성화
- 동적 광 산란(DLS) 기기로 IR783/BC NP의 평균 크기를 측정합니다( 재료 표 참조). 큐벳에 IR783/BC NP 용액 200μL를 추가하고 측정을 위해 큐벳을 홀더에 삽입합니다. 측정 유형을 '크기'로, 측정 온도를 25°C로 설정합니다. 각 측정에 대해 20초의 지속 시간으로 세 번의 측정을 수행합니다.
- 제타 전위 테스트 큐벳을 사용하여 DLS 기기로 IR783/BC NP의 표면 전하를 측정합니다.
- IR783/BC NP 용액 25μL를 1.5mL 마이크로튜브에 725μL의 탈이온수로 희석하고 용액을 제타 전위 테스트 큐벳에 추가합니다. 큐벳을 샘플 홈에 놓습니다. 샘플 홈을 덮습니다.
- 측정 유형을 '제타 전위'로 설정하고 측정 온도를 25°C로 설정합니다. 10회 측정합니다.
- 투과 전자 현미경(TEM) 이미징을 위해 샘플을 준비합니다. 구리 그리드(300메쉬)의 구멍이 뚫린 탄소 필름 조각에 IR783/BC NP 용액 10μL를 추가하고 7μL를 제거합니다.
참고: NP 용액 10μL를 추가한 후 7μL를 제거하면 액적이 필름의 더 넓은 영역을 덮을 수 있습니다.
4. IR783/BC NP의 광활성화
- 조명이 작업 현장을 직접 향하도록 철제 스탠드가 있는 LED 램프(530nm, 재료 표 참조)를 설정합니다. 적분구 포토다이오드 광도계( 재료 표 참조)를 LED 램프 바로 아래에 놓습니다.
알림: 환경 조명의 영향을 방지하기 위해 모든 광 조사 실험은 암실에서 수행됩니다. - LED 램프를 켜고 광도계의 캡을 엽니다. 방사 조도를 기록하고 램프 관련 소프트웨어를 사용하여 매개변수를 설정합니다( 재료 표 참조). 입력 전류(mA)를 조정하여 방사 조도를 50mW/cm2로 설정합니다.
알림: 조도는 LED 램프 사이의 거리에도 영향을 받습니다. 여기에 사용된 설정(그림 3A,B)에서 거리는 5cm로 고정되어 있습니다. - IR783/BC NP 용액을 탈이온수로 BC 농도를 기준으로 50μM로 희석합니다. IR783/BC NP 용액 200μL를 1.5mL 마이크로튜브에 추가합니다. 4.1단계에서 마이크로튜브의 홈 피팅 크기와 광도계와 동일한 높이의 폼 블록에 튜브를 놓습니다(그림 3C,D).
- 튜브의 캡을 엽니다. LED 램프를 켜고 나노 입자 용액을 1, 2, 3, 5, 7, 10분 동안 조사합니다.
- 광 조사 후 HPLC로 BC 소비량 및 Cb 방출을 정량화합니다. 다음 방정식을 사용하여 나머지 BC 및 Cb 방출의 백분율을 계산합니다.

5. 빛 조사 유무에 관계없이 IR783/BC NP의 세포 독성 테스트
- HCT116 세포 (인간 결장직장 종양 세포주)를 37°C에서 5% CO2 분위기 하에 10% 소 태아 혈청 및 1% 페니실린-스트렙토마이신 (완전 배지)을 함유하는 RPMI 1640 배지 (90 mm 세포 배양 디쉬 내의 디쉬당~2 x 10 6 세포)에서 배양하였다. 2-3일마다 정기적으로 세포를 계대 배양합니다.
참고: HCT116은 인간 결장 세포주입니다. HeLa, MCF7 및 A549 세포와 같은 다른 암세포와 비교하여 HCT-116 세포는 IR783에 의해 표적화되고 IR783/BC NP의 세포 흡수를 향상시킬 수 있는 더 높은 수준의 카베올린-1 25를 발현합니다. - HCT116 세포를 96-웰 플레이트에 RPMI 1640 완전 배지로 웰 당 104 세포의 밀도로 플레이트합니다.
- 세포 밀도가 50%를 초과할 때 배양 접시에서 배지를 흡인합니다. 세포를 1x PBS로 세척하고 PBS를 제거한다. 0.25% 트립신 용액 1mL를 첨가하고 5%CO2 인큐베이터에서 37°C에서 인큐베이션한다.
- 3분 후, 트립신 소화를 촉진하기 위해 2 mL의 완전 배지를 추가합니다. 세포를 재현탁하고, 세포 현탁액을 15mL 원심분리 튜브로 옮기고, 300 x g 에서 3분 동안 원심분리한다. 상층액을 버리고 세포 펠릿을 1mL의 완전 배지에 재현탁합니다.
- 세포 현탁액 10μL를 완전 배지로 200μL로 희석합니다. 혈구계에 10μL를 놓고 커버슬립으로 덮습니다.
- 현미경으로 혈구계를 관찰합니다(접안렌즈: 10x, 대물렌즈: 4x). 네 모서리 사각형과 중앙에 셀 번호를 세고 기록합니다. 다음 공식을 사용하여 세포 농도를 계산합니다.
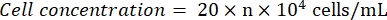
여기서 n = 5 개의 제곱에 대한 셀 번호의 평균입니다. - 세포 현탁액을 1 x 105 cells/mL로 희석합니다. 96-웰 플레이트에 웰당 100μL의 세포 현탁액을 추가하여 세포를 시딩합니다. 시드되지 않은 웰에 웰당 100μL의 PBS를 추가합니다.
- 세포를 (1) 0.1-150 μM free BC, (2) 0.1-150 μM IR783/BC NP(BC 농도 기준), (3) 0.1-150 μM free BCs(광 조사), 또는 (4) 0.1-150 μM IR783/BC NP(BC 농도 기준)로 광 조사. 세포를 5%CO2 인큐베이터에서 37°C에서 6시간 동안 인큐베이션한다.
참고: 무료 BC 및 IR783/BC NP 용액은 각각의 원액에서 완전한 배지로 희석됩니다. - 6시간 배양 후 전구약물/나노입자 함유 배지를 새로운 완전 배지로 교체합니다. 방사선 조사되지 않은 그룹 1과 2를 어둠 속에서 24시간 동안 배양합니다. 그룹 3 및 4의 경우 530nm LED 램프(50mW/cm2)로 5분 동안 세포를 조사하고 24시간 동안 배양합니다.
알림: 셀 플레이트는 4.1단계의 광도계와 동일한 높이를 보장하기 위해 폼 블록에 배치됩니다. - 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT) 분석법으로 세포 생존율을 측정합니다.
- BC 또는 나노 입자 처리 후 각 웰에 10 μL의 MTT (PBS에서 10 mg / mL)를 추가하고 플레이트를 37 ° C에서 3 시간 동안 배양합니다. 그런 다음 배지를 제거하고 각 웰에 100μL의 DMSO를 추가합니다. 마이크로플레이트 리더로 490nm, 570nm, 630nm에서 흡광도를 판독합니다.
- 다음 방정식을 사용하여 세포 생존율을 계산합니다.

참고: 분석을 위해 각 그룹의 4개의 독립적인 실험(n = 4)이 수행됩니다. OD490은 세포 생존율의 계산에서OD570-OD630으로 대체될 수 있다.
결과
IR783/BC NP는 플래시 침전 방법을 사용하여 이 연구에서 성공적으로 제조되었습니다. 합성된 IR783/BC NP는 보라색 용액으로 표시되는 반면 IR783의 수용액은 파란색이었습니다(그림 4A). 그림 4B에서 볼 수 있듯이 IR783/BC NP는 다분산 지수(PDI)가 0.089인 약 87.22nm의 평균 크기를 나타내어 좁은 크기 분포를 보여줍니다. IR783/NP의 표면 전하는 약 -29.8mV(
토론
이 프로토콜은 나노 입자 형성을 위한 간단하고 편리한 접근 방식을 제공하는 전구약물-염료 나노입자의 제조를 위한 손쉬운 플래시 침전 방법을 설명합니다. 이 방법에는 몇 가지 중요한 단계가 있습니다. 첫째, 합성, 제조 및 특성화의 모든 단계에서 마이크로튜브와 같은 용기는 환경광에 의한 BC 프로드러그의 불필요한 광절단을 방지하기 위해 호일로 덮어야 합니다. 또한, 플래시 침전 단계에?...
공개
PCT 출원은 No.PCT/CN2021/081262에 제출되었습니다.
감사의 말
우리는 홍콩 대학교 Li Ka Shing 의과 대학 교수 핵심 시설의 도움을 인정합니다. 인간 HCT116 세포주를 제공한 홍콩 대학교의 Chi-Ming Che 교수에게 감사드립니다. 이 작업은 Ming Wai Lau Center for Reparative Medicine Associate Member Program과 홍콩 연구 보조금 위원회(Early Career Scheme, No. 27115220)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1260 Infinity II HPLC | Agilent Technologies | ||
| 2,4-Dimethyl pyrrole | J&K Scientific | 315305 | |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT) | Gibco | M6494 | |
| 4-Dimethylaminopyridine (4-DMAP) | J&K Scientific | 212279 | |
| 90 mm Petri Dish Clear Treated Sterile | SPL | 11090 | |
| 96-well Tissue Culture Plate Clear Treated Sterile | SPL | 30096 | |
| Acetoxyacetyl chloride | J&K Scientific | 192001 | |
| Boron trifluoride diethyl etherate | J&K Scientific | 921076 | |
| Büchner funnel | AS ONE | 3-6466-01 | |
| Chlorambucil | J&K Scientific | 321407-1G | |
| CM100 Transmission Electron Microscope | Philips | ||
| CombiFlash RF chromatography system | Teledyne ISCO | ||
| Dichloromethane | DUKSAN Pure Chemicals | JT9315-88 | |
| Dimethyl sulfoxide | DUKSAN Pure Chemicals | 2762 | |
| Disposable cuvette | Malvern Panalytical | DTS1070 | Zeta potential measurement |
| Disposable cuvette | Malvern Panalytical | ZEN0040 | |
| Empty Disposable Sample Load Cartridges | Teledyne ISCO | 693873225 | can hold up to 65 g |
| Fetal bovine serum | Gibco | 10270106 | |
| Filtering flask | AS ONE | 3-7089-03 | |
| Hexane | DUKSAN Pure Chemicals | 4198 | |
| Holey carbon film on copper grid | Beijing Zhongjingkeyi Technology Co.,Ltd | BZ10023a | |
| HPLC column (InfinityLab Poroshell 120) | Agilent Technologies | 695975-902T | |
| Integrating sphere photodiode power sensor | Thorlabs | S142C | |
| IR783 | Tokyo Chemical Industry (TCI) Co., Ltd | I1031 | |
| LED | Mightex | LCS-0530-15-11 | |
| LED Driver Control Panel V3.2.0 (Software) | Mightex | ||
| Lithium Hydroxide Anhydrous | TCI | L0225 | |
| Methylmagnesium iodide, 3M solution in diethyl ether | Aladdin | M140783 | |
| N,N-Diisopropyl ethyl amine (DIPEA) | J&K Scientific | 203402 | |
| N,N'-Dicyclohexylcarbodiimide (DCC) | J&K Scientific | 275928 | |
| penicillin–streptomycin | Gibco | 15140122 | |
| Phosphate-buffered saline (10×) | Sigma-Aldrich | P5493 | |
| Power and energy meter | Thorlabs | PM100 USB | |
| Rotavapor | BUCHI Rotavapor R300 | ||
| RMPI 1640 | Gibco | 21870076 | |
| Separatory funnel (125 mL) | Synthware | F474125L | |
| Silver Silica Gel Disposable Flash Columns, 40 g | Teledyne ISCO | 692203340 | |
| Sodium sulfate, anhydrous | Alfa Aesar | A19890 | |
| SpectraMax M4 | Molecular Devices LLC | ||
| Tetrahydrofuran (THF), anhydrous | J&K Scientific | 943616 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200056 | |
| Vortex | DLAB Scientific Co., Ltd | MX-S | |
| Zetasizer Nano ZS90 | Malvern Instrument |
참고문헌
- Chabner, B. A., Roberts, T. G. Chemotherapy and the war on cancer. Nature Reviews Cancer. 5 (1), 65-72 (2005).
- Monsuez, J. -. J., Charniot, J. -. C., Vignat, N., Artigou, J. -. Y. Cardiac side-effects of cancer chemotherapy. International Journal of Cardiology. 144 (1), 3-15 (2010).
- Floyd, J., Mirza, I., Sachs, B., Perry, M. C. Hepatotoxicity of chemotherapy. Seminars in Oncology. 33 (1), 50-67 (2006).
- Bar-Joseph, H., Stemmer, S. M., Tsarfaty, I., Shalgi, R., Ben-Aharon, I. Chemotherapy-induced vascular toxicity-real-time in vivo imaging of vessel impairment. Journal of Visualized Experiments. (95), e51650 (2015).
- Denny, W. A. Prodrug strategies in cancer therapy. European Journal of Medicinal Chemistry. 36 (7-8), 577-595 (2001).
- Kastrati, I., Delgado-Rivera, L., Georgieva, G., Thatcher, G. R. J., Frasor, J. Synthesis and characterization of an aspirin-fumarate prodrug that inhibits NFκB activity and breast cancer stem cells. Journal of Visualized Experiments. (119), e54798 (2017).
- Mao, J., et al. A simple dual-pH responsive prodrug-based polymeric micelles for drug delivery. ACS Applied Materials & Interfaces. 8 (27), 17109-17117 (2016).
- Li, S. -. Y., et al. A pH-responsive prodrug for real-time drug release monitoring and targeted cancer therapy. Chemical Communications. 50 (80), 11852-11855 (2014).
- Andresen, T. L., Thompson, D. H., Kaasgaard, T. Enzyme-triggered nanomedicine: Drug release strategies in cancer therapy (Invited Review). Molecular Membrane Biology. 27 (7), 353-363 (2010).
- Xu, G., McLeod, H. L. Strategies for enzyme/prodrug cancer therapy. Clinical Cancer Research. 7 (11), 3314-3324 (2001).
- Luo, W., et al. Dual-targeted and pH-sensitive doxorubicin prodrug-microbubble complex with ultrasound for tumor treatment. Theranostics. 7 (2), 452 (2017).
- Gao, J., et al. Ultrasound triggered phase-change nanodroplets for doxorubicin prodrug delivery and ultrasound diagnosis: An in vitro study. Colloids and Surfaces B: Biointerfaces. 174, 416-425 (2019).
- Brade, A. M., Szmitko, P., Ngo, D., Liu, F. -. F., Klamut, H. J. Heat-directed suicide gene therapy for breast cancer. Cancer Gene Therapy. 10 (4), 294-301 (2003).
- Long, K., et al. One-photon red light-triggered disassembly of small-molecule nanoparticles for drug delivery. Journal of Nanobiotechnology. 19 (1), 357 (2021).
- Liu, Y., Long, K., Kang, W., Wang, T., Wang, W. Optochemical control of immune checkpoint blockade via light-triggered PD-L1 dimerization. Advanced NanoBiomed Research. 2 (6), 2200017 (2022).
- Wang, T., et al. Optochemical control of mTOR signaling and mTOR-dependent autophagy. ACS Pharmacology & Translational Science. 5 (3), 149-155 (2022).
- Abet, V., Filace, F., Recio, J., Alvarez-Builla, J., Burgos, C. Prodrug approach: An overview of recent cases. European Journal of Medicinal Chemistry. 127, 810-827 (2017).
- Li, G., et al. Small-molecule prodrug nanoassemblies: an emerging nanoplatform for anticancer drug delivery. Small. 17 (52), 2101460 (2021).
- Shamay, Y., et al. Quantitative self-assembly prediction yields targeted nanomedicines. Nature Materials. 17 (4), 361-368 (2018).
- Sinoway, P. A., Callen, J. P. Chlorambucil. Arthritis & Rheumatism. 36 (3), 319-324 (1993).
- Owen, W. R., Stewart, P. J. Kinetics and mechanism of chlorambucil hydrolysis. Journal of Pharmaceutical Sciences. 68 (8), 992-996 (1979).
- Lv, W., et al. Upconversion-like photolysis of BODIPY-based prodrugs via a one-photon process. Journal of the American Chemical Society. 141 (44), 17482-17486 (2019).
- Silver, J. Let us teach proper thin layer chromatography technique. Journal of Chemical Education. 97 (12), 4217-4219 (2020).
- Saad, W. S., Prud'homme, R. K. Principles of nanoparticle formation by flash nanoprecipitation. Nano Today. 11 (2), 212-227 (2016).
- Long, K., et al. Photoresponsive prodrug-dye nanoassembly for in-situ monitorable cancer therapy. Bioengineering & Translational Medicine. 7 (3), 10311 (2022).
- Zhong, T., et al. A self-assembling nanomedicine of conjugated linoleic acid-paclitaxel conjugate (CLA-PTX) with higher drug loading and carrier-free characteristic. Scientific Reports. 6 (1), 36614 (2016).
- Long, K., et al. Green light-triggered intraocular drug release for intravenous chemotherapy of retinoblastoma. Advanced Science. 8 (20), 2101754 (2021).
- Lv, W., Wang, W. One-photon upconversion-like photolysis: a new strategy to achieve long-wavelength light-excitable photolysis. Synlett. 31 (12), 1129-1134 (2020).
- Rwei, A. Y., Wang, W., Kohane, D. S. Photoresponsive nanoparticles for drug delivery. Nano Today. 10 (4), 451-467 (2015).
- Grzelczak, M., Vermant, J., Furst, E. M., Liz-Marzán, L. M. Directed self-assembly of nanoparticles. ACS Nano. 4 (7), 3591-3605 (2010).
- Gnanasammandhan, M. K., Idris, N. M., Bansal, A., Huang, K., Zhang, Y. Near-IR photoactivation using mesoporous silica-coated NaYF4:Yb,Er/Tm upconversion nanoparticles. Nature Protocols. 11 (4), 688-713 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유