Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Fácil preparación y fotoactivación de nanoensamblajes profármaco-colorante
En este artículo
Resumen
Este protocolo describe la fabricación y caracterización de un nanoensamblaje fotosensible profármaco-colorante. Se describe explícitamente la metodología para la liberación del fármaco de las nanopartículas mediante el desmontaje activado por la luz, incluida la configuración de irradiación de la luz. Los fármacos liberados de las nanopartículas después de la irradiación de luz exhibieron excelentes efectos antiproliferación en las células tumorales colorrectales humanas.
Resumen
El autoensamblaje es un método simple pero confiable para construir sistemas de administración de fármacos a nanoescala. Los profármacos fotoactivables permiten la liberación controlable de fármacos de nanoportadores en sitios objetivo modulados por irradiación de luz. En este protocolo, se presenta un método fácil para fabricar nanopartículas fotoactivables de profármaco-colorante a través del autoensamblaje molecular. Los procedimientos para la síntesis de profármacos, la fabricación de nanopartículas, la caracterización física del nanoensamblaje, la demostración de fotoescisión y la verificación de citotoxicidad in vitro se describen en detalle. Primero se sintetizó un profármaco fotodicente boro-dipironoteno-clorambucilo (BC). BC y un tinte infrarrojo cercano, IR-783, en una proporción optimizada, podrían autoensamblarse en nanopartículas (IR783 / BC NPs). Las nanopartículas sintetizadas tenían un tamaño promedio de 87.22 nm y una carga superficial de -29.8 mV. Las nanopartículas se desmontaron con irradiación de luz, que pudo observarse mediante microscopía electrónica de transmisión. La fotoescisión de BC se completó en 10 min, con una eficiencia de recuperación del 22% para clorambucilo. Las nanopartículas mostraron una mayor citotoxicidad bajo irradiación de luz a 530 nm en comparación con las nanopartículas no irradiadas y el profármaco BC libre irradiado. Este protocolo proporciona una referencia para la construcción y evaluación de sistemas de administración de fármacos fotosensibles.
Introducción
La quimioterapia es un tratamiento común contra el cáncer que emplea agentes citotóxicos para destruir las células cancerosas y, por lo tanto, inhibe el crecimiento tumoral1. Sin embargo, los pacientes pueden sufrir efectos secundarios como cardiotoxicidad y hepatotoxicidad debido a la absorción fuera del objetivo de los medicamentos de quimioterapia 2,3,4. Por lo tanto, la administración localizada de fármacos a través del control espaciotemporal de la liberación/activación del fármaco en los tumores es esencial para minimizar la exposición al fármaco en los tejidos normales.
Los profármacos son fármacos modificados químicamente que presentan una toxicidad reducida en los tejidos normales, conservando su acción en las lesiones enfermas tras la activación 5,6. Los profármacos pueden responder a una variedad de estímulos, como pH7,8, enzimas 9,10, ultrasonido 11,12, calor 13 y luz14,15,1 6, y liberar sus fármacos parentales específicamente en las lesiones. Sin embargo, muchos profármacos presentan inconvenientes inherentes, como baja solubilidad, tasa de absorción incorrecta y destrucción metabólica temprana, lo que puede limitar su desarrollo17. En este contexto, la formación de nanoensamblajes de profármacos ofrece ventajas como la disminución de los efectos secundarios, la liberación in situ del fármaco, una mejor retención y la combinación de tratamiento e imágenes, lo que indica un gran potencial de aplicación para estos nanoensamblajes. Se han desarrollado muchos nanoensamblajes de profármacos para el tratamiento de enfermedades, incluidas las nanoesferas de profármacos de doxorrubicina, las micelas de profármacos de curcumina y las nanofibras de profármacos de camptotecina18.
En este protocolo, presentamos un método simple para la preparación de nanoensamblajes profármaco-colorante que exhiben un alto contenido de profármacos, buena dispersabilidad del agua, estabilidad a largo plazo y capacidad de respuesta sensible. IR783 es un colorante infrarrojo cercano soluble en agua que puede servir como estabilizador de los nanoconjuntos19. El otro componente del nanoensamblaje es boro-dipironeteno-clorambucilo (BODIPY-Cb, BC), un profármaco que fue diseñado por dos razones principales. Como el clorambucilo (Cb) muestra toxicidad sistémica in vivo, la forma profármaco puede disminuir su toxicidad20. El profármaco BC se puede fotoescindar utilizando irradiación de luz de 530 nm dirigida a las lesiones de la enfermedad, lo que permite la liberación local de Cb. Por otro lado, el Cb es propenso a la hidrólisis en ambientes acuosos, y puede protegerse transformándolo en una forma profármaco21. Por lo tanto, se esperaba que el ensamblaje conjunto del profármaco BC y el colorante IR-783 formara un nanosistema de administración de fármacos estable y efectivo (Figura 1A). Este nanoensamblaje profármaco-colorante mejora la dispersabilidad y estabilidad de las moléculas de profármaco, lo que sugiere su potencial para su aplicación en la administración de fármacos controlables por la luz. La fotoescisión del profármaco BC permite el desmontaje de nanopartículas y la liberación controlada por luz de Cb en las lesiones (Figura suplementaria 1).
Protocolo
1. Síntesis del profármaco boro-dipironeteno-clorambucilo (BC) (Figura 2)22
- Síntesis de BODIPY-OAc
- Pesar 1,903 g de 2,4-dimetilpirrol y disolverlo en 20 ml de diclorometano anhidro (MCD) en un matraz de fondo redondo en atmósfera de nitrógeno. Pesar 1.638 g de acetoxy acetil cloruro y añadirlo gota a gota a la solución. Mantener agitando durante 10 min a temperatura ambiente y luego reflujo la solución durante 1 h a 40 °C.
- Enfríe la mezcla a temperatura ambiente. Pesar 5.170 g de N,N-diisopropiletilamina (DIPEA) y añadirlo gota a gota a la mezcla bajo agitación. Después de 30 min, pesar 5,677 g de trifluoruro de boro dietil etherato (BF3· OEt2), agréguelo gota a gota en la solución y siga revolviendo durante 30 minutos adicionales.
- Añadir 10 g de gel de sílice (malla 200-400) a la mezcla y eliminar el disolvente por evaporación rotativa a 45 °C. Detenga la evaporación cuando el gel de sílice vuelva a ser polvo seco.
- Agregue una frita en la parte inferior de un cartucho (consulte la Tabla de materiales). Llene el gel de sílice (del paso 1.1.3) en el cartucho y, a continuación, añada otra frita al cartucho en la parte superior del gel lleno.
- Fije el cartucho en el collar conectado con el sistema de cromatografía flash (consulte Tabla de materiales) y gírelo para bloquearlo. Instale el cartucho en la parte superior de la válvula de seis vías en el sistema de cromatografía flash e instale una columna de flash (consulte la Tabla de materiales) debajo de la válvula.
- Inicie el instrumento de cromatografía y establezca 515 nm y 365 nm como longitudes de onda de detección. Realizar la elución con 4/3 (v/v) hexano/DCM. Recoja las fracciones eluyentes a medida que aparezca la señal de 515 nm.
- Retirar el disolvente de las fracciones recogidas por evaporación rotativa a 40 °C hasta que no se recoja más disolvente en el matraz de recogida de disolventes. Coloque el producto sólido en una cámara de secado al vacío durante la noche para eliminar el resto del disolvente.
- Síntesis de BODIPY-OH
- Pesar 1,120 g de BODIPY-OAc (sintetizado en el paso 1.1) y disolverlo en 70 ml de tetrahidrofurano (THF) a temperatura ambiente, completamente cubierto con papel de aluminio. Añadir 70 ml de solución acuosa de LiOH 0,1 M gota a gota en la solución BODIPY-OAc.
- Agitar la mezcla durante 30 min y retirar el disolvente a 40 °C por evaporación rotativa hasta que no se recoja más disolvente en el matraz de recogida de disolventes. Coloque el residuo en una cámara de secado al vacío durante la noche para eliminar el agua.
- Disuelva el residuo seco en 30 ml de DCM y agregue 10 g de gel de sílice a la solución. Eliminar el disolvente por evaporación rotativa a 40 °C. Detenga la evaporación cuando el gel de sílice vuelva a ser polvo seco.
- Purificar el producto BODIPY-OH por cromatografía en columna, siguiendo los pasos 1.1.4 a 1.1.6, con DCM solo como eluyente.
- Comparar fracciones recogidas en diferentes puntos de tiempo de elución con una solución THF de BODIPY-OAc en cromatografía en capa fina (TLC) e identificar el producto23.
- Detectar 3-4 μL de la fracción eluyida y la solución de BODIPY-OAc por separado en un borde de una placa TLC a la misma altura. Coloque la placa TLC en una cámara de vidrio que contenga 1 ml de DCM, sumergiendo el borde manchado en el disolvente DCM pero con los dos puntos fuera del disolvente.
- Saque la placa TLC cuando el disolvente DCM alcance más de la mitad de la altura de la placa. Seleccione la fracción eluyente con un punto TLC a una altura diferente del punto BODIPY-OAc.
- Eliminar el disolvente por evaporación rotativa a 40 °C (paso 1.1.7) para obtener el producto BODIPY-OH.
- Síntesis de BODIPY-(Me)2-OH
- Pesar 313 mg de BODIPY-OH y disolverlo en 35 ml de éter dietílico anhidro en la oscuridad bajo una atmósfera de nitrógeno. Añadir 3,75 ml de yoduro de metil magnesio (3 M en éter dietílico) gota a gota en la solución y mantener agitando durante 3 h a temperatura ambiente.
- Apague la reacción agregando 3.5 ml de agua gota a gota.
- Extraer la mezcla con DCM y agua.
- Transfiera la mezcla a un embudo de separación de 125 ml. Agregue 20 ml de DCM a la mezcla.
- Cierre la tapa del embudo separador. Incline el embudo a unos 45° y agite ligeramente el embudo. Abra la tapa para desinflar. Repita este paso 3 veces y deje reposar durante 3 minutos.
- Abra la válvula inferior y recoja la fase orgánica inferior en un vaso de precipitados.
- Añadir 30 mL de DCM a la fase acuosa. Repita la extracción (pasos 1.3.3.2 y 1.3.3.3) 3 veces con 30 ml de MCD cada vez.
- Añadir 10 g deNa2SO4 sólido en la fase orgánica recogida para secar la fase orgánica durante la noche.
- Conecte un matraz filtrante a una bomba de vacío con un tubo de goma. Coloque un trozo de papel de filtro en el embudo Büchner e inserte el embudo en la parte superior del matraz. Moje el papel de filtro con 1 ml de DCM, transfiera la mezcla al embudo y encienda la bomba de vacío. Recoger la solución orgánica en el matraz.
- Añadir 10 g de gel de sílice en la solución orgánica. Eliminar el disolvente orgánico por evaporación rotativa a 40 °C hasta que el gel de sílice vuelva a convertirse en polvo seco. Purificar el producto BODIPY-(Me)2-OH por cromatografía en columna (pasos 1.1.4 a 1.1.6) con hexano/DCM = 1/1 (v/v) como eluyente.
- Seleccione las fracciones eluidas que contienen el producto mediante el análisis TLC como se describe en el paso 1.2.5 (punto TLC a una altura diferente de BODIPY-OH). Eliminar el disolvente por evaporación rotativa a 40 °C para obtener el producto como se describe en el paso 1.1.7.
- Síntesis de BODIPY-(Me)2-I 2-OH
- Pesar 41 mg de BODIPY-(Me)2-OH y disolverlo en 2,5 ml de THF anhidro en la oscuridad bajo una atmósfera de nitrógeno. Pesar 74 mg de N-yodosuccinimida y disolverlo en 1 ml de THF anhidro.
- Agregue la solución de N-yodosuccinimida gota a gota en la solución BODIPY-(Me)2-OH. Después de agitar durante 3,5 h a temperatura ambiente, extraer el disolvente por evaporación rotativa a 40 °C hasta que no se recoja más disolvente en el matraz de recogida de disolventes del evaporador rotativo.
- Disolver el residuo en 10 ml de MCD y lavarlo 3 veces con 30 ml de agua cada vez, como se describe en el paso 1.3.3. Secar la fase orgánica conNa2SO4 (pasos 1.3.4 y 1.3.5). Eliminar el disolvente por evaporación rotativa a 40 °C (paso 1.1.7) para obtener el producto BODIPY-(Me)2-I 2-OH.
- Síntesis de BODIPY-Cb
- Pesar 85 mg de clorambucilo y disolverlo en 2 ml de MCD anhidro en la oscuridad bajo una atmósfera de nitrógeno. Pesar 69 mg de N,N'-diciclohexilcarbodiimida y disolverlo en 1 mL de DCM anhidro. Añádalo gota a gota en la solución de clorambucilo agitando durante 10 minutos.
- Disolver 1,7 mg de 4-dimetilaminopiridina en 0,5 ml de MCD anhidro. Agregue esta solución a la mezcla y siga revolviendo durante 10 minutos a temperatura ambiente. Luego agregue 73 mg de BODIPY-(Me)2-I 2-OH disuelto en 2 ml de DCM anhidro y mantenga la agitación durante 2 h.
- Añadir 10 g de gel de sílice a la mezcla y eliminar el disolvente por evaporación rotativa a 40 °C. Detenga la evaporación cuando el gel de sílice vuelva a ser polvo seco. Purificar el producto BODIPY-Cb por cromatografía en columna (pasos 1.1.4 a 1.1.6, longitud de onda de señal de 540 nm y 365 nm) con hexano/DCM = 7/3 (v/v) como eluyente.
- Seleccione las fracciones eluidas que contienen el producto diferente de BODIPY-(Me)2-I 2-OH mediante el análisis TLC (paso 1.2.5). Eliminar el disolvente por evaporación rotativa a 40 °C (paso 1.1.7) para obtener el producto BODIPY-Cb.
2. Preparación de NPs IR783/BC por el método de precipitación flash
- Pesar 10 mg del profármaco B (BODIPY-Cb) y disolverlo en 1 ml de DMSO en un microtubo de 1,5 ml para obtener una solución madre de 10 mg/ml. Cubra la solución BC con papel de aluminio.
- Preparar 300 μL de 0,4 mg/ml IR-783 en agua desionizada filtrada en un microtubo de 1,5 ml. Coloque este microtubo en un mezclador de vórtice a 1.500 rpm.
- Añadir 20 μL de la solución BC en DMSO a la solución IR-783 durante 10 s a una velocidad constante utilizando una pipeta de 20 μL. El extremo de la punta de la pipeta debe tocar la pared interna del microtubo (Figura 1B).
- Mantenga el microtubo en el mezclador de vórtice durante 30 s adicionales para obtener la solución IR783/BC NP. Luego, coloque la solución de nanopartículas en un estante completamente cubierto con papel de aluminio.
- Centrifugar la solución IR783/BC NP resultante durante 10 min a 2.000 x g y 4 °C para eliminar los agregados. Recoja el sobrenadante, dejando ~20 μL en el tubo para evitar perturbar el pellet. Deseche el pellet.
- Centrifugar el sobrenadante dos veces durante 30 min a 30.000 x g y 4 °C y recoger el precipitado de nanopartículas de ambas centrifugaciones. Resuspender las nanopartículas en 300 μL de 1x PBS.
NOTA: Cuando el profármaco BC hidrófobo en DMSO se dispersa en agua con vórtice, el DMSO es disuelto por el agua, y las moléculas del profármaco tienden a formar ensamblajes a nanoescala para mantenerse estables bajo la situación de sobresaturación local24. - Cuantificar el contenido de IR-783 y BC por cromatografía líquida de alta resolución (HPLC), utilizando el método de elución que se muestra en la Tabla 1.
NOTA: La muestra de HPLC se prepara mezclando volúmenes iguales de solución de nanopartículas y acetonitrilo. El volumen de inyección es de 20 μL. La longitud de onda de detección para clorambucilo y profármaco BC es de 260 nm, y la longitud de onda de detección para IR783 es de 783 nm. La columna de HPLC es una columna C18 analítica de 4,6 mm (diámetro interior) x 100 mm (longitud), con un tamaño de partícula de 2,7 μm y un tamaño de poro de 120 Å. - Calcule la eficiencia de encapsulación del profármaco (EE%) y la capacidad de carga (LC%) de acuerdo con las siguientes ecuaciones:

| Tiempo (min) | Acetonitrilo (%) | Agua (%) |
| 0 | 20 | 80 |
| 5 | 20 | 80 |
| 30 | 95 | 5 |
| 35 | 95 | 5 |
Tabla 1: Método de HPLC para el análisis cualitativo y cuantitativo del profármaco BC y su fotoescisión. Reproducido con permiso25. Derechos de autor 2022, Wiley.
3. Caracterización de NPs IR783/BC
- Mida el tamaño promedio de los NP IR783 / BC con un instrumento de dispersión dinámica de luz (DLS) (consulte la Tabla de materiales). Añadir 200 μL de solución IR783/BC NP en una cubeta e insertar la cubeta en el soporte para su medición. Establezca el tipo de medición como "tamaño" y la temperatura de medición como 25 °C. Realice tres mediciones con una duración de 20 s para cada medición.
- Mida la carga superficial de las NP IR783/BC con el instrumento DLS utilizando una cubeta de prueba de potencial zeta.
- Diluir 25 μL de solución IR783/BC NP con 725 μL de agua desionizada en un microtubo de 1,5 ml y añadir la solución a una cubeta de prueba de potencial zeta. Coloque la cubeta en la ranura de muestra. Tapa la ranura de la muestra.
- Establezca el tipo de medición como "potencial zeta" y la temperatura de medición como 25 °C. Realizar 10 mediciones.
- Prepare las muestras para la obtención de imágenes por microscopía electrónica de transmisión (TEM). Añadir 10 μL de solución de NP IR783/BC sobre un trozo de película de carbono agujereada en una rejilla de cobre (malla 300) y retirar 7 μL. Dejar 3 μL de solución en la película durante la noche para la autoevaporación.
NOTA: La adición de 10 μL de la solución NP seguida de la eliminación de 7 μL permite que la gota cubra un área más amplia en la película.
4. Fotoactivación de NPs IR783/BC
- Instale una lámpara LED (530 nm; consulte la Tabla de materiales) con un soporte de hierro para que la luz mire directamente hacia el piso de operación. Coloque un fotómetro de fotodiodo de esfera integradora (consulte la Tabla de materiales) directamente debajo de la lámpara LED.
NOTA: Para evitar la influencia de la luz ambiental, todos los experimentos de irradiación de luz se llevan a cabo en un cuarto oscuro. - Encienda la lámpara LED y abra la tapa del fotómetro. Registre la irradiancia y ajuste los parámetros de la lámpara utilizando el software asociado (consulte la Tabla de materiales). Ajuste la corriente de entrada (mA) para ajustar la irradiancia como 50 mW/cm2.
NOTA: La irradiancia también se ve afectada por la distancia entre la lámpara LED y el fotómetro. En la configuración utilizada aquí (Figura 3A, B), la distancia se fija en 5 cm. - Diluir la solución IR783/BC NP con agua desionizada a 50 μM en función de la concentración de BC. Añadir 200 μL de la solución IR783/BC NP en un microtubo de 1,5 ml. Coloque el tubo en un bloque de espuma con un tamaño de ranura del microtubo y la misma altura que el fotómetro en el paso 4.1 (Figura 3C, D).
- Abra la tapa del tubo. Encienda la lámpara LED e irradie la solución de nanopartículas durante 1, 2, 3, 5, 7 y 10 min.
- Cuantificar el consumo de BC y la liberación de Cb por HPLC después de la irradiación de luz. Calcule el porcentaje de liberación de BC y Cb restante utilizando las siguientes ecuaciones:

5. Ensayo de citotoxicidad de NPs IR783/BC con y sin irradiación lumínica
- Cultivo de células HCT116 (línea celular de tumor colorrectal humano) en medio RPMI 1640 que contiene 10% de suero bovino fetal y 1% de penicilina-estreptomicina (medio completo) en una atmósfera de CO2 al 5% a 37 °C (~2 x 106 células por plato en una placa de cultivo celular de 90 mm). Subcultivo rutinario de las células cada 2-3 días.
NOTA: HCT116 es una línea celular de colon humano. En comparación con otras células cancerosas como las células HeLa, MCF7 y A549, las células HCT-116 expresan un nivel más alto de caveolina-125, que puede ser atacado por IR783 y mejorar la absorción celular de IR783 / BC NP. - Coloque las células HCT116 en placas de 96 pocillos con medio completo RPMI 1640 a una densidad de 10a 4 células por pocillo.
- Aspirar el medio de la placa de cultivo cuando la confluencia celular supere el 50%. Lave las celdas con 1x PBS y retire el PBS. Añadir 1 ml de solución de tripsina al 0,25% e incubar a 37 °C en una incubadora deCO2 al 5%.
- Después de 3 minutos, agregue 2 ml de medio completo para calmar la digestión de tripsina. Vuelva a suspender las células, transfiera la suspensión celular a un tubo de centrifugación de 15 ml y centrifugar a 300 x g durante 3 min. Desechar el sobrenadante y resuspender el pellet celular en 1 mL de medio completo.
- Diluir 10 μL de la suspensión celular a 200 μL con medio completo. Coloque 10 μL en un hemocitómetro y cúbralo con un cubreobjetos.
- Observe el hemocitómetro bajo un microscopio (ocular: 10x; lente del objetivo: 4x). Cuente y registre los números de celda en los cuatro cuadrados de las esquinas y el centro. Calcule la concentración celular usando la fórmula:
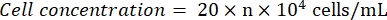
Donde n = el promedio de los números de celda de los cinco cuadrados. - Diluir la suspensión celular a 1 x 105 células/ml. Agregue 100 μL de la suspensión celular por pocillo en una placa de 96 pocillos para sembrar las células. Agregue 100 μL de PBS por pocillo en los pozos sin sembrar.
- Tratar las células con (1) 0.1-150 μM libres BCs, (2) 0.1-150 μM IR783/BC NPs (basado en la concentración BC), (3) 0.1-150 μM BC libre con irradiación de luz, o (4) 0.1-150 μM IR783/BC NPs (basado en la concentración de BC) con irradiación de luz. Incubar las células a 37 °C en una incubadora deCO2 al 5% durante 6 h.
NOTA: Las soluciones libres BC e IR783/BC NP se diluyen de sus respectivas soluciones madre con medio completo. - Después de 6 h de incubación, sustituir el medio que contiene profármacos/nanopartículas por un medio fresco completo. Incubar los grupos de no irradiación 1 y 2 en la oscuridad durante 24 h. Para los grupos 3 y 4, irradiar las células con una lámpara LED de 530 nm (50 mW/cm2) durante 5 min, e incubar durante 24 h.
NOTA: Las placas celulares se colocan en un bloque de espuma para garantizar la misma altura que el fotómetro en el paso 4.1. - Determinar la viabilidad celular con el ensayo de bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difenil tetrazolio (MTT).
- Después del tratamiento BC o nanopartículas, añadir 10 μL de MTT (10 mg/ml en PBS) a cada pocillo e incubar las placas a 37 °C durante 3 h. Luego, retire el medio y agregue 100 μL de DMSO a cada pocillo. Lea la absorbancia con un lector de microplacas a 490 nm, 570 nm y 630 nm.
- Calcula la viabilidad celular usando la siguiente ecuación:

NOTA: Se realizan cuatro experimentos independientes (n = 4) de cada grupo para el análisis. OD490 puede ser reemplazado por OD570-OD 630 en el cálculo de la viabilidad celular.
Resultados
Las NP IR783 / BC se fabricaron con éxito en este estudio utilizando un método de precipitación repentina. Los NPs IR783/BC sintetizados se presentaron como una solución púrpura, mientras que la solución acuosa de IR783 fue azul (Figura 4A). Como se muestra en la Figura 4B, los NP IR783/BC exhibieron un tamaño promedio de aproximadamente 87.22 nm con un índice de polidispersidad (PDI) de 0.089, lo que demuestra una distribución de tamaño estrecha. La c...
Discusión
Este protocolo describe un método de precipitación flash fácil para la fabricación de nanopartículas de colorante profármaco, que ofrece un enfoque simple y conveniente para la formación de nanopartículas. Hay varios pasos críticos en este método. En primer lugar, para todos los pasos de síntesis, fabricación y caracterización, los recipientes como los microtubos deben cubrirse con papel de aluminio para evitar la fotoescisión innecesaria del profármaco BC por la luz ambiental. Además, en la etapa de prec...
Divulgaciones
Se ha presentado una solicitud PCT con el Nº.PCT/CN2021/081262.
Agradecimientos
Reconocemos la asistencia de la Facultad de Medicina Li Ka Shing de la Universidad de Hong Kong. Agradecemos al profesor Chi-Ming Che de la Universidad de Hong Kong por proporcionar la línea celular humana HCT116. Este trabajo fue apoyado por el Programa de Miembros Asociados del Centro Ming Wai Lau para la Medicina Reparadora y el Consejo de Becas de Investigación de Hong Kong (Plan de Carrera Temprana, No. 27115220).
Materiales
| Name | Company | Catalog Number | Comments |
| 1260 Infinity II HPLC | Agilent Technologies | ||
| 2,4-Dimethyl pyrrole | J&K Scientific | 315305 | |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT) | Gibco | M6494 | |
| 4-Dimethylaminopyridine (4-DMAP) | J&K Scientific | 212279 | |
| 90 mm Petri Dish Clear Treated Sterile | SPL | 11090 | |
| 96-well Tissue Culture Plate Clear Treated Sterile | SPL | 30096 | |
| Acetoxyacetyl chloride | J&K Scientific | 192001 | |
| Boron trifluoride diethyl etherate | J&K Scientific | 921076 | |
| Büchner funnel | AS ONE | 3-6466-01 | |
| Chlorambucil | J&K Scientific | 321407-1G | |
| CM100 Transmission Electron Microscope | Philips | ||
| CombiFlash RF chromatography system | Teledyne ISCO | ||
| Dichloromethane | DUKSAN Pure Chemicals | JT9315-88 | |
| Dimethyl sulfoxide | DUKSAN Pure Chemicals | 2762 | |
| Disposable cuvette | Malvern Panalytical | DTS1070 | Zeta potential measurement |
| Disposable cuvette | Malvern Panalytical | ZEN0040 | |
| Empty Disposable Sample Load Cartridges | Teledyne ISCO | 693873225 | can hold up to 65 g |
| Fetal bovine serum | Gibco | 10270106 | |
| Filtering flask | AS ONE | 3-7089-03 | |
| Hexane | DUKSAN Pure Chemicals | 4198 | |
| Holey carbon film on copper grid | Beijing Zhongjingkeyi Technology Co.,Ltd | BZ10023a | |
| HPLC column (InfinityLab Poroshell 120) | Agilent Technologies | 695975-902T | |
| Integrating sphere photodiode power sensor | Thorlabs | S142C | |
| IR783 | Tokyo Chemical Industry (TCI) Co., Ltd | I1031 | |
| LED | Mightex | LCS-0530-15-11 | |
| LED Driver Control Panel V3.2.0 (Software) | Mightex | ||
| Lithium Hydroxide Anhydrous | TCI | L0225 | |
| Methylmagnesium iodide, 3M solution in diethyl ether | Aladdin | M140783 | |
| N,N-Diisopropyl ethyl amine (DIPEA) | J&K Scientific | 203402 | |
| N,N'-Dicyclohexylcarbodiimide (DCC) | J&K Scientific | 275928 | |
| penicillin–streptomycin | Gibco | 15140122 | |
| Phosphate-buffered saline (10×) | Sigma-Aldrich | P5493 | |
| Power and energy meter | Thorlabs | PM100 USB | |
| Rotavapor | BUCHI Rotavapor R300 | ||
| RMPI 1640 | Gibco | 21870076 | |
| Separatory funnel (125 mL) | Synthware | F474125L | |
| Silver Silica Gel Disposable Flash Columns, 40 g | Teledyne ISCO | 692203340 | |
| Sodium sulfate, anhydrous | Alfa Aesar | A19890 | |
| SpectraMax M4 | Molecular Devices LLC | ||
| Tetrahydrofuran (THF), anhydrous | J&K Scientific | 943616 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200056 | |
| Vortex | DLAB Scientific Co., Ltd | MX-S | |
| Zetasizer Nano ZS90 | Malvern Instrument |
Referencias
- Chabner, B. A., Roberts, T. G. Chemotherapy and the war on cancer. Nature Reviews Cancer. 5 (1), 65-72 (2005).
- Monsuez, J. -. J., Charniot, J. -. C., Vignat, N., Artigou, J. -. Y. Cardiac side-effects of cancer chemotherapy. International Journal of Cardiology. 144 (1), 3-15 (2010).
- Floyd, J., Mirza, I., Sachs, B., Perry, M. C. Hepatotoxicity of chemotherapy. Seminars in Oncology. 33 (1), 50-67 (2006).
- Bar-Joseph, H., Stemmer, S. M., Tsarfaty, I., Shalgi, R., Ben-Aharon, I. Chemotherapy-induced vascular toxicity-real-time in vivo imaging of vessel impairment. Journal of Visualized Experiments. (95), e51650 (2015).
- Denny, W. A. Prodrug strategies in cancer therapy. European Journal of Medicinal Chemistry. 36 (7-8), 577-595 (2001).
- Kastrati, I., Delgado-Rivera, L., Georgieva, G., Thatcher, G. R. J., Frasor, J. Synthesis and characterization of an aspirin-fumarate prodrug that inhibits NFκB activity and breast cancer stem cells. Journal of Visualized Experiments. (119), e54798 (2017).
- Mao, J., et al. A simple dual-pH responsive prodrug-based polymeric micelles for drug delivery. ACS Applied Materials & Interfaces. 8 (27), 17109-17117 (2016).
- Li, S. -. Y., et al. A pH-responsive prodrug for real-time drug release monitoring and targeted cancer therapy. Chemical Communications. 50 (80), 11852-11855 (2014).
- Andresen, T. L., Thompson, D. H., Kaasgaard, T. Enzyme-triggered nanomedicine: Drug release strategies in cancer therapy (Invited Review). Molecular Membrane Biology. 27 (7), 353-363 (2010).
- Xu, G., McLeod, H. L. Strategies for enzyme/prodrug cancer therapy. Clinical Cancer Research. 7 (11), 3314-3324 (2001).
- Luo, W., et al. Dual-targeted and pH-sensitive doxorubicin prodrug-microbubble complex with ultrasound for tumor treatment. Theranostics. 7 (2), 452 (2017).
- Gao, J., et al. Ultrasound triggered phase-change nanodroplets for doxorubicin prodrug delivery and ultrasound diagnosis: An in vitro study. Colloids and Surfaces B: Biointerfaces. 174, 416-425 (2019).
- Brade, A. M., Szmitko, P., Ngo, D., Liu, F. -. F., Klamut, H. J. Heat-directed suicide gene therapy for breast cancer. Cancer Gene Therapy. 10 (4), 294-301 (2003).
- Long, K., et al. One-photon red light-triggered disassembly of small-molecule nanoparticles for drug delivery. Journal of Nanobiotechnology. 19 (1), 357 (2021).
- Liu, Y., Long, K., Kang, W., Wang, T., Wang, W. Optochemical control of immune checkpoint blockade via light-triggered PD-L1 dimerization. Advanced NanoBiomed Research. 2 (6), 2200017 (2022).
- Wang, T., et al. Optochemical control of mTOR signaling and mTOR-dependent autophagy. ACS Pharmacology & Translational Science. 5 (3), 149-155 (2022).
- Abet, V., Filace, F., Recio, J., Alvarez-Builla, J., Burgos, C. Prodrug approach: An overview of recent cases. European Journal of Medicinal Chemistry. 127, 810-827 (2017).
- Li, G., et al. Small-molecule prodrug nanoassemblies: an emerging nanoplatform for anticancer drug delivery. Small. 17 (52), 2101460 (2021).
- Shamay, Y., et al. Quantitative self-assembly prediction yields targeted nanomedicines. Nature Materials. 17 (4), 361-368 (2018).
- Sinoway, P. A., Callen, J. P. Chlorambucil. Arthritis & Rheumatism. 36 (3), 319-324 (1993).
- Owen, W. R., Stewart, P. J. Kinetics and mechanism of chlorambucil hydrolysis. Journal of Pharmaceutical Sciences. 68 (8), 992-996 (1979).
- Lv, W., et al. Upconversion-like photolysis of BODIPY-based prodrugs via a one-photon process. Journal of the American Chemical Society. 141 (44), 17482-17486 (2019).
- Silver, J. Let us teach proper thin layer chromatography technique. Journal of Chemical Education. 97 (12), 4217-4219 (2020).
- Saad, W. S., Prud'homme, R. K. Principles of nanoparticle formation by flash nanoprecipitation. Nano Today. 11 (2), 212-227 (2016).
- Long, K., et al. Photoresponsive prodrug-dye nanoassembly for in-situ monitorable cancer therapy. Bioengineering & Translational Medicine. 7 (3), 10311 (2022).
- Zhong, T., et al. A self-assembling nanomedicine of conjugated linoleic acid-paclitaxel conjugate (CLA-PTX) with higher drug loading and carrier-free characteristic. Scientific Reports. 6 (1), 36614 (2016).
- Long, K., et al. Green light-triggered intraocular drug release for intravenous chemotherapy of retinoblastoma. Advanced Science. 8 (20), 2101754 (2021).
- Lv, W., Wang, W. One-photon upconversion-like photolysis: a new strategy to achieve long-wavelength light-excitable photolysis. Synlett. 31 (12), 1129-1134 (2020).
- Rwei, A. Y., Wang, W., Kohane, D. S. Photoresponsive nanoparticles for drug delivery. Nano Today. 10 (4), 451-467 (2015).
- Grzelczak, M., Vermant, J., Furst, E. M., Liz-Marzán, L. M. Directed self-assembly of nanoparticles. ACS Nano. 4 (7), 3591-3605 (2010).
- Gnanasammandhan, M. K., Idris, N. M., Bansal, A., Huang, K., Zhang, Y. Near-IR photoactivation using mesoporous silica-coated NaYF4:Yb,Er/Tm upconversion nanoparticles. Nature Protocols. 11 (4), 688-713 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados