Method Article
نموذج عضوي دماغي بشري لزراعة الخلايا العصبية
In This Article
Summary
هنا ، نصف بروتوكولا لزرع وتتبع الخلايا العصبية الموسومة في عضويات دماغية بشرية.
Abstract
يتطلب تقدم مناهج زراعة الخلايا أنظمة نموذجية تسمح بإجراء تقييم دقيق للفعالية الوظيفية للخلايا المزروعة. بالنسبة للجهاز العصبي المركزي ، على الرغم من أن زراعة الأعضاء الخارجية لا تزال على أحدث طراز ، فإن مثل هذه النماذج تمثل تحديا تقنيا ومحدودة الإنتاجية ومكلفة. علاوة على ذلك ، فإن الإشارات البيئية الموجودة لا تتفاعل تماما مع الخلايا البشرية. تقدم هذه الورقة نموذجا غير مكلف ويمكن الوصول إليه ومتوافق مع الإنتاجية العالية لزرع وتتبع الخلايا العصبية البشرية في عضويات دماغية بشرية. يمكن توليد هذه الكائنات العضوية بسهولة من الخلايا الجذعية متعددة القدرات التي يسببها الإنسان باستخدام مجموعات تجارية وتحتوي على أنواع الخلايا الرئيسية للمخ.
نوضح أولا بروتوكول الزرع هذا من خلال حقن الخلايا السلفية العصبية البشرية المشتقة من iPSC (NPCs) التي تحمل علامة EGFP في هذه الكائنات العضوية. نناقش بعد ذلك اعتبارات تتبع نمو هذه الخلايا في العضو العضوي بواسطة الفحص المجهري الفلوري للخلايا الحية ونوضح تتبع NPCs المزروعة التي تحمل علامة EGFP في عضو عضوي على مدار 4 أشهر. أخيرا ، نقدم بروتوكولا للتقسيم ، وتلطيخ المناعة الفلورية الدورية ، وتصوير الخلايا المزروعة في سياقها المحلي. يسمح نموذج زرع الأعضاء المعروض هنا بالتتبع طويل الأجل (4 أشهر على الأقل) للخلايا البشرية المزروعة مباشرة في بيئة دقيقة بشرية ببروتوكول غير مكلف وسهل التنفيذ. وبالتالي ، فإنه يمثل نموذجا مفيدا لكل من علاجات الخلايا العصبية (عمليات الزرع) ، وعلى الأرجح ، لنمذجة أورام الجهاز العصبي المركزي (CNS) بطريقة أكثر دقة من الناحية المجهرية.
Introduction
الدماغ البشري هو عضو معقد يتكون من أنواع متعددة من الخلايا من السلالات العصبية والدبقية. معا ، تشكل هذه شبكة متطورة تؤدي إلى الإدراك. هناك اهتمام كبير بزرع الخلايا في هذا النظام كعلاج لمجموعة واسعة من الاضطرابات العصبية ، بما في ذلك إصابات الدماغ الرضحية (TBI) 1،2 ، والاضطرابات التنكسية العصبية3،4،5،6،7 ، والسكتة الدماغية8. ومع ذلك ، فإن أحد القيود الرئيسية في تطوير مثل هذه الاستراتيجيات هو الندرة النسبية للنماذج قبل السريرية المتاحة لتحديد نتائج الزرع المتوقعة. النماذج الأكثر استخداما حاليا هي طرق الزراعة في المختبر لتحديد إمكانات الخلية وزرع الأجانب في الفئران. في حين أن طرق زراعة الخلايا يمكن أن تقيم التمايز وإمكانات التجديد الذاتي9 ، يتم إجراؤها في ظل ظروف النمو المثلى التي لا تحاكي البيئة المكروية التي قد تواجهها الخلايا في سياق الزرع. علاوة على ذلك ، فإن الطريقة التي تنمو بها الخلايا يمكن أن تؤثر على سلوكها10.
تحتوي أدمغة الفئران على جميع خلايا البيئة المكروية ، وبالتالي فهي أنظمة نموذجية قوية للغاية للزرع11. ومع ذلك ، هناك اختلافات مهمة بين الفأر والقشرة البشرية12,13 ، ولا تتفاعل جميع عوامل النمو بين الأنواع. تعد نماذج الرئيسيات بديلا أقرب يحاكي النظام البشري بشكل أفضل وقد أسفرت أيضا عن نتائج مهمة قبل السريرية14. حتى هؤلاء الأقارب الأكثر ارتباطا ، ومع ذلك ، يحتفظون باختلافات مهمة في تركيبتهم الخلوية15. في حين أن كلا النظامين النموذجيين يوفران رؤى قيمة حول سلوك الخلية أثناء الزرع ويدمجان العناصر الجراحية للعلاج النهائي ، إلا أنهما يظلان غير كاملين. كما أنها مكلفة وصعبة من الناحية الفنية (أي أنه يجب على المرء إجراء جراحة دماغية على) ، مما يحد من الإنتاجية المحتملة. علاوة على ذلك ، هناك عدد كبير من القضايا الأخلاقية المرتبطة بزرع خلايا الدماغ البشري في16. تسمح مزارع شرائح الدماغ بقطع دماغ واحد واستخدامه في علاجات متعددة ، وبالتالي إزالة بعض قيود عمليات زرع. ومع ذلك ، فإن هذه لها أعمار محدودة (أسابيع) ، ولا تزال مشتقة من ، و (كونها شريحة رقيقة) ليس لديها حجم / سلامة سطح كافية لتقليد حقن الخلايا17. وبالتالي ، لا تزال هناك فجوة مهمة بين زراعة الخلايا / النماذج المحتملة بدقة وزرع الأعضاء في الجسم الحي.
العضويات الدماغية هي نموذج في المختبر يحتوي على أنواع الخلايا العصبية الرئيسية الموجودة في الدماغ ويمكن توليدها بأعداد كبيرة من الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (iPSCs)18,19. وبالتالي ، توفر هذه الكائنات العضوية سياقا خلويا ، مما قد يسمح بتقييم القدرة الوظيفية لخلية الاختبار ذات الأهمية في إعداد الزرع. في الواقع ، أظهرت دراسة حديثة أن الخلايا السلفية العصبية (NPCs) المزروعة في عضويات دماغية بشرية تعيش وتتكاثر وتتمايز بشكل مشابه ل NPCs المزروعة في دماغ فأر السكري المصاب بالسمنة المفرطة20. وبالتالي ، تمثل الكائنات العضوية الدماغية نظاما خاليا من القسوة وطويل العمر (>6 أشهر) وفعالا من حيث التكلفة يلتقط أنواع خلايا الدماغ البشري. على هذا النحو ، يمكن أن يمثلوا متلقيا مثاليا لعملية زرع لاختبار المرحلة المبكرة للقدرة التجديدية للخلايا العصبية.
تقدم هذه الورقة بروتوكولا للزرع والتتبع اللاحق ل NPCs البشرية الموسومة في عضويات دماغية بشرية (الشكل 1). يبدأ هذا بحقن NPCs المسمى GFP في عضويات دماغية ناضجة (2-4 أشهر)18. ثم يتبع الخلايا المزروعة الفحص المجهري الفلوري للخلايا الحية على مدى 4 أشهر. خلال هذا الوقت ، نظهر كلا من استمرار الخلايا في موقع الحقن ولكن أيضا الهجرة إلى المناطق البعيدة من العضوي. في نقطة النهاية ، نوضح استرجاع المستضد وتلطيخه وتصويره للأقسام النسيجية المشتقة من هذه الكائنات العضوية ، بما في ذلك بروتوكول لتبريد الأصباغ الحالية القائمة على AlexaFluor للسماح بجولات تلطيخ وتصوير إضافية ، بناء على العمل السابق21. وبالتالي ، يمكن أن يكون هذا البروتوكول مفيدا في قياس قدرة تمايز الخلايا في بيئة الزرع ، ومتانة الكسب غير المشروع ، وتوسع الخلايا في الموقع ، وهجرة الخلايا من موقع الزرع. نتوقع أن يكون هذا مفيدا لكل من تطبيقات الطب التجديدي / العلاج بالخلايا ، وكذلك نمذجة الورم عن طريق دمج الخلايا السرطانية في عضويات ذات صلة خاصة بالمنطقة.
Protocol
ملاحظة: راجع جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والكواشف والمعدات المستخدمة في هذا البروتوكول.
1. وضع العلامات الفلورية للخلايا عن طريق نقل الفيروسات العدسية
- قم بإذابة حصة من مصفوفة الغشاء القاعدي القابلة للذوبان المفضلة على الجليد.
- أثناء ذوبان القسمة ، أضف الماء المعقم لملء الفجوات بين الآبار في صفيحة 24 بئرا ، إلى جانب جميع الآبار الخارجية.
ملاحظة: هذا يترك ثمانية آبار مفتوحة في المنتصف للاستخدام ويضمن بقاء الخلايا في رطوبة عالية ، وبالتالي تقليل التباين الناجم عن التبخر. - قم بتخفيف مصفوفة الغشاء القاعدي القابل للذوبان 1: 100 في وسط DMEM / F12 المثلج البارد (تم الحصول على تركيز نهائي قدره 0.089 مجم / مل مع الكمية المستخدمة هنا).
- أضف 300 ميكرولتر من مصفوفة الغشاء القاعدي القابل للذوبان المخفف إلى أحد الآبار الوسطى (المفتوحة) للوحة 24 بئرا المحضرة لكل إصابة يتم إجراؤها. تأكد من تغطية قاع البئر بالكامل بالتساوي ، وإضافة المزيد ، إذا لزم الأمر ، لضمان طلاء متساو.
- احتضن اللوحة لمدة 30 دقيقة عند 37 درجة مئوية للسماح للطبقة بالتصلب على طول قاع البئر. تحقق في نهاية هذه الحضانة من أن السائل لا يزال يغطي قاع البئر بالكامل ولم يتبخر في المركز. التبخر هو علامة على أن الرطوبة منخفضة للغاية ؛ إذا حدث هذا ، كرر الطلاء.
ملاحظة: يمكن طلاء الألواح في المساء السابق وتركها في مصفوفة غشاء قاعدي مخفف قابل للذوبان دون آثار سيئة واضحة ؛ ومع ذلك ، يزداد خطر التبخر بشكل كبير ، لذلك يجب فحصها بعناية قبل الاستخدام. - قم بإزالة الوسط من بئر واحد من NPCs المشتقة من iPSC المتقاربة التي تنمو في صفيحة بئر.
ملاحظة: بالنسبة لهذه الورقة ، تم استخدام السلف العصبي المشتق من iPSC الذي تم إنتاجه باستخدام مجموعة تجارية وفقا لتعليمات الشركة المصنعة بين المقطع 3 والممر 10. - أضف 1 مل من PBS برفق إلى جانب البئر ، وقم بهز اللوحة لضمان الغسيل المتساوي.
- قم بإزالة PBS ، واستبدله ب 300 ميكرولتر من مزيج الإنزيم المحلل للبروتين والكولاجينو ، مع هز اللوحة مرة أخرى لضمان تغطية قاع البئر بالكامل. احتضان لمدة 5 دقائق على 37 درجة مئوية. تحقق من أن الخلايا تنفصل عن سطح اللوحة بواسطة المجهر الضوئي.
- باستخدام ماصة P1,000 ، أضف 700 ميكرولتر من DMEM / F12 ، وافصل الخلايا عن طريق رش هذا الخليط عبر جميع أسطح الجزء السفلي من اللوحة. ماصة لأعلى ولأسفل لضمان تقسيم مجاميع الخلايا إلى تعليق موحد أحادي الخلية. تناول الخلايا ، وأضف إلى 9 مل من وسط DMEM / F12 في أنبوب مخروطي 15 مل.
- أجهزة الطرد المركزي في 300 × غرام لمدة 5 دقائق.
- خلال هذا الوقت ، قم بإعداد ما يكفي من الوسط المكمل ب 10 ميكرومتر Y-27632 مقابل 500 ميكرولتر لكل بئر ليتم طلاءه ، بالإضافة إلى 1 مل للتعليق.
ملاحظة: Y-27632 ضروري لضمان بقاء عالية من NPCs بعد المرور كخلايا مفردة. - قم بإزالة المادة الطافية ، وأعد تعليق الخلايا في 1 مل من الوسط المكمل ب Y-27632 ، وقم بالسحب لأعلى ولأسفل برفق عدة مرات لتفتيت مجاميع الخلايا.
- أخرج بضعة ميكرولترات من الخلايا ، وقم بتخفيفها (1: 5 إلى 1:10) باللون الأزرق المثقب.
- عد الخلايا القابلة للحياة (التريبان الأزرق السلبي) على مقياس الدم. اضبط تخفيف التريبان الأزرق للحصول على 50 خلية قابلة للحياة على الأقل لكل ربع من مقياس الدم لضمان دقة العد. احسب حجم تعليق الخلية اللازم لوجود 100000 خلية في كل بئر.
- امزج الخلايا برفق لأعلى ولأسفل عن طريق السحب ، وشغل الحجم المحسوب (ل 100000 خلية لكل بئر). أضف هذا إلى الوسط المكمل Y-27632 (من الخطوة 1.11) بحيث يكون الحجم النهائي 500 ميكرولتر لكل بئر يتم طلائه.
- قم بإزالة مصفوفة الغشاء القاعدي المخفف القابل للذوبان من الآبار المطلية مسبقا (بافتراض اكتمال الحضانة لمدة 30 دقيقة أو أكثر).
- امزج الخلايا برفق عن طريق السحب ، وأضف 500 ميكرولتر من تعليق الخلية إلى كل بئر.
- لتوزيع الخلايا بالتساوي ، حرك اللوحة في حركة علامة "+" كبيرة مع عمليات مسح خطية لطيفة (للأمام والخلف ، والتوقف ، والخلف للأمام) مباشرة قبل وضعها في حاضنة زراعة الخلايا.
- احتضان بين عشية وضحاها (16-24 ساعة) في 37 درجة مئوية و 5 ٪ CO2.
- قم بإزالة الوسط وإضافة فيروس العدس المعاير. إذا كانت أحداث التكامل الفردية مطلوبة ، فاستهدف تعدد العدوى بمقدار 0.3 وحدة معدية لكل خلية (معايرة بشكل مثالي على الخلايا ذات الاهتمام) ، وقم بزيادة تصل إلى 500 ميكرولتر في الوسط (بدون Y-27632).
ملاحظة: يمكن شراء الفيروس العدسي محل الاهتمام معايرا مسبقا أو إنتاجه داخليا كما حدث سابقا22. هنا ، تم استخدام فيروس عدسي GFP منتج داخليا مع مقاومة البوروميسين لتوليد واختيار الشخصيات غير القابلة للعب التي تعبر عن EGFP. إذا لم تتم معايرة الفيروس العدسي على الخلايا ذات الأهمية وكان رقم النسخة حرجا ، فمن المستحسن إضافة عدة مجلدات إلى بئرين وأن يتم استخدام البئر الذي يحتوي على ~ 30٪ EGFP + خلايا 48-72 ساعة لاحقا. إذا لم يكن رقم النسخة حرجا ، فيمكن إضافة الفيروس الزائد مع التحذير من أن الطفرات الإدراجية قد تؤدي إلى سلوك شاذ في بعض المستنسخة. تنبيه: النواقل الفيروسية هي خطر بيولوجي من المستوى 2-3 (اعتمادا على محتوياتها). اتبع لوائح السلامة البيولوجية المحلية للتعامل مع فيروس العدس ، وإزالة التلوث من الأسطح والأواني البلاستيكية ، والنفايات السائلة. - أعد الخلايا إلى الحاضنة ، واحتضنها لمدة 24 ساعة عند 37 درجة مئوية و 5٪ CO2.
- إزالة الخلايا من الحاضنة ، وإزالة طاف.
تنبيه: نظرا لأن المادة الطافية من الخلايا لا تزال تحتوي على جزيئات عدسية في هذه المرحلة ، استمر في اتباع لوائح السلامة البيولوجية المحلية للتعامل معها والتخلص منها. - شطف الخلايا مع 2 × 500 ميكرولتر من PBS عن طريق إضافة PBS بلطف إلى جدار البئر ؛ ثم أخرجه من زاوية البئر لإزالة أي فيروس عدسي متبقي.
تنبيه: نظرا لأن المادة الطافية من الخلايا لا تزال تحتوي على جزيئات عدسية في هذه المرحلة ، استمر في اتباع لوائح السلامة البيولوجية المحلية للتعامل معها والتخلص منها. - قم بالتغيير إلى 500 ميكرولتر من الوسط الطازج (بدون Y-27632) ، واستمر في النمو عند 37 درجة مئوية و 5٪ CO2 بين عشية وضحاها.
- استخدم الفحص المجهري الفلوري للخلايا الحية للتحقق من نسبة الخلايا التي تعبر عن EGFP واختيار البئر الذي يجب المضي قدما فيه.
- إذا كان الناقل الفيروسي العدسي المفضل يحتوي على شريط انتقاء (جين مقاوم للمضادات الحيوية مثل مقاومة البوروميسين) ، أضف عامل الاختيار (هنا ، 1 ميكروغرام / مل بوروميسين) إلى الوسط بجرعة تم التحقق من صحتها مسبقا تقتل الخلايا الحساسة ولكن غير المقاومة. خلاف ذلك ، استخدم فرز الخلايا المنشط بالفلورة لعزل خلايا EGFP + في وقت الانقسام الأول.
- من الآن فصاعدا ، حافظ على الخلايا مع المراقبة اليومية للالتقاء ، وقم بإجراء تغييرات متوسطة كاملة يوميا.
- عند الوصول إلى نقطة التقاء ، قم بإعداد بئر واحد أو أكثر من صفيحة جديدة مطلية ب 6 آبار (مع 1 مل من مصفوفة الغشاء القاعدي المخفف القابل للذوبان ؛ انظر الخطوات 1.3-1.5) ، وحصاد الخلايا كما هو موضح في الخطوات 1.6-1.15.
ملاحظة: إذا لم يتم تضمين عامل تحديد ، فقم بفرز الخلايا حسب قياس التدفق الخلوي في هذه المرحلة. تأكد من فرز الخلايا بفوهة واسعة بما فيه الكفاية وضغط منخفض لتقليل الضغط ، بالإضافة إلى تضمين 10 ميكرومتر Y-27632 في كل خطوة في عملية الفرز. - قم بطلاء الخلايا بكثافة نهائية تبلغ 200000 خلية / سم2.
- الحفاظ على المراقبة اليومية وإكمال التغييرات المتوسطة يوميا.
ملاحظة: عندما تصل الخلايا مرة أخرى إلى نقطة التقاء ، تكون الآن جاهزة للاستخدام. بدلا من ذلك ، يمكن الآن تجميد المخزون للاستخدام في المستقبل على النحو التالي. - قم بتقسيم الخلايا وحصادها وعدها كما هو موضح في الخطوات من 1.6 إلى 1.15.
- قم بتسمية مجموعة من cryovials مسبقا بالمعلومات ذات الصلة (على سبيل المثال ، المرور ، EGFP ٪ ، الخط).
- أعد التعليق عند 400000 خلية / مل في المتوسط + 10٪ DMSO.
ملاحظة: DMSO سامة للخلايا عندما لا يتم تجميدها ، لذلك قلل الوقت الذي تقضيه في درجة حرارة الغرفة في وجود DMSO. - أضف 1 مل (400000 خلية) من الخليط من الخطوة 1.33 لكل cryovial ، وضعها في وعاء تجميد الخلايا.
- انقل الحاوية إلى فريزر -80 درجة مئوية طوال الليل.
- في اليوم التالي ، انقل الخلايا إلى نيتروجين سائل للتخزين طويل الأجل.
2. حقن الخلايا المسمى في الدماغ العضوي
ملاحظة: بالنسبة لهذه الورقة ، تم إنتاج المواد العضوية الدماغية باستخدام مجموعة تجارية وفقا لتعليمات الشركة المصنعة. يمكن استبدال هذا مع العضوية الدماغية من الاهتمام. يجب تبريد المواد المستخدمة في هذا الجزء من البروتوكول لتجنب تبلور مصفوفة الغشاء القاعدي القابل للذوبان عند أعلى من 4 درجات مئوية.
- ضع محاقن (محاقن) الأنسولين والنصائح والأنابيب التي ستكون على اتصال بمصفوفة الغشاء القاعدي القابل للذوبان عند -20 درجة مئوية للسماح لها بالتبريد.
- قم بإذابة حصة مناسبة الحجم من مصفوفة الغشاء القاعدي القابلة للذوبان على الجليد اعتمادا على عدد الحقن التي سيتم إجراؤها (~ 2 ميكرولتر / حقن). يستغرق هذا حوالي 30 دقيقة.
- أثناء إذابة القسمة ، قم بتقسيم الخلايا وحصادها وعدها كما هو موضح في الخطوات 1.6-1.15.
- احسب الأحجام اللازمة لكل حقنة. في حالة إجراء حقن متعددة ، ضع الحجم الكلي للخلايا في أنبوب سعة 1.5 مل ، وأضف ما يصل إلى 1 مل من DMEM / F12.
ملاحظة: يجب استخدام وحدة تخزين تسمح ببعض الحقن الإضافية لحساب الخسائر / أخطاء الماصة. - ضع الخلايا في الثلج أثناء إعداد الخطوات التالية.
- بعد الذوبان ، قم بتخفيف مصفوفة الغشاء القاعدي القابل للذوبان إلى تركيز نهائي قدره 3 مجم / مل في DMEM / F12 المثلج البارد.
- خذ المعلق أحادي الخلية من الجليد ، وقم بتدويره لأسفل عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية.
ملاحظة: في حالة عدم توفر جهاز طرد مركزي مبرد ، يبدو أن الدوران في درجة حرارة الغرفة مقبول بشكل عام. - قم بإزالة الوسط برفق تماما دون إزعاج حبيبات الخلية. أعد تعليق حبيبات الخلية عن طريق السحب اللطيف في مصفوفة الغشاء القاعدي المخفف القابل للذوبان (3 مجم / مل) للحصول على حجم نهائي قدره 2 ميكرولتر لكل حقنة يتم إجراؤها ، ثم ضعها على الفور مرة أخرى على الثلج حتى الاستخدام.
ملاحظة: يجب إجراء إعادة تعليق الخلايا ببطء وبأطراف مبردة مسبقا لتجنب تكوين الفقاعات والهلام. - انقل المحاقن المبردة مسبقا من الفريزر -20 درجة مئوية إلى دلو ثلج. احتفظ بها هناك حتى الاستخدام.
- إزالة لوحة مع عضويات الدماغ من الحاضنة. استخدم طرفا عريض التجويف لنقل العضو العضوي المراد حقنه في طبق 35 مم. قم بإزالة كل الوسائط الممكنة دون إتلاف العضو العضوي لتثبيته وتسهيل الحقن.
ملاحظة: من المهم استخدام أطراف عريضة التجويف لتجنب تدمير العضو العضوي. إذا لم تكن متوفرة ، فقم بقص نهاية طرف P1,000 العادي بمقص معقم. - ضع الطبق مقاس 35 مم الذي يحتوي على العضو العضوي تحت مجهر تشريح للمساعدة في توجيه وتسهيل الحقن.
ملاحظة: إذا لم يكن المجهر التشريحي متاحا في منطقة معقمة ، فمن الممكن إجراء الحقن بدون واحد ، وإن كان ذلك مع تحكم منخفض إلى حد ما. بديل آخر هو استخدام حلقة التكبير أو النظارات. - بمجرد أن يصبح العنصر (العناصر) العضوية جاهزا للحقن ، أعد تعليق الخلايا برفق بطرف ماصة P20 مبرد ، وانقل 2 ميكرولتر (يحتوي على العدد المطلوب من الخلايا المراد حقنها) على شريحة زجاجية معقمة مبردة.
ملاحظة: بالنسبة للحقن المتعددة ، يمكن إضافة أحجام إضافية 2 ميكرولتر عبر الشريحة الزجاجية. احتفظ بها على الجليد ، واحرص على تجنب التبخر. - خذ حقنة أنسولين مبردة مسبقا من الثلج ، واسحب ببطء 2 ميكرولتر من معلق الخلية مع توجيه شطبة الإبرة لأسفل للسماح بامتصاص جميع الخلايا / الوسط.
ملاحظة: تأكد من السير ببطء شديد لتجنب السحب في أي هواء. - افتح غطاء الطبق الذي يحتوي على العضو العضوي ، وركز المجهر عليه. امسك الطبق بيد واحدة. ضع شطبة الإبرة لأعلى ، ومن ناحية أخرى ، قم بحقن الخلايا ببطء في السطح العضوي.
ملاحظة: من المهم الحقن ببطء لتجنب إتلاف الأنسجة. - بعد الحقن ، ضع الغطاء مرة أخرى في الطبق ، واترك العضو المحقون لمدة 1-2 دقيقة.
ملاحظة: هذا يسمح لمصفوفة الغشاء القاعدي المخفف القابل للذوبان بالهلام ، مع تثبيت الخلايا في مكانها. إذا تمت إضافة الوسط في وقت مبكر جدا ، فيمكنه غسل الخلايا الموجودة على السطح. - أضف برفق 500 ميكرولتر من الوسط العضوي ، وانقل العضو العضوي بطرف عريض التجويف إلى بئر من صفيحة 24 بئرا. احتضان العضو العضوي عند 37 درجة مئوية و 5٪ CO2 بين عشية وضحاها. قم بإجراء تغييرات متوسطة كاملة كل يومين.
ملاحظة: من المهم تضمين عضوي للتحكم السلبي (حقن وهمي) ، والذي سيتم استخدامه لتعديلات التصوير. للقيام بذلك ، قم بحقن عضوي كما هو موضح سابقا بمصفوفة غشاء قاعدي مخففة قابلة للذوبان (3 مجم / مل) للحصول على حجم نهائي يبلغ 2 ميكرولتر بدون خلايا.
3. تتبع الكسب غير المشروع عن طريق التصوير الفلوري للخلايا الحية
ملاحظة: استخدم مجهرا مضانا يمكنه إثارة الفلوروفور محل الاهتمام ويحتوي على مجموعة المرشحات اللازمة للكشف عن مضانه. كما ذكرنا من قبل ، كانت NPCs المستخدمة هنا هي EGFP + ، مع ذروة إثارة تبلغ 488 نانومتر وذروة انبعاث تبلغ ~ 510 نانومتر.
- قم بتحميل عضوي للتحكم السلبي (غير محقون أو حقن وهمي) ، واضبط شدة الإضاءة ووقت التعرض بحيث يكون التألق الذاتي ضئيلا. بالنسبة للأداة المستخدمة هنا ، تم ضبط شدة الإضاءة بين 1 و 2 ووقت التعرض بين 80 مللي ثانية و 100 مللي ثانية.
ملاحظة: نظرا لأن العديد من الأطوال الموجية للإثارة (خاصة الأطوال الموجية المنخفضة) يمكن أن تكون سامة للخلايا ، فمن المستحسن الحفاظ على الشدة منخفضة وتجنب البحث لفترة طويلة لمنع تلف العضو العضوي. - قم بتحميل عنصر التحكم العضوي الإيجابي ، وارفع وقت التعرض إذا لزم الأمر للتأكد من أن الخلايا المصنفة مرئية بوضوح. أعد وضع العضو العضوي بطرف ماصة عريض التجويف للعثور على موقع الحقن (منطقة EGFP + ).
- قم بإزالة الوسط تماما من عضوي التحكم السلبي. قم بتحميل عنصر التحكم السلبي العضوي ، وقم بتصويره بالإعدادات المحددة (بالنسبة للأداة المستخدمة هنا ، تم ضبط شدة الإضاءة بين 1 و 2 ووقت التعرض بين 80 مللي ثانية و 100 مللي ثانية). عند اكتمال التصوير ، أضف على الفور وسيطا جديدا لمنع العضو العضوي من الجفاف.
ملاحظة: تعد الإزالة المتوسطة أمرا بالغ الأهمية للحصول على صورة جيدة لأنها تحدد ارتفاع واتجاه الكائنات العضوية ، والتي تطفو وتتحرك باستمرار ، مما يحول دون التصوير عالي الجودة. - كرر الإزالة / التصوير المتوسط مع كل من عضويات الاختبار.
- أعد الكائنات العضوية إلى الحضانة الطبيعية / التغييرات المتوسطة (كما في الخطوة 2.16) ، وكرر التصوير على الفترات المطلوبة. هنا ، تم تصوير المواد العضوية في الأسبوع 1 والأسبوع 9 والأسبوع 16 بعد الحقن لمتابعة واختبار بقاء وانتشار وتمايز وهجرة EGFP + NPCs المحقونة.
4. الأنسجة والتألق المناعي
- عند نقطة النهاية ، انقل العضو العضوي إلى شريط نسيجي يحمل معرف العضو العضوي والمعرفات الضرورية الأخرى.
- املأ الكاسيت بنسبة 10٪ فورمالين وأغلقه. احتفظ بها في درجة حرارة الغرفة لمدة 24 ساعة.
- انقل الكاسيت المغلق مع العضو العضوي إلى عملية الأنسجة ، واضبط البروتوكول التالي: الإيثانول 70٪ 10 دقيقة ، الإيثانول 80٪ 20 دقيقة ، الإيثانول 95٪ 30 دقيقة ، الإيثانول 100٪ 30 دقيقة ، الإيثانول 100٪ 40 دقيقة ، الإيثانول 100٪ 50 دقيقة ، التولوين 30 دقيقة ، التولوين 40 دقيقة ، التولوين 50 دقيقة ، البارافين 25 دقيقة عند 59 درجة مئوية ، البارافين 35 دقيقة عند 59 درجة مئوية ، البارافين 40 دقيقة عند 59 درجة مئوية ، البارافين 50 دقيقة عند 59 درجة مئوية.
ملاحظة: تتم الخطوات المذكورة أعلاه تحت فراغ في درجة حرارة الغرفة ما لم ينص على خلاف ذلك. يستبدل هذا البروتوكول الماء بتدرجات من الكحول تصل إلى 100٪. الخطوة الوسيطة مع التولوين هي الانتقال بين الكحول والبارافين ، حيث أن كلاهما قابل للذوبان فيه. تنبيه: يعتبر التولوين والبارافين من المواد الخطرة حيث يمكن أن يكونا سوائل شديدة الاشتعال ويمكن أن يتسببان في تلف عن طريق الاستنشاق أو ملامسة الجلد أو العينين. تأكد من تخزينها مغلقة بإحكام في مكان آمن. ارتد معدات الحماية الشخصية المناسبة عند التعامل معها. تخلص من النفايات وفقا للوائح المخاطر الكيميائية المحلية. - انقل الكاسيت المغلق مع العضو العضوي إلى حمام البارافين في محطة التضمين.
- خذ الكاسيت من الحمام وافتحه وانقل العضو العضوي إلى قالب قاعدة فولاذية. ضع القالب تحت موزع البارافين ، وقم بتغطيته بالكامل بالبارافين.
- ضع الكاسيت الفارغ أعلى قالب القاعدة الفولاذية. هنا ، أضف المزيد من البارافين أعلى الكاسيت.
- انقل قالب القاعدة الفولاذية مع وضع الكاسيت في الأعلى إلى ثلج ، واتركه يبرد لمدة 5 دقائق. قم بإزالة القالب الفولاذي ، واحتفظ بالكاسيت مع العضو العضوي المضمن في كتلة البارافين.
- انقل الكاسيت إلى ميكروتوم لقطع الأقسام. قطع المقاطع حسب الرغبة.
ملاحظة: هنا ، تم عمل مقاطع بسمك 15 ميكرومتر في جميع أنحاء العضو العضوي. - قم بإسقاط كل قسم على سطح حمام مائي على درجة حرارة 45 درجة مئوية ، والتقطه على شريحة مجهر زجاجي.
- اترك الشرائح تجف في حاضنة عند 42 درجة مئوية طوال الليل.
ملاحظة: يمكن الآن تخزين الشرائح في درجة حرارة الغرفة حتى وقت تلطيخها. - ضع الشريحة في برطمان تلطيخ شرائح كوبلين مملوء بالتولوين لمدة 2 دقيقة. كرر هذه الخطوة مرة أخرى.
تنبيه: يعتبر التولوين مادة خطرة لأنه يمكن أن يكون سائلا شديد الاشتعال ويمكن أن يسبب أضرارا عن طريق الاستنشاق أو ملامسة الجلد أو العينين. تأكد من تخزينه مغلقا بإحكام في مكان آمن. ارتد معدات الحماية الشخصية المناسبة عند التعامل معها. تخلص من النفايات وفقا للوائح المخاطر الكيميائية المحلية. - نقل إلى الزجاج كوبلين الشريحة تلطيخ جرة مليئة EtOH 100٪ لمدة 2 دقيقة. كرر هذه الخطوة مرة أخرى.
- نقل إلى الزجاج كوبلين الشريحة تلطيخ جرة مليئة بالماء المقطر لمدة 2 دقيقة. كرر هذه الخطوة مرة أخرى.
- لاسترجاع المستضد ، قم بإعداد محلول سيترات (10 مللي متر حامض الستريك ، 0.05٪ توين 20 ، درجة الحموضة 6.0).
ملاحظة: يمكن تخزين المخزن المؤقت للسيترات في درجة حرارة الغرفة لمدة تصل إلى 3 أشهر أو عند 4 درجات مئوية لتخزين أطول. - اضبط حماما مائيا بين 95 درجة مئوية و 100 درجة مئوية.
تنبيه: يمكن أن يسبب هذا الحمام المائي حروقا إذا لم يكن المرء حذرا. اتخاذ جميع الاحتياطات اللازمة لتجنب الاتصال المباشر مع الحمام أو مكوناته. - في الحمام المائي ، قم بتعويم حاوية بلاستيكية يمكن أن تناسب الشرائح بالداخل. تأكد من أن البلاستيك لا يلمس قاع الحمام (على افتراض أنه حمام تسخين سفلي) لتجنب الذوبان. صب المخزن المؤقت للسيترات داخل الحاوية البلاستيكية ، واتركه يصل إلى 95-100 درجة مئوية.
- بمجرد وصول المخزن المؤقت إلى درجة الحرارة المطلوبة ، ضع الشرائح داخل المخزن المؤقت ، وقم بتغطية الحاوية بشكل غير محكم بغطاء. اترك الشرائح داخل الحاوية في حمام مائي لمدة 30-40 دقيقة.
- أخرج الحاوية البلاستيكية من الحمام المائي واتركها تبرد في درجة حرارة الغرفة لمدة 20 دقيقة أخرى.
- اغسل الشرائح لمدة 3 × 2 دقيقة باستخدام PBS. قم بإزالة PBS بمنديل ورقي دون لمس العينة أو الإفراط في تجفيفها.
- تحضير المخزن المؤقت للنفاذية (90 مل من PBS + 0.1٪ Tween-20) ، وملء جرة تلطيخ الشريحة الزجاجية معها. اغمر الشرائح في المخزن المؤقت للنفاذية ، واحتضانها لمدة 10 دقائق.
- اغسل الشرائح لمدة 3 × 2 دقيقة باستخدام PBS.
- تحضير ما يكفي من مزيج تلطيخ لتغطية كل عينة (~ 25 ميكرولتر).
ملاحظة: انظر الجدول 1 لمعرفة الأجسام المضادة والتركيزات النهائية المستخدمة هنا. - أضف 25 ميكرولتر من مزيج التلوين لتغطية كل شريحة عضوية. احتضان في درجة حرارة الغرفة لمدة 1 ساعة أو بين عشية وضحاها في 4 درجة مئوية في الظلام.
ملاحظة: تأكد من بقاء العينات في رطوبة عالية لمنع تبخر مزيج التلطيخ. إذا لم تتوفر حاوية للحفاظ على رطوبة الشرائح ، فضعها داخل صندوق به بعض المناديل المبللة في الزاوية. - اغسل الشرائح لمدة 3 × 2 دقيقة باستخدام PBS.
- شطف مرة واحدة بالماء المقطر داخل جرة تلطيخ الشريحة الزجاجية لإزالة الملح.
- أضف 10 ميكرولتر من مركب السائل + 4 '، 6-دياميدينو -2-فينيليندول (DAPI) إلى كل عينة.
ملاحظة: يمكن إغلاق الشرائح إذا لم يتم إجراء جولة ثانية من التلطيخ. هنا ، لم يتم تغطية الشرائح للسماح بالوصول إلى التبريد / إعادة التلطيخ لأن إزالة الغطاء يمكن أن تلحق الضرر بالأنسجة. - صور الشرائح باستخدام المجهر الفلوري المحدد.
ملاحظة: تأكد من وجود عناصر تحكم إيجابية وسلبية لكل جسم مضاد للسماح بالإعداد المناسب للشدة وأوقات التعرض (بالنسبة للأداة المستخدمة هنا ، تم ضبط شدة الإضاءة بين 5 و 6 ووقت التعرض بين 2000 مللي ثانية و 3000 مللي ثانية) ، على الرغم من أن هذا يمكن أن يختلف اعتمادا على الجسم المضاد. بالإضافة إلى ذلك ، تأكد من أن المجهر يحتوي على كاشفات كافية لكل قناة مستخدمة. اعلم أنه نظرا لعدم تغطية العينات ، يجب وضعها ووجهها لأعلى أثناء تصويرها. - بعد التصوير ، قم بإعداد مخزن مؤقت جديد للتبريد 2x (9٪ H2O2 + 50 mM NaOH في PBS).
ملاحظة: يجب تحضير محلول التبريد طازجا قبل استخدامه مباشرة. التفاعل حساس لنشاط H2O2 ، والذي سينخفض بمرور الوقت. تنبيه: H2O2 مهيج ، وهيدروكسيد الصوديوم مادة كاوية. يجب معالجتها بمعدات السلامة المناسبة ، ويجب تجنب ملامسة الجلد. تأكد من التخلص منها وفقا لسياسات السلامة الكيميائية المحلية. - املأ جرة تلطيخ الشريحة الزجاجية Coplin في منتصف الطريق بمخزن مؤقت للتبريد 2x (45 مل) ، وأضف 45 مل PBS ، وضع الشرائح بالداخل. احتضان بين عشية وضحاها في 4 درجة مئوية.
- تحقق بواسطة المجهر الفلوري من أن الفلوروفورات قد تم إخمادها بشكل فعال.
- كرر التلوين والتصوير على النحو الوارد أعلاه.
ملاحظة: يمكن تكرار التبريد وإعادة التلطيخ لجولات إضافية حسب الحاجة ، على الرغم من أن خطر التلف يزداد مع كل جولة إضافية.
5. تسجيل الصورة
- افتح فيجي.
- قم بإنشاء مجلد يحتوي على صور DAPI من الجولة 1 والجولة 2. قم بتغيير الأسماء لتوضيح أيهما ، إذا لزم الأمر.
- قم بعمل مجلد فارغ لإخراج تسجيل الصورة.
- انقر فوق الإضافات | التسجيل | تسجيل شرائح المكدس الظاهري.
- ضمن الدليل المصدر، حدد المجلد الذي يحتوي على صور DAPI من كل جولة.
- ضمن دليل الإخراج ، حدد المجلد الذي تم إنشاؤه لإخراج التسجيل.
- اضبط نموذج استخراج الميزة على جامد والقائمة المنسدلة نموذج التسجيل على جامد - ترجمة + تدوير لإصلاح التسجيل ، مما يسمح فقط بنقل الصورة وتدويرها للمحاذاة بدلا من تشويهها.
ملاحظة: في حالة توقع حدوث تشوه ، يمكن تعديل نموذج استخراج الميزة ونموذج التسجيل إلى Affine أو نماذج أخرى حسب الرغبة ، على الرغم من أن هذا قد يؤدي إلى تحويلات غير مرغوب فيها. في بعض الأحيان قد تتلف شريحة بين الجولات ، مما قد يمنع التسجيل الناجح. - حدد مربع حفظ التحويلات لحفظ معلمات التحويل ، مما يسمح بتطبيقها على القنوات الأخرى.
- انقر فوق موافق.
- حدد الموقع لحفظ ملف التحويل (الإعدادات الافتراضية لدليل الإدخال) ، وانقر فوق فتح.
- حدد صورة DAPI لتكون بمثابة مرجع للتحويلات. ستتم محاذاة صورة DAPI من كل جولة من الجولات الأخرى مع هذه الصورة.
ملاحظة: عند الانتهاء، ستظهر الصور المسجلة كمكدس (وفي مجلد الإخراج). - استخدم شريط التمرير في الأسفل للقلب ذهابا وإيابا بين الصور للتحقق من نجاح تسجيل الصورة (توجد النوى في نفس المكان في كلتا الصورتين ، على الأقل للمناطق المتداخلة).
- تحقق من إنشاء ملف .xml لكل جولة من الصور المدخلة.
ملاحظة: تحتوي هذه على معلمات الترجمة اللازمة للملفات من تلك الجولة. - قم بإنشاء مجلد يحتوي على جميع الصور المراد تسجيلها (كل قناة من كل جولة). لاحظ ترتيب الملفات.
- قم بإنشاء مجلد لمعلمات التحويل ، وقم بعمل نسخة واحدة من ملف .xml لكل جولة لكل قناة ليتم تسجيلها. تحقق جيدا من أن ترتيب الملفات (حسب الاسم) هو نفسه بين الصور المراد تسجيلها ونسخ معلمة التحويل ، حيث ستمر الخطوة التالية وتحول كل صورة بترتيب ملفات معلمات التحويل.
- انقر فوق الإضافات | تحويل | تحويل شرائح المكدس الظاهري.
- ضمن الدليل المصدر، حدد المجلد الذي يحتوي على الصور المراد تسجيلها.
- ضمن دليل الإخراج ، حدد المجلد الذي تم إنشاؤه لإخراج التسجيل.
- ضمن دليل التحويلات، حدد المجلد الذي يحتوي على ملفات .xml بنسخة واحدة لكل ملف صورة ليتم تحويله. مرة أخرى ، تأكد من أن الترتيب يطابق الملفات (على سبيل المثال ، نسخة واحدة من الجولة 1 .xml لكل قناة جولة 1 ، نسخة واحدة من الجولة 2 .xml لكل قناة جولة 2 ، وما إلى ذلك).
- انقر فوق موافق.
ملاحظة: عند الانتهاء، ستظهر الصور المسجلة من تلك الجولة كمكدس (وفي مجلد الإخراج). - استخدم شريط التمرير في الأسفل للقلب ذهابا وإيابا بين القنوات. تحقق من تحويل جميع القنوات بنفس الطريقة. إذا لم يكن الأمر كذلك ، فمن المحتمل أن يكون هذا بسبب ملف .xml خاطئ في دليل التحويلات ؛ في هذه الحالة ، قم بإصلاح الملف وكرر.
ملاحظة: سيعتمد نطاق السطوع المعروض على قناة واحدة ، لكن هذا لا يؤثر على الصور المحفوظة الفعلية ، فقط على الشاشة. - لاحظ أن جميع الصور المسجلة تتم محاذاتها بنجاح عبر الجولات وجاهزة للتحليل المتراكب / المصب.
ملاحظة: هناك طرق برمجية أكثر كفاءة لإنجاز التسجيل للدفعات الكبيرة. الطريقة المعروضة هنا هي مجرد طريقة سهلة لا تتطلب البرمجة.
النتائج
كالتحقق من هوية العضو العضوي الدماغي ، تم تلطيخ الأقسام النسيجية للعضو الدماغي الناضج (شهرين من العمر) ل PAX6 (علامة على NPCsالظهرية 23) و SATB2 (علامة على الخلايا العصبية الناضجة ، بعد الميتوتيك ، الطبقة العليا24). كما هو متوقع ، كانت خلايا PAX6 + موجودة في الجزء الداخلي من العضو العضوي ، وكانت خلايا SATB2 + موجودة في الطبقات العليا (الشكل 2). تدعم هذه النتائج أن العضويات الدماغية المستخدمة كانت بالفعل الدماغ الأمامي الظهري كما هو محدد في مجموعة التمايز. لتأسيس الاعتماد على الجرعة لنظام زرع الأعضاء الدماغية ، تم حقن عضويات دماغية عمرها 2 شهرا بأعداد متزايدة من NPCs المشتقة من EGFP + iPSC. كان هناك اعتماد واضح على جرعة مضان GFP على رقم خلية الإدخال ، مع اكتشاف ثابت لرقعة خلية EGFP + عند 10000 خلية وما فوق (الشكل 3). تم تقييم استمرار وهجرة NPCs المزروعة بعد ذلك باتباع الكائنات العضوية المزروعة بمرور الوقت. لهذا الغرض ، تم زرع 50000 من EGFP + NPCs المشتقة من iPSC في عضويات دماغية عمرها 2-3 أشهر تم إنشاؤها من نفس خط iPSC. تم تصوير المواد العضوية والضوابط المحقونة لإيجابية EGFP في نقاط زمنية محددة خلال الأشهر 3-4 القادمة. في سلسلة الزرع هذه ، لاحظنا استمرار الموقع المحقون طوال فترة التتبع البالغة 4 أشهر (الشكل 4 أ). ظهرت بقع خلايا EGFP + إضافية لمدة 9 أيام بعد الزرع واستمرت حتى نقطة نهاية الدراسة (3-4 أشهر حسب العضو العضوي) ، مما يشير إلى هجرة الخلايا والتكامل في مواقعها الجديدة (الشكل 4 أ). عند التكبير العالي ، كان من الممكن ملاحظة التشكل العصبي الواضح مع إسقاطات طويلة في العضو العضوي (الشكل 4 ب) ، مما يؤكد تكامل الخلايا المحقونة.
لتحديد حالة تمايز الخلايا المحقونة في وقت متأخر بعد الحقن ، تم تثبيت العضو العضوي المتتبع لمدة 4 أشهر والتحكم فيه ، وتضمين البارافين ، وتقطيعه إلى شرائح بسمك 15 ميكرومتر ، وتركيبه على شرائح زجاجية. ثم تمت معالجة الشرائح وتلطيخها إما في جولة واحدة من التلوين الفلوري (EGFP ، TUJ1 ، NESTIN) أو لدورتين متتاليتين من التلوين لإضافة علامات إضافية (MAP2 ، GFAP). أكد التلوين الأولي أحادي الجولة وجود خلايا EGFP + في موقع الحقن ، بما في ذلك خليط من الخلايا التي تحتفظ بحالة NPC (NESTIN + TUJ1−) وتلك التي تمايزت نحو مصير عصبي (NESTIN−TUJ1+) (الشكل 5). بالنسبة لكل من الكائنات العضوية الضابطة والمحقونة ، لوحظ عدد قليل جدا من NESTIN + NPCs (معظمها ، وإن لم يكن جميعها عبارة عن NPCs مزروعة EGFP + في موقع الحقن) ، مع غالبية الخلايا العصبية غير الناضجة TUJ1 + (الشكل 5). أعطى التلوين المكون من جولتين مزيدا من التفاصيل ، وكشف عن الخلايا العصبية الناضجة (NESTIN −TUJ1 + MAP2 + GFAP−) حول معظم المنطقة الخارجية للعضوي ، مع مناطق الخلايا العصبية غير الناضجة (NESTIN − TUJ1 + MAP2 − GFAP −) نحو الوسط (الشكل 6A ، B). كانت الخلايا النجمية (NESTIN−TUJ1−MAP2−GFAP+) موجودة في كل من الكائنات العضوية المحقونة والتحكم وتتخللها حول الحواف الخارجية (الشكل 6 أ ، ب). أظهرت الشريحة التي تم إجراء تلطيخها من جولتين في العضو المحقون مستعمرة صغيرة تابعة لخلايا EGFP + بعيدا عن موقع الحقن الذي اعتمد النمط الظاهري للخلايا العصبية الناضجة (الشكل 6B ، C). يبدو أن بعض هذه الخلايا على مقربة من الخلايا النجمية. ومع ذلك ، لم تكن هناك خلايا EGFP + مع تداخل كامل مع تلطيخ GFAP ، مما يشير إلى أنها كانت متجاورة بدلا من توليد الخلايا النجمية نفسها (الشكل 6B ، C).
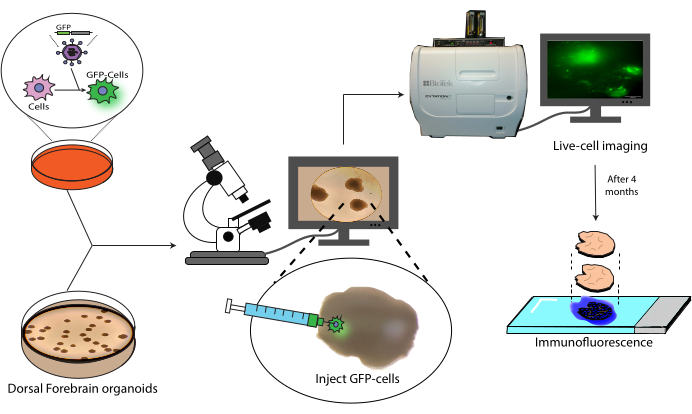
الشكل 1: نموذج زرع الخلايا الموسومة إلى عضويات دماغية. نظرة عامة تخطيطية على توليد الخلايا الموسومة عن طريق نقل الفيروسات العدسية ، وزرعها في عضويات دماغية ، وتتبعها عن طريق تصوير الخلايا الحية والتألق المناعي. اختصار: GFP = بروتين الفلورسنت الأخضر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
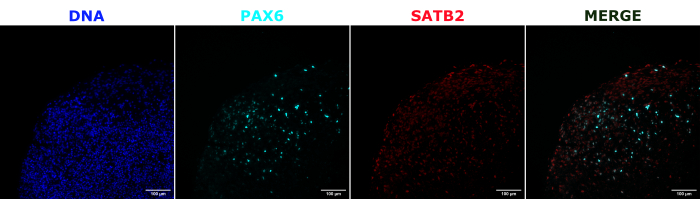
الشكل 2: التألق المناعي للمقاطع النسيجية التي توضح بنية الكائنات العضوية المبكرة والمتأخرة. تم إصلاح عضوي دماغي عمره شهرين ، ومضمن في البارافين ، وشرائح ، وملطخة ب PAX6 و SATB2 و DAPI. تم استخدام قسم غير ملوث لضبط وقت التعرض والتكامل لتجنب إشارة إيجابية كاذبة من التألق الذاتي. كانت خلايا PAX6 + موجودة في الجزء الداخلي من العضو العضوي ، بينما كانت خلايا SATB2 + موجودة في الطبقات العليا. تم التقاط صور Z-stack كل 4.2 ميكرومتر من خلال قسم الأنسجة 15 ميكرومتر بأكمله. تم دمج المقاطع البصرية باستخدام خيار تكديس التركيز في برنامج Gen5 مع الخيارات الافتراضية. قضبان المقياس = 100 ميكرومتر. الاختصارات: PAX6 = بروتين مربع 6 مقترن ؛ SATB2 = بروتين ربط تسلسلي خاص غني ب AT-rich 2 ؛ DAPI = 4 '، 6-دياميدينو -2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
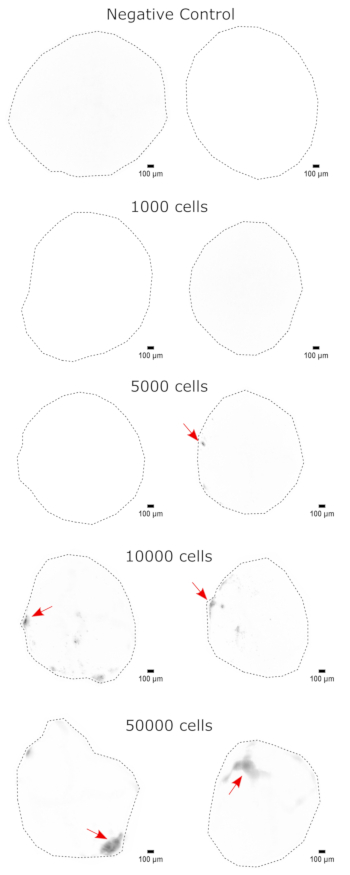
الشكل 3: النقش المعتمد على الجرعة من NPCs في عضويات دماغية. تم زرع المواد العضوية مع 0 (تحكم سلبي) أو 1,000 أو 5,000 أو 10,000 أو 50,000 GFP + iPSC مشتقة من NPCs. في 1 أسبوع بعد الزرع ، تم تصوير المواد العضوية على Cytation 5 مع مكعب مرشح GFP. تم استخدام التحكم السلبي لضبط وقت التعرض والتكامل لتقليل التألق الذاتي. تشير الألوان الداكنة إلى المزيد من مضان EGFP بالنسبة إلى التحكم السلبي. قضبان المقياس = 100 ميكرومتر. هذه هي صور 4x من المواد العضوية بأكملها. بعد التصوير ، تم إجراء طرح خلفية الكرة المتدحرجة بنصف قطر بكسل 50 قبل العرض لتصحيح شدة الخلفية المتغيرة عبر المواد العضوية. يشار إلى مواقع الحقن المحددة على أنها مناطق أعلى نقش بسهم أحمر حيث كان النقش موجودا. الاختصارات: NPCs = الخلايا السلفية العصبية. GFP = بروتين الفلورسنت الأخضر ؛ EGFP = GFP المحسن ؛ iPSC = الخلايا الجذعية المستحثة متعددة القدرات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
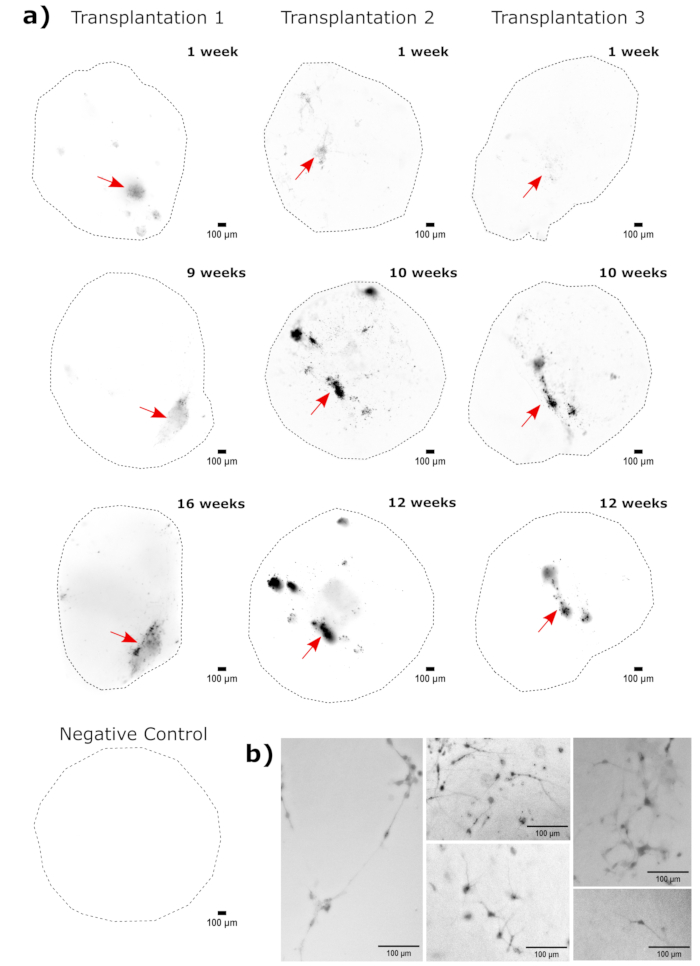
الشكل 4: تتبع نمو الخلايا المزروعة وهجرتها وثباتها باستخدام التصوير الفلوري للخلايا الحية. (أ) أعقب التحكم وزرع (50000 GFP + iPSC مشتقة من NPCs) تصوير الخلايا الحية الفلورية على مدار 2-4 أشهر من مجموعتين مستقلتين للزرع. تم استخدام عضويات التحكم السلبي لضبط وقت التعرض والتكامل لتقليل التألق الذاتي في كل نقطة زمنية. تم التقاط صور EGFP باستخدام مكعب مرشح GFP على Cytation 5 في الأوقات المحددة بعد الزرع. تشير الألوان الداكنة إلى المزيد من مضان EGFP بالنسبة إلى عنصر التحكم السلبي لتلك النقطة الزمنية. تم إجراء طرح خلفية الكرة المتدحرجة بنصف قطر بكسل 50 قبل العرض لتصحيح كثافة الخلفية المتغيرة عبر الكائنات العضوية. تم وضع الكائنات العضوية في نفس الاتجاه تقريبا في كل نقطة زمنية ، وتم تدوير الصور من أجل اتساق الشاشة وإظهار نمو الخلايا المزروعة بوضوح. يشار إلى مواقع الحقن المحددة على أنها مناطق أعلى نقش في أقرب نقطة زمنية بسهم أحمر. يظهر مثال عضوي للتحكم السلبي في الجزء السفلي من الشكل. (ب) مثال على عرض صور 20x من عضويات مطعمة في الأسبوع 1 والأسبوع 15 بعد الزرع. تم تحسين التباين المحلي قبل العرض باستخدام FIJI لضمان الرؤية العصبية. قضبان المقياس = 100 ميكرومتر. الاختصارات: NPCs = الخلايا السلفية العصبية. GFP = بروتين الفلورسنت الأخضر ؛ EGFP = GFP المحسن ؛ iPSC = الخلايا الجذعية المستحثة متعددة القدرات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
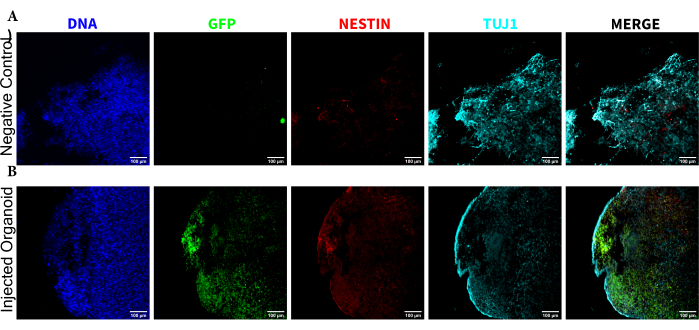
الشكل 5: التألق المناعي للأقسام النسيجية التي تكشف عن استمرار NPCs المزروعة في موقع الحقن جنبا إلى جنب مع الهجرة والتمايز العصبي. صور مضان أحادية القناة من (أ) غير محقونة و (ب) عضويات مزروعة. تظهر الصورة المتراكبة على اليمين قنوات الاهتمام الثلاث (NESTIN و TUJ1 و EGFP) ، ولكنها لا تتضمن DAPI. تم تعيين الحد الأدنى للعرض لاستبعاد الإشارة فقط من الخلايا السالبة (المحددة ل EGFP من التحكم غير المحقون وللقنوات الأخرى بناء على مجموعات العلامات المعروفة). استندت الحدود القصوى للعرض إلى أعلى إشارة لوحظت لهذا الجسم المضاد في أي خلية. تم الحفاظ على نطاقات العرض ثابتة بين المواد العضوية غير المحقونة والمزروعة للسماح بالمقارنة المباشرة. قضبان المقياس = 100 ميكرومتر. الاختصارات: NPCs = الخلايا السلفية العصبية. DAPI = 4 '، 6-دياميدينو -2-فينيليندول ؛ TUJ1 = توبولين بيتا الثالث ؛ EGFP = بروتين الفلورسنت الأخضر المحسن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
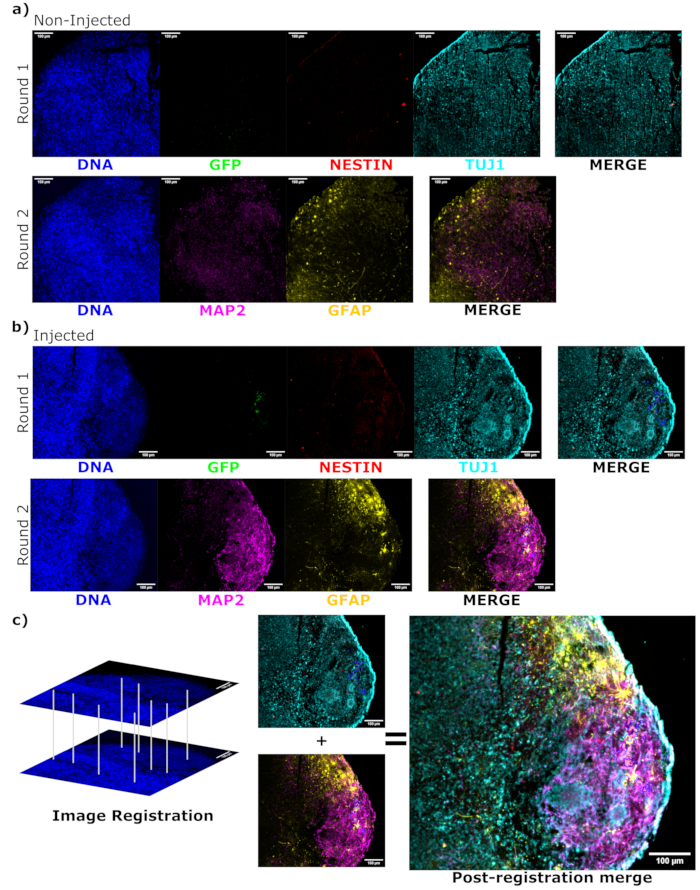
الشكل 6: تقييم حالة تمايز الخلايا المطعمة وتوطينها باستخدام التألق المناعي الدوري للأقسام النسيجية. يتم عرض صور مضان أحادية القناة من المواد العضوية غير المحقونة ، (A) المتطابقة مع العمر ، و (B) المزروعة للجولة الأولى والثانية من التلوين كما هو موضح. تم تعيين الحد الأدنى للعرض لاستبعاد الإشارة فقط من الخلايا السالبة (المحددة ل EGFP من التحكم غير المحقون وللقنوات الأخرى بناء على مجموعات العلامات المعروفة). استندت الحدود القصوى للعرض إلى أعلى إشارة لوحظت لهذا الجسم المضاد في أي خلية. تم الحفاظ على نطاقات العرض (وبالطبع معلمات التصوير) ثابتة بين التحكم والمواد العضوية المحقونة للسماح بالمقارنة المباشرة. قضبان المقياس = 100 ميكرومتر. يتم عرض صورة متراكبة (باستثناء DAPI) لكل جولة تلطيخ لكل عضوي على اليمين. (ب) بالنسبة للعضوي المحقون حيث تم تسجيل الصورة، يتم اقتصاص جميع الصور إلى المنطقة التي لوحظت في كلتا جولتي التلطيخ. (ب، ج) بالنسبة للعضوي المحقون ، يتم تحديد مناطق خلية EGFP + باللون الأزرق. يظهر رسم تخطيطي لكيفية استخدام DAPI لمطابقة الميزات أثناء تسجيل الصورة في (C) ، متبوعا بدمج شامل للصورة المسجلة. الاختصارات: DAPI = 4',6-دياميدينو-2-فينيليندول; TUJ1 = توبولين بيتا الثالث ؛ EGFP = بروتين الفلورسنت الأخضر المحسن ؛ MAP2 = البروتين المرتبط بالأنابيب الدقيقة 2 ؛ GFAP = البروتين الحمضي الليفي الدبقي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| استنساخ | فلوروفور | تركيز | |
| مضاد نستين | 10ج2 | أليكسا فلور 594 | 1 في 2,000 |
| مضاد للأنبوب3 | TUJ1 | أليكسا فلور 647 | 1 في 2,000 |
| مكافحة GFP | FM264G | أليكسا فلور 488 | 1 من كل 200 |
| مكافحة GFAP | SMI 25 | أليكسا فلور 594 | 1 من كل 500 |
| مكافحة MAP2 | SMI 52 | أليكسا فلور 488 | 1 من كل 1,000 |
| مكافحة PAX6 | O18-1330 | أليكسا فلور 647 | 1 في 100 |
| مضاد لمحركات الأقراص SATB2 | EPNCIR130A | أليكسا فلور 594 | 1 من كل 500 |
الجدول 1: تركيزات الأجسام المضادة للتلطيخ. الاختصارات: TUBB3 = بيتا توبولين III ؛ GFP = بروتين الفلورسنت الأخضر ؛ GFAP = البروتين الحمضي الليفي الدبقي ؛ MAP2 = البروتين المرتبط بالأنابيب الدقيقة 2 ؛ PAX6 = بروتين مربع 6 مقترن ؛ SATB2 = بروتين خاص مرتبط بالتسلسل الغني ب AT.
Discussion
نظرا للاهتمام الكبير بالنهج العلاجية الخلوية لعلاج إصابات الجهاز العصبي المركزي / الاضطرابات التنكسية العصبية1،2،3،4،5،6،7،8 ، تكتسب نماذج وظيفة الخلية في بيئة الزرع أهمية. تقدم هذه الورقة طريقة لزرع NPCs البشرية الموسومة في عضويات دماغية بشرية ، جنبا إلى جنب مع تتبع الخلايا الحية وتقييم نقطة النهاية عن طريق علم الأنسجة وتلطيخ المناعة. الأهم من ذلك ، أظهرنا أن الخلايا المزروعة كانت قادرة على الهجرة والتمايز والمثابرة طويلة الأجل (4 أشهر) في الإعداد العضوي. مثل هذا الثبات على المدى الطويل هو زيادة ملحوظة على قابلية الحفاظ على مزارع شريحة الدماغ17. وبالتالي ، فإن هذا النظام مناسب لفحص العديد من السلوكيات التي قد يحتاج المرء إلى تقييمها في بيئة علاجية محتملة ، مثل البقاء على قيد الحياة والانتشار والتمايز. في الواقع ، أظهرت دراسة متعامدة مؤخرا أن NPCs المزروعة تصرفت بشكل مشابه في الكائنات العضوية الدماغية مقارنة ب NPCs المزروعة في أدمغة الفئران NSG20 ، مما يؤكد فائدة المواد العضوية كمتلقي للزرع. نظرا لأن هذا نظام في المختبر ، فمن السهل أيضا إضافة السيتوكينات أو الأدوية ذات الأهمية. يمكن استخدام هذا لفهم تأثيرات بيئات معينة مثل الالتهاب ومثبطات المناعة على الخلايا المزروعة بشكل أفضل لتقليد ما قد يواجهونه في بيئة علاجية. يعمل بروتوكول التألق المناعي الدوري الذي أظهرناه (بناء على البحثالسابق 21) على توسيع قوة هذا النهج ، مما يسمح بتقييم مجموعة واسعة من العلامات الخاصة بالنسب ، وربما الخاصة بالمرض في وقت واحد في قسم واحد ، وبالتالي ، السماح بالتتبع الدقيق للخلايا المزروعة وتأثيرها على الأنسجة. بالطبع ، يمكن استخدام طرق تقييم نقطة النهاية الأخرى بدلا من ذلك اعتمادا على أهداف التحليل. على سبيل المثال ، يمكن استخدام إزالة الأنسجة مع إعادة بناء 3D إذا كان مورفولوجيا الخلية ذات أهمية أساسية ، أو يمكن استخدام التفكك متبوعا بقياس التدفق الخلوي إذا كان تحديد كمية أنواع معينة من الخلايا هو الهدف النهائي. نتوقع أن تكون هذه الطريقة قابلة للتوسيع بسهولة لأنواع الخلايا الأخرى مثل أورام الجهاز العصبي المركزي ، مما قد يسمح بدراستها في سياق ذي صلة بالبيئة الدقيقة. وبالمثل ، يمكن استبدال الكائنات العضوية المستخدمة كمتلقين بعضويات نموذج المرض25،26،27 ، مما قد يسمح بنمذجة مناهج الزرع لهذه الحالات.
كما هو الحال مع جميع النماذج ، فإن النموذج المعروض هنا له أيضا حدوده الخاصة. أولا ، الكائنات العضوية المشتقة من iPSC غير ناضجةمن الناحية التنموية 19 ، وبالتالي ، لها اختلافات مهمة مقارنة بشيخوخة الدماغ ، حيث تظهر العديد من الأمراض التنكسية العصبية. كما أن الكائنات العضوية الدماغية غير موحدة في التطور19 ، مما يحول دون الحقن المتسق في نفس المكان الفسيولوجي الدقيق. علاوة على ذلك ، في حين أنها تحتوي على أنواع الخلايا في مناطق الدماغ ذات الصلة18,19 ، فإنها تفتقر إلى المكونات البطانية والدبقية الصغيرة والمناعية ، والتي تعتبر مهمة أيضا في الإعداد في الجسم الحي 14. هذا يحد من دراسة كيفية تفاعل المضيف مع زرع الخلايا. تأتي التقنيات حاليا على الإنترنت لإضافة خلايا الأوعية الدموية28 والخلايا الدبقيةالصغيرة 29 ، وكذلك لزيادة اتساق الأعضاء والأقلمة18 ، وبالتالي تحسين قوة النمذجة لنظام زرع الأعضاء. ومع ذلك ، فإنها تتطلب مزيدا من الاختبار والتحسين بما يتجاوز ما هو معروض هنا. في حين أن هذا البروتوكول غير مكلف ولا يتطلب معدات متخصصة ، لا يزال هناك عدد من الاعتبارات الفنية المهمة - عمق الحقن ، على سبيل المثال. ويرجع ذلك إلى حقيقة أن المواد العضوية لا تتغلغل ، وبالتالي ، غالبا ما يكون لها مركز إذا نمت بشكل كبير جدا19 وأن الضوء لا يمكن أن يخترق النواة العضوية لتتبع الخلايا الحية. وبالتالي ، قد يتم تفويت الخلايا التي تم حقنها بعمق شديد والمستعمرات التي هاجرت إلى الداخل. في حين يمكن تحسين ذلك عن طريق استخدام الفلوروفورات ذات الطول الموجي الأطول مع اختراق أفضلللأنسجة 30 ، اعتمادا على حجم العضو وجهاز الكشف ، فمن المحتمل أن يظل هذا أحد الاعتبارات. أخيرا ، نظرا لأن عضويات الدماغ في حالة تطور ، فإن توقيت الزرع هو اعتبار رئيسي آخر ، حيث من المحتمل أن تختلف البيئة اعتمادا على المرحلة التنموية للعضو الذي يتم حقنه فيه. في حين أنه يمكن التحكم في هذا إلى حد ما من خلال ضمان عمر عضوي ثابت في وقت الحقن ، إلا أنه بلا شك عامل يحتاج إلى النظر فيه.
هذا البروتوكول غير مكلف وبسيط وخالي من ولا يتطلب معدات متخصصة ، مما يجعل نمذجة الزرع في متناول مجموعة متنوعة من المختبرات. مع الوتيرة السريعة للتقدم في كل من علاجات الخلايا العصبية وأنظمة النماذج العضوية ، نتوقع أن يكون بروتوكول زرع الأعضاء المقدم هنا نموذجا مفيدا لمجموعة من الأمراض والأساليب العلاجية.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم توفير الأموال لهذا العمل من خلال صناديق IRIC الخيرية من مؤسسة مارسيل وجان كوتو ومن صندوق أبحاث كيبيك - الصحة (FRQS #295647). D.J.H.F.K. لديه دعم راتب من FRQS في شكل زمالة Chercheurs-boursiers Junior 1 (# 283502). تم دعم M.I.I.R. بجائزة الدكتوراه IRIC من معهد البحوث في علم المناعة والسرطان ، وبورصة العبور accélère de la maitrise au الدكتوراه من جامعة مونتريال ، و Bourse de Mérite aux cycles supérieurs.
Materials
| Name | Company | Catalog Number | Comments |
| Accutase | StemCell Technologies | 7920 | proteolytic-collagenolytic enzyme mix |
| Alexa Fluor 488 anti-GFP Antibody | BioLegend | 338008 | |
| Alexa Fluor 488 anti-MAP2 (clone SMI 52) | BioLegend | 801804 | |
| Alexa Fluor 594 anti-GFAP Antibody (clone SMI 25) | BioLegend | 837510 | |
| Alexa Fluor 594 anti-Nestin (clone 10C2) | BioLegend | 656804 | |
| Alexa Fluor 647 anti-Tubulin β 3 (TUBB3) (clone TUJ1) | BioLegend | 801209 | |
| Citric Acid Monohydrate | Fisher Chemical | A104-500 | |
| Cytation 5 Cell Imaging Multimode Reader | Biotek | - | |
| Denaturated Ethyl Alcohol (Anhydrous) | ChapTec | - | |
| DMEM F12/Glutamax | Thermo | 10565018 | |
| Dymethil Sulfoxide (DMSO), Sterile | BioShop | DMS666.100 | |
| FIJI 1.53c | - | - | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501128-4L | |
| Gen5 | - | - | |
| HistoCore Arcadia H | Leica Biosystems | - | |
| Matrigel Growth Factor Reduced (GFR) | Corning | 356231 | Phenol Red-free, LDEV-free |
| MX35 microtome blade | Epredia | 3053835 | |
| NaOH | Sigma | 655104 | |
| PBS (-Ca -Mg) | Sigma | D8537 | |
| Puromycin Dihydrochloride | Thermo | A1113803 | |
| ROCK inhibitor Y-27632 | Abcam | ab120129 | |
| Simport Scientific Stainless-Steel Base Molds | Fisher Scientific | 22-038-209 | |
| Simport Scientific UNISETTE Biopsy Processing/Embedding Cassette | Fisher Scientific | 36-101-9255 | |
| STEMdiff Forebrain Neuron Differentiation Kit | StemCell Technologies | 8600 | |
| STEMdiff Neural Progenitor Medium | StemCell Technologies | 5833 | |
| STEMdiff SMADi Neural Induction Kit | StemCell Technologies | 8581 | |
| Thermo Scientific Shandon Finesse ME Microtome | Thermo Scientific | - | |
| Tissue Prep | Fisher Scientific | T555 | |
| Tissue-Tek VIP 6 AI Tissue Processor | Sakura Finetek | - | |
| Toluene (histological) | ChapTec | - | |
| Trypan blue; 0.4% (wt/vol) | Thermo | 15250061 | |
| Tween 20 | BioShop | TWN510.100 |
References
- Spurlock, M. S., et al. Amelioration of penetrating ballistic-like brain injury induced cognitive deficits after neuronal differentiation of transplanted human neural stem cells. Journal of Neurotrauma. 34 (11), 1981 (2017).
- Zhou, Y., Shao, A., Xu, W., Wu, H., Deng, Y. Advance of stem cell treatment for traumatic brain injury. Frontiers in Cellular Neuroscience. 13, 301 (2019).
- Hayashi, Y., Lin, H. -. T., Lee, C. -. C., Tsai, K. -. J. Effects of neural stem cell transplantation in Alzheimer's disease models. Journal of Biomedical Science. 27 (1), 29 (2020).
- Kefalopoulou, Z., et al. Long-term clinical outcome of fetal cell transplantation for Parkinson disease: Two case reports. JAMA Neurology. 71 (1), 83-87 (2014).
- Li, W., et al. Extensive graft-derived dopaminergic innervation is maintained 24 years after transplantation in the degenerating parkinsonian brain. Proceedings of the National Academy of Sciences of the United States of America. 113 (23), 6544-6549 (2016).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Takahashi, J. iPS cell-based therapy for Parkinson's disease: A Kyoto trial. Regenerative Therapy. 13, 18-22 (2020).
- Krause, M., Phan, T. G., Ma, H., Sobey, C. G., Lim, R. Cell-based therapies for stroke: Are we there yet. Frontiers in Neurology. 10, 656 (2019).
- Coles-Takabe, B. L. K., et al. Don't look: Growing clonal versus nonclonal neural stem cell colonies. Stem Cells. 26 (11), 2938-2944 (2008).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Jakel, R. J., Schneider, B. L., Svendsen, C. N. Using human neural stem cells to model neurological disease. Nature Reviews Genetics. 5 (2), 136-144 (2004).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Li, J., et al. Conservation and divergence of vulnerability and responses to stressors between human and mouse astrocytes. Nature Communications. 12 (1), 3958 (2021).
- Morizane, A., et al. MHC matching improves engraftment of iPSC-derived neurons in non-human primates. Nature Communications. 8 (1), 385 (2017).
- Khrameeva, E., et al. Single-cell-resolution transcriptome map of human, chimpanzee, bonobo, and macaque brains. Genome Research. 30 (5), 776-789 (2020).
- Powell, K. Hybrid brains: The ethics of transplanting human neurons into animals. Nature. 608 (7921), 22-25 (2022).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- García-Delgado, A. B., et al. Brain organoids to evaluate cellular therapies. Animals. 12 (22), (2022).
- Lin, J. -. R., Fallahi-Sichani, M., Sorger, P. K. Highly multiplexed imaging of single cells using a high-throughput cyclic immunofluorescence method. Nature Communications. 6 (1), 8390 (2015).
- Knapp, D. J. H. F., et al. Single-cell analysis identifies a CD33+ subset of human cord blood cells with high regenerative potential. Nature Cell Biology. 20 (6), 710-720 (2018).
- Georgala, P. A., Carr, C. B., Price, D. J. The role of Pax6 in forebrain development. Developmental Neurobiology. 71 (8), 690-709 (2011).
- Britanova, O., et al. Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex. Neuron. 57 (3), 378-392 (2008).
- Kim, H., et al. Modeling G2019S-LRRK2 sporadic Parkinson's disease in 3D midbrain organoids. Stem Cell Reports. 12 (3), 518-531 (2019).
- Smits, L. M., et al. Modeling Parkinson's disease in midbrain-like organoids. NPJ Parkinson's Disease. 5, 5 (2019).
- Jin, M., et al. Type-I-interferon signaling drives microglial dysfunction and senescence in human iPSC models of Down syndrome and Alzheimer's disease. Cell Stem Cell. 29 (7), 1135.e8-1153.e8 (2022).
- Sun, X. -. Y., et al. Generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, e76707 (2022).
- Popova, G., et al. Human microglia states are conserved across experimental models and regulate neural stem cell responses in chimeric organoids. Cell Stem Cell. 28 (12), 2153.e6-2166.e6 (2021).
- Wang, S., Li, B., Zhang, F. Molecular fluorophores for deep-tissue bioimaging. ACS Central Science. 6 (8), 1302-1316 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved