Method Article
מודל אורגנואיד מוחי אנושי להשתלת תאים עצביים
In This Article
Summary
במאמר זה אנו מתארים פרוטוקול להשתלה ולמעקב אחר תאים עצביים מסומנים באורגנואידים מוחיים אנושיים.
Abstract
התקדמות גישות השתלת תאים דורשת מערכות מודל המאפשרות הערכה מדויקת של העוצמה התפקודית של התאים המושתלים. עבור מערכת העצבים המרכזית, למרות שהשתלת קסנו נותרה חדישה, מודלים כאלה הם מאתגרים מבחינה טכנית, מוגבלים בתפוקה ויקרים. יתר על כן, האותות הסביבתיים הנוכחיים אינם מגיבים באופן מושלם עם תאים אנושיים. מאמר זה מציג מודל זול, נגיש ותואם תפוקה גבוהה להשתלה ומעקב אחר תאים עצביים אנושיים באורגנואידים מוחיים אנושיים. אורגנואידים אלה יכולים להיווצר בקלות מתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם באמצעות ערכות מסחריות ומכילים את סוגי תאי המפתח של המוח.
אנו מדגימים לראשונה את פרוטוקול ההשתלה הזה עם הזרקת תאי אב עצביים אנושיים שמקורם ב-EGFP (NPCs) לתוך אורגנואידים אלה. לאחר מכן נדון בשיקולים למעקב אחר גדילתם של תאים אלה באורגנואיד באמצעות מיקרוסקופ פלואורסצנטי של תאים חיים, ונדגים את המעקב אחר NPCs מושתלים המסומנים ב-EGFP באורגנואיד במשך תקופה של 4 חודשים. לבסוף, אנו מציגים פרוטוקול לחתך, צביעה אימונופלואורסצנטית מחזורית והדמיה של התאים המושתלים בהקשר המקומי שלהם. מודל השתלת האורגנואידים המוצג כאן מאפשר מעקב ארוך טווח (לפחות 4 חודשים) אחר תאים אנושיים מושתלים ישירות במיקרו-סביבה אנושית עם פרוטוקול זול ופשוט לביצוע. זה, אם כן, מייצג מודל שימושי הן עבור טיפולים בתאים עצביים (השתלות) וככל הנראה, עבור מודלים של גידולים במערכת העצבים המרכזית (CNS) באופן מדויק יותר מבחינה מיקרו-סביבתית.
Introduction
המוח האנושי הוא איבר מורכב המורכב מסוגי תאים מרובים של השושלות העצביות והגלייה. יחד, אלה יוצרים רשת מתוחכמת המולידה קוגניציה. יש עניין משמעותי בהשתלת תאים במערכת זו כטיפול במגוון רחב של הפרעות נוירולוגיות, כולל פגיעה מוחית טראומטית (TBI)1,2, הפרעות נוירודגנרטיביות 3,4,5,6,7 ושבץ8. עם זאת, מגבלה מרכזית אחת בקידום אסטרטגיות כאלה היא המיעוט היחסי של מודלים פרה-קליניים זמינים לקביעת תוצאות ההשתלה הצפויות. המודלים הנפוצים ביותר כיום הם שיטות תרבית חוץ גופית כדי לקבוע פוטנציאל תאים והשתלת קסנו בעכברים. בעוד ששיטות תרבית תאים יכולות להעריך התמיינות ופוטנציאל התחדשות עצמית9, אלה מבוצעות בתנאי גידול אופטימליים שאינם מחקים את המיקרו-סביבה שהתאים היו פוגשים בהקשר של השתלה. יתר על כן, האופן שבו התאים גדלים יכול להשפיע על התנהגותם10.
מוחות עכברים מכילים את כל תאי המיקרו-סביבה ולכן הם מערכות מודל חזקות ביותר להשתלה11. עם זאת, ישנם הבדלים חשובים בין העכבר לקליפת המוח האנושית12,13, ולא כל גורמי הגדילה מגיבים בין המינים. מודלים של פרימטים הם חלופה קרובה יותר המחקה טוב יותר את המערכת האנושית וגם הניבו תוצאות פרה-קליניות חשובות14. עם זאת, אפילו קרובי משפחה קרובים יותר אלה שומרים על הבדלים חשובים בהרכב התאי שלהם15. בעוד ששתי מערכות מודל אלה מספקות תובנות חשובות על התנהגות התא במהלך ההשתלה ומשלבות את האלמנטים הכירורגיים של טיפול בסופו של דבר, הן נותרות לא מושלמות. הם גם יקרים ומאתגרים מבחינה טכנית (כלומר, יש לבצע ניתוחי מוח בבעלי החיים), ובכך מגבילים את התפוקה האפשרית. יתר על כן, יש שפע של סוגיות אתיות הקשורות להשתלת תאי מוח אנושיים בבעלי חיים16 . תרביות פרוסות מוח מאפשרות לחתוך מוח אחד ולהשתמש בו לטיפולים מרובים, ובכך להסיר חלק מהמגבלות של השתלות בעלי חיים; עם זאת, אלה יש תוחלת חיים מוגבלת (שבועות), הם עדיין נגזר מן החי, (להיות פרוסה דקה) אין מספיק נפח / שלמות פני השטח כדי לחקות את הזרקת תאים17. לפיכך, נותר פער חשוב בין תרביות תאים בלבד / מודלים פוטנציאליים לבין השתלת in vivo.
אורגנואידים מוחיים הם מודל במבחנה המכיל את סוגי התאים העצביים העיקריים הקיימים במוח וניתן לייצר אותם במספרים גבוהים מתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (iPSCs)18,19. אורגנואידים כאלה מספקים אפוא הקשר תאי, שיכול לאפשר להעריך את היכולת התפקודית של תא בדיקה בעל עניין בסביבת ההשתלה. ואכן, מחקר שנערך לאחרונה הראה כי תאי אב עצביים (NPCs) המושתלים באורגנואידים מוחיים אנושיים שורדים, מתרבים ומתמיינים באופן דומה ל- NPCs המושתלים במוחו של עכבר n סוכרתי על מנתיתר המשולב gamma (NSG)20. אורגנואידים מוחיים מייצגים אפוא מערכת נטולת אכזריות, מאריכת חיים (>6 חודשים), חסכונית הלוכדת את סוגי התאים במוח האנושי. ככאלה, הם יכולים לייצג מושתל אידיאלי לבדיקה בשלב מוקדם של יכולת ההתחדשות של תאים עצביים.
מאמר זה מציג פרוטוקול להשתלה ולמעקב אחר NPCs אנושיים מתויגים באורגנואידים מוחיים אנושיים (איור 1). זה מתחיל עם הזרקת NPCs המסומנים GFP לתוך אורגנואידים מוחיים בוגרים (2-4 חודשים)18. התאים המושתלים מלווים במיקרוסקופ פלואורסצנטי של תאים חיים במשך תקופה של 4 חודשים. במהלך הזמן הזה, אנו מראים גם את ההתמדה של תאים באתר ההזרקה, אבל גם הגירה לאזורים דיסטליים של האורגנואיד. בנקודת הקצה, אנו מדגימים את השליפה, הצביעה וההדמיה של מקטעים היסטולוגיים הנגזרים מאורגנואידים אלה, כולל פרוטוקול למרווה של צבעים קיימים מבוססי AlexaFluor כדי לאפשר סבבי צביעה והדמיה נוספים, בהתבסס על עבודה קודמת21. פרוטוקול זה יכול, אם כן, להיות שימושי במדידת יכולת ההתמיינות של תאים בסביבת השתלה, עמידות השתל, הרחבת תאים באתרם ונדידת תאים מאתר ההשתלה. אנו צופים כי זה יהיה שימושי הן עבור רפואה רגנרטיבית / יישומי תרפיה תאית, כמו גם מודלים הגידול על ידי השתלת תאים סרטניים לתוך אורגנואידים ספציפיים לאזור הרלוונטי.
Protocol
הערה: עיין בטבלת החומרים לקבלת פרטים הקשורים לכל החומרים, הריאגנטים והציוד המשמשים בפרוטוקול זה.
1. תיוג פלואורופור של תאים על ידי התמרה lentiviral
- הפשירו אליקוט של מטריצת קרום המרתף המסיסה, לפי בחירתכם, על קרח.
- בזמן שהאליקוט מפשיר, מוסיפים מים סטריליים כדי למלא את הרווחים בין הבארות בצלחת של 24 בארות, יחד עם כל הבארות החיצוניות.
הערה: זה משאיר שמונה בארות פתוחות באמצע לשימוש ומבטיח שהתאים יישארו בלחות גבוהה, ובכך ממזער את השונות הנגרמת על ידי אידוי. - לדלל את מטריצת קרום המרתף המסיס 1:100 בתווך DMEM/F12 קר כקרח (ריכוז סופי של 0.089 מ"ג/מ"ל התקבל עם המגרש המשמש כאן).
- הוסף 300 μL של מטריצת קרום מרתף מדולל מסיס לאחת הבארות האמצעיות (הפתוחות) של צלחת 24 בארות מוכן לכל זיהום להתבצע. הקפידו לכסות באופן שווה את כל תחתית הבאר, והוסיפו עוד, במידת הצורך, כדי להבטיח ציפוי אחיד.
- דוגרים על הצלחת במשך 30 דקות בטמפרטורה של 37°C כדי לאפשר לשכבה להתמצק לאורך קרקעית הבאר. ודא בסוף הדגירה כי הנוזל עדיין מכסה במלואו את קרקעית הבאר ולא התאדה במרכז. אידוי הוא סימן לכך שהלחות נמוכה מדי; במקרה כזה, חזרו על הציפוי.
הערה: ניתן לצפות את הלוחות בערב הקודם ולהשאיר אותם במטריצת קרום מרתף מדוללת ומסיסה ללא תופעות לוואי ניכרות; עם זאת, הסיכון של אידוי גדל מאוד, ולכן הם חייבים להיבדק בקפידה לפני השימוש. - הסר את התווך מבאר אחת של NPCs שמקורם ב- iPSC הגדלים בצלחת באר.
הערה: במאמר זה נעשה שימוש באבות עצביים שמקורם ב-iPSC שיוצרו באמצעות ערכה מסחרית בהתאם להוראות היצרן בין מעבר 3 למעבר 10. - הוסיפו בעדינות 1 מ"ל PBS לצד הבאר, ונענעו את הצלחת כדי להבטיח שטיפה אחידה.
- הסר את PBS, והחלף עם 300 μL של תערובת אנזימים proteolytic-collagenolytic, שוב נדנד את הצלחת כדי להבטיח ציפוי מלא של קרקעית הבאר. יש לדגור במשך 5 דקות בטמפרטורה של 37°C. ודא שהתאים מתנתקים מפני השטח של הצלחת באמצעות מיקרוסקופ אור.
- עם פיפטה P1,000, הוסף 700 μL של DMEM/F12, ונתק את התאים על ידי ריסוס תערובת זו על כל המשטחים של תחתית הצלחת. פיפטה למעלה ולמטה כדי להבטיח שאגרגטי התאים מפורקים לתרחיף אחיד של תא יחיד. קח את התאים, ולהוסיף 9 מ"ל של מדיום DMEM/F12 בצינור חרוטי 15 מ"ל.
- צנטריפוגה ב 300 × גרם במשך 5 דקות.
- במהלך תקופה זו, להכין מספיק בינוני בתוספת 10 מיקרומטר Y-27632 עבור 500 μL לכל באר להיות מצופה, בתוספת 1 מ"ל עבור השעיה.
הערה: Y-27632 נחוץ כדי להבטיח הישרדות גבוהה של NPCs לאחר המעבר כתאים בודדים. - הסר את supernatant, ו resuspend את התאים ב 1 מ"ל של תווך תוספת Y-27632, pipeting למעלה ולמטה בעדינות מספר פעמים כדי לשבור את צברי התא.
- הוציאו כמה מיקרוליטרים של תאים, ודללו אותם (1:5 עד 1:10) בכחול טריפאן.
- לספור את התאים קיימא (טריפאן כחול-שלילי) על המוציטומטר. התאימו את הדילול הכחול של טריפאן כדי לקבל לפחות 50 תאים בני קיימא לכל רביע של ההמוציטומטר כדי להבטיח שהספירה מדויקת. חשב את נפח תרחיף התאים הדרוש כדי ש-100,000 תאים יהיו נוכחים בכל באר.
- מערבבים את התאים בעדינות למעלה ולמטה על ידי פיפט, ותופסים את הנפח המחושב (עבור 100,000 תאים לבאר). הוסף זאת למדיום בתוספת Y-27632 (משלב 1.11) כך שהנפח הסופי הוא 500 μL לכל באר שיש לצפות.
- הסר את מטריצת קרום המרתף המדוללת והמסיסה מהבארות שצופו קודם לכן (בהנחה שהדגירה של 30 דקות או יותר הושלמה).
- מערבבים את התאים בעדינות על ידי פיפטינג, ומוסיפים 500 μL של תרחיף התא לכל באר.
- כדי לפזר את התאים באופן שווה, הזיזו את הצלחת בתנועת סימן "+" גדולה עם טאטוא ליניארי עדין (קדימה-אחורה, עצירה, אחורה-קדימה) מיד לפני הכניסה לאינקובטור תרבית תאים.
- יש לדגור למשך הלילה (16-24 שעות) בטמפרטורה של 37°C ו-5% CO2.
- הסר את המדיום, ולהוסיף את lentivirus titrated. אם נדרשים אירועי אינטגרציה בודדים, יש לשאוף לריבוי זיהומים של 0.3 יחידות זיהומיות לכל תא (רצוי לטיטרציה על התאים המעניינים), ולהגיע עד 500 μL בתווך (ללא Y-27632).
הערה: את lentivirus של עניין ניתן לרכוש מראש titrated או מיוצר בבית כפי שנעשה בעבר22. כאן, GFP lentivirus המיוצר בתוך הבית עם עמידות puromycin שימש כדי ליצור ולבחור NPCs המבטאים EGFP. אם הלנטיוירוס לא עבר טיטרציה על התאים המעניינים ומספר העותק הוא קריטי, מומלץ להוסיף מספר כרכים לכמה בארות ולהשתמש בבאר עם ~30% תאי EGFP+ 48-72 שעות מאוחר יותר. אם מספר העותק אינו קריטי, ניתן להוסיף עודף וירוס עם אזהרה כי מוטגנזה החדרה עלולה לגרום להתנהגות חריגה בחלק מהשיבוטים. זהירות: וקטורים לנטי-ויראליים הם סיכון ביולוגי ברמה 2-3 (תלוי בתכולתם). פעל בהתאם לתקנות הבטיחות הביולוגית המקומיות לטיפול בלנטיוירוס, טיהור משטחים וכלי פלסטיק ופסולת נוזלית. - להחזיר את התאים לאינקובטור, ולדגור אותם במשך 24 שעות ב 37 ° C ו 5% CO2.
- מוציאים את התאים מהאינקובטור, ומוציאים את הסופרנטנט.
זהירות: מכיוון שהסופרנאטנט מהתאים עדיין מכיל חלקיקים לנטי-ויראליים בשלב זה, המשך לעקוב אחר תקנות הבטיחות הביולוגית המקומיות לטיפול בו וסילוקו. - לשטוף את התאים עם 2 x 500 μL של PBS על ידי הוספה עדינה PBS לקיר של הבאר; לאחר מכן, הסר מפינת הבאר כדי לשטוף את כל lentivirus שנותרו.
זהירות: מכיוון שהסופרנאטנט מהתאים עדיין מכיל חלקיקים לנטי-ויראליים בשלב זה, המשך לעקוב אחר תקנות הבטיחות הביולוגית המקומיות לטיפול בו וסילוקו. - החליפו ל-500 מיקרוליטר של מדיום טרי (ללא Y-27632), והמשיכו לגדול ב-37°C וב-5% CO2 בן לילה.
- השתמש במיקרוסקופ פלואורסצנטי של תאים חיים כדי לאמת את שיעור התאים המבטאים EGFP ולבחור את הבאר שאיתה יש להמשיך.
- אם וקטור הבחירה הלנטיויראלי מכיל קלטת בחירה (גן עמידות לאנטיביוטיקה כגון עמידות לפורומיצין), הוסף את סוכן הבחירה (כאן, 1 מיקרוגרם/מ"ל פורומיצין) למדיום במינון שאומת בעבר והורג תאים רגישים אך לא עמידים. אחרת, השתמש במיון תאים המופעל על-ידי פלואורסצנטיות כדי לבודד את תאי EGFP+ בזמן הפיצול הראשון.
- מעתה ואילך, לשמור על התאים עם ניטור יומי עבור confluency, ולבצע שינויים בינוניים מלאים מדי יום.
- כאשר מגיעים למפגש, הכינו באר אחת או יותר של צלחת טרייה מצופה 6 בארות (עם 1 מ"ל של מטריצת קרום מרתף מדוללת ומסיסה; ראו שלבים 1.3-1.5), וקצרו את התאים כמתואר בשלבים 1.6-1.15.
הערה: אם לא כלול סוכן בחירה, מיין את התאים לפי ציטומטריית זרימה בשלב זה. ודא כי התאים ממוינים עם זרבובית רחבה מספיק ולחץ נמוך כדי למזער מתח, כמו גם כי 10 מיקרומטר Y-27632 כלול בכל שלב בתהליך המיון. - לוחית את התאים לצפיפות סופית של 200,000 תאים לסמ"ק2.
- לשמור על ניטור יומי ולהשלים שינויים בינוניים מדי יום.
הערה: כאשר התאים מגיעים שוב למפגש, הם מוכנים כעת לשימוש. לחלופין, כעת ניתן להקפיא מלאי לשימוש עתידי כדלקמן. - פצל, קצור וספור את התאים כמתואר בשלבים 1.6-1.15.
- תייגו מראש קבוצה של קריובלים עם המידע הרלוונטי (למשל, מעבר, EGFP%, קו).
- השהיה מחדש ב-400,000 תאים/מ"ל ב-DMSO בינוני + 10%.
הערה: DMSO רעיל לתאים כאשר אינו קפוא, לכן יש למזער את הזמן המושקע בטמפרטורת החדר בנוכחות DMSO. - הוסיפו 1 מ"ל (400,000 תאים) של התערובת משלב 1.33 לכל קריוביאלי, והניחו במיכל להקפאת תאים.
- מעבירים את המיכל למקפיא בטמפרטורה של 80°C למשך הלילה.
- למחרת, להעביר את התאים לחנקן נוזלי לאחסון לטווח ארוך.
2. הזרקת תאים מסומנים לאורגנואיד המוח
הערה: עבור נייר זה, אורגנואידים מוחיים יוצרו באמצעות ערכה מסחרית בהתאם להוראות היצרן. זה יכול להיות מוחלף עם אורגנואיד מוחי של עניין. החומרים המשמשים בחלק זה של הפרוטוקול חייבים להיות מקוררים מראש כדי למנוע את הג'לינג של מטריצת קרום המרתף המסיס מעל 4 ° C.
- הניחו את מזרקי האינסולין, הקצוות והצינורות שיהיו במגע עם מטריצת קרום המרתף המסיס בטמפרטורה של -20°C כדי לאפשר להם להתקרר.
- הפשירו אליקוט בגודל מתאים של מטריצת קרום מרתף מסיס על קרח בהתאם למספר הזריקות שיבוצעו (~ 2 μL / הזרקה). זה לוקח בערך 30 דקות.
- בזמן שהאליקוט מפשיר, מפצל, קוצר וסופר את התאים כמתואר בשלבים 1.6-1.15.
- חשב את הנפחים הדרושים לכל הזרקה. אם אתה מבצע זריקות מרובות, מקם את נפח התאים הכולל בצינור של 1.5 מ"ל, והוסף עד 1 מ"ל של DMEM/F12.
הערה: יש להשתמש בנפח המאפשר מספר זריקות נוספות כדי להסביר הפסדים/שגיאות צנרת. - הניחו את התאים בקרח בזמן הכנת השלבים הבאים.
- לאחר ההפשרה, דללו את מטריצת קרום המרתף המסיס לריכוז סופי של 3 מ"ג/מ"ל ב-DMEM/F12 קר כקרח.
- קח את המתלה התא היחיד מהקרח, וסובב אותו למטה ב 300 × גרם במשך 5 דקות ב 4 ° C.
הערה: אם צנטריפוגה בקירור אינה זמינה, סיבוב בטמפרטורת החדר נראה בדרך כלל נסבל. - הסר בעדינות את המדיום לחלוטין מבלי להפריע לכדורית התא. יש להשהות מחדש את כדורית התא על ידי צנרת עדינה במטריצת קרום המרתף המדוללת והממוססת (3 מ"ג/מ"ל) כדי לקבל נפח סופי של 2 מיקרוליטר לכל הזרקה שיש לבצע, ומיד החזירו אותה לקרח עד לשימוש.
הערה: ההשעיה של התאים צריכה להתבצע לאט עם טיפים מראש כדי למנוע היווצרות של בועות ו gelling. - מעבירים את המזרק(ים) המצוננים מהמקפיא בטמפרטורה של 20°C לתוך דלי קרח. שמור אותם שם עד לשימוש.
- מוציאים את הצלחת עם האורגנואידים במוח מהאינקובטור. השתמשו בקצה רחב כדי להעביר את האורגנואיד להזרקה לצלחת בקוטר 35 מ"מ. הסר את כל המדיום האפשרי מבלי לפגוע באורגנואיד כדי לייצב אותו ולהקל על ההזרקה.
הערה: חשוב להשתמש בקצוות רחבים כדי למנוע הרס של האורגנואיד. אם הם אינם זמינים, גזרו את קצהו של קצה P1,000 רגיל עם מספריים סטריליים. - הניחו את צלחת 35 מ"מ המכילה את האורגנואיד תחת מיקרוסקופ מנתח כדי לעזור להנחות ולהקל על ההזרקה.
הערה: אם מיקרוסקופ מנתח אינו זמין באזור סטרילי, ניתן לבצע את ההזרקה ללא אחד, אם כי עם שליטה מופחתת במקצת. חלופה נוספת היא שימוש בלולאת הגדלה או משקפיים. - ברגע שהאורגנואידים מוכנים להזרקה, יש להשהות מחדש בעדינות את התאים עם קצה פיפטה P20 מקורר, ולהעביר 2 μL (המכיל את מספר התאים הרצוי להזרקה) על מגלשת זכוכית סטרילית מצוננת.
הערה: עבור הזרקות מרובות, ניתן להוסיף נפחים נוספים של 2 μL על פני שקופית הזכוכית. שמור אותו על קרח, והיזהר למנוע אידוי. - קח מזרק אינסולין מראש מן הקרח, ולצייר לאט את 2 μL של תרחיף התא עם שיפוע של המחט פונה כלפי מטה כדי לאפשר את כל התאים / מדיום להיקלט.
הערה: הקפד ללכת לאט מאוד כדי למנוע שאיבת אוויר. - פתחו את מכסה התבשיל המכיל את האורגנואיד, ומקדו בו את המיקרוסקופ. החזיקו את המנה ביד אחת. מניחים את שיפוע המחט כלפי מעלה, וביד השנייה מזריקים את התאים באיטיות לתוך משטח האורגנואידים.
הערה: חשוב להזריק לאט כדי למנוע פגיעה ברקמה. - לאחר ההזרקה, מחזירים את המכסה לצלחת, ומניחים לאורגנואיד המוזרק לשבת למשך 1-2 דקות.
הערה: פעולה זו מאפשרת למטריצת קרום המרתף המדוללת והמסיסה לג'ל, ומחזיקה את התאים במקומם. אם מוסיפים את המדיום מוקדם מדי, הוא יכול לשטוף את התאים היושבים על פני השטח. - מוסיפים בעדינות 500 μL של תווך האורגנואידים, ומעבירים את האורגנואיד עם קצה רחב לתוך באר של צלחת 24 בארות. יש לדגור על האורגנואיד בטמפרטורה של 37°C ו-5%CO2 למשך הלילה. בצע שינויים בינוניים מלאים כל יומיים.
הערה: חשוב לכלול אורגנואיד בקרה שלילי (מוזרק דמה), אשר ישמש להתאמות הדמיה. לשם כך, הזריקו אורגנואיד כפי שתואר קודם לכן עם מטריצת קרום מרתף מדוללת ומסיסה (3 מ"ג / מ"ל) כדי לקבל נפח סופי של 2 μL ללא תאים.
3. מעקב השתל על ידי הדמיה פלואורסצנטית של תאים חיים
הערה: השתמש במיקרוסקופ פלואורסצנטי שיכול לעורר את הפלואורופור המעניין ויש לו את ערכת המסנן הדרושה כדי לזהות את הפלואורסצנטיות שלו. כפי שהוזכר קודם, NPCs בשימוש כאן היו EGFP+, עם שיא עירור של 488 ננומטר ושיא פליטה של ~ 510 ננומטר.
- טען אורגנואיד בקרה שלילי (לא מוזרק או מוזרק מדומה), והגדר את עוצמת ההארה ואת זמן החשיפה כך שהאוטופלואורסצנטיות תהיה מינימלית. עבור המכשיר המשמש כאן, עוצמת ההארה נקבעה בין 1 ל -2 וזמן החשיפה בין 80 מילישניות ל -100 מילישניות.
הערה: מכיוון שאורכי גל עירור רבים (במיוחד אורכי גל נמוכים יותר) יכולים להיות רעילים לתאים, מומלץ לשמור על עוצמה נמוכה ולהימנע מלחפש זמן רב מדי כדי למנוע נזק לאורגנואיד. - טען את אורגנואיד הבקרה החיובי, והגדל את זמן החשיפה במידת הצורך כדי להבטיח שהתאים המסומנים נראים בבירור. מקם מחדש את האורגנואיד עם קצה פיפטה רחב כדי למצוא את אתר ההזרקה (אזור EGFP+ ).
- הסר את המדיום לחלוטין מאורגנואיד הבקרה השלילי. טען את אורגנואיד הבקרה השלילי, וצלם אותו עם ההגדרות שנבחרו (עבור המכשיר המשמש כאן, עוצמת ההארה נקבעה בין 1 ל -2 וזמן החשיפה בין 80 מילישניות ל -100 אלפיות השנייה). לאחר השלמת ההדמיה, יש להוסיף מיד מדיום טרי כדי למנוע מהאורגנואיד להתייבש.
הערה: הסרה בינונית היא קריטית לקבלת תמונה טובה מכיוון שהיא מקבעת את הגובה והכיוון של האורגנואידים, שאחרת צפים ונעים כל הזמן, ומונעים הדמיה באיכות גבוהה. - חזור על ההסרה/הדמיה הבינונית עם כל אחד מאורגנואידי הבדיקה.
- החזר את האורגנואידים לשינויים נורמליים בדגירה/בינונית (כמו בשלב 2.16), וחזור על ההדמיה במרווחי הזמן הרצויים. כאן, האורגנואידים צולמו בשבוע 1, בשבוע 9 ובשבוע 16 לאחר ההזרקה כדי לעקוב ולבדוק את ההישרדות, ההתפשטות, ההתמיינות והנדידה של NPCs EGFP+ שהוזרקו.
4. היסטולוגיה ואימונופלואורסנציה
- בנקודת הקצה, העבר את האורגנואיד לקלטת היסטולוגיה המסומנת עם מזהה האורגנואיד ומזהים נחוצים אחרים.
- ממלאים את הקלטת ב-10% פורמלין וסוגרים אותה. יש לשמור אותו בטמפרטורת החדר למשך 24 שעות.
- העבר את הקלטת הסגורה עם האורגנואיד לתהליך רקמה, והגדר את הפרוטוקול הבא: אתנול 70% 10 דקות, אתנול 80% 20 דקות, אתנול 95% 30 דקות, אתנול 100% 30 דקות, אתנול 100% 30 דקות, אתנול 100% 50 דקות, טולואן 30 דקות, טולואן 40 דקות, טולואן 50 דקות, פרפין 25 דקות ב-59 מעלות צלזיוס, פרפין 35 דקות ב-59 מעלות צלזיוס, פרפין 40 דקות ב-59°C, פרפין 50 דקות ב-59°C.
הערה: השלבים לעיל נעשים תחת ואקום בטמפרטורת החדר, אלא אם צוין אחרת. פרוטוקול זה מחליף את המים בשיפועים של אלכוהול עד 100%. שלב הביניים עם טולואן הוא מעבר בין האלכוהול לפרפין, שכן שניהם מסיסים בו. זהירות: טולואן ופרפין נחשבים לחומרים מסוכנים מכיוון שהם יכולים להיות נוזלים דליקים מאוד ויכולים לגרום נזק על ידי שאיפה או מגע עם העור או העיניים. הקפידו לאחסן אותם סגורים היטב בחלל מאובטח. יש ללבוש ציוד מגן אישי מתאים בעת הטיפול בהם. יש להשליך פסולת בהתאם לתקנות הסיכון הכימי המקומיות. - מעבירים את הקלטת הסגורה עם האורגנואיד לאמבט פרפין בעמדת ההטבעה.
- מוציאים את הקלטת מהאמבטיה, פותחים אותה ומעבירים את האורגנואיד לתבנית בסיס פלדה. מניחים את התבנית מתחת למתקן הפרפין, ומכסים אותו לחלוטין בפרפין.
- מניחים את הקלטת הריקה על החלק העליון של תבנית בסיס הפלדה. כאן, להוסיף עוד פרפין על גבי הקלטת.
- מעבירים את תבנית בסיס הפלדה עם הקלטת למעלה לקרח, ומניחים לה להתקרר במשך 5 דקות. מוציאים את תבנית הפלדה, ושומרים את הקלטת עם האורגנואיד מוטבע בבלוק פרפין.
- מעבירים את הקלטת למיקרוטום כדי לחתוך חלקים. חתכו מקטעים לפי הצורך.
הערה: כאן, חלקים בעובי 15 מיקרומטר נעשו בכל האורגנואיד. - זרוק כל קטע על פני השטח של אמבט מים ב 45 מעלות צלזיוס, והרים אותו על מגלשת מיקרוסקופ זכוכית.
- תנו למגלשות להתייבש באינקובטור בטמפרטורה של 42 מעלות צלזיוס למשך הלילה.
הערה: כעת ניתן לאחסן את השקופיות בטמפרטורת החדר עד למועד הצביעה. - מניחים את המגלשה בצנצנת מכתימה של מגלשת קופלין מלאה בטולואן למשך 2 דקות. חזור על שלב זה פעם נוספת.
זהירות: טולואן נחשב לחומר מסוכן מכיוון שהוא יכול להיות נוזל דליק מאוד ויכול לגרום נזק על ידי שאיפה או מגע עם העור או העיניים. הקפידו לאחסן אותו סגור היטב בחלל מאובטח. יש ללבוש ציוד מגן אישי מתאים בעת הטיפול בו. יש להשליך פסולת בהתאם לתקנות הסיכון הכימי המקומיות. - מעבירים לצנצנת זכוכית קופלין מלאה ב-EtOH 100% למשך 2 דקות. חזור על שלב זה פעם נוספת.
- מעבירים לצנצנת זכוכית עם מגלשת קופלין מלאה במים מזוקקים למשך 2 דקות. חזור על שלב זה פעם נוספת.
- לשליפת אנטיגן, הכינו חיץ ציטראט (10 mM חומצת לימון, 0.05% Tween 20, pH 6.0).
הערה: ניתן לאחסן מאגר ציטראט בטמפרטורת החדר עד 3 חודשים או ב-4°C לאחסון ארוך יותר. - הגדר אמבט מים בין 95 °C (75 °F) ו 100 °C (75 °F).
זהירות: אמבט מים זה עלול לגרום לכוויות אם לא נזהרים. נקוט בכל אמצעי הזהירות הדרושים כדי למנוע מגע ישיר עם האמבטיה או מרכיביה. - באמבט המים, צפים מיכל פלסטיק שיכול להתאים למגלשות שבתוכו. ודאו שהפלסטיק אינו נוגע בתחתית האמבטיה (בהנחה שמדובר באמבטיה עם חימום תחתון) כדי למנוע התכה. יוצקים את חיץ ציטראט בתוך מיכל פלסטיק, ולתת לו להגיע 95-100 מעלות צלזיוס.
- ברגע שהמאגר מגיע לטמפרטורה הרצויה, הניחו את המגלשות בתוך המאגר, וכסו את המיכל באופן רופף במכסה. השאירו את המגלשות בתוך המיכל באמבט המים למשך 30-40 דקות.
- הסר את מיכל הפלסטיק מאמבט המים, ולתת לו להתקרר בטמפרטורת החדר במשך 20 דקות נוספות.
- שטפו את המגלשות במשך 3 x 2 דקות עם PBS. הסר את PBS עם ממחטת נייר מבלי לגעת בדגימה או לייבש אותה יתר על המידה.
- הכינו את חיץ החדירה (90 מ"ל של PBS + 0.1% Tween-20), ומלאו בו צנצנת מכתימה מזכוכית מגלשה. טבלו את המגלשות במאגר החדירה, ודגרו במשך 10 דקות.
- שטפו את המגלשות במשך 3 x 2 דקות עם PBS.
- הכינו מספיק תערובת כתמים כדי לכסות כל דגימה (~ 25 μL).
הערה: ראה טבלה 1 עבור הנוגדנים והריכוזים הסופיים המשמשים כאן. - הוסיפו 25 מיקרוליטר של תערובת כתמים כדי לכסות כל פרוסת אורגנואידים. יש לדגור בטמפרטורת החדר למשך שעה אחת או למשך הלילה ב-4 מעלות צלזיוס בחושך.
הערה: ודא שהדגימות נשארות בלחות גבוהה כדי למנוע אידוי של תערובת הצביעה. אם מיכל לשמירה על לחות המגלשות אינו זמין, שים אותם בתוך קופסה עם כמה רקמות רטובות בפינה. - שטפו את המגלשות במשך 3 x 2 דקות עם PBS.
- יש לשטוף פעם אחת במים מזוקקים בתוך צנצנת זכוכית עם הכתמה כדי להסיר את המלח.
- הוסף 10 μL של mountant נוזלי + 4',6-diamidino-2-phenylindole (DAPI) לכל אחת מהדגימות.
הערה: ניתן לאטום את השקופיות אם לא בוצע סבב צביעה שני. כאן, המגלשות לא כוסו כדי לאפשר גישה למרווה / שמירה מכיוון שהסרת החלקה עלולה לפגוע ברקמה. - דמיינו את השקופיות באמצעות המיקרוסקופ הפלואורסצנטי שנבחר.
הערה: יש לוודא שיש בקרות חיוביות ושליליות לכל נוגדן כדי לאפשר הגדרה נכונה של העוצמות וזמני החשיפה (עבור המכשיר המשמש כאן, עוצמת ההארה נקבעה בין 5 ל -6 וזמן החשיפה בין 2,000 מילישניות ל -3,000 מילישניות), אם כי זה יכול להשתנות בהתאם לנוגדן. בנוסף, ודא כי במיקרוסקופ יש גלאים מתאימים עבור כל ערוץ בשימוש. שימו לב שמכיוון שהדגימות אינן מכוסות, יש להניח אותן עם הפנים כלפי מעלה בזמן ההדמיה שלהן. - לאחר ההדמיה, הכינו חיץ מרווה טרי 2x (9% H2O2 + 50 mM NaOH ב- PBS).
הערה: יש להכין את פתרון המרווה טרי מיד לפני השימוש בו. התגובה רגישה לפעילות של H2O2, אשר תפחת עם הזמן. זהירות: H2O2 הוא מגרה, ו- NaOH הוא קאוסטי. אלה צריכים להיות מטופלים עם ציוד בטיחות מתאים, ויש להימנע ממגע בעור. יש לוודא שהם מושלכים בהתאם למדיניות הבטיחות הכימית המקומית. - ממלאים את צנצנת הזכוכית של קופלין באמצע הדרך עם חיץ מרווה פי 2 (45 מ"ל), מוסיפים PBS של 45 מ"ל ומכניסים את המגלשות פנימה. לדגור לילה ב 4 °C (75 °F).
- בדוק במיקרוסקופ פלואורסצנטי שהפלואורופורים היו מרווים ביעילות.
- חזור על הצביעה וההדמיה כנ"ל.
הערה: ניתן לחזור על המרווה והשמירה לסבבים נוספים לפי הצורך, אם כי הסיכון לנזק עולה עם כל סבב נוסף.
5. רישום תמונה
- פתח את פיג'י.
- צור תיקייה עם תמונות DAPI מסבב 1 וסיבוב 2. שנה את השמות כדי להבהיר איזה מהם, במידת הצורך.
- צור תיקייה ריקה לפלט של רישום התמונה.
- לחץ על תוספים | הרשמה | רשום פרוסות מחסנית וירטואליות.
- תחת ספריית מקור, בחר את התיקיה המכילה את תמונות DAPI מכל סבב.
- תחת ספריית פלט, בחר את התיקיה שנוצרה עבור פלט הרישום.
- הגדר את מודל חילוץ התכונות לקשיח ואת התפריט הנפתח מודל רישום לקשיח - תרגם+סובב כדי לתקן את ההתאמה, ואפשר להזיז ולסובב את התמונה רק ליישור ולא לעיוות.
הערה: אם צפוי עיוות, ניתן להתאים את מודל חילוץ התכונות ואת מודל הרישום ל - Affine או למודלים אחרים לפי הצורך, אם כי הדבר עלול לגרום להמרות בלתי רצויות. לעיתים עלולה להיפגע פרוסה בין הסיבובים, מה שעלול למנוע רישום מוצלח. - סמן את התיבה שמור המרות כדי לשמור את פרמטרי שינוי הצורה, ולאפשר להחיל אותם על הערוצים האחרים.
- לחץ על אישור.
- בחר את המיקום לשמירת קובץ ההמרה (ברירת המחדל לספריית הקלט) ולחץ על פתח.
- בחר בתמונת DAPI שתשמש כהפניה להמרות. תמונת DAPI מכל אחד מהסבבים האחרים תהיה מיושרת לסבב זה.
הערה: לאחר השלמתה, התמונות הרשומות יופיעו כערימה (ובתיקיית הפלט). - השתמש בפס השקופיות בחלק התחתון כדי לדפדף קדימה ואחורה בין התמונות כדי לוודא שרישום התמונה הצליח (הגרעינים נמצאים באותו מקום בשתי התמונות, לפחות באזורים החופפים).
- ודא שנוצר קובץ .xml עבור כל סבב של תמונות הקלט.
הערה: אלה מכילים את פרמטרי התרגום הדרושים לקבצים מאותו סבב. - צור תיקייה המכילה את כל התמונות לרישום (כל ערוץ של כל סיבוב). שים לב לסדר הקבצים.
- צור תיקייה לפרמטרי ההמרה, וצור עותק אחד של קובץ .xml לכל סבב לכל ערוץ לרישום. בדוק שוב שסדר הקבצים (לפי שם) זהה בין התמונות שיש לרשום לבין העתקות פרמטר שינוי הצורה, מכיוון שהשלב הבא יעבור וישנה כל תמונה לפי סדר קובצי פרמטרי ההמרה.
- לחץ על תוספים | טרנספורמציה | המר פרוסות מחסנית וירטואליות.
- תחת ספריית מקור, בחר את התיקיה המכילה את התמונות לרישום.
- תחת ספריית פלט, בחר את התיקיה שנוצרה עבור פלט הרישום.
- תחת Transforms directory, בחר את התיקייה המכילה את .xml הקבצים עם עותק אחד לכל קובץ תמונה להמרה. שוב, ודא שהסדר תואם את הקבצים (כלומר, עותק אחד של .xml סבב 1 לכל ערוץ סבב 1, עותק אחד של סבב 2 .xml לכל ערוץ סבב 2 וכו').
- לחץ על אישור.
הערה: לאחר השלמתה, התמונות הרשומות מסיבוב זה יופיעו כערימה (ובתיקיית הפלט). - השתמש בפס השקופיות בחלק התחתון כדי לדפדף קדימה ואחורה בין הערוצים. ודא שכל הערוצים השתנו באותו אופן. אם לא, סביר להניח שהסיבה לכך היא קובץ .xml שגוי בספריית ההמרות; במקרה זה, תקן את הקובץ וחזור על הפעולה.
הערה: טווח הבהירות המוצג יתבסס על ערוץ אחד, אך הדבר אינו משפיע על התמונות שנשמרו בפועל, אלא רק על הצג. - שימו לב שכל התמונות הרשומות מיושרות בהצלחה בין סבבים ומוכנות לניתוח שכבות-על/במורד הזרם.
הערה: קיימות דרכים פרוגרמטיות יעילות יותר לביצוע רישום עבור אצוות גדולות. השיטה המוצגת כאן היא פשוט קלה שאינה דורשת תכנות.
תוצאות
כאימות לזהות האורגנואיד המוחי, חלקים היסטולוגיים של אורגנואיד מוחי בוגר (בן חודשיים) הוכתמו עבור PAX6 (סמן של NPCs23 גבי) ו-SATB2 (סמן של נוירונים בוגרים, פוסט-מיטוטיים, בשכבה העליונה24). כצפוי, תאי PAX6+ היו נוכחים בחלק הפנימי של האורגנואיד, ותאי SATB2+ היו נוכחים בשכבות העליונות (איור 2). תוצאות אלה תומכות בכך שהאורגנואידים המוחיים בהם נעשה שימוש היו אכן המוח הקדמי הגבי כמפורט בערכת ההתמיינות. כדי לבסס את התלות במינון של מערכת השתלת אורגנואידים מוחיים, אורגנואידים מוחיים בני חודשיים הוזרקו עם מספר גדל והולך של NPCs שמקורם ב- EGFP+ iPSC. נמצאה תלות ברורה במינון של פלואורסצנטיות GFP במספר תאי הקלט, עם זיהוי עקבי של טלאי תא EGFP+ ב-10,000 תאים ומעלה (איור 3). ההתמדה והנדידה של NPCs המושתלים הוערכו לאחר מכן על ידי מעקב אחר האורגנואידים המושתלים לאורך זמן. לשם כך, 50,000 NPCs שמקורם ב-iPSC הושתלו באורגנואידים מוחיים בני 2-3 חודשים שנוצרו מאותו קו iPSC. האורגנואידים והבקרות שהוזרקו צולמו עבור EGFP חיובי בנקודות הזמן שצוינו במהלך 3-4 החודשים הבאים. בסדרת ההשתלות הזו ראינו התמדה של האתר המוזרק לאורך 4 חודשי המעקב (איור 4A). מדבקות תאי EGFP+ נוספות הופיעו 9 ימים לאחר ההשתלה ונמשכו עד לנקודת הסיום של המחקר (3-4 חודשים, תלוי באורגנואיד), מה שמצביע על נדידת התאים והשתלבותם באתרים החדשים שלהם (איור 4A). בהגדלה גבוהה יותר, ניתן היה להבחין במורפולוגיה עצבית ברורה עם הקרנות ארוכות לתוך האורגנואיד (איור 4B), המאשרות את האינטגרציה של התאים שהוזרקו.
כדי לקבוע את מצב ההתמיינות של התאים המוזרקים באיחור לאחר ההזרקה, אורגנואיד המעקב בן 4 החודשים והשליטה בו תוקנו, הוטמעו בפרפין, נחתכו לפרוסות בעובי 15 מיקרומטר והורכבו על שקופיות זכוכית. לאחר מכן עובדו הפרוסות ונצבעו בסבב אחד של צביעה פלואורסצנטית (EGFP, TUJ1, NESTIN) או במשך שני מחזורי צביעה רצופים כדי להוסיף סמנים נוספים (MAP2, GFAP). הצביעה הראשונית בסיבוב אחד אישרה את נוכחותם של תאי EGFP+ באתר ההזרקה, כולל תערובת של תאים ששמרו על מצב NPC (NESTIN+TUJ1−) ואלה שהתמיינו לקראת גורל עצבי (NESTIN−TUJ1+) (איור 5). הן עבור אורגנואידי הבקרה והן עבור אורגנואידים שהוזרקו, נצפו מעט מאוד NPCs מסוג NESTIN+ (רובם, אם כי לא כולם, היו NPCs מושתלים של EGFP+ במקום ההזרקה), כאשר רוב תאי העצב TUJ1+ לא בשלים (איור 5). הצביעה הדו-סיבובית נתנה פירוט רב יותר, וחשפה תאי עצב בוגרים (NESTIN−TUJ1+MAP2+GFAP−) סביב רוב האזור החיצוני של האורגנואיד, עם אזורים של תאי עצב לא בוגרים (NESTIN−TUJ1+MAP2−GFAP−) לכיוון האמצע (איור 6A,B). אסטרוציטים (NESTIN−TUJ1−MAP2−GFAP+) היו נוכחים הן באורגנואידים המוזרקים והן באורגנואיד הבקרה, והיו מפוזרים סביב הקצוות החיצוניים (איור 6A,B). הפרוסה שעבורה בוצעה הצביעה הדו-עגולה באורגנואיד המוזרק הראתה מושבת לוויין קטנה של תאי EGFP+ הרחק מאתר ההזרקה שאימץ את הפנוטיפ של תאי עצב בוגרים (איור 6B,C). חלקם נראו קרובים לאסטרוציטים; אולם לא היו תאי EGFP+ עם חפיפה מלאה לצביעת GFAP, מה שמרמז על כך שהם היו סמוכים ולא יצרו את האסטרוציטים עצמם (איור 6B,C).
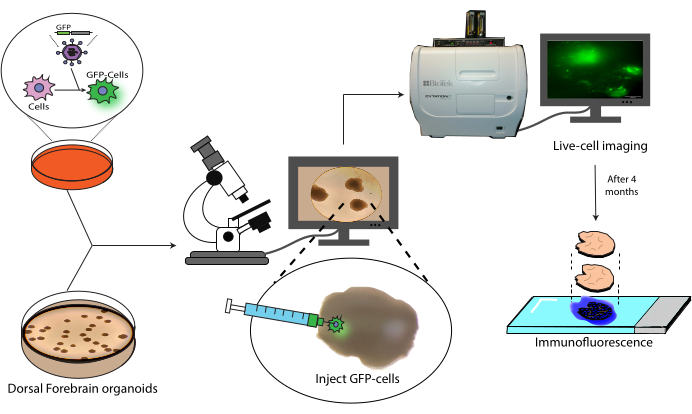
איור 1: מודל השתלה של תאים מסומנים באורגנואידים מוחיים. סקירה סכמטית של יצירת תאים מסומנים על ידי התמרה לנטיוויראלית, השתלתם באורגנואידים מוחיים, ומעקב על ידי הדמיה של תאים חיים ואימונופלואורסנציה. קיצור: GFP = חלבון פלואורסצנטי ירוק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
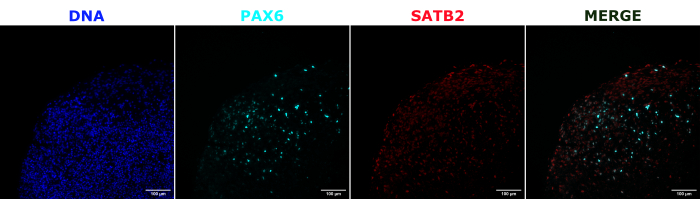
איור 2: אימונופלואורסנציה של חתכים היסטולוגיים שמראים ארכיטקטורה של אורגנואידים מוקדמים ומאוחרים. אורגנואיד מוחי בן חודשיים תוקן, הוטמע בפרפין, נחתך ומוכתם ב-PAX6, SATB2 ו-DAPI. קטע לא מוכתם שימש להגדרת זמן החשיפה והאינטגרציה כדי למנוע אות חיובי כוזב מאוטופלואורסצנטיות. תאי PAX6+ היו נוכחים בחלק הפנימי של האורגנואיד, בעוד שתאי SATB2+ היו נוכחים בשכבות העליונות. תמונות Z-stack צולמו כל 4.2 מיקרומטר דרך כל קטע הרקמה של 15 מיקרומטר. מקטעים אופטיים שולבו באמצעות אפשרות ערימת הפוקוס בתוכנת Gen5 עם אפשרויות ברירת מחדל. פסי קנה מידה = 100 מיקרומטר. קיצורים: PAX6 = חלבון קופסה 6 מזווג; SATB2 = חלבון קושר רצף עשיר AT-עשיר מיוחד 2; DAPI = 4',6-diamidino-2-phenylindole. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
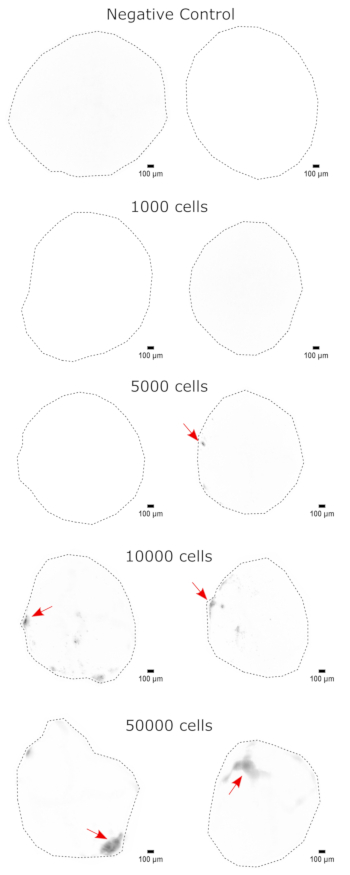
איור 3: השתלה תלוית מינון של NPCs באורגנואידים מוחיים. האורגנואידים הושתלו עם 0 (בקרה שלילית), 1,000, 5,000, 10,000 או 50,000 NPCs שמקורם ב-GFP+ iPSC. שבוע לאחר ההשתלה, האורגנואידים צולמו על ציטיישן 5 עם קוביית מסנן GFP. הבקרה השלילית שימשה להגדרת זמן החשיפה והאינטגרציה כדי למזער את הפלואורסצנטיות העצמית. צבעים כהים יותר מצביעים על פלואורסצנטיות רבה יותר של EGFP ביחס לבקרה השלילית. פסי קנה מידה = 100 מיקרומטר. אלה הן תמונות 4x של אורגנואידים שלמים. לאחר ההדמיה, בוצע חיסור רקע כדור מתגלגל ברדיוס פיקסל של 50 לפני התצוגה כדי לתקן את עוצמת הרקע המשתנה על פני האורגנואידים. אתרי הזרקה המזוהים כאזורי ההזרקה הגבוהים ביותר מסומנים בחץ אדום היכן שהייתה קליטה. קיצורים: NPCs = תאי אב עצביים; GFP = חלבון פלואורסצנטי ירוק; EGFP = GFP משופר; iPSC = תא גזע פלוריפוטנטי מושרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
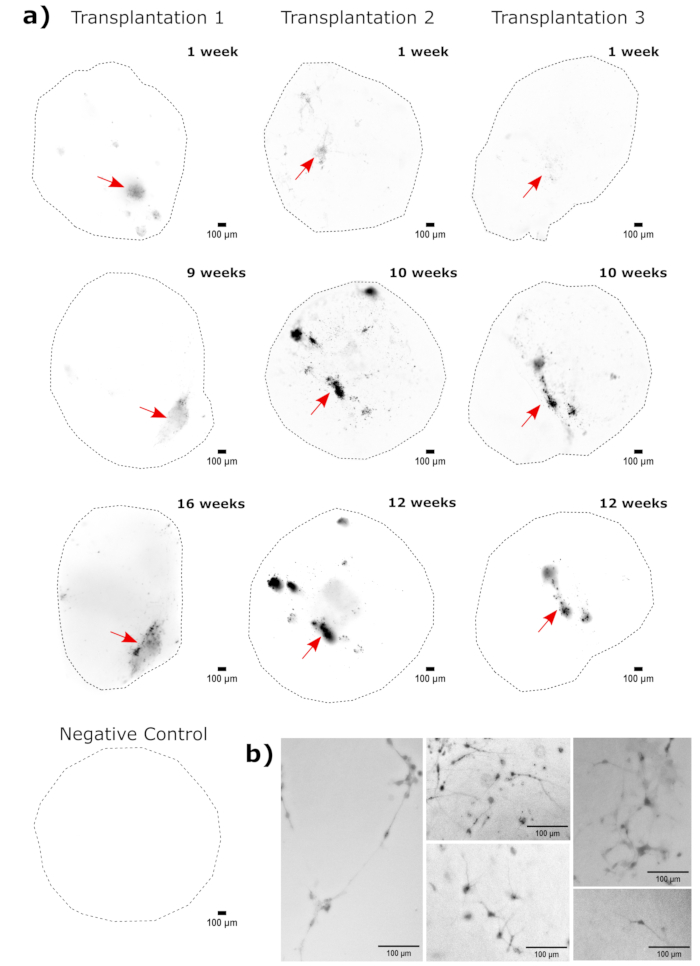
איור 4: מעקב אחר גדילת תאים מושתלים, נדידה והתמדה באמצעות דימות תאים חיים פלואורסצנטיים. (A) אורגנואידים שעברו בקרה והשתלה (50,000 GFP+ iPSC שמקורם ב-iPSC) לוו בהדמיה פלואורסצנטית של תאים חיים במשך 2-4 חודשים משתי קבוצות השתלות עצמאיות. אורגנואידי בקרה שליליים שימשו להגדרת זמן החשיפה והאינטגרציה כדי למזער את האוטופלואורסצנטיות בכל נקודת זמן. תמונות EGFP צולמו באמצעות קוביית מסנן GFP על Cytation 5 בזמנים שצוינו לאחר ההשתלה. צבעים כהים יותר מצביעים על פלואורסצנטיות רבה יותר של EGFP ביחס לבקרה השלילית באותה נקודת זמן. חיסור רקע כדור מתגלגל ברדיוס פיקסל של 50 בוצע לפני התצוגה כדי לתקן את עוצמת הרקע המשתנה על פני האורגנואידים. האורגנואידים מוקמו בערך באותו כיוון בכל נקודת זמן, והתמונות סובבו כדי לשמור על עקביות התצוגה ולהראות בבירור את צמיחת התאים המושתלים. אתרי ההזרקה המזוהים כאזורי הקליטה הגבוהה ביותר בנקודת הזמן המוקדמת ביותר מסומנים בחץ אדום. אורגנואיד בקרה שלילי לדוגמה מוצג בתחתית האיור. (B) דוגמה 20x תמונות מוצגות מאורגנואידים מושתלים בשבוע 1 ובשבוע 15 לאחר ההשתלה. הניגודיות המקומית שופרה לפני התצוגה באמצעות FIJI כדי להבטיח ראות עצבית. פסי קנה מידה = 100 מיקרומטר. קיצורים: NPCs = תאי אב עצביים; GFP = חלבון פלואורסצנטי ירוק; EGFP = GFP משופר; iPSC = תא גזע פלוריפוטנטי מושרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
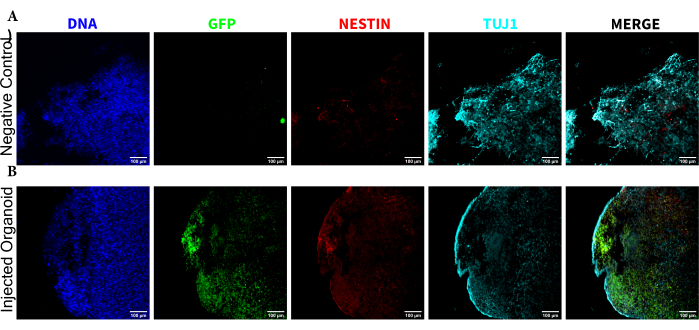
איור 5: אימונופלואורסנציה של החתכים ההיסטולוגיים החושפת את ההתמדה של NPCs המושתלים באתר ההזרקה יחד עם נדידה והתמיינות עצבית. תמונות פלואורסצנטיות חד-ערוציות מ-(A) אורגנואידים שלא הוזרקו ו-(B) אורגנואידים מושתלים. תמונת השכבת-על מימין מציגה את שלושת ערוצי העניין (NESTIN, TUJ1 ו-EGFP), אך אינה כוללת את DAPI. מינימום התצוגה הוגדר כך שלא יכלול את האות מהתאים השליליים (נקבע עבור EGFP מהבקרה שלא הוזרק ועבור ערוצים אחרים בהתבסס על שילובי סמנים ידועים). מקסימום התצוגה התבסס על האות הגבוה ביותר שנצפה עבור נוגדן זה בכל תא. טווחי התצוגה נשמרו קבועים בין האורגנואידים שלא הוזרקו והמושתלים כדי לאפשר השוואה ישירה. פסי קנה מידה = 100 מיקרומטר. קיצורים: NPCs = תאי אב עצביים; DAPI = 4',6-diamidino-2-phenylindole; TUJ1 = בטא-III טובולין; EGFP = חלבון פלואורסצנטי ירוק משופר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
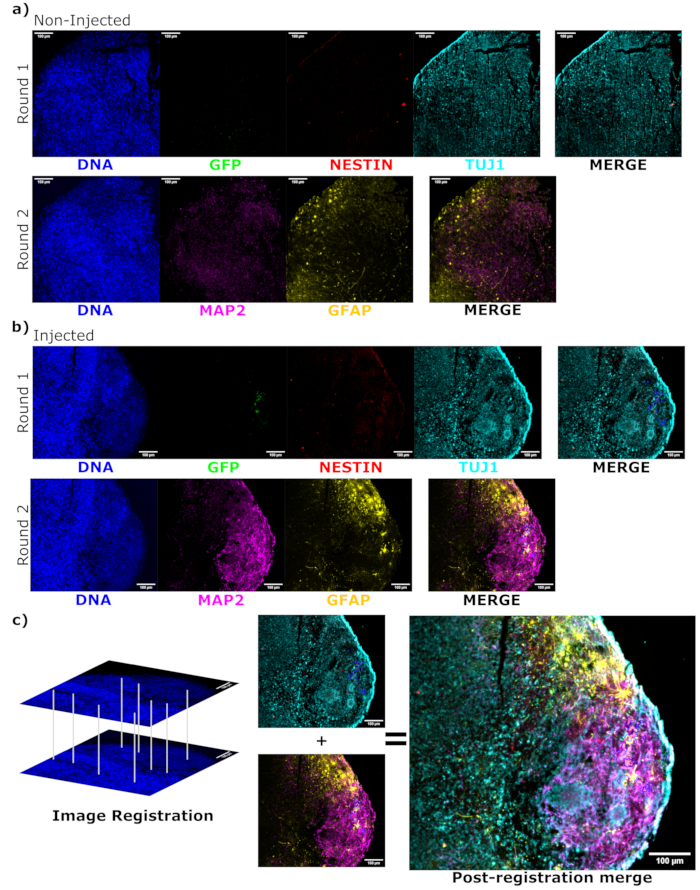
איור 6: הערכת מצב התמיינות תאים מושתלים ולוקליזציה באמצעות אימונופלואורסנציה מחזורית של החתכים ההיסטולוגיים. תמונות פלואורסצנטיות חד-ערוציות מהאורגנואידים הלא מוזרקים, (A) תואמי גיל ו-(B) מושתלים מוצגות בסבב הראשון והשני של הצביעה כפי שצוין. מינימום התצוגה הוגדר כך שלא יכלול את האות מהתאים השליליים (נקבע עבור EGFP מהבקרה שלא הוזרק ועבור ערוצים אחרים בהתבסס על שילובי סמנים ידועים). מקסימום התצוגה התבסס על האות הגבוה ביותר שנצפה עבור נוגדן זה בכל תא. טווחי התצוגה (וכמובן, פרמטרי ההדמיה) נשמרו קבועים בין הבקרה לבין אורגנואידים מוזרקים כדי לאפשר השוואה ישירה. פסי קנה מידה = 100 מיקרומטר. תמונה עם שכבת-על (למעט DAPI) מוצגת עבור כל סיבוב צביעה עבור כל אורגנואיד מימין. (B) עבור האורגנואיד המוזרק שבו בוצע רישום תמונה, כל התמונות נחתכות לאזור שנצפה בשני סבבי הצביעה. (ב,ג) עבור האורגנואיד המוזרק, אזורי תאי EGFP+ מסומנים בכחול. דיאגרמה של אופן השימוש ב- DAPI כדי להתאים לתכונות במהלך רישום תמונה מוצגת ב- (C), ואחריה מיזוג כולל של התמונה הרשומה. קיצורים: DAPI = 4',6-diamidino-2-phenylindole; TUJ1 = בטא-III טובולין; EGFP = חלבון פלואורסצנטי ירוק משופר; MAP2 = חלבון הקשור למיקרוטובול 2; GFAP = חלבון גליה פיברילרי חומצי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| שיבוט | פלואורופור | ריכוז | |
| אנטי-נסטין | 10ג2 | AlexaFluor 594 | 1 ל-2,000 |
| אנטי-TUBB3 | TUJ1 | AlexaFluor 647 | 1 ל-2,000 |
| אנטי-GFP | FM264G | AlexaFluor 488 | 1 ל-200 |
| אנטי-GFAP | SMI 25 | AlexaFluor 594 | 1 מתוך 500 |
| אנטי-MAP2 | SMI 52 | AlexaFluor 488 | 1 ל-1,000 |
| אנטי-PAX6 | O18-1330 | AlexaFluor 647 | 1 מתוך 100 |
| אנטי-SATB2 | EPNCIR130A | AlexaFluor 594 | 1 מתוך 500 |
טבלה 1: ריכוזי נוגדנים להכתמה. קיצורים: TUBB3 = בטא-טובולין III; GFP = חלבון פלואורסצנטי ירוק; GFAP = חלבון גליה פיברילרי חומצי; MAP2 = חלבון הקשור למיקרוטובול 2; PAX6 = קופסה 6 חלבון; SATB2 = חלבון קושר רצף מיוחד עשיר ב-AT, 2.
Discussion
לאור העניין המשמעותי בגישות טיפוליות תאיות לטיפול בפציעות CNS / הפרעות נוירודגנרטיביות 1,2,3,4,5,6,7,8, מודלים של תפקוד התא במסגרת השתלה צוברים חשיבות. מאמר זה מציג שיטה להשתלת NPCs אנושיים מתויגים באורגנואידים מוחיים אנושיים, יחד עם מעקב אחר תאים חיים והערכת נקודות קצה על ידי היסטולוגיה וצביעה אימונופלואורסצנטית. חשוב לציין, הראינו כי התאים המושתלים היו מסוגלים לנדוד, התמיינות והתמדה לטווח ארוך (4 חודשים) בסביבה אורגנואידית. התמדה ארוכת טווח כזו היא עלייה ניכרת לעומת יכולת התחזוקה של תרביות פרוסות מוח17. מערכת זו מתאימה, אם כן, לבחון רבות מההתנהגויות שיש להעריך במסגרת טיפולית פוטנציאלית, כגון הישרדות, ריבוי והבחנה. ואכן, מחקר אורתוגונלי הראה לאחרונה כי NPCs מושתלים התנהגו באופן דומה באורגנואידים מוחיים בהשוואה ל- NPCs שהושתלו במוחות עכבר NSG20, ובכך אישרו את התועלת של אורגנואידים כמושתלים. מכיוון שמדובר במערכת חוץ גופית, זה גם פשוט להוסיף ציטוקינים או תרופות מעניינות. זה יכול לשמש כדי להבין טוב יותר את ההשפעות של סביבות ספציפיות כגון דלקת ומדכאי חיסון על התאים המושתלים כדי לחקות עוד יותר את מה שהם עשויים להיתקל בסביבה טיפולית. פרוטוקול האימונופלואורסנציה המחזורית שהדגמנו (בהתבסס על מחקרקודם 21) מרחיב עוד יותר את כוחה של גישה זו, ומאפשר להעריך בו זמנית מגוון רחב של סמנים ספציפיים לשושלת ואולי גם למחלה במקטע אחד, ובכך מאפשר מעקב מדויק אחר התאים המושתלים והשפעתם על הרקמה. כמובן, ניתן להשתמש בשיטות אחרות להערכת נקודות קצה במקום זאת בהתאם למטרות הניתוח. לדוגמה, ניקוי רקמות עם שחזור תלת-ממדי יכול לשמש אם מורפולוגיה של התא היא עניין עיקרי, או דיסוציאציה ואחריה ציטומטריית זרימה יכול לשמש אם כימות של סוגי תאים ספציפיים הוא המטרה הסופית. אנו מצפים ששיטה זו תהיה ניתנת להרחבה בקלות לסוגי תאים אחרים כגון גידולים במערכת העצבים המרכזית, מה שעשוי לאפשר את המחקר שלהם בהקשר מיקרו-סביבתי רלוונטי. באופן דומה, ניתן להחליף את האורגנואידים המשמשים כמושתלים באורגנואידים מודל מחלה 25,26,27, מה שעשוי לאפשר מידול של גישות השתלה למצבים אלה.
כמו בכל הדגם, גם לזה המוצג כאן יש מגבלות משלו. ראשית, אורגנואידים שמקורם ב- iPSC אינם בשלים מבחינה התפתחותית19, ולכן יש להם הבדלים חשובים בהשוואה למוח המזדקן, שבו מחלות נוירודגנרטיביות רבות מתבטאות. אורגנואידים מוחיים גם אינם אחידים בהתפתחותם19, ובכך מונעים הזרקה עקבית לאותה נישה פיזיולוגית בדיוק. יתר על כן, בעוד שהם מכילים את סוגי התאים של אזורי המוח הרלוונטיים18,19, הם חסרים את רכיבי האנדותל, מיקרוגליאה ומערכת החיסון, שגם הם חשובים בסביבה in vivo 14. זה מגביל את המחקר של איך המארח יגיב להשתלת התא. טכניקות מגיעות כיום לאינטרנט כדי להוסיף תאי כלי דם28 ו microglial29, כמו גם כדי להגדיל את עקביות אורגנואיד אזוריזציה18, ובכך לשפר את כוח המידול של מערכת השתלת אורגנואידים. עם זאת, הם ידרשו בדיקות נוספות ואופטימיזציה מעבר למה שמוצג כאן. בעוד פרוטוקול זה אינו יקר ואינו דורש ציוד מיוחד, נותרו מספר שיקולים טכניים חשובים - עומק ההזרקה, למשל. זאת הן בשל העובדה שאורגנואידים אינם מחוררים, ולכן לעתים קרובות יש להם מרכז נמק אם הם גדלים יותר מדי19 ושאור אינו יכול לחדור דרך ליבת האורגנואיד לצורך מעקב אחר תאים חיים. לכן, התאים שהוזרקו עמוק מדי ומושבות שהיגרו פנימה עלולים להתפספס. בעוד שניתן לשפר זאת על ידי שימוש בפלואורופורים באורך גל ארוך יותר עם חדירה טובה יותר לרקמות30, בהתאם לגודל האורגנואיד ומנגנון האיתור, סביר להניח שזה יישאר שיקול. לבסוף, מכיוון שאורגנואידים במוח נמצאים במצב התפתחותי, תזמון ההשתלה הוא שיקול מרכזי נוסף, מכיוון שהסביבה צפויה להשתנות בהתאם לשלב ההתפתחותי של האורגנואיד שאליו הוא מוזרק. בעוד שניתן לשלוט בכך במידה מסוימת על ידי הבטחת גיל אורגנואיד עקבי בזמן ההזרקה, זהו, ללא ספק, גורם שיש לקחת בחשבון.
פרוטוקול זה זול, פשוט, נטול בעלי חיים ואינו דורש ציוד מיוחד, ובכך הופך את מידול ההשתלות לנגיש למגוון רחב יותר של מעבדות. עם קצב ההתקדמות המהיר הן בטיפול בתאים עצביים והן במערכות מודל אורגנואידים, אנו צופים כי פרוטוקול השתלת האורגנואידים המוצג כאן יהיה מודל שימושי למגוון מחלות וגישות טיפוליות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המימון לעבודה זו ניתן באמצעות קרנות פילנתרופיות IRIC מקרן מרסל וז'אן קוטו ומקרן Fonds de recherche du Québec - Santé (FRQS #295647). ל- D.J.H.F.K. יש תמיכה בשכר מ- FRQS בצורה של מלגת Chercheurs-boursiers Junior 1 (#283502). M.I.I.R. נתמך על ידי פרס IRIC לדוקטורט מהמכון לחקר אימונולוגיה וסרטן, Bourse de passage accélère de la maitrise au doctorat מאוניברסיטת מונטריאול, ובורס דה Mérite aux cycles supérieurs.
Materials
| Name | Company | Catalog Number | Comments |
| Accutase | StemCell Technologies | 7920 | proteolytic-collagenolytic enzyme mix |
| Alexa Fluor 488 anti-GFP Antibody | BioLegend | 338008 | |
| Alexa Fluor 488 anti-MAP2 (clone SMI 52) | BioLegend | 801804 | |
| Alexa Fluor 594 anti-GFAP Antibody (clone SMI 25) | BioLegend | 837510 | |
| Alexa Fluor 594 anti-Nestin (clone 10C2) | BioLegend | 656804 | |
| Alexa Fluor 647 anti-Tubulin β 3 (TUBB3) (clone TUJ1) | BioLegend | 801209 | |
| Citric Acid Monohydrate | Fisher Chemical | A104-500 | |
| Cytation 5 Cell Imaging Multimode Reader | Biotek | - | |
| Denaturated Ethyl Alcohol (Anhydrous) | ChapTec | - | |
| DMEM F12/Glutamax | Thermo | 10565018 | |
| Dymethil Sulfoxide (DMSO), Sterile | BioShop | DMS666.100 | |
| FIJI 1.53c | - | - | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501128-4L | |
| Gen5 | - | - | |
| HistoCore Arcadia H | Leica Biosystems | - | |
| Matrigel Growth Factor Reduced (GFR) | Corning | 356231 | Phenol Red-free, LDEV-free |
| MX35 microtome blade | Epredia | 3053835 | |
| NaOH | Sigma | 655104 | |
| PBS (-Ca -Mg) | Sigma | D8537 | |
| Puromycin Dihydrochloride | Thermo | A1113803 | |
| ROCK inhibitor Y-27632 | Abcam | ab120129 | |
| Simport Scientific Stainless-Steel Base Molds | Fisher Scientific | 22-038-209 | |
| Simport Scientific UNISETTE Biopsy Processing/Embedding Cassette | Fisher Scientific | 36-101-9255 | |
| STEMdiff Forebrain Neuron Differentiation Kit | StemCell Technologies | 8600 | |
| STEMdiff Neural Progenitor Medium | StemCell Technologies | 5833 | |
| STEMdiff SMADi Neural Induction Kit | StemCell Technologies | 8581 | |
| Thermo Scientific Shandon Finesse ME Microtome | Thermo Scientific | - | |
| Tissue Prep | Fisher Scientific | T555 | |
| Tissue-Tek VIP 6 AI Tissue Processor | Sakura Finetek | - | |
| Toluene (histological) | ChapTec | - | |
| Trypan blue; 0.4% (wt/vol) | Thermo | 15250061 | |
| Tween 20 | BioShop | TWN510.100 |
References
- Spurlock, M. S., et al. Amelioration of penetrating ballistic-like brain injury induced cognitive deficits after neuronal differentiation of transplanted human neural stem cells. Journal of Neurotrauma. 34 (11), 1981 (2017).
- Zhou, Y., Shao, A., Xu, W., Wu, H., Deng, Y. Advance of stem cell treatment for traumatic brain injury. Frontiers in Cellular Neuroscience. 13, 301 (2019).
- Hayashi, Y., Lin, H. -. T., Lee, C. -. C., Tsai, K. -. J. Effects of neural stem cell transplantation in Alzheimer's disease models. Journal of Biomedical Science. 27 (1), 29 (2020).
- Kefalopoulou, Z., et al. Long-term clinical outcome of fetal cell transplantation for Parkinson disease: Two case reports. JAMA Neurology. 71 (1), 83-87 (2014).
- Li, W., et al. Extensive graft-derived dopaminergic innervation is maintained 24 years after transplantation in the degenerating parkinsonian brain. Proceedings of the National Academy of Sciences of the United States of America. 113 (23), 6544-6549 (2016).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Takahashi, J. iPS cell-based therapy for Parkinson's disease: A Kyoto trial. Regenerative Therapy. 13, 18-22 (2020).
- Krause, M., Phan, T. G., Ma, H., Sobey, C. G., Lim, R. Cell-based therapies for stroke: Are we there yet. Frontiers in Neurology. 10, 656 (2019).
- Coles-Takabe, B. L. K., et al. Don't look: Growing clonal versus nonclonal neural stem cell colonies. Stem Cells. 26 (11), 2938-2944 (2008).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Jakel, R. J., Schneider, B. L., Svendsen, C. N. Using human neural stem cells to model neurological disease. Nature Reviews Genetics. 5 (2), 136-144 (2004).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Li, J., et al. Conservation and divergence of vulnerability and responses to stressors between human and mouse astrocytes. Nature Communications. 12 (1), 3958 (2021).
- Morizane, A., et al. MHC matching improves engraftment of iPSC-derived neurons in non-human primates. Nature Communications. 8 (1), 385 (2017).
- Khrameeva, E., et al. Single-cell-resolution transcriptome map of human, chimpanzee, bonobo, and macaque brains. Genome Research. 30 (5), 776-789 (2020).
- Powell, K. Hybrid brains: The ethics of transplanting human neurons into animals. Nature. 608 (7921), 22-25 (2022).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- García-Delgado, A. B., et al. Brain organoids to evaluate cellular therapies. Animals. 12 (22), (2022).
- Lin, J. -. R., Fallahi-Sichani, M., Sorger, P. K. Highly multiplexed imaging of single cells using a high-throughput cyclic immunofluorescence method. Nature Communications. 6 (1), 8390 (2015).
- Knapp, D. J. H. F., et al. Single-cell analysis identifies a CD33+ subset of human cord blood cells with high regenerative potential. Nature Cell Biology. 20 (6), 710-720 (2018).
- Georgala, P. A., Carr, C. B., Price, D. J. The role of Pax6 in forebrain development. Developmental Neurobiology. 71 (8), 690-709 (2011).
- Britanova, O., et al. Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex. Neuron. 57 (3), 378-392 (2008).
- Kim, H., et al. Modeling G2019S-LRRK2 sporadic Parkinson's disease in 3D midbrain organoids. Stem Cell Reports. 12 (3), 518-531 (2019).
- Smits, L. M., et al. Modeling Parkinson's disease in midbrain-like organoids. NPJ Parkinson's Disease. 5, 5 (2019).
- Jin, M., et al. Type-I-interferon signaling drives microglial dysfunction and senescence in human iPSC models of Down syndrome and Alzheimer's disease. Cell Stem Cell. 29 (7), 1135.e8-1153.e8 (2022).
- Sun, X. -. Y., et al. Generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, e76707 (2022).
- Popova, G., et al. Human microglia states are conserved across experimental models and regulate neural stem cell responses in chimeric organoids. Cell Stem Cell. 28 (12), 2153.e6-2166.e6 (2021).
- Wang, S., Li, B., Zhang, F. Molecular fluorophores for deep-tissue bioimaging. ACS Central Science. 6 (8), 1302-1316 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved