Method Article
Un modelo de organoide cerebral humano de trasplante de células neurales
En este artículo
Resumen
Aquí, describimos un protocolo para el trasplante y seguimiento de células neuronales marcadas en organoides cerebrales humanos.
Resumen
El avance de los enfoques de trasplante celular requiere sistemas modelo que permitan una evaluación precisa de la potencia funcional de las células trasplantadas. Para el sistema nervioso central, aunque el xenotrasplante sigue siendo el estado del arte, estos modelos son técnicamente desafiantes, de rendimiento limitado y costosos. Además, las señales ambientales presentes no reaccionan perfectamente con las células humanas. Este artículo presenta un modelo económico, accesible y compatible con el alto rendimiento para el trasplante y seguimiento de células neuronales humanas en organoides cerebrales humanos. Estos organoides se pueden generar fácilmente a partir de células madre pluripotentes inducidas humanas utilizando kits comerciales y contienen los tipos celulares clave del cerebro.
En primer lugar, demostramos este protocolo de trasplante con la inyección de células progenitoras neurales (NPC) derivadas de iPSC humanas marcadas con EGFP en estos organoides. A continuación, discutimos las consideraciones para rastrear el crecimiento de estas células en el organoide mediante microscopía de fluorescencia de células vivas y demostramos el seguimiento de NPC trasplantadas marcadas con EGFP en un organoide durante un período de 4 meses. Finalmente, presentamos un protocolo para el seccionamiento, tinción inmunofluorescente cíclica e imagen de las células trasplantadas en su contexto local. El modelo de trasplante de organoides que se presenta aquí permite el seguimiento a largo plazo (al menos 4 meses) de las células humanas trasplantadas directamente en un microambiente humano con un protocolo económico y fácil de realizar. Por lo tanto, representa un modelo útil tanto para las terapias de células neurales (trasplantes) como, probablemente, para modelar tumores del sistema nervioso central (SNC) de una manera más precisa desde el punto de vista microambiental.
Introducción
El cerebro humano es un órgano complejo compuesto por múltiples tipos de células de los linajes neural y glial. Juntos, forman una red sofisticada que da lugar a la cognición. Existe un interés significativo en el trasplante de células en este sistema como tratamiento para una amplia variedad de trastornos neurológicos, incluyendo la lesión cerebral traumática (TCE)1,2, los trastornos neurodegenerativos 3,4,5,6,7 y el accidente cerebrovascular8. Sin embargo, una limitación importante en el avance de estas estrategias es la relativa escasez de modelos preclínicos disponibles para determinar los resultados esperados del trasplante. Los modelos más utilizados en la actualidad son los métodos de cultivo in vitro para determinar el potencial celular y el xenotrasplante en ratones. Si bien los métodos de cultivo celular pueden evaluar la diferenciación y el potencial de autorrenovación9, estos se realizan en condiciones óptimas de crecimiento que no imitan el microambiente que las células encontrarían en un contexto de trasplante. Además, la forma en que se cultivan las células puede influir en su comportamiento10.
Los cerebros de ratón contienen todas las células del microambiente y, por lo tanto, son sistemas modelo extremadamente poderosos para el trasplante11. Sin embargo, existen diferencias importantes entre la corteza del ratón y la del ser humano12,13, y no todos los factores de crecimiento reaccionan de forma cruzada entre especies. Los modelos de primates son una alternativa más cercana que imita mejor el sistema humano y también han arrojado importantes resultados preclínicos14. Sin embargo, incluso estos parientes más estrechamente relacionados conservan diferencias importantes en su composición celular15. Si bien estos dos sistemas modelo proporcionan información valiosa sobre el comportamiento celular durante el trasplante e incorporan los elementos quirúrgicos de una eventual terapia, siguen siendo imperfectos. También son costosos y técnicamente desafiantes (es decir, se debe realizar una cirugía cerebral en los animales), lo que limita el rendimiento posible. Además, hay una gran cantidad de cuestiones éticas asociadas con el trasplante de células cerebrales humanas en animales16. Los cultivos de cortes de cerebro permiten cortar un cerebro y utilizarlo para múltiples tratamientos, eliminando así algunas de las limitaciones de los trasplantes de animales; Sin embargo, estos tienen una vida útil limitada (semanas), todavía son de origen animal y (al ser una rebanada delgada) no tienen suficiente integridad de volumen/superficie para imitar la inyección de células17. Por lo tanto, sigue existiendo una brecha importante entre los modelos estrictamente de cultivo celular/potencial y el trasplante in vivo.
Los organoides cerebrales son un modelo in vitro que contiene los principales tipos de células neurales presentes en el cerebro y pueden generarse en grandes cantidades a partir de células madre pluripotentes inducidas humanas (iPSCs)18,19. De este modo, estos organoides proporcionan un contexto celular que podría permitir la evaluación de la capacidad funcional de una célula de prueba de interés en el entorno del trasplante. De hecho, un estudio reciente demostró que las células progenitoras neurales (NPC) trasplantadas a organoides cerebrales humanos sobreviven, proliferan y se diferencian de manera similar a las NPC trasplantadas en el cerebro de un ratóndiabético obeso que nuncaha combinado inmunodeficiente gamma (NSG)20. Por lo tanto, los organoides cerebrales representan un sistema rentable, libre de crueldad animal y de larga duración (>6 meses) que captura los tipos de células del cerebro humano. Como tales, podrían representar un receptor de trasplante ideal para las pruebas en etapa temprana de la capacidad regenerativa de las células neuronales.
En este trabajo se presenta un protocolo para el trasplante y posterior seguimiento de NPCs humanas marcadas en organoides cerebrales humanos (Figura 1). Esto comienza con la inyección de NPCs marcadas con GFP en organoides cerebrales maduros (2-4 meses de edad)18. A continuación, las células trasplantadas se someten a una microscopía de fluorescencia de células vivas durante un período de 4 meses. Durante este tiempo, mostramos tanto la persistencia de las células en el lugar de la inyección como la migración a las regiones distales del organoide. En el punto final, demostramos la recuperación de antígenos, la tinción y la obtención de imágenes de secciones histológicas derivadas de estos organoides, incluido un protocolo para el enfriamiento de los colorantes existentes basados en AlexaFluor para permitir rondas adicionales de tinción e imágenes, basado en trabajos anteriores21. Por lo tanto, este protocolo podría ser útil en la medición de la capacidad de diferenciación de las células en un entorno de trasplante, la durabilidad del injerto, la expansión celular in situ y la migración celular desde el sitio del trasplante. Anticipamos que esto será útil tanto para aplicaciones de medicina regenerativa / terapia celular, como para el modelado de tumores mediante el injerto de células tumorales en organoides específicos de regiones relevantes.
Protocolo
NOTA: Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales, reactivos y equipos utilizados en este protocolo.
1. Marcaje de fluoróforos de células por transducción lentiviral
- Descongelar una alícuota de la matriz solubilizada de la membrana basal de elección en hielo.
- Mientras la alícuota se descongela, agregue agua estéril para llenar los espacios entre los pozos en una placa de 24 pocillos, junto con todos los pozos exteriores.
NOTA: Esto deja ocho pozos abiertos en el medio para su uso y asegura que las celdas permanezcan en alta humedad, minimizando así la variabilidad inducida por la evaporación. - Diluir la matriz de membrana basal solubilizada 1:100 en medio DMEM/F12 helado (se obtuvo una concentración final de 0,089 mg/mL con el lote utilizado aquí).
- Añadir 300 μL de la matriz de membrana basal solubilizada diluida a uno de los pocillos medios (abiertos) de la placa de 24 pocillos preparada por infección a realizar. Asegúrese de cubrir uniformemente todo el fondo del pozo y agregue más, si es necesario, para garantizar un recubrimiento uniforme.
- Incubar la placa durante 30 min a 37 °C para permitir que una capa se solidifique a lo largo del fondo del pozo. Verifique al final de esta incubación que el líquido todavía esté cubriendo completamente el fondo del pozo y no se haya evaporado en el centro. La evaporación es una señal de que la humedad es demasiado baja; Si esto sucede, repita el recubrimiento.
NOTA: Las placas pueden recubrirse la noche anterior y dejarse en matriz de membrana basal solubilizada diluida sin efectos nocivos evidentes; Sin embargo, el riesgo de evaporación aumenta considerablemente, por lo que deben inspeccionarse cuidadosamente antes de su uso. - Retire el medio de un pocillo de NPC derivados de iPSC confluentes que crecen en una placa de pocillo.
NOTA: Para este trabajo, se utilizaron progenitores neuronales derivados de iPSC producidos utilizando un kit comercial según las instrucciones del fabricante entre el pasaje 3 y el pasaje 10. - Agregue suavemente 1 ml de PBS al costado del pocillo y agite la placa para garantizar un lavado uniforme.
- Retire el PBS y reemplácelo con 300 μL de la mezcla de enzimas proteolíticas y colagenolíticas, balanceando nuevamente la placa para asegurarse de cubrir completamente el fondo del pocillo. Incubar durante 5 min a 37 °C. Verifique que las células se estén desprendiendo de la superficie de la placa mediante microscopía óptica.
- Con una pipeta P1.000, añadir 700 μL de DMEM/F12 y separar las células pulverizando esta mezcla por todas las superficies del fondo de la placa. Pipetear hacia arriba y hacia abajo para asegurarse de que los agregados celulares se rompan en una suspensión uniforme de una sola célula. Tome las células y agréguelas a 9 ml de medio DMEM/F12 en un tubo cónico de 15 ml.
- Centrifugar a 300 × g durante 5 min.
- Durante este tiempo, prepare suficiente medio suplementado con 10 μM Y-27632 para 500 μL por pocillo a sembrar, más 1 mL para la resuspensión.
NOTA: Y-27632 es necesario para asegurar una alta supervivencia de los NPCs después de pasar como células individuales. - Retire el sobrenadante y vuelva a suspender las células en 1 ml de medio suplementado con Y-27632, pipeteando hacia arriba y hacia abajo suavemente varias veces para romper los agregados celulares.
- Saca unos microlitros de células y dilúyelos (1:5 a 1:10) en azul tripano.
- Cuente las células viables (azul de tripano negativo) en un hemocitómetro. Ajuste la dilución de azul de tripano para obtener al menos 50 células viables por cuadrante del hemocitómetro para asegurarse de que los recuentos sean precisos. Calcule el volumen de suspensión celular necesario para que 100.000 células estén presentes en cada pocillo.
- Mezcle las celdas suavemente hacia arriba y hacia abajo pipeteando y tome el volumen calculado (para 100.000 celdas por pocillo). Agregue esto al medio suplementado con Y-27632 (a partir del paso 1.11) de modo que el volumen final sea de 500 μL por pocillo a sembrar.
- Retire la matriz de membrana basal solubilizada diluida de los pocillos previamente recubiertos (suponiendo que se haya completado la incubación de 30 minutos o más).
- Mezcle las células suavemente pipeteando y agregue 500 μL de la suspensión celular a cada pocillo.
- Para distribuir uniformemente las células, mueva la placa con un gran movimiento de signo "+" con suaves barridos lineales (adelante-atrás, parada, atrás-atrás) inmediatamente antes de colocarla en una incubadora de cultivo celular.
- Incubar durante la noche (16-24 h) a 37 °C y 5% deCO2.
- Retire el medio y agregue el lentivirus titulado. Si se requieren eventos de integración únicos, apunte a una multiplicidad de infección de 0,3 unidades infecciosas por célula (idealmente tituladas en las células de interés) y rellene hasta 500 μL en medio (sin Y-27632).
NOTA: El lentivirus de interés puede adquirirse pretitulado o producirse internamente como se hizo anteriormente22. Aquí, se utilizó un lentivirus GFP de producción propia con resistencia a la puromicina para generar y seleccionar las NPC que expresan EGFP. Si el lentivirus no se ha titulado en las células de interés y el número de copias es crítico, se recomienda añadir varios volúmenes a un par de pocillos y que el pocillo con ~30% de células EGFP+ 48-72 h se utilice posteriormente. Si el número de copias no es crítico, se puede añadir un exceso de virus con la advertencia de que la mutagénesis de inserción puede dar lugar a un comportamiento anómalo en algunos clones. PRECAUCIÓN: Los vectores lentivirales son un peligro biológico de nivel 2-3 (dependiendo de su contenido). Siga las normas locales de bioseguridad para el manejo del lentivirus, la descontaminación de superficies y artículos de plástico, y los desechos líquidos. - Devolver las células a la incubadora e incubarlas durante 24 h a 37 °C y 5% de CO2.
- Retire las células de la incubadora y retire el sobrenadante.
PRECAUCIÓN: Como el sobrenadante de las células todavía contiene partículas lentivirales en este punto, continúe siguiendo las regulaciones locales de bioseguridad para su manejo y eliminación. - Enjuague las celdas con 2 x 500 μL de PBS agregando suavemente PBS a la pared del pocillo; Luego, retírelo de la esquina del pozo para lavar cualquier lentivirus restante.
PRECAUCIÓN: Como el sobrenadante de las células todavía contiene partículas lentivirales en este punto, continúe siguiendo las regulaciones locales de bioseguridad para su manejo y eliminación. - Cambie a 500 μL de medio fresco (sin Y-27632) y continúe creciendo a 37 °C y 5% de CO2 durante la noche.
- Utilice microscopía de fluorescencia de células vivas para verificar la proporción de células que expresan EGFP y seleccionar el pocillo con el que proceder.
- Si el vector lentiviral de elección contiene un casete de selección (gen de resistencia a antibióticos como la resistencia a la puromicina), agregue el agente de selección (en este caso, 1 μg/ml de puromicina) al medio a una dosis previamente validada que mata las células sensibles pero no resistentes. De lo contrario, utilice la clasificación celular activada por fluorescencia para aislar las células EGFP+ en el momento de la primera división.
- A partir de ahora, mantenga las celdas con monitoreo diario de confluencia y realice cambios completos de medios diariamente.
- Cuando se alcance la confluencia, prepare uno o más pocillos de una placa fresca recubierta de 6 pocillos (con 1 mL de matriz de membrana basal solubilizada diluida; ver pasos 1.3-1.5) y recoja las células como se describe en los pasos 1.6-1.15.
NOTA: Si no se incluye ningún agente de selección, clasifique las células por citometría de flujo en esta etapa. Asegúrese de que las celdas estén clasificadas con una boquilla lo suficientemente ancha y baja presión para minimizar el estrés, así como de que se incluyan 10 μM Y-27632 en cada paso del proceso de clasificación. - Coloque las células en placas hasta una densidad final de 200.000 células/cm2.
- Mantenga el monitoreo diario y complete los cambios de medios diariamente.
NOTA: Cuando las celdas vuelven a alcanzar la confluencia, ya están listas para su uso. Alternativamente, ahora se puede congelar una acción para su uso futuro de la siguiente manera. - Divida, recoja y cuente las celdas como se describe en los pasos 1.6-1.15.
- Etiquete previamente un conjunto de crioviales con la información relevante (p. ej., pasaje, EGFP%, línea).
- Resuspender a 400.000 células/mL en medio + 10% DMSO.
NOTA: El DMSO es tóxico para las células cuando no está congelado, así que minimice el tiempo que pasa a temperatura ambiente en presencia de DMSO. - Agregue 1 ml (400,000 células) de la mezcla del paso 1.33 por criovial y colóquelo en un recipiente para congelar células.
- Transfiera el recipiente a un congelador a -80 °C durante la noche.
- Al día siguiente, transfiera las células a nitrógeno líquido para su almacenamiento a largo plazo.
2. Inyección de células marcadas en el organoide cerebral
NOTA: Para este artículo, los organoides cerebrales se produjeron utilizando un kit comercial según las instrucciones del fabricante. Esto puede ser reemplazado por el organoide cerebral de interés. Los materiales utilizados en esta parte del protocolo deben ser preenfriados para evitar la gelificación de la matriz de la membrana basal solubilizada por encima de 4 °C.
- Coloque la(s) jeringa(s), puntas y tubos de insulina que van a estar en contacto con la matriz de la membrana basal solubilizada a -20 °C para que se enfríen.
- Descongelar una alícuota de tamaño adecuado de matriz de membrana basal solubilizada en hielo en función del número de inyecciones que se vayan a realizar (~2 μL/inyección). Esto toma aproximadamente 30 min.
- Mientras la alícuota se descongela, divida, recoja y cuente las células como se describe en los pasos 1.6-1.15.
- Calcule los volúmenes necesarios por inyección. Si realiza varias inyecciones, coloque el volumen total de células en un tubo de 1,5 ml y agregue hasta 1 ml de DMEM/F12.
NOTA: Se debe utilizar un volumen que permita algunas inyecciones adicionales para tener en cuenta las pérdidas/errores de pipeteo. - Coloque las células en hielo mientras se preparan los siguientes pasos.
- Después de la descongelación, diluir la matriz de la membrana basal solubilizada hasta una concentración final de 3 mg/ml en DMEM/F12 helado.
- Tome la suspensión unicelular del hielo y gírela a 300 × g durante 5 minutos a 4 °C.
NOTA: Si no se dispone de una centrífuga refrigerada, generalmente parece tolerarse el centrifugado a temperatura ambiente. - Retire suavemente el medio por completo sin alterar el gránulo de la celda. Resuspender el gránulo celular mediante pipeteo suave en la matriz de membrana basal solubilizada diluida (3 mg/mL) para obtener un volumen final de 2 μL por inyección a realizar, e inmediatamente volver a colocarlo en hielo hasta su uso.
NOTA: La resuspensión de las células debe realizarse lentamente y con puntas preenfriadas para evitar la formación de burbujas y gelificación. - Transfiera la(s) jeringa(s) preenfriada(s) del congelador a -20 °C a una cubitera. Guárdalos allí hasta que los uses.
- Retire la placa con los organoides cerebrales de la incubadora. Utilice una punta de diámetro ancho para transferir el organoide que se va a inyectar en una placa de 35 mm. Eliminar todo el medio posible sin dañar el organoide para estabilizarlo y facilitar la inyección.
NOTA: Es importante utilizar puntas de diámetro ancho para evitar destruir el organoide. Si no están disponibles, corte el extremo de una punta normal de P1,000 con tijeras estériles. - Coloque el plato de 35 mm que contiene el organoide bajo un microscopio de disección para ayudar a guiar y facilitar la inyección.
NOTA: Si no se dispone de un microscopio de disección en una zona estéril, es posible realizar la inyección sin él, aunque con un control algo reducido. Otra alternativa es el uso de un lazo de aumento o gafas. - Una vez que los organoides estén listos para ser inyectados, vuelva a suspender suavemente las células con una punta de pipeta P20 enfriada y mueva 2 μL (que contienen el número deseado de células a inyectar) sobre un portaobjetos de vidrio estéril preenfriado.
NOTA: Para inyecciones múltiples, se pueden agregar volúmenes adicionales de 2 μL a través del portaobjetos de vidrio. Manténgalo en hielo y tenga cuidado de evitar la evaporación. - Tome una jeringa de insulina preenfriada del hielo y extraiga lentamente los 2 μL de suspensión celular con el bisel de la aguja hacia abajo para permitir que se absorban todas las células/medio.
NOTA: Asegúrese de ir extremadamente despacio para evitar la entrada de aire. - Abra la tapa del plato que contiene el organoide y enfoque el microscopio en él. Sostén el plato con una mano. Coloque el bisel de la aguja hacia arriba y, con la otra mano, inyecte las células lentamente en la superficie del organoide.
NOTA: Es importante inyectar lentamente para evitar dañar el tejido. - Después de la inyección, vuelva a colocar la tapa en el plato y deje reposar el organoide inyectado durante 1-2 minutos.
NOTA: Esto permite que la matriz de membrana basal solubilizada diluida se gelifique, manteniendo las células en su lugar. Si el medio se agrega demasiado pronto, puede eliminar las células que se encuentran en la superficie. - Agregue suavemente 500 μL del medio organoide y transfiera el organoide con una punta de diámetro ancho a un pocillo de una placa de 24 pocillos. Incubar el organoide a 37 °C y 5% de CO2 durante la noche. Realice cambios medios completos cada dos días.
NOTA: Es importante incluir un organoide de control negativo (simulacro inyectado), que se utilizará para los ajustes de imagen. Para ello, inyecte un organoide como el descrito anteriormente con matriz de membrana basal solubilizada diluida (3 mg/mL) para obtener un volumen final de 2 μL sin células.
3. Seguimiento del injerto mediante imágenes de fluorescencia de células vivas
NOTA: Utilice un microscopio de fluorescencia que pueda excitar el fluoróforo de interés y que tenga el conjunto de filtros necesario para detectar su fluorescencia. Como se mencionó anteriormente, los NPC utilizados aquí fueron EGFP+, con un pico de excitación de 488 nm y un pico de emisión de ~510 nm.
- Cargue un organoide de control negativo (no inyectado o inyectado simulado) y ajuste la intensidad de la iluminación y el tiempo de exposición de manera que la autofluorescencia sea mínima. Para el instrumento utilizado aquí, la intensidad de la iluminación se estableció entre 1 y 2 y el tiempo de exposición entre 80 ms y 100 ms.
NOTA: Como muchas longitudes de onda de excitación (particularmente las longitudes de onda más bajas) pueden ser tóxicas para las células, se recomienda mantener la intensidad baja y evitar buscar durante demasiado tiempo para evitar daños en el organoide. - Cargue el organoide de control positivo y aumente el tiempo de exposición si es necesario para asegurarse de que las células marcadas sean claramente visibles. Vuelva a colocar el organoide con una punta de pipeta de diámetro ancho para encontrar el lugar de inyección (región EGFP+ ).
- Retire el medio completamente del organoide de control negativo. Cargue el organoide de control negativo y visualícelo con los ajustes seleccionados (para el instrumento utilizado aquí, la intensidad de iluminación se estableció entre 1 y 2 y el tiempo de exposición entre 80 ms y 100 ms). Cuando se complete la toma de imágenes, agregue inmediatamente medio nuevo para evitar que el organoide se seque.
NOTA: La eliminación del medio es fundamental para obtener una buena imagen, ya que fija la altura y la orientación de los organoides, que de otro modo flotarían y se moverían constantemente, lo que impide obtener imágenes de alta calidad. - Repita la eliminación del medio/obtención de imágenes con cada uno de los organoides de prueba.
- Regrese los organoides a los cambios normales de incubación/medio (como en el paso 2.16) y repita la toma de imágenes a los intervalos deseados. Aquí, se obtuvieron imágenes de los organoides en la semana 1, la semana 9 y la semana 16 después de la inyección para seguir y probar la supervivencia, proliferación, diferenciación y migración de las NPC EGFP+ inyectadas.
4. Histología e inmunofluorescencia
- En el punto final, transfiera el organoide a un casete de histología etiquetado con la identificación del organoide y otros identificadores necesarios.
- Llene el casete con formalina al 10% y ciérrelo. Manténgalo a temperatura ambiente durante 24 h.
- Transfiera el casete cerrado con el organoide a un proceso tisular y establezca el siguiente protocolo: etanol 70% 10 min, etanol 80% 20 min, etanol 95% 30 min, etanol 100% 30 min, etanol 100% 40 min, etanol 100% 50 min, tolueno 30 min, tolueno 40 min, tolueno 50 min, parafina 25 min a 59 °C, parafina 35 min a 59 °C, parafina 40 min a 59 °C, parafina 50 min a 59 °C.
NOTA: Los pasos anteriores se realizan al vacío a temperatura ambiente, a menos que se especifique lo contrario. Este protocolo sustituye el agua con gradientes de alcohol de hasta el 100%. El paso intermedio con el tolueno es una transición entre el alcohol y la parafina, ya que ambos son solubles en él. PRECAUCIÓN: El tolueno y la parafina se consideran materiales peligrosos, ya que pueden ser líquidos altamente inflamables y pueden causar daños por inhalación o contacto con la piel o los ojos. Asegúrese de guardarlos bien cerrados en un espacio seguro. Use el equipo de protección personal adecuado cuando los manipule. Deseche los residuos de acuerdo con las regulaciones locales de riesgo químico. - Transfiera el casete cerrado con el organoide a un baño de parafina en la estación de inclusión.
- Saca el casete de la bañera, ábrelo y transfiere el organoide a un molde con base de acero. Coloca el molde debajo del dispensador de parafina y cúbrelo completamente con parafina.
- Coloque el casete vacío en la parte superior del molde de base de acero. Aquí, agregue más parafina en la parte superior del casete.
- Transfiera el molde de base de acero con el casete encima a hielo y déjelo enfriar durante 5 minutos. Retire el molde de acero y mantenga el casete con el organoide incrustado en un bloque de parafina.
- Transfiere el casete a un micrótomo para cortar secciones. Corta las secciones como desees.
NOTA: Aquí, se hicieron secciones de 15 μm de espesor en todo el organoide. - Deje caer cada sección sobre la superficie de un baño de agua a 45 °C y recójala en un portaobjetos de microscopio de vidrio.
- Deje secar los portaobjetos en una incubadora a 42 °C durante la noche.
NOTA: Los portaobjetos ahora se pueden almacenar a temperatura ambiente hasta el momento de la tinción. - Coloque el portaobjetos en un frasco de tinción de portaobjetos Coplin lleno de tolueno durante 2 min. Repita este paso una vez más.
PRECAUCIÓN: El tolueno se considera un material peligroso, ya que puede ser un líquido altamente inflamable y puede causar daños por inhalación o contacto con la piel o los ojos. Asegúrese de guardarlo bien cerrado en un espacio seguro. Use el equipo de protección personal adecuado cuando lo manipule. Deseche los residuos de acuerdo con las regulaciones locales de riesgo químico. - Transfiera a un frasco de tinción de portaobjetos Coplin de vidrio lleno de EtOH al 100% durante 2 min. Repita este paso una vez más.
- Transfiera a un frasco de vidrio para tinción de portaobjetos Coplin lleno de agua destilada durante 2 min. Repita este paso una vez más.
- Para la recuperación de antígenos, prepare tampón citrato (10 mM de ácido cítrico, 0,05% Tween 20, pH 6,0).
NOTA: El tampón de citrato se puede almacenar a temperatura ambiente hasta por 3 meses o a 4 °C para un almacenamiento más prolongado. - Ajuste un baño de agua entre 95 °C y 100 °C.
PRECAUCIÓN: Este baño de agua puede causar quemaduras si no se tiene cuidado. Tome todas las precauciones necesarias para evitar el contacto directo con la bañera o sus componentes. - En el baño de agua, haga flotar un recipiente de plástico en el que quepan los toboganes. Asegúrese de que el plástico no toque el fondo del baño (suponiendo que sea un baño de calentamiento inferior) para evitar que se derrita. Vierta el tampón de citrato dentro del recipiente de plástico y deje que alcance los 95-100 °C.
- Una vez que el tampón alcance la temperatura deseada, coloque los portaobjetos dentro del tampón y cubra sin apretar el recipiente con una tapa. Deje los portaobjetos dentro del recipiente en el baño maría durante 30-40 min.
- Retira el recipiente de plástico del baño de agua y déjalo enfriar a temperatura ambiente durante 20 minutos más.
- Lave los portaobjetos durante 3 x 2 minutos con PBS. Retire el PBS con un pañuelo de papel sin tocar la muestra ni secarla demasiado.
- Prepare el tampón de permeabilización (90 ml de PBS + 0,1% Tween-20) y llene con él un frasco de tinción de portaobjetos de vidrio. Sumerja los portaobjetos en el tampón de permeabilización e incube durante 10 minutos.
- Lave los portaobjetos durante 3 x 2 minutos con PBS.
- Prepare suficiente mezcla de tinción para cubrir cada muestra (~25 μL).
NOTA: Consulte la Tabla 1 para ver los anticuerpos y las concentraciones finales utilizadas aquí. - Agregue 25 μL de mezcla de tinción para cubrir cada rodaja de organoide. Incubar a temperatura ambiente durante 1 h o toda la noche a 4 °C en la oscuridad.
NOTA: Asegúrese de que las muestras permanezcan a una humedad alta para evitar la evaporación de la mezcla de tinción. Si no se dispone de un recipiente para mantener los portaobjetos húmedos, colóquelos dentro de una caja con algunos pañuelos húmedos en la esquina. - Lave los portaobjetos durante 3 x 2 minutos con PBS.
- Enjuague una vez con agua destilada dentro de un frasco de vidrio para eliminar la sal.
- Añadir 10 μL de líquido de montaje + 4',6-diamidino-2-fenilindol (DAPI) a cada una de las muestras.
NOTA: Los portaobjetos se pueden sellar si no se realiza una segunda ronda de tinción. En este caso, los portaobjetos no se cubrieron para permitir el acceso para el enfriamiento / retinción, ya que la eliminación del cubreobjetos puede dañar el tejido. - Tome imágenes de los portaobjetos con el microscopio de fluorescencia seleccionado.
NOTA: Asegúrese de tener controles positivos y negativos para cada anticuerpo para permitir el ajuste adecuado de las intensidades y los tiempos de exposición (para el instrumento utilizado aquí, la intensidad de la iluminación se estableció entre 5 y 6 y el tiempo de exposición entre 2.000 ms y 3.000 ms), aunque esto puede variar según el anticuerpo. Además, asegúrese de que el microscopio tenga detectores adecuados para cada canal utilizado. Tenga en cuenta que, como las muestras no están cubiertas, deben colocarse boca arriba mientras se toman imágenes de ellas. - Después de la obtención de imágenes, prepare un tampón de enfriamiento 2x fresco (9% H2O2 + 50 mM de NaOH en PBS).
NOTA: La solución de enfriamiento debe prepararse fresca inmediatamente antes de usarla. La reacción es sensible a la actividad delH2O2, que disminuirá con el tiempo. PRECAUCIÓN: El H2O2 es un irritante y el NaOH es cáustico. Estos deben tratarse con el equipo de seguridad adecuado y se debe evitar el contacto con la piel. Asegúrese de que se eliminen de acuerdo con las políticas locales de seguridad química. - Llene el frasco de tinción de portaobjetos Coplin de vidrio hasta la mitad con 2 tampones de enfriamiento (45 ml), agregue 45 ml de PBS y coloque los portaobjetos adentro. Incubar durante la noche a 4 °C.
- Comprobar mediante microscopía de fluorescencia que los fluoróforos se han apagado eficazmente.
- Repita la tinción y la obtención de imágenes como se indicó anteriormente.
NOTA: El enfriamiento y la retinción se pueden repetir durante rondas adicionales según sea necesario, aunque el riesgo de daño aumenta con cada ronda adicional.
5. Registro de imágenes
- Abre FIJI.
- Haz una carpeta con las imágenes DAPI de la ronda 1 y la ronda 2. Cambie los nombres para aclarar cuál es cuál, si es necesario.
- Cree una carpeta vacía para la salida del registro de la imagen.
- Haga clic en Plugins | Inscripción | Registre segmentos de pila virtual.
- En Directorio de origen, seleccione la carpeta que contiene las imágenes DAPI de cada ronda.
- En Directorio de salida, seleccione la carpeta creada para la salida de registro.
- Establezca el Modelo de extracción de entidades en Rígido y el menú desplegable Modelo de registro en Rígido - traducir + rotar para corregir el registro, permitiendo solo que la imagen se mueva y gire para alinearla en lugar de deformarla.
NOTA: Si se espera una deformación, el modelo de extracción de entidades y el modelo de registro se pueden ajustar a Afines u otros modelos según se desee, aunque esto puede dar lugar a transformaciones no deseadas. Ocasionalmente, un segmento puede dañarse entre rondas, lo que puede impedir el registro exitoso. - Marque la casilla Guardar transformaciones para guardar los parámetros de transformación, lo que permite que se apliquen a los otros canales.
- Haga clic en Aceptar.
- Seleccione la ubicación para guardar el archivo de transformación (el valor predeterminado es el directorio de entrada) y haga clic en Abrir.
- Seleccione la imagen DAPI que servirá como referencia para las transformaciones. La imagen DAPI de cada una de las otras rondas se alineará con esta.
NOTA: Cuando se complete, las imágenes registradas aparecerán como una pila (y en la carpeta de salida). - Utilice la barra deslizante de la parte inferior para desplazarse entre las imágenes y verificar que el registro de la imagen se ha realizado correctamente (los núcleos están en el mismo lugar en ambas imágenes, al menos para las áreas superpuestas).
- Compruebe que se ha creado un archivo .xml para cada ronda de las imágenes de entrada.
NOTA: Estos contienen los parámetros de traducción necesarios para los archivos de esa ronda. - Hacer una carpeta que contenga todas las imágenes a registrar (cada canal de cada ronda). Tenga en cuenta el orden de los archivos.
- Cree una carpeta para los parámetros de transformación y haga una copia del archivo .xml para cada ronda por canal que se registrará. Compruebe que el orden de los archivos (por nombre) es el mismo entre las imágenes que se van a registrar y las copias de los parámetros de transformación, ya que el siguiente paso pasará por y transformará cada imagen en el orden de los archivos de parámetros de transformación.
- Haga clic en Plugins | Transformar | Transforme segmentos de pila virtual.
- En Directorio de origen, seleccione la carpeta que contiene las imágenes que se van a registrar.
- En Directorio de salida, seleccione la carpeta creada para la salida de registro.
- En Directorio de transformaciones, seleccione la carpeta que contiene los archivos .xml con una copia por archivo de imagen que se va a transformar. Nuevamente, asegúrese de que el orden coincida con los archivos (es decir, una copia de la .xml de la ronda 1 para cada canal de la ronda 1, una copia de la .xml de la ronda 2 para cada canal de la ronda 2, etc.).
- Haga clic en Aceptar.
NOTA: Cuando se complete, las imágenes registradas de esa ronda aparecerán como una pila (y en la carpeta de salida). - Use la barra deslizante en la parte inferior para voltear hacia adelante y hacia atrás entre los canales. Verifique que todos los canales se hayan transformado de la misma manera. Si no es así, es probable que se deba a un archivo .xml incorrecto en el directorio transforms; En este caso, corrija el archivo y repita.
NOTA: El rango de brillo que se muestra se basará en un canal, pero esto no afecta a las imágenes guardadas reales, solo a la pantalla. - Observe que todas las imágenes registradas están alineadas correctamente en todas las rondas y listas para superposiciones/análisis posteriores.
NOTA: Hay formas programáticas más eficaces de lograr el registro para lotes grandes. El método presentado aquí es fácil y no requiere programación.
Resultados
Como validación de la identidad del organoide cerebral, se tiñeron secciones histológicas de un organoide cerebral maduro (de 2 meses de edad) para PAX6 (un marcador de NPC dorsales23) y SATB2 (un marcador de neuronas maduras, postmitóticas y de capa superior24). Como era de esperar, las células PAX6+ estaban presentes en el interior del organoide, y las células SATB2+ estaban presentes en las capas superiores (Figura 2). Estos resultados apoyan que los organoides cerebrales utilizados eran, de hecho, prosencéfalos dorsales, como se especifica en el kit de diferenciación. Para establecer la dependencia de la dosis del sistema de trasplante de organoides cerebrales, se inyectaron organoides cerebrales de 2 meses de edad con un número creciente de NPC derivadas de iPSC de EGFP+ . Se observó una clara dependencia de la dosis de la fluorescencia de GFP en el número de células de entrada, con una detección consistente de parches celulares EGFP+ a partir de 10.000 células (Figura 3). A continuación, se evaluó la persistencia y la migración de las NPC trasplantadas mediante el seguimiento de los organoides trasplantados a lo largo del tiempo. Para ello, se trasplantaron 50.000 NPC EGFP+ derivadas de iPSC a organoides cerebrales de 2-3 meses de edad generados a partir de la misma línea de iPSC. Se tomaron imágenes de los organoides inyectados y de los controles para determinar la positividad de EGFP en los puntos de tiempo indicados durante los siguientes 3-4 meses. En esta serie de trasplantes, observamos persistencia del sitio inyectado a lo largo del período de seguimiento de 4 meses (Figura 4A). Aparecieron parches celulares adicionales de EGFP+ a los 9 días después del trasplante y persistieron hasta el punto final del estudio (3-4 meses dependiendo del organoide), lo que indica la migración de las células y la integración en sus nuevos sitios (Figura 4A). A mayor aumento, se observó una clara morfología neuronal con proyecciones largas en el organoide (Figura 4B), lo que confirma la integración de las células inyectadas.
Para determinar el estado de diferenciación de las células inyectadas después de la inyección, el organoide rastreado de 4 meses y su control se fijaron, se incluyeron en parafina, se cortaron en rodajas de 15 μm de espesor y se montaron en portaobjetos de vidrio. A continuación, los cortes se procesaron y se tiñeron en una sola ronda de tinción fluorescente (EGFP, TUJ1, NESTIN) o durante dos ciclos de tinción consecutivos para añadir marcadores adicionales (MAP2, GFAP). La tinción inicial de una sola ronda confirmó la presencia de células EGFP+ en el lugar de la inyección, incluida una mezcla de células que conservaban el estado de NPC (NESTIN+TUJ1−) y aquellas que se habían diferenciado hacia un destino neural (NESTIN−TUJ1+) (Figura 5). Tanto para el organoide de control como para el inyectado, se observaron muy pocas NPC NESTIN+ (la mayoría, aunque no todas, eran NPC trasplantadas con EGFP+ en el lugar de la inyección), con una mayoría de neuronas inmaduras-maduras TUJ1+ (Figura 5). La tinción de dos rondas dio más detalles, revelando neuronas maduras (NESTIN−TUJ1+MAP2+GFAP−) alrededor de la mayor parte de la región externa del organoide, con áreas de neuronas inmaduras (NESTIN−TUJ1+MAP2−GFAP−) hacia el centro (Figura 6A,B). Los astrocitos (NESTIN−TUJ1−MAP2−GFAP+) estaban presentes tanto en los organoides inyectados como en los de control y estaban intercalados alrededor de los bordes externos (Figura 6A,B). El corte para el que se realizó la tinción de dos rondas en el organoide inyectado mostró una pequeña colonia satélite de células EGFP+ lejos del lugar de la inyección que había adoptado el fenotipo de neuronas maduras (Figura 6B, C). Algunos de ellos parecían estar muy cerca de los astrocitos; sin embargo, no había células EGFP+ con superposición completa a la tinción GFAP, lo que sugiere que eran adyacentes en lugar de generar los astrocitos en sí mismos (Figura 6B, C).
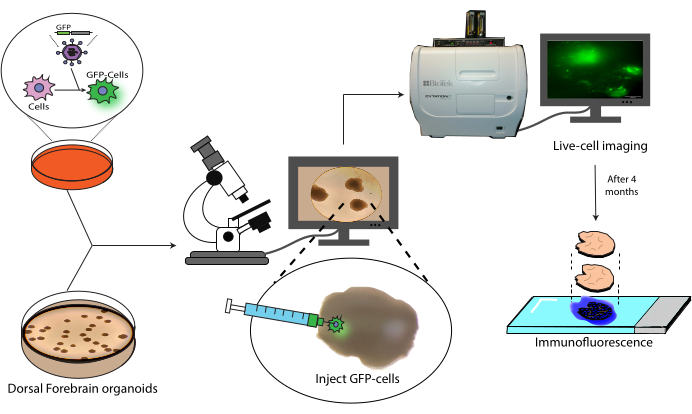
Figura 1: Modelo de trasplante de células marcadas en organoides cerebrales. Visión general esquemática de la generación de células marcadas por transducción lentiviral, su trasplante a organoides cerebrales y el seguimiento mediante imágenes de células vivas e inmunofluorescencia. Abreviatura: GFP = proteína verde fluorescente. Haga clic aquí para ver una versión más grande de esta figura.
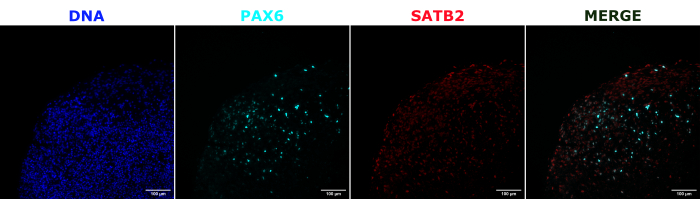
Figura 2: Inmunofluorescencia de cortes histológicos que muestran la arquitectura de organoides tempranos y tardíos. Un organoide cerebral de 2 meses de edad fue fijado, incluido en parafina, cortado en rodajas y teñido con PAX6, SATB2 y DAPI. Se utilizó una sección sin teñir para establecer la exposición y el tiempo de integración para evitar una señal falsa positiva de la autofluorescencia. Las células PAX6+ estaban presentes en el interior del organoide, mientras que las células SATB2+ estaban presentes en las capas superiores. Se tomaron imágenes de la pila Z cada 4,2 μm a través de toda la sección de tejido de 15 μm. Las secciones ópticas se combinaron utilizando la opción de apilamiento de enfoque en el software Gen5 con opciones predeterminadas. Barras de escala = 100 μm. Abreviaturas: PAX6 = proteína de la caja 6 pareada; SATB2 = proteína especial de unión a secuencia 2 rica en AT; DAPI = 4',6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
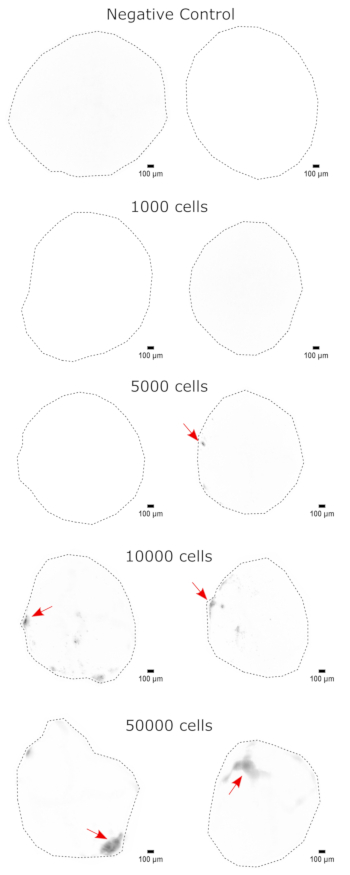
Figura 3: Injerto dependiente de la dosis de NPCs en organoides cerebrales. Los organoides se trasplantaron con 0 (control negativo), 1.000, 5.000, 10.000 o 50.000 NPC derivadas de GFP+ iPSC. A la semana siguiente al trasplante, los organoides se visualizaron en un Cytation 5 con un cubo de filtro GFP. El control negativo se utilizó para establecer el tiempo de exposición e integración para minimizar la autofluorescencia. Los colores más oscuros indican más fluorescencia de EGFP en relación con el control negativo. Barras de escala = 100 μm. Estas son imágenes 4x de los organoides completos. Después de la obtención de imágenes, se realizó una sustracción de fondo de bola rodante con un radio de píxeles de 50 antes de la visualización para corregir la intensidad variable del fondo en los organoides. Los sitios de inyección identificados como las regiones de mayor injerto se indican con una flecha roja donde hubo injerto. Abreviaturas: NPCs = células progenitoras neurales; GFP = proteína verde fluorescente; EGFP = GFP aumentada; iPSC = célula madre pluripotente inducida. Haga clic aquí para ver una versión más grande de esta figura.
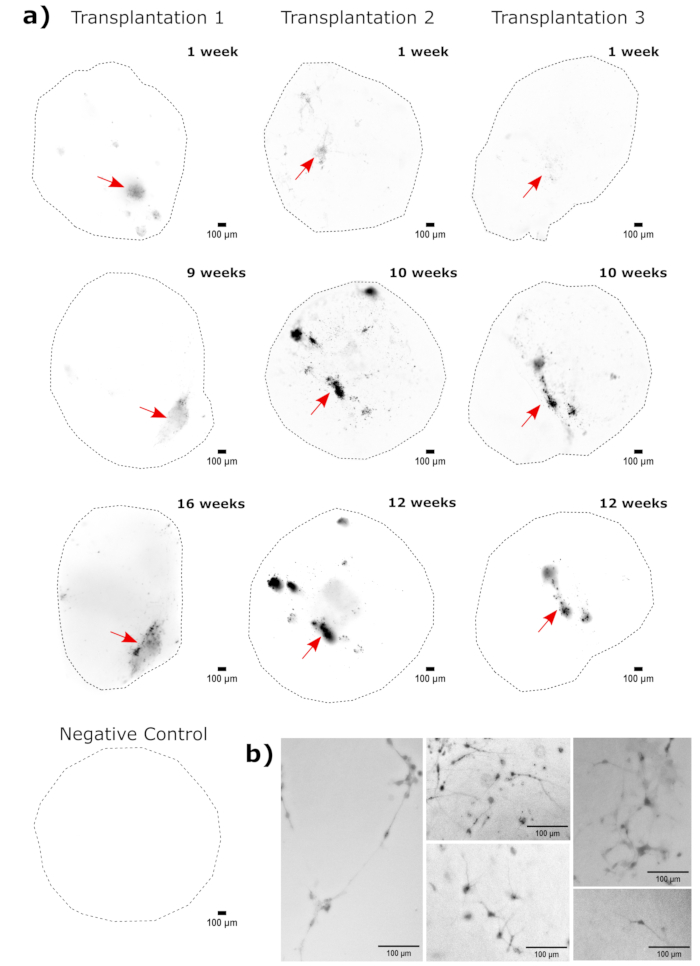
Figura 4: Seguimiento del crecimiento, la migración y la persistencia de las células trasplantadas con imágenes de células vivas de fluorescencia. (A) Los organoides de control y trasplantados (50.000 NPC derivadas de GFP+ iPSC) fueron seguidos por imágenes de células vivas de fluorescencia en el transcurso de 2 a 4 meses a partir de dos conjuntos de trasplante independientes. Se utilizaron organoides de control negativo para establecer el tiempo de exposición e integración para minimizar la autofluorescencia en cada punto de tiempo. Las imágenes de EGFP se capturaron utilizando un cubo de filtro GFP en el Cytation 5 en los momentos indicados después del trasplante. Los colores más oscuros indican más fluorescencia de EGFP en relación con el control negativo para ese punto de tiempo. Se realizó una sustracción de fondo de bola rodante con un radio de píxel de 50 antes de la visualización para corregir la intensidad variable del fondo en los organoides. Los organoides se colocaron aproximadamente en la misma orientación en cada punto de tiempo, y las imágenes se rotaron para mantener la consistencia de la visualización y para mostrar claramente el crecimiento de las células trasplantadas. Los sitios de inyección identificados como las regiones de mayor injerto en el punto de tiempo más temprano se indican con una flecha roja. En la parte inferior de la figura se muestra un ejemplo de organoide de control negativo. (B) Se muestran imágenes de ejemplo 20x de organoides injertados en la semana 1 y la semana 15 después del trasplante. El contraste local se mejoró antes de la visualización utilizando FIJI para garantizar la visibilidad de las neuritas. Barras de escala = 100 μm. Abreviaturas: NPCs = células progenitoras neurales; GFP = proteína verde fluorescente; EGFP = GFP aumentada; iPSC = célula madre pluripotente inducida. Haga clic aquí para ver una versión más grande de esta figura.
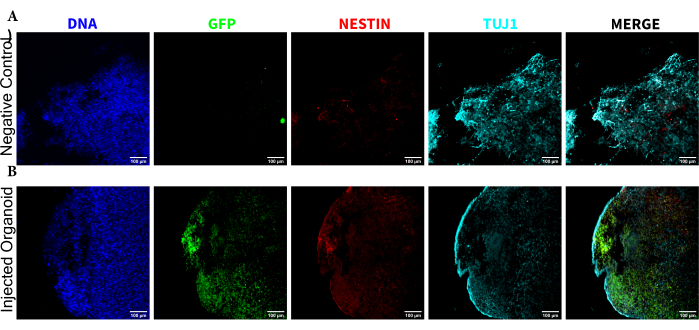
Figura 5: Inmunofluorescencia de los cortes histológicos que revelan la persistencia de las NPC trasplantadas en el lugar de la inyección junto con la migración y la diferenciación neuronal. Imágenes de fluorescencia de un solo canal de organoides (A) no inyectados y (B) trasplantados. La imagen superpuesta de la derecha muestra los tres canales de interés (NESTIN, TUJ1 y EGFP), pero no incluye DAPI. Los mínimos de visualización se establecieron para excluir la señal de las celdas negativas (determinadas para EGFP del control no inyectado y para otros canales basados en combinaciones de marcadores conocidas). Los máximos de visualización se basaron en la señal más alta observada para ese anticuerpo en cualquier célula. Los rangos de visualización se mantuvieron constantes entre los organoides no inyectados y trasplantados para permitir una comparación directa. Barras de escala = 100 μm. Abreviaturas: NPCs = células progenitoras neurales; DAPI = 4',6-diamidino-2-fenilindol; TUJ1 = tubulina beta-III; EGFP = proteína fluorescente verde aumentada. Haga clic aquí para ver una versión más grande de esta figura.
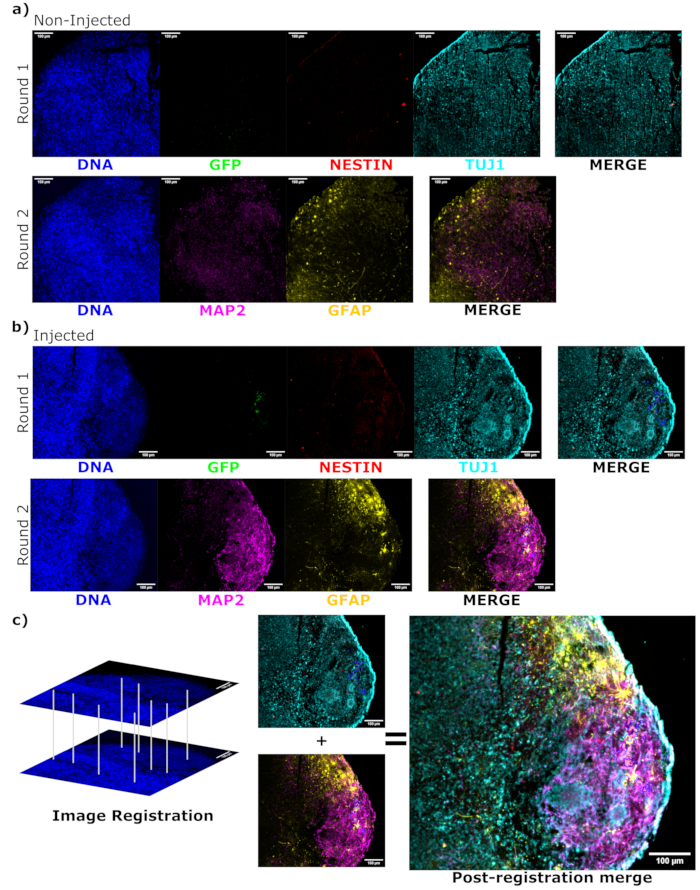
Figura 6: Evaluación del estado de diferenciación celular injertado y localización mediante inmunofluorescencia cíclica de los cortes histológicos. Se muestran imágenes de fluorescencia de un solo canal de los organoides no inyectados, (A) de la misma edad y (B) trasplantados para la primera y segunda ronda de tinción, según se indica. Los mínimos de visualización se establecieron para excluir la señal de las celdas negativas (determinadas para EGFP del control no inyectado y para otros canales basados en combinaciones de marcadores conocidas). Los máximos de visualización se basaron en la señal más alta observada para ese anticuerpo en cualquier célula. Los rangos de visualización (y, por supuesto, los parámetros de imagen) se mantuvieron constantes entre los organoides de control e inyectados para permitir la comparación directa. Barras de escala = 100 μm. A la derecha se muestra una imagen superpuesta (excluyendo DAPI) para cada ronda de tinción para cada organoide. (B) Para el organoide inyectado en el que se realizó el registro de imágenes, todas las imágenes se recortan a la región observada en ambas rondas de tinción. (B,C) Para el organoide inyectado, las regiones celulares de EGFP+ se delinean en azul. En (C) se muestra un diagrama de cómo se utiliza DAPI para hacer coincidir las entidades durante el registro de imágenes, seguido de una combinación general de la imagen registrada. Abreviaturas: DAPI = 4',6-diamidino-2-fenilindol; TUJ1 = tubulina beta-III; EGFP = proteína verde fluorescente mejorada; MAP2 = proteína 2 asociada a microtúbulos; GFAP = proteína ácida fibrilar glial. Haga clic aquí para ver una versión más grande de esta figura.
| Clon | Fluoróforo | Concentración | |
| Anti-NESTIN | 10C2 | AlexaFluor 594 | 1 en 2.000 |
| Anti-TUBB3 | TUJ1 | AlexaFluor 647 | 1 en 2.000 |
| Anti-GFP | FM264G | AlexaFluor 488 | 1 en 200 |
| Anti-GFAP | SMI 25 | AlexaFluor 594 | 1 en 500 |
| Anti-MAP2 | SMI 52 | AlexaFluor 488 | 1 de cada 1.000 |
| Anti-PAX6 | O18-1330 | AlexaFluor 647 | 1 de cada 100 |
| Anti-SATB2 | EPNCIR130A | AlexaFluor 594 | 1 en 500 |
Tabla 1: Concentraciones de anticuerpos para la tinción. Abreviaturas: TUBB3 = beta-tubulina III; GFP = proteína verde fluorescente; GFAP = proteína ácida fibrilar glial; MAP2 = proteína 2 asociada a microtúbulos; PAX6 = proteína de la caja 6 pareada; SATB2 = proteína especial de unión a secuencias 2 rica en AT.
Discusión
Dado el gran interés en los enfoques terapéuticos celulares para el tratamiento de las lesiones del SNC/trastornos neurodegenerativos 1,2,3,4,5,6,7,8, los modelos de función celular en un entorno de trasplante están ganando importancia. En este artículo se presenta un método para el trasplante de NPCs humanas marcadas en organoides cerebrales humanos, junto con su seguimiento de células vivas y la evaluación del punto final mediante histología y tinción inmunofluorescente. Es importante destacar que demostramos que las células trasplantadas eran capaces de migrar, diferenciarse y persistir a largo plazo (4 meses) en el entorno de los organoides. Esta persistencia a largo plazo es un marcado aumento con respecto a la capacidad de mantenimiento de los cultivos de cortes de cerebro17. Este sistema es, por lo tanto, apropiado para examinar muchos de los comportamientos que uno necesitaría evaluar en un entorno terapéutico potencial, como la supervivencia, la proliferación y la diferenciación. De hecho, un estudio ortogonal demostró recientemente que las NPC trasplantadas se comportaron de manera similar en organoides cerebrales en comparación con las NPC trasplantadas en cerebros de ratón NSG20, confirmando así la utilidad de los organoides como receptores de trasplantes. Al tratarse de un sistema in vitro, también es sencillo añadir citoquinas o fármacos de interés. Esto podría utilizarse para comprender mejor los efectos de entornos específicos, como la inflamación y los inmunosupresores, en las células trasplantadas para imitar aún más lo que podrían encontrar en un entorno terapéutico. El protocolo de inmunofluorescencia cíclica que demostramos (basado en investigaciones previas21) amplía aún más el poder de este enfoque, permitiendo que una amplia gama de marcadores específicos de linaje y, potencialmente, de enfermedades se evalúen simultáneamente en una sola sección y, por lo tanto, permitiendo un seguimiento preciso de las células trasplantadas y su impacto en el tejido. Por supuesto, se podrían utilizar otros métodos de evaluación de puntos finales en su lugar, dependiendo de los objetivos del análisis. Por ejemplo, se podría utilizar el aclaramiento de tejidos con reconstrucción 3D si la morfología celular es de interés principal, o se podría utilizar la disociación seguida de citometría de flujo si el objetivo final es la cuantificación de tipos celulares específicos. Esperamos que este método sea fácilmente extensible a otros tipos de células, como los tumores del SNC, lo que podría permitir su estudio en un contexto microambientalmente relevante. De manera similar, los organoides utilizados como receptores podrían intercambiarse por organoides modelo de enfermedad 25,26,27, lo que podría permitir el modelado de enfoques de trasplante para estas condiciones.
Como ocurre con todos los modelos, el que aquí se presenta también tiene sus propias limitaciones. Por un lado, los organoides derivados de iPSC son inmaduros desde el punto de vista del desarrollo19 y, por lo tanto, tienen diferencias importantes en comparación con el cerebro envejecido, en el que se manifiestan muchas enfermedades neurodegenerativas. Los organoides cerebrales tampoco son uniformes en el desarrollo19, lo que impide la inyección consistente en el mismo nicho fisiológico exacto. Además, si bien contienen los tipos celulares de las regiones cerebrales relevantes18,19, carecen de los componentes endoteliales, microgliales e inmunológicos, que también son importantes en el entorno in vivo 14. Esto limita el estudio de cómo reaccionará el huésped al trasplante de células. Actualmente se están poniendo en marcha técnicas para añadir células vasculares28 y microgliales29, así como para aumentar la consistencia y regionalización de los organoides18, mejorando así el poder de modelado del sistema de trasplante de organoides. Sin embargo, requerirían más pruebas y optimización más allá de lo que se presenta aquí. Si bien este protocolo es económico y no requiere equipo especializado, sigue habiendo una serie de consideraciones técnicas importantes, por ejemplo, la profundidad de inyección. Esto se debe al hecho de que los organoides no se perfunden y, por lo tanto, a menudo tienen un centro necrótico si crecen demasiado19 y esa luz no puede penetrar a través del núcleo del organoide para el seguimiento de las células vivas. Por lo tanto, las células que se han inyectado demasiado profundo y las colonias que han migrado al interior pueden pasarse por alto. Si bien esto puede mejorarse mediante el uso de fluoróforos de longitud de onda más larga con una mejor penetrancia tisular30, dependiendo del tamaño del organoide y del aparato de detección, es probable que esto siga siendo una consideración. Finalmente, como los organoides cerebrales se encuentran en un estado de desarrollo, el momento del trasplante es otra consideración clave, ya que el entorno probablemente diferirá según la etapa de desarrollo del organoide en el que se inyecta. Si bien esto se puede controlar hasta cierto punto asegurando una edad constante del organoide en el momento de la inyección, es, sin duda, un factor que debe tenerse en cuenta.
Este protocolo es económico, simple, libre de animales y no requiere equipo especializado, lo que hace que el modelado de trasplante sea accesible para una variedad más amplia de laboratorios. Con el rápido ritmo de avance tanto en la terapéutica de células neurales como en los sistemas modelo de organoides, anticipamos que el protocolo de trasplante de organoides presentado aquí será un modelo útil para una variedad de enfermedades y enfoques terapéuticos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los fondos para este trabajo fueron proporcionados a través de los fondos filantrópicos del IRIC de la fundación Marcelle y Jean Coutu y del Fonds de recherche du Québec - Santé (FRQS #295647). D.J.H.F.K. cuenta con el apoyo salarial de FRQS en forma de una beca Chercheurs-boursiers Junior 1 (#283502). El M.I.I.R. contó con el apoyo de un Premio de Doctorado IRIC del Instituto de Investigación en Inmunología y Cáncer, una Bolsa de Pasaje Accélère de la maitrise au doctorat de la Universidad de Montreal y la Bolsa de Mérito de los Ciclos Superiores.
Materiales
| Name | Company | Catalog Number | Comments |
| Accutase | StemCell Technologies | 7920 | proteolytic-collagenolytic enzyme mix |
| Alexa Fluor 488 anti-GFP Antibody | BioLegend | 338008 | |
| Alexa Fluor 488 anti-MAP2 (clone SMI 52) | BioLegend | 801804 | |
| Alexa Fluor 594 anti-GFAP Antibody (clone SMI 25) | BioLegend | 837510 | |
| Alexa Fluor 594 anti-Nestin (clone 10C2) | BioLegend | 656804 | |
| Alexa Fluor 647 anti-Tubulin β 3 (TUBB3) (clone TUJ1) | BioLegend | 801209 | |
| Citric Acid Monohydrate | Fisher Chemical | A104-500 | |
| Cytation 5 Cell Imaging Multimode Reader | Biotek | - | |
| Denaturated Ethyl Alcohol (Anhydrous) | ChapTec | - | |
| DMEM F12/Glutamax | Thermo | 10565018 | |
| Dymethil Sulfoxide (DMSO), Sterile | BioShop | DMS666.100 | |
| FIJI 1.53c | - | - | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501128-4L | |
| Gen5 | - | - | |
| HistoCore Arcadia H | Leica Biosystems | - | |
| Matrigel Growth Factor Reduced (GFR) | Corning | 356231 | Phenol Red-free, LDEV-free |
| MX35 microtome blade | Epredia | 3053835 | |
| NaOH | Sigma | 655104 | |
| PBS (-Ca -Mg) | Sigma | D8537 | |
| Puromycin Dihydrochloride | Thermo | A1113803 | |
| ROCK inhibitor Y-27632 | Abcam | ab120129 | |
| Simport Scientific Stainless-Steel Base Molds | Fisher Scientific | 22-038-209 | |
| Simport Scientific UNISETTE Biopsy Processing/Embedding Cassette | Fisher Scientific | 36-101-9255 | |
| STEMdiff Forebrain Neuron Differentiation Kit | StemCell Technologies | 8600 | |
| STEMdiff Neural Progenitor Medium | StemCell Technologies | 5833 | |
| STEMdiff SMADi Neural Induction Kit | StemCell Technologies | 8581 | |
| Thermo Scientific Shandon Finesse ME Microtome | Thermo Scientific | - | |
| Tissue Prep | Fisher Scientific | T555 | |
| Tissue-Tek VIP 6 AI Tissue Processor | Sakura Finetek | - | |
| Toluene (histological) | ChapTec | - | |
| Trypan blue; 0.4% (wt/vol) | Thermo | 15250061 | |
| Tween 20 | BioShop | TWN510.100 |
Referencias
- Spurlock, M. S., et al. Amelioration of penetrating ballistic-like brain injury induced cognitive deficits after neuronal differentiation of transplanted human neural stem cells. Journal of Neurotrauma. 34 (11), 1981 (2017).
- Zhou, Y., Shao, A., Xu, W., Wu, H., Deng, Y. Advance of stem cell treatment for traumatic brain injury. Frontiers in Cellular Neuroscience. 13, 301 (2019).
- Hayashi, Y., Lin, H. -. T., Lee, C. -. C., Tsai, K. -. J. Effects of neural stem cell transplantation in Alzheimer's disease models. Journal of Biomedical Science. 27 (1), 29 (2020).
- Kefalopoulou, Z., et al. Long-term clinical outcome of fetal cell transplantation for Parkinson disease: Two case reports. JAMA Neurology. 71 (1), 83-87 (2014).
- Li, W., et al. Extensive graft-derived dopaminergic innervation is maintained 24 years after transplantation in the degenerating parkinsonian brain. Proceedings of the National Academy of Sciences of the United States of America. 113 (23), 6544-6549 (2016).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Takahashi, J. iPS cell-based therapy for Parkinson's disease: A Kyoto trial. Regenerative Therapy. 13, 18-22 (2020).
- Krause, M., Phan, T. G., Ma, H., Sobey, C. G., Lim, R. Cell-based therapies for stroke: Are we there yet. Frontiers in Neurology. 10, 656 (2019).
- Coles-Takabe, B. L. K., et al. Don't look: Growing clonal versus nonclonal neural stem cell colonies. Stem Cells. 26 (11), 2938-2944 (2008).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Jakel, R. J., Schneider, B. L., Svendsen, C. N. Using human neural stem cells to model neurological disease. Nature Reviews Genetics. 5 (2), 136-144 (2004).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Li, J., et al. Conservation and divergence of vulnerability and responses to stressors between human and mouse astrocytes. Nature Communications. 12 (1), 3958 (2021).
- Morizane, A., et al. MHC matching improves engraftment of iPSC-derived neurons in non-human primates. Nature Communications. 8 (1), 385 (2017).
- Khrameeva, E., et al. Single-cell-resolution transcriptome map of human, chimpanzee, bonobo, and macaque brains. Genome Research. 30 (5), 776-789 (2020).
- Powell, K. Hybrid brains: The ethics of transplanting human neurons into animals. Nature. 608 (7921), 22-25 (2022).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- García-Delgado, A. B., et al. Brain organoids to evaluate cellular therapies. Animals. 12 (22), (2022).
- Lin, J. -. R., Fallahi-Sichani, M., Sorger, P. K. Highly multiplexed imaging of single cells using a high-throughput cyclic immunofluorescence method. Nature Communications. 6 (1), 8390 (2015).
- Knapp, D. J. H. F., et al. Single-cell analysis identifies a CD33+ subset of human cord blood cells with high regenerative potential. Nature Cell Biology. 20 (6), 710-720 (2018).
- Georgala, P. A., Carr, C. B., Price, D. J. The role of Pax6 in forebrain development. Developmental Neurobiology. 71 (8), 690-709 (2011).
- Britanova, O., et al. Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex. Neuron. 57 (3), 378-392 (2008).
- Kim, H., et al. Modeling G2019S-LRRK2 sporadic Parkinson's disease in 3D midbrain organoids. Stem Cell Reports. 12 (3), 518-531 (2019).
- Smits, L. M., et al. Modeling Parkinson's disease in midbrain-like organoids. NPJ Parkinson's Disease. 5, 5 (2019).
- Jin, M., et al. Type-I-interferon signaling drives microglial dysfunction and senescence in human iPSC models of Down syndrome and Alzheimer's disease. Cell Stem Cell. 29 (7), 1135.e8-1153.e8 (2022).
- Sun, X. -. Y., et al. Generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, e76707 (2022).
- Popova, G., et al. Human microglia states are conserved across experimental models and regulate neural stem cell responses in chimeric organoids. Cell Stem Cell. 28 (12), 2153.e6-2166.e6 (2021).
- Wang, S., Li, B., Zhang, F. Molecular fluorophores for deep-tissue bioimaging. ACS Central Science. 6 (8), 1302-1316 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados