Method Article
Un modello di organoide cerebrale umano di trapianto di cellule neurali
In questo articolo
Riepilogo
Qui, descriviamo un protocollo per il trapianto e il tracciamento di cellule neurali marcate in organoidi cerebrali umani.
Abstract
Il progresso degli approcci di trapianto cellulare richiede sistemi modello che consentano una valutazione accurata della potenza funzionale delle cellule trapiantate. Per il sistema nervoso centrale, sebbene lo xenotrapianto rimanga allo stato dell'arte, tali modelli sono tecnicamente impegnativi, limitati in termini di produttività e costosi. Inoltre, i segnali ambientali presenti non reagiscono perfettamente con le cellule umane. Questo documento presenta un modello economico, accessibile e compatibile con l'alto rendimento per il trapianto e il monitoraggio di cellule neurali umane in organoidi cerebrali umani. Questi organoidi possono essere facilmente generati da cellule staminali pluripotenti indotte umane utilizzando kit commerciali e contengono i tipi di cellule chiave del cervello.
Per prima cosa dimostriamo questo protocollo di trapianto con l'iniezione di cellule progenitrici neurali (NPC) derivate da iPSC umane marcate con EGFP in questi organoidi. Successivamente discutiamo le considerazioni per monitorare la crescita di queste cellule nell'organoide mediante microscopia a fluorescenza su cellule vive e dimostriamo il monitoraggio delle NPC marcate con EGFP trapiantate in un organoide per un periodo di 4 mesi. Infine, presentiamo un protocollo per il sezionamento, la colorazione immunofluorescente ciclica e l'imaging delle cellule trapiantate nel loro contesto locale. Il modello di trapianto di organoidi qui presentato consente il monitoraggio a lungo termine (almeno 4 mesi) di cellule umane trapiantate direttamente in un microambiente umano con un protocollo economico e semplice da eseguire. Rappresenta quindi un modello utile sia per le terapie cellulari neurali (trapianti) che, probabilmente, per modellare i tumori del sistema nervoso centrale (SNC) in modo più accurato dal punto di vista microambientale.
Introduzione
Il cervello umano è un organo complesso composto da più tipi di cellule delle linee neurali e gliali. Insieme, questi formano una rete sofisticata che dà origine alla cognizione. C'è un interesse significativo nel trapianto di cellule in questo sistema come trattamento per un'ampia varietà di disturbi neurologici, tra cui lesioni cerebrali traumatiche (TBI)1,2, disturbi neurodegenerativi 3,4,5,6,7 e ictus8. Una delle principali limitazioni nell'avanzamento di tali strategie, tuttavia, è la relativa scarsità di modelli preclinici disponibili per determinare gli esiti attesi del trapianto. I modelli attualmente più utilizzati sono i metodi di coltura in vitro per determinare il potenziale cellulare e lo xenotrapianto nei topi. Sebbene i metodi di coltura cellulare siano in grado di valutare il potenziale di differenziazione e di auto-rinnovamento9, questi vengono eseguiti in condizioni di crescita ottimali che non imitano il microambiente che le cellule incontrerebbero in un contesto di trapianto. Inoltre, il modo in cui le cellule vengono cresciute può influenzare il loro comportamento10.
I cervelli di topo contengono tutte le cellule del microambiente e sono, quindi, sistemi modello estremamente potenti per il trapianto11. Ci sono, tuttavia, importanti differenze tra la corteccia del topo e quella umana12,13 e non tutti i fattori di crescita reagiscono in modo incrociato tra le specie. I modelli di primati sono un'alternativa più vicina che imita meglio il sistema umano e hanno anche prodotto importanti risultati preclinici14. Anche questi parenti più strettamente imparentati, tuttavia, conservano importanti differenze nella loro composizione cellulare15. Sebbene entrambi questi sistemi modello forniscano preziose informazioni sul comportamento delle cellule durante il trapianto e incorporino gli elementi chirurgici di un'eventuale terapia, rimangono imperfetti. Sono anche costosi e tecnicamente impegnativi (ad esempio, è necessario eseguire un intervento chirurgico al cervello sugli animali), limitando così la possibile produttività. Inoltre, ci sono una pletora di questioni etiche associate al trapianto di cellule cerebrali umane negli animali16. Le colture di fette di cervello consentono di tagliare un cervello e di utilizzarlo per più trattamenti, rimuovendo così alcune delle limitazioni dei trapianti di animali; Tuttavia, questi hanno una durata di vita limitata (settimane), sono ancora di origine animale e (essendo una fetta sottile) non hanno sufficiente volume/integrità superficiale per imitare l'iniezione di cellule17. Pertanto, rimane un importante divario tra i modelli strettamente di coltura cellulare/potenziale e il trapianto in vivo.
Gli organoidi cerebrali sono un modello in vitro contenente i principali tipi di cellule neurali presenti nel cervello e possono essere generati in numero elevato da cellule staminali pluripotenti indotte umane (iPSCs)18,19. Tali organoidi forniscono quindi un contesto cellulare, che potrebbe consentire la valutazione della capacità funzionale di una cellula di prova di interesse nel contesto del trapianto. In effetti, uno studio recente ha dimostrato che le cellule progenitrici neurali (NPC) trapiantate in organoidi cerebrali umani sopravvivono, proliferano e si differenziano in modo simile alle NPC trapiantate nel cervello di untopo diabetico obeso con immunodeficienza combinata di gamma (NSG)20. Gli organoidi cerebrali rappresentano quindi un sistema cruelty-free, longevo (>6 mesi) ed economico che cattura i tipi di cellule del cervello umano. In quanto tali, potrebbero rappresentare un destinatario ideale per il test in fase iniziale della capacità rigenerativa delle cellule neurali.
Questo articolo presenta un protocollo per il trapianto e il successivo monitoraggio di NPC umani marcati in organoidi cerebrali umani (Figura 1). Questo inizia con l'iniezione di NPC marcati con GFP in organoidi cerebrali maturi (2-4 mesi)18. Le cellule trapiantate vengono quindi seguite da microscopia a fluorescenza su cellule vive per un periodo di 4 mesi. Durante questo periodo, mostriamo sia la persistenza delle cellule nel sito di iniezione, ma anche la migrazione verso le regioni distali dell'organoide. All'endpoint, dimostriamo il recupero dell'antigene, la colorazione e l'imaging di sezioni istologiche derivate da questi organoidi, incluso un protocollo per l'estinzione di coloranti esistenti a base di AlexaFluor per consentire ulteriori cicli di colorazione e imaging, sulla base di lavori precedenti21. Questo protocollo potrebbe, quindi, essere utile nella misurazione della capacità di differenziazione delle cellule in un contesto di trapianto, della durata dell'innesto, dell'espansione cellulare in situ e della migrazione cellulare dal sito del trapianto. Prevediamo che questo sarà utile sia per le applicazioni di medicina rigenerativa/terapia cellulare, sia per la modellazione tumorale innestando cellule tumorali in organoidi specifici per regione.
Protocollo
NOTA: Vedere la Tabella dei materiali per i dettagli relativi a tutti i materiali, i reagenti e le apparecchiature utilizzati in questo protocollo.
1. Marcatura fluoroforica delle cellule mediante trasduzione lentivirale
- Scongelare un'aliquota della matrice di membrana basale solubilizzata di scelta su ghiaccio.
- Mentre l'aliquota si sta scongelando, aggiungere acqua sterile per riempire gli spazi vuoti tra i pozzi in una piastra da 24 pozzetti, insieme a tutti i pozzi esterni.
NOTA: Questo lascia otto pozzetti aperti al centro per l'uso e garantisce che le celle rimangano in condizioni di elevata umidità, riducendo così al minimo la variabilità indotta dall'evaporazione. - Diluire la matrice di membrana basale solubilizzata 1:100 in terreno DMEM/F12 ghiacciato (una concentrazione finale di 0,089 mg/mL è stata ottenuta con il lotto qui utilizzato).
- Aggiungere 300 μL di matrice di membrana basale solubilizzata diluita a uno dei pozzetti intermedi (aperti) della piastra a 24 pozzetti preparata per ogni infezione da eseguire. Assicurati di coprire uniformemente l'intero fondo del pozzetto e aggiungine altro, se necessario, per garantire un rivestimento uniforme.
- Incubare la piastra per 30 minuti a 37 °C per consentire a uno strato di solidificarsi lungo il fondo del pozzetto. Verificare al termine di questa incubazione che il liquido stia ancora coprendo completamente il fondo del pozzo e non sia evaporato al centro. L'evaporazione è un segno che l'umidità è troppo bassa; In tal caso, ripetere il rivestimento.
NOTA: Le piastre possono essere rivestite la sera prima e lasciate in matrice di membrana basale solubilizzata diluita senza evidenti effetti negativi; Tuttavia, il rischio di evaporazione è notevolmente aumentato, quindi devono essere attentamente ispezionati prima dell'uso. - Rimuovere il terreno da un pozzetto di NPC confluenti derivati da iPSC che crescono in una piastra a pozzetti.
NOTA: Per questo documento, sono stati utilizzati progenitori neurali derivati da iPSC prodotti utilizzando un kit commerciale secondo le istruzioni del produttore tra il passaggio 3 e il passaggio 10. - Aggiungere delicatamente 1 ml di PBS sul lato del pozzetto e scuotere la piastra per garantire un lavaggio uniforme.
- Rimuovere il PBS e sostituirlo con 300 μL della miscela di enzimi proteolitici-collagenolitici, scuotendo nuovamente la piastra per assicurarsi di rivestire completamente il fondo del pozzo. Incubare per 5 minuti a 37 °C. Verificare che le cellule si stiano staccando dalla superficie della piastra mediante microscopia ottica.
- Con una pipetta P1.000, aggiungere 700 μL di DMEM/F12 e staccare le cellule spruzzando questa miscela su tutte le superfici del fondo della piastra. Pipettare su e giù per garantire che gli aggregati cellulari siano scomposti in una sospensione unicellulare uniforme. Prelevare le cellule e aggiungerle a 9 mL di terreno DMEM/F12 in una provetta conica da 15 mL.
- Centrifugare a 300 × g per 5 min.
- Durante questo periodo, preparare una quantità sufficiente di terreno integrato con 10 μM Y-27632 per 500 μL per pozzetto da piastrare, più 1 mL per la rispensione.
NOTA: Y-27632 è necessario per garantire un'elevata sopravvivenza degli NPC dopo il passaggio come cellule singole. - Rimuovere il surnatante e risospendere le cellule in 1 mL di terreno integrato con Y-27632, pipettando delicatamente su e giù più volte per rompere gli aggregati cellulari.
- Prelevare alcuni microlitri di cellule e diluirle (da 1:5 a 1:10) nel blu di tripano.
- Contare le cellule vitali (tripano-blu-negative) su un emocitometro. Regolare la diluizione del blu di tripano per ottenere almeno 50 cellule vitali per quadrante dell'emocitometro per garantire che i conteggi siano accurati. Calcolare il volume di sospensione cellulare necessario affinché 100.000 cellule siano presenti in ciascun pozzetto.
- Mescolare delicatamente le cellule su e giù mediante pipettaggio e prelevare il volume calcolato (per 100.000 cellule per pozzetto). Aggiungerlo al mezzo integrato con Y-27632 (dal passaggio 1.11) in modo che il volume finale sia di 500 μL per pozzetto da placcare.
- Rimuovere la matrice di membrana basale solubilizzata diluita dai pozzetti precedentemente rivestiti (supponendo che l'incubazione di 30 minuti o più sia stata completata).
- Mescolare delicatamente le cellule mediante pipettaggio e aggiungere 500 μL di sospensione cellulare a ciascun pozzetto.
- Per distribuire uniformemente le cellule, muovere la piastra con un ampio movimento del segno "+" con delicati movimenti lineari (avanti-indietro, stop, indietro-indietro) immediatamente prima di inserirla in un incubatore per colture cellulari.
- Incubare per una notte (16-24 h) a 37 °C e 5% di CO2 .
- Rimuovere il terreno e aggiungere il lentivirus titolato. Se sono necessari singoli eventi di integrazione, puntare a una molteplicità di infezione di 0,3 unità infettive per cellula (idealmente titolata sulle cellule di interesse) e rabboccare fino a 500 μL nel terreno (senza Y-27632).
NOTA: Il lentivirus di interesse può essere acquistato pre-titolato o prodotto internamente come fatto in precedenza22. Qui, un lentivirus GFP prodotto internamente con resistenza alla puromicina è stato utilizzato per generare e selezionare gli NPC che esprimono EGFP. Se il lentivirus non è stato titolato sulle cellule di interesse e il numero di copie è critico, si raccomanda di aggiungere diversi volumi a un paio di pozzetti e di utilizzare successivamente il pozzetto con ~30% di cellule EGFP+ 48-72 h. Se il numero di copie non è critico, è possibile aggiungere un eccesso di virus con l'avvertenza che la mutagenesi inserzionale può causare un comportamento anomalo in alcuni cloni. ATTENZIONE: I vettori lentivirali sono un pericolo biologico di livello 2-3 (a seconda del loro contenuto). Seguire le normative locali sulla biosicurezza per la gestione del lentivirus, la decontaminazione delle superfici e degli articoli in plastica e i rifiuti liquidi. - Rimettere le cellule nell'incubatore e incubarle per 24 ore a 37 °C e 5% di CO2 .
- Rimuovere le cellule dall'incubatrice e rimuovere il surnatante.
ATTENZIONE: Poiché il surnatante delle cellule contiene ancora particelle lentivirali a questo punto, continuare a seguire le normative locali di biosicurezza per la sua manipolazione e smaltimento. - Sciacquare le cellule con 2 x 500 μL di PBS aggiungendo delicatamente PBS alla parete del pozzetto; Quindi, rimuovere dall'angolo del pozzo per lavare via eventuali lentivirus rimanenti.
ATTENZIONE: Poiché il surnatante delle cellule contiene ancora particelle lentivirali a questo punto, continuare a seguire le normative locali di biosicurezza per la sua manipolazione e smaltimento. - Passare a 500 μL di terreno fresco (senza Y-27632) e continuare a crescere a 37 °C e 5% di CO2 durante la notte.
- Utilizzare la microscopia a fluorescenza su cellule vive per verificare la proporzione di cellule che esprimono EGFP e selezionare il pozzetto con cui procedere.
- Se il vettore lentivirale di scelta contiene una cassetta di selezione (gene di resistenza agli antibiotici come la resistenza alla puromicina), aggiungere l'agente di selezione (in questo caso, 1 μg/mL di puromicina) al terreno a una dose precedentemente convalidata che uccide le cellule sensibili ma non resistenti. In caso contrario, utilizzare l'ordinamento cellulare attivato dalla fluorescenza per isolare le cellule EGFP+ al momento della prima divisione.
- D'ora in poi, mantieni le cellule con il monitoraggio quotidiano della confluenza ed esegui cambi di terreno completi ogni giorno.
- Quando viene raggiunta la confluenza, preparare uno o più pozzetti di una piastra rivestita fresca a 6 pozzetti (con 1 mL di matrice di membrana basale solubilizzata diluita; vedere i passaggi 1.3-1.5) e prelevare le cellule come descritto nei passaggi 1.6-1.15.
NOTA: Se non è incluso alcun agente di selezione, ordinare le cellule in base alla citometria a flusso in questa fase. Assicurarsi che le celle siano smistate con un ugello sufficientemente largo e una bassa pressione per ridurre al minimo lo stress, nonché che 10 μM Y-27632 siano inclusi in ogni fase del processo di selezione. - Placcare le celle fino a una densità finale di 200.000 cellule/cm2.
- Mantenere il monitoraggio giornaliero e completare i cambi di fluido ogni giorno.
NOTA: Quando le celle raggiungono nuovamente la confluenza, sono ora pronte per l'uso. In alternativa, uno stock può ora essere congelato per un uso futuro come segue. - Dividi, raccogli e conta le celle come descritto nei passaggi 1.6-1.15.
- Pre-etichettare una serie di crioviali con le informazioni pertinenti (ad esempio, passaggio, linea EGFP%).
- Risospendere a 400.000 cellule/mL in terreno + 10% di DMSO.
NOTA: Il DMSO è tossico per le cellule quando non è congelato, quindi ridurre al minimo il tempo trascorso a temperatura ambiente in presenza di DMSO. - Aggiungere 1 ml (400.000 cellule) della miscela della fase 1,33 per crioviale e mettere in un contenitore per il congelamento delle cellule.
- Trasferire il contenitore in un congelatore a −80 °C per una notte.
- Il giorno seguente, trasferire le cellule in azoto liquido per la conservazione a lungo termine.
2. Iniezione di cellule marcate nell'organoide cerebrale
NOTA: Per questo articolo, gli organoidi cerebrali sono stati prodotti utilizzando un kit commerciale secondo le istruzioni del produttore. Questo può essere sostituito con l'organoide cerebrale di interesse. I materiali utilizzati in questa parte del protocollo devono essere preraffreddati per evitare la gelificazione della matrice di membrana basale solubilizzata a una temperatura superiore a 4 °C.
- Posizionare le siringhe, i puntali e le provette da insulina che verranno a contatto con la matrice della membrana basale solubilizzata a -20 °C per lasciarli raffreddare.
- Scongelare un'aliquota di dimensioni adeguate di matrice di membrana basale solubilizzata su ghiaccio a seconda del numero di iniezioni che verranno eseguite (~2 μL/iniezione). Questa operazione richiede circa 30 minuti.
- Mentre l'aliquota si scongela, dividere, raccogliere e contare le cellule come descritto nei passaggi 1.6-1.15.
- Calcolare i volumi necessari per iniezione. Se si eseguono più iniezioni, posizionare il volume totale delle cellule in una provetta da 1,5 mL e aggiungere fino a 1 mL di DMEM/F12.
NOTA: Per tenere conto delle perdite/errori di pipettaggio, è necessario utilizzare un volume che consenta alcune iniezioni aggiuntive. - Metti le cellule nel ghiaccio mentre si preparano i passaggi successivi.
- Dopo lo scongelamento, diluire la matrice di membrana basale solubilizzata a una concentrazione finale di 3 mg/mL in DMEM/F12 ghiacciato.
- Prelevare la sospensione unicellulare dal ghiaccio e centrifugarla a 300 × g per 5 minuti a 4 °C.
NOTA: Se non è disponibile una centrifuga refrigerata, la centrifuga a temperatura ambiente sembra generalmente essere tollerata. - Rimuovere delicatamente completamente il terreno senza disturbare il pellet cellulare. Risospendere il pellet cellulare mediante pipettaggio delicato nella matrice di membrana basale solubilizzata diluita (3 mg/mL) per ottenere un volume finale di 2 μL per iniezione da eseguire e rimetterlo immediatamente in ghiaccio fino all'uso.
NOTA: La risospensione delle celle deve essere eseguita lentamente e con punte preraffreddate per evitare la formazione di bolle e gelificazione. - Trasferire la/e siringa/e preraffreddata/e dal congelatore a -20 °C in un secchiello per il ghiaccio. Tienili lì fino all'uso.
- Rimuovere la piastra con gli organoidi cerebrali dall'incubatrice. Utilizzare una punta a foro largo per trasferire l'organoide da iniettare in una capsula da 35 mm. Rimuovere tutto il mezzo possibile senza danneggiare l'organoide per stabilizzarlo e facilitare l'iniezione.
NOTA: È importante utilizzare punte a foro largo per evitare di distruggere l'organoide. Se non sono disponibili, tagliare l'estremità di una normale punta P1,000 con forbici sterili. - Posizionare la capsula da 35 mm contenente l'organoide sotto un microscopio da dissezione per guidare e facilitare l'iniezione.
NOTA: Se un microscopio da dissezione non è disponibile in un'area sterile, è possibile eseguire l'iniezione senza di esso, anche se con un controllo leggermente ridotto. Un'altra alternativa è l'uso di un anello di ingrandimento o di occhiali. - Una volta che gli organoidi sono pronti per essere iniettati, risospendere delicatamente le cellule con un puntale per pipetta P20 raffreddato e spostare 2 μL (contenenti il numero desiderato di cellule da iniettare) su un vetrino sterile preraffreddato.
NOTA: Per iniezioni multiple, è possibile aggiungere ulteriori volumi di 2 μL attraverso il vetrino. Tienilo sul ghiaccio e fai attenzione a evitare l'evaporazione. - Prendere una siringa da insulina preraffreddata dal ghiaccio e aspirare lentamente i 2 μL di sospensione cellulare con lo smusso dell'ago rivolto verso il basso per consentire l'aspirazione di tutte le cellule/il terreno.
NOTA: Assicurarsi di procedere estremamente lentamente per evitare di aspirare aria. - Aprire il coperchio del piatto contenente l'organoide e mettere a fuoco il microscopio su di esso. Tenere il piatto con una mano. Posiziona lo smusso dell'ago verso l'alto e, con l'altra mano, inietta lentamente le cellule nella superficie dell'organoide.
NOTA: È importante iniettare lentamente per evitare di danneggiare il tessuto. - Dopo l'iniezione, rimettere il coperchio nel piatto e lasciare riposare l'organoide iniettato per 1-2 minuti.
NOTA: Ciò consente alla matrice di membrana basale solubilizzata diluita di gelificare, mantenendo le cellule in posizione. Se il terreno viene aggiunto troppo presto, può lavare via le cellule che si trovano in superficie. - Aggiungere delicatamente 500 μL del terreno organoide e trasferire l'organoide con una punta a foro largo in un pozzetto di una piastra a 24 pozzetti. Incubare l'organoide a 37 °C e 5% di CO2 per una notte. Eseguire cambi di terreno completi ogni due giorni.
NOTA: È importante includere un organoide di controllo negativo (finto iniettato), che verrà utilizzato per le regolazioni dell'imaging. Per fare ciò, iniettare un organoide come descritto in precedenza con matrice di membrana basale solubilizzata diluita (3 mg/mL) per ottenere un volume finale di 2 μL senza cellule.
3. Tracciamento dell'innesto mediante imaging a fluorescenza su cellule vive
NOTA: Utilizzare un microscopio a fluorescenza in grado di eccitare il fluoroforo di interesse e che disponga del set di filtri necessario per rilevarne la fluorescenza. Come accennato in precedenza, gli NPC utilizzati qui erano EGFP+, con un picco di eccitazione di 488 nm e un picco di emissione di ~510 nm.
- Caricare un organoide di controllo negativo (non iniettato o iniettato simulatamente) e impostare l'intensità dell'illuminazione e il tempo di esposizione in modo che l'autofluorescenza sia minima. Per lo strumento qui utilizzato, l'intensità dell'illuminazione è stata impostata tra 1 e 2 e il tempo di esposizione tra 80 ms e 100 ms.
NOTA: Poiché molte lunghezze d'onda di eccitazione (in particolare le lunghezze d'onda più basse) possono essere tossiche per le cellule, si raccomanda di mantenere bassa l'intensità e di evitare di cercare troppo a lungo per evitare danni all'organoide. - Caricare l'organoide di controllo positivo e, se necessario, aumentare il tempo di esposizione per garantire che le cellule marcate siano chiaramente visibili. Riposizionare l'organoide con una punta di pipetta a foro largo per trovare il sito di iniezione (regione EGFP+ ).
- Rimuovere completamente il terreno dall'organoide di controllo negativo. Caricare l'organoide di controllo negativo e visualizzarlo con le impostazioni selezionate (per lo strumento utilizzato qui, l'intensità dell'illuminazione è stata impostata tra 1 e 2 e il tempo di esposizione tra 80 ms e 100 ms). Al termine dell'imaging, aggiungere immediatamente terreno fresco per evitare che l'organoide si secchi.
NOTA: La rimozione del mezzo è fondamentale per ottenere una buona immagine in quanto fissa l'altezza e l'orientamento degli organoidi, che altrimenti fluttuano e si muovono costantemente, precludendo l'imaging di alta qualità. - Ripetere la rimozione/imaging del terreno con ciascuno degli organoidi di prova.
- Riportare gli organoidi alla normale incubazione/cambio di terreno (come al punto 2.16) e ripetere l'imaging agli intervalli desiderati. Qui, gli organoidi sono stati sottoposti a imaging alla settimana 1, alla settimana 9 e alla settimana 16 dopo l'iniezione per seguire e testare la sopravvivenza, la proliferazione, la differenziazione e la migrazione degli NPC EGFP+ iniettati.
4. Istologia e immunofluorescenza
- Al punto finale, trasferire l'organoide su una cassetta istologica etichettata con l'ID dell'organoide e altri identificatori necessari.
- Riempire la cassetta con il 10% di formalina e chiuderla. Conservare a temperatura ambiente per 24 ore.
- Trasferire la cassetta chiusa con l'organoide in un processo tissutale e impostare il seguente protocollo: etanolo 70% 10 min, etanolo 80% 20 min, etanolo 95% 30 min, etanolo 100% 30 min, etanolo 100% 40 min, etanolo 100% 50 min, toluene 30 min, toluene 40 min, toluene 50 min, paraffina 25 min a 59 °C, paraffina 35 min a 59 °C, paraffina 40 min a 59 °C, paraffina 50 min a 59 °C.
NOTA: I passaggi precedenti vengono eseguiti sotto vuoto a temperatura ambiente, se non diversamente specificato. Questo protocollo sostituisce l'acqua con gradienti di alcol fino al 100%. Il passaggio intermedio con il toluene è una transizione tra l'alcol e la paraffina, poiché entrambi sono solubili in esso. ATTENZIONE: Il toluene e la paraffina sono considerati materiali pericolosi in quanto possono essere liquidi altamente infiammabili e possono causare danni per inalazione o contatto con la pelle o gli occhi. Assicurati di conservarli ben chiusi in uno spazio sicuro. Indossare dispositivi di protezione individuale adeguati quando li si maneggia. Smaltire i rifiuti secondo le normative locali sui rischi chimici. - Trasferire la cassetta chiusa con l'organoide in un bagno di paraffina nella stazione di inclusione.
- Prendi la cassetta dal bagno, aprila e trasferisci l'organoide in uno stampo con base in acciaio. Posizionare lo stampo sotto l'erogatore di paraffina e coprirlo completamente con paraffina.
- Posizionare la cassetta vuota sulla parte superiore dello stampo con base in acciaio. Qui, aggiungi altra paraffina sopra la cassetta.
- Trasferire lo stampo con la cassetta in acciaio sopra nel ghiaccio e lasciarlo raffreddare per 5 minuti. Rimuovere lo stampo in acciaio e conservare la cassetta con l'organoide incorporato in un blocco di paraffina.
- Trasferire la cassetta in un microtomo per tagliare le sezioni. Tagliare le sezioni come desiderato.
NOTA: Qui, sezioni di 15 μm di spessore sono state realizzate in tutto l'organoide. - Far cadere ogni sezione sulla superficie di un bagnomaria a 45 °C e prelevarla su un vetrino da microscopio.
- Lasciare asciugare i vetrini in un'incubatrice a 42 °C per una notte.
NOTA: I vetrini possono ora essere conservati a temperatura ambiente fino al momento della colorazione. - Mettere il vetrino in un barattolo colorato per vetrini Coplin riempito di toluene per 2 minuti. Ripeti questo passaggio ancora una volta.
ATTENZIONE: Il toluene è considerato un materiale pericoloso in quanto può essere un liquido altamente infiammabile e può causare danni per inalazione o contatto con la pelle o gli occhi. Assicurati di conservarlo ben chiuso in uno spazio sicuro. Indossare dispositivi di protezione individuale adeguati quando lo si maneggia. Smaltire i rifiuti secondo le normative locali sui rischi chimici. - Trasferire in un barattolo di vetro per vetrini Coplin riempito con EtOH 100% per 2 min. Ripeti questo passaggio ancora una volta.
- Trasferire in un barattolo di vetro per vetrini Coplin riempito di acqua distillata per 2 min. Ripeti questo passaggio ancora una volta.
- Per il recupero dell'antigene, preparare un tampone citrato (10 mM di acido citrico, 0,05% Tween 20, pH 6,0).
NOTA: Il tampone citrato può essere conservato a temperatura ambiente per un massimo di 3 mesi o a 4 °C per una conservazione più lunga. - Impostare un bagnomaria tra 95 °C e 100 °C.
ATTENZIONE: Questo bagnomaria può causare ustioni se non si presta attenzione. Prendere tutte le precauzioni necessarie per evitare il contatto diretto con il bagno o i suoi componenti. - A bagnomaria, far galleggiare un contenitore di plastica che possa contenere i vetrini all'interno. Assicurarsi che la plastica non tocchi il fondo del bagno (supponendo che si tratti di un bagno di riscaldamento del fondo) per evitare che si sciolga. Versare il tampone citrato all'interno del contenitore di plastica e lasciare che raggiunga i 95-100 °C.
- Una volta che il tampone raggiunge la temperatura desiderata, posizionare i vetrini all'interno del tampone e coprire liberamente il contenitore con un coperchio. Lasciare i vetrini all'interno del contenitore a bagnomaria per 30-40 minuti.
- Rimuovere il contenitore di plastica dal bagnomaria e lasciarlo raffreddare a temperatura ambiente per altri 20 minuti.
- Lavare i vetrini per 3 x 2 minuti con PBS. Rimuovere il PBS con un fazzoletto di carta senza toccare il campione o asciugarlo eccessivamente.
- Preparare il tampone di permeabilizzazione (90 mL di PBS + 0,1% Tween-20) e riempirlo con un barattolo di vetro per la colorazione. Immergere i vetrini nel tampone di permeabilizzazione e incubare per 10 minuti.
- Lavare i vetrini per 3 x 2 minuti con PBS.
- Preparare una quantità di miscela colorante sufficiente a coprire ogni campione (~25 μL).
NOTA: Vedere la Tabella 1 per gli anticorpi e le concentrazioni finali qui utilizzate. - Aggiungere 25 μL di miscela colorante per coprire ogni fetta di organoide. Incubare a temperatura ambiente per 1 ora o per una notte a 4 °C al buio.
NOTA: Assicurarsi che i campioni rimangano ad alta umidità per evitare l'evaporazione della miscela colorante. Se non è disponibile un contenitore per mantenere umidi i vetrini, metterli all'interno di una scatola con dei fazzoletti bagnati all'angolo. - Lavare i vetrini per 3 x 2 minuti con PBS.
- Risciacquare una volta con acqua distillata all'interno di un barattolo di vetro per rimuovere il sale.
- Aggiungere 10 μL di montante liquido + 4',6-diamidino-2-fenilindolo (DAPI) a ciascuno dei campioni.
NOTA: I vetrini possono essere sigillati se non viene eseguito un secondo ciclo di colorazione. In questo caso, i vetrini non sono stati coperti per consentire l'accesso per la tempra/ricolorazione, poiché la rimozione del vetrino coprioggetto può danneggiare il tessuto. - Acquisire un'immagine dei vetrini utilizzando il microscopio a fluorescenza selezionato.
NOTA: Assicurarsi di avere controlli positivi e negativi per ciascun anticorpo per consentire la corretta impostazione delle intensità e dei tempi di esposizione (per lo strumento utilizzato qui, l'intensità di illuminazione è stata impostata tra 5 e 6 e il tempo di esposizione tra 2.000 ms e 3.000 ms), anche se questo può variare a seconda dell'anticorpo. Inoltre, assicurarsi che il microscopio disponga di rilevatori adeguati per ciascun canale utilizzato. Tenere presente che, poiché i campioni non sono coperti, devono essere posizionati a faccia in su durante l'imaging. - Dopo l'imaging, preparare un tampone di tempra fresco 2x (9% H2O2 + 50 mM NaOH in PBS).
NOTA: La soluzione di tempra deve essere preparata fresca immediatamente prima dell'uso. La reazione è sensibile all'attività dell'H2O2, che diminuirà nel tempo. ATTENZIONE: H2O2 è irritante e NaOH è caustico. Questi devono essere trattati con dispositivi di sicurezza appropriati e il contatto con la pelle deve essere evitato. Assicurarsi che vengano smaltiti in conformità con le politiche locali di sicurezza chimica. - Riempire a metà il barattolo di vetro per la colorazione dei vetrini Coplin con 2 tamponi di tempra (45 ml), aggiungere 45 ml di PBS e inserire i vetrini all'interno. Incubare una notte a 4 °C.
- Verificare al microscopio a fluorescenza che i fluorofori siano stati effettivamente temprati.
- Ripetere la colorazione e l'imaging come sopra.
NOTA: La tempra e la ricolorazione possono essere ripetute per ulteriori round, se necessario, anche se il rischio di danni aumenta con ogni round aggiuntivo.
5. Registrazione dell'immagine
- Aprire le FIJI.
- Crea una cartella con le immagini DAPI del round 1 e del round 2. Modificare i nomi per chiarire quale è quale, se necessario.
- Crea una cartella vuota per l'output della registrazione dell'immagine.
- Fare clic su Plugin | Registrazione | Registrare le sezioni dello stack virtuale.
- In Directory di origine, selezionare la cartella contenente le immagini DAPI di ciascun round.
- In Directory di output selezionare la cartella creata per l'output della registrazione.
- Impostare il modello di estrazione della feature su Rigido e il menu a discesa Modello di registrazione su Rigido - traslazione+rotazione per correggere la registrazione, consentendo solo di spostare e ruotare l'immagine per l'allineamento anziché deformarla.
NOTA: Se si prevede una deformazione, il modello di estrazione delle feature e il modello di registrazione possono essere regolati su Affine o altri modelli a seconda delle esigenze, anche se ciò può causare trasformazioni indesiderate. Occasionalmente una fetta può essere danneggiata tra un round e l'altro, il che può impedire la corretta registrazione. - Selezionare la casella Salva trasformazioni per salvare i parametri di trasformazione, consentendone l'applicazione agli altri canali.
- Fare clic su OK.
- Selezionare la posizione in cui salvare il file di trasformazione (il valore predefinito è la directory di input) e fare clic su Apri.
- Selezionare l'immagine DAPI da utilizzare come riferimento per le trasformazioni. L'immagine DAPI di ciascuno degli altri round sarà allineata a questa.
NOTA: Al termine, le immagini registrate appariranno come una pila (e nella cartella di output). - Utilizzare la barra di scorrimento in basso per scorrere avanti e indietro tra le immagini per verificare che la registrazione dell'immagine sia andata a buon fine (i nuclei sono nella stessa posizione in entrambe le immagini, almeno per le aree sovrapposte).
- Verificare che sia stato creato un file .xml per ogni round delle immagini di input.
NOTA: contengono i parametri di traduzione necessari per i file di quel round. - Crea una cartella contenente tutte le immagini da registrare (ogni canale di ogni round). Prendere nota dell'ordine dei file.
- Create una cartella per i parametri di trasformazione e create una copia del file .xml per ogni arrotondamento per canale da registrare. Verificare che l'ordine dei file (per nome) sia lo stesso tra le immagini da registrare e le copie dei parametri di trasformazione, poiché il passaggio successivo eseguirà e trasformerà ogni immagine nell'ordine dei file dei parametri di trasformazione.
- Fare clic su Plugin | Trasformazione | Trasforma le sezioni dello stack virtuale.
- In Directory di origine, selezionare la cartella contenente le immagini da registrare.
- In Directory di output selezionare la cartella creata per l'output della registrazione.
- In Directory trasformazioni, selezionare la cartella contenente i file .xml con una copia per ogni file di immagine da trasformare. Ancora una volta, assicurati che l'ordine corrisponda ai file (ad esempio, una copia del .xml del round 1 per ogni canale del round 1, una copia del .xml del round 2 per ogni canale del round 2, ecc.).
- Fare clic su OK.
NOTA: Al termine, le immagini registrate da quel round appariranno come una pila (e nella cartella di output). - Usa la barra di scorrimento in basso per passare avanti e indietro tra i canali. Verificare che tutti i canali siano stati trasformati nello stesso modo. In caso contrario, è probabile che ciò sia dovuto a un file .xml errato nella directory delle trasformazioni. In questo caso, correggi il file e ripeti.
NOTA: L'intervallo di luminosità visualizzato si baserà su un canale, ma ciò non influisce sulle immagini salvate effettive, ma solo sulla visualizzazione. - Osservate che le immagini registrate sono tutte allineate correttamente tra gli arrotondamenti e pronte per l'analisi a valle.
NOTA: esistono modi programmatici più efficienti per eseguire la registrazione per batch di grandi dimensioni. Il metodo presentato qui è semplice e non richiede programmazione.
Risultati
Come convalida dell'identità dell'organoide cerebrale, le sezioni istologiche di un organoide cerebrale maturo (2 mesi) sono state colorate per PAX6 (un marcatore di NPC dorsali23) e SATB2 (un marcatore di neuroni maturi, postmitotici, di strato superiore24). Come previsto, le cellule PAX6+ erano presenti all'interno dell'organoide e le cellule SATB2+ erano presenti negli strati superiori (Figura 2). Questi risultati supportano che gli organoidi cerebrali utilizzati erano effettivamente il prosencefalo dorsale, come specificato nel kit di differenziazione. Per stabilire la dose-dipendenza del sistema di trapianto di organoidi cerebrali, in organoidi cerebrali di 2 mesi sono stati iniettati un numero crescente di NPC derivati da EGFP+ iPSC. Era presente una chiara dose-dipendenza della fluorescenza GFP dal numero di cellule in ingresso, con un rilevamento coerente di patch cellulari EGFP+ a 10.000 cellule e oltre (Figura 3). La persistenza e la migrazione degli NPC trapiantati sono state successivamente valutate seguendo gli organoidi trapiantati nel tempo. Per questo, 50.000 NPC EGFP+ derivati da iPSC sono stati trapiantati in organoidi cerebrali di 2-3 mesi generati dalla stessa linea di iPSC. Gli organoidi iniettati e i controlli sono stati sottoposti a imaging per la positività all'EGFP nei punti temporali indicati nei successivi 3-4 mesi. In questa serie di trapianti, abbiamo osservato la persistenza del sito iniettato per tutto il periodo di monitoraggio di 4 mesi (Figura 4A). Ulteriori chiazze di cellule di EGFP+ sono apparse 9 giorni dopo il trapianto e sono persistite fino all'endpoint dello studio (3-4 mesi a seconda dell'organoide), indicando la migrazione delle cellule e l'integrazione nei loro nuovi siti (Figura 4A). A un ingrandimento più elevato, è stata osservata una chiara morfologia neurale con lunghe proiezioni nell'organoide (Figura 4B), confermando l'integrazione delle cellule iniettate.
Per determinare lo stato di differenziazione delle cellule iniettate dopo l'iniezione, l'organoide monitorato per 4 mesi e il suo controllo sono stati fissati, inclusi in paraffina, tagliati a fette spesse 15 μm e montati su vetrini. Le fette sono state quindi lavorate e colorate in un singolo ciclo di colorazione fluorescente (EGFP, TUJ1, NESTIN) o per due cicli di colorazione consecutivi per aggiungere ulteriori marcatori (MAP2, GFAP). La colorazione iniziale a ciclo singolo ha confermato la presenza di cellule EGFP+ nel sito di iniezione, tra cui una miscela di cellule che conservano lo stato NPC (NESTIN+TUJ1−) e quelle che si erano differenziate verso un destino neurale (NESTIN−TUJ1+) (Figura 5). Sia per gli organoidi di controllo che per quelli iniettati, sono stati osservati pochissimi NPC NESTIN+ (la maggior parte, anche se non tutti, sono NPC trapiantati con EGFP+ nel sito di iniezione), con una maggioranza di neuroni TUJ1+ immaturi-maturi (Figura 5). La colorazione a due turni ha fornito maggiori dettagli, rivelando neuroni maturi (NESTIN−TUJ1+MAP2+GFAP−) intorno alla maggior parte della regione esterna dell'organoide, con aree di neuroni immaturi (NESTIN−TUJ1+MAP2−GFAP−) verso il centro (Figura 6A,B). Gli astrociti (NESTIN−TUJ1−MAP2−GFAP+) erano presenti sia negli organoidi iniettati che in quelli di controllo ed erano sparpagliati intorno ai bordi esterni (Figura 6A,B). La fetta per la quale è stata eseguita la colorazione a due turni nell'organoide iniettato mostrava una piccola colonia satellite di cellule EGFP+ lontane dal sito di iniezione che avevano adottato il fenotipo dei neuroni maturi (Figura 6B,C). Alcuni di questi sembravano essere in prossimità degli astrociti; tuttavia, non c'erano cellule EGFP+ con sovrapposizione completa alla colorazione GFAP, suggerendo che fossero adiacenti piuttosto che generare gli astrociti stessi (Figura 6B,C).
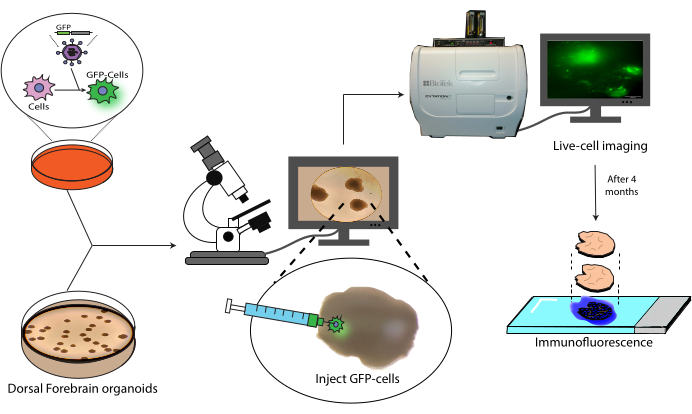
Figura 1: Modello di trapianto di cellule marcate in organoidi cerebrali. Panoramica schematica della generazione di cellule marcate mediante trasduzione lentivirale, il loro trapianto in organoidi cerebrali e il monitoraggio mediante imaging di cellule vive e immunofluorescenza. Abbreviazione: GFP = proteina fluorescente verde. Fare clic qui per visualizzare una versione più grande di questa figura.
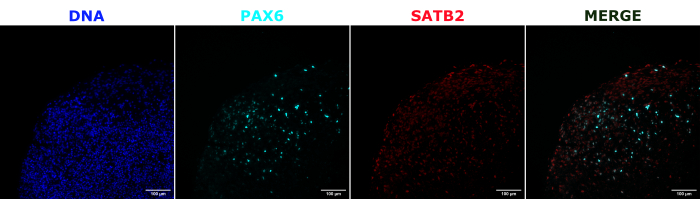
Figura 2: Immunofluorescenza di sezioni istologiche che mostrano l'architettura di organoidi precoci e tardivi. Un organoide cerebrale di 2 mesi è stato fissato, incorporato in paraffina, affettato e colorato con PAX6, SATB2 e DAPI. Una sezione non colorata è stata utilizzata per impostare l'esposizione e il tempo di integrazione per evitare un segnale falso positivo dall'autofluorescenza. Le cellule PAX6+ erano presenti all'interno dell'organoide, mentre le cellule SATB2+ erano presenti negli strati superiori. Le immagini Z-stack sono state scattate ogni 4,2 μm attraverso l'intera sezione di tessuto da 15 μm. Le sezioni ottiche sono state combinate utilizzando l'opzione di messa a fuoco nel software Gen5 con le opzioni predefinite. Barre di scala = 100 μm. Abbreviazioni: PAX6 = proteina box 6 accoppiata; SATB2 = proteina speciale 2 legante la sequenza ricca di AT; DAPI = 4',6-diamidino-2-fenilindolo. Fare clic qui per visualizzare una versione più grande di questa figura.
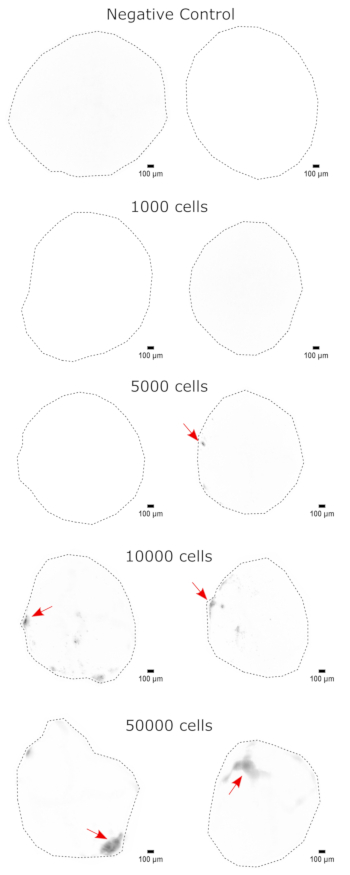
Figura 3: Attecchimento dose-dipendente di NPC in organoidi cerebrali. Gli organoidi sono stati trapiantati con 0 (controllo negativo), 1.000, 5.000, 10.000 o 50.000 NPC derivati da GFP+ iPSC. A 1 settimana dal trapianto, gli organoidi sono stati sottoposti a imaging su un Cytation 5 con un cubo filtrante GFP. Il controllo negativo è stato utilizzato per impostare l'esposizione e il tempo di integrazione per ridurre al minimo l'autofluorescenza. I colori più scuri indicano una maggiore fluorescenza dell'EGFP rispetto al controllo negativo. Barre di scala = 100 μm. Queste sono immagini 4x dell'intero organoide. Dopo l'imaging, è stata eseguita la sottrazione dello sfondo a sfera rotolante con un raggio di pixel di 50 prima della visualizzazione per correggere l'intensità variabile dello sfondo attraverso gli organoidi. I siti di iniezione identificati come le regioni di attecchimento più elevato sono indicati con una freccia rossa in cui era presente l'attecchimento. Abbreviazioni: NPCs = cellule progenitrici neurali; GFP = proteina fluorescente verde; EGFP = GFP potenziata; iPSC = cellula staminale pluripotente indotta. Fare clic qui per visualizzare una versione più grande di questa figura.
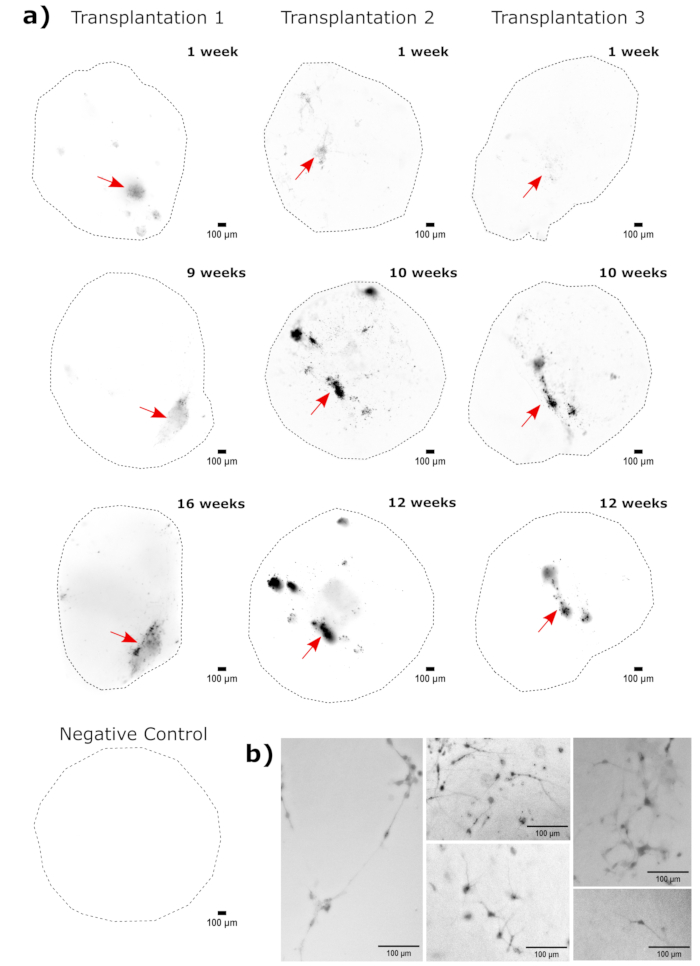
Figura 4: Monitoraggio della crescita, della migrazione e della persistenza delle cellule trapiantate con l'imaging a fluorescenza di cellule vive. (A) Gli organoidi di controllo e trapiantati (50.000 NPC derivati da GFP+ iPSC) sono stati seguiti da imaging di cellule vive a fluorescenza nel corso di 2-4 mesi da due set di trapianto indipendenti. Gli organoidi di controllo negativo sono stati utilizzati per impostare l'esposizione e il tempo di integrazione per ridurre al minimo l'autofluorescenza in ogni punto temporale. Le immagini dell'EGFP sono state catturate utilizzando un cubo filtrante GFP sul Cytation 5 nei momenti indicati dopo il trapianto. I colori più scuri indicano una maggiore fluorescenza EGFP rispetto al controllo negativo per quel punto temporale. La sottrazione dello sfondo a sfera rotolante con un raggio di pixel di 50 è stata eseguita prima della visualizzazione per correggere l'intensità variabile dello sfondo attraverso gli organoidi. Gli organoidi sono stati posizionati all'incirca con lo stesso orientamento in ogni punto temporale e le immagini sono state ruotate per garantire la coerenza della visualizzazione e per mostrare chiaramente la crescita delle cellule trapiantate. I siti di iniezione identificati come le regioni di più alto attecchimento nel primo momento sono indicati con una freccia rossa. Un esempio di organoide di controllo negativo è mostrato nella parte inferiore della figura. (B) Esempi di immagini 20x sono mostrate da organoidi trapiantati alla settimana 1 e alla settimana 15 dopo il trapianto. Il contrasto locale è stato migliorato prima della visualizzazione utilizzando FIJI per garantire la visibilità dei neuriti. Barre di scala = 100 μm. Abbreviazioni: NPCs = cellule progenitrici neurali; GFP = proteina fluorescente verde; EGFP = GFP potenziata; iPSC = cellula staminale pluripotente indotta. Fare clic qui per visualizzare una versione più grande di questa figura.
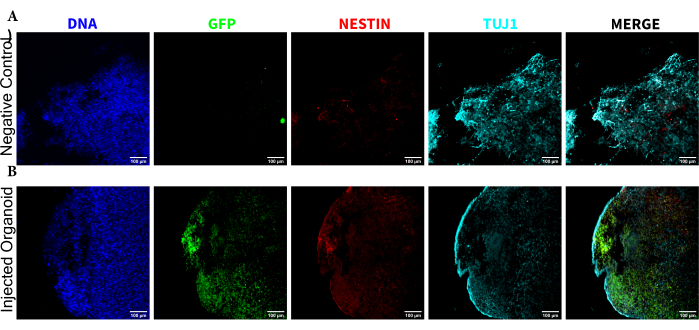
Figura 5: Immunofluorescenza delle sezioni istologiche che rivelano la persistenza delle NPC trapiantate nel sito di iniezione insieme alla migrazione e alla differenziazione neurale. Immagini di fluorescenza a canale singolo da organoidi (A) non iniettati e (B) trapiantati. L'immagine sovrapposta a destra mostra i tre canali di interesse (NESTIN, TUJ1 e EGFP), ma non include DAPI. I minimi di visualizzazione sono stati impostati per escludere solo il segnale dalle celle negative (determinato per l'EGFP dal controllo non iniettato e per altri canali in base a combinazioni di marcatori note). I valori massimi visualizzati si basavano sul segnale più alto osservato per quell'anticorpo in qualsiasi cellula. Gli intervalli di visualizzazione sono stati mantenuti costanti tra gli organoidi non iniettati e trapiantati per consentire un confronto diretto. Barre di scala = 100 μm. Abbreviazioni: NPCs = cellule progenitrici neurali; DAPI = 4',6-diamidino-2-fenilindolo; TUJ1 = tubulina beta-III; EGFP = proteina fluorescente verde potenziata. Fare clic qui per visualizzare una versione più grande di questa figura.
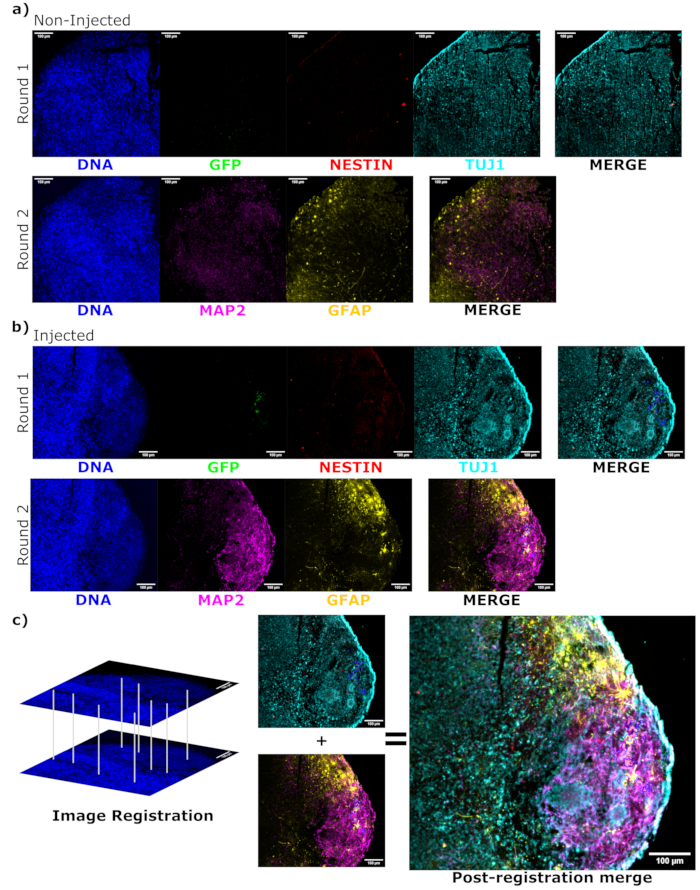
Figura 6: Valutazione dello stato di differenziamento e localizzazione delle cellule trapiantate mediante immunofluorescenza ciclica delle sezioni istologiche. Le immagini di fluorescenza a canale singolo degli organoidi non iniettati, (A) abbinati all'età e (B) trapiantati sono mostrate per il primo e il secondo ciclo di colorazione come indicato. I minimi di visualizzazione sono stati impostati per escludere solo il segnale dalle celle negative (determinato per l'EGFP dal controllo non iniettato e per altri canali in base a combinazioni di marcatori note). I valori massimi visualizzati si basavano sul segnale più alto osservato per quell'anticorpo in qualsiasi cellula. Gli intervalli di visualizzazione (e, naturalmente, i parametri di imaging) sono stati mantenuti costanti tra gli organoidi di controllo e iniettati per consentire un confronto diretto. Barre di scala = 100 μm. Un'immagine sovrapposta (escluso DAPI) è mostrata per ogni ciclo di colorazione per ogni organoide a destra. (B) Per l'organoide iniettato in cui è stata eseguita la registrazione dell'immagine, tutte le immagini vengono ritagliate nella regione osservata in entrambi i cicli di colorazione. (B,C) Per l'organoide iniettato, le regioni cellulari EGFP+ sono delineate in blu. In (C) viene mostrato un diagramma di come DAPI viene utilizzato per abbinare le funzionalità durante la registrazione dell'immagine, seguito da un'unione complessiva dell'immagine registrata. Abbreviazioni: DAPI = 4',6-diamidino-2-fenilindolo; TUJ1 = tubulina beta-III; EGFP = proteina fluorescente verde potenziata; MAP2 = proteina 2 associata ai microtubuli; GFAP = proteina acida fibrillare gliale. Fare clic qui per visualizzare una versione più grande di questa figura.
| Clone | Fluoroforo | Concentrazione | |
| Anti-NESTIN | 10C2 | AlexaFluor 594 | 1 su 2.000 |
| Anti-TUBB3 | TUJ1 | AlexaFluor 647 | 1 su 2.000 |
| Anti-GFP | FM264G | AlexaFluor 488 | 1 su 200 |
| Anti-GFAP | SMI 25 | AlexaFluor 594 | 1 su 500 |
| Anti-MAP2 | SMI 52 | AlexaFluor 488 | 1 su 1.000 |
| Anti-PAX6 | Visualizzazione del materiale O18-1330 | AlexaFluor 647 | 1 su 100 |
| Anti-SATB2 | EPNCIR130A | AlexaFluor 594 | 1 su 500 |
Tabella 1: Concentrazioni di anticorpi per la colorazione. Abbreviazioni: TUBB3 = beta-tubulina III; GFP = proteina fluorescente verde; GFAP = proteina acida fibrillare gliale; MAP2 = proteina 2 associata ai microtubuli; PAX6 = proteina accoppiata box 6; SATB2 = speciale proteina legante la sequenza ricca di AT 2.
Discussione
Dato il significativo interesse per gli approcci terapeutici cellulari per il trattamento delle lesioni del SNC/malattie neurodegenerative 1,2,3,4,5,6,7,8, i modelli di funzione cellulare in un contesto di trapianto stanno acquisendo importanza. Questo articolo presenta un metodo per il trapianto di NPC umani marcati in organoidi cerebrali umani, insieme al loro monitoraggio delle cellule vive e alla valutazione dell'end-point mediante istologia e colorazione immunofluorescente. È importante sottolineare che abbiamo dimostrato che le cellule trapiantate erano in grado di migrare, differenziarsi e persistere a lungo termine (4 mesi) nel contesto dell'organoide. Tale persistenza a lungo termine è un marcato aumento rispetto alla manutenibilità delle colture di fette di cervello17. Questo sistema è, quindi, appropriato per esaminare molti dei comportamenti che si dovrebbero valutare in un potenziale contesto terapeutico, come la sopravvivenza, la proliferazione e la differenziazione. Infatti, uno studio ortogonale ha recentemente dimostrato che gli NPC trapiantati si comportano in modo simile negli organoidi cerebrali rispetto agli NPC trapiantati nel cervello di topo NSG20, confermando così l'utilità degli organoidi come destinatari del trapianto. Poiché si tratta di un sistema in vitro, è anche semplice aggiungere citochine o farmaci di interesse. Questo potrebbe essere utilizzato per comprendere meglio gli effetti di ambienti specifici come l'infiammazione e gli immunosoppressori sulle cellule trapiantate per imitare ulteriormente ciò che potrebbero incontrare in un ambiente terapeutico. Il protocollo di immunofluorescenza ciclica che abbiamo dimostrato (basato su precedenti ricerche21) estende ulteriormente la potenza di questo approccio, consentendo di valutare simultaneamente un'ampia gamma di marcatori specifici del lignaggio e, potenzialmente, della malattia in un'unica sezione e, quindi, consentendo un monitoraggio accurato delle cellule trapiantate e del loro impatto sul tessuto. Naturalmente, è possibile utilizzare altri metodi di valutazione degli endpoint a seconda degli obiettivi dell'analisi. Ad esempio, la pulizia dei tessuti con ricostruzione 3D potrebbe essere utilizzata se la morfologia cellulare è di interesse primario, oppure la dissociazione seguita da citometria a flusso potrebbe essere utilizzata se la quantificazione di specifici tipi cellulari è l'obiettivo finale. Ci aspettiamo che questo metodo sia facilmente estendibile ad altri tipi di cellule come i tumori del SNC, consentendo potenzialmente il loro studio in un contesto microambientale rilevante. Allo stesso modo, gli organoidi utilizzati come riceventi potrebbero essere scambiati con organoidi modello di malattia 25,26,27, consentendo potenzialmente la modellazione di approcci di trapianto per queste condizioni.
Come per tutti i modelli, anche quello qui presentato ha i suoi limiti. Innanzitutto, gli organoidi derivati da iPSC sono immaturi dal punto di vista dello sviluppo19 e, quindi, presentano importanti differenze rispetto all'invecchiamento cerebrale, in cui si manifestano molte malattie neurodegenerative. Anche gli organoidi cerebrali non sono uniformi nello sviluppo19, precludendo così l'iniezione consistente nella stessa identica nicchia fisiologica. Inoltre, mentre contengono i tipi di cellule delle regioni cerebrali rilevanti18,19, mancano delle componenti endoteliali, microgliali e immunitarie, che sono importanti anche nel setting in vivo 14. Ciò limita lo studio di come l'ospite reagirà al trapianto di cellule. Attualmente sono disponibili tecniche per aggiungere cellule vascolari28 e microgliali29, nonché per aumentare la consistenza e la regionalizzazione degli organoidi18, migliorando così il potere di modellazione del sistema di trapianto di organoidi. Tuttavia, richiederebbero ulteriori test e ottimizzazioni oltre a quelli presentati qui. Sebbene questo protocollo sia poco costoso e non richieda attrezzature specializzate, rimangono una serie di importanti considerazioni tecniche, ad esempio la profondità di iniezione. Ciò è dovuto sia al fatto che gli organoidi non sono perfusi e, quindi, spesso hanno un centro necrotico se diventano troppo grandi19 e che la luce non può penetrare attraverso il nucleo dell'organoide per il monitoraggio delle cellule vive. Pertanto, le cellule che sono state iniettate troppo in profondità e le colonie che sono migrate all'interno possono essere perse. Sebbene questo possa essere migliorato con l'uso di fluorofori a lunghezza d'onda più lunga con una migliore penetranza tissutale30, a seconda delle dimensioni dell'organoide e dell'apparato di rilevamento, questo rimarrà probabilmente un fattore da considerare. Infine, poiché gli organoidi cerebrali sono in uno stato di sviluppo, la tempistica del trapianto è un'altra considerazione chiave, poiché l'ambiente probabilmente differirà a seconda dello stadio di sviluppo dell'organoide in cui viene iniettato. Sebbene questo possa essere controllato in una certa misura garantendo un'età costante dell'organoide al momento dell'iniezione, è, senza dubbio, un fattore che deve essere considerato.
Questo protocollo è economico, semplice, privo di animali e non richiede attrezzature specializzate, rendendo così la modellazione dei trapianti accessibile a una più ampia varietà di laboratori. Con il rapido ritmo di avanzamento sia nelle terapie delle cellule neurali che nei sistemi modello di organoidi, prevediamo che il protocollo di trapianto di organoidi qui presentato sarà un modello utile per una serie di malattie e approcci terapeutici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
I fondi per questo lavoro sono stati forniti attraverso i fondi filantropici IRIC della fondazione Marcelle e Jean Coutu e del Fonds de recherche du Québec - Santé (FRQS #295647). D.J.H.F.K. ha un sostegno salariale da FRQS sotto forma di una borsa di studio Chercheurs-boursiers Junior 1 (#283502). M.I.I.R. è stato sostenuto da un premio di dottorato IRIC dell'Institut of Research in Immunology and Cancer, da una Bourse de passage accélère de la maitrise au doctorat dell'Università di Montreal e da una Bourse de Mérite aux cycles supérieurs.
Materiali
| Name | Company | Catalog Number | Comments |
| Accutase | StemCell Technologies | 7920 | proteolytic-collagenolytic enzyme mix |
| Alexa Fluor 488 anti-GFP Antibody | BioLegend | 338008 | |
| Alexa Fluor 488 anti-MAP2 (clone SMI 52) | BioLegend | 801804 | |
| Alexa Fluor 594 anti-GFAP Antibody (clone SMI 25) | BioLegend | 837510 | |
| Alexa Fluor 594 anti-Nestin (clone 10C2) | BioLegend | 656804 | |
| Alexa Fluor 647 anti-Tubulin β 3 (TUBB3) (clone TUJ1) | BioLegend | 801209 | |
| Citric Acid Monohydrate | Fisher Chemical | A104-500 | |
| Cytation 5 Cell Imaging Multimode Reader | Biotek | - | |
| Denaturated Ethyl Alcohol (Anhydrous) | ChapTec | - | |
| DMEM F12/Glutamax | Thermo | 10565018 | |
| Dymethil Sulfoxide (DMSO), Sterile | BioShop | DMS666.100 | |
| FIJI 1.53c | - | - | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501128-4L | |
| Gen5 | - | - | |
| HistoCore Arcadia H | Leica Biosystems | - | |
| Matrigel Growth Factor Reduced (GFR) | Corning | 356231 | Phenol Red-free, LDEV-free |
| MX35 microtome blade | Epredia | 3053835 | |
| NaOH | Sigma | 655104 | |
| PBS (-Ca -Mg) | Sigma | D8537 | |
| Puromycin Dihydrochloride | Thermo | A1113803 | |
| ROCK inhibitor Y-27632 | Abcam | ab120129 | |
| Simport Scientific Stainless-Steel Base Molds | Fisher Scientific | 22-038-209 | |
| Simport Scientific UNISETTE Biopsy Processing/Embedding Cassette | Fisher Scientific | 36-101-9255 | |
| STEMdiff Forebrain Neuron Differentiation Kit | StemCell Technologies | 8600 | |
| STEMdiff Neural Progenitor Medium | StemCell Technologies | 5833 | |
| STEMdiff SMADi Neural Induction Kit | StemCell Technologies | 8581 | |
| Thermo Scientific Shandon Finesse ME Microtome | Thermo Scientific | - | |
| Tissue Prep | Fisher Scientific | T555 | |
| Tissue-Tek VIP 6 AI Tissue Processor | Sakura Finetek | - | |
| Toluene (histological) | ChapTec | - | |
| Trypan blue; 0.4% (wt/vol) | Thermo | 15250061 | |
| Tween 20 | BioShop | TWN510.100 |
Riferimenti
- Spurlock, M. S., et al. Amelioration of penetrating ballistic-like brain injury induced cognitive deficits after neuronal differentiation of transplanted human neural stem cells. Journal of Neurotrauma. 34 (11), 1981 (2017).
- Zhou, Y., Shao, A., Xu, W., Wu, H., Deng, Y. Advance of stem cell treatment for traumatic brain injury. Frontiers in Cellular Neuroscience. 13, 301 (2019).
- Hayashi, Y., Lin, H. -. T., Lee, C. -. C., Tsai, K. -. J. Effects of neural stem cell transplantation in Alzheimer's disease models. Journal of Biomedical Science. 27 (1), 29 (2020).
- Kefalopoulou, Z., et al. Long-term clinical outcome of fetal cell transplantation for Parkinson disease: Two case reports. JAMA Neurology. 71 (1), 83-87 (2014).
- Li, W., et al. Extensive graft-derived dopaminergic innervation is maintained 24 years after transplantation in the degenerating parkinsonian brain. Proceedings of the National Academy of Sciences of the United States of America. 113 (23), 6544-6549 (2016).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Takahashi, J. iPS cell-based therapy for Parkinson's disease: A Kyoto trial. Regenerative Therapy. 13, 18-22 (2020).
- Krause, M., Phan, T. G., Ma, H., Sobey, C. G., Lim, R. Cell-based therapies for stroke: Are we there yet. Frontiers in Neurology. 10, 656 (2019).
- Coles-Takabe, B. L. K., et al. Don't look: Growing clonal versus nonclonal neural stem cell colonies. Stem Cells. 26 (11), 2938-2944 (2008).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Jakel, R. J., Schneider, B. L., Svendsen, C. N. Using human neural stem cells to model neurological disease. Nature Reviews Genetics. 5 (2), 136-144 (2004).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Li, J., et al. Conservation and divergence of vulnerability and responses to stressors between human and mouse astrocytes. Nature Communications. 12 (1), 3958 (2021).
- Morizane, A., et al. MHC matching improves engraftment of iPSC-derived neurons in non-human primates. Nature Communications. 8 (1), 385 (2017).
- Khrameeva, E., et al. Single-cell-resolution transcriptome map of human, chimpanzee, bonobo, and macaque brains. Genome Research. 30 (5), 776-789 (2020).
- Powell, K. Hybrid brains: The ethics of transplanting human neurons into animals. Nature. 608 (7921), 22-25 (2022).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- García-Delgado, A. B., et al. Brain organoids to evaluate cellular therapies. Animals. 12 (22), (2022).
- Lin, J. -. R., Fallahi-Sichani, M., Sorger, P. K. Highly multiplexed imaging of single cells using a high-throughput cyclic immunofluorescence method. Nature Communications. 6 (1), 8390 (2015).
- Knapp, D. J. H. F., et al. Single-cell analysis identifies a CD33+ subset of human cord blood cells with high regenerative potential. Nature Cell Biology. 20 (6), 710-720 (2018).
- Georgala, P. A., Carr, C. B., Price, D. J. The role of Pax6 in forebrain development. Developmental Neurobiology. 71 (8), 690-709 (2011).
- Britanova, O., et al. Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex. Neuron. 57 (3), 378-392 (2008).
- Kim, H., et al. Modeling G2019S-LRRK2 sporadic Parkinson's disease in 3D midbrain organoids. Stem Cell Reports. 12 (3), 518-531 (2019).
- Smits, L. M., et al. Modeling Parkinson's disease in midbrain-like organoids. NPJ Parkinson's Disease. 5, 5 (2019).
- Jin, M., et al. Type-I-interferon signaling drives microglial dysfunction and senescence in human iPSC models of Down syndrome and Alzheimer's disease. Cell Stem Cell. 29 (7), 1135.e8-1153.e8 (2022).
- Sun, X. -. Y., et al. Generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, e76707 (2022).
- Popova, G., et al. Human microglia states are conserved across experimental models and regulate neural stem cell responses in chimeric organoids. Cell Stem Cell. 28 (12), 2153.e6-2166.e6 (2021).
- Wang, S., Li, B., Zhang, F. Molecular fluorophores for deep-tissue bioimaging. ACS Central Science. 6 (8), 1302-1316 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon